-
Medical journals
- Career
Sarkopenická obezita: od vzniku k intervenci
Authors: Tereza Vágnerová 1,2; Martin Šaier 3
Authors‘ workplace: Geriatrická klinika 1. LF UK a VFN, Praha 1; Ústav hygieny a epidemiologie 1. LF UK a VFN, Praha 2; III. interní klinika – endokrinologie a metabolismu 1. LF UK a VFN, Praha 3
Published in: Geriatrie a Gerontologie 2021, 10, č. 1: 23-30
Category: Review Article
Overview
Vágnerová T, Šaier M. Sarkopenická obezita: od vzniku k intervenci
Sarkopenická obezita (SO) je specifickým typem obezity, medicínským stavem definovaným jako koexistence nízké svalové síly a hmoty a zmnožené tukové tkáně. Při SO dochází k infiltraci kosterní i viscerální svaloviny tukovou tkání (myosteatóze), která negativně ovlivňuje funkční zdatnost a sekundárně i soběstačnost a celkovou kvalitu života seniorů. Hlavní roli v rozvoji SO hraje chronický proinflamatorní stav se zvýšenou produkcí zánětlivých cytokinů a hormonů secernovaných tukovou tkání. Přítomnost sarkopenie, resp. SO, je nejčastěji diagnostikována zobrazovacími technikami (DXA, CT, MRI) či v praxi využitelnější bioimpedanční analýzou tělesného složení a posouzením fyzické zdatnosti pomocí komplexních výkonnostních testů. SO je provázena závažnými zdravotními důsledky, negativně ovlivňujícími život pacienta i socioekonomický systém – zvyšuje morbiditu, mortalitu, podílí se na vzniku kardiovaskulárních chorob, diabetes mellitus 2. typu, prodlužuje délku hospitalizace, zpomaluje hojení ran a zhoršuje kognitivní funkce. Představuje však také významný modifikovatelný rizikový faktor, kdy v prevenci a léčbě hraje klíčovou roli změna životního stylu. Jako nejúčinnější se jeví kombinace aerobního a silového tréninku společně s odborně vedeným kalorickým deficitem, avšak s dostatečným příjmem proteinů.
Klíčová slova:
sarkopenie – sarkopenická obezita – pohybová intervence – nutriční intervence
Úvod
Stárnutí je asociováno s (pato)fyziologickými, genderově specifickými změnami tělesné kompozice a metabolismu. Významná odchylka – progresivní nárůst tukové hmoty (obezita) při současném snížení kvality a hmoty kosterní svaloviny (sarkopenie) – zvyšuje výskyt nežádoucích zdravotních důsledků, morbidity i mortality.(1) Koexistence obezity a sarkopenie, nazývaná též sarkopenická obezita (SO), představuje díky této synergicky působící metabolické zátěži kruciální rizikový faktor pro výskyt pádů, rozvoj imobility, pokles funkční zdatnosti či předčasnou institucionalizaci.(2) Vznik a perzistence SO se zdají být úzce spojeny s chronickým proinflamatorním stavem, involučními změnami v neuromuskulárních funkcích, anabolickým potenciálem, oxidativním stresem a v neposlední řadě i s behaviorálními faktory – stavem výživy a stupněm fyzické aktivity. Není tedy s podivem, že významnou roli v rozvoji SO hrají zánětlivé cytokiny, hormony a další proteiny, konkrétně TNF-alfa, IL-6 či IL-15, leptin, adiponektin, irisin či myostatin.(3) Interakce jednotlivých vnějších i vnitřních faktorů z dlouhodobého hlediska velmi pravděpodobně překonává i pozitivně popisovaný „paradox obezity“ ve starším věku.(4) V etiopatogenezi SO je zkoumán též vliv střevního mikrobiomu a na základě výsledků konstruovány intervenční strategie.(5) V popředí však i nadále zůstává cílená nutriční podpora a vhodná fyzická aktivita.(6–8)
V článku je podrobně rozebrána terminologie, definice, etiopatogeneze a intervence SO s přesahem do klinické praxe.
Terminologie a definice
Sarkopenická obezita představuje samostatnou nozologickou jednotku, charakterizovanou nízkým množstvím beztukové hmoty (FFM – fat free mass) při současném nadbytku tkáně tukové – obezitě.(1) Vektor synergického vývoje obou rizikových faktorů vedoucích ke vzniku SO je možné jen velmi obtížně určit, přesto se někteří autoři přiklánějí k redefinici a nahrazení SO termínem „obézní sarkopenie“ (z angl. obese sarcopenia), který by měl, dle dostupných dat, lépe definovat patofyziologickou cestu onemocnění.(9)
Ačkoli se obezita v rámci ICD-10-CM objevuje již delší čas (E65–E68 Obezita a jiné hyperalimentace),(10) sarkopenie byla do této mezinárodní klasifikace zařazena až v roce 2016, a to pod kódem M62.84.(11,12) Pro obě choroby jsou tedy v současné době vyčleněny samostatné diagnózy s vlastními kódy, SO však svůj kód prozatím postrádá. Obdobně je tomu i s diagnostickými kritérii SO. I proto současná definice SO vychází pouze z definic sarkopenie a obezity selektivně.(13) Ty se však výrazně liší a použití rozdílných diagnostických kritérií a mezních hodnot způsobuje rozdíly v prevalenci v jednotlivých studiích a významně ovlivňuje senzitivitu jakékoli predikce rizika onemocnění SO včetně přidružených komplikací.
Definice sarkopenie
Sarkopenie je stavem, onemocněním, kdy největší orgán lidského těla – svalová hmota – selhává ve své funkci. Terminologicky jej můžeme charakterizovat jako tzv. muscle failure. Sarkopenie je definována jako progresivní, generalizovaná ztráta svalové hmoty, síly a výkonnosti pod stanovenou hranici (mezní hodnotu), která je spojena se zvýšeným rizikem nežádoucích zdravotních důsledků včetně pádů, zlomenin, fyzické disability a mortality. Úbytek a související změny svalové hmoty jsou primárně dány involučně, a vyskytují se tedy především ve vyšším věku, mohou se však objevit i dříve, v závislosti na přidružených chorobách a rizikových faktorech. Tyto rizikové faktory pak sehrávají roli v intervenčních strategiích, které zpomalují nástup sarkopenie nebo mu předcházejí.
Revidovaný konsenzus European Working Group on Sarcopenia in Older People – EWGSOP-2 z roku 2019 poprvé stanovuje mezní hodnoty na základě zkušeností asijských výzkumníků, kteří poukázali na význam implementace jednotných kritérií do klinické praxe za účelem sjednocení diagnostiky sarkopenie.(14) Právě původní nekonzistence prováděných studií byla totiž jedním z důvodů, proč v prvním konsenzu (EWGSOP-1) z roku 2010 nebyly mezní hodnoty jasně stanoveny.(15) Na rozdíl od EWGSOP-1 je též v diagnostice upřednostňována nízká svalová síla jako klíčový faktor a stanovení množství svalové hmoty a její kvality je doporučeno (pouze) k prvotnímu záchytu sarkopenie (screeningu).(14)
Sarkopenii provází zhoršení kvality svalové hmoty – mikro - a makroskopické změny ve svalové architektuře a kompozici, dochází k progresivnímu úbytku svaloviny, zatímco množství tukové tkáně zůstává zachováno nebo se zvyšuje. Tuková tkáň je v těle redistribuována – zvyšuje se podíl viscerálního tuku (především v játrech), kosterní svalovina je tukem postupně infiltrována (tzv. mramorování) a ubývá tuku podkožního.(3) Mramorování kosterní svaloviny poté přispívá ke zhoršování funkčních schopností jedince. Detekce snížené fyzické zdatnosti a výkonnosti predisponuje seniory k výrazně nepříznivějším zdravotním důsledkům, a proto je, mimo jiné, výkonnostních testů využíváno k identifikaci závažnosti sarkopenie.
Celý diagnostický postup sarkopenie je založen na předpokladu vyšetření svalové síly (nejčastěji ručním dynamometrem), zhodnocení fyzické zdatnosti (standardizovanými výkonnostními testy) a měření množství svalové hmoty. Operativní definice sarkopenie se poté odráží od výsledků těchto vyšetření:
- Sarkopenie je pravděpodobná, pokud je identifikováno kritérium č. 1.
- Sarkopenie je potvrzená, pokud je ke kritériu č. 1 potvrzeno také kritérium č. 2.
- Pokud současně potvrzujeme kritérium č. 1, 2 i 3, pak je sarkopenie definována jako závažná.
- Kritérium č. 1: Nízká svalová síla
- Kritérium č. 2: Nízké množství svalové hmoty či zhoršená kvalita svalové hmoty
- Kritérium č. 3: Nízká zdatnost/výkonnost
K identifikaci jednotlivých kritérií jsou v rámci nového konsenzu (EWGSOP-2) stanoveny mezní hodnoty. Nízká svalová síla (kritérium č. 1) je nejčastěji detekována při vyšetření síly stisku ruky pomocí ručního dynamometru. Mezní hodnoty k tomuto měření jsou dány – pro muže < 27 kg (dříve 30 kg), pro ženy pak < 16 kg (dříve 20 kg). Nízké množství svalové hmoty/kvality je určováno vyšetřením DXA/BIA, mezní hodnoty jsou dány pomocí Appendicular Skeletal Muscle Mass (ASM) – pro muže < 20 kg, pro ženy pak < 15 kg; adjustované mezní hodnoty k výšce (ASM/výška2) – pro muže < 7,0 kg/m2, pro ženy < 5,5 kg/m2. Pro posouzení fyzické zdatnosti/výkonnosti se využívá měření rychlosti chůze, kdy by rychlost neměla být pomalejší než 0,8 m/s, chůze na 400 m – za signifikantní se považuje nezvládnutí testu / čas rovný nebo delší než 6 minut. Velmi kvalitním komplexním výkonnostním testem, který se používá i k detekci geriatrické křehkosti, je Short Physical Performance Battery (SPPB) – skóre rovné nebo nižší než 8 bodů je považováno za průkaz závažné sarkopenie. Využít je možné též Timed Up and Go test (TUG), zde je signifikantní čas rovný nebo delší než 20 s.(14)
Posouzení výkonnosti/zdatnosti a svalové síly se zdá být klíčové i pro identifikaci a závažnost sarkopenické obezity.(16)
Definice obezity
Obezita je metabolickým onemocněným charakterizovaným abnormálním či nadměrným zmnožením tukových zásob v těle. Tato akumulace má za následek zvýšené riziko metabolických onemocnění (např. diabetes mellitus 2. typu), kardiovaskulárních chorob a mortality.(17) Obezita je komplexním onemocněním asociovaným s více než 150 komorbiditami (např. s kolorektálním karcinomem či nealkoholovou steatohepatitidou).(18) Obdobně jako u sarkopenie nejsou ani u obezity v současné době jasně stanovena jednotná diagnostická kritéria. Světová zdravotnická organizace (WHO) definuje obezitu u dospělé populace pomocí Body Mass Indexu (BMI). Hodnota BMI v rozsahu 30–34,9 kg/m2 je definována jako obezita 1. stupně, BMI v pásmu 35–39,9 kg/m2 poukazuje na obezitu 2. stupně a BMI ≥ 40 kg/m2 na obezitu 3. stupně. Jako nadváha je pak definován BMI vyšší než 25 kg/m2. Ekvivalentně s rostoucím BMI stoupá též míra metabolického rizika.
Použití BMI jako jediného kritéria pro diagnostiku obezity je však v mnoha ohledech sporné. V určitých oblastech světa (např. Severní Amerika) je proto jako klinický ukazatel využíván pouze omezeně. Jedná se především o státy s vysokou prevalencí nadváhy a obezity, kde je preferenčně využíváno poměrů v množství tukové a svalové hmoty. Involuční změny v množství a redistribuci tukové tkáně a jejich souvislost s mortalitním rizikem komplikují stanovení optimálních pásem BMI i pro seniorský věk. Geriatričtí pacienti se v rámci optimálního BMI pohybují v mírně odlišném rozmezí, než je udáváno pro populaci dospělou – některé výzkumy totiž dokazují, že senioři profitují z tzv. paradoxu obezity, respektive nadváhy. Tento paradox je vysvětlován vyšší anabolickou odpovědí při výraznějším mechanickém stimulu (vyšší hmotnosti) kompenzující anabolickou rezistenci ve svalu, která je pro stáří typická.(4) Ideální BMI pro seniorský věk se s ohledem na mortalitní riziko pohybuje v rozmezí 24,0–30,9 kg/m2, přičemž vůbec nejnižší mortality dosahují geriatričtí pacienti s BMI v úzkém pásmu 27,0–27,9 kg/m2. BMI přesahující 30,9 kg/m2 má však stejný negativní vliv na mortalitu a morbiditu seniorů jako u populace středního věku.(19)
Další nevýhodou použití BMI jako diagnostického kritéria je fakt, že nezohledňuje procento tuku v těle. Potenciální rizikovost obezity se totiž odráží především v množství a distribuci tukové tkáně. Z tohoto úhlu pohledu je pak možné rozlišovat dva základní typy obezity:
- Androidní typ je charakterizován akumulací tuku v abdominální oblasti, proto je nazýván také centrální, viscerální či obezita horního typu.
- Gynoidní typ je specifický ukládáním tuku v oblasti stehen a hýždí, tzv. dolní typ.
Vhodným parametrem selektujícím pacienty s jedním nebo druhým typem obezity se pro klinickou praxi zdá být obvod pasu. Obvod pasu velmi dobře koreluje s mírou uloženého viscerálního tuku a odráží tak potenciální kardiometabolickou rizikovost. Zvýšené riziko zdravotních komplikací je dle WHO stanoveno u žen při obvodu pasu ≥ 80 cm, u mužů pak ≥ 94 cm. Vysoké riziko představuje obvod pasu u žen ≥ 94 cm a u mužů ≥ 102 cm. WHO stanovuje též procentuální hranici množství tukové hmoty, které je možné považovat za obezitu – u žen > 35 %, u mužů > 25 %.(20) Redistribuce tukové tkáně a fyziologicky vyšší procento tuku v těle u geriatrických pacientů však vedou k diskusi, zda jsou tyto procentuální hodnoty validní, využitelné a představují stejné mortalitní riziko i u této populace.
Prevalence sarkopenické obezity
Přesná data o prevalenci SO jsou díky neuniformním diagnostickým kritériím a rozdílům v používaných vyšetřovacích technologiích limitována.(1) Zajímavé údaje o prevalenci SO poskytuje 14 let trvající prospektivní studie z přelomu 21. století The National Health and Nutrition Examination Survey (NHANES) III. Do této studie bylo mezi lety 1999–2004 zařazeno celkem 4984 subjektů starších 60 let (průměrný věk – 70,5 roku u mužů; 71,6 roku u žen). Sarkopenie byla diagnostikována pomocí Appendicular Lean Mass (ALM) (muži < 19,75 kg; ženy < 15,02 kg) a ALM adjustovaného k BMI (muži < 0,789; ženy < 0,512). Diagnóza obezity se odrážela od procentuálního podílu tuku v těle – muži ≥ 25 %; ženy ≥ 35 %. Koexistence obou kritérií pak definovala přítomnost SO. Prevalence SO v tomto obsáhlém souboru při zvolených dg. kritériích dosahovala 18,1 % u žen a 42,9 % u mužů.(21) V návaznosti na rasovou specificitu je možné srovnat data NHANES s korejskou databází Korean NHANES (KNHANES) IV. SO byla posuzována za použití DXA jako hodnoticího nástroje u 2221 Korejců starších 60 let. Prevalence SO byla v této populaci výrazně nižší než v původní americké studii, a to 6,1 % u žen a 7,3 % u mužů.(22)
Bez rasové specifikace a v závislosti na použitých vyšetřovacích metodách se prevalence SO pohybuje v rozmezí 2,75–20 %.(23)
Patofyziologie a zdravotní důsledky sarkopenické obezity
Rozvoj SO je podmíněn více faktory, které z větší či menší míry ovlivňují progresi onemocnění a celkovou prognózu, a to jak nezávisle, tak synergicky.
Hlavním (rizikovým) faktorem vzniku SO je samotné stárnutí, dále faktory životního stylu – vliv výživy (malnutrice) a nedostatek fyzické aktivity, inzulinová rezistence, neurohumorální změny a již dříve zmíněné změny tělesné kompozice (pokles množství svalové hmoty a nárůst hmoty tukové).
Stárnutí
Stárnutí je spojeno s poklesem bazálního metabolismu přibližně o 3 % za jednu dekádu.(24) Tento pokles může být důvodem nárůstu tělesné hmotnosti a snížení množství svalové hmoty, a může tedy přispívat ke vzniku SO. Involuční pokles svaloviny je fyziologický a po 50. roce života dochází k postupné ztrátě o přibližně 1–2 % ročně, přičemž svalová síla klesá progresivněji, a to o 1,5–5 % ročně.(25,26) Nejvyšší množství kosterní svaloviny (peak) je možné sledovat kolem 30. roku věku, po 30. roce množství svalové hmoty setrvale klesá a je doprovázeno paralelním nárůstem hmoty tukové.(27) I proto se SO častěji vyskytuje ve vyšším věku i bez nutného nárůstu hmotnosti. Na vině vzniku SO je mimo jiné i ektopická redistribuce tukové tkáně – tuk má s věkem tendenci k ukládání (pohybu) do vnitřních orgánů, svalů a abdominální oblasti, a je tak jedním z hlavních metabolických faktorů způsobujících inzulinovou rezistenci, chronický zánět a hormonální změny.(28)
Nedostatek fyzické aktivity
SO vyššího věku je spojována s nedostatkem fyzické aktivity. Minimální fyzická aktivita, pomalá chůze a převážně sedavý způsob života jsou u seniorů varovnými signály sarkopenie a předzvěstí SO. Atrofované svalstvo, resp. přítomnost sarkopenie dále ztěžují a limitují rehabilitaci, a omezují tak snahy o úpravu životního stylu, kruh se uzavírá. Kombinace odporového a aerobního tréninku má proto své místo v preventivních i léčebných opatřeních.(29)
Chronický prozánětlivý stav mírného charakteru
Jak stárnutí, tak přítomnost obezity zvyšují prostřednictvím omezené fyzické aktivity riziko rozvoje sarkopenie, a tedy i SO. Myosteatóza (dříve zmíněné mramorování) neboli infiltrace svalu tukovou tkání, resp. tukovými buňkami (adipocyty), podporuje taxi imunitních buněk, konkrétně makrofágů (M1), které synergicky s adipocyty (především viscerálního tuku) produkují celou řadu látek proteinové povahy s endokrinním účinkem – adipokiny, např. leptin, chemerin, resistin a jiné proinflamatorní cytokiny – TNF-α, interleukiny (IL), zejména IL-6 a IL-1β, či interferon γ (INF-γ). Tukové prorůstání svalové hmoty způsobuje mitochondriální dysfunkci, limituje β-oxidaci, podporuje zvýšenou peroxidaci lipidů a akumulaci lipidových meziproduktů se zvýšenou tvorbou reaktivních kyslíkových radikálů (RO). Toto lipotoxické prostředí svalu pak vede k chronickému zánětlivému stavu mírného charakteru s následkem svalové degradace a perzistujícího katabolismu kosterní svaloviny. Řada studií podporuje fakt, že tento chronický proinflamatorní stav hraje významnou roli v progresi SO a negativně ovlivňuje morbiditu a mortalitu způsobenou SO.(30–33) Podobné závěry je možné dohledat i v italské studii z roku 2007, která ověřovala, zda zvýšené hladiny IL-6 a C-reaktivního proteinu (CRP) souvisejí se SO a ovlivňují negativně svalovou sílu.(34) Zdá se, že elevace sérových hladin monocyty chemoatrahujícího proteinu 1 (proteinu exprimovaného mesangiálními buňkami ledvin při hyperglykemii) prokazatelně podporují asociaci SO a chronického proinflamatorního stavu.(35)
Mimo to jsou kriticky významné i chronicky zvýšené hladiny adipokinu leptinu, které vedou k leptinové rezistenci a akumulaci volných mastných kyselin (VMK). Vzhledem k porušené β-oxidaci, resp. mitochondriální svalové dysfunkci je porušená utilizace VMK, a dochází tak k jejich hromadění v klíčových vnitřních orgánech (játrech, srdci a slezině). Infiltrace viscerální oblasti tukem vede k dysfunkční produkci inzulinu, a tedy k inzulinové rezistenci – viz následující oddíl.(36) Zvýšená tvorba RO popsaná výše v textu vede k oxidativnímu stresu a expresi celé řady zánětlivých transkripčních faktorů, např. nukleárního faktoru kappa B – NF-kB, modulujícího proteolytické dráhy a podporujícího zánět. Dysbalance mezi hormony svalové tkáně (tzv. myokiny) zprostředkovaná akumulací tukové tkáně provází a výrazně negativně ovlivňuje inzulinovou rezistenci.(37,38)
Inzulinová rezistence
Produkce a účinnost inzulinu s věkem a u obézních pacientů klesá. Jak již bylo popsáno, chronický proinflamatorní stav podporuje produkci a sekreci celé řady prozánětlivých faktorů, a moduluje tak citlivost tkání na inzulin prostřednictvím změn v inzulinové signální cestě. Výsledkem této změny je inzulinová rezistence (IR).(39) IR nepříznivě ovlivňuje anabolismus bílkovin a nepřímo zapříčiňuje atrofii svalových vláken. Obezita tento fakt umocňuje – především u starších diabetiků je výrazně snížena síla a kvalita svaloviny dolních končetin, což limituje fyzickou aktivitu a vytváří začarovaný kruh.(40) Obezitou indukovaná IR kosterního svalstva vede k narušení svalového metabolismu a nesprávné signalizaci ve svalových buňkách. U obézních pacientů mohou svalové progenitorové buňky diferencovat na adipocytům-podobný fenotyp v důsledku parakrinní signalizace z (adipo)cytokinů, a ústit tak v omezení kapacity svalové regenerace.(41) IR indukovaná mitochondriální dysfunkce a downregulace genů pro mitochondriální enzymy snižuje mitochondriální kapacitu, a zpětně tak vede k akumulaci tuku ve svalech, játrech a k jaterní steatóze. IR je těmito cestami zapojena do patofyziologických mechanismů ovlivňujících snížené množství svalové hmoty a síly, které podporují vznik SO.(42)
Hormonální změny
Jakožto endokrinní orgán produkuje kosterní sval celou řadu myokinů, z nichž nejdůležitější se zdají být myostatin a irisin. Má se za to, že myostatin inhibuje růst a diferenciaci svalových buněk, zatímco irisin růst svalové hmoty stimuluje. Četné studie na animálních modelech potvrzují, že regulací hladin myostatinu je možné pozitivně ovlivnit či zvrátit involuční pokles kosterní svaloviny.(43–45) Existují také důkazy o tom, že nízké hladiny cirkulujícího irisinu jsou senzitivním markerem svalové atrofie a nízké svalové síly, a irisin tak může být potenciálním biomarkerem svalové dysfunkce a předpovídat nástup sarkopenie, stejně tak jako může být potenciální terapeutickou strategií pro disabilní či imobilní pacienty.(46) Snížené hladiny irisinu za současné elevace hladin myostatinu jsou úzce spojeny s narušením procesu hnědnutí (z angl. browning) bílé tukové tkáně, snížením energetického výdeje a stimulací hmotnostního přírůstku. Hnědnutí bílé tukové tkáně se ukazuje být protektivním faktorem vůči obezitě a metabolickým poruchám.(47) Není divu, že na bázi těchto faktů je budována celá řada terapeutických strategií, prozatím však bez silné evidence.
Další hormony jako inzulinu podobný růstový faktor 1 (IGF-1), růstový hormon, testosteron a estrogen hrají rovněž roli v regulaci svalového anabolismu/katabolismu.(48) Zvýšené hladiny cirkulujících VMK u obézních pacientů inhibují sekreci IGF-1 a růstového hormonu,(9) tato redukce IGF-1 je spojena s downregulací irisinu, snižuje množství a sílu svalové hmoty a přispívá ke vzniku SO. Involuční pokles testosteronu a estrogenu negativně ovlivňuje zdraví svalové hmoty – tyto aberantní změny pak exacerbují SO.(49)
Image 1. Faktory ovlivňující vznik sarkopenické obezity (dle Kalinkovich a Livshits, 2017) 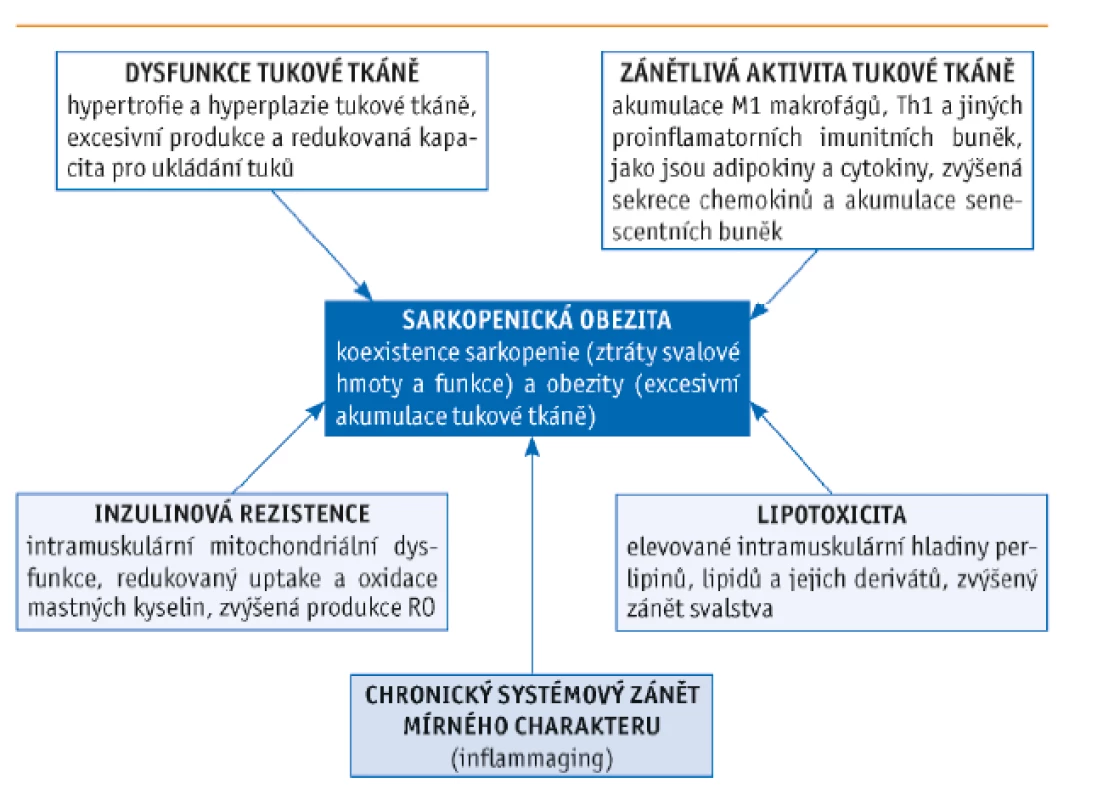
Zdravotní důsledky sarkopenické obezity
Je všeobecně známým faktem, že přítomnost nízké svalové hmoty a síly je nezávislým negativním rizikovým faktorem snížení funkční zdatnosti a kvality života, to samé platí i pro přítomnost obezity. Je tedy logické spekulovat o tom, zda tyto dva prognostické faktory mohou působit synergicky, a výrazněji tak zvyšovat riziko morbidity, celkové i kardiovaskulární mortality, metabolických poruch a snížení kvality života ve vyšším věku.(50) Ukazuje se, že SO je prokazatelně asociována se zvýšeným rizikem úmrtí ze všech příčin u komunitně žijících seniorů.(51) Metaanalýza 12 kohortových studií prokázala, že při srovnání subjektů bez SO mají participanti se SO o 24 % zvýšené riziko úmrtí ze všech příčin, toto riziko bylo zvláště patrné u mužské populace. Je však nutné podotknout, že riziko mortality se liší v závislosti na použitých diagnostických parametrech SO – konkrétně je možné sledovat nárůst rizikových ukazatelů při měření obvodu paže a svalové síly (HR 1,46; 95% CI 1,23–1,73, resp. 1,23; 1,09–1,38), oproti hodnocení množství kosterní svaloviny (HR 1,24; 95% CI 1,12–1,37, p < 0,001).(52) Tato diskrepance je v souladu s výsledky a doporučením nových guidelines Evropské pracovní skupiny pro sarkopenii (viz výše), kde je kladen důraz právě na svalovou sílu jako významnější rizikový a prognostický faktor oproti celkovému množství svalové hmoty.(14) Pokud bereme v úvahu dg. kritéria související s obezitou, je zajímavé popsat výsledky recentní japonské studie, kde bylo zvýšení úmrtnosti ze všech příčin u mužů asociováno při SO definované pomocí obvodu pasu (HR 1,19; 95% CI 1,02–1,38), nikoli však při použití BMI či procenta tukové hmoty.(53)
SO se podílí na vzniku závažných metabolických poruch – onemocněních kardiovaskulárního aparátu (KVO), diabetes mellitus či onkologických chorob.(54) Koexistence viscerální obezity, hyperglykemie, hyperinzulinemie, dyslipidemie a hypertenze jsou prediktivními faktory diabetu a KVO. Alarmujícím faktem zůstává, že SO zvyšuje riziko rozvoje diabetes mellitus téměř o 38 % ve srovnání s jedinci s nadváhou či samotnou obezitou.(55) Zdá se, že SO negativně ovlivňuje i výsledky onkologické léčby – především toxicitu používané medikace, zvyšuje riziko pooperačních komplikací, fyzické disability a zkracuje délku dožití.(56–57) V průřezové studii z roku 2018 hodnotili výzkumníci v geriatrické populaci souvislost mezi SO a kognitivními funkcemi a zjistili, že SO je prediktivním indikátorem vzniku kognitivního deficitu.(58)
Všechny tyto faktory, které významně ovlivňují kvalitu života seniorů, byly ilustrovány i v mírně odlišně koncipované studii z roku 2017, která odhalila nejvyšší riziko pádu a nejhorší výsledky výkonnostních testů právě ve skupině SO.
Výše popsaná data potvrzují přímou korelaci mezi kvalitou života a zdravotním skóre u pacientů se SO.(59)
Nefarmakologické intervence v prevenci a léčbě sarkopenické obezity
V preventivních i léčebných strategiích managementu SO je klíčová včasná, a především dlouhodobá intervence (prevence). Změna životního stylu, resp. úprava stravovacích zvyklostí, cílená nutriční podpora a vhodně zvolená pohybová aktivita jsou kruciální součástí léčby SO. Limitací těchto režimových opatření bývá nízká compliance pacientů k nastavené dietní léčbě, kdy pacienti často nepochopí nutnost modifikace stravovacího režimu a inklinují ke stávajícím nevyhovujícím zvyklostem, zde je proto kvalitní edukace naprosto fundamentální.(60,61)
Cílem intervencí je změna tělesné kompozice ve smyslu redukce tukové hmoty při současném nárůstu hmoty svalové. Monitorace pouze tělesné hmotnosti může být v tomto ohledu zavádějící, je proto doporučováno zaměřit se především na vyšetření složení těla (např. pomocí bioimpedanční analýzy či DXA) a v pravidelných intervalech kontrolovat výsledky výkonnostních testů (např. Timed Up and Go test). Při nevhodně nastavené terapeutické intervenci může docházet ke ztrátě kostní denzity, svalové hmoty a progresi osteosarkopenie.(61)
Pohybová intervence
Aerobní i anaerobní trénink se významně podílí na atenuaci involučního poklesu svalové hmoty a síly. Zařazení pravidelné fyzické aktivity zvyšuje inzulinovou senzitivitu, anabolickou odpověď organismu na endogenní aminokyseliny, aktivuje proliferaci a diferenciaci satelitních buněk, zvyšuje mitochondriální biogenezi, upravuje hormonální nerovnováhu a snižuje oxidativní zátěž.(61,29)
Světová zdravotnická organizace doporučuje v terapii SO zařazení aerobní aktivity střední nebo vysoké intenzity v minimálním rozsahu 150 minut týdně v kombinaci se silovým tréninkem s frekvencí 2× týdně.(62) Cílem aerobní zátěže je zvýšení fyzické výkonnosti, zatímco silový trénink vede ke zlepšení flexibility, svalové síly a ke svalové hypertrofii.(29) Tento superiorní efekt kombinace silového cvičení s aerobním tréninkem lze dohledat v četné literatuře, nejlépe jsou však tyto výsledky patrné ve studii z roku 2017, která testovala rozdílné tréninkové protokoly a jejich vliv na SO.(63)
I přes signifikantní benefity pohybové aktivity je adherence seniorů velmi nízká a pohybuje se pouze v rozmezí 7–15 %.(64,65) Důvody nespolupráce jsou četné – nedostatek času, strach, zdravotní obavy, bolest, únava a v neposlední řadě nedostatečná sociální podpora. Z toho důvodu je nezbytné, a to navzdory robustní evidenci podporující zařazení pravidelné pohybové aktivity jako efektivní intervence, vyhledávat a zkoumat i intervence na pohybové aktivitě nezávislé.(66)
Nutriční intervence
Množství kvalitních studií zkoumajících problematiku nutričních strategií SO je v současné době nedostatečné, a většina doporučení je proto konstruována na základě expertních názorů. Primární nutriční intervence tvoří restrikce kalorického příjmu spolu s dostatečným příjmem bílkovin a suplementací mikroživin.
Nastavení optimální kalorické restrikce (CR) může být obtížné. Příliš velká CR představuje riziko nadměrné ztráty svalové hmoty – může prohloubit sarkopenii, oslabit syntézu svalové hmoty a zvyšovat její degeneraci, a sekundárně tak ovlivnit i kvalitu kostní denzity. Cílem CR je snížení tělesné hmotnosti alespoň o 5–8 % z původní hodnoty.(29) Jako optimální se tedy u starší populace jeví redukce příjmu energie představující deficit 200–750 kcal/den.(61) Recentní review z roku 2020 poukazuje na fakt, že dietou indukovaná redukce tělesné hmotnosti může zvýšit fyzickou zdatnost obézních seniorů i bez souběžných změn ve frekvenci pohybové aktivity.(4)
Pro zachování svalové hmoty po dobu CR je nezbytný dostatečný příjem kvalitních proteinů, zvláště ve vyšším věku. Novější studie ukazují, že dříve doporučované množství 0,8 g / kg tělesné hmotnosti není dostatečné a intervence u pacientů se SO by měla cílit na příjem proteinů výrazně vyšší (1,2–1,5 g/kg), v případě akutního onemocnění může potřeba vysoce přesáhnout i toto množství.(67) Ačkoli primární a nejzásadnější je absolutní příjem bílkovin, svou roli hraje i rozložení jejich konzumace v průběhu dne. Za ideální se považuje rozložení celkového množství bílkovin do 3–4 porcí za den.(61)
Mezi doporučené suplementy v léčbě a prevenci SO patří proteinové doplňky stravy (zejména při současném silovém tréninku) obohacené o aminokyselinu leucin. Na zvážení je též podávání kreatinu, hydroxymethylbutyrátu (HMB), a vitaminu D.(68)
Modifikace životního stylu ve stáří by měla být považována za primární dlouhodobou intervenci v léčbě i prevenci SO a měla by být stavěna před farmakologickou léčbu.
Závěr
Demografické stárnutí populace spolu se zvyšujícím se výskytem obezity nevyhnutelně vede ke vzniku SO. SO je asociována se zvýšeným rizikem disability, prodlužuje délku hospitalizace, zvyšuje kardiometabolickou zátěž, morbiditu, mortalitu a snižuje kvalitu života – představuje tedy významný problém pro jednotlivce i zdravotnický systém. V léčbě SO je kruciální včasná a dlouhodobá intervence kombinující pravidelnou fyzickou aktivitu s prvky silového tréninku a individuální nutriční plán vedený odborníkem.
Mgr. Ing. Tereza Vágnerová
Vystudovala obor Nutriční terapeut na 1. LF UK, v roce 2013 absolvovala inženýrský studijní program v oboru Výživa a potraviny ČZU a o dva roky později v roce 2017 magisterský studijní program v oboru Nutriční specialista 1. LF UK. Na lékařské fakultě pokračuje v postgraduálním studijním programu Preventivní medicína s projektem zaměřeným na primární prevenci podvýživy při syndromu geriatrické křehkosti a sarkopenie. Od roku 2013 je nutriční terapeutkou Oddělení nutričních terapeutů při Geriatrické klinice VFN a 1. LF UK. Zde zároveň působí jako odborná asistentka a vyučuje v nelékařských studijních oborech i všeobecném lékařství. Byla jedním ze zakládajících členů České asociace nutričních terapeutů, z. s., v níž se angažuje jako členka výkonného výboru. Věnuje se výzkumu v oblasti výživy (SPRINTT), dietetiky a nutriční biochemie (InvestGAIT) na evropské i celosvětové úrovni.
Korespondenční adresa:
Mgr. Ing. Tereza Vágnerová
Geriatrická klinika 1. LF UK a VFN
Londýnská 15
120 00 Praha 2
e-mail: tereza.vagnerova@vfn.cz
Sources
1. Prado CMM, Wells JCK, Smith SR, et al. Sarcopenic obesity: a critical appraisal of the current evidence. Clin Nutr 2012; 31(5): 583–601.
2. Batsis JA, Mackenzie TA, Barre LK, et al. Sarcopenia, sarcopenic obesity and mortality in older adults: results from the National Health and Nutrition Examination Survey III. Eur J Clin Nutr 2014; 68(9): 1001–1007.
3. Sakuma K, Yamaguchi A. Sarcopenic obesity and endocrinal adaptation with age. Int J Endocrinol online 2013; 2013 : 204164.
4. Morgan PT, Smeuninx B, Breen L. Exploring the impact of obesity on skeletal muscle function in older age. Front Nutr 2020; 7 : 569904.
5. Prokopidis K, Cervo MM, Gandham A, Scott D. Impact of protein intake in older adults with sarcopenia and obesity: a gut microbiota perspective. Nutrients 2020; 12(8): 2285.
6. Batsis JA, Villareal DT. Sarcopenic obesity in older adults: aetiology, epidemiology and treatment strategies. Nat Rev Endocrinol 2018; 14(9): 513–537.
7. Bouchonville MF, Villareal DT. Sarcopenic obesity: how do we treat it? Curr Opin Endocrinol Diabetes Obes 2013; 20(5): 412–419.
8. Petroni ML, Caletti MT, Dalle Grave R, et al. Prevention and treatment of sarcopenic obesity in women. Nutrients 2019; 11(6): 1302.
9. Kalinkovich A, Livshits G. Sarcopenic obesity or obese sarcopenia: a cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis. Ageing Res Rev 2017; 35 : 200–221.
10. 2021 ICD-10-CM Diagnosis Codes E65-68. Dostupné na: https://www.icd10data.com/ICD10CM/Codes/E00-E89/E65-E68
11. 2021 ICD-10-CM Diagnosis Code M62.84. Dostupné na: http://www.icd10data.com/ICD10CM/Codes/M00-M99/M60-M63/M62-/M62.84
12. Vellas B, Fielding RA, Bens C, et al. Implications of ICD-10 for sarcopenia clinical practice and clinical trials: report by the International Conference on Frailty and Sarcopenia Research Task Force. J Frailty Aging 2018; 7(1): 2–9.
13. Roh E, Choi KM. Health consequences of sarcopenic obesity: a narrative review. Front Endocrinol 2020; 11 : 332.
14. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised european consensus on definition and diagnosis. Age Ageing 2019; 48(1): 16–31.
15. Cruz-Jentoft AJ, Baeyens J-P, Bauer JM, et al. Sarcopenia: european consensus on definition and diagnosis. Age Ageing 2010; 39(4): 412–423.
16. von Berens Å, Obling SR, Nydahl M, et al. Sarcopenic obesity and associations with mortality in older women and men – a prospective observational study. BMC Geriatr 2020; 20(1): 199.
17. Obesity: preventing and managing the global epidemic. Report of a WHO consultation. World Health Organization Technical Report Series 2000; 894: i–xii/1–253.
18. Jarolimova J, Tagoni J, Stern TA. Obesity: its epidemiology, comorbidities, and management. Prim Care Companion CNS Disord 2013; 15(5): PCC.12f01475.
19. Winter JE, Macinnis RJ, Wattanapenpaiboon N, Nowson CA. BMI and all-cause mortality in older adults: a meta-analysis. Am J Clin Nutr 2014; 99(4): 875–890.
20. Alberti KGMM, Zimmet P, Shaw J, IDF Epidemiology Task Force Consensus Group. The metabolic syndrome – a new worldwide definition. Lancet 2005; 366(9491): 1059–1062.
21. Batsis JA, Mackenzie TA, Lopez-Jimenez F, Bartels SJ. Sarcopenia, sarcopenic obesity and functional impairments in older adults: NHANES 1999–2004. Nutr Res 2015; 35(12): 1031–1039.
22. Hwang B, Lim J-Y, Lee J, et al. Prevalence rate and associated factors of sarcopenic obesity in korean elderly population. J Korean Med Sci 2012; 27(7): 748–755.
23. Donini LM, Busetto L, Bauer JM, et al. Critical appraisal of definitions and diagnostic criteria for sarcopenic obesity based on a systematic review. Clin Nutr 2020; 39(8): 2368–2388.
24. Volkert D, Beck AM, Cederholm T, et al. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clin Nut 2019; 38(1): 10–47.
25. Keller K, Engelhardt M. Strength and muscle mass loss with aging process. Age and strength loss. Muscles Ligaments Tendons J 2014; 3(4): 346–350.
26. Sayer AA, Syddall H, Martin H, et al. The developmental origins of sarcopenia. J Nutr Health Aging 2008; 12(7): 427–432.
27. Mourtzakis M, Prado CMM, Lieffers JR, et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab 2008; 33(5): 997–1006.
28. Polyzos SA; Margioris AN. Sarcopenic obesity. Hormones 2018; 17(3): 321–331.
29. Poggiogalle E, Parrinello E, Barazzoni R, et al. Therapeutic strategies for sarcopenic obesity: a systematic review. Curr Opin Clin Nutr Metab Care 2021; 24(1): 33–41.
30. Kim TN, Park MS, Lim KI, et al. Relationships between sarcopenic obesity and insulin resistance, inflammation, and vitamin D status: the Korean Sarcopenic Obesity Study. Clin Endocrinol 2013; 78(4): 525–532.
31. Neels JG, Olefsky JM. Inflamed fat: what starts the fire? J Clin Invest 2006; 116(1): 33–35.
32. Batsis JA, Mackenzie TA, Jones JD, et al. Sarcopenia, sarcopenic obesity and inflammation: results from the 1999–2004 National Health and Nutrition Examination Survey. Clin Nutr 2016; 35(6): 1472–1483.
33. da Cunha Nascimento D, da Cunha Oliveira S, Vieira DCL, et al. The impact of sarcopenic obesity on inflammation, lean body mass, and muscle strength in elderly women. Int J Gen Med 2018; 11 : 443–449.
34. Schrager MA, Metter EJ, Simonsick E, et al. Sarcopenic obesity and inflammation in the InCHIANTI study. J Appl Physiol 2007; 102(3): 919–925.
35. Lim JP, Leung BP, Ding YY, et al. Monocyte chemoattractant protein-1: a proinflammatory cytokine elevated in sarcopenic obesity. Clin Interv Aging 2015; 10 : 605–609.
36. Shimabukuro M. Leptin Resistance and lipolysis of white adipose tissue: an implication to ectopic fat disposition and its consequences. J Atheroscler Thromb 2017; 24(11): 1088–1089.
37. Wannamethee SG, Atkins JL. Muscle loss and obesity: the health implications of sarcopenia and sarcopenic obesity. Proc Nutr Soc 2015; 74(4): 405–412.
38. Meng S-J, Yu L-J. Oxidative stress, molecular inflammation and sarcopenia. Int J Mol Sci 2010; 11(4): 1509–1526.
39. Chen L, Chen R, Wang H, Liang F. Mechanisms linking inflammation to insulin resistance. Int J Endocrinol 2015; 2015 : 508409.
40. Abbatecola AM, Ferrucci L, Ceda G, et al. Insulin resistance and muscle strength in older persons. J Gerontol Series A 2005; 60(10): 1278–1282.
41. Kob R, Bollheimer LC, Bertsch T, et al. Sarcopenic obesity: molecular clues to a better understanding of its pathogenesis? Biogerontology 2015; 16(1): 15–29.
42. Abbatecola AM, Paolisso G, Fattoretti P, et al. Discovering pathways of sarcopenia in older adults: a role for insulin resistance on mitochondria dysfunction. J Nutr Health Aging 2011; 15(10): 890–895.
43. Collins-Hooper H, Sartori R, Macharia R, et al. Propeptide-mediated inhibition of myostatin increases muscle mass through inhibiting proteolytic pathways in aged mice. J Gerontol Series A 2014; 69(9): 1049–1059.
44. Camporez J-PG, Petersen M, Abudukadier A, et al. Anti-myostatin antibody increases muscle mass and strength and improves insulin sensitivity in old mice. Proc Natl Acad Sci USA 2016; 113(8): 2212–2217.
45. Murphy KT, Koopman R, Naim T, et al. Antibody-directed myostatin inhibition in 21-mo-old mice reveals novel roles for myostatin signaling in skeletal muscle structure and function. FASEB J 2010; 24(11): 4433–4442.
46. Chang JS, Kim TH, Nguyen TT, et al. Circulating irisin levels as a predictive biomarker for sarcopenia: a cross-sectional community-based study. Geriatr Gerontol Int 2017; 17(11): 2266–2273.
47. Colaianni G, Cinti S, Colucci S, Grano M. Irisin and musculoskeletal health. Ann NY Acad Sci 2017; 1402(1): 5–9.
48. Wang C, Bai L. Sarcopenia in the elderly: basic and clinical issues. Geriatr Gerontol Int 2012; 12(3): 388–396.
49. Sipilä S, Narici M, Kjaer M, et al. Sex hormones and skeletal muscle weakness. Biogerontology 2013; 14(3): 231–245.
50. Choi KM. Sarcopenia and sarcopenic obesity. Korean J Intern Med 2016; 31(6): 1054–1060.
51. Liu P, Hao Q, Hai S, et al. Sarcopenia as a predictor of all-cause mortality among community-dwelling older people: a systematic review and meta-analysis. Maturitas 2017; 103 : 16–22.
52. Tian S, Xu Y. Association of sarcopenic obesity with the risk of all-cause mortality: a meta-analysis of prospective cohort studies. Geriatr Gerontol Int 2016; 16(2): 155–166.
53. Sanada K, Chen R, Willcox B, et al. Association of sarcopenic obesity predicted by anthropometric measurements and 24-y all-cause mortality in elderly men: the Kuakini Honolulu Heart Program. Nutrition 2018; 46 : 97–102.
54. Hong, S-H, Choi KM. Sarcopenic obesity, insulin resistance, and their implications in cardiovascular and metabolic consequences. Int J Mol Sci 2020; 21(2): 494
55. Khadra D, Itani L, Tannir H, et al. Association between sarcopenic obesity and higher risk of type 2 diabetes in adults: A systematic review and meta-analysis. World J Diabetes 2019; 10(5): 311–323.
56. Carneiro IP, Mazurak VC, Prado CM. Clinical implications of sarcopenic obesity in cancer. Curr Oncol Rep 2016; 18(10): 62.
57. Baracos VE, Arribas L. Sarcopenic obesity: hidden muscle wasting and its impact for survival and complications of cancer therapy. Ann Oncol 2018; 29(Suppl 2): ii1–ii9.
58. Tolea MI, Chrisphonte S, Galvin JE. Sarcopenic obesity and cognitive performance. Clin Interv Aging 2018; 13 : 1111–1119.
59. Öztürk ZA, Türkbeyler İH, Abiyev A, et al. Health-related quality of life and fall risk associated with age-related body composition changes; sarcopenia, obesity and sarcopenic obesity. Intern Med J 2018; 48(8): 973–981.
60. Prado CM, Anker SD, Coats AJS, et al. Nutrition in the spotlight in cachexia, sarcopenia and muscle: avoiding the wildfire. J Cachexia Sarcopen Muscle 2000, December 31. doi: https://doi.org/10.1002/jcsm.12673
61. Koliaki Ch, Liatis S, Dalamaga M, Kokkinos A. Sarcopenic obesity: epidemiologic evidence, pathophysiology, and therapeutic perspectives. Curr Obes Rep 2019; 8(4): 458–471.
62. Garber CE, Blissmer B, Deschenes MR, et al. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc 2011; 43(7): 1334–1359.
63. Villareal DT, Aguirre L, Gurney AB, et al. Aerobic or resistance exercise, or both, in dieting obese older adults. New Engl J Med 2017; 376(20): 1943–1955.
64. Burton E, Farrier K, Lewin G, et al. Motivators and barriers for older people participating in resistance training: a systematic review, J Aging Phys Act 2017; 25(2): 311–324.
65. O’Brien MW, Robinson SA, Frayne R, et al. Achieving Canadian physical activity guidelines is associated with better vascular function independent of aerobic fitness and sedentary time in older adults. Appl Physiol Nutr Metab 2018; 43(10): 1003–1009.
66. Forbes SC, Candow DG, Ferreira LHB, Souza-Junior TP. Effects of creatine supplementation on properties of muscle, bone, and brain function in older adults: a narrative review. J Dietary Suppl 2021, January 27. Dostupné na: https://www.tandfonline.com/doi/abs/10.1080/19390211.2021.1877232
67. Bauer J, Biolo G, Cederholm T, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Direct Assoc 2013; 14(8): 542–559.
68. Gielen E, Beckwée D, Delaere A, et al. Nutritional interventions to improve muscle mass, muscle strength, and physical performance in older people: an umbrella review of systematic reviews and meta-analyses. Nutr Rev 2021; 79(2): 121–147.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2021 Issue 1-
All articles in this issue
- Editorial
-
The assessment of disability using WHODAS 2.0 tool at geriatric patients.
A pilot study WHODAS-GERI - Knihy
- Disability Assessment Schedule 2.0
- Mobility as a key factor for healthy ageing
- Kniha
- Sarcopenic obesity: from the onset to interventions
- How to determine cardiovascular risk in geriatric patients?
- Giant cell arteritis – a severe disease of the elderly
-
Nutritional guidelines in geriatrics
The nutrition care process and screening
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sarcopenic obesity: from the onset to interventions
-
Nutritional guidelines in geriatrics
The nutrition care process and screening - Mobility as a key factor for healthy ageing
-
The assessment of disability using WHODAS 2.0 tool at geriatric patients.
A pilot study WHODAS-GERI
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


