-
Medical journals
- Career
Léčba diabetu mellitu 1. typu u osob vyššího věku
Authors: D. Janíčková Žďárská
Published in: Geriatrie a Gerontologie 2017, 6, č. 4: 163-167
Category: Review Article
Overview
Starší nemocní s diabetem mellitem 1. typu jsou ve vysokém riziku hypoglykemie a mohou mít závažné komorbidity. Problémy s kognitivní poruchou, mobilitou, smyslovou deteriorací, chronickou bolestí, nepravidelnost ve stravovacím režimu, častá interkurentní onemocnění či progrese stávajících komorbidit interferují se schopností dodržovat běžnou péči o diabetes. V léčbě diabetu mellitu 1. typu volíme jednoznačně intenzifikovaný inzulinový režim za podmínek frekventního selfmonitoringu, nebráníme se novějším typům inzulinů, jako jsou inzulinová analoga. Cílovou metabolickou kompenzaci posuzujeme individuálně, zaměřujeme se na minimalizaci rizika hypoglykemie či závažné hyperglykemie s maximalizací kvality života.
Klíčová slova:
diabetes mellitus 1. typu – geriatrický pacient – inzulinová analoga – hypoglykemieÚvod
Přestože doménou vyššího věku je diabetes mellitus 2. typu, setkáváme se dnes stále častěji u těchto pacientů s diabetem mellitem 1. typu (DM1T). Jednak prevalence autoimunitního diabetu celosvětově vzrůstá, jednak díky zlepšující se péči o diabetiky se tito nemocní dožívají vyššího věku(1–4). Jedná se o pacienty s vysokým rizikem hypoglykemie, často s přidruženými závažnými komorbiditami. Strategii léčby přizpůsobujeme individuálně zejména s ohledem na funkční stav a schopnost nemocného zvládnout každodenní péči o diabetes (selfmonitoring, dietní opatření, aplikace inzulinu apod.).
Hypoglykemie, specifika vyššího věku a DM
Hypoglykemie je spojena se zvýšenou morbiditou a mortalitou pacientů a ovlivňuje kvalitu života(5–9). Při hypoglykemii dochází ke kardiovaskulárním abnormalitám včetně poruch rytmu(10) či postižení mozku(11, 12). Porucha rozpoznávání hypoglykemie je významným rizikovým faktorem pro závažné a recidivující hypoglykemie u DM1T(13). U starší populace pak nabývá porucha rozpoznávání zvýšeného zájmu z důvodu vysokého rizika pádů, kognitivních poruch a kardiovaskulárního onemocnění. S délkou trvání diabetu a s narůstajícím věkem také klesá schopnost kontraregulační odpovědi na hypoglykemii(14–17). Zmatenost, slabost, pády, komunikační problémy, zhoršená koordinace mohou být snadno opomenuty jako varovné signály hypoglykemie a přičteny samotnému věku.
Pro svou vysokou rizikovost ve vyšším věku je nepřítomnost hypoglykemie jedním z hlavních cílů léčby. U starých a polymorbidních pacientů volíme méně těsnou cílovou metabolickou kompenzaci s dosažením asymptomatického stavu (tj. bez polyurie, polydipsie, váhového úbytku) a zároveň nepřítomnosti hypoglykemií. Většinou se tedy spokojíme s hladinami lačné glykemie pod 11 mmol/l (což většinou koresponduje s hodnotami HbA1c 65–70 mmol/mol). Při těchto hodnotách je jen minimální pravděpodobnost výskytu hypoglykemických epizod a nejsou většinou přítomny subjektivní příznaky hyperglykemie; většinou nedochází ani k energetickému deficitu, katabolismu a poruchám vnitřního prostředí. Cíle léčby pro starší, jinak zdravé diabetické pacienty mohou být obdobné jako pro mladé diabetiky, jmenovitě glykemie nalačno pod 7 mmol/l a HbA1c do 54 mmol/mol bez výskytu hypoglykemií.
Z dalších faktorů, které ovlivňují metabolickou kompenzaci, uveďme chronickou bolest, jež zapříčiňuje zvýšenou glykemickou variabilitu. Péči o diabetes pak dále zhoršují problémy se zrakem a sluchem, komplikace cévní a neurologické vedoucí k poruše hybnosti či inaktivitě(18–21) a v neposlední řadě další přidružené komorbidity. Starší nemocní s DM1T mohou tak potřebovat častější úpravu dávek inzulinu a titraci při progresi chronických komorbidit a jiných interkurentních onemocnění.
Diabetická dieta je základním pilířem léčby DM1T. Dávka inzulinu před jídlem je určena množstvím konzumovaných sacharidů. Jakákoli inkonzistence, změna v jídelním režimu musí být v dávce zohledněna. Nepravidelnost v příjmu potravy u starší populace je pak důležitým faktorem lability glykemie(22).
Dostupné inzulinové přípravky a inzulinové režimy v léčbě DM1T
Inzulinové přípravky podle původu
V současnosti se používají v léčbě diabetu inzuliny lidské (humánní) a inzulinová analoga. Lidský inzulin je polypeptid obsahující 51 aminokyselin. Vyrábí se biosynteticky pomocí přenosu rekombinantní DNA do buňky Escherichia coli či Saccharomyces cerevisiae, které potom tvoří inzulin jako svůj produkt. Označuje se zkratkou HM. Cílem exogenně podávaného inzulinu je umožnit co nejlepší napodobení fyziologického profilu inzulinu, což se při subkutánním podání konvenčních humánních inzulinů ne zcela daří, profil čas/účinek nenapodobuje přesně normální fyziologickou sekreci inzulinu. To vedlo k hledání analog inzulinu s odlišnými farmakokinetickými a farmakodynamickými vlastnostmi, bližšími fyziologickým principům inzulinové sekrece. Analoga inzulinu mají molekulu, která je umělou a cílenou modifikací molekuly lidského inzulinu, a to ve smyslu prodloužené (inzulin glargin 100 U/ml, glargin 300 U/ml, detemir) či zkrácené absorpce (inzulin glulisin, aspart a lispro 100 U/ml a 200 U/ml).
Inzulinové přípravky podle doby působení
Podle rychlosti nástupu biologického účinku, vrcholu působení a trvání účinku po s. c. podání rozlišujeme inzulinové přípravky ultrakrátce působící, krátce působící a inzuliny s prodlouženou dobou účinku. Inzuliny s prodlouženou dobou účinku pak dělíme na středně a dlouhodobě působící. Mezi středně dlouho působící inzuliny zařazujeme i stabilizované inzulinové směsi. Schematické zobrazení inzulinů podle délky působení je vyjádřeno níže (obr. 1).
Image 1. Schématické znázornění profilu jednotlivých inzulinů 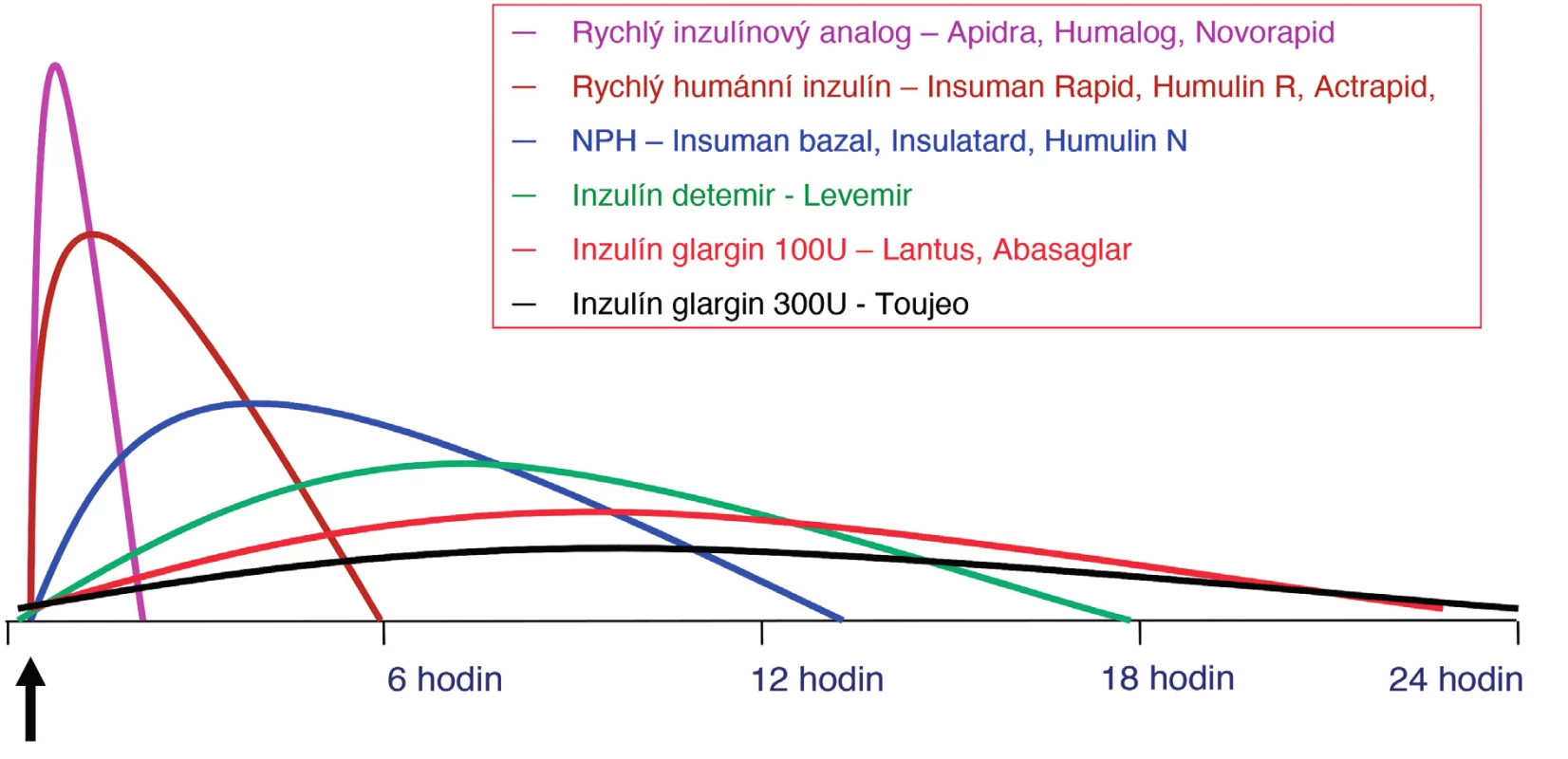
Ultrakrátce působící inzuliny
V současné době jsou na našem trhu dostupná tři ultrakrátce účinkující inzulinová analoga – inzulin lispro 100 U, lispro 200 U, aspart a glulisin. Jejich účinek nastupuje za 10–15 minut po subkutánním podání, maximum účinku je patrné za 30–45 minut a klinicky významný účinek trvá 2–5 hodin.
Klinické využití
Vzhledem k rychlejšímu a mohutnějšímu efektu ve srovnání s HM rapid inzulinem lépe korigují postprandiální hyperglykemii. Je možné je aplikovat těsně před jídlem, po jídle (a to zejména v případě nízké preprandiální glykemie), ale klinické zkušenosti ukazují, že maximálního efektu je dosaženo při podání 10–15 min před jídlem, což platí zejména pro větší dávky. Ve srovnání s HM rapid odbourávají problém pozdní hypoglykemie po jídle. Je možná vícečetná aplikace během dne (dopich svačin, nárazová jídla, nepravidelnost režimu, korekce hyperglykemie…). Na druhé straně v režimu ve spojení s bazálním analogem je také možné vynechat dávku (např. nechci jíst, zažívací obtíže…). Jelikož řeší problém pozdní hypoglykemie, lépe korigují postprandiální glykemii, mohou za podmínek správné titrace bazálního inzulinu vést ke snížení HbA1c. V případě inzulinu lispro 200 U/ml je jedna jednotka obsažena v polovičním objemu ve srovnání s doposud používaným inzulinem lispro 100 U/ml. Tato objemová změna ale nepřináší změnu v účinnosti koncentrovaného inzulinu, lispro 200 U/ml je tzv. bioekvivalentní inzulinu lispro100 U/ml. Inzulin lispro 200U/ml je určen pro pacienty užívající více než 20 jednotek krátkodobě působícího analoga/den(23, 24).
Krátce (rychle) působící inzuliny
Jedná se o čiré, neutrální roztoky bez přípravků zpomalujících absorpci. Jsou určeny k nitrožilní (jako jediné!), subkutánní, intramuskulární i intraperitoneální aplikaci. Po subkutánní aplikaci začínají působit za 15–30 minut (je nutné je aplikovat tedy 15–30 minut před jídlem), vrcholí za 1–3 hodiny a účinek končí za 4–6 hodin. Délka účinku je přímo úměrná velikosti dávky. Příkladem je Actrapid HM, Humulin R a Insuman Rapid.
Klinické využití
Krátkodobé humánní inzuliny představují zlatý standard v inzulinoterapii. Hlavním cílem je korekce postprandiální hyperglykemie. V intenzifikovaných inzulinových režimech, kdy se aplikují před každým jídlem, korigují i glykemii nalačno během dne (pokud nejsou kombinovány s dlouhodobým analogem). U některých pacientů se HM rapid inzuliny za podmínek pravidelného režimu podaří jak glykemii nalačno, tak glykemii postprandiální zkorigovat. Pokud tomu tak není, je na místě volba inzulinových analog (samozřejmě za patřičné edukace). Pro pomalejší nástup účinku po s. c. podání se musí aplikovat 20–30 min před jídlem. Jako jediné se používají v i. v. aplikaci.
Středně dlouho působící inzuliny
Tyto inzuliny jsou zkalené substance, které jsou určeny pro subkutánní a intramuskulární podání. Klasickou cestou, jež se používá k prodloužení účinku HM inzulinů, je buď: a) kombinace se zásaditou bílkovinou protaminsulfátem a malým množstvím zinku (Neutral Protamin Hagedorn – NPH, NPL) nebo b) krystalizace inzulinu v přítomnosti iontů zinku (zink-inzulin suspenze, někdy také označování lente inzuliny – Humulin L, Monotard HM). V současné době je v ČR k dispozici pouze protamin-zink inzulin (NPH). Jeho účinnost nastupuje za 1–2 hodiny, trvá 12–24 hodin a maxima účinku je dosaženo mezi 4.–12. hodinou po s. c. aplikaci.
Klinické využití
Středně dlouho působící inzuliny nahrazují bazální sekreci inzulinu, tudíž korigují glykemii nalačno. Aplikují se nejčastěji okolo 22. hodiny (tzv. bed-time aplikace). Hlavním problémem jsou vzhledem ke špičce jejich účinku noční hypoglykemie. Dávku tudíž nemůžeme k pokrytí ranní glykemie bezpečně zvedat, noční hypoglykemie jsou hlavní limitací v titraci dávky. Pokud chceme NPH inzulin kombinovat s ultrakrátkodobými inzulinovými analogy, je nezbytná jejich aplikace 2× denně (v případě DM 1. typu či při vyhaslé endogenní sekreci u DM 2. typu).
Dlouhodobě působící inzuliny
Ideální bazální inzulin by měl mít dlouhý poločas, jen minimální vrchol účinku, dávkování jednou denně a malou intra - i interindividuální variabilitu. Reprezentanty v této skupině jsou dlouhodobá inzulinová analoga inzulin glargin 100 U/ml, glargin 300 U/ml a detemir(23).
Inzulin glargin
Inzulin glargin byl cíleně připravený tak, aby měl malou rozpustnost při neutrálním pH. Je úplně rozpustný při kyselém pH (pH 4) injekčního roztoku. Po aplikaci injekce do podkožní tkáně je kyselý roztok neutralizován, což vede ke vzniku mikroprecipitátů, ze kterých jsou plynule uvolňována malá množství inzulinu glargin, zajišťující hladký a předvídatelný profil koncentrace/čas bez vrcholového peaku s prodlouženým trváním účinku. Podává se nejčastěji 1× denně. V některých případech lze aplikovat i 2× denně, a to zejména tam, kde je vystupňována odlišná kontraregulační osa v průběhu dne a noci. Pro výběr času aplikace volíme mezi nejpřijatelnější dobou aplikace pro pacienta – je možné podat ráno, večer či v tzv. bed-time čase (např. 22 hod.). Jako prevence nočních hypoglykemií se osvědčila doba aplikace večer (např. období hlavní večeře společně s krátkodobým inzulinem).
Inzulin glargin 300 U/ml je inzulin o vyšší koncentraci a třetinovém objemu oproti glarginu 100 U/ml. Oba inzuliny nejsou bioekvivalentní (nemají farmakokinetickou srovnatelnost), což přináší několik rozdílů, zde uveďme zejména prodloužení doby účinku glarginu 300 U/ml. Účinek u glarginu 100 U/ml nastupuje po podkožní aplikaci za 3–4 hodiny a efekt přetrvává 24–36 hodin, u glarginu 300 U/ml je o něco delší (menší povrch precipitátu při sníženém objemu injekce o dvě třetiny zajišťuje trvalejší uvolňování inzulinu glargin 300 U/ml v porovnání s inzulinem glargin 100 U/ml)(24–29).
Inzulin detemir
Inzulin detemir byl vytvořen adicí kyseliny myristové do pozice B29 na lysin. Mastná kyselina se váže reverzibilně na sérový albumin, molekula inzulinu tudíž zůstává déle v oběhu a je dosaženo zpomaleného vstřebávání. Účinek detemiru nastupuje pozvolna asi za 1 hodinu po s. c. aplikaci. Maximum a délka působení závisí na dávce. Při dávce 0,4 IU/kg je maximum účinku mezi 6.–8. hodinou, působí okolo 20 hodin, při dávce 0,2 IU/kg je klinický účinek patrný do 12 hodin.
Detemir považujeme také za bezvrcholový inzulin, vzhledem k faktu nedostatečného pokrytí 24 hodin se musí u DM1T s ultrakrátkými analogy podávat 2× denně. Pokud je kombinován s HM rapid inzulinem, postačí aplikace 1× denně.
Klinické užití
Hlavní úlohou bazálních inzulinů je kompenzace glykemie nalačno. Dlouhodobá inzulinová analoga mají prokazatelně nižší intraindividuální variabilitu účinku, což v praxi znamená, že je možné jejich efekt lépe předpovídat, a proto lze s jejich pomocí bezpečně titrovat léčbu k hodnotám glykemie, které jsou bližší glykemii zdravého člověka. Díky svému bezvrcholovému profilu významně snižují riziko nočních hypoglykemií ve srovnání s NPH inzulinem(30, 31).
V praxi převedení z NPH inzulinu na dlouhodobě působící analog vytvoří prostor pro zlepšení kompenzace. K poklesu HbA1c nedojde pouhou výměnou jednoho inzulinu za druhý (tím snížíme pouze riziko hypoglykemie), teprve úprava dávky, titrace a edukace pacienta může přinést kýžený efekt, což znamená bezpečné zlepšení metabolické kompenzace s redukcí orgánových komplikací.
Intenzifikovaný inzulinový režim u DM1T
Již studie DCCT (Diabetes Control and Complications Trial) prokázala výrazný efekt intenzifikovaných inzulinových režimů na lepší kompenzaci diabetu s následkem menšího rizika rozvoje orgánových komplikací diabetu. Z tohoto důvodu jsou intenzifikované inzulinové režimy (IIT) jednoznačně indikované u pacientů s DM1T, nevyjímaje starší populaci(32). Ke konvenčnímu inzulinovému režimu (aplikace 1× či 2× denně) přistupujeme v krajních případech, kde je IIT problematický, u pacienta s nepříznivou životní prognózou apod.
IIT znamená podávání inzulinů, které kopírují fyziologické principy inzulinové sekrece. Hovoříme o systému bazál–bolus. IIT je nejčastěji prováděna formou vícečetných injekcí inzulinu pomocí inzulinového pera (MDI – multiple dose insulin therapy) nebo pomocí kontinuální subkutánní inzulinové infuze inzulinovou pumpou (CSII), kterou lze také použít ve vyšším věku. MDI zahrnuje aplikaci krátkodobého inzulinu či ultrakrátce působícího analoga k jídlu 3–5× denně (podle počtu přijímaných porcí jídla) a 1–2× denně dávku bazálního inzulinu – tj. středně dlouho působícího či dlouhodobého inzulinového analoga.
Inzulin je tvořen ß-buňkami Langerhansových ostrůvků pankreatu. Celková denní produkce inzulinu je u zdravého člověka asi 20–40 IU. Z tohoto množství připadá asi 50 % na bazální sekreci a druhá polovina na stimulovanou sekreci. Bazální sekrece zajišťuje blokádu nadměrné produkce glukózy játry a normální hodnoty glykemie nalačno. Stimulovaná (prandiální) sekrece představuje inzulin secernovaný při příjmu potravy a hraje stěžejní roli v regulaci postprandiální glykemie. Při léčbě DM1T (tam, kde je vyhaslá endogenní inzulinová sekrece) bychom se měli snažit o respektování těchto principů, tj. zachovat poměry prandiální a bazální sekrece.
Dřívější IIT režimy, kde byla bazální složka tvořena NPH inzulinem, byly značně limitovány v optimalizaci glykemií obavou z hypoglykemií. A to pro nevyhovující profil NPH se špičkou v nočních hodinách a prodlouženou účinnost krátkodobých inzulinů, které částečně suplemetovaly bazální sekreci. V dnešní době, kdy jsou na trhu inzulinová analoga, je možné tuto překážku snáze překonat. Bezvrcholové a pozvolné uvolňování dlouhodobého analoga dovoluje bezpečně navyšovat dávku až k požadovaným 50 %. V praxi často vídané vysoké dávky prandiálního inzulinu vedou k rozkolísanosti a nestabilitě glykemických profilů. Naopak nízké dávky dlouhodobého inzulinového analoga nejsou s to dosáhnout požadovaných glykemií nalačno. Systém bazál–bolus je dobrým prostředkem k dosažení uspokojivé metabolické kompenzace, je ovšem třeba, aby byl doplněn o pečlivou a důslednou titraci prandiálního a bazálního inzulinu, a to pokud možno v konečném celkovém poměru blížícím se fyziologické sekreci u zdravých jedinců(33, 34).
V režimu IIT s použitým dlouhodobým analogem lze krátkodobý inzulinový analog v některých případech nahradit krátkodobým HM inzulinem. A to zejména tam, kde pacient svačí, nechce dopichovat přídatné injekce krátkého analoga, má pravidelný režim. Pokud kombinujeme krátkodobý analog s inzulinem detemir u DM1T, je nutné jeho podání 2× denně.
Schematické znázornění možností režimu je uvedeno na obrázcích 2a–c.
Obr. 2a Intenzifikované inzulinové režimy Režim krátkodobého inzulinu 3x denně + NPH na noc 
Obr. 2b Intenzifikované inzulinové režimy Krátký inzulinový analog 3x denně + 2x denně NPH 
Obr. 2c Intenzifikované inzulinové režimy Krátký inzulinový analog 3x denně + 1x denně dlouhodobý analog 
Závěr
Starší nemocní s DM1T jsou ve vysokém riziku hypoglykemie. Porucha rozpoznávání a přidružené zejména kardiovaskulární komorbidity důsledky hypoglykemie prohlubují.
U těchto nemocných volíme méně těsnou metabolickou kompenzaci za podmínek frekventního selfmonitoringu právě s ohledem na riziko hypoglykemie. Zohledňujeme celkový stav pacienta, schopnost dovedností nutných k zajištění každodenní péče o diabetes.
I přestože nevolíme těsnou metabolickou kompenzaci, nebráníme se novějším léčebným možnostem, jako jsou režimy s inzulinovými analogy. Ta pro svůj fyziologičtější profil redukují riziko hypoglykemie, zmírňují glykemickou variabilitu, umožňují vybočení z fixního režimu s flexibilnější reakcí na současný stav pacienta.
MUDr. Denisa Janíčková Žďárská, Ph.D.
Interní klinika 2. LF UK a FN Motol Praha
MUDr. Denisa Janíčková Žďárská, Ph.D.
e-mail: denisa.janickova.zdarska@email.cz
Promovala na 1. LF UK v Praze v roce 2000. V roce 2003 složila atestaci z oboru Interní lékařství, v roce 2008 z oboru Diabetologie. V roce 2008 úspěšně obhájila dizertační práci v oboru Fyziologie a patofyziologie člověka a získala titul Ph.D. V práci se věnovala problematice autoimunitního diabetu mellitu a diabetické nefropatii. V roce 2009 získala specializační způsobilost v oboru Interní lékařství. Od roku 2000 působí na Interní klinice 2. LF UK a FN v Motole jako lékařka, od roku 2007 současně jako vysokoškolská asistentka 2. LF UK. Je autorkou řady publikací v domácí i zahraniční literatuře.
Sources
1. Diamond Project Group. Incidence and trends of childhood type 1 diabetes worldwide 1990–1999. Diabet Med 2006; 23 : 857–866.
2. Patterson CC, Dahlquist GG, Gyürüs E, et al. EURODIAB study group: Incidence trends for childhood type 1 diabetes in Europe during 1989–2003 and predicted new cases 2005–2020: a multicentre prospective registration study. Lancet 2009; 373 : 2027–2033.
3. International Diabetes Federation. Diabetes Atlas. Brussels, International Diabetes Federation 2011.
4. Schutt M, Fach EM, Seufert J, et al. DPV Initiative and the German BMBF Competence Network Diabetes Network: Multiple complications and frequent severe hypoglycaemia in ‘elderly’ and ‘old’ patients with type 1 diabetes. Diabet Med 2012; 29 : 176–179.
5. JDRF Continuous Glucose Monitoring Study Group. Effectiveness of continuous glucose monitoring in a clinical care environment: evidence from the JDRF Continuous Glucose Monitoring trial. Diabetes Care 2010; 33 : 17–22.
6. MacLeod KM, Hepburn DA, Frier BM. Frequency and morbidity of severe hypoglycaemia in insulin-treated diabetic patients. Diabet Med 1993; 10 : 238–245.
7. Microvascular and acute complications in IDDM patiens: the EURODIAB IDDM Complications study. Diabetologia 1994; 37 : 278–285.
8. Braak EW, Appelman AM, van de Laak M, et al. Clinical characteristics of type 1 diabetic patients with and without severe hypoglycemia. Diabetes Care 2000; 23 : 1467–1471.
9. McCoy RG, Van Houten HK, Ziegenfuss JY, et al. Increased mortality of patients with diabetes reporting severe hypoglycemia. Diabetes Care 2012; 35 : 1897–1901.
10. Nordin C. The case for hypoglycaemia as a proarrhythmic event: basic and clinical evidence. Diabetologia 2010; 53 : 1552–1561.
11. Bree AJ, Puente EC, Daphna-Iken D, Fisher SJ. Diabetes increases brain damage caused by severe hypoglycemia. Am J Physiol Endocrinol Metab 2009; 297 : 194–201.
12. Kodl CT, Seaquist ER. Cognitive dysfunction and diabetes mellitus. Endocr Rev 2008; 29 : 494–511.
13. Gold AE, MacLeod KM, Frier BM. Frequency of severe hypoglycemia in patients with type 1 diabetes with impaired awareness of hypoglycaemia. Diabetes Care 1994; 17 : 697–703.
14. Matyka K, Evans M, Lomas J, et al. Altered hierarchy of protective responses against severe hypoglycemia in normal aging in healthy men. Diabetes Care 1997; 20 : 135–141.
15. Brierley EJ, Broughton DL, James OF, Alberti KG. Reduced awareness of hypoglycaemia in the elderly despite an intact counterregulatory response. Q J Med 1995; 88 : 439–445.
16. Bremer JP, Jauch-Chara K, Hallschmid M, et al. Hypoglycemia unawareness in older compared with middle-aged patients with type 2 diabetes. Diabetes Care 2009; 32 : 1513–1517.
17. Cryer PE. Hypoglycemia in type 1 diabetes mellitus. Endocrinol Metab Clin North Am 2010; 39 : 641–654.
18. Centers for Disease Control and Prevention. Vision health initiative. Dostupné na: www.cdc.gov. 6 July 2013
19. Bainbridge KE, Hoffman HJ, Cowie CC. Diabetes and hearing impairment in the United States: audiometric evidence from the National Health and Nutrition Examination Survey, 1999 to 2004. Ann Intern Med 2008; 149 : 1–10.
20. Bainbridge KE, Hoffman HJ, Cowie CC. Risk factors for hearing impairment among U. S. adults with diabetes: National Health and Nutrition Examination Survey 1999–2004. Diabetes Care 2011; 34 : 1540–1545.
21. Jaroslav Rybka. Zvláštnosti terapie diabetu u seniorů. Interní Med 2012; 14(8 a 9): 303–308.
22. Dhaliwal R, Weinstock RS. Management of type 1 diabetes in older adults. Diabetes Spectr 2014; 27(1): 9–20.
23. Pelikánová T, Bartoš V a kol. Praktická diabetologie. Maxdorf 2010.
24. Pena A, Seger M, Soon D, et al. Bioequivalence and comparative pharmacodynamics of insulin lispro 200 U/mL relative to insulin lispro (Humalog®) 100 U/mL. Clin Pharmacol Drug Dev 2016; 5(1): 69–75.
25. Haluzík M. Inzulin glargin 300 U/ml. Farmakoterapie 2015; 4 : 474–479.
26. Adamíková A. Klinický význam bazálních inzulinů se zaměřením na Toujeo 300 U/ml. Vnitr Lek 2015; 61(11): 985–988.
27. Home PD, Bergenstal RM, Bolli GB, et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 1 diabetes: a randomized, phase 3a, open-label clinical trial (EDITION 4). Diabetes Care [published online June 17, 2015].
28. Becker RHA, Nowotny I, Teichert L, et al. Low within - and between-day variability in exposure to new insulin glargine 300 U/ml. Diabetes Obes Metab 2015; 17(3): 261–267.
29. Dailey G, Lavernia F. A review of the safety and efficacy data for insulin glargine 300 units/ml, a new formulation of insulin glargine. Diabetes Obes Metab 2015;
30. Rosenstock J, et al. Basal insulin glargine (HOE 901) versus NPH insulin patients with type 1 diabetes on multiple daily insulin regimens. Diabetes Care 2000; 23(8): 1137–1142.
31. Ratner RE, Hirsch IB, Neifing JL, et al. Less hypoglycemia with insulin glargine in intensive insulin therapy for type 1 diabetes. U. S. Study Group of Insulin Glargine in Type 1 Diabetes. Diabetes Care 2000; 23(5): 639–643.
32. DCCT (Diabetes Control and Complication Trial). The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329(14).
33. Owens DR, Matfin G, Monnier L. Basal insulin analogues in the management of diabetes mellitus: What progress have we made? Diabetes Metab Res Rev 2014; 30 : 104–119.
34. Janíčková Žďárská D, Piťhová P, Kvapil M. Možnosti terapie inzulinem v roce 2015. Klin Farmakol Farm 2015; 29(1): 30–34.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2017 Issue 4-
All articles in this issue
- Výskyt a vývoj deprese v různých typech seniorských zařízení – využití Geriatrické škály deprese
- Prevence aterosklerotických kardiovaskulárních příhod u křehčích pacientů
- Léčba diabetu mellitu 1. typu u osob vyššího věku
- Krvácení do gastrointestinálního traktu – velké riziko pro geriatrické pacienty
- CHOPN – novinky v diagnostice a léčbě
- Zajištění cévního vstupu u geriatrických nemocných
- Křehký pacient se selháním ledvin
- Opakované resuscitace u geriatrické pacientky – a jak to bylo dál?
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krvácení do gastrointestinálního traktu – velké riziko pro geriatrické pacienty
- Zajištění cévního vstupu u geriatrických nemocných
- CHOPN – novinky v diagnostice a léčbě
- Výskyt a vývoj deprese v různých typech seniorských zařízení – využití Geriatrické škály deprese
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


