-
Medical journals
- Career
Molekulární mechanismy rezistence u nádorového onemocnění prostaty
Authors: M. Raudenská 1; J. Balvan 1; J. Gumulec 1; M. Sztalmachová 1; H. Polanská 1; V. Adam 2; M. Stiborová 3; T. Eckschlager 4; R. Kizek 2; M. Masařík 1
Authors‘ workplace: Masarykova univerzita, Brno Lékařská fakulta Ústav patologické fyziologie Přednostka: prof. MUDr. Anna Vašků, CSc. 1; Mendelova univerzita v Brně Ústav chemie a biochemie Vedoucí: doc. RNDr. Vojtěch Adam, Ph. D. 2; Univerzita Karlova, Praha Přírodovědecká fakulta Katedra biochemie Vedoucí: doc. RNDr. Miroslav Šulc, Ph. D. 3; 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Motol Klinika dětské hematologie a onkologie Přednosta: prof. MUDr. Jan Starý, DrSc. 4
Published in: Prakt. Lék. 2014; 94(2): 88-93
Category: Of different specialties
Overview
Vznik rezistence nádorových buněk k léčbě je velmi frustrující problém pro pacienty i onkology. Vyskytuje se ve dvou variantách: rezistence primární a rezistence získaná v průběhu léčby. Pokroky ve výzkumu poskytují nové léčebné strategie a mnoho druhů nádorů, které byly dříve považovány za primárně rezistentní, nyní odpovídá na nové léčebné postupy. Pozornost se tedy postupně přesouvá k závažnému problému získané rezistence. Rezistence k léčbě může vznikat mnoha různými mechanismy. Jedním z nich je konstitutivní aktivace transkripčních faktorů NF-κB, která byla pozorována u mnoha nádorů. Tato aktivace podporuje přežívání nádorových buněk a snižuje jejich senzitivitu k chemoterapii. Některá chemoterapeutika, která jsou využívána k léčbě nádorů, jsou rovněž schopna aktivovat NF-κB, a zpětnou vazbou tak snižují svoji efektivitu. V některých případech může již první cyklus léčby vyselektovat populaci rezistentních nádorových buněk, které způsobí relaps onemocnění a v důsledku své rezistence i selhání následné léčby. Tento mechanismus vzniku rezistence se uplatňuje zejména u nádorů skládající se z heterogenní populace buněk, což je mimo jiné právě případ nádorů prostaty. Progrese nádoru prostaty tumoru vyžaduje pozitivní zpětnou vazbu mezi fibroblasty asociovanými s nádorem (CAFs) a nádorovými buňkami. Nádorové buňky udržují fibroblasty v aktivovaném stavu (vyšší transkripční aktivita některých genů) a ty produkují růstové faktory a cytokiny, které umožňují progresi nádoru zprostředkovanou remodelací extracelulární matrix (ECM), proliferací nádorových buněk, podporou angiogeneze a přeměny epitelových buněk na mezenchymové (EMT). Důkladné porozumění mechanismům rezistence a jejich vzájemným interakcím by mohlo přinést dva základní výsledky. Prvním výsledkem bude identifikace pacientů, kteří nemohou profitovat z určité terapie a zvolení terapie jiné. Pacienti tak nebudou vystaveni zbytečným nežádoucím účinkům jinak neúčinné terapie. Druhým výsledkem může být objevení molekulárních cílů pro vývoj nových léčiv.
Klíčová slova:
rezistence k anti-androgenům – signální dráhy – chemorezistence – radiorezistence – NF-κB – PTEN – p53 – fibroblasty asociované s rakovinouÚVOD
Karcinom prostaty (CaP) je nejčastějším solidním maligním nádorem a druhou nejčastější příčinou smrti na nádory u mužů. Nejčastějším histologickým typem karcinomu prostaty je adenokarcinom vycházející z epiteliálních buněk prostatických acinů. Vzácně se vyskytuje duktální adenokarcinom, mucinózní adenokarcinom, karcinom z přechodného epitelu, malobuněčný karcinom, karcinom z prsténčitých buněk, adenoidně bazocelulární karcinom a vysoce maligní sarkomatoidní karcinom. Výběr terapie karcinomu prostaty se značně liší a závisí na stupni rozvoje a diferenciace onemocnění. Radikální prostatektomie a radiační terapie nabízí řešení, pokud je nádor omezen pouze na prostatu případně její nejbližší okolí. Pokud je nádor generalizovaný, lze použít blokaci přísunu androgenů orchiektomií či antiandrogeny, případně chemoterapii. Z cytostatik se v léčbě karcinomu prostaty používají vinorelbin, estramustin, mitoxantron a docetaxel často v kombinaci s kortikoidy, ale efekt je pouze paliativní. Navzdory řadě nových terapeutických možností zůstává pokročilý karcinom prostaty nevyléčitelným onemocněním. Hlavní překážkou úspěšné léčby je vznik rezistence k cytostatické a cytotoxické terapii (radioterapii, chemoterapii). Tato rezistence může vznikat mnoha různými mechanismy. Mezi nejvýznamnější patří narušení programované buněčné smrti a regulace buněčného cyklu, modulace importu, exportu a metabolismu léčiva a deregulace signálních drah ovlivňujících některé další buněčné procesy. Na vzniku rezistence se mohou podílet i signály z tkání, které obklopují nádor.
MECHANISMY REZISTENCE VŮČI ANTI-ANDROGENŮM
Za normální situace je přežití buněk zdravé tkáně i karcinomu prostaty závislé na přítomnosti androgenního receptoru (AR), na který se váže dihydrotestosteron (DHT) či testosteron, a aktivuje tak příslušné buněčné procesy (proliferaci, antiapoptotické signály a také syntézu prostatického specifického antigenu (PSA)). Pacienti zpočátku příznivě reagují na androgenní deprivaci. Je typické, že dochází k remisi onemocnění, která je však často následována růstem nádoru nezávislým na androgenech. Tato fáze onemocnění se označuje jako hormonálně refrakterní karcinom prostaty (HRPC – hormone refractory prostate cancer). Interval od zahájení hormonální léčby do vzniku HRPC se v individuálních případech výrazně liší a pohybuje se od několika měsíců do několika let, průměrně je odhadován na 18–24 měsíců. Prognóza pacientů, u kterých nádor přejde do hormonálně refrakterního stadia, je nepříznivá. Proliferace nezávislá na androgenech může probíhat několika způsoby; uplatňuje se hypersenzitivita receptorů, vazby non-androgenních ligandů či aktivace alternativní signální dráhy.
Hypersenzitivita
Hladina androgenů postačující pro aktivaci androgenní signalizace pomocí AR je snížena. Tento stav je většinou způsoben amplifikací genu pro AR nebo jeho aktivační mutací, která vede ke konstitutivní aktivaci receptoru nezávislé na přítomnosti DHT, mnohdy hraje významnou roli alternativní sestřih (4). Alternativní sestřih je jev, při němž díky různým variantám sestříhání pre-mRNA vzniká několik rozdílných mRNA, a jeden gen tak kóduje vznik více rozdílných proteinů. Bylo též pozorováno, že léčbou navozená androgenní deprivace podporuje syntézu DHT z jeho dosud neaktivních prekurzorů v nádoru (5).
Vazba non-androgenních ligandů
Některé mutace genu pro AR mění specificitu receptoru, což umožní jeho aktivaci non-androgenními steroidními hormony jako je progesteron či estrogen. Tyto steroidní hormony pak mohou spouštět buněčné procesy specifické pro DHT. Schopnost vázat se na AR mohou mít i některé fenoly, fytoestrogeny a ftaláty.
Aktivace alternativní signální dráhy
Na ligandu nezávislá aktivace AR a následná proliferace, či na AR nezávislá aktivace genů způsobující proliferaci prostatických buněk může být způsobena zapojením alternativní signální dráhy (obr. 1). Je to adaptační mechanismus, který využívá redundance signálních drah ve výsledné signální síti. Je známo, že řada signálních molekul je sdílena více drahami a výsledná aktivace určitého děje může být důsledkem signalizace několika různých drah. Aktivace AR může být zajištěna přes signální dráhu WNT/β-katenin. V nepřítomnosti WNT ligandu dochází k fosforylaci β-kateninu za pomoci destrukčního komplexu Axin/APC/ GSK3β/CK1α a jeho následnému odbourání ubikvitinací. Když se však WNT ligand naváže na Frizzled/LRP receptorový komplex, je destrukční komplex destabilizován a GSK3β již není schopna fosforylovat β-katenin, a zajistit tak jeho degradaci. β-katenin se tak dostává do jádra, kde interaguje s transkripčním faktorem TCF/LEF a aktivuje proliferaci. β-katenin může však působit i jako kofaktor AR. V tomto případě zvyšuje senzitivitu receptoru a umožňuje mu reagovat i na nízké hladiny androgenů a non-androgenní ligandy (14). Na modelech xenograftů lidských karcinomů prostaty byla prokázána zvýšená exprese β-kateninu i AR, jejich lokalizace v jádře a vzájemná interakce (15). Zvýšená exprese β-kateninu se rovněž podílí na vyšší invazivitě nádorů prostaty.
Image 1. Signální dráhy vedoucí k proliferaci prostatických buněk Signály vedoucí k proliferaci prostatických buněk mohou vyžadovat funkční receptor androgenů (AR), viz dráha RTK (receptorové tyrosin kinázy)/RAS protein/AKT (proteinkináza B)/AR či PI3K/AKT, nebo mohou být na AR nezávislé, viz dráha AKT/NF-kB či WNT/b-katenin. Šipka znamená aktivační mechanismus, ukončení čtverečkem značí inhibiční mechanismus. 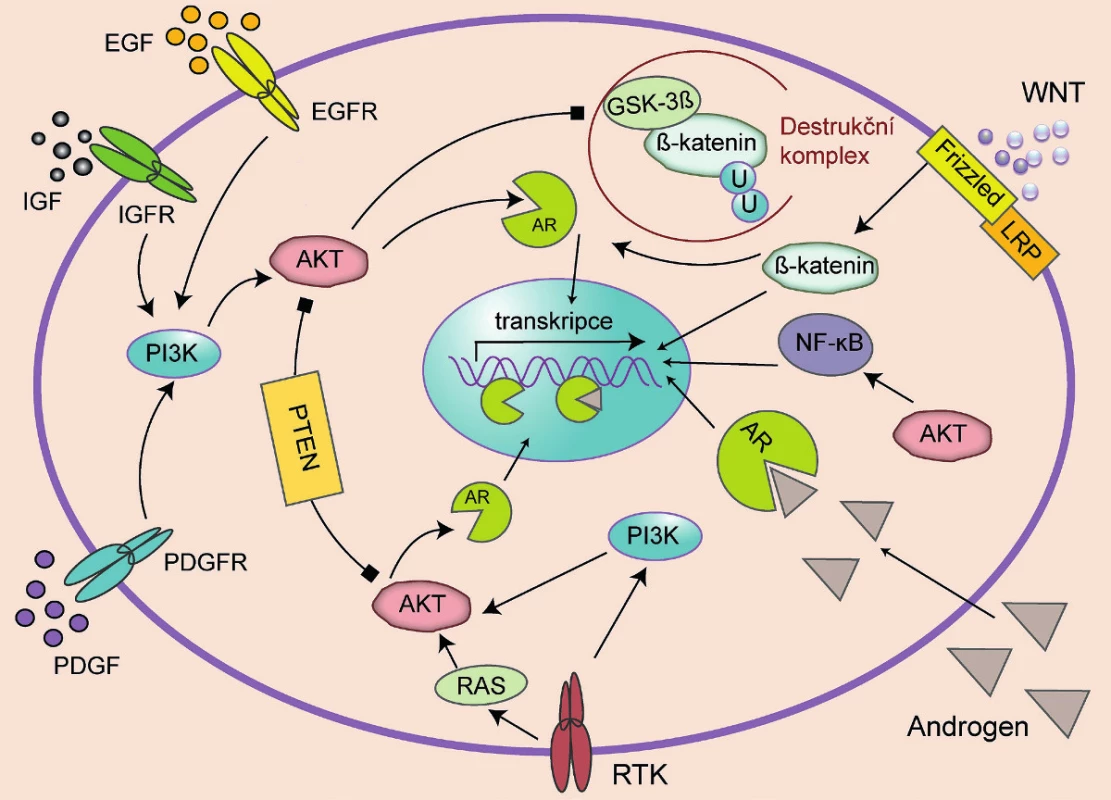
AR mohou být aktivovány bez působení DHT i růstovými faktory (IGF – inzulinu podobný růstový faktor, EGF – epidermální růstový faktor, PDGF – destičkový růstový faktor), v důsledku aktivace receptorových tyrosinkináz (RTK) a PI3K/AKT (fofatidylinositol-3-kináza/proteinkináza B) signalizací. PI3K/AKT signální dráha se zdá být velmi důležitá při vývoji rezistence, zejména pokud je poškozen tumor supresor PTEN (phosphatase and tensin homologue). Ztráta funkce PTEN vede k aktivaci dráhy PI3K/AKT a následné inhibici apoptózy a zvýšené proliferaci. Byla též prokázána aktivace AR v důsledku zvýšené hladiny interleukinu-6 (IL-6).
MECHANISMY REZISTENCE VŮČI POŠKOZENÍ NÁDOROVÉ BUŇKY
Cytostatická terapie je většinou zaměřena proti nádorovým buňkám, jejichž proliferace převyšuje proliferaci nenádorových tkání. Principem účinku je nejčastěji zvýšená toxicita záření, nebo cytostatika pro dělící se buňku. Poškození DNA spouští mechanismy udržující integritu genomu prostřednictvím komplexních signálních sítí. Tyto sítě aktivují senzory poškození DNA, opravu DNA a zástavu buněčného cyklu. Zástava buněčného cyklu je podmíněna kontrolními body, které jsou spojeny s opravou DNA případně s apoptózou, je-li poškození DNA nevratné. Rezistence nádorových buněk k látkám poškozujícím DNA může být navozena několika cestami: 1. cíleným snížením intracelulární koncentrace léčiva, 2. specifickou podporou přežívání buněk, 3. vlivem okolní nenádorové tkáně.
Snížení koncentrace chemoterapeutika v buňce a jeho efektivní detoxikace
Schopnost buněk transportovat různé druhy molekul z cytoplazmy je známa již dlouho. První souvislosti mezi membránovými transportéry či pumpami a rezistencí k toxickým látkám byly popsány v sedmdesátých letech 20. století. Zvýšená exprese transportéru s názvem P-glykoprotein (produkt genu MDR1 alias ABCB1) u několika buněčných linií korelovala s rezistencí k cytostatikům. V roce 1992 byl nalezen další transportér MRP1 (gen MRP1 alias ABCC1), který hrál roli při vzniku rezistence (3). Zvýšená exprese MRP1 byla nalezena u nádorů prostaty, prsu a plic. Aktivace PI3K signálních drah, která je u nádorů prostaty velmi častá (viz výše), byla asociována rovněž se zvýšením exprese MRP1 u pokročilých nádorů prostaty (7).
P-glykoprotein i MRP1 patří do rodiny ATP vázající ABC transportérů, které slouží k odčerpávání látek ven z buněk. Škála substrátů těchto transportérů je široká a patří mezi ně antracyklinová cytostatika, taxany, vinka alkaloidy, podofylotoxiny, aktinomycin D, metotrexát a také těžké kovy včetně oxidu arzenitého, který se užívá k léčbě promyelocytární leukémie. U pacientů s HRPC léčených docetaxelem a thalidomidem byly nalezeny souvislosti mezi polymorfními variantami genu ABCB1, vznikem neuropatie způsobené léčbou a horší prognózou (12).
Pokud již toxická látka překoná transportéry a dostane se do buňky, může být metabolizována a její toxicita může být utlumena. Zde hrají velkou roli cytochromy P450, což jsou enzymy metabolizující xenobiotika. Mezi jejich substráty patří mimo jiné docetaxel, tamoxifen a flutamid. Zvýšená exprese některých typů cytochromů P450 byla prokázána u mnoha nádorů včetně nádorů prostaty. Následkem této zvýšené exprese je pravděpodobně zrychlená metabolizace a odbourání chemoterapeutika. Některé cytochromy P450 jsou také exprimovány pouze v tumorech, nikoli ve zdravé tkáni; mezi ně patří např. CYP2W1, který je exprimován pouze v období embryogeneze a v nádorech kolorekta a nadledviny.
Součástí toxického působení mnoha chemoterapeutik je tvorba volných kyslíkových radikálů (ROS) a následný vznik oxidačního stresu. Buňka se vyrovnává s ROS pomocí antioxidačních mechanismů, jejichž účinnost se může u jednotlivých typů buněk lišit. Silná antioxidační obrana nádorové buňky může snížit toxické působení chemoterapeutika či radiace, a zmenšit tak míru poškození DNA pod úroveň, která by vedla k buněčné smrti. Při působení chemoterapeutik na bázi platiny narůstá koncentrace kovu a ROS v organismu, což zvyšuje expresi metalothioneinů (MT). U nádorů prostaty byla zvýšená exprese MT pozorována (10). Vysoká hladina MT korelovala s rezistencí k adriamycinem vyvolané apoptóze a s inhibicí nádorového supresoru p53. Rovněž k cisplatině rezistentní buňky karcinomu močového měchýře vykazovaly zvýšenou hladinu MT. Prokázána byla také vyšší exprese MT v buněčné linii odvozené od neuroblastomu s experimentálně navozenou rezistencí k cisplatině při inkubaci v médiu s cisplatinou nebo karboplatinou. Při kultivaci v médiu bez cytostatik a u senzitivní linie byly hladiny MT podstatně nižší.
Podpora přežívání a proliferace
Deregulace řízené smrti buněk při odpovědi na poškození buňky je jedním z faktorů působících vznik mnoha onemocnění. Protein p53 funguje v buňce jako regulátor odpovědi na buněčný stres. Pokud jsou v buňce signální dráhy p53 narušeny (mutací genu TP53, poškozením proteinu na posttranslační úrovni či zvýšenou expresí jeho inaktivátorů), může se buňka vystavená různým formám stresu vyhnout buněčné smrti. Ztráta citlivosti buňky k signálům aktivujícím programovanou buněčnou smrt je jedním z hlavních znaků neoplastické transformace buněk. I když je frekvence mutací TP53 u počátečních stadií nádorech prostaty nižší než u řady jiných nádorů, v pokročilých fázích CaP, v metastázách a v nádorech nezávislých na androgenech je frekvence mutací tohoto genu vysoká.
U 10 % primárních nádorů a ve více než 30 % metastáz karcinomu prostaty byly zaznamenány genetické změny homologu fosfatázy a tenzinu PTEN (phosphatase and tensin homologue) (1). Ztráta exprese funkčního PTEN je důsledkem mutací či epigenetického umlčení hypermetylací DNA. Nádorově supresivní funkce PTEN jsou spojeny s regulací buněčného cyklu, s apoptózou a migrací buněk (obr. 1). Ztráta funkce PTEN vede k aktivaci AKT, v jejímž důsledku přežívají a proliferují buňky s poškozenou DNA, což napomáhá vzniku mutací potřebných pro další rozvoj vlastností typických pro nádorové buňky.
Mnoho cytotoxických látek, včetně cisplatiny, 5-fluorouracilu, doxorubicinu, vinblastinu, vinkristinu, paclitaxelu, daunomycinu, tamoxifenu a bortezomibu a radioterapie způsobuje aktivaci NF-κB (jaderný faktor κB) (8). NF-κB je skupina transkripčních faktorů vážících se na specifické DNA sekvence v regulačních oblastech cílových genů. NF-κB tak reguluje transkripci více než 400 genů, které se účastní procesů, jako je imunita, zánětlivá odpověď, proliferace, apoptóza, embryonální vývoj, angiogeneze, mezibuněčné adheze, migrace a invazivita. U mnoha solidních nádorů byla nalezena konstitutivní aktivace NF-κB, což bylo dáno do souvislosti se zvýšeným přežíváním a proliferací nádorových buněk a redukcí účinku chemoterapeutik a radioterapie. Naopak inhibice NF-κB snížila kachexii a tvorbu metastáz u myší s experimentálně navozenými nádory (2). Mezi inhibitory NF-κB patří i přírodní látky, jako jsou: sojový izoflavon genistein, kurkumin a kyselina dokosahexaenová. Tyto látky snižovaly u prostatických nádorových buněčných kultur vznik rezistence při léčbě cisplatinou, 5-fluorouracilem a taxany (11).
Vlivy okolních tkání
Doposud jsme se zabývali signálními drahami nádorových prostatických buněk, které ovlivňují přímo buňky, ve kterých jsou tyto dráhy spuštěny. Nádorové buňky však tvoří heterogenní populaci a navíc je nádor tvořen nejen nádorovými buňkami, ale i buňkami nenádorovými (fibroblasty, epiteliální buňky atd.). Tyto různorodé populace buněk mezi sebou komunikují prostřednictvím parakrinních signálů a extracelulární matrix. Bylo prokázáno, že adheze nádorových buněk na molekuly matrix ovlivňuje jejich přežívání při poškození. Organizace a poloha nádoru vzhledem k vaskulatuře rovněž ovlivňuje průnik léčiva, okysličení a proliferaci nádorových buněk. Často byl pozorován vznik chemorezistence i radiorezistence v důsledku hypoxie. Hypoxie je u solidních tumorů častá a napomáhá stabilizaci a aktivaci HIF-1α (hypoxií indukovatelný faktor-1α) a jeho signálních drah. HIF-1α se mimo jiné podílí na regulaci transkripce ABC transportérů (MRP1 a MDR1), čímž napomáhá transportu léčiv z buněk.
Cytostatická terapie se snaží selektivně působit na nádorové buňky, přičemž využívá jejich charakteristické rysy, jako je rychlá proliferace či genomová nestabilita. Protinádorová léčba však bohužel zasahuje i zdravé buňky a může narušit normální fyziologii a funkci tkání a orgánů. Aby se předešlo fatálním poškozením orgánů u pacientů podstupujících terapii, nepodává se jediná vysoká dávka léčiva, ale léčba se provádí v cyklech, aby mohlo dojít k obnovení zdravých buněk a jejich funkce. Mezery mezi cykly však umožňují i repopulaci kmenových nádorových buněk, které přežily první cyklus terapie, a aktivaci signálních drah, které vyvolávají rezistenci k další léčbě (6). Zásadní roli při repopulaci nádorových buněk hrají signály z takzvaných CAFs (fibroblasty asociované s nádorem) (obr. 2). Jde o fibroblasty aktivované v důsledku vlastního poškození či pozměněné parakrinními signály z nádorových buněk. Takto aktivované fibroblasty produkují růstové faktory, cytokiny a jiné signální molekuly, které umožňují nádorovým buňkám přežít, proliferovat, zvýšit metastatický potenciál a aktivovat signální dráhy vedoucí k rezistenci. Mezi signály produkované fibroblasty, které ovlivňují maligní potenciál a rezistenci nádorových buněk, patří IL-6 a WNT16B (6, 13). V důsledku chemoterapie či radioterapie a signální interakce mezi nádorovými buňkami a fibroblasty může tak paradoxně nádorové onemocnění progradovat.
Image 2. Rezistence k chemoterapii a radioterapii vyvolaná parakrinními signály z poškozených fibroblastů Rezistence nádorových buněk k terapii nemusí vycházet pouze z inherentních vlastností nádoru, ale může vznikat i v důsledku poškození okolních tkání. Poškozené buňky produkují signály, které vedou ke snadnější regeneraci nádorových buněk a zvyšují jejich maligní potenciál. U nádorů prostaty tyto signály produkují zejména fibroblasty ve stromatu, jejichž DNA byla v důsledku léčby poškozena. Mezi signály produkované fibroblasty, které ovlivňují maligní potenciál a rezistenci nádorových buněk, patří například IL-6 a WNT16B (volně přepracováno dle 9). 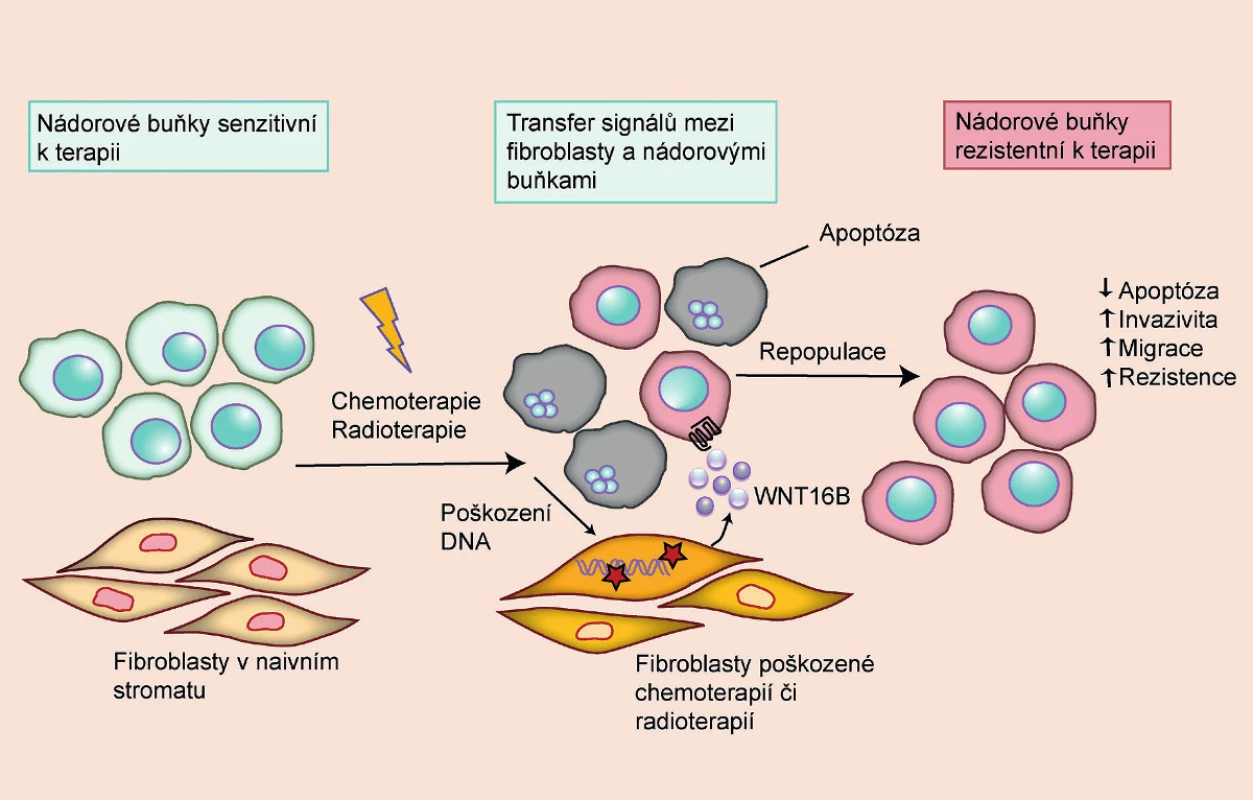
VÝHLEDY DO BUDOUCNA
V současné době probíhá řada klinických studií zaměřených na využití cílené terapie v léčbě CaP, u které lze předpokládat, že překoná mechanismy rezistence. Testovány jsou například monoklonální protilátky a malé molekuly inhibující EGFR, inhibitory PDGFR, inhibitory survivinu a antiangiogenní léčba. Rovněž je intenzivně studována aktivní imunoterapie využívající dendritické buňky, se kterou probíhají klinické studie i v České republice. Tyto perspektivní léčebné postupy jsou zatím ve fázi klinických studií a je ještě otázkou delšího času, než budou některé z nich zařazeny do standardní léčby CaP. Do té doby bude nutné získat ještě řadu znalostí o biologii tohoto nádoru a rozdělit tyto nádory do kategorií podle jejich klinických a hlavně molekulárně-biologických znaků, jako je tomu například u karcinomu prsu (TNM klasifikace, pozitivita estrogenových a/nebo progesteronových receptorů, HER2 pozitivita).
ZÁVĚR
Studium a rozpoznání signálních drah účastnících se vzniku nádoru, jeho progrese a vzniku rezistence k terapii je zásadní pro pochopení dějů odehrávajících se v nádorových buňkách a pro volbu správné terapie. Léčba založená na znalosti kompletního genetického profilu nádoru nebude zřejmě v blízké budoucnosti možná, ale identifikace klíčových molekul nejdůležitějších signálních drah a jejich mutací by mohla umožnit alespoň vyřazení neúčinné léčby. Znalost mechanismů vzniku rezistence pak může pomoci k vývoji kombinované terapie, při níž by byl účinek zvoleného chemoterapeutika podpořen použitím inhibitoru signální dráhy, která je zodpovědná za rezistenci k použitému chemoterapeutiku. V současné době se testují inhibitory transkripčního faktoru NF-κB a HIF-1α. Zavedení personalizované léčby na základě lepšího porozumění rezistenci a heterogenitě mezi pacienty se stejným nádorem, může vést k významnému pokroku v léčbě. Koncept personalizované léčby se již v praxi osvědčil u mnoha nádorů.
Seznam použitých zkratek
ABC ATP-Binding Cassette
AKT proteinkináza B
APC Adenomatosis Polyposis Coli, tumor supresor
AR receptor androgenů
ATP adenosintrifosfát
CAFs fibroblasty asociované s nádorem
CaP karcinom prostaty
CK1α kaseinová kináza 1α
DHT dihydrotestosteron
DNA deoxyribonukleová kyselina
ECM extracelulární matrix
EGF epidermální růstový faktor
EMT epiteliálně-mezenchymální tranzice
GSK3β kináza glykogen syntázy 3β
HIF-1α hypoxií indukovatelný faktor-1α
HRPC Hormone Refractory Prostate Cancer
IGF inzulinu podobný růstový faktor
IL-6 interleukin-6, cytokin
LRP Low Density Lipoprotein Receptor-related Proteins, součást receptorového komplexu pro β-katenin
MDR1 Multiple Drug Resistance 1, gen kódující P-glykoprotein
mRNA messenger RNA
MRP1 Multidrug Resistance-associated Protein 1
MT metalothionein
NF-κB jaderný faktor κB, transkripční faktor
PDGF destičkový růstový faktor
PI3K fosfatidylinositol 3-kináza
PSA prostatický specifický antigen
PTEN homolog fosfatázy a tensinu
RAS Rat Sarcoma Protein, GTPáza
ROS volné kyslíkové radikály
RTK receptorová tyrozin kináza
TCF/LEF T cell factor/lymphoid enhancer factor, transkripční faktor
TP53 Tumor Protein p53, gen kódující tumor supresor p53
WNT16B Wingless-Type MMTV (Mouse Mammary Tumor Virus) Integration Site Family Member 16b, signální protein
Práce byla podpořena projektem NanoBioTECell GA ČR P102/11/1068 a MZ ČR – RVO, FN v Motole 00064203.
ADRESA PRO KORESPONDENCI:
RNDr. Michal Masařík, Ph.D.
Ústav patologické fyziologie LF MU
Kamenice 5, 625 00 Brno
e-mail: masarik@med.muni.cz
Sources
1. Abate-Shen C, Shen MM. Molecular genetics of prostate cancer. Genes Dev 2000; 14(19): 2410–2434.
2. Arlt A, Schafer H. NF kappa B-dependent chemoresistance in solid tumors. Int J Clin Pharm Ther 2002; 40(8): 336–347.
3. Cole SPC, Bhardwaj G, Gerlach JH, et al. Overexpression of a transporter gene in a multidrug-resistant human lung-cancer cell-line. Science 1992; 258(5088): 1650–1654.
4. Dehm SM, Tindall DJ. Alternatively spliced androgen receptor variants. Endocr Relat Cancer 2011; 18(5): R183–R196.
5. Ishizaki F, Nishiyama T, Kawasaki T, et al. Androgen deprivation promotes intratumoral synthesis of dihydrotestosterone from androgen metabolites in prostate cancer. Scientific Reports 2013; published online Mar 25.
6. Kypta RM, Waxman J. Wnt/beta-catenin signalling in prostate cancer. Nat Rev Urol 2012; 9(8): 418–428.
7. Lee JT, Steelman LS, McCubrey JA. Phosphatidylinositol 3'-kinase activation leads to multidrug resistance protein-1 expression and subsequent chemoresistance in advanced prostate cancer cells. Cancer Res 2004; 64(22): 8397–8404.
8. Li F, Sethi G. Targeting transcription factor NF-kappa B to overcome chemoresistance and radioresistance in cancer therapy. BBA-Rev Cancer 2010; 1805(2): 167–180.
9. Ostman A. The tumor microenvironment controls drug sensitivity. Nat Med 2012; 18(9): 1332–1334.
10. Raudenská M, Šmerková K, Tanhäuserová V. a kol. Metalothionein a jeho role v detoxikaci téžkých kovů a predispozici k chorobám. Prakt. Lék. 2012; 92(6): 322–326.
11. Shaikh IAA, Brown L, Schofield AC, et al. Docosahexaenoic acid enhances the efficacy of docetaxel in prostate cancer cells by modulation of apoptosis: the role of genes associated with the NF-kappa B pathway. Prostate 2008; 68(15): 1635–1646.
12. Sissung TM, Baum CE, Deeken J, et al. ABCB1 genetic variation influences the toxicity and clinical outcome of patients with androgen-independent prostate cancer treated with docetaxel. Clin Cancer Res 2008; 14(14): 4543–4549.
13. Sun Y, Campisi J, Higano C, et al. Treatment-induced damage to the tumor microenvironment promotes prostate cancer therapy resistance through WNT16B. Nat Med 2012; 18(9): 1359–1368.
14. Verras M, Brown J, Li XM, et al. Wnt3a growth factor induces androgen receptor-mediated transcription and enhances cell growth in human prostate cancer cells. Cancer Res 2004; 64(24): 8860–8866.
15. Wang G, Wang J, Sadar MD. Crosstalk between the Androgen Receptor and beta-Catenin in Castrate-Resistant Prostate Cancer. Cancer Res 2008; 68(23): 9918–9927.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2014 Issue 2-
All articles in this issue
- Chudoba
- Alergická bronchopulmonální aspergilóza
- Moderní radioterapie karcinomu prostaty
- Diskuze o medicíně a zdravotnictví jako součást výuky humanitních základů lékařství
- Posuzování zdravotní způsobilosti k práci v noci
- Laxativa – bezpečná a účinná
- Roční zkušenosti s posuzováním stupně závislosti pro účely příspěvku na péči
- Molekulární mechanismy rezistence u nádorového onemocnění prostaty
- Předčasná ejakulace
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Posuzování zdravotní způsobilosti k práci v noci
- Laxativa – bezpečná a účinná
- Alergická bronchopulmonální aspergilóza
- Moderní radioterapie karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

