-
Medical journals
- Career
Endoskopická cytoskopie – nová metoda k vyšetření trávicí trubice
Authors: Z. Beneš
Authors‘ workplace: Přednosta: MUDr. Zdeněk Beneš, CSc. ; II. interní klinika, Fakultní Thomayerova nemocnice, Praha
Published in: Prakt. Lék. 2008; 88(3): 172-174
Category: Diagnostis
Overview
Mezi nejnovější endoskopické metody, jejichž cílem je velmi detailní zobrazení sliznice trávicího traktu, patří tzv. endoskopická cytoskopie. Tato metoda umožňuje zvětšit vyšetřovanou slizniční oblast až 1 200x a je jedinou endoskopickou metodou, pomocí níž lze velmi detailně barevně zobrazit morfologickou strukturu mukózy, buňky včetně jader, jadérek, apod., in vivo. Prozkoumání probíhá souběžně při rutinním endoskopickém vyšetření a dovoluje detekovat zánětlivé, preneoplastické a maligní změny. Velmi důležitá je dobrá spolupráce s patologem. Vyšetření je vhodné k vyšetření žaludku, tlustého střeva a zejména jícnu. Endocytoskopii lze provádět i u nemocných, kde je biopsie nebezpečná pro riziko krvácení.
Klíčová slova:
endoskopie, endoskopická cytoskopie, slizniční morfologické změny.Úvod
V posledních letech dochází k velkému rozvoji endoskopických postupů, které se snaží o co nejpřesnější vizualizaci sliznice gastrointestinálního traktu (GIT). Dnes se používají při endoskopii techniky, jako jsou chromoendoskopie, optická koherentní tomografie, autofluorescence a v poslední době je již na trhu dostupná metoda tzv. NBI (Narrow Band Imaging). Zásadním přínosem těchto technik je možnost detailního zobrazení změn sliznice, zejména při detekci a diagnostice premaligních či maligních afekcí (10). I když tedy dovedou dnešní endoskopické postupy zobrazit vyšetřované slizniční oblasti velmi detailně, nedokáží zobrazit morfologickou strukturu sliznice.
Zcela novou metodou, která umožňuje zobrazit sliznici trávicí trubice do histologických detailů je tzv. endoskopická endocytoskopie – endoscopic cytoscopy (ECS), někdy zkráceně nazývaná endocytoskopie. Patří mezi tzv. mikroskopické endoskopické metody či kontaktní endoskopii, protože se při vyšetření dotýkáme vyšetřovací sondou vlastní sliznice (2, 3, 8, 9).
Popis metody
ECS je založená na principu světelné kontaktní mikroskopické techniky. Pomocí speciální endocytoskopické sondy, kterou lze protáhnout pracovním kanálem konvenčního endoskopu (gastroskopu, kolonoskopu) můžeme zvětšit vyšetřovanou sliznici 450–1 200x. Délka vlastní endocytoskopické sondy je 250 cm, takže endocytoskopicky lze vyšetřovat jak při gastroskopii, tak i při kolonoskopii. Endocytoskopickou sondou se při vyšetření velmi lehce dotýkáme sliznice a můžeme tak vyšetřovat suspektní lézi na jejím povrchu. Někdy je vhodné na konec mateřského endoskopu připevnit fixační kroužek (cap) – jako při provádění mukosektomie – abychom docílili lepší kontakt ECS sondy s mukózou. Je nutné zdůraznit, že povrch sliznice, který chceme pomocí ECS sondy vyšetřit, musí být zcela čistý, prostý obsahu, zbytků stravy či hlenu. Je proto vhodné sliznici během vyšetření očistit nejlépe tlakovou vodou (1). Před vyšetřením je nutné mukózu obarvit vhodným barvivem, aby se obarvily buněčné elementy – nejlépe 1–2% methylenovou modří.
Během ECS vyšetření můžeme tak souběžně při rutinní endoskopií provést in vivo morfologické zobrazení sliznice (6, 7, 11). Při ECS lze zobrazit ihned změny architektury sliznice, vlastní buňky, jejich jádra, jadérka, apod. Je možné také pozorovat buněčné atypie, preneoplastické a maligní změny na povrchu vyšetřované oblasti (4, 5).
Endoskopickou cystoskopii používáme na II. interní klinice Fakultní Thomayerovy nemocnice zejména při vyšetření jícnu, ale také žaludku a tlustého střeva. U jícnu se zaměřujeme na detekci Barettova jícnu a karcinomu jícnu. U žaludku je hlavní indikací záchyt preneoplastických a maligních změn. U tlustého střeva je hlavním naším zájmem včasný záchyt kolorektálního karcinomu. ECS však lze použít i při diagnostice nespecifických střevních zánětů či detekci neoplázie v terénu těchto zánětlivých onemocnění.
Nicméně i ECS má svá určitá úskalí. S endocytoskopickou sondou se musí pracovat velmi jemně, aby se podařilo dobře zobrazit morfologické struktury sliznice. Nesmírně důležité je vyšetřovat sliznici zcela čistou a dobře obarvenou methylenovou modří. Hloubka morfologického zobrazení je 0–30 μm. Vyšetření také ztěžují respirační a kardiální pohyby pacienta. Větší krvácení je rovněž překážkou při vyšetření pomocí ECS.
I přes tyto obtíže má ECS jednoznačně mnoho výhod. Vyšetření nijak více nezatěžuje nemocného, morfologickou diagnostiku můžeme provést ihned souběžně s rutinní endoskopií in vivo. K tomu je dobré poznamenat, že ECS metodu můžeme použít zcela bezpečně i pacientů, kteří užívají antikoagulancia či antiagregancia, kde by biopsie vedla k riziku krvácení. Naprosto nutná je velmi dobrá spolupráce s fundovaným patologem. Význam ECS musí v následujících letech podpořit studie, srovnávající ECS výsledky a bioptická vyšetření. Nicméně již dnes je zřejmé, že ECS je současně jedinou metodou, kterou lze barevně zobrazit ihned souběžně při endoskopii jemnou morfologii sliznice do cytologických detailů.
Image 1. Endocytoskopická sonda 
Image 2. Endocytoskopická sonda v endoskopu. 
Image 3. Detail endocytoskopické sondy 
Image 4. Dotek endocytoskopické sondy se sliznicí jícnu 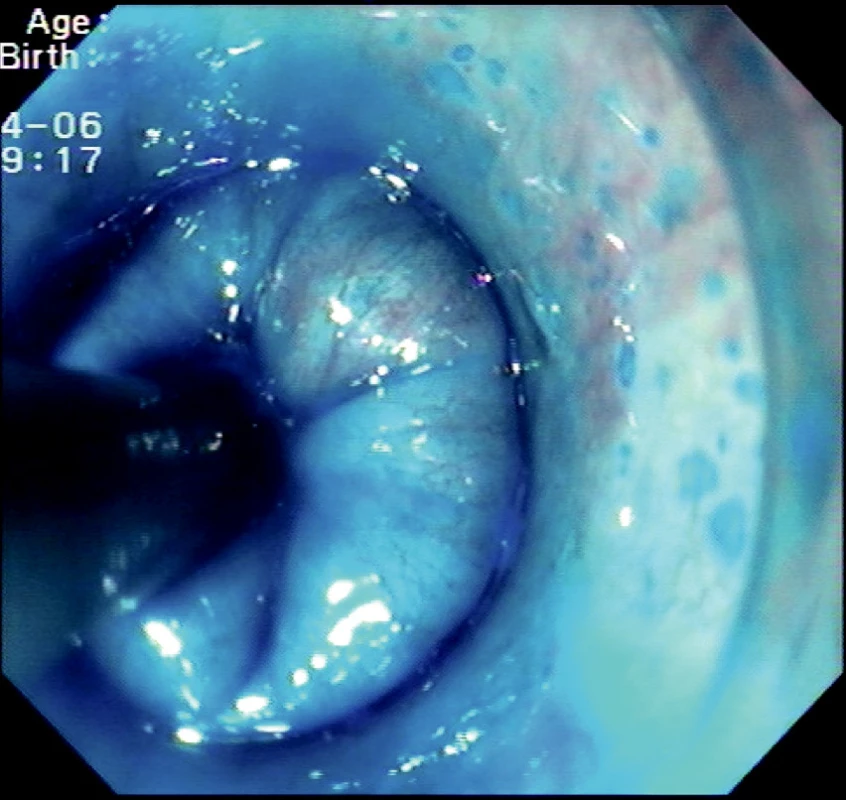
Image 5. Endocytoskopický obraz normálního epitelu jícnu 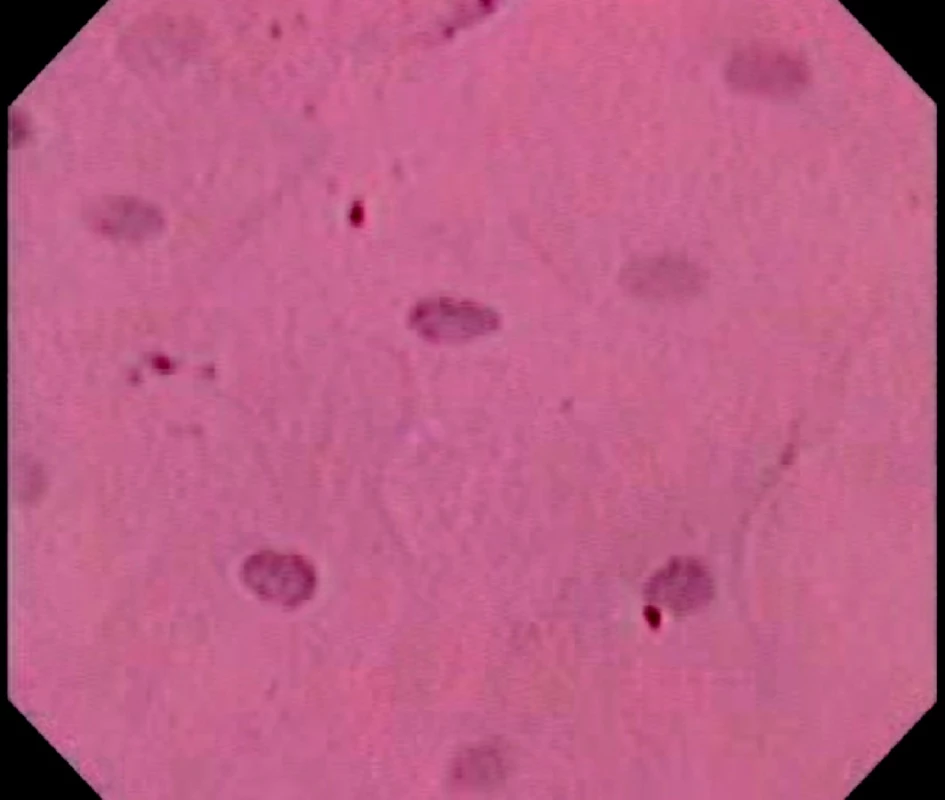
Image 6. Endocytoskopický obraz karcinomu žaludku 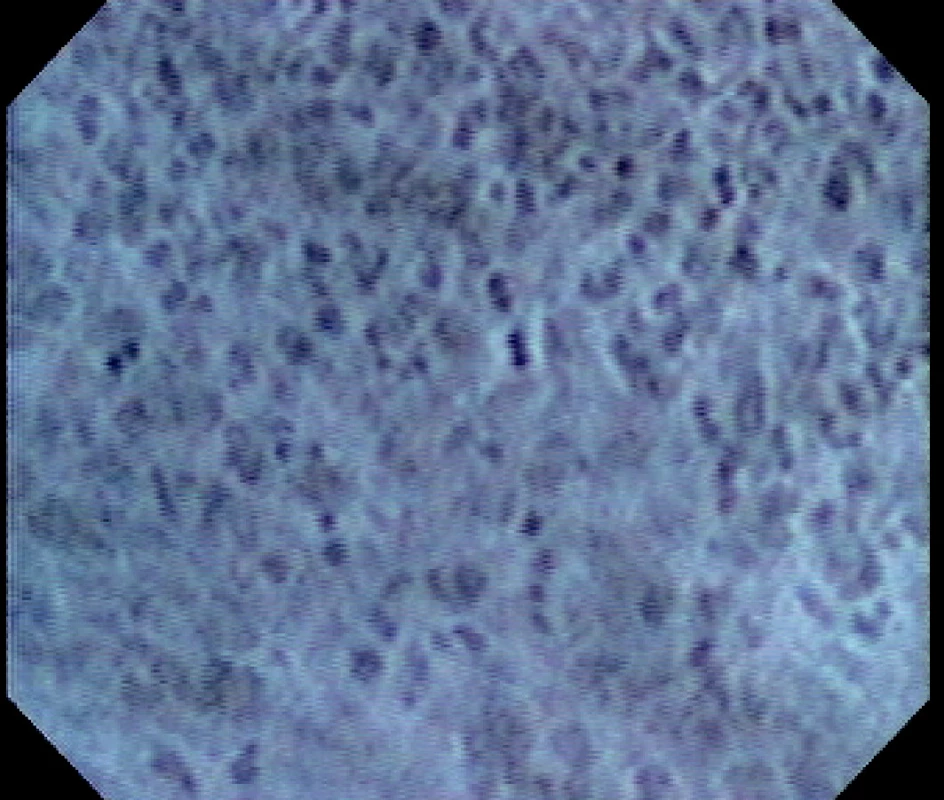
Image 7. Endocytoskopický obraz karcinomu jícnu 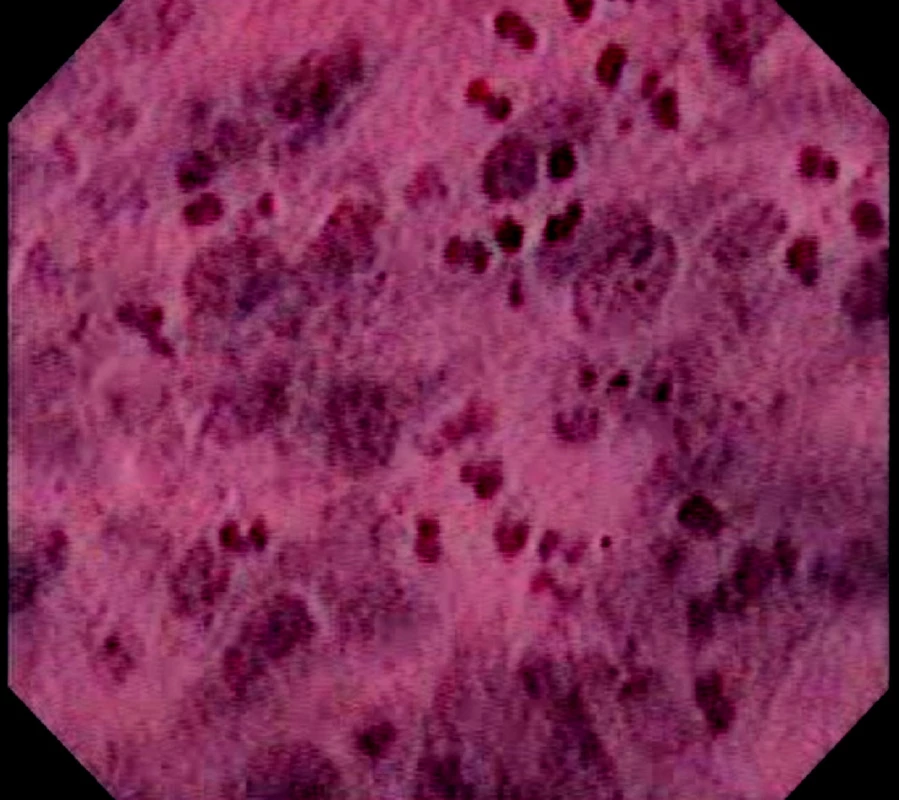
Image 8. Endocytoskopický obraz karcinomu kolon 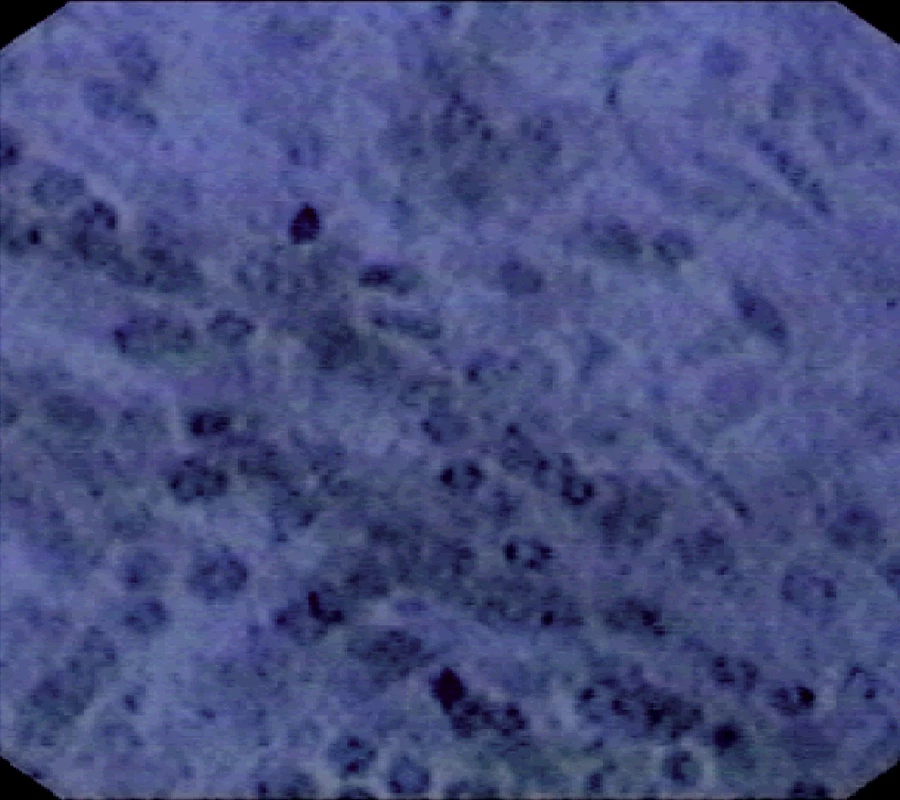
Závěr
Endoskopická cytoskopie je nyní kvalitativně novou endoskopickou metodou, která umožňuje provést morfologickou verifikaci slizničního povrchu GIT. Lze s její pomocí barevně zobrazit buňku, její jádro či další buněčné struktury. Dokáže rozeznat normální slizniční mikrostrukturu od zánětu, karcinomu, apod. Tato nová kontaktní endoskopická technika umožňuje provést histologickou verifikaci přímo při vyšetření in vivo.
MUDr. Zdeněk Beneš, CSc.
II. interní klinika
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4 – Krč
E-mail: zdenek.benes@ftn.cz
Sources
1. Fuji, T., Iishi H., Tatsuta, M. et al. Effectiveness of premedication with pronase for improving visibility during gastroendoscopy: a randomized controlled trial. Gastrointest. Endosc. 1998, 47, p. 382-387.
2. Chiu, P.W.Y., Inoue, H., Satodate, H. et al. Validation of the quality of histological images obtained of fresh and formalin-fixed speciemens of esophageal and gastric mucosa by laser-scanning confocal microscopy. Endoscopy 2006, 38 (3), p. 236-240.
3. Inoue, H., Kudo, S., Shiokawa A. Novel endoscopic imaging techniques toward in vivo observation of living cancer cells in the gastrointestinal tract. Dig. Dis. 2004, 22, p. 334-337.
4. Inoue, H., Sasajima, K., Kaga, M. et al. Endoscopic in vivo evaluation of tissue atypia in the esophagus using a newly designed intergrated endocytoscope: a pilot trial. Endoscopy 2006, 38 (9), p. 891-895.
5. Kakeji, Y., Yamaguchi, S., Yoshida D. et al. Development and assessment of morfologic criteria for diagnosing gastric cancer using confocal endomicroscopy: an ex vivo and in vivo study. Endoscopy 2006, 38 (9), p. 886-890.
6. Kumagai, Y., Monma, K., Kawada, K. Magnifying chromoendoscopy of the esophagus: In vivo pathological diagnosis using an endocytoscopy system. Endoscopy 2004, 36 (7), p. 590-594.
7. Kumagai, Y., Toi, M., Inoue, H. Dynamism of tumour fasculature in the early phase of cancer progression: outcomes from oesophage cancer research. Lancet Oncol 2002, 3, p. 604–610.
8. Saito, N., Sato, F., Oda, A. et al. Removal mucus for ultrastructural observation of the surface of human epithelium using pronase. Helicobacter 2002, 7, 2, p. 112-115.
9. Sakashita, M., Inoue, H., Kashida, H. et al. Virtual histology of colorectal lesions using laser-scanning confocal microscopy. Endoscopy 2003, 35 (12), p. 1033-1038.
10. Sano, Y., Saito, Y., I Fu K. et al. Efficacy of magnifying chromoendoscopy for the differential diagnosis of colorectal lesions. Digestive Endoscopy 2005, 17, p. 105-116.
11. Sasajima, K., Kudo, S., Inoue, H. et al. Real-time in vivo virtual histology of colorectal lesions when using the endocytoscopy systém. Gastrointest. Endosc. 2006, 63 (7), p. 1010-7.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 3-
All articles in this issue
- Nadváha, jídelní zvyklosti a dietní tendence dospívajících
- Mezinárodní klasifikace funkčních schopností, disability a zdraví WHO jako nástroj moderní rehabilitace
- Kombinovaná chelatační léčba u pacienta s myelodysplastickým syndromem a vrozenou hemochromatózou Popis případu
- Profesní neimunologické asthma bronchiale
- Endoskopická cytoskopie – nová metoda k vyšetření trávicí trubice
- Vztah obezity a osteoartrózy
- Urogenitální tuberkulóza – současný stav
- Zrakové poznávání a jeho poruchy
- Psychosomatika bolesti Konvergence neurologické a psychogenní etiopatogeneze a možnosti psychoterapie
- Úloha orální hygieny v prevenci plakem plakem podmíněných onemocnění dutiny ústní
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urogenitální tuberkulóza – současný stav
- Psychosomatika bolesti Konvergence neurologické a psychogenní etiopatogeneze a možnosti psychoterapie
- Úloha orální hygieny v prevenci plakem plakem podmíněných onemocnění dutiny ústní
- Kombinovaná chelatační léčba u pacienta s myelodysplastickým syndromem a vrozenou hemochromatózou Popis případu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

