-
Medical journals
- Career
Urogenitální tuberkulóza – současný stav
: P. Nencka 1; R. Zachoval 1; V. Bártů 2; H. Blažková 3
: Urologické oddělení Fakultní Thomayerovy nemocnice s poliklinikou, Praha Primář: doc. MUDr. Roman Zachoval, Ph. D. ; Pneumologická klinika 1. LF UK a FTNsP, Praha Přednosta: MUDr. Václava Bártů 2; Oddělení plicní a mimoplicní tuberkulózy, Odborný léčebný ústav, Jevíčko Primář: MUDr. Helena Blažková 3
: Prakt. Lék. 2008; 88(3): 132-137
: Reviews
Tuberkulóza provází lidstvo po tisíce let, odhaduje se, že v současnosti je asi třetina světové populace infikována kmeny Mycobacterium tuberculosis. Urogenitální forma je relativně vzácnou, přesto jednou z nejčastějších mimoplicních forem tuberkulózy. Rostoucí migrace obyvatelstva, zejména ze zemí Východní Evropy a Asie, pandemie AIDS, imunosupresivní léčba a celosvětově nekoordinovaná terapie tuberkulózy jsou reálné hrozby růstu incidence tuberkulózy a její urogenitální formy také v zemích Střední a Západní Evropy. Povědomí o této nemoci, včasná a správná diagnostika, stejně jako účinná a koordinovaná léčba mohou toto nebezpečí výrazně redukovat.
Klíčová slova:
tuberkulóza, urogenitální, diagnostika, léčba.Úvod
Zmínky o tuberkulóze – dále TBC – pocházejí z období již před 7 000 lety, a její etiologie byla popsána Kochem v roce 1882. V roce 1937 popsal Wildbolz TBC ledviny a nadvarlete jako lokální manifestace jedné hematogenně šířené infekce a užil také jako první pojem urogenitální tuberkulóza – dále U-TBC (1). Ještě ve třicátých letech 20. století držela v České republice (ČR) primát jako nejčastější příčina úmrtí. Po rapidním ústupu incidence TBC odborná veřejnost podlehla iluzi, že se jedná o vzácné onemocnění, které si nezaslouží výjimečnou pozornost, a mnoho lékařů ji již nebere v úvahu při diferenciální diagnostice.
Podle odhadů WHO je jedna třetina světové populace infikována kmeny Mycobacterium tuberculosis, ročně přibývá 8–10 milionů nově infikovaných osob a 2 miliony pacientů ročně umírá. Devadesát procent těchto případů připadá na země rozvojového světa (2). Neefektivní léčba TBC je příčinou nárůstu rezistence v mnoha zemích světa.
Celosvětově je infekce TBC nejčastější oportunní infekcí u pacientů s AIDS a HIV infekce je jedním z nejrizikovějších kofaktorů propuknutí TBC u pacientů infikovaných M. tuberculosis (3).
U-TBC je i přes svůj relativně nízký výskyt závažnou formou extra-pulmonální tuberkulózy. Společně s periferní lymfadenopatií a postižením skeletu je nejčastější mimoplicní formou TBC. V rozvo-jových zemích má 15–20 % pacientů s TBC pozitivní močový nález (4). U-TBC je zastoupena mezi extrapulmonálními formami TBC 20–73 %, u dětí je výrazně vzácnější. Správně ordinovaná chemoterapie je efektivním prostředkem přerušení řetězu nákazy. Proto je nejlepší prevencí TBC léčba infekčních pacientů (2).
Epidemiologie
V roce 2003 bylo ve WHO Evropském regionu (celkem 880 mil obyvatel) hlášeno 415 786 případů onemocnění TBC, tj. 47,2 případu na 100 tis. obyvatel (46,2 v roce 2002). Uvádí to zpráva Euro TB o epidemiologické situaci „Surveillance of tuberculosis in Europe – hlášené případy v roce 2003“. Ruská federace je co do počtu infikovaných TBC na 9. místě na světě. Incidence případů TBC se výrazně liší i mezi jednotlivými státy Evropy. Poměr ženy/muži mezi nově vzniklými případy TBC byl 0,4 (1).
Dle recentních analýz je 2,6 % nových případů u pacientů s HIV. V Rusku je 1% lidí každoročně infikovaných TBC HIV pozitivní a 35 % pacientů s AIDS na TBC umírá.
Incidence extrapulmonální TBC je vyšší u hemodialyzovaných pacientů (6). U-TBC je vzácná u pacientů do 25 let věku (7). Mykobakteriální infekce má negativní dopad na pacienty po transplantaci ledviny, zejména v průběhu prvního roku po výkonu (8). Zastoupení mužů a žen je rovnoměrné. V ČR je ročně notifikováno 10 až 30 nových onemocnění U-TBC, záchyt U-TBC v ČR demonstruje tabulka 1.
1. Hlášená onemocnění tuberkulózy močové a pohlavní soustavy podle klasifikační diagnózy (MKN-10) 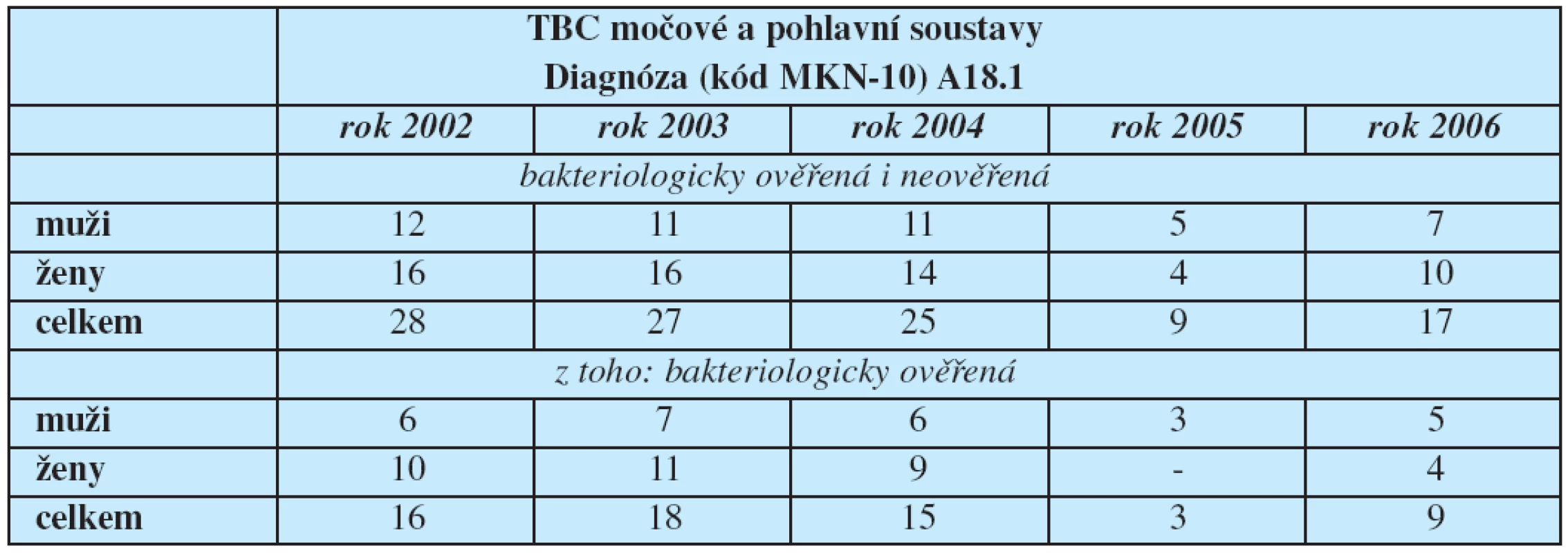
Etiologie
Původcem TBC u člověka je většinou bacil humánní tuberkulózy, bovinní typ se u člověka vyskytuje zřídka. U-TBC je způsobena kmenem Mycobacterium tuberculosis, což je striktně aerobní pomalu rostoucí mikroorganismus. Nejspolehlivějším testem je identifikace acidorezistentních bacilů v krevním nátěru se senzitivitou 22–81 % (4). Molekulární metody jako hybridizace nukleové kyseliny a PCR DNA nebo RNA mají v klinických testech relativně nízkou senzitivitu, zejména pokud není přítomno větší množství mikroorganismů (9–14).
Patogeneze
Téměř všechny infekce M. tuberculosis jsou způsobeny vdechnutím infikovaných partikulí aerosolu do plicních alveolů. Riziko infekce záleží na době expozice, velikosti a množství vdechnutých partikulí a infekčnosti mykobakteriálního kmene. Riziko rozvoje aktivní TBC u infikované osoby je 5–10 % v průběhu života. Do dvou let od nákazy se vyvine 50 % všech aktivních onemocnění (4).
TBC ledviny, močových cest a mužského genitálu je stejně jako ostatní plicní i mimoplicní formy TBC způsobena bakteriemi Mycobacterium tuberculosis komplex (4). Propuknutí nemoci závisí na interakci patogenu a imunitního systému hostitele. Za průběh onemocnění je zodpovědná buněčná imunita. Mykobakterie mají dlouhou generační dobu a jsou schopny v lidském organismu přežívat ve spícím stavu po řadu let. K vzplanutí onemocnění může dojít tzv. endogenní reaktivací za nepříznivých podmínek, kterými jsou vysoký věk, alkoholismus, oslabení imunitního stavu léčbou, zářením, jinými chorobami, špatnými životními a sociálními podmínkami.
U 10 % infikovaných pacientů dochází k reaktivaci TBC, vzniká postprimární TBC. Méně častou formou nákazy je tzv. exogenní superinfekce. Jde o situaci, kdy je pacient nakažen masivní expozicí tuberkulózním mykobakteriím, tedy kontaktem se silně infekční osobou. Z tohoto pohledu jsou v největším riziku osoby v blízkém a dlouhodobém kontaktu s nemocnou osobou.
TBC se vyskytuje přibližně v 90 % v plicní formě a 10 % při mimoplicní lokalizaci. Tuberkulózní postižení urogenitálního traktu je způsobeno aktivací primárně hematogenní infekce, ke které mohlo u pacienta dojít o řadu let dříve, než se objeví známky vlastního onemocnění TBC urogenitálního traktu ve formě postižení ledviny, nadvarlete, vzácněji prostaty. Z urogenitálního traktu pouze tyto orgány bývají postiženy TBC izolovaně, proto bývají nazývány branami vstupu mykobakteriální infekce.
Vývoj infekce závisí na množství mykobakterií a jejich virulenci, intenzitě infekce a obranyschopnosti hostitele. Mykobakteria sídlí v ledvinách v juxtaglomerulárních cévách, kde vytváří léze s přítomností polymorfonukleárů, leukocytů a makrofágů. Vzniká kaseózní granulom, který obsahuje Langhansovy obrovské buňky, ohraničené lymfocyty a fibroblasty. Pokud je zastavena intracelulární reprodukce mykobakterií, léze se hojí fibrózní tkání a kalcifikacemi. Při pokračujícím množení propadá centrum granulomu kazeózní nekróze a vytvářejí se typické malé kaverny.
Patologie
Ledvina
TBC postihuje ledvinu buď jako součást generalizované infekce, nebo jako lokalizované urogenitální postižení. Ledvina je většinou infikována hematogenně z primárního ložiska v plicích či střevech. Urogenitální infekce vzniká většinou reaktivací TBC po období dormance. Klinicky se TBC většinou manifestuje jednostranně, patologické nálezy však posléze často verifikují bilaterální proces. Ledvina se hojí fibrózní tkání s depozity kalciových solí, vzniká klasická kalcifikovaná léze. Kalcifikace v ledvinách jsou u TBC infekce běžné a často vyžadují chirurgickou excizi (4). Hlavním cílem je zachovat maximum funkční tkáně, sledování by mělo trvat deset a více let, jelikož náhlý nárůst velikosti kalcifikací si může vyžádat další chirurgickou intervenci (15, 16).
Komplikací těžké jednostranné TBC ledviny se snížením průtoku krve ledvinou bývá hypertenze, dvě třetiny pacientů dosahují výrazného poklesu tlaku po nefrektomii (17). Postupující proces TBC může vést k tuberkulózní pyonefróze a vzniku tmelové ledviny. Sekundárně se může vyskytovat nefrolitiáza a TBC perinefritida.
Nekróza ledvinového parenchymu může způsobit progresi procesu do kalicho-pánvičkového systému. Nejdříve bývají napadeny a zničeny papily, odchod nekrotické papily močovodem může vyvolat obraz renální koliky.
TBC proces postihuje kalichy, které jsou ulcerovány typických způsobem. Fibrózní hojení vytváří četné striktury kalichového systému, hlavně v oblasti infundibul kalichů.
Při progresi na ledvinovou pánvičku působí jizvení výraznou redukci objemu a strikturu pyelo-ureterální junkce. Kalcifikace v ledvině obsahují vitální mykobakteria.
Ureter
Tuberkulózní ureteritida je vždy způsobena přestupem infekce z ledviny. Nejčastěji bývá postižena ureterovesikální junkce. Postižení je vždy druhotné vzhledem k masivnímu postižení ledviny, a pokud není rozpoznáno včas, rychle končí úplnou destrukcí ureteru.
Vzácně je postižen celý ureter. U těchto pacientů je ledvina masivně postižena, často nefunkční a kalcifikovaná. Stěna močovodu je poškozena ulceracemi a fibrózními lézemi a výsledkem je močovod tvaru růžence. U afunkčních tmelových ledvin s postižením ureteru je nefroureterektomie jediným možným řešením (4).
Močový měchýř
Postižení měchýře jsou bez výjimky sekundární při postižení ledviny. Časné stadium se projevuje změnami v oblasti ureterálních ústí, kde pozorujeme zarudnutí a edém. Při pokročilejších formách dochází ke granulomatozně bulózním změnám, které můžou kompletně obturovat močovody. Sliznice močového měchýře je ulcerována s nepravidelnými vředy s centrálním zarudnutím ohraničeným granulacemi. Zánět může pokračovat do stěny měchýře. Hojí se fibrózní tkání a výsledkem je malý svraštělý měchýř. Maximum fibrózních změn bývá okolo uretrálních ústí, které ztrácí antireflexní vlastnosti, stávají se rigidními a nabývají tvaru „golfové jamky“ (4).
Varle
Postižení varlete je méně časté než postižení nadvarlete a je většinou způsobeno přímo invazívní epididymitidou. Tuberkulózní orchitida bez postižení nadvarlete je extrémně vzácná. Takovéto zduření varlete není možné bezpečně odlišit od nádoru, a pokud není přítomna rychlá odpověď na léčbu antituberkulotiky, je indikována včasná operační revize (18, 19).
Tuberkulózní granulomy s centrálními kazeózními nekrózami se mohou projevit kožními píštělemi.
Nadvarle
Genitální TBC u mužů nejčastěji postihuje nadvarle a prostatu. Tuberkulózní epididymitida je pravděpodobně způsobena hematogenní infekcí, protože postižení nadvarlete je pozorováno často jako jediné postižení urotraktu.
Onemocnění většinou začíná v kaudě nadvarlete, které je oproti ostatním částem více prokrvené. Tuberkulózní epididymitis může být prvním a jediným projevem U-TBC (4).
Nemoc se zpravidla objevuje u mladých sexuálně aktivních mužů, v 70 % je přítomen údaj TBC v anamnéze. Prvním projevem bývá bolestivé zánětlivé zduření skrota. Kauda nadvarlete je samostatně postižena ve 40 %.
Léčba tuberkulózní epididymitidy může být komplikovaná nemožností průkazu mykobakterií v moči. V akutní fázi zánětlivá reakce postihuje také varle a je obtížné odlišit akutní orchiepididymitidu (1).
Pokud se netvoří dutiny a mykobakteria nejsou prokazatelná v moči, je třeba zahájit odpovídající antibiotickou léčbu. Při nezlepšení do 2–3 týdnů by měla být zahájena antituberkulotická chemoterapie. Za další 3 týdny, pokud se léze stane nebolestivou a uzlovitou, je indikována operační revize bez prodlení (4).
Přenos TBC pohlavním stykem z muže na ženu je velmi vzácný. Sporé kazuistiky popisující pánevní tuberkulózu u sexuálních partnerek pacientů s tuberkulózní orchiepididymitidou svědčí pro možnost sexuálního přenosu z žen na muže (20).
Tuberkulózní etiologie u obstruktivní azoospermie nemá vliv na úspěšnost odběru spermatozoí a IVF (21).
Prostata
TBC prostaty je vzácná a je v mnoha případech diagnostikována při pitvě nebo náhodně zjištěna při histologickém vyšetření preparátu po transuretrální resekci. Cestou infekce je hematogenní rozsev. Tuberkulózní prostatitis vzniká antegrádní infekcí urotraktu (4). Charakteristická je přítomností granulomu, kavitací s kazeózní nekrózou, fibrózních změn a kalcifikací. Možná je i tvorba píštělí do perineálního sinu. TBC infekce přechází často do semenných váčků, kde se obvykle projevuje jako empyém nebo fibrózně změněné vezikuly.
Penis
TBC penisu je velmi vzácná. Primární TBC penisu vzniká po kontaktu s mikroorganismy při sexuálním styku nebo při kontaktu s kontaminovaným prádlem (22). Před léty byla běžnou komplikací rituálních obřízek. Infekce se projevuje povrchovými vředy na glandu vyvolávajícími často podezření na maligní etiologii. Někdy se TBC penisu manifestuje nodulárními změnami nebo ulcerací kavernózních těles. Diagnóza je potvrzena biopsií, léze obecně velmi rychle reagují na podanou chemoterapii (4). Byly popsány případy endometriální tuberkulózy u sexuálních partnerek pacientů s tuberkulózou penisu. Izolované mikroorganismy nejsou rozlišitelné za použití molekulárních metod (23).
Uretra
TBC uretry je velmi vzácná (4, 24). K infekci dochází descendentním šířením z proximálních močových cest nebo při pokročilém onemocnění penisu. Následkem bývají většinou četné striktury uretry. U pacientů by měla být zahájena chemoterapie (1, 4).
Klinické projevy a diagnostické metody
Diagnóza U-TBC je obtížná pro její nespecifické projevy. Nejdůležitějším bodem diagnostiky je podrobná anamnéza. Informace o tuberkulózní infekci v minu-losti, ať již plicní či mimoplicní, je v mnoha případech důležitým vodítkem. Latence mezi plicními projevy a urogenitální manifestací je enormní, v některých případech je tento interval delší než 30 let (9).
Velmi častými projevy jsou mikční obtíže a chronické uroinfekce, nereagující na ATB terapii. U mužů je typickou manifestací U-TBC izolovaná epididymitis často se skrotálními píštělemi.
Dalšími symptomy jsou bolesti zad, boků, bolesti nad sponou, hematurie, polakisurie a nykturie. Renální kolika není typická, vyskytuje se u méně než 10 % pacientů a celkové příznaky jako horečka, váhový úbytek a noční poty nejsou obvyklé. Obtíže jsou často intermitentní a pacient vyhledává lékaře s prodlením (9).
Mikrobiologická diagnóza je obvykle stanovena kultivací vyvolávajícího agens z moče nebo bioptického materiálu na konvenčních pevných půdách. Pozitivní kultivace nebo histologické ověření bioptických vzorků spolu s PCR jsou u většiny pacientů nezbytné k definitivnímu stanovení diagnózy (9). Detekce acidorezistentních bacilů ze vzorků moče mikroskopicky (barvení dle Ziehl - Neelsena) není spolehlivá, protože je možná záměna za M. smegmatis. Zhodnocení biologické aktivity TBC je možné pouze kultivací mykobakterií.
Při hodnocení závažnosti onemocnění a poté adekvátní léčby je posuzováno množství bakterií, rozsah onemocnění a postižené anatomické struktury.
U-TBC spolu s dalšími mimoplicními formami je považována za závažné onemocnění (2). U-TBC je formou sekundární TBC s nespecifickými příznaky. Tato diagnóza by tudíž měla být zvažována vždy, pokud nelze nalézt příčinu dlouhotrvajících nespecifických urologických obtíží. Latence mezi infekcí a manifestací urogenitálního postižení je často více než 20 let (25).
Typickými laboratorními nálezy jsou pyurie, albuminurie a hematurie. Patologický nález na rentgenogramu hrudníku má při přijetí 75 % procent pacientů, 88 % pacientů má pozitivní tuberkulinový kožní test a u 63 % vyšetřovaných je abnormální nález při vylučovací urografii. U 16 % pacientů jsou prokazatelné kalcifikace v ledvinách (25).
TBC ledvin je ve 100 % provázena přítomností mykobakterií v moči (26). Symptomy TBC ledviny se neprojevují v intervalu od 3 do 10 i více let od infekce, proto je U-TBC vzácná u dětí (4).
Pacienti si obvykle stěžují na častou nebolestivou mikci, zprvu v noci, později i během dne. Pokud není přítomno rozsáhlé postižení měchýře, jsou urgence neobvyklé. Moč je sterilní, v mnoha případech je přítomna leukocyturie. Přesto až 20 % pacientů leukocyturii nemá (4). Makrohematurie je přítomna v 10 %, mikrohematurie až v 50 %. Suprapubická bolest a bolest ledviny se vyskytují zřídka a jsou vždy známkami pokročilého postižení ledvin a měchýře.
Hemospermie je vzácným příznakem U-TBC, ta by však měla být zvažována u všech pacientů s izolovanou hemospermií i bez dalších známek postižení urotraktu. Recidivující cystitida je také suspektním nálezem. Je nezbytné provádět opakovaná vyšetření moče, izolace mykobakterií z moče je obtížná. Jediným symptomem U-TBC může být bolestivé zduření varlete, k odlišení od akutní orchiepididymitidy je třeba provést opakovaná vyšetření ranní moče (4). Zřídka je diagnóza stanovena jako incidentální nález při transuretrální resekci prostaty.
Léčba těchto pacientů je založena na podání antituberkulózních chemoterapeutik.
Tuberkulinový test
Tuberkulinový test se provádí intradermální injekcí purifikovaného proteinového derivátu tuberkulinu. V místě vpichu se objevuje zánětlivá reakce, která dosahuje svého maxima 48–72 hodin po aplikaci. Tato reakce se skládá z centrální indurace s periferním erytémem. Průměr indurace je pro hodnocení rozhodující. Schopnost imunitní odpovědi je snížena u malignit, nutričních deficitů, terapii kortikoidy, ozáření a u AIDS (27). Pozitivní tuberkulinový test podporuje diagnózu, negativní kožní test nevylučuje mimoplicní manifestaci, zejména urogenitální formu (9).
Krevní testy
Jako pomocné krevní testy v diagnostice U-TBC jsou využívány testy Quanti FERON®-TB Gold test a Elispot. Využívají schopnost uvolňování interferonu gama aktivovanými lymfocyty infikovaných pacientů při styku s tuberkulózními antigeny (syntetické peptidy ESAT-6 a CFP-10), které jsou aplikovány do odebraných krevních vzorků. Výhodou těchto testů je rychlost – výsledky mohou být k dispozici do 24 hodin, vysoká specificita a senzitivita nejsou ovlivněny předchozí BCG vakcinací. Nevýhodou je náročnost zpracování vzorků s ohledem na nízkou životaschopnost leukocytů in vitro a limitovaná data publikovaná pro užití u dětí, osob čerstvě infikovaných a imunosuprimovaných (37).
Vyšetření moče
Moč je vyšetřována na přítomnost erytrocytů a leukocytů, je sledováno pH a koncentrace. Je prováděna kultivace moče na běžné uropatogeny, které mohou způsobovat sekundární infekci až ve 20 %. „Sterilní pyurie“ je typickým závěrem standardního vyšetření moče a kultivace.
Diagnóza U-TBC je postavena na kultivačním průkazu mykobakterií. Měly by být kultivovány 3 nebo lépe 5 vzorků ranní moče na dvou specifických půdách:
- Lowenstein-Jensenova k průkazu M. tuberculosis, bacilus Calmette-Guérin (BCG) a příležitostně netuberkulózních mykobakterií,
- pyruvátové vaječné medium s peni-cilinem k průkazu M. bovis, které je částečně anaerobní a roste pod povrchem půdy.
V poslední době je intenzivně zkoumána úloha PCR v detekci M. tuberculosis complex, bylo však publikováno relativně málo studií hodnotících senzitivitu a specificitu tohoto vyšetření - tyto senzitivitu i specificitu potvrzují (9).
Molekulární biologické metody Gen-Probe, PCR (Polymerase Chain Reaction) nebo LCR (Ligase Chain Reaction) jsou rychlé diagnostické metody, pomocí kterých lze získat výsledek během šesti až osmi hodin. Tyto vysoce citlivé metody prokazují nukleové kyseliny (RNA, DNA) mykobakterií – Mycobacterium tuberculosis komplexu (M. tuberculosis, M. bovis, M. bovis BCG, M. africanum a M. microti). Lze s nimi detekovat 1–10 mykobakteriálních buněk v 1 ml materiálu. Pacienta s pozitivním průkazem mykobakterií molekulárními metodami (PCR, LCR) zejména v moči lze považovat za prokazatelně nemocného urogenitální tuberkulózou. Kromě toho metody PCR, LCR prokazují genetický materiál Mycobacterium tuberculosis komplexu (M. tuberculosis, M. bovis, M. bovis BCG, M. africanum a M. microti).
Ostatní klinicky více či méně významná či saprofytická mykobakteria lze prokázat pouze kultivačně. Totéž platí pro identifikaci mykobakterií komplexu M. tuberculosis. Z těchto důvodů je vždy souběžně zakládáno kultivační vyšetření a mikroskopický preparát. Protože klasická kultivace je dlouhodobá, určitým řešením je využití urychlených kultivačních metod, které v případě pozitivity mohou poskytnout výsledek během 2 až 10 dnů (10).
Zobrazovací metody
Nativní snímek urotraktu
Nativní rentgenový snímek může prokázat kalcifikace v ledvinách či močových cestách. Tyto kalcifikace nemusí znamenat inaktivní proces, což vyžaduje další dovyšetření (4).
Vylučovací urografie
Charakteristické známky na pyelogramu a CT jsou pro odhalení U-TBC přínosné, umožňují rychlejší stanovení diagnózy a nasazení adekvátní terapie. V začátcích onemocnění je možné pomocí vylučovací urografie detekovat změny jednotlivých kalichů. Jsou popisovány deformace jednotlivých kalichů – tzv. moly vykousané ulcerace, vymizení kalichů – tzv. amputace kalichů – při fibróze kalichu a stenóze infundibula, mnohočetné deformity kalichů nebo závažné destrukce kalichů a parenchymu.
Při pokročilém onemocnění vylučovací urografie odhalí deformace kalichů, striktury ureterů a fibrózní změny měchýře (9). Močovod bývá vlivem četných striktur a kalcifikací zkrácen a nabývá charakteru růžence. Někdy je patrný i vesiko-ureterální reflux z inkompetence ústí močovodů. Močový měchýř bývá postižen kalcifikacemi, defekty náplně, bývá zesílená stěna a redukována kapacita. V oblasti prostaty mohou být četné kalcifikace. Negativní nález při vylučovací urografii diagnózu TBC nevylučuje.
Vylučovací urografie je zlatým standardem při vyšetřování. Je možné ji doplnit o dynamickou studii, která podává informaci o peristaltice ureteru, rozsahu fibrózy, délce striktury, zejména v oblasti ureterovesikální junkce. Funkční nebo výrazně postižená ledvina svědčí pro ireverzibilní onemocnění (4).
Ascendentní ureteropyelografie
(AUPG)
Je užívaná zřídka, existují 2 indikace k jejímu provedení:
- striktury distálního ureteru – ozřejmuje délku striktury a stupeň obstrukce a dilatace nad překážkou
- katetrizace ureteru – může být indikována s úmyslem separovaného získání vzorku moče z obou ledvin (4).
Sonografie a CT
Sonografie ledvin může odhalit výraznější známky obstrukce močových cest. Jelikož je nález často velmi diskrétní, pouze velmi citlivý ultrasonografický přístroj je schopen rozlišit postižení jednotlivých orgánů včas a významně tak ovlivnit prognózu onemocnění. CT a NMR (nukleární magnetická rezonance) jsou nepostradatelné v diferenciální diagnostice. (zmnožení parenchymu, jizvení, autonefrektomie) (9).
Cystoskopie a uretroskopie
Endoskopické vyšetření musí být vždy provedeno v celkové anestézii a relaxaci, aby bylo minimalizováno riziko krvácení. Měchýř by měl být plněn pod kontrolou zraku. Indikace k provedení ureterorenoskopie jsou vzácné. TBC ledviny by měla být zvažována v diferenciální diagnostice jednostranné hematurie, obzvláště při absenci jasné příčiny krvácení. Přímý odběr moče na kultivaci z ureteru má vyšší senzitivitu (28).
Biopsie měchýř
Ve stádiu akutní tuberkulózní cystitidy je biopsie měchýře kontraindikovaná. Je možné ji provést k vyloučení diagnózy karcinomu pouze u pacientů s tuberkuly či vředy na sliznici měchýře v dostatečné vzdálenosti od suficientního ústí močovodu (4).
Legislativa
Zákon o ochraně veřejného zdraví č. 258/2000 Sb., (§ 62) a prováděcí předpis – vyhláška 195/2005 Ministerstva zdravotnictví – ukládají zdravotnickým zařízením při zjištění infekčního onemocnění, při podezření na takové onemocnění či úmrtí na ně, při vylučování původců infekčních onemocnění, nebo když se o těchto skutečnostech dozví, povinnost hlášení orgánu ochrany veřejného zdraví (OOVZ) (hygienická stanice), příslušnému podle místa činnosti a provedení prvních nezbytných opatření k zamezení šíření onemocnění, včetně odběru biologického materiálu a jeho vyšetření. Způsob hlášení je upraven vyhláškou. Hlášení provádí lékař, který onemocnění diagnostikoval. Další opatření pak provádí osoba poskytující zdravotní péči dle pokynu orgánu ochrany veřejného zdraví. Při výskytu tuberkulózy zákon (§ 45, odst. 3) stanovuje povinnost zdravotnických zařízení nařídit izolaci pacienta na oddělení TRN, a pacienti jsou povinni se léčení podrobit.
Pokud je pacient hospitalizován na jiném oddělení, je to možné pouze za předpokladu vytvoření adekvátních podmínek izolace na jednolůžkovém či vyhrazeném vícelůžkovém pokoji.
Medikamentózní léčba
Dle doporučení WHO začíná antituberkulózní léčba podáním 3 až 4 léků denně (rifampicin, isoniazid, pyrazinamid a etam-butol nebo streptomycin) po dobu 2 měsíců. Dochází ke zničení téměř všech tuberkulózních bacilů. Následuje 4 měsíční fáze pokračovací, kdy je podávána kombinace 2 léků 2–3 krát týdně.
Medikamentózní léčba je metodou první volby v terapii U-TBC. Během posledních 40 let byla doba léčby zkrácena z 24 na 6 měsíců. Pouze u komplikovaných případů (rekurentní TBC, imunosuprese a HIV/AIDS) je nezbytné prodloužit léčbu na 9–12 měsíců.
Velkým problémem současnosti je nárůst rezistence na antituberkulotika. Rizikovými faktory pro vznik vícelékové rezistence jsou předchozí léčba antituberkulotiky a pobyt v zemích s výskytem rezistentních kmenů.
V případech rezistentní TBC, jak je definována WHO – mykobakteria rezistentní na rifampicin a isoniazid s nebo bez rezistence na ostatní léky – vyžaduje léčba užití kombinace léků vybraných na základě citlivosti (etionamid, prothionamid, chinolony, klaritromycin, cykloserin, kanamycin, viomycin, cypreomycin, thiaacetazon, kyselina paraaminosalicylová). Tyto léky jsou však méně účinné a často toxičtější než léky první volby. Délka terapie se řídí výsledky kultivačního vyšetření, může trvat 18 měsíců i déle.
Mycobacterium bovis vykazuje primární rezistenci na pyrazinamid a je často zachycováno u pacientů s U-TBC. V klinické praxi by u těchto pacientů nemělo být užito, také z důvodů indukce hyperurikémie a hyperurikosurie. Pacientům s U-TBC léčeným pyrazinamidem v první intenzivní fázi by měl být zároveň podáván inhibitor xantinoxidázy. Šestiměsíční léčba je účinná také u nekomplikované U-TBC. U pacientů s renální insuficiencí je třeba uvážlivě podávat streptomycin, další aminoglykosidy a etambutol, které jsou vylučovány ledvinami (1).
Chirurgická léčba
Přestože léčbou volby u U-TBC je chemoterapie, v některých případech je v první řadě nutná chirurgická léčba z důvodu řešení septických stavů či abscesů (29).
Nefrektomie afunkční ledviny či excize extenzivně postižené částečně fungující ledviny jsou kontroverzními tématy. Indikací k nefrektomii jsou komplikace jako závažná infekce horních močových cest G+ nebo G - bakteriemi a/nebo urolitiasa a hypertenze.
Rekonstrukční chirurgie se uplatňuje zejména při řešení striktur distálního močovodu a při augmentaci fibrotického měchýře. Radikální i rekonstrukční zákroky by měly být provedeny v průběhu prvních dvou měsíců intenzivní terapie (15). Celková incidence chirurgických zákroků u U-TBC v posledních 20 letech je udávána cca 0,5 % ze všech urologických zákroků (30).
Časné zavedení stentu nebo založení perkutánní punkční nefrostomie u pacientů s tuberkulózními strikturami močovodu může zvýšit šanci na pozdější úspěch rekonstrukčního zákroku a snížit riziko ztráty ledviny. Ve všech ostatních případech by před chirurgickým zákrokem měla předcházet minimálně 4 týdenní intenzivní chemoterapie (4).
Nefrektomie
Indikacemi k nefrektomii jsou:
- afunkční ledvina s nebo bez kalcifikací,
- rozsáhlé postižení celé ledviny s hypertenzí a obstrukcí PU přechodu,
- koexistence renálního karcinomu (1).
Téměř 90 % afunkčních ledvin je zničeno a vyžaduje nefrektomii (4). I přes sterilní kultivační nález v moči po intenzivní chemoterapii vykazuje až 50 % histologických preparátů získaných nefrektomií stále aktivní TBC (32, 33).
Resekce ledviny
Indikace:
- lokalizované postižení jednoho pólu ledviny s kalcifikací, které nereaguje na 6 týdenní intenzivní léčbu,
- pomalu se zvětšující kalcifikace, která postupně ničí celou ledvinu (1). Resekce ledviny bez kalcifikace není indikována (1, 4).
Drenáž abscesu
Otevřená drenáž abscesu by neměla být prováděna. Obsah abscesové dutiny by měl být minimálně invazívně aspirován (4).
Epididymektomie
Indikace:
- kazeózní absces nereagující na léčbu,
- tvrdé zduření nadvarlete nejevící známky regrese nebo se zvětšující po léčbě antituberkulotiky a antibiotiky (1).
Orchiektomie je nutná zřídka, ligace kontralaterálního duktu není vyžadována (4).
Striktury ureteru
Nejčastější striktury se nacházejí v oblasti vesikoureterální junkce (VUJ), pyeloureterálního přechodu a vzácně ve středním močovodu. Vznikají u 50 % pacientů s ledvinným postižením (34).
Striktury pyeloureterálního přechodu
U všech typů uretrálních striktur je indikováno zavedení JJ stentu z důvodu adekvátní drenáže v průběhu hojení při medikamentózní terapii nebo po chirurgickém zákroku a ke sledování efektu léčby (1). Uspokojivé výsledky jsou popisovány po plastikách dle Anderson Hynes a Culpa (4, 29).
Striktury středního močovodu
Preferována je ureterostomie či zavedení JJ stentu na dobu minimálně 6 týdnů (4).
Striktury distálního ureteru
Striktury distálního ureteru se vyskytují u 9 % pacientů. Mohou být léčeny medikamentózně nebo chirurgicky. Pokud je obstrukce přítomna na začátku léčby, je nutná pečlivá observace. Tyto striktury mohou být způsobeny otokem a reagují na terapii antituberkulotiky. Pacient by měl podstoupit terapii a v týdenních intervalech vylučovací urografii. Pokud není pozorováno zlepšení do 3 týdnů, jsou nasazovány kortikosteroidy, pokud dojde ke zhoršení, či není zaznamenáno zlepšení do 6 týdnů, je indikována reimplantace močovodu (1).
Závěr
Urogenitální tuberkulóza je relativně vzácnou formou tuberkulózy, její symptomy bývají nespecifické, latence mezi primoinfekcí a propuknutím onemocnění dlouhá, a proto je diagnostika a včasná terapie obtížná. Měla by být zvažována vždy, pokud pacient udává dlouhotrvající urologické obtíže, pro které není jednoznačné vysvětlení.
Diagnostika je prováděna na základě kultivačních nálezů v minimálně 3, optimálně 5 po sobě jdoucích vzorcích moče, je využíváno molekulárních metod, zobrazovacích metod a histologického průkazu.
Chemoterapie antituberkulotiky je v terapii urogenitální tuberkulózy metodou volby, chirurgická řešení jsou indikována po minimálně 4 týdnech léčby s výjimkou zavedení JJ stentu či založení punkční nefrostomie, které jsou v případě uretrálních striktur indikovány bez prodlení a zvyšují úspěšnost rekonstrukčních operací a zároveň snižují riziko ztráty ledviny.
MUDr. Petr Nencka
Urologické oddělení Fakultní Thomayerovy nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E-mail: petr.nencka@ftn.cz
Sources
1. Cek, M., Severin, L., Naber, K.G., et al. EAU Guidelines for the management of genitourinary tuberculosis. Eur. Urol. 2005, 48, p. 353-362.
2. Treatment of Tuberculosis: Guidlines for National Programmes, 3rd ed. Geneva: WHO, 2003. Dostupné na http://www.who.int/docstore/gtb/ publications/ttgnp/pdf/2003.313.pdf.
3. Fain, O., Lortholary, O., Lascaux, V.V. et al. Extrapulmonary tuberculosis in the northeastern suburbs of Paris: 141 cases. Eur. J. Intern. Med. 2000, 11, p. 145-150.
4. Warren, D., Johnson, J.R., Johnson, C.W., Lowe, F.C. Genitourinary Tuberculosis. In: Walsh PC, Retik AB, Vaughn FD: Campbell´s Urology. 8th ed. Philadelphia: Saunders, 2002.
5. Chattopadhyay, A., Bhatnagar, V., Agarwala, S., Mitra, D.K. Genitourinary tuberculosis in pediatric surgical practice. J. Pediatr. Surg. 1997, 32, p. 1283-1286.
6. Chuang, F.R., Lee, C.H., Wang, I.K. et al. Extrapulmonary tuberculosis in chronic hemodialysis patiens. Ren. Fail. 2003, 25, p. 739-746.
7. Ferrie, B.G., Rundle, J.S. Genitourinary tuberculosis in patients under twenty-five years of age. Urology 1985, 25, p. 576–578.
8. Queipo, J.A., Broseta, E., Santos, M. et al. Mycobacterial infection in a series of 1261 renal transplant recipients. Clin. Microbiol. Infect. 2003, 9, p. 518-525.
9. Lenk, S., Schroeder, J. Genitourinary tuberculosis. Curr. Opin. Urol. 2001, 11, p. 93-98.
10. Ptáková, M., Klamo, J., Dvořáček, J. Problematika diagnostiky urogenitální tuberkulózy ve vztahu k legislativě. Urologie pro praxi 4, 2003, 2, s. 66-68.
11. Hemal, A.K., Gusta, N.P., Rajeev, T.P. et al. Polymerase chain reaction in clinically suspected genitourinary tuberculosis: comparison with intravenous urography, bladder biopsy, and urine acid fast bacilli culture. Urology 2000, 56, p. 570-574.
12. Missirliu, A., Gasman, D., Vogt, B. et al. Genitourinary tuberculosis: rapid diagnosis using the polymerase chain reaction. Eur. Urol. 1996, 30, p. 523-524.
13. Moussa, O.M., Eraky, I., El-Far, M.A. et al. Rapid diagnosis of genitourinary tuberculosis by polymerase chain reaction and non-radioactive DNA hybidisation. J. Urol. 2000, 164, 2, p. 5, 84-88.
14. Fischetti, G., Lombardo, G., Barrese, F. et al. Tb Test in the diagnosis of „closed“ tuberculosis of the urinary tract. Minerva Urol. Nephrol. 1999, 51, 4, p. 197-201.
15. Gow, J.G. Tuberculosis: genitourinary tuberculosis. Br. J. Hosp. Med. 1979, 22, p. 556-568.
16. Kao, S.C., Fang, J.T., Tsai, C.J. et al. Urinary tract tuberculosis: a 10-year experience. Changgeng Yi Xue Za Zhi 1996, 19, 1, p. 1-9.
17. Flechner, S.M., Gow, J.G. Role of nephrectomy in the treatment of non functioning or very poorly functioning unilateral tuberculous kidney. J. Urol. 1980, 123, p. 822-825.
18. Loffler, U., Berndt, A., Kosmehl, H. et al. An unusual case of genital tuberculosis. A case report. Urologe A 1999, 38, 1, p. 60-64.
19. Joual, A., Rabii, R., Guesson, H. et al. Isolated testicular tuberculosis: report of a case. Ann. Urol. (Paris) 2000, 34. 3, p. 192-194.
20. Wolf, J.S., McAninch, J.W. Tuberculous epididymo-orchitis: diagnosis by fine needle aspiration. J. Urol. 1991, 145, 4, p. 836-838.
21. Moon, S.Y., Kim, S.H., Jee, B.C. et al. The outcome of sperm retrieval and intacytoplasmic sperm injection in patinets with obstructive azoospermia: impact of previous tuberculous epididymitis. J. Assist. Reprod. Genet. 1999, 16, 8, p. 431-435.
22. Narayana, A.S., Kelly, D.G., Duff, F.A. Tuberculosis of the penis. Br. Urol. 1976, 48, p. 274.
23. Angus, B.J., Yates, M., Conlon, C., Byreen, I. Cutaneous tuberculosis of the penis and sexual transmission of tuberculosis confirmed by molecular typing. Clin. Infect. Dis. 2001, 33, 11, p. 132-134.
24. Raghavaiah, N.V. Tuberculosis of the male urethra. J. Urol. 1979, 122, p. 417-418.
25. Christensen, W.I. Genitourinary tuberculosis: review of 102 cases. Medicine (Baltimore) 1974, 53, 5, p. 377-390.
26. Popkova, G.G., Aksenova, V.A. Clinical and epidemiological characteristics of renal tuberculosis in children and adolescents. Probl. Tuberk. 2003, 1; p. 39-42.
27. Centers for Disease Control and Prevention, 2000 (http://www.cdc.gov).
28. Chan, S.W., Shalhav, A.L., Clayman, R.V. Renal tuberculosis presenting as lateralizing hematuria diagnosis by ureterorenoscopy and selective upper tract urine culture. Endourol. 1998, 12, p. 363-364.
29. Carl, P., Stark, L. Indications for surgical menagement of genitourinary tuberculosis. World J. Surg. 1997, 21, p. 505-510.
30. Rizzo, M., Ponchietti, R., Di Loro, F. et al. Twenty-years experience on genitourinary tuberculosis. Arch. Ital. Urol. Androl. 2004, 76, p. 83-87.
31. Shin, K.Y., Park, H.J., Lee, J.J. et al. Role of early endourologic management of tuberculous ureteral strictures. J. Endourology 2002, 16, 10, p. 755-758.
32. Osterhage, H.R., Fischer, V., Hanbensak, K. Positive histological tuberculous findings, despite stable sterility of the urine on culture. Eur. Urol. 1980, 6, p. 116.
33. Fischer, M., Flamm, J. The value of surgical therapy in the treatment of urogenital tuberculosis. Urologe A 1990, 29, p. 261-264.
34. Allen, F.J., deKock, M.L. Genitourinary tuberculosis-experience with 52 urology inpatients. S. Afr. Med. J. 1993, 83, 12, p. 903-907.
35. Murphy, D.M., Fallon, B., Lane, V., O´Flynn, J.D. Tuberculous stricture of ureter. Urology 1982, 20, p. 382.
36. Kolombo, I., Berndt, D., Pabišta, R. TBC v ordinaci urologa – stále aktuální téma. Urologie pro praxi 2003, 6, s. 251-253.
37. Centers for Disease Control and Prevention. Guidelines for the investigation of contacts of persons with infectious tuberculosis and Guidelines for using the QuantiFERON®-TB Gold test for detecting Mycobacterium tuberculosis infection, UnitedStates. MMWR 2005; 54 (No. RR-15). Dostupné na http://www.cdc.gov/mmwr/PDF/rr/rr5415.pdf.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 3-
All articles in this issue
- Excessive body weight, eating habits and dietary trends in adolescents
- WHO International Classification of Functioning, Disability and Health as the tool for modern rehabilitation
- Combined chelation treatment in patients with myelodysplastic syndrome and hereditary hemochromatosis – a case study
- Professional non-immunological asthma
- Endoscopic cytoscopy – a new method for investigation of the gastrointestinal tract
- Interrelationship between obesity and osteoarthritis
- Genitourinary tuberculosis – current state
- Visual cognition and its disorders
- The convergence between neurological and psychogenic etiopathogenesis and the possibilities of psychotherapy.
- The importance of oral hygiene in the prevention of plaque induced oral cavity diseases
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Genitourinary tuberculosis – current state
- The convergence between neurological and psychogenic etiopathogenesis and the possibilities of psychotherapy.
- The importance of oral hygiene in the prevention of plaque induced oral cavity diseases
- Combined chelation treatment in patients with myelodysplastic syndrome and hereditary hemochromatosis – a case study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

