-
Medical journals
- Career
Vztah klinického obrazu a neurobiologie vaskulárních demencí
: F. Koukolík
: Primář: MUDr. František Koukolík DrSc. ; Národní referenční laboratoř prionových chorob ; Fakultní Thomayerova nemocnice s poliklinikou, Praha ; Oddělení patologie a molekulární medicíny
: Prakt. Lék. 2008; 88(1): 17-21
: Various Specialization
O vaskulárních demencích (VD) se píše více než 450 let, přesto se o jejich epidemiologii, klinickém obrazu a patogenezi v současnosti debatuje více než kdy jindy. Při výzkumu se užívá několik druhů klinických diagnostických kritérií (MKN-10, DSM-IV, NINCDS-AIREN, ADDTC), která však ve stejných souborech identifikují různé, jen částečně se překrývající skupiny nemocných. Senzitivita a specificita těchto kritérií není příliš vysoká a výsledky nelze vzájemně přenášet. Situaci komplikuje velmi častý výskyt Alzheimerovy nemoci, která se s VD často kombinuje. VD je podobně jako Alzheimerova nemoc klinické a neuropatologické kontinuum, má jak podprahová, tak klinicky vyvinutá stádia, v jejichž průběhu se vyjadřuje možná a pravděpodobná diagnóza. Definitivní diagnóza VD je neuropatologická, nicméně jednotlivá pracoviště užívají odlišné diagnostické postupy, takže výsledky jsou rovněž obtížně reprodukovatelné. Nejčastějším neuropatologickým substrátem VD je kombinace trombotické embolizace do mozku, aterosklerotického postižení extracerebrálních tepen a arteriolosklerózy (lipohyalinóza, mikroangiopatie) intracerebrálních tepen. Důsledkem jsou malé a velké infarkty mozkové tkáně, lakunární stav, klinicko patologická jednotka pojmenovaná Binswangerova nemoc. Vzácnějšími příčinami jsou mozková cévní amyloidóza ve sporadické i familiární podobě, CADASIL a vaskulitidy. Je nutné mít na mysli, že cerebrální amyloidóza doprovází 90 % případů Alzheimerovy nemoci, takže cévní poškození mozku je součástí i tohoto onemocnění. Poruchy chování při VD jsou podmíněny ložiskovým poškozením kůry a bílé hmoty. Projevují se jak neurologické ložiskové příznaky, tak kontinuum poškození kognitivních funkcí, zejména řídících funkcí čelních laloků, paměti, orientované pozornosti a praxie.
Klíčová slova:
vaskulární demence, epidemiologie, patogeneze, diagnostická kritéria, vztah mozku a chování.Úvod
Jaso de Gratis vydal roku 1549 v Bazileji knihu De cerebri morbis. Je v ní kapitola o cévních mozkových příhodách (De apoplexia), hned za ní následuje kapitola o demenci (De detrimento memore). Při dobré vůli lze obě kapitoly považovat za úsvit pojmu vaskulární demence. Otto von Binswanger a Alois Alzheimer uveřejnili na přelomu 19. a 20. století sérii prací, na jejichž základě roku 1910 vydělil Emil Kraepelin „arteriosklerotickou psychózu“. Odlišil ji progresivní paralýzy a presenilní a senilní „neurodegenerativní“ demence.
Binswangerova klasická práce (1893) je založena na přesném klinickém popisu a makroskopickém vyšetření mozku, neurohistologické vyšetřování je dílem Alzheimerovým. Popis obou autorů zahrnující spektrum charakteristických změn je viděno současnýma očima natolik přesný, že se k němu v této úrovni vyšetřování dá dodat jen málo. Pojem „arteriosklerotická demence“, „arteriosclerosis cerebri“, „mozková skleróza“ v průběhu 20. století přešel do folklóru, přičemž první má s realitou společného málo, další dva vůbec nic.
Teprve r. 1976 dokázal Katzman, že příčinou většiny případů demence ve stáří je Alzheimerova nemoc. Následující výzkum dokázal, že podkladem vaskulární demence je spektrum tepenných změn aterosklerotického a arteriosklerotického typu, kromě toho může mít četné další, byť vzácnější nearteriosklerotické příčiny (4). V současné době nahrazují brusiči pojmosloví název vaskulární demence pojmem vaskulární kognitivní léze (VCI, vascular cognitive impairment), čímž mají na mysli „široké spektrum změn kognitivních funkcí a chování spjaté s patologickými změnami cév. Spektrum charakterizuje alespoň v populacích účastnících se klinických studií specifický kognitivní profil s poškozením převážně řídících funkcí a orientované pozornosti doprovázený určitými non-kognitivními změnami, zvláště depresí a poměrně stabilním průběhem“ (9,10).
Epidemiologie, diagnostika, rizikové faktory vaskulární demence
Incidence a prevalence vaskulární demence je odvislá na užitých diagnostických kriteriích. Nejsou jednotná. Nejčastěji se užívají čtyři typy:
- DSM IV,
- ADDTC,
- NINCDS-AIREN,
- MKN-10 (4).
Senzitivita a specificita kritérií jednotlivých klasifikací se odlišují. Výsledky nelze vzájemně převádět. Nejrozšířenější jsou kritéria NINCDS-AIREN (National Institute of Neurological Disorders and Stroke – Association International pour la Recherche et l’Enseignement en Neuro-sciences, tab. 1).
1. Diagnostická kritéria vaskulární demence NINCDS-AIREN 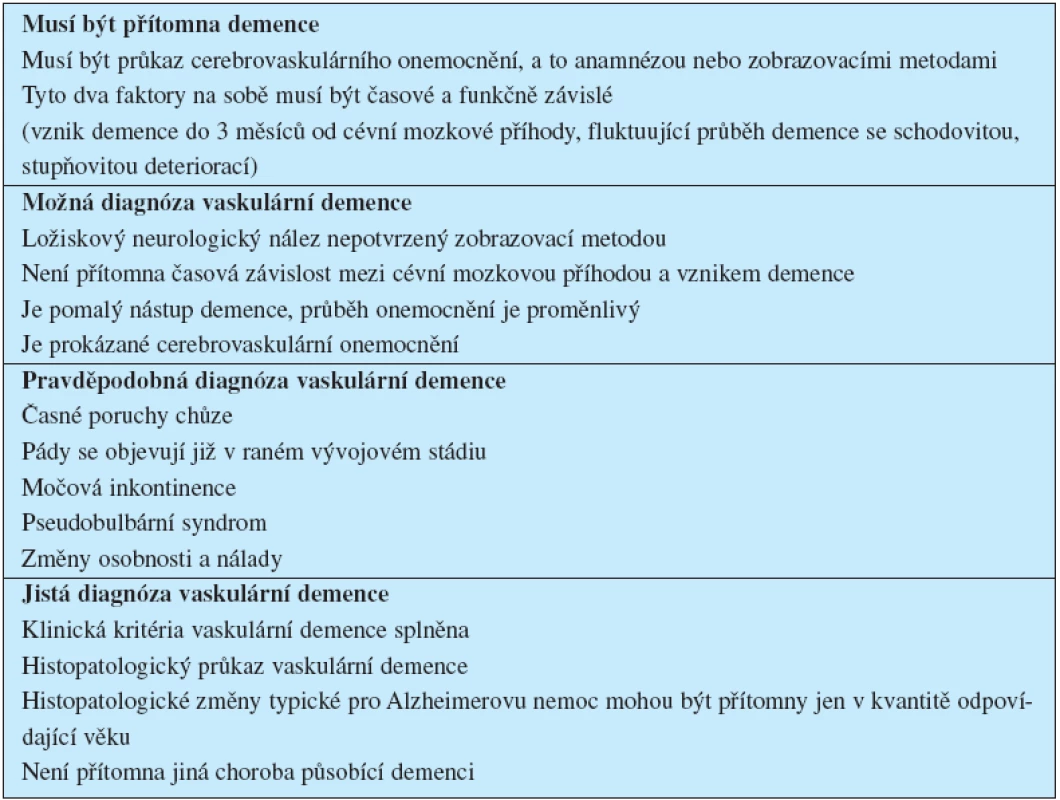
Lopez et al. porovnali výsledky užití kritérií DSM-IV, NINCDS-AIREN a ADDTC v souboru 480 následných pacientů (7). Klinická diagnóza před vyšetřením mozku magnetickou rezonancí (MR) prokázala vaskulární demenci (VD) u 52 nemocných, kombinaci vaskulární demence a Alzheimerovy nemoci, neboli smíšenou demenci, u 76 nemocných. Po vyšetření mozku MR byla užita:
- kritéria DSM-IV na jejichž základě byla v tomto souboru diagnostikována VD u 61 nemocných,
- kritéria NINCDS-AIREN na jejichž základě bylo v tomto souboru určeno 43 nemocných s možnou VD a 10 nemocných s pravděpodobnou VD (tj. komplikovanou dalšími onemocněními, definitivní diagnóza VD je stejně jako v případě Alzheimerovy nemoci neuropatologická),
- kritéria ADDTC, na jejichž základě bylo v tomto souboru určeno 117 nemocných s možnou VD a 96 nemocných s pravděpodobnou VD.
V další studii autoři sledovali po dobu 5,5 let incidenci a typ demence 3 375 pacientů, u nichž bylo provedeno vyšetření mozku MR v době, kdy ještě nebyli dementní. K diagnóze VD byla užita kritéria ADDTC a NINCDS-AIREN, k diagnóze Alzheimerovy nemoci (AN) kritéria ADRDA (4).
Kritéria ADDTC v tomto souboru určila z celkové incidence 480 případů demence 213 případů (44 %) VD. K bezpečnějšímu rozlišení AD a VD je nutné užít vyšetření MR, jinak snadno dojde k diagnostické záměně (6).
Ke stejnému závěru dospěla nová studie podrobně vyšetřených 107 pacientů. K diagnóze byla užita kritéria MKN 10, DSM III, DSM IV, ADDTC a NINCDS-AIREN. Naprosto všechna kritéria diagnózy VD byla splněna jen u 31 pacientů, u zbylé části byla naplněna jen některá. Počet případů VD se líšil podle toho, jaká kritéria byla užita. Podle DSM III jich v tomto souboru bylo 39, podle ADDTC 35, podle NINCDS-AIREN 39 a podle DSM IV plných 98 (12).
Diagnostická senzitivita jednotlivých kritérií je kolem 50 %, specificita se udává v rozsahu 64–98 %. Prevalence VD v autoptických sériích je 8–15%, v Japonsku je vyšší, 22–35 % (3). Z toho plyne, že při interpretaci incidence a prevalence VD je nutné vždy vědět, která diagnostická kritéria byla užita. Užívaná kritéria totiž ve stejném souboru neidentifikují totožné skupiny pacientů. Situaci znejasňuje velmi častý výskyt Alzheimerovy nemoci, která má také „svou“ cévní složku podmíněnou amyloidovou angiopatií.
S vědomím těchto zásadních metodologických problémů plyne ze současných epidemiologických dat, že incidence a prevalence VD roste s věkem, prevalence VD je vyšší u mužů a mezi jednotlivými státy existují co do prevalence a incidence velké rozdíly. Například Kungsholmen projekt, longitudinální epidemiologická studie VD, dokazuje u mu-žů ve věkovém rozmezí 75–90 let růst pre-valence VD z hodnoty 1,5 % na 11,1 %, u žen z 1,3 % na 7,7 %. Incidence VD u mužů ve věkové skupině 75–89 let rostla z 3,1 % na 12,5 %, u žen ve věkové skupině 75–90 let rostla z 2,4 % na 4,5 % (4).
Rizikové faktory pro vznik VD jsou hypertenze, srdeční onemocnění, hypercholesterolémie, diabetes mellitus, cévní mozková příhoda, hypertriglyceridémie, obezita, kouření, závislost na alkoholu a nedostatek pohybu. U většiny pacientů se prokazuje více než jeden rizikový faktor (15).
V retrospektivní studii 8 845 pacientů vyšetřovaných ve věkovém rozmezí 40–44 let v letech 1964–1973, bylo v rozmezí let 1994–2003 zjištěno 721 případů demence (8,2 %). Kouření, hypertenze, hypercholesterolémie a cukrovka ve věku 40–44 let zvyšuje riziko vývoje demence ve stáří o 20–40 %. V porovnání s pacienty, kteří nebyli zatíženi žádným z těchto rizikových vlivů, roste riziko demence při zátěži jedním rizikem 1,27x, všemi čtyřmi riziky 2,37x. Sloučení všech těchto čtyř rizikových vlivů do jednoho faktoru odhalilo, že vývoj demence odpovídá jeho velikosti: čím vyšší velikost faktoru, tím pravděpodobnější vývoj demence.(16).
Podobně zvyšuje riziko pozdější VD vyšší index tělesné hmotnosti. Riziko VD lidí obézních ve středním věku 40–45 let (index tělesné hmotnosti větší než 30) bylo o 30 let později v porovnání s nor-mou pětinásobné. Riziko Alzheimerovy nemoci bylo také vyšší, a to 3,1x. Nižší index tělesné hmotnosti znamenal nižší riziko pro obě onemocnění (17).
Zkušenost však říká, že vysvětlovat kuřákům, hypertonikům a obézním lidem ve středním věku, že o 30 let později riskují VD, bývá bez efektu. Pro mnohé může být přívětivou zprávou, že mírné požívání alkoholu, do 15 g/den, v tomto případě převážně italského vína, může vývoj demence zpomalovat (14).
Neurobiologie vaskulárních demencí
Nejužívanější klasifikace NINCDS-AIREN rozlišuje:
- demenci při mikroangiopatii, do jejíhož rámce spadá Binswangerova nemoc, mnohočetné lakuny, leukoencefalopatie a amyloidová angiopatie,
- demenci při strategicky umístěném infarktu, například řečově dominantní hemisféry, dále při oboustranném infarktu thalamu nebo předních částí bazálního telencefala, kde jsou nc. originis cholinergního systému mozku,
- multiinfarktovou demenci danou početnými „malými i většími infarkty“ mozkové tkáně a demenci, která je důsledkem mozkové hypoperfúze, například po srdeční zástavě, při krajní hypotenzi nebo rozsáhlejší ischémii hraničních oblastí cévního zásobení mozku,
- demenci v důsledku jiných cévních mechanismů (například při vaskulitidě), demenci vzniklou kombinací výše uvedených mechanismů nebo mechanismů neznámých (13).
Mozkový infarkt jsou různě velká ložiska ischemické nekrózy, která se postupně vyvíjejí do postmalatické pseudocysty. Minimální arbitrární rozměr infarktu je 10 mm.
Lakunární infarkty (lakuny) jsou postmalatické pseudocysty, jejichž průměr je menší než 10 mm. Větší počet lakun obvykle v bazálních gangliích a/nebo v mozkovém kmeni tradice nazývá status lacunaris. Cribra jsou naproti tomu dutinky vznikající mechanicky pulzací drobných tepének, takže v dutince se obvykle tepénky najdou. Při velkém výskytu mluví tradice o status cribrosus (obr. 1).
1. Lakuny (větší dutinky) a cribra (menší dutinky) bazálních ganglií. Lakuna je postmalatická pseudocysta do průměru 10 mm. Cribrum je dutinka vytvořená mechanicky pulzem tepének. 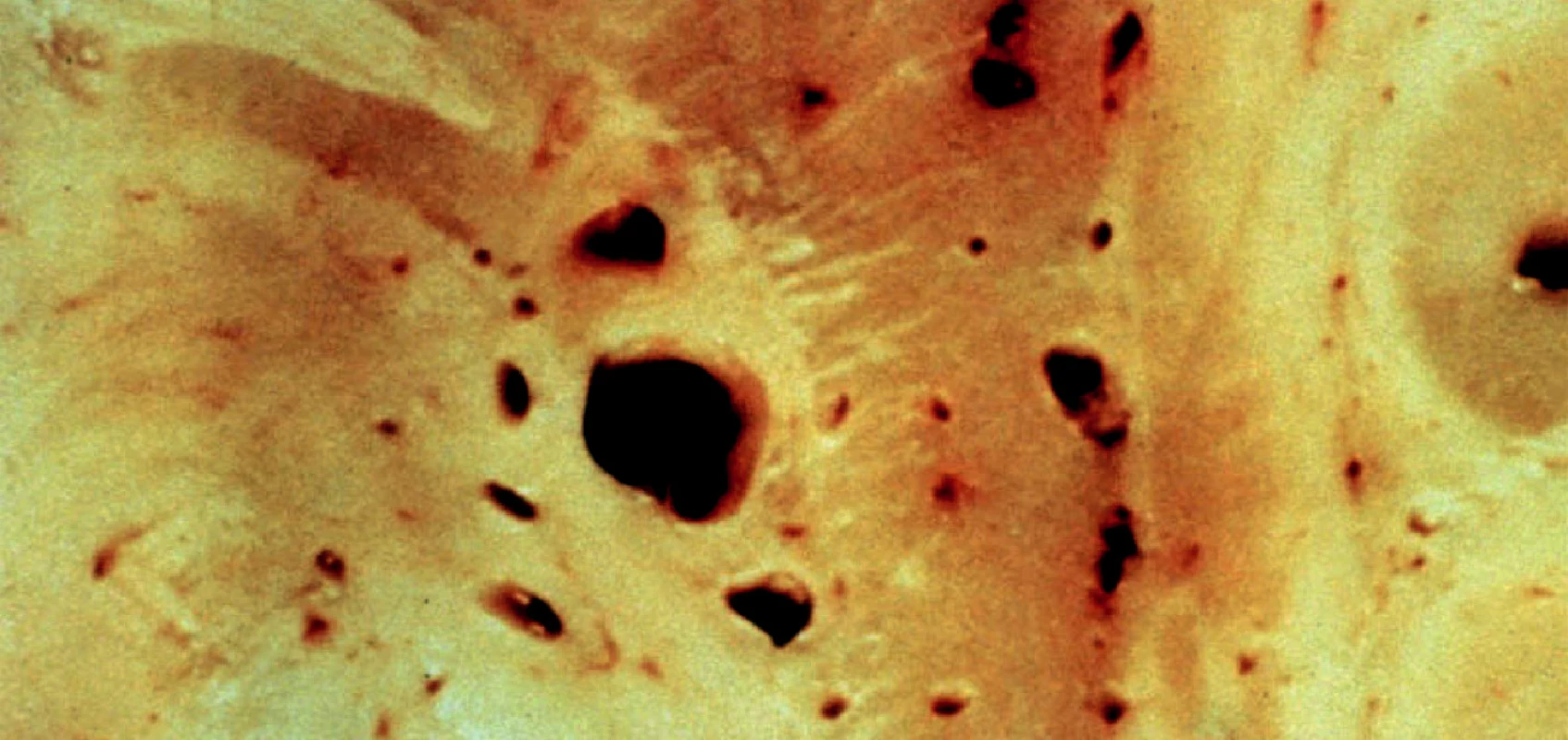
Mikroinfarkty jsou ložiska ischemické nekrózy obvykle klínovitá, patrná mikroskopicky v mozkové kůře.
Aterosklerotické změny extracerebrálních tepen (large vessel disease) odpovídají stupňovitému vývoji arteriosklerózy.
Arteriolosklerotické změny intracerebrálních tepen (synonyma: small vesel disease, mikroangiopatie, lipohyalinóza) mají dvě formy: jednak fibrotické ztluštění stěny tepének s průsvitem 10–700 m (obr. 2), jednak ložiskové nekrózy, tzv. fibrinoidní, ty postihují penetrující tepénky s průsvitem 100–400 m a někdy se podaří v jejich stěně najít mikroaneurysmata.
2. Lipohyalinóza (neboli arterioloskleróza, small vesel disease, mikroangiopatie). Cerebrální amyloidovou angiopatie odliší speciální barvení nebo imunohistochemická reakce. (Zv. x 200, barvení H.E). 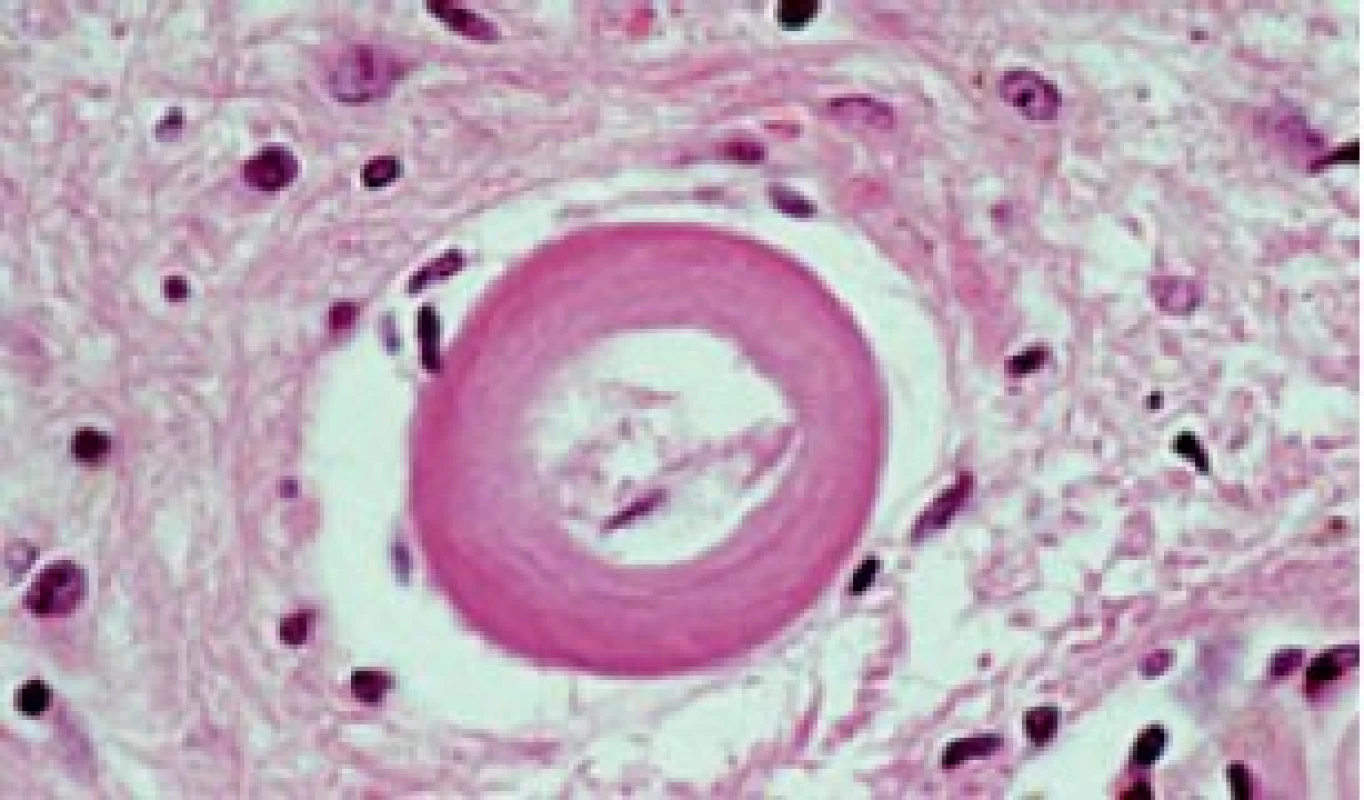
Leukoaraióza (synonyma: periventrikulární leukoencefalopatie) je popisný neuroradiologický pojem, jenž označuje „projasnění“ periventrikulární bílé hmoty mozku bez projasnění bílé hmoty sousedících závitů a rýh a bez ohledu na etiologii (obr. 3). Doprovází tedy jak VD, tak Alzheimerovu nemoc a další onemocnění. Substrátem je „palor“, neboli vyblednutí bílé hmoty v histologickém obrazu, status cribrosus a rozšíření Virchowových-Robinových perikapilárních prostorů. V postižených místech jsou myelinové pochvy dystrofické, mohou chybět, axony se rozpadají, glióza je různého stupně, někdy proliferuje astroglie. Postižení poznávacích funkcí do jisté míry odpovídá stupni leukoaraiózy. U dementních pacientů s leukoaraiózou je v postižených oblastech nápadná numerická atrofie kapilár, která se však u těchto pacientů prokazuje i v místech, kde leukoaraiosa není (2).
3. Leukoaraiózu v obrazu MR prozradí „projasnění“ periventrikulární bílé hmoty. Leukoaraióza je popisný neuroradiologický pojem označující poškození bílé hmoty z jakýchkoli důvodů, doprovází tedy jak VD, tak Alzheimerovu nemoc. Kognitivním poruchám odpovídá leukoaraióza jen do jisté míry, obvykle při těžším postižení. 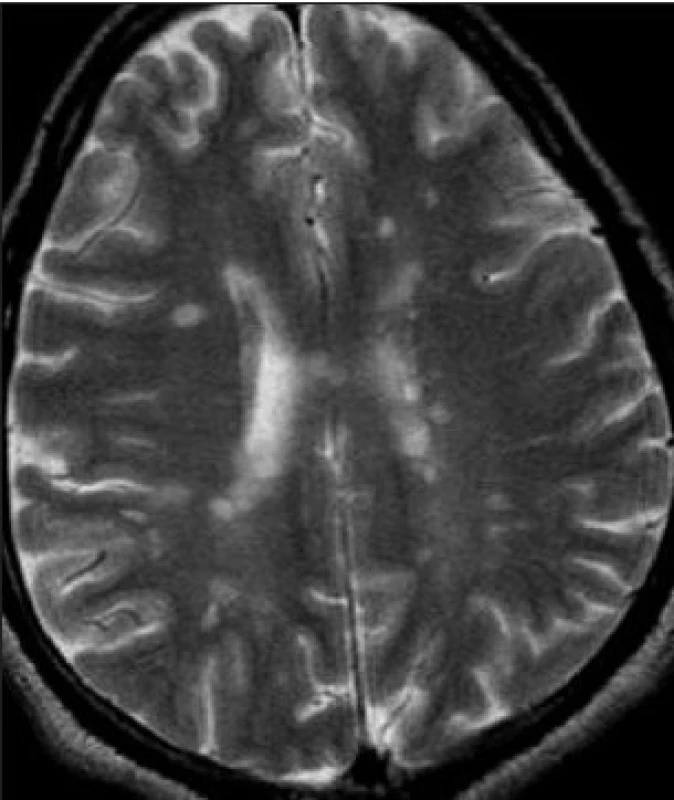
Multiinfarktová demence vyznačující se mnohočetnými „malými a velkým infarkty“ postihujícími kůru i podkorové oblasti mozku se dnes považuje za součást kontinua změn při VD s tím, že kritický objem poškozeného mozku původně udávaný 100 ml může být u některých postižených i poloviční.
Opačným pólem kontinua je Binswangerova nemoc, při které je makroskopický nález zcela nenápadný, pravděpodobně proto až do zavedení zobrazovacích metod toto velmi časté postižení mozku pozornosti patologů unikalo. V souboru 132 mužů a 212 žen, kteří zemřeli ve věkovém rozmezí 60–99 let pitvaných podle principu epidemiologické autopsie, bylo zjištěno 7,8 % nemocných s touto chorobou (5).
Charakteristickou změnou je výše popsaná mikroangiopatie, ložisková, někdy difúzní demyelinizace bílé hmoty hemisfér a corpus callosum, zbylé myelinové pochvy jsou zduřelé. Typické je zachování povrchových asociačních U vláken. Onemocnění doprovází v různém stupni cribrosní a lakunární stav bazálních ganglií, někdy i kmene a korové mikroinfarkty.
Poškození bílé hmoty je důsledkem hypoperfúze podmíněné ve více než 90 % případů hypertenzivní angiopatií. Mikroembolizace jsou vzácné.
Podobně jako v případě Alzheimerovy nemoci je diagnóza VD pravděpodobná, pravděpodobná a jistá, ta je neuropatologická (viz. tab. 1). Problémem je, že různá neuropatologická pracoviště užívají rozmanité postupy, takže jejích výsledky nebývají úplně reprodukovatelné.
Příkladem distribuce v jednotlivých změn v neuropatologickém kontinuu, které je korelátem VD, mohou být výsledky švédské prospektivní autoptické studie probíhající v letech 1976–1995. Studie zastihla 175 případů VD. Pouze 49 z nich bylo „čistých“, s jediným typem cerebrovaskulární léze a bez alzheimerovských změn. V 7 případech této skupiny bylo zjištěno těžké poškození extracerebrálních tepen, v 36 případech postižené mozkových tepének, 6 nemocných utrpělo hypoxemickou hypoperfúzní příhodu. Ve zbylých 126 případech byl zastižen víc než jeden druh cerebrovaskulárního poškození a k tomu alzheimerovské změny: neuritické plaky a neuronální klubka. Hypoxemická-hypoperfúzní příhoda byla zjištěna v 55 případech, těžké postižení extracerebrálních tepen u 50 pacientů a postižením mozkových tepének u 110 nemocných. Celkem 87 % všech případů s hypoxemicko-hypoperfúzní příhodou mělo v mozku rovněž alzheimerovské změny (1).
Praktické poučení: u starších lidí je nutné za každou cenu zabraňovat hypoxemicko-hypoperfúzním příhodám, zejména v průběhu celkové anestézie, jinak jsou důsledkem kognitivní poruchy, někdy hluboké a obtížně zvratné. Postižena je zejména autobiografická paměť.
Mozková, též cerebrální amyloidová angiopatie (CAA) je dána ukládáním amyloidu do stěn mozkových tepen, tepének, případně do kapilár a vén (obr. 4). Po hypertonické nemoci je nejčastější příčinou mozkového krvácení.
4. Mozková amyloidová angiopatie. Imunohistochemická reakce prozrazující bamyloid. (Zv. x 400, barveno protilátkou proti b-amyloidu). 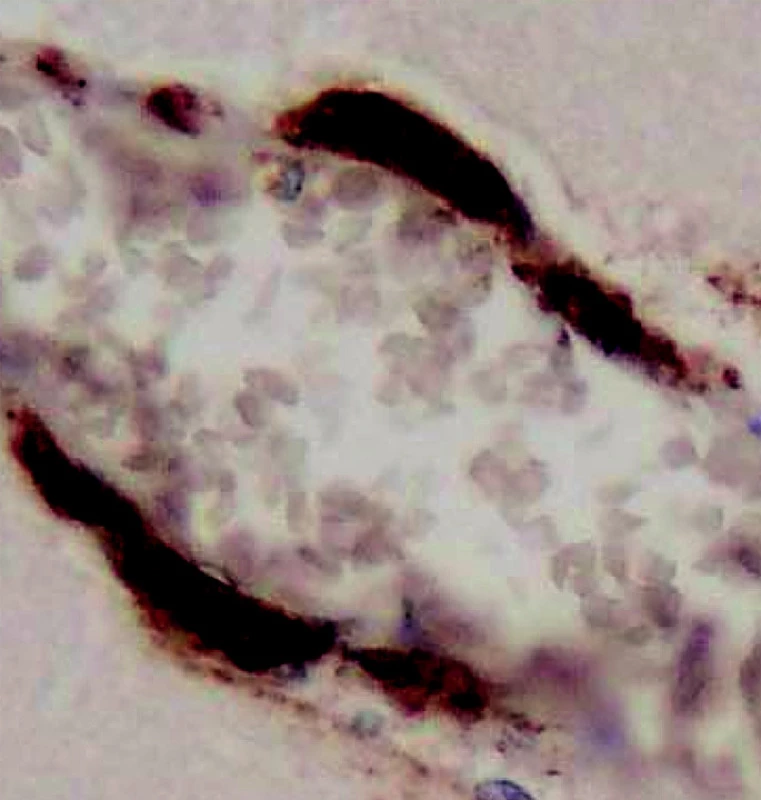
Má dvě sporadické a několik typů familiárních forem.
Sporadická forma doprovází stárnutí mozku a nalézá se v 90 % případů Alzheimerovy nemoci, to se ukládá b-amyloid. (11, 4). Při první a druhý typ sporadické CAA odlišuje ukládání amyloidu v kapilárách, to se při druhém typu neprokazuje. V obou typech společně jsou pak postiženy tepny včetně leptomeningeálních, tepénky, venuly a vény. U pacientů s prvním typem CAA je čtyřikrát vyšší frekvence alely genu APOE-4.
Vzácné, nicméně molekulárně geneticky s neuropatologicky velmi zajímavé jsou klinicky s ohledem na krvácení do mozku katastrofické familiární amyloidózy postihující CNS:
- hereditární cerebrální krvácení s amyloidózou islandského typu,
- hereditární cerebrální krvácení s amyloidózou holandského typu,
- meningovaskulární amyloidóza,
- familiární amyloidóza finského typu,
- dánská a britská familiární demence (11, 4).
CADASIL je rozšířená zkratka pojmu cerebrální autosomálně dominantní arteriopatie se subkortikálními infarkty a leukoencefalopatií, zřejmě častější, než se má za to. Onemocnění se projevuje ve středním věku, Diagnosticky charakteristické jsou cévní změny: ve všech případech se najde hyalinní degenerace stěny mozkových a meningeálních cév doprovázená ztluštěním, fragmentací a zdvojo-váním lamina elastica interna, subendotelová proliferace, někdy fibrinoidní nekróza intimy (obr. 5). Nápadné a typické je ukládání granulární materiálu v medii malých tepen, ten je v obrazu elektronového mikroskopu charakteristický. Příčinou onemocnění jsou malé delece, jednotlivé missense a další typy mutací genu NOTCH-3. Předpokládá se, že normální signalizace Notch-3 tlumí apoptózu buněk hladké svaloviny tepének. Právě tato změna odlišuje CADASIL od Binswangerovy nemoci, nemusí však být nalezena ve všech případech. CADASIL je možné diagnostikovat imunohistochemicky z kožní biopsie monoklonálními protilátkami proti transmembranóznímu receptoru Notch-3.
5. Charakteristické poškození mozkové tepénky pfii CADASIL. Stejné poškození se dá zachytit v kožní biopsii, kde lze dospět k jednoznačné diagnóze imunohistochemické užitím protilátky proti receptoru Notch-3. (Zv. x 200, barveno H.E.) 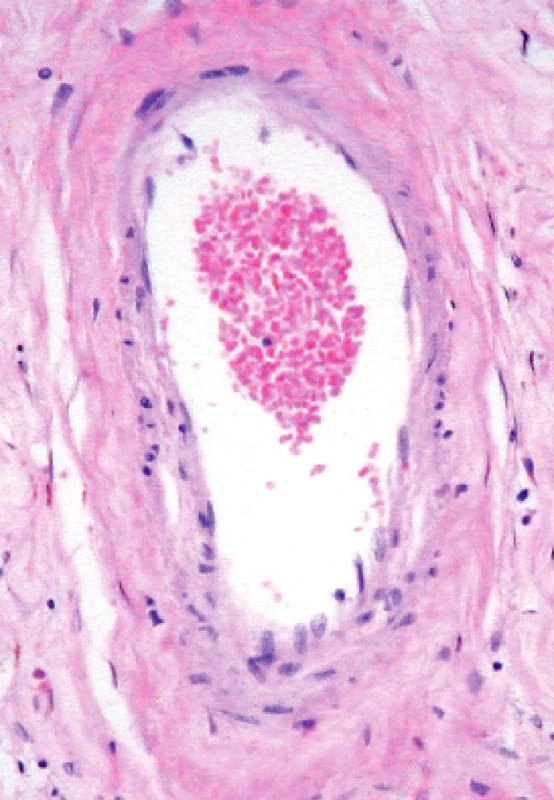
Vaskulární demence jako vztah mozku a chování
Pestrý a individuální obraz vývoje možné a pravděpodobné VD je podmíněn tempem vývoje a rozsahem ložiskových i difúzních změn z kontinua neuropatologického obrazu. Jestliže v patogenezi převažují mnohotné obvykle následné „malé a větší infarkty“, pak jsou v anamnéze i v současnosti ložiskové neurologické a neuropsychologické příznaky. Stává se, že za demenci je považována afázie podmíněná náhlou cévní příhodou v akutním vývojovém stadiu doprovázeném zmateností. Podobně bývá za demenci považován syndrom opomíjení (neglect) jehož příčinou je poškození parietální pravostranné kůry v oblastech integrujících zrakové a prostorové informace.
Poměrně časté bývá kupení lakun v bílé hmotě čelních laloků mozku, aniž by byly příliš poškozeny další mozkové oblasti. Důsledkem je porucha řídících neboli exekutivních funkcí. Poškození dorzolaterálního prefrontálního subkortikálního obvodu způsobí poruchu motorického programování, plánování pohybů, vybavování z paměti, tvorbu domněnek, poruší zachovávání a přesouvání myšlenkových setů, naruší tlumení sociálně nežádoucího chování i detekci nových podnětů, což je podkladem apatie.
Poškození orbitofrontálního a mediálního prefrontálního subkortikálního obvodu je příčinou změn osobnosti, poklesu svědomitosti, iniciativy a zájmu, podrážděnosti, beztaktnosti, mohou se objevit hypomanické příznaky. Poškození gyrus cinguli a jeho zapojení je podle kvantity a lokalizace příčinou poruchy systému orientované pozornosti, jestliže je poškozena přední část závitu, při oboustranné lézi předních částí se objevuje kinetický mutismus, dále jsou poruchy afektivity, vokalizace, odpovědi na bolestivé podněty, při rozsáhlejším poškození je apatie, desinhibice, deprese, úzkost, obsedantně-nutkavé projevy, někdy hypersexualita a bulimie. Poškození bílé hmoty zejména levého čelního laloku může být příčinou tak těžké a terapeuticky obtížně zvládnutelné deprese ve stáří, že se obtížně odlišuje od demence. Mluví se o demenci při depresi (8).
Difúzní poškození „binswangerovského“ typu se kromě poškození kognitivních funkcí často projevuje šouravou chůzí malými krůčky, inkontinencí moči. Podstatný podíl případů normotenzního hydrocefalu ve vyšším věku, který neodpovídá na terapii shuntem, je podmíněn Binswangerovou nemocí.
MUDr. František Koukolík, DrSc.
Oddělení patologie
a molekulární medicíny
Národní referenční laboratoř
prionových chorob
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4 Krč
E-mail: frantisek.koukolik@ftn.cz
Sources
1. Andin, U., Gustafsson, L., Passant U. et al. A clinico-pathological study of heart and brain lesion in vascular dementia. Dementia and Geriatric Cognitive Disorders 2005, 19, p. 222-228.
2. Brown,W.R., Moody, D.M., Thore, C.R. et al. Vascular demenita in leukoaraiosis may be consequence of capillary loss not only in the lesions, but in normal appearing white matter and cortex as well. J. Neurol. Sci. 2007, 257, p. 62-66.
3. Jellinger, K.A. The enigma of vascular cognitive disorder and vascular dementia. Acta Neuropathol. (Berl.) 2007; 114, p. 349-388.
4. Jirák, R., Koukolík, F. Demence. Neurobiologie, klinický obraz, terapie. Praha: Galén, 2004. 335 s. ISBN 80-7262-268-4.
5. Koukolík, F., Neubertová, E. Epidemiologická autopsie Binswangerovy nemoci. Čas. lékařů českých 1997, 136, s. 181-185
6. Kuller, L.H., Lopez, O.L., Jagust, W.J. et al. Determinants of vascular dementia in the cardiovascular health cognition study. Neurology 2005, 64, p. 1548-1552.
7. Lopez, O.L., Kuller, L.H., Becker, J.T. et al. Classification of vascular dementia in the Cardiovascular Health Cognition Study. International Psychogeriatrics 2003, 15, p. 47-52.
8. Motlová, L., Koukolík, F. Citový mozek. Neurobiologie, klinické poruchy, terapie. Praha: Galén 2007 (v tisku).
9. O’Brien, J.T. Vascular cognitive impairment. Am. J. Geriatr. Psychiatry 2006, 14, p. 724-733.
10. O’Brien, J.T. Vascular cognitive impairment. International Psychogeriatrics 2002, 14, p. 239-248.
11. On-line Mendelian Inheritance in Man (OMIM). Dostupné na http://www.ncbi.nlm.nih.gov/ sites/entrez?db=OMIM.
12. Pohjasvaara, T., Mäntylä, R., Ylikoski, R. et al. Comparison of different clinical criteria (DSM-III, ADDTC, ICD-10, NINCDS-AIREN, DSM-IV) for the diagnosis of vascular dementia. Stroke 2000, 31, p. 2952-2957.
13. Roman, G.C., Tatemichi, T.K., Erkinjutti, T. et al. Vascular dementia: diagnostic criteria for research studies: report of NINCDS-AIREN international workshop. Neurology 1993, 43, p. 250-260.
14. Solfrizzi, V., D’Introno, A., Colacicco, A.M. Alcohol consumption, mild cognitive impairment, and progression to dementia Neurology 2007, 68, p. 1790-1799.
15. Stella, F., Banzato, C.E., Gasparetto, S.A., et al. Risk factor for vascular dementia in elderly psychiatric outpatients with preserved cognitive functions. J. Neurol. Sci. 2007, .257, p. 247-249.
16. Whitmer R.A., Sydney, S., Selby, J. et al. Midlife cardiovascular risk factor of dementia in late life. Neurology 2005, 64, p. 277-281.
17. Whitmer, R.A,., Gunderson, E.P., Quesenberry, Ch.P. et al. Body mass index in midlife and risk of Alzheimer disease and vascular dementia. Current Alzheimer Research 2007, 4, p. 103-109.
Labels
Addictology Allergology and clinical immunology Anaesthesiology, Resuscitation and Inten Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric dermatology & STDs Paediatric gastroenterology Paediatric gynaecology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric clinical oncology Paediatric ENT Paediatric pneumology Paediatric psychiatry Paediatric radiology Paediatric urologist Diabetology Endocrinology Pharmacy Clinical pharmacology Physiotherapist, university degree Gastroenterology and hepatology Medical genetics Geriatrics Gynaecology and obstetrics Haematology Hygiene and epidemiology Hyperbaric medicine Vascular surgery Chest surgery Plastic surgery Medical virology Intensive Care Medicine Cardiac surgery Clinical speech therapy Clinical microbiology Nephrology Neonatology Neurosurgery Neurology Nuclear medicine Nutritive therapist Obesitology Ophthalmology Orthodontics Orthopaedics ENT (Otorhinolaryngology) Anatomical pathology Paediatrics Pneumology and ftiseology Burns medicine Occupational medicine General practitioner for children and adolescents General practitioner for adults Orthopaedic prosthetics Clinical psychology Radiodiagnostics Radiotherapy Rehabilitation Reproduction medicine Nurse Sexuology Forensic medical examiner Dental medicine Sports medicine Toxicology Trauma surgery Urology Laboratory Home nurse Phoniatrics Health Care Dental Hygienist Medical student
Article was published inGeneral Practitioner

2008 Issue 1-
All articles in this issue
- Skin examination by high-frequency ultrasound
- Diagnostic problems of non-alcoholic steatohepatitis in clinicopathological practice
- Clinical aspects and neurobiology of vascular dementia
- Influence of smoking and free radicals on antioxidant defence and on the pathogenesis of certain diseases
- Febrile infections in travellers returning from the tropics
- Combination of paclitaxel + gemcitabine as a salvage therapy in patients with germ cell tumors.
- Causal treatment options for lower extremity varices
- The role of the general practitioner and the occupational disease specialist in diagnosis of occupational asthma and occupational rhinitis
- Smoking Helpline service – an important programme in the fight against tobbaco addition
- Dynamics of oncomarkers duringthe oncological treatment of testicular germinal cell tumours
- Ethics committees in the Czech Republic
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Clinical aspects and neurobiology of vascular dementia
- Causal treatment options for lower extremity varices
- Dynamics of oncomarkers duringthe oncological treatment of testicular germinal cell tumours
- Influence of smoking and free radicals on antioxidant defence and on the pathogenesis of certain diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

