-
Medical journals
- Career
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti
Authors: K. Poc 1; P. Mačinga 2; P. Štirand 2; P. Wohl 2; P. Drastich 2; J. Martínek 2; P. Taimr 2; V. Nosek 3; J. Špičák 2; T. Hucl 2
Authors‘ workplace: 1. LF UK v Praze 1; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 2; Gastroenterologie, Nemocnice Jablonec nad Nisou, p. o. 3
Published in: Gastroent Hepatol 2017; 71(5): 401-408
Category: Gastrointestinal Oncology: Original Article
doi: https://doi.org/10.14735/amgh2017401Overview
Úvod:
Endosonograficky (EUS) navigovaná drenáž je běžně používanou metodou v léčbě symptomatických pankreatických tekutinových kolekcí, pankreatické pseudocysty a ohraničené pankreatické nekrózy. Míra úspěšnosti a výskytu komplikací se v různých studiích významně liší.Pacienti a metody:
Provedli jsme retrospektivní zhodnocení všech pacientů, kteří podstoupili na našem pracovišti EUS navigovanou drenáž v období od ledna 2000 do prosince 2016. Posoudili jsme jejich anamnestické údaje, indikace, průběh výkonu, komplikace a výsledky léčby.Výsledky:
EUS navigovanou drenáž podstoupilo celkem 104 pacientů. U 76 (73 %) pacientů se jednalo o drenáž pseudocysty a u 28 (27 %) pacientů o drenáž ohraničené nekrózy. Pseudocysty vznikly v důsledku chronické (53 %) nebo akutní (42 %) pankreatitidy. Průměrná velikost pseudocysty byla 9 ± 4,8 cm. Drenáž byla provedena transgastricky (62 %), transduodenálně (17 %) nebo transpapilárně (21 %). Pacientům byly zavedeny plastikové (91 %) nebo metalické (9 %) stenty. Technicky úspěšných bylo 93 % výkonů. K rezoluci kolekce došlo u 75 % pacientů, střední doba drenáže byla 64 (1–1 744) dní. Klinická úspěšnost byla 72% při užití plastikových stentů a 100% při užití metalických stentů (p = 0,319). Zaznamenané komplikace byly krvácení (4), perforace (5) a sekundární infekce (8). Ohraničená nekróza se rozvinula jako následek akutní (89 %) nebo exacerbace chronické (11 %) pankreatitidy. Průměrná velikost byla 11 ± 5,8 cm. Ohraničená nekróza byla drenována transgastricky (93 %) nebo transduodenálně (7 %). K drenáži byly použity plastikové (71 %), metalické (21 %) stenty či jejich kombinace (8 %). Technická úspěšnost drenáže byla 96 %. Endoskopické nekrektomie byly provedeny u 9 pacientů (32 %). K rezoluci došlo u 77 % pacientů se střední dobou drenáže 69 (1–1 210) dní. Klinická úspěšnost byla 71% při užití plastikových stentů a 100% při užití metalických stentů (p = 0,289). Jako komplikace jsme zaznamenali krvácení (1), perforace (1) a sekundární infekce (3).Závěr:
EUS navigovaná drenáž byla efektivní metoda v léčbě pankreatických tekutinových kolekcí s nezanedbatelným rizikem komplikací. Její účinnost se nelišila dle typu pankreatické kolekce, trend lepší klinické úspěšnosti drenáží metalickými stenty však nedosáhl statistické významnosti.Klíčová slova:
pankreatická tekutinová kolekce – pseudocysta – ohraničená pankreatická nekróza – endosonografie – drenážÚvod
Pankreatické tekutinové kolekce (PFC – pancreatic fluid collection) vznikají jako komplikace akutní či chronické pankreatitidy, operace nebo traumatu. Nová Atlantská klasifikace rozlišuje PFC dle stáří a přítomnosti nekrotických hmot na akutní, vznikající do 4 týdnů od ataky (APFC – acute peripancreatic fluid collection či ANC – acute necrotic collection), a chronické, přetrvávající déle než 4 týdny. Mezi chronické kolekce patří pankreatická pseudocysta (PP) a ohraničená pankreatická nekróza (WOPN – walled-off pancreatic necrosis) [1]. Chronické tekutinové kolekce vyvine až 15 % pacientů s akutní pankreatitidou [2].
Zjištění etiologie, stáří, morfologie a anatomické lokalizace je u PFC zásadně důležité kvůli rozdílnému přístupu v jejich léčbě. Akutní (< 4 týdny) PFC jsou většinou asymptomatické, nevyžadují léčbu a často spontánně mizí [3]. Asi 5–15 % akutních kolekcí přetrvá a dojde k rozvoji PP v případě APFC nebo ohraničené pankreatické nekrózy v případě ANC [4,5]. Rozvoj klinických symptomů je indikací k drenáži PFC [6]. Symptomy mohou být útlakové (bolest, porucha evakuace žaludku, obstrukce žlučových cest) nebo následkem infekce kolekce [4].
Pankreatické kolekce mohou být řešeny chirurgicky, perkutánně, přímou transmurální či EUS navigovanou drenáží. První EUS navigovaná drenáž PP byla provedena v roce 1992 [7] a postupně se stala pro svoji miniinvazivitu, vysokou efektivitu a bezpečnost metodou první volby u většiny symptomatických pacientů [2]. V přímém srovnání měla endoskopická drenáž pseudocyst stejnou technickou úspěšnost a výskyt komplikací jako drenáž perkutánní, potřeba reintervence a délka hospitalizace byly nižší [8]. Obdobný byl výsledek srovnání endoskopické a chirurgické léčby pseudocyst [9]. V randomizovaných studiích byla EUS navigovaná drenáž technicky úspěšnější ve srovnání s přímou transmurální drenáží [10,11], jejíž zásadní nevýhodou je nutnost endoskopicky patrného vyklenutí [12]. Volba použité metody je u každého pacienta individualizovaná a závisí také na zkušenosti endoskopisty a centra, v některých případech je nutná léčba více metodami.
K EUS navigované drenáži mohou být použity plastikové či metalické stenty, speciálním typem metalických stentů jsou k transmurální drenáži speciálně vyvinuté apoziční stenty (LAMS – lumen-apposing metal stents). Výhoda metalických stentů spočívá v jednoduchosti zavedení, ve schopnosti drenáže solidních nekrotických hmot a možnosti provedení nekrektomie cestou metalického stentu.
Efektivita EUS navigované drenáže se ve většině studií pohybuje nad 80 %, výskyt komplikací je nejčastěji mezi 10 a 20 % [2]. Mezi hlavní komplikace patří krvácení a perforace. Úspěšnost a výskyt komplikací mohou souviset s typem drenované kolekce. Například Varadarujulu et al prokázali 63% úspěšnost a 16% výskyt komplikací při léčbě infikované pseudocysty ve srovnání s 94% úspěšností a 5% výskytem komplikací u sterilních pseudocyst [13]. Efektivita drenáže je také nižší u ohraničené nekrózy, kde v případě, že po iniciální drenáži nedojde ke zlepšení stavu, může být k definitivnímu úspěchu nutné provedení endoskopické nekrektomie.
Cílem studie bylo zjistit technickou a klinickou úspěšnost a bezpečnost EUS navigovaných drenáží PFC provedených na našem pracovišti.
Pacienti a metody
Do studie jsme zařadili všechny pacienty, kteří v období od ledna 2000 do prosince 2016 podstoupili na našem pracovišti EUS navigovanou drenáž PFC. Retrospektivně jsme zhodnotili indikaci k výkonu, typ a počet použitých stentů, technickou úspěšnost, komplikace a krátkodobou a dlouhodobou úspěšnost.
Identifikovali jsme pacienty, u kterých byla drenáž provedena pro ohraničenou pankreatickou nekrózu, a porovnali jsme je s pacienty drenovanými pro PP. Vzhledem k tomu, že termín ohraničené nekrózy nebyl v době začátku studie ještě přesně definován, část pacientů jsme identifikovali zpětně po zhodnocení anamnestických dat a nálezů zobrazovacích vyšetření (sonografie, EUS, CT).
Endoskopická drenáž byla provedena v analgosedaci (midazolam + fentanyl) či v celkové anestezii s endotracheální intubací nebo bez ní. Všichni pacienti užívali v době drenáže antibiotika. V případě, že pacient neužíval antibiotika pro známky infekce kolekce již dříve, byla podána intravenózní antibiotika před výkonem. Všechny výkony byly provedeny za hospitalizace na naší klinice či jiném interním či chirurgickém pracovišti.
Výkon byl proveden pod skiaskopickou kontrolou za použití lineárního echoendoskopu (GF UCT 140 nebo 160, Olympus, Hamburg, Germany). Pomocí EUS obrazu bylo nalezeno ložisko. Drenáž byla provedena u ložisek, které v dostatečné míře naléhaly na stěnu žaludku a jejichž vzdálenost od stěny nepřesahovala 10 mm. EUS obraz odlišil pseudocystu a ohraničenou nekrózu (přítomnost solidní nekrózy uvnitř tekutinové kolekce). Nejprve byla pod EUS kontrolou provedena punkce ložiska 19 G jehlou. Následná aspirace potvrdila pozici jehly uvnitř kolekce a umožnila získat materiál na biochemické, kultivační a cytologické vyšetření. Cestou punkční jehly byl do kolekce zaveden vodič. Po extrakci jehly byl po vodiči zaveden cystotom (6–10 Fr, Cook Medical, Limerick, Ireland) a aplikací řezacího proudu byl vytvořen kanál ve stěně trávicího traktu (žaludek, duodenum) a stěně kolekce. Tento kanál byl následně dilatován pomocí balonku (6–12 mm, Boston Scientific, Natick, USA). Nakonec byl zaveden jeden či více plastikových „double-pigtail“ stentů velikost 7–10 Fr nebo jeden metalický stent (Nagi™ stent, Taewoong Medical Co., Ilsan, South Korea). V případě použití metalického stentu Hot AXIOS™ (Boston Scientific, Natick, USA) bylo zavedení provedeno v jednom kroku pomocí zaváděcího mechanizmu, který je již součástí stentu (obr. 1–3). V některých případech, kdy byla indikací k výkonu infikovaná kolekce, jsme na přechodnou dobu paralelně zavedli nazocystický drén, který byl vyveden jícnem a nosní dírkou z těla ven a sloužil k proplachu.
Image 1. Drenáž pseudocysty plastikovým stentem. Punkce kolekce cystotomem zavedeným po vodiči (A), dilatace anastomózy balonkem (B), zavedený plastikový stent (C). Fig. 1. Drainage of a pancreatic pseudocyst with a plastic stent. Puncture of the collection with a cystotome over a wire (A), dilation of anastomosis with a balloon (B), drainage with a plastic stent (C). 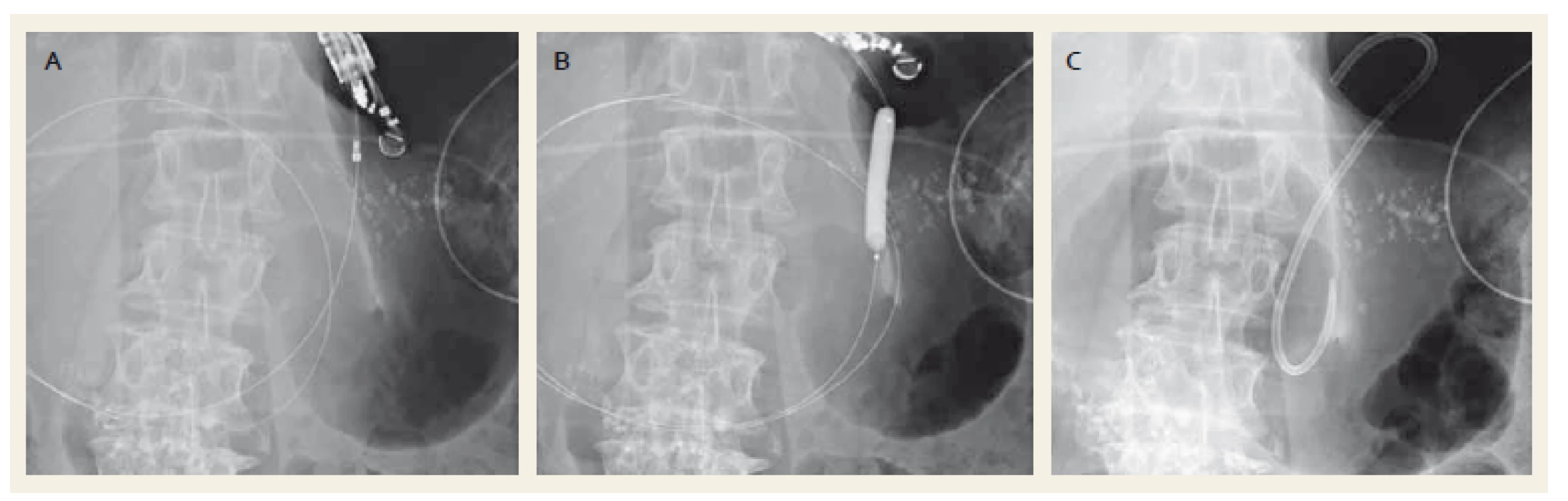
Image 2. Drenáž ohraničené nekrózy metalickým stentem Nagi™ (Taewoong Medical Co., Ltd., Ilsan, South Korea). Punkce kolekce jehlou (A), dilatace anastomózy balonkem (B), zavedený metalický stent (C). Fig. 2. Drainage of a walled-off necrosis with a Nagi™ metal stent (Taewoong Medical Co., Ltd., Ilsan, South Korea). Puncture of the collection with a needle (A), dilation of anastomosis with a balloon (B), drainage with a metal stent (C). 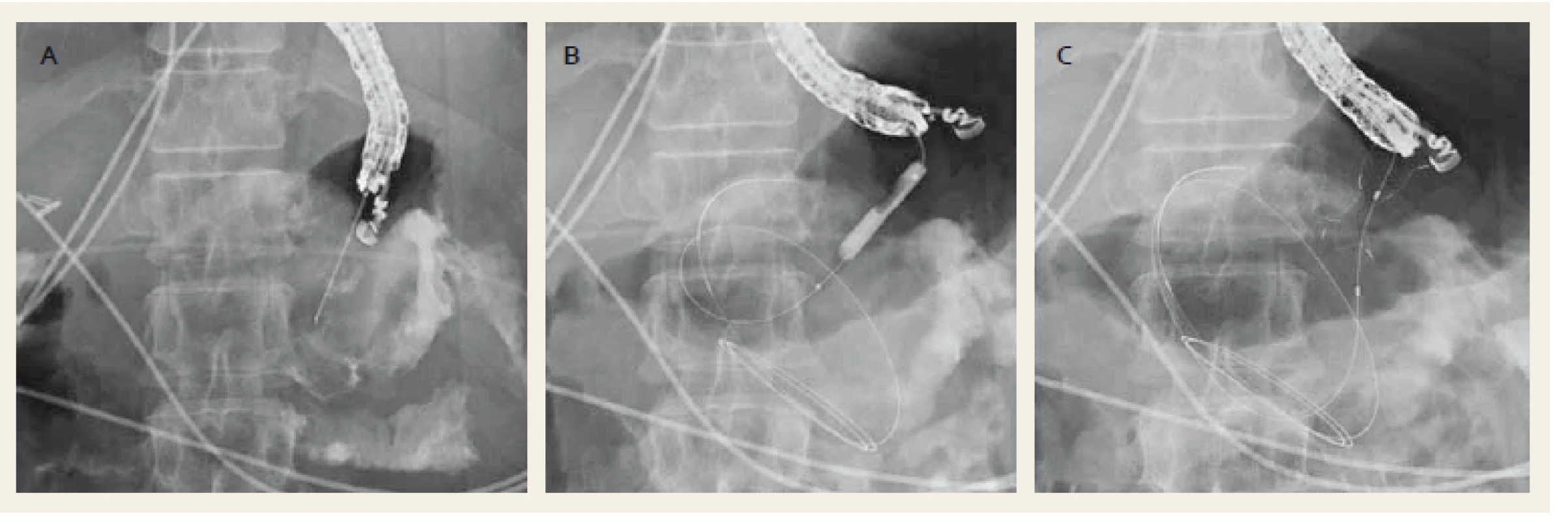
Image 3. Drenáž ohraničené nekrózy metalickým stentem Hot-AXIOS™ (Boston Scientific, Natick, USA). Punkce zaváděcím systémem (A), zavedení stentu po pojistném vodiči (B), zavedený metalický stent (C). Fig.3. Drainage of a walled-off necrosis with a Hot-AXIOS™ stent (Boston Scientific, Natick, USA). Puncture of the collection with a stent deployment system (A), placement of metal stent over a wire (B), drainage with a metal stent (C). 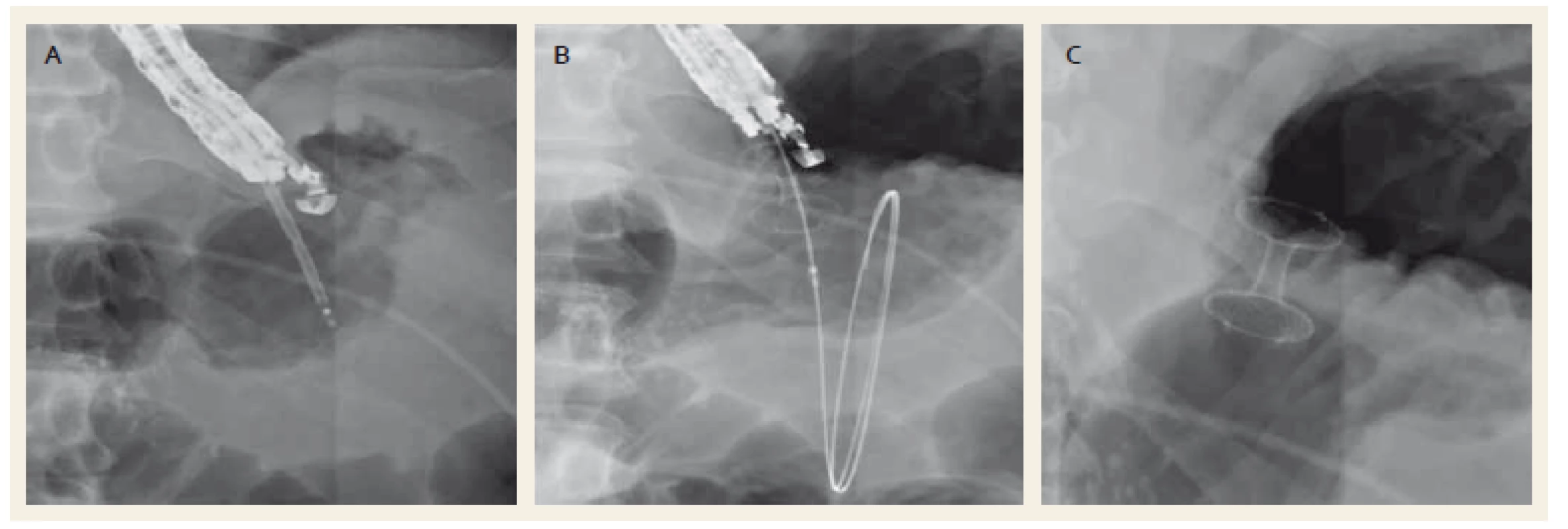
V případě transpapilární drenáže (komunikující tekutinová kolekce v hlavě pankreatu neobsahující nekrózu) byl zaveden plastikový stent (do dutiny či do pankreatického vývodu tak, aby přemostil odstup dutiny) cestou Vaterské papily při endoskopické retrográdní cholangiopankreatografii.
Technická úspěšnost byla definována jako zavedení alespoň jednoho stentu (plastikového či metalického) správně do lumen tekutinové kolekce. Pacienti byli po výkonu monitorováni ke zjištění komplikací a ústupu symptomů vedoucích k intervenci. V případě příznivého klinického vývoje bylo v intervalu 4–12 týdnů od výkonu provedeno zobrazení drénované kolekce pomocí CT a v případě její regrese (minimálního rezidua) byly stenty odstraněny. V případě absence regrese byla provedena endoskopická revize anastomózy a dle potřeby její dilatace, výměna či přidání stentů. Klinická úspěšnost byla definována jako vymizení symptomů, které byly indikací k provedení drenáže a regrese či minimální reziduum drénovaného ložiska za 4–12 týdnů od výkonu.
Odstranění bylo provedeno endoskopicky pomocí polypektomické kličky. Pokud se jednalo o drenáž infikované nekrózy a u pacienta nedošlo v následujících dnech po výkonu ke zlepšení klinického stavu, byla indikována endoskopická revize dutiny a nekrektomie za použití dostupných endoskopický akcesorií (polypektomie klička, košík, síťka).
Po odstranění stentů byli pacienti indikováni k pravidelnému ambulantnímu sledování s monitorací klinického stavu a alespoň jednomu kontrolnímu zobrazovacímu vyšetření v intervalu asi 6 měsíců. Jako rekurenci jsme hodnotili klinicky významné doplnění ložiska v průběhu dalšího sledování.
Rozdíly mezi skupinami a v rámci skupin byly hodnoceny pomocí Studentova t-testu u kvantitativních parametrů a pomocí Fisherova exaktního testu v případě kvalitativních parametrů. Za hranici statistické významnosti byla považována hodnota p = 0,05.
Výsledky
Od ledna 2000 do prosince 2016 podstoupilo na naší klinice EUS navigovanou drenáž PFC celkem 104 pacientů. Jednalo se o 59 mužů a 45 žen průměrného věku 54 ± 13 let. U 76 pacientů (73 %) jsme pankreatickou kolekci hodnotili jako PP, ve 28 případech (27 %) jako ohraničenou pankreatickou nekrózu. Rozdělení pacientů shrnuje tab. 1.
Table 1. Charakteristika souboru pacientů. Tab. 1. Patient characteristics. 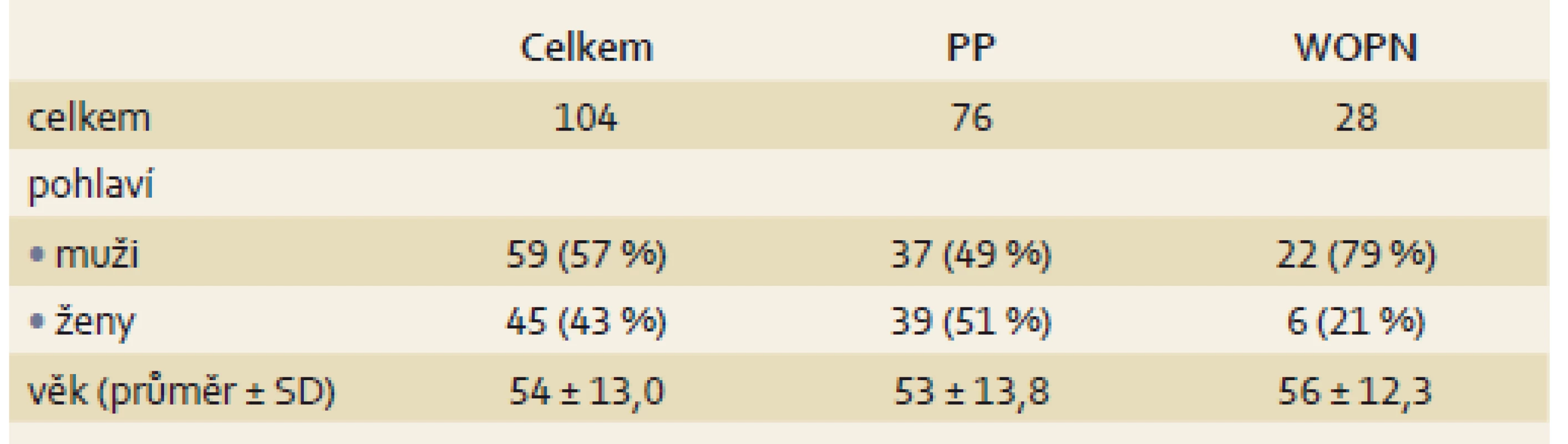
PP – pankreatická pseudocysta, WOPN – ohraničená pankreatická nekróza, SD – směrodatná odchylka Pankreatická pseudocysta
K endoskopickému ošetření bylo ve sledovaném období indikováno celkem 76 pacientů (37 mužů, 39 žen, průměrný věk 53 ± 14 let) s PP, která vznikla v důsledku chronické (53 %) či akutní (42 %) pankreatitidy. Průměrná velikost PP byla 9 ± 4,8 cm. Indikací k endoskopické drenáži byly symptomy spojené s tlakem či útlakem ložiska u 67 pacientů (88 %) a známky infekce pseudocysty u 9 pacientů (12 %).
Drenáž byla provedena transgastricky (62 %), transduodenálně (17 %) nebo transpapilárně (21 %). V 69 případech jsme použili plastikové stenty (91 %) a v 7 případech (9 %) stenty metalické. Technicky úspěšní jsme byli u 71 pacientů (93 %). Medián počtu výkonu na pacienta byl 1 (1–5) a střední doba drenáže 64 dnů (1–1 744). Klinickou úspěšnost v odstupu 1–3 měsíců jsme měli možnost hodnotit u 56 pacientů, úspěch jsme zaznamenali u 42 (75 %) z nich. Ve skupině pacientů drenovaných pomocí plastikových stentů byla klinická úspěšnost 72% ve srovnání se 100% úspěšností ve skupině pacientů drenovaných metalickými stenty (p = 0,319).
Komplikace se vyskytly u 17 (22 %) pacientů. Jednalo se o 4 případy krvácení, 5 případů perforace a 8 případů sekundární infekce. U 3 dlouhodobě sledovaných pacientů došlo k recidivě pseudocysty po extrakci stentů, ve všech případech byla provedena redrenáž, která byla účinná. Výsledky shrnují tab. 2 a 3.
Table 2. Charakteristika pacientů v závislosti na typu pankreatické kolekce. Tab. 2. Patient characteristics according to the type of pancreatic collection. 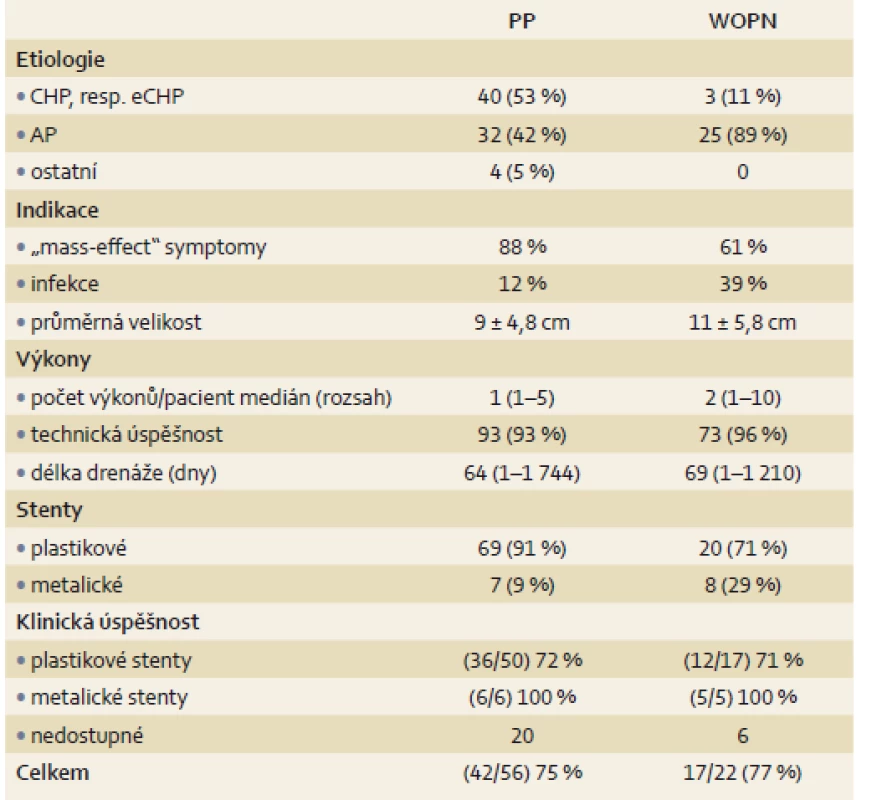
PP – pankreatická pseudocysta, WOPN – ohraničená pankreatická nekróza, CHP – chronická pankreatitida, eCHP – exacerbace chronické pankreatitidy, AP – akutní pankreatitida Table 3. Komplikace drenážních výkonů. Tab. 3. Drainage complications. 
PP – pankreatická pseudocysta, WOPN – ohraničená pankreatická nekróza Ohraničená nekróza
EUS navigovaná drenáž byla provedena u 28 pacientů s WOPN (22 mužů, 6 žen, průměrný věk 56 ± 12 let), která vznikla v důsledku akutní pankreatitidy (89 %) či akutní exacerbace chronické pankreatitidy (11 %). Průměrná velikost WOPN byla 11 ± 5,8 cm. Indikací k drenáži byly útlakové symptomy u 17 pacientů (61 %) či známky infekce (39 %).
Drenáž byla provedena transgastricky (93 %) či transduodenálně (7 %). Ve 20 případech (71 %) jsme použili plastikové stenty, v 5 případech (18 %) stenty metalické a kombinaci obou ve 2 případech (7 %). Technicky úspěšní jsme byli u 27 pacientů (96 %). Medián počtu výkonů na pacienta byl 2 (1–10) a střední doba drenáže 69 dnů (1–1 210). V 9 případech (32 %) jsme indikovali nekrektomii. Dlouhodobou klinickou úspěšnost jsme měli možnost hodnotit u 22 pacientů (79 %), úspěch jsme zaznamenali u 17 z nich (77 %). Ve skupině pacientů léčených plastikovými stenty byla klinická úspěšnost 74% ve srovnání se 100% klinickou úspěšností ve skupině pacientů řešených metalickými stenty (p = 0,289).
Komplikace se u pacientů s WOPN rozvinuly v 5 případech (18 %). V 1 případě došlo ke vzniku perforace, chirurgické řešení vedlo k odstranění WOPN. U dalšího pacienta to byla sekundární infekce ložiska a rozvoj septického šoku s následkem úmrtí. Jeden pacient drenovaný pro infikovanou WOPN zemřel navzdory provedené drenáži na důsledky sepse. U jednoho pacienta došlo k recidivě tekutinové kolekce po odstranění drenáže, kterou jsme úspěšně vyřešili redrenáží. Výsledky jsou shrnuty v tab. 2 a 3.
Diskuze
PFC patří mezi nejčastější komplikace akutní pankreatitidy. Akutně vzniklé kolekce většinou spontánně vymizí a nevyžadují léčbu, část z nich se ale ohraničí a vzniká PP s tekutým obsahem nebo ohraničená pankreatická nekróza obsahující kromě tekutiny také zbytky pankreatické tkáně. V případě symptomů je indikována intervenční léčba. V případě, že to anatomické poměry dovolí, je endoskopická drenáž metodou volby pro svou nízkou morbiditu a mortalitu ve srovnání s drenáží perkutánní či chirurgickou. Při transmurální endoskopické drenáži je pod EUS kontrolou vytvořena komunikace mezi kolekcí a žaludkem či duodenem. Průchodnost této komunikace a drenáž jsou zajištěny plastikovými nebo metalickými stenty. Zavedení metalických stentů a jejich nedávné zdokonalení vedlo ke snížení technické náročnosti výkonu a snížení potřeby reintervencí. Endoskopická léčba má své komplikace, které mohou být závažné. Měla by být prováděna na pracovištích s možností účasti intervenčních radiologů a chirurgů [14].
Technická proveditelnost drenáže byla v našem souboru vysoká a srovnatelná s publikovanými soubory [15]. Klinická efektivita drenáže pankreatických kolekcí je závislá na řadě faktorů. Ohraničená nekróza obsahuje zbytky solidní nekrotické tkáně, které mohou bránit kompletní drenáži. Celková klinická úspěšnost endoskopické drenáže tak bývá v případě ohraničené nekrózy nižší (63–81 %) ve srovnání s drenáží pseudocysty (86–100 %) [14,16–19]. V našem souboru byla efektivita drenáže v obou skupinách srovnatelná. V případě pseudocyst jsme dosáhli klinického efektu v 75 % a v případě ohraničené nekrózy v 77 %. V případě pseudocyst je náš výsledek ve srovnání se světovými soubory o něco nižší. Při vysvětlení je nutné přihlédnout k tomu, že popisovaný soubor zahrnuje pacienty léčené v období 17 let. Naše zkušenosti s EUS drenáží a technické možnosti (např. dostupnost metalických stentů) byly na počátku období omezené. Příkladem je i vysoký počet pacientů léčených izolovanou transpapilární drenáží, z nichž většina byla léčena na počátku sledovaného období. V této skupině byla efektivita léčby pouze kolem 70 %. Léčili jsme např. i pacienty, jejichž kolekce dosahovala velikosti 13 cm, tedy pacienty, u kterých dnes víme, že nejsou vhodnými kandidáty transpapilární drenáže. Méně příznivý výsledek v obou skupinách může být také způsoben vysokým počtem pacientů, u kterých nejsou k dispozici data o dlouhodobém výsledku léčby. U těchto pacientů byl na našem pracovišti proveden pouze výkon bez následného sledování. Lze předpokládat, že v této skupině pacientů budou dominantně zastoupeni ti, u kterých byla léčba úspěšná.
Jiným faktorem, který může ovlivnit úspěšnost léčby, je použití metalických stentů. V naší studii jsme prokázali rozdíl v účinnosti stentů v obou skupinách ve prospěch metalických stentů, tento rozdíl však nebyl statisticky významný. Absence statistické významnosti je nejspíše způsobena malým počtem pacientů léčených metalickými stenty. Velké randomizované studie srovnávající efektivitu plastikových a metalických stentů chybí. Retrospektivní srovnání Siddiquia et al ukázalo vyšší efektivitu metalických stentů ve srovnání s plastikovými stenty u ohraničené nekrózy [20]. Obdobný výsledek ukázala studie Sharaihy et al, kde byla drenáž pseudocyst metalickými stenty efektivnější a doprovázená nižším výskytem komplikací výkonu než drenáž stenty plastikovými [21]. V randomizované studii, která porovnala 50 pacientů s pankreatickými kolekcemi drenovanými metalickými a plastikovými stenty, byla účinnost v obou skupinách stejná. Drenáž metalickými stenty byla ale jednodušší a časově méně náročná. V systematickém review hodnotícím 881 pacientů nebyl prokázán statisticky významný rozdíl mezi efektivitou plastikových a metalických stentů u pseudocyst i ohraničené nekrózy [22]. Studie užívající metalické stenty, vč. těch specificky vyvinutých pro potřeby transmurální drenáže, však byly v této studii málo zastoupeny [14].
V poslední dekádě byly položeny základy miniinvazivní a postupné (step-up) léčby pankreatických kolekcí. Nizozemská studie PANTER prokázala, že pacienti s infikovanou nekrózou, u kterých byl zvolen tzv. step-up přístup, tedy léčba od méně invazivní perkutánní drenáže po miniinvazivní chirurgickou léčbu, měli méně komplikací a nižší mortalitu ve srovnání s pacienty léčenými nekrektomií při laparotomii [23]. Standardní jednorázová drenáž plastikovými či metalickými stenty je vysoce účinná u pseudocyst. U ohraničené nekrózy nemusí však být taková drenáž dostatečná. Výše uvedený step-up přístup lze aplikovat i do samotné endoskopické léčby. Příkladem je kombinace endoskopické drenáže s perkutánní, zavedení nazocystické drenáže či endoskopická nekrektomie. V našem souboru pacientů jsme kombinace endoskopické a perkutánní drenáže využili u dvou pacientů. Endoskopickou nekrektomii jsme provedli u devíti pacientů s ohraničenou nekrózou. Ve všech případech se jednalo o pacienty s infikovanou nekrózou, kteří nereagovali na první etapu drenáže. U ostatních pacientů, u kterých došlo k úpravě klinického stavu v reakci na iniciální drenáž, jsme nekrektomii neindikovali a dosáhli klinické odpovědi v 86 % případů. Naše pozorování na malém souboru pacientů podporuje recentní rozsáhlá retrospektivní studie popisující 205 pacientů se symptomatickou ohraničenou nekrózou. Iniciální drenáž pomocí dedikovaného metalického stentu byla efektivní u 74,6 % pacientů. V případě nedostatečného efektu následovalo nejprve zprůchodnění metalického stentu, poté zavedení nazocystické drenáže a nakonec přímá nekrektomie. Celková efektivita pak dosáhla 96,5 % pacientů a nekrektomie byla nutná pouze u 9,2 % pacientů [24].
Endoskopická nekrektomie se stala výrazně jednodušší díky speciálně vyvinutým stentům jako např. Nagi™ stent (Taewoong Medical Co., Ltd., Ilsan, South Korea), SPAXUS stent (Taewoong Medical Co., Ltd, Ilsan, South Korea) nebo Hot AXIOS™ stent (Boston Scientific, Natick, USA). Mezi výhody těchto stentů patří jednodušší zavedení, které je v případě Hot AXIOS™ stentu ještě navýšeno tím, že součástí zaváděcího systému je elektrokauterizační elektroda umožňující iniciální transmurální punkci. Jinou výhodou jsou rozšiřující se okraje, které udržují lumen propojených dutin těsně u sebe, a mohou tak snížit riziko krvácení z okrajů anastomózy nebo perforace (LAMS). Důležitou charakteristikou je také jejich široké lumen umožňující lepší drenáž a přímý vstup endoskopu do drenované dutiny v případě nekrektomie bez nutnosti dilatace anastomózy. V našem souboru jsme tyto stenty použili v 15 případech (12× Nagi™ stent, 3× Hot AXIOS™ stent). Předběžné výsledky prvních zahraničních studií však ukázaly i na rizika použití těchto stentů jako odložené krvácení či migrace [25]. Zavedení vnitřního pigtail stentu může být vedle časné extrakce jedním ze způsobů prevence těchto komplikací (obr. 3).
Komplikace se vyskytly v našem souboru asi u 1/5 pacientů. Četnost komplikací se nelišila ve skupině pacientů léčených pro pseudocystu (22 %) a ohraničenou nekrózu (18 %). Rozdíl také nebyl patrný mezi pacienty léčenými plastikovými a metalickými stenty. Výskyt komplikací byl v souladu s řadou publikovaných studií, především při srovnání drenáže ohraničené nekrózy. Výskyt komplikací v této skupině pacientů se pohybuje mezi 14 a 33 % [14,26]. Mezi nejčastější komplikace patří krvácení, perforace, infekce a migrace. Na rozdíl od našich výsledků bývá výskyt komplikací nižší u pacientů s pseudocystou. Například v retrospektivní studii hodnotící 211 pacientů byl výskyt komplikací ve skupině pseudocyst významně nižší ve srovnání s ohraničenou nekrózou (5,2 vs. 15,8 %). Vyšší výskyt komplikací v našem souboru pacientů s pseudocystou může souviset s nízkým zastoupením pacientů léčených metalickými stenty, u kterých je míra komplikací většinou nižší [21].
Nedostatkem naší studie je její omezená velikost, retrospektivní charakter a relativně vysoký počet pacientů nedostupných k dlouhodobému hodnocení efektu. To je dáno charakterem našeho pracoviště jako terciálního centra, kdy byla řada pacientů před drenáží a po ní sledována ve spádových zdravotnických zařízeních. Nevýhodou je také fakt, že pouze malá část pacientů byla léčena metalickými stenty.
Léčba pankreatických kolekcí je komplexní a vyžaduje individuální přístup. Na jejím počátku je klíčová správná indikace k léčbě a její načasování. Jen část pankreatických kolekcí vyžaduje intervenční léčbu, kterou provádíme v jejich chronické fázi. Anatomická charakteristika kolekce umožní rozhodnout o nejvhodnější modalitě léčby. Charakterizace kolekce pak přispěje k výběru typu stentu. Dodržení endoskopického step-up přístupu umožní provést nekrektomii pouze v menšině případů. Při respektování těchto zásad je endoskopická léčba vysoce účinná, avšak není prosta komplikací. Nutností je provedení léčby v centru s multidisciplinárním zázemím.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 9. 2017
Přijato: 27. 9. 2017
doc. MUDr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie Transplantcentrum,
IKEM Vídeňská 1958/9
140 21 Praha 4
tomas.hucl@ikem.cz
Sources
1. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62 (1): 102–111. doi: 10.1136/gutjnl-2012-302779.
2. Tyberg A, Karia K, Gabr M et al. Management of pancreatic fluid collections: a comprehensive review of the literature. World J Gastroenterol 2016; 22 (7): 2256–2270. doi: 10.3748/wjg.v22.i7. 2256.
3. Lenhart DK, Balthazar EJ. MDCT of acute mild (nonnecrotizing) pancreatitis: abdominal complications and fate of fluid collections. AJR Am J Roentgenol 2008; 190 (3): 643–649. doi: 10.2214/AJR.07. 2761.
4. Baillie J. Pancreatic pseudocysts (Part I). Gastrointestinal Endosc 2004; 59 (7): 873–879.
5. Kim KO, Kim TN. Acute pancreatic pseudocyst: incidence, risk factors, and clini-cal outcomes. Pancreas 2012; 41 (4): 577–581. doi: 10.1097/MPA.0b013e3182 374def.
6. Špičák J, Urban O (eds). Novinky v digestivní endoskopii. Praha: Grada 2015.
7. Grimm H, Binmoeller KF, Soehendra N. Endosonography-guided drainage of a pan-creatic pseudocyst. Gastrointestinal Endosc 1992; 38 (2): 170–171.
8. Akshintala VS, Saxena P, Zaheer A et al. A comparative evaluation of outcomes of endoscopic versus percutaneous drainage for symptomatic pancreatic pseudocysts. Gastrointest Endosc 2014; 79 (6): 921–928. doi: 10.1016/j.gie.2013.10. 032.
9. Varadarajulu S, Bang JY, Sutton BS et al. Equal efficacy of endoscopic and surgical cystogastrostomy for pancreatic pseudocyst drainage in a randomized trial. Gastroenterology 2013; 145 (3): 583–590. doi: 10.1053/j.gastro.2013.05.046.
10. Varadarajulu S, Christein JD, Tamhane A et al. Prospective randomized trial comparing EUS and EGD for transmural drainage of pancreatic pseudocysts (with videos). Gastrointest Endosc 2008; 68 (6): 1102–1111. doi: 10.1016/j.gie.2008.04.028.
11. Park DH, Lee SS, Moon SH et al. Endoscopic ultrasound-guided versus conventional transmural drainage for pancreatic pseudocysts: a prospective randomized trial. Endoscopy 2009; 41 (10): 842–848. doi: 10.1055/s-0029-1215133.
12. Kliment M, Urban O, Fojtík P et al. Endoskopická drenáž pankreatických tekutinových kolekcií – 6-ročná skúsenosť v terciárnom gastroenterologickom centre v období rokov 2006–2012. Gastroent Hepatol 2017; 71 (3): 199–207. doi: 10.14735/amgh2017199.
13. Varadarajulu S, Bang JY, Phadnis MA. Endoscopic transmural drainage of peripancreatic fluid collections: outcomes and predictors of treatment success in 211 consecutive patients. J Gastrointest Surg 2011; 15 (11): 2080–2088. doi: 10.1007/s11605-011-1621-8.
14. Nabi Z, Basha J, Reddy DN. Endoscopic management of pancreatic fluid collections-revisited. World J Gastroenterol 2017; 23 (15): 2660–2672. doi: 10.3748/wjg.v23.i15.2660.
15. Cahen D, Rauws E, Fockens P et al. Endoscopic drainage of pancreatic pseudocysts: long-term outcome and procedural factors associated with safe and success-ful treatment. Endoscopy 2005; 37 (10): 977–983.
16. Seifert H, Biermer M, Schmitt W et al. Transluminal endoscopic necrosectomy after acute pancreatitis: a multicentre study with long-term follow-up (the GEPARD Study). Gut 2009; 58 (9): 1260–1266. doi: 10.1136/gut.2008.163733.
17. Gardner TB, Coelho-Prabhu N, Gordon SR et al. Direct endoscopic necrosectomy for the treatment of walled-off pancreatic necrosis: results from a multicenter U.S. series. Gastrointest Endosc 2011; 73 (4): 718–726.
18. Holt BA, Varadarajulu S. The endoscopic management of pancreatic pseudocysts (with videos). Gastrointest Endosc 2015; 81 (4): 804–812. doi: 10.1016/j.gie.2014.12.026.
19. Baron TH, Harewood GC, Morgan DE et al. Outcome differences after endo-scopic drainage of pancreatic necrosis, acute pancreatic pseudocysts, and chronic pancreatic pseudocysts. Gastrointest Endosc 2002; 56 (1): 7–17.
20. Siddiqui AA, Kowalski TE, Loren DE et al. Fully covered self-expanding metal stents versus lumen-apposing fully covered self-expanding metal stent versus plastic stents for endoscopic drainage of pancreatic walled-off necrosis: clinical outcomes and success. Gastrointest Endosc 2017; 85 (4): 758–765. doi: 10.1016/j.gie.2016.08.014.
21. Sharaiha RZ, DeFilippis EM, Kedia P et al. Metal versus plastic for pancreatic pseudocyst drainage: clinical outcomes and success. Gastrointest Endosc 2015; 82 (5): 822–827. doi: 10.1016/j.gie.2015.02. 035.
22. Bang JY, Hawes R, Bartolucci A et al. Efficacy of metal and plastic stents for transmural drainage of pancreatic fluid collections: a systematic review. Dig Endosc 2015; 27 (4): 486–498. doi: 10.1111/den.12 418.
23. van Santvoort HC, Besselink MG, Bakker OJ et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010; 362 (16): 1491–1502. doi: 10.1056/NEJMoa0908821.
24. Lakhtakia S, Basha J, Talukdar R et al. Endoscopic „step-up approach“ using a dedicated biflanged metal stent reduces the need for direct necrosectomy in walled-off necrosis (with videos). Gastrointest Endosc 2017; 85 (6): 1243–1252. doi: 10.1016/j.gie.2016.10.037.
25. Bang JY, Hasan M, Navaneethan U et al. Lumen-apposing metal stents (LAMS) for pancreatic fluid collection (PFC) drainage: may not be business as usual. Gut 2016. In press. doi: 10.1136/gutjnl-2016-312812.
26. van Brunschot S, Fockens P, Bakker OJ et al. Endoscopic transluminal necro-sectomy in necrotising pancreatitis: a systematic review. Surg Endosc 2014; 28 (5): 1425–1438. doi: 10.1007/s00464-013-3382-9.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2017 Issue 5-
All articles in this issue
- 31st Hildebrand Bardejov Gastroenterology Days
- Výběr z mezinárodních časopisů
- Meteospasmyl – fixní kombinace alverin citrátu a simeticonu v terapii funkčních poruch trávicí trubice
- Dobré zprávy v nejisté době
- Účast české populace na screeningu kolorektálního karcinomu – vývoj a aktuální stav
- „Účast české populace na screeningu kolorektálního karcinomu – vývoj a aktuální stav“ vo svetle Národného screeningového programu kolorektálneho karcinómu na Slovensku
- Rizikové faktory lokální reziduální neoplazie po endoskopické mukózní resekci
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Moderní léčba karcinomu jícnu, gastroezofageální junkce a žaludku – update roku 2017
- Příklad multidisciplinárního přístupu v léčbě metastazujícího karcinomu rekta
- Doporučený postup diagnostiky a léčby infekce virem hepatitidy B
- Neobvyklý případ biliárního ileu
- Zemřel profesor Henri Sarles, jeden ze zakladatelů moderní pankreatologie
- Idiopatické střevní záněty a gastrointestinální malignity – rizika, incidence a management
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Meteospasmyl – fixní kombinace alverin citrátu a simeticonu v terapii funkčních poruch trávicí trubice
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Rizikové faktory lokální reziduální neoplazie po endoskopické mukózní resekci
- Moderní léčba karcinomu jícnu, gastroezofageální junkce a žaludku – update roku 2017
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

