-
Medical journals
- Career
Moderní léčba karcinomu jícnu, gastroezofageální junkce a žaludku – update roku 2017
: R. Obermannová
: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
: Gastroent Hepatol 2017; 71(5): 409-414
: Gastrointestinal Oncology: Review Article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2017409Lokálně pokročilé a metastatické karcinomy jícnu a žaludku zaujímají přední místa jako příčina úmrtí na nádorové onemocnění. Přes pokroky v terapii je celkové přežití pacientů s metastatickým onemocněním stále velmi nízké, okolo 12 měsíců. Chemoterapie je základní součástí perioperační léčby lokálně pokročilého karcinomu žaludku a součástí konkomitantního předoperačního nebo definitivního postupu u karcinomu jícnu. Režim FLOT (5-fluorouracil, leukovorin, oxaliplatina, docetaxel) je novým standardem v perioperační chemoterapii u lokálně pokročilého onemocnění, přičemž při použití tohoto režimu přežívá 5 let až 45 % pacientů. Radioterapie je nosnou metodou v terapii karcinomu jícnu a gastroezofageální junkce, ale v adjuvantním konceptu léčby karcinomu žaludku byl její význam zpochybněn a k definitivnímu zhodnocení jejího významu je třeba vyčkat výsledků probíhajících klinických studií. Z cílených léků je u metastatického onemocnění standardní součástí léčby anti-HER2 protilátka trastuzumab a v 2. linii antiangiogenní protilátka ramucirumab. Ostatní cílené molekuly v klinických studiích neuspěly. S rozvojem imunoonkologie probíhá testování checkpoint inhibitorů také u karcinomu horního gastrointestinálního traktu a ve studiích časných fází bylo dosaženo podobně jako u jiných malignit celkové odpovědi okolo 20 %. Paliativní chirurgické výkony jsou součástí léčby metastatického onemocnění. Metastazektomie u oligometastatického onemocnění a resekce žaludku jsou experimentální metodou a jejich význam u selektované skupiny pacientů je třeba definovat.
Klíčová slova:
karcinom jícnu a žaludku – chemoterapie – checkpoint inhibitoryÚvod
Karcinom jícnu a gastroezofageální junkce (GEJ) žaludku zaujímají celosvětově čelní příčky jako příčina smrti na nádorové onemocnění [1]. Na rozdíl od kolorektálního karcinomu, kde figuruje ČR na 4. místě v incidenci, jsou karcinomy „horního zažívacího traktu“ – horního gastrointestinálního traktu (GIT) v zemích střední Evropy nemocí vzácnější [2]; podle údajů Systému pro vizualizaci onkologických dat (SVOD) za rok 2015 je incidence v ČR v případě karcinomu jícnu 3,2 na 100 000 obyvatel a mortalita 2,5 na 100 000, u karcinomu žaludku pak 13,1 na 100 000 při mortalitě 10,0 na 100 000 obyvatel. V posledních letech pozorujeme posun v lokalizaci primárního nádoru, tedy narůstající výskyt adenokarcinomu GEJ při klesající incidenci spinocelulárního karcinomu jícnu a adenokarcinomu distální části žaludku. Přes pokroky v onkologické terapii je medián přežití lokálně pokročilého či metastatického onemocnění velmi nízký [3–5]. U pacientů s metastatickým onemocněním léčených moderním chemoterapeutickým režimem dosahuje medián celkového přežití (mOS – median overall survival) kolem 11 měsíců a až 16 měsíců u adenokarcinomu junkce a žaludku při použití kombinace s cílenou terapií zvolenou na základě známého prediktivního faktoru. Téměř všechny dosud testované cílené léky u této diagnózy selhaly. Jediným prokazatelně účinným lékem u diseminovaného karcinomu žaludku je trastuzumab [6], ačkoli ostatní léky cílené na HER2 receptor nepotvrdily zisk v délce života pacientů (lapatinib, pertuzumab, T-DM1). Z inhibitorů angiogeneze se uplatňuje v léčbě metastatického adenokarcinomu ramucirumab [7,8]. Po významném objevu checkpoint inhibitorů a jejich vstupu do naší klinické praxe v léčbě vysoce imunogenních nádorů, jako je maligní melanom a nádory ledviny, dochází k extenzivnímu testování monoterapie i kombinace i u gastrointestinálních tumorů. V klinické praxi se zatím uplatňuje jediná společná indikace, a to pro MSI (microsatellite instability) high/deficitní MMR (mismatch repair) nádory. Použití pembrolizumabu u této skupiny nádorů bylo schváleno americkou lékovou agenturou FDA (Food and Drug Administration) letos na jaře. Následující text nabízí update moderní onkologické léčby lokálně pokročilého a metastatického karcinomu GEJ a žaludku. Modernizace chirurgických metod vedla k redukci významu radioterapie u lokálně pokročilého karcinomu žaludku, naopak radioterapie zůstává stěžejní terapeutickou metodou u lokálně pokročilého karcinomu jícnu a junkce. V tomto sdělení se stručně zmiňujeme o možnosti chirurgie a významu radioterapie u nádorů horního GIT, avšak podrobný rozbor problematiky operativy ani technik radioterapie není předmětem tohoto sdělení.
Chemoradioterapie u lokálně pokročilého karcinomu jícnu a GEJ
Samostatná operace dnes není standardem léčby lokálně pokročilého karcinomu jícnu či junkce. Pouze operací je dosaženo kompletní resekce u 30 % nádorů T3 a 50 % nádorů T4. Po R0 resekci pouze 20 % pacientů dosahuje 5letého OS bez použití multimodální léčby a navíc předoperační chemoterapie nebo chemoradioterapie prokázala zisk v počtu dosažených R0 resekcí a OS [4,9]. Standardním etablovaným léčebným postupem u lokálně pokročilého karcinomu GEJ je chemoradioterapie nebo perioperační chemoterapie.
Chemoradioterapie je vhodným léčebným postupem u spinocelulárního karcinomu jícnu, adenokarcinomu distálního jícnu a GEJ, tedy u nádorů Siewert I, II.
Z chemoterapeutických režimů se standardně používal režim založený na 5-fluorouracilu a cisplatině [10], v posledních letech je cisplatina nahrazována méně toxickou oxaliplatinou [11]. Lépe tolerovanou variantou je kombinace týdně podávaného paklitaxelu a karboplatiny. Studie CROSS prokázala zlepšení v OS [4]. Do nizozemské studie CROSS bylo v letech 2004–2008 zařazeno celkem 368 pacientů, z toho 23 % pacientů se spinocelulárním karcinomem a 75 % pacientů s adenokarcinomem. Všichni pacienti byli léčeni radioterapií o LD 41,4 Gy v 23 frakcích a podávanou kombinací chemoterapie paklitaxel/karboplatina v týdenním režimu po dobu 5 týdnů s následnou operací (n = 180) nebo byli pouze operováni (n = 188) bez neadjuvantní léčby. Při minimálním follow-up (F-U) 5 let a mediánu F-U 84 měsíců bylo dosaženo mOS při léčbě chemoradioterapií 49 měsíců ve srovnání s operací, 24 měsíce [4]. Statisticky významný benefit byl pozorován u skupiny pacientů se spinocelulárním karcinomem (mOS 81,6 vs. 21,1 měsíce; HR 0,48), ale také ve skupině chemorezistentnějšího adenokarcinomu došlo k významnému delšímu přežití u pacientů léčených předoperačně chemoradioterapií (mOS 43,2 vs. 27,1 měsíce; HR 0,73). Chemoradioterapie prodloužila 5leté přežití pacientů s lokálně pokročilým karcinomem jícnu celkově o 14 % [12], což je více, než bylo dosaženo u pacientek s karcinomem prsu léčených adjuvantní chemoterapií. Výhodou tohoto režimu je velmi dobrá tolerance, nízká slizniční toxicita a flexibilita při týdenním podávání.
Neadjuvantní či definitivní chemoradioterapie u spinocelulárního karcinomu
Neadjuvantní či definitivní chemoradioterapie u spinocelulárního karcinomu – operace ano či ne? Podle ESMO (European Society for Medical Oncology) guidelines 2016 je neoadjuvantní chemoradioterapie s následnou operací nebo definitivní chemoradioterapie se sledováním a salvage operací v případě perzistence tumoru či lokální recidivy srovnatelným léčebným postupem, ačkoli počet lokálních rekurencí byl vyšší u definitivní chemoradioterapie [13,14]. Dle celkového stavu pacienta jsou tedy variantou oba léčebné postupy. Je však nutné zdůraznit, že dosud neexistují data, která by přímo srovnala obě modality. Proto by terapeutická rozvaha měla proběhnout po pečlivém zhodnocení stavu pacienta, pohovoru s ním a na základě konzultace multidisciplinárního týmu. Definitivní chemoradioterapie je jediným doporučeným postupem u cervikální lokalizace karcinomu jícnu [10].
Operativa lokálně pokročilého karcinomu jícnu
Operace a pooperační komplikace, mortalita a stále vysoká postoperační morbidita jsou však nedílnou součástí komplexní onkologické léčby. Informace o možnosti minimalizace chirurgického přístupu jsou zásadní pro naši klinickou praxi, neboť většinou léčíme polymorbidní pacienty s řadou potenciálních komplikací. Současným standardem je transthorakální ezofagektomie (Ivor-Lewis ezofagektomie). Tento postup je zatížen stále vysokou pooperační morbiditou. Určitou nadějí na zmenšení postoperační morbidity je minimální invazivní přístup. Dle ESMO guidelines 2016 narůstá význam thorakoskopické ezofagektomie nebo operace Ivor Lewis s laparoskopicky asistovanou mobilizací žaludku a otevřenou pravostrannou thorakotomií (hybridní minimálně invazivní ezofagektomie), oba výkony vedly dle randomizovaných studií k nižším postoperačním komplikacím, zejména k redukci plicních komplikací. Na konferenci ESMO 2017 byly francouzskými autory publikovány výsledky studie MIRO. Jednalo se o otevřenou randomizovanou studii na 207 pacientech s resekabilním karcinomem středního a distálního jícnu (s lokalizací pod karinou), kteří podstoupili transthorakální otevřenou ezofagektomii (OE) nebo hybridní minimálně invazivní ezofagektomii (HIME). Postoperační morbidita byla signifikantně vyšší u pacientů s OE než HIME, 64,4 vs. 35,9 %, navíc plicní komplikace byly mnohem častější u pacientů s otevřenou thorakotomií (30,1 vs. 17,7 %). Také byl zaznamenán trend k prodloužení 3letého OS, při mediánu F-U 48,8 měsíce bylo OS 67,0 vs. 54,8 % OE vs. HIME (p = 0,054). HIME má potenciál stát se novým terapeutickým standardem u pacientů s karcinomem středního a dolního jícnu [15].
Lokálně pokročilý adenokarcinom GEJ a žaludku
Standardem je léčba neoadjuvantní konkomitantní chemoradioterapií v případě karcinomu GEJ (viz výše) nebo perioperační chemoterapie. V Evropě je upřednostněna obvykle perioperační chemoterapie [4,16]. Dosavadní standardní režimy, triplet s antracyklinem, nebo dvojkombinace založená na 5-fluorouracilu a cisplatině, budou nahrazeny modifikovaným tripletem s modernějšími cytostatiky – oxaliplatinou a taxanem. Německá skupina AIO (Arbeitsgemeinschaft Internistische Onkologie) publikovala na ASCO (American Society of Clinical Oncology) 2017 studii, která znamená změnu základního perioperačního režimu ve prospěch tripletu s taxanem. Režim FLOT (čtyři cykly předoperační a čtyři cykly pooperační chemoterapie složením 5-flourouracil, leukovorin, oxaliplatina a docetaxel) prokázal jednoznačně superioritu nad dosavadním standardem ECF (epirubincin, cyklofosfamid, 5-fluorouracil). Medián 5letého kalkulovaného OS dosáhl 45 %. Tento významný přínos v OS pacientů s lokálně pokročilým adenokarcinomem GEJ a žaludku je zachován i v případě, kdy podobně jako u ostatních studií pouze 50 % pacientů dokončí pooperační chemoterapii. Relevantní variantou obzvláště u starších pacientů je použití pouze dvojkombinace založené na fluoropyrimidinu a derivátu platiny (cisplatině či lépe oxaliplatině) [11].
V Asii se používá primárně operace a následuje adjuvantní chemoterapie S1 po dobu 1 roku nebo půlroční léčba dupletem XELOX (capecitabine/oxaliplatina) [17]. Tento postup může být použit i u pacientů s karcinomem žaludku, jsou-li z důvodů komplikací (např. krvácející či obturující tumor) nejprve operováni. Adjuvantní chemoradioterapie byla řadu let standardem [18], recentní studie však význam radioterapie v léčbě lokálně pokročilého karcinomu žaludku nepotvrdily. Zdokonalením operační techniky a standardním prováděním D2 lymfadenektomie zanikl zisk v OS pacientů. Zda přinese radioterapie prodloužení celkové délky života u vybrané skupiny pacientů (N2 a intestinální histologie), potvrdí probíhající klinické studie – TOPGEAR (ACTRN12609000035224), CRITICS (NCT00407186) a ARTIST-II (NCT01761461).
Žádná cílená léčba v kombinaci či monoterapii nepřinesla efekt v léčbě lokálně pokročilého karcinomu GEJ a žaludku. Lékem s tímto potenciálem je trastuzumab, neboť se osvědčil v terapii metastatického onemocnění. V Evropě i Asii nyní probíhá EORTC (European Organisation for Research and Treatment of Cancer) studie INNOVATION testující kombinaci trastuzumab/pertuzumab v perioperačním podání (NCT02205047). Význam kombinace s neoadjuvantní chemoradioterapií u adenokarcinomu distálního jícnu hodnotí studie fáze III RTOG 1010.
Metastatický karcinom žaludku
Přes rychlý vývoj onkologie a nástup éry cílené terapie a nověji přes dynamický a extenzivní rozvoj imunoonkologie zůstává celková délka života pacientů s metastatickým onemocněním velmi krátká. Nejjednoduššími prognostickými parametry jsou stále histologický typ a rozsah postižení. Pacienti s adenokarcinomem žaludkudifuzního typu mají zásadně kratší OS než pacienti s intestinálním karcinomem. Asijští pacienti žijí déle, jako důvod se udává časnější záchyt onemocnění, menší četnost difuzních karcinomů a delší celková doba terapie.
Standardním chemoterapeutickým režimem v paliaci je kombinace cisplatiny, dnes pro profil nežádoucích účinků preferujeme již oxaliplatinu, a 5-fluorouracilu nebo jeho derivátů. Kombinovanou léčbou cytostatiky získáme mOS 11–12 měsíců. Triplet s taxany používáme méně s ohledem na větší nežádoucí účinky a snahu zachovat pacientovi s metastatickým onemocněním co nejlepší kvalitu života. Jak již bylo předesláno, v současné době v naší praxi používáme 1–4 linie paliativní chemoterapie. Používaná cystostatika v dalších liniích jsou irinotekan v monoterapii či kombinaci s 5-fluorouracilem, paklitaxel, případně docetaxel. Z cílených léků jsou k dispozici trastuzumab v 1. linii a ramucirumab v 2. linii.
Cílená léčba v praxi u karcinomu GEJ a žaludku
HER2 cílená terapie
Přidání trastuzumabu ke kombinaci 5-fluorouracilu nebo kapecitabinu a cisplatiny u HER2 pozitivních pacientů s karcinomem žaludku a GEJ prodloužilo mOS (13,8 vs. 11,1 měsíce; p = 0,0046) [19]. Ostatní léky směřované proti HER2 v této diagnóze však neuspěly. T-DM1, konjugát trastuzumabu s emtansinem ani pertuzumab, humanizovaná monoklonální protilátka zabraňující dimerizaci HER2 s ostatními receptory HER rodiny, ani lapatinib, EGFR/HER2 tyrozinkinázový inhibitor, nezlepšily přežití pacientů s metastatickým onemocněním. Optimální postup po progresi léčby trastuzumabem není znám.
Antiangiogenní léčba
Antiangiogenní terapie se používá zatím pouze v 2. linii léčby metastatického onemocnění. Studie REGARD a RAINBOW přinesly ramucirumab, monoklonální anti-VEGFR2 protilátku, do klinické praxe. Ramucirumab se používá v monoterapii mOS 3,8 vs. 5,2 měsíce (HR 0,776) či v kombinaci s paklitaxelem, mOS 9,6 vs. 7,4 měsíce; HR 0,807 [7,8].
Léčba checkpoint inhibitory
Léčba checkpoint inhibitory zasahujícími do komplexních interakcí imunitního systému a nádorové buňky představuje nový léčebný koncept. Použitím checkpoint inhibitorů došlo k zásadní změně prognózy maligního melanomu, a tak je dnes standardní součástí léčby maligního melanomu, karcinomu plic či nádoru ledviny. Obecně je efektivní napříč řadou malignit a dosahuje úspěšnosti zhruba u 20 % pacientů. Bohužel zatím nemáme žádný spolehlivý prediktor účinku, který by pomohl selektovat vhodnou populaci pacientů. V tab. 1 je přehled výsledků léčby u karcinomu jícnu a žaludku.
1. Přehled výsledků léčby u karcinomu jícnu a žaludku. Tab. 1. Overview of treatment outcomes in oesophageal and gastric cancer. 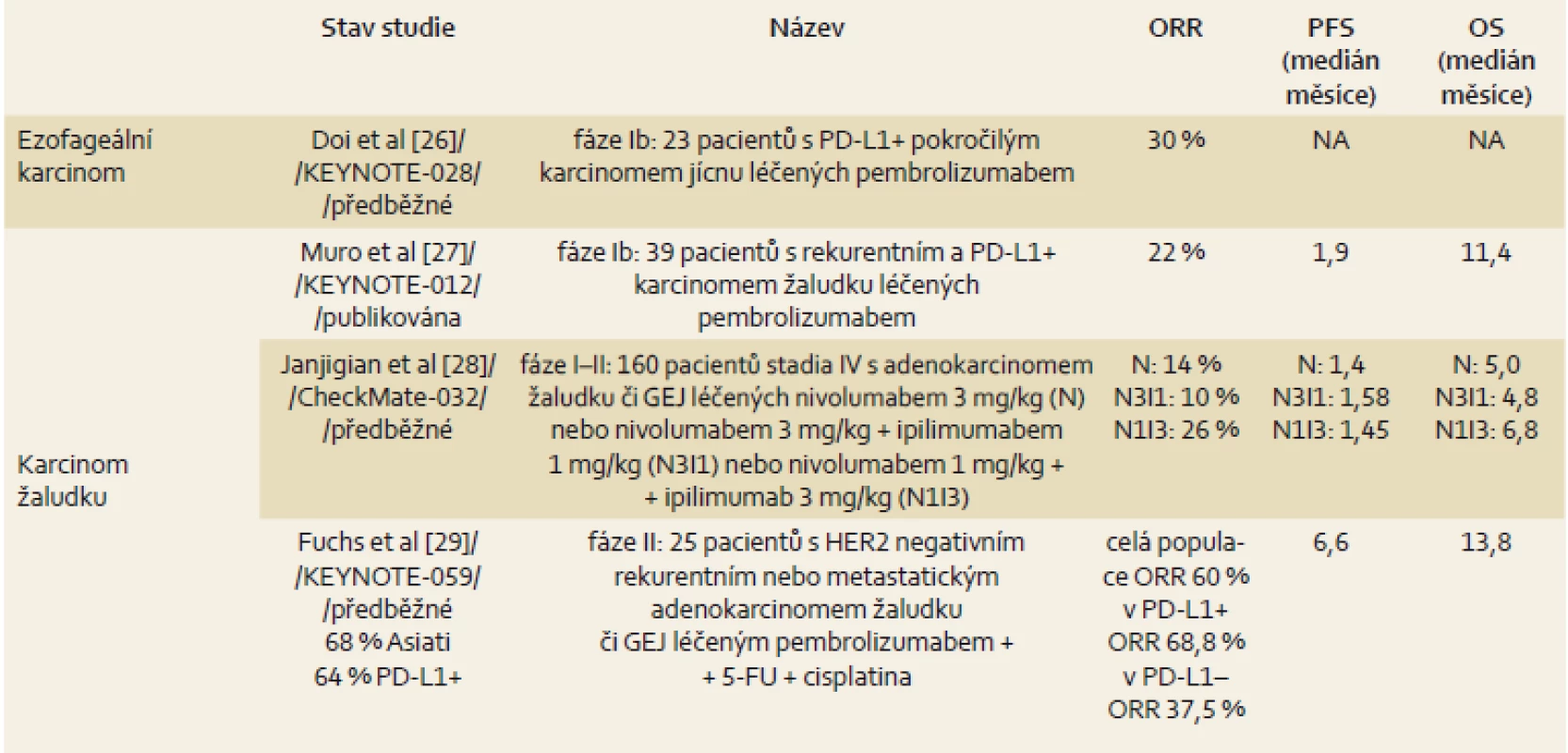
5-FU – 5-fluorouracil, NA – není aplikovatelné, ORR – celková odpověď, OS – celkové přežití, PD-L1 – programmed death ligand-1, PFS – doba do progrese, GEJ – gastroezofageální junkce Paliativní operační výkony – speciální situace v onkologii
Synchronní metastázy
Krvácení či obturující tumor jsou obvyklou indikací paliativní gastrektomie, je-li však pacient asymptomatický, je její význam nejasný. Přínos paliativní gastrektomie při léčbě paliativní chemoterapií je také nejasný, přesto některé publikované studie svědčí v její prospěch. Studie REGATTA prováděná v Asii hodnotila význam paliativní gastrektomie a její výsledky byly nedávno publikovány [20]. Celkem 175 pacientů bylo randomizováno k léčbě samotnou chemoterapií (86 pacientů) nebo gastrektomií následovanou paliativní chemoterapií (89 pacientů). Dvouleté OS dosáhlo 31,7 % u pacientů léčených pouze chemoterapií ve srovnání s 25,1 % u pacientů s provedenou gastrektomií a chemoterapií. Z těchto důvodů není paliativní gastrektomie v situaci paliativní chemoterapie standardně doporučována.
Metastazektomie
Některé kazuistické případy dokladují prodloužení přežití u vybraných pacientů, kteří podstoupili hepatektomii, resekci plicních metatáz nebo operaci pro Krukenbergův tumor [21–23].
Studie RENAISSANCE (NCT02578 368) hodnotí, zda může metastazektomie u oligometastatického onemocnění v situaci perioperační chemoterapie zlepšit průběh onemocnění. Dokud nebudou známy výsledky, musíme považovat metastazektomii za experimentální přístup. Tento výkon je možné zvážit u vysoce selektované populace pacientů.
Peritonektomie
Pacienti pouze s peritoneálním postižením mohou být léčeni cytoredukční operací s hypertermickou intraperitoneální chemoterapií (HIPEC). Tento postup je ovšem mimo Asii podpořen minimálními daty. Francouzská studie hovoří o OS v případě cytoredukční operace a HIPEC, medián 5letého přežití byl u všech pacientů 13 a 23 % u těch, kteří podstoupili kompletní cytoredukční operaci [24,25]. HIPEC je zatím u karcinomu žaludku metodou experimentální.
Závěr
Lokálně pokročilý karcinom GEJ a žaludku je onemocnění se špatnou prognózou. V poslední dekádě však dochází k trendu zlepšení celkového průběhu onemocnění. Perioperační chemoterapií režimem FLOT je dosaženo celkového mediánu 5letého OS až 45 %, což je významné zlepšení. Chemoradioterapie je nosnou metodou u lokálně pokročilého karcinomu jícnu, a to neoadjuvantní či definitivní, naopak u karcinomu žaludku ztrácí své postavení zejména kvůli dokonalejší operativě. Cílená léčba je u této diagnózy zklamáním. Jediným přínosným lékem se známým prediktorem zůstává trastuzumab, bez prediktoru je alternativou v 2. linii léčby metastatického onemocnění antiangiogenní lék ramucirumab. Terapie checkpoint inhibitory bude významnou součástí u podskupiny pacientů. Paliativní chirurgické výkony jsou součástí léčby u komplikovaného onemocnění. U asymptomatického pacienta je paliativní chirurgie experimentálním postupem, nicméně u selektované skupiny symptomatických pacientů může přinést zlepšení průběhu onkologického onemocnění.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15 P03-17-29389A a projekty LO1413, DRO (instituce) a LM15089 BBMRI-CZ.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24.9.2017
Přijato: 27.9.2017
MUDr. Radka Obermannová, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
obermannova@mou.cz
Sources
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc.29 210.
2. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Dostupné z: www.svod.cz.
3. Cunningham D, Allum WH, Stenning SP et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355 (1): 11–20.
4. Boige V, Pignon J, Saint-Aubert B et al. Final results of a randomized trial comparing preoperative 5-FU to surgery alone in adenocarcinoma of the stomach and lower esophagus: FNLCC ACCORD07-FFCD 9703 trial. J Clin Oncol 2007; 25 (18 Suppl): Abstract 4510.
5. Van Hagen P, Hulshof MC, van Lanschot JJ et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012; 366 (22): 2074–2084. doi: 10.1056/NEJMoa1112088.
6. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastrin or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376 (9742): 687–697. doi: 10.1016/S0140-6736 (10) 61121-X.
7. Fuchs CHS, Tomasek J, Yong CJ et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2014; 383 (9911): 31–39. doi: 10.1016/S0140-6736 (13) 61719-5.
8. Wilke HJ, Muro K, Cutsem E et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treat-ed advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol 2014; 15 (11): 1224–1235. doi: 10.1016/S1470-2045 (14) 70420-6.
9. Sjoquist KM, Burmeister BH, Smithers BM et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis. Lancet Oncol 2011; 12 (7): 681–692. doi: 10.1016/S1470-2045 (11) 70142-5.
10. Lee SS, Kim SB, Park SI et al. Capecitabine and cisplatin chemotherapy (XP) alone or sequentially combined chemoradiotherapy containing XP regimen in patiens with free different settings of stage IV esophageal cancer. Jpn J Clin Oncol 2007; 37 (11): 829–835.
11. Khushalani NI, Leichman CG, Proulx G et al. Oxaliplatin in combination with protracted-infusion 5-FU and radiation: report of a clinical trial for patiens with esophageal cancer. J Clin Oncol 2002; 20 (12): 2844–2850.
12. Wong I, Law S. The CROSS road in neoadjuant therapy for esophageal cancer: long-term results of CROSS trial. Transl Cancer Res 2016; 5 (Suppl 3): S415–S419.
13. Stahl M, Stuschke M, Lehmann N et al. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 2005; 23 (10): 2310–2317.
14. Bedenne L, Michel P, Bouché O et al. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 2007; 25 (10): 1160–1168.
15. Davenport L. MIRO: Minimally Invasive Surgery for Esophageal Cancer. Abstract 6150_PR. Presented at: ESMO 2017, Madrid, September 8–12.
16. Cunningham D, Allum WH, Stenning SP et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355 (1): 11–20.
17. Noh SH, Park SR, Yang HK et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15 (12): 1389–1396. doi: 10.1016/ S1470-2045 (14) 70473-5.
18. Macdonald JS, Smalley SR, Benedetti J et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345 (10): 725–730.
19. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastrin or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376 : 687–697. doi: 10.1016/S0140-6736 (10) 61121-X.
20. Fujitani K, Yang HK, Mizusawa J et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncol 2016; 17 (3): 309–318. doi: 10.1016/S1470-2045 (15) 00553-7.
21. Markar SR, Mikhail S, Malietzis G et al. Influence of surgical resection of hepatic metastases from gastric adenocarcinoma on long-term survival: systematic review and pooled analysis. Ann Surg 2016; 263 (6): 1092–1101. doi: 10.1097/SLA.000 0000000001542.
22. Shiono S, Sato T, Horio H et al. Outcomes and prognostic factors of survival after pulmonary resection for metastatic gastric cancer. Eur J Cardiothorac Surg 2013; 43: e13–e16. doi: 10.1093/ejcts/ezs 574.
23. Rosa F, Marrelli D, Morgagni P et al. Krukenberg tumors of gastric origin: the rationale of surgical resection and peri-operative treatments in a multicenter western experience. World J Surg 2016; 40 (4): 921–928. doi: 10.1007/s00268-015-33 26-8.
24. Yang XJ, Huang CQ, Suo T et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase III randomized clinical trial. Ann Surg Oncol 2011; 18 (6): 1575–1581. doi: 10.1245/s10434-011-1631-5.
25. Glehen O, Gilly FN, Arvieux C et al. Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Ann Surg Oncol 2010; 17 (9): 2370–2377. doi: 10.1245/s10434-010-1039-7.
26. Doi T, Piha-Paul SA, Jalal SI et al. Updated results for the advanced esophageal carcinoma cohort of the phase Ib KEYNOTE-028 study of pembrolizumab (MK-3475). J Clin Oncol 2016; 34 (4 Suppl). Abstract 7.
27. Muro K, Chung HC, Shankaran V et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016; 17 (6): 717–726. doi: 10.1016/S1470-2045 (16) 00175-3.
28. Janjigian YY, Bendell JC, Calvo E et al. CheckMate-032: Phase I/II, open-label study of safety and activity of nivolumab (nivo) alone or with ipilimumab (ipi) in advanced and metastatic (A/M) gastric cancer (GC). J Clin Oncol 2016; 34 (15 Suppl). Abstract 4010.
29. Fuchs CS, Doi T, Jang RW et al. KEYNOTE-059 cohort 1: efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol 2017; 35 (15 Suppl): Abstract 4003.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2017 Issue 5-
All articles in this issue
- 31st Hildebrand Bardejov Gastroenterology Days
- The selection from international journals
- Meteospasmyl – a fixed combination of alverine citrate and simethicone in the treatment of digestive tract functional disorders
- Good news in uncertain times
- Participation of the Czech population in the Colorectal Cancer Screening Programme – trends and current situation
- Comments on the article ‘Participation of the Czech population in colorectal cancer screening – trends and current situation’ in light of the National Colorectal Cancer Screening Programme in Slovakia
- Risk factors for local residual neoplasia after endoscopic mucosal resection
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Modern treatment of oesophageal cancer, gastroesophageal junction and stomach – 2017 update
- An example of a multidisciplinary approach for the treatment of metastatic rectal carcinoma
- Diagnosis and therapy of hepatitis B virus infection – Czech national guidelines
- An unusual case of gallstone ileus
- In memoriam: Professor Henri Sarles, one of the founders of modern pancreatology
- Inflammatory bowel disease and gastrointestinal malignancies – risks, incidence and management
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Meteospasmyl – a fixed combination of alverine citrate and simethicone in the treatment of digestive tract functional disorders
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Risk factors for local residual neoplasia after endoscopic mucosal resection
- Modern treatment of oesophageal cancer, gastroesophageal junction and stomach – 2017 update
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

