-
Medical journals
- Career
Lymfom imitující GIST
Authors: M. Ďurovcová 1; O. Urban 2,3; V. Zoundjiekpon 2; V. Procházka 4; D. Žiak 5; P. Kovala 1
Authors‘ workplace: Interna, Městská nemocnice Ostrava, p. o. 1; Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava 2; Lékařská fakulta OU v Ostravě 3; Hemato-onkologická klinika LF UP a FN Olomouc 4; CGB laboratoř, a. s., Vzdělávací a výzkumný institut AGEL, o. p. s., Ostrava 5
Published in: Gastroent Hepatol 2016; 70(3): 230-234
Category: Digestive Endoscopy: Case Report
doi: https://doi.org/10.14735/amgh2016csgh.info07Overview
Gastrointestinální stromální tumory jsou nejčastější mezenchymální nádory gastrointestinálního traktu. V endoskopickém obraze vidíme tyto tumory jako subepiteliální lézi s intaktní sliznicí. Diferenciální diagnostika subepiteliálních lézí je široká. Prezentujeme případ pacienta s MALT lymfomem žaludku, jehož endoskopický obraz imituje gastrointestinální stromální tumor. Současná léčba MALT lymfomu se zásadně liší od terapie gastrointestinálního stromálního tumoru. Ačkoli endosonografické vyšetření hraje významnou roli ve vyšetřovacím algoritmu subepiteliálních lézí, k přesné diagnostice je nutná histologická verifikace.
Klíčová slova:
gastrointestinální stromální tumor – GIST – MALT lymfomÚvod
Termín submukózní tumory, přesněji subepiteliální léze (SEL), je používán pro širokou skupinu non-neoplastických, benigních, premaligních nebo maligních lézí lokalizovaných ve stěně trávicí trubice pod vrstvou intaktní sliznice. SEL nacházíme často náhodně při endoskopickém vyšetření z jiné indikace. Prevalence submukózních žaludečních lézí není vysoká a činí 0,4 % [1]. K diagnostice těchto lézí využíváme endosonografické vyšetření (EUS) jako nejpřesnější zobrazovací modalitu. EUS dokáže nejen odlišit SEL od extramurální, umožňuje také přesně zobrazit vrstvu trávicí stěny, ze které léze vychází, posoudí vzhled a velikost léze, její echogenitu, vaskularitu a okolní lymfadenopatii. Limitací EUS je nedostatečná přesnost v odlišení maligní léze od benigní. Bylo dokumentováno, že samotné EUS má 64% senzitivitu a 80% specifitu v diferenciaci maligních a benigních SEL. Kombinace EUS a endosonograficky navigované tenkojehlové aspirační biopsie (FNA – fine needle aspiration) zvyšuje přesnost diagnostiky SEL (80 – 91 %) [2].
Popis případu
Pacient, 65 let, léčený pro diabetes, hypertenzi, fibrilaci síní, s aneuryzmatem abdominální aorty v anamnéze, byl došetřován pro intermitentní bolesti břicha a váhový úbytek. V říjnu 2009 na jiném pracovišti diagnostikovali u pacienta ulceraci těla žaludku, histologicky Helicobacter pylori pozitivní. Pacient byl léčen standardní antibiotickou eradikační terapií. Při kontrolním endoskopickém vyšetření v prosinci 2009 bylo popsáno zhojení léze, H. pylori z biopsie byl negativní. V roce 2010 jsme provedli na endoskopickém pracovišti Vítkovické nemocnice vyšetření horní části trávicího traktu s nálezem subepiteliálního tumoru v oblasti subkardie s makroskopicky intaktní sliznicí na povrchu léze (obr. 1). Klešťová biopsie z léze byla negativní, stejně tak H. pylori v biopsii nebyl prokázán. Při EUS jsme zobrazili hypoechogenní ložisko o rozměrech 33 × 23 mm vycházející z II. echovrstvy (muscularis mucosae) s ojedinělou perigastrickou lymfatickou uzlinou benigního vzhledu velikosti 11 × 4 mm (obr. 2). Pacientovi jsme navrhli FNA pod EUS kontrolou, pacient však preferoval sledování, kontrolní vyšetření jsme naplánovali za 12 měsíců. V roce 2011 jsme na kontrolním EUS zjistili významnou progresi velikosti ložiska s rozměry 47 × 45 × 50 mm (obr. 3). Provedli jsme endosonograficky navigovanou tenkojehlovou biopsii (EUS-FNA) 22 G jehlou. Cytologický nález byl nejednoznačný, v diferenciální diagnostice byl zvažován MALT (mucosa associated lymphoid tissue) lymfom a DLBCL (diffuse large B cell lymphoma). Následně jsme provedli biopsii „klíčovou dírkou“ (KHB – key-hole biopsy), která potvrdila diagnózu MALT lymfomu (obr. 4). V histologických vzorcích byla prokázána exprese CD20+, BCL2+, Ki-67 1 – 5 % (obr. 5). V rámci komplexního došetření jsme u pacienta doplnili CT plic s nálezem ložiskového postižení, histologicky byl také potvrzen lymfom. Pacienta jsme odeslali na Hemato-onkologickou kliniku ve FN Olomouc, kde před zahájením léčby provedli vyšetření na antigen H. pylori ve stolici s negativním výsledkem. Pacient podstoupil imunochemoterapii dle protokolu R-COP (Rituximab, Cyclophosfamide, Vincristine, Prednison) / R-CHOP (Rituximab, Cyclophosfamide, Doxorubicin, Vincristine, Prednison), celkem osm cyklů chemoterapie, následně radioterapie na PET pozitivní reziduum v oblasti žaludku 36 Gy do června 2012. V lednu 2013 bylo dosaženo kompletní remise s normalizací endoskopického nálezu (obr. 6). Pacient byl klinicky bez trávicích potíží.
Image 1. Endoskopický obraz submukózního nádoru v žaludku. Fig. 1. Endoscopic image of submucosal tumor in the stomach. 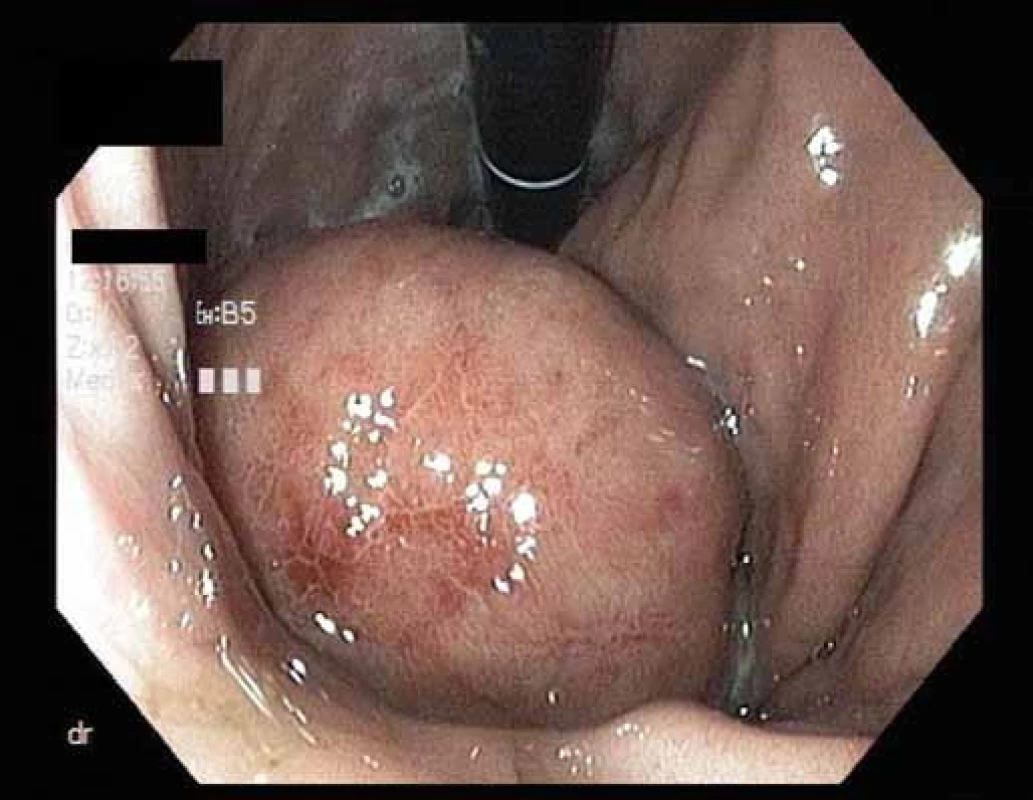
Image 2. EUS nález – hypoechogennní léze 33 × 23 mm vycházející ze 2. echovrstvy – muscularis mucosae. Fig. 2. EUS findings – hypoechoic lesion 33 ×23 mm originating from the 2<sup>nd</sup> echolayer – muscularis mucosae. 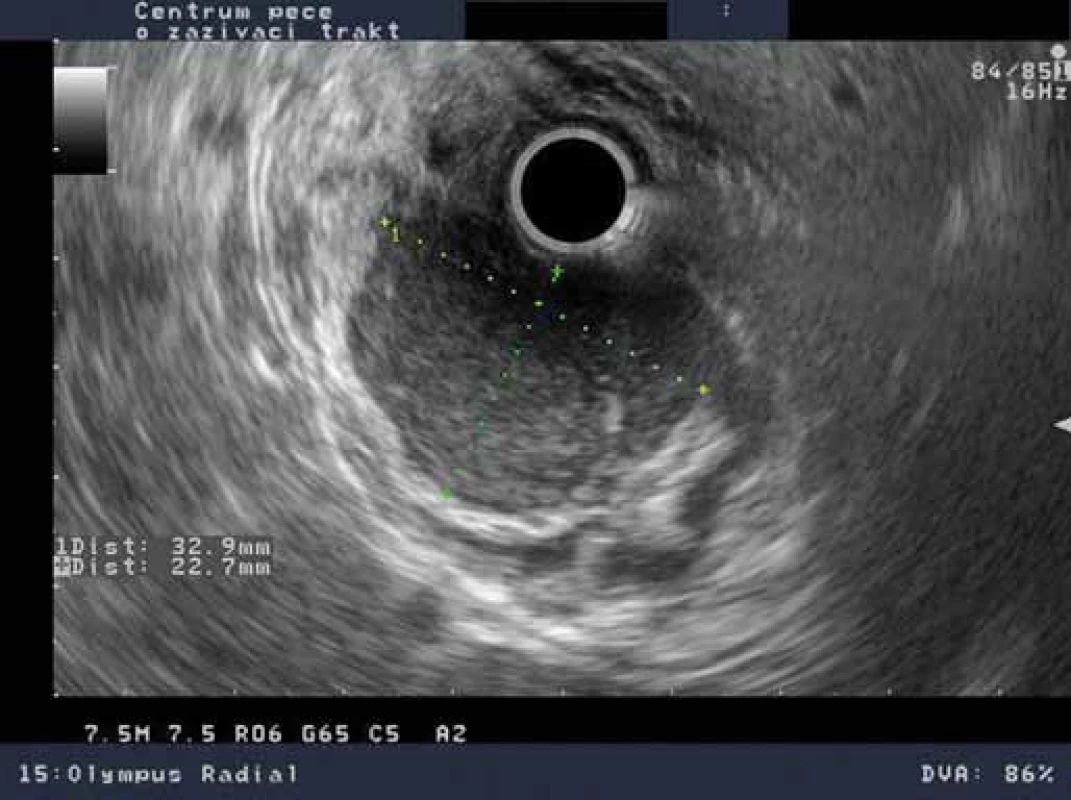
Image 3. EUS nález s progresí – hypoechogenní léze 47 × 45 × 50 mm vycházející ze 2. echovrstvy. Fig. 3. EUS findings with progression – hypoechoic lesion 47 × 45 × 50 mm originating from the 2<sup>nd</sup> echolayer. 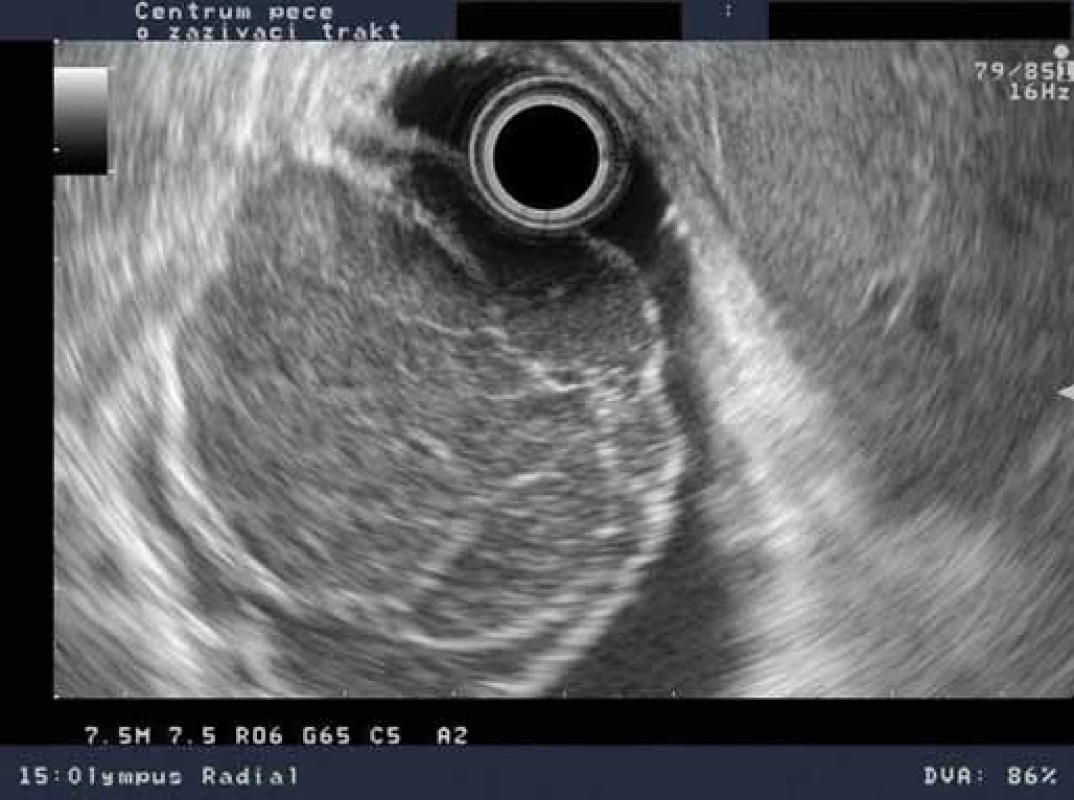
Image 4. Histologická diagnóza, barvení hematoxylin-eozin. Fig. 4. Histologic diagnosis, haematoxylin-eosin staining. 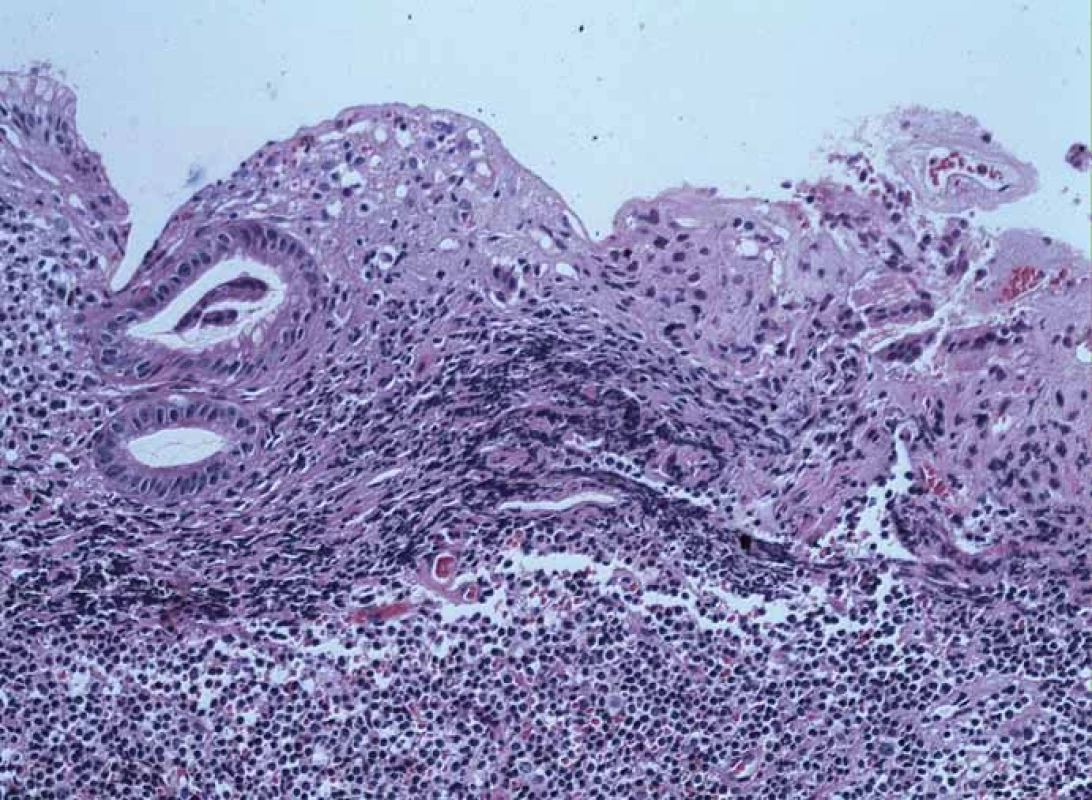
Image 5. Imunohistochemie, proliferační marker Ki-67. Fig. 5. Immunohistochemical staining, proliferation marker Ki-67. 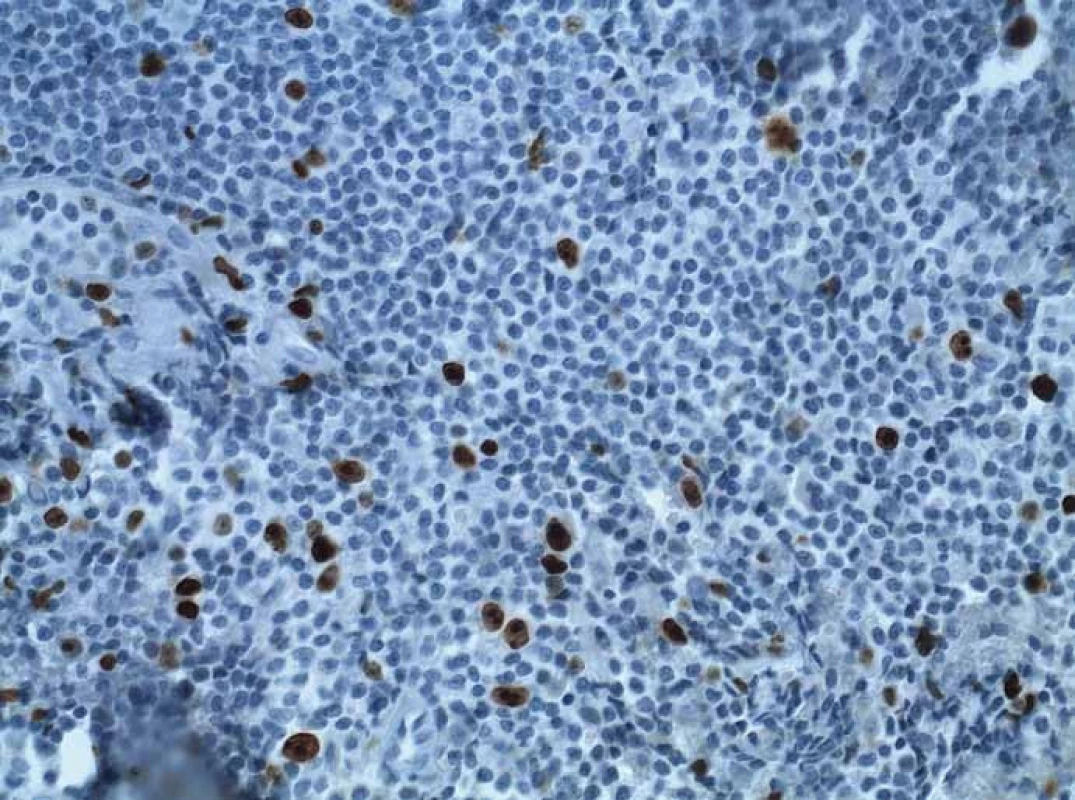
Image 6. Endoskopický obraz po terapii. Fig. 6. Endoscopic image after therapy. 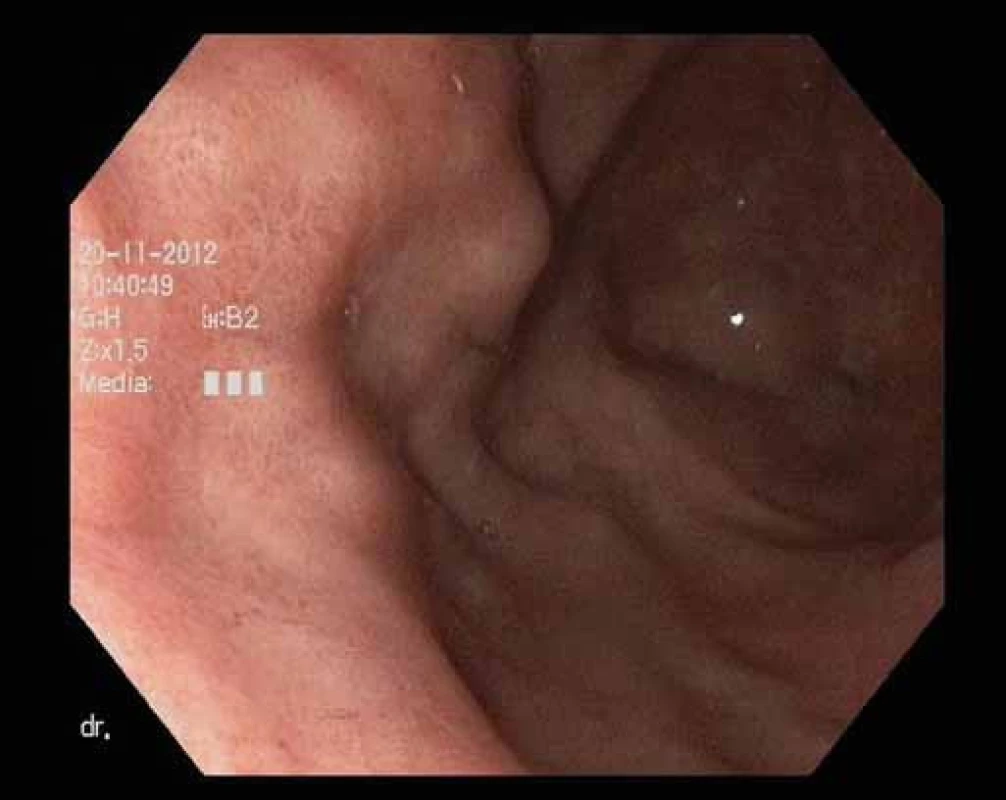
Diskuze
Gastrointestinální stromální nádory (GIST) jsou nejčastější mezenchymální tumory gastrointestinálního traktu (GIT). Aktuální incidence GIST je odhadována minimálně na 10 – 20 případů na 1 mil. osob za rok, prevalence GIST je odhadována na 120 – 150 případů na 1 mil. osob [3]. GIST vycházejí z prekurzorů Cajalových buněk a vykazují v 80 % mutaci genu receptoru tyrosinkinázy c Kit a/ nebo růstového destičkového faktoru α. GIST představují podle různých literárních údajů 2 – 5 % ze všech gastrointestinálních malignit [4].
V 60 – 70 % nalézáme GIST v žaludku, méně často v tenkém střevě (20 – 30 %), v 5 – 15 % v tlustém střevě a raritně v jícnu a v rektu (5 %). Žádný GIST nemůže být považován za pravý benigní nádor [5]. K určení stupně rizika malignity GIST se používá velikost tumoru, mitotická aktivita a lokalizace v GIT. V endoskopickém obraze typicky nacházíme submukózní dobře ohraničenou masu vyklenující se do lumen GIT, krytou intaktní sliznicí. V některých případech může být povrch GIST exulcerován. Endosonograficky GIST vidíme jako ohraničenou hypoechogenní homogenní masu vycházející ze IV. vrstvy muscularis propria nebo z II. vrstvy muscularis mucosae. Přibližně 75 % ze všech hypoechogenních submukózních nádorů žaludku > 2 cm jsou GIST, přičežětšina z nich má nízký maligní potenciál. Diferenciální diagnostika je široká, zahrnuje např. leiomyom, leiomyosarkom, maligní melanom, schwannom, desmoidní tumor, zánětlivý myofibroblastický tumor, fibrózní nádor, sarkomatoidní karcinom, neuroendokrinní karcinom, angiosarkom vzácně i lymfom [6]. Definitivní diagnóza GIST může být tedy stanovena pouze histologicky. GIST vykazují charakteristické imunohistochemické znaky, v 95 % případů je exprese CD117 antigenu, v 60 – 70 % je pozitivní CD34 [5]. Klešťová biopsie je zpravidla nevýtěžná. K získání histologie využíváme EUS-FNA a EUS navigovanou tru-cut biopsii (EUS-TCB). EUS-FNA umožňuje získat reprezentativní materiál pro cytologické zhodnocení v 70 – 84 % případů. Její diagnostická výtěžnost je často limitována nedostatečným množstvím materiálu potřebným pro imunohistochemické vyšetření, které je nezbytné pro odlišení GIST od ostatních mezenchymálních nádorů, např. leiomyomu a schwannomu [7]. Podmínkou pro imunohistochemické vyšetření je zpracování části cytologického materiálu získaného při EUS-FNA metodou cytobloků. V praxi je výhodný odběr materiálu ze dvou vpichů do léze při jednom endoskopickém výkonu a přítomnost cytopatologa na odběrovém sálku (ROSE – rapid on-site evaluation) [8]. EUS-TCB není přesnější než EUS-FNA v diagnostice SEL, avšak jejich kombinace má vyšší výtěžnost než jednotlivé metody samostatně [9]. Provedení EUS-TCB je omezeno lokalizací a velikostí submukózních tumorů vzhledem k délce tru-cut jehly. Pomocí EUS navigované biopsie (FNA/ TCB) není možné spolehlivě stanovit mitotický index, a tím predikovat jejich maligní potenciál [7]. Tento nedostatek je možné nahradit vyšetřením nukleárního proteinu asociovaného s buněčnou proliferací Ki-67, který se dle literárních zdrojů ukazuje jako významný prognostický parametr progrese onemocnění [8]. Další metodou získání histologie je KHB. Tato metoda umožňuje získat více bioptického materiálu, kontroverzní zůstává otázka perforace nádoru, která se uvádí jako samostatný negativní prognostický faktor [10]. Žiak et al ve své práci konstatovali, že výsledky cytologického vyšetření materiálu z EUS-FNA byly pro diagnostiku GIST z pohledu patologa srovnatelné s klešťovou biopsií, event. resekcí [8]. Léčba je převážně chirurgická a spočívá v odstranění clého nádoru bez porušení jeho celistvosti. Extenzivní resekce a rozsáhlejší lymfadenektomie nejsou indikovány ani u pokročilých onemocnění vzhledem k nízkému výskytu metastáz ve spádových uzlinách [11]. Klasická chemoterapie a radioterapie je neúčinná. Významného pokroku v léčbě metastatického GIST bylo dosaženo molekulárně cílenou léčbou. Zavedení imatinibu-inhibitoru tyrosinových kináz do léčby pacientů s GIST znamenalo zásadní průlom v prognóze pacientů.
Primární gastrointestinální lymfomy jsou extranodální lymfomy, které se v pokročilém stadiu mohou šířit do uzlin a extralymfatických orgánů. Tvoří asi 30 – 40 % všech extranodálních lymfomů [12]. Lymfom je druhý nejčastější nádor žaludku, žaludek je postižen v 60 – 75 % případů. Mezi nejčastější typy lymfomů v GIT patří difuzní velkobuněčný B lymfom a MALT lymfom. MALT lymfomy tvoří 50 % všech primárně gastrických non-hodgkinských lymfomů a vyskytují se hlavně u starších osob nad 50 let, převaha postižení mužů 1,5 : 1. Nejčastěji se MALT lymfom vyskytuje v žaludku, méně často v tenkém střevě, tlusté střevo bývá postiženo vzácně. Žaludeční sliznice za normálních okolností na rozdíl od střeva neobsahuje lymfatickou tkáň, ale tato se zde může vyvinout zejména při imunitní odpovědi na infekční agens (H. pylori, virus Epsteina a Barrové, Campylobacter). Vzniku MALT lymfomu většinou předchází chronický zánět způsobený H. pylori. Asociace mezi H. pylori a MALT lymfomem žaludku je pozorována v 80 – 90 % případů [13]. U 10 – 50 % pacientů s gastrickým MALT lymfomem nalézáme translokaci t(11;18) (q21;q21). Pacienti s touto chromozomální translokací nereagují na eradikační léčbu H. pylori [14]. Diagnostika lymfomů je obtížná. Endoskopický obraz žaludečního lymfomu je vysoce nespecifický, od změn připomínajících gastritidu přes hyperplastické řasy, ulcerozní léze, polypoidní útvary až po submukózní tumor jako v našem případě. Nádorové buňky exprimují antigeny B buněk marginální zóny: CD20, CD79a, BCL2, IgM a variabilně CD43 a CD11c. Nádorový infiltrát se ze sliznice a submukózy kontinuálně šíří přes muscularis propria na serózu a dále do okolních tkání. Nádorové buňky mohou infiltrovat regionální lymfatické uzliny a jiné části GIT nebo slezinu, metastatické postižení kostní dřeně je vzácné. EUS je suverénní metodou v diagnostice lymfomu. Určuje lokální rozsah postižení stěny GIT a případně infiltraci nejbližšího okolí. EUS vyšetření nám umožňuje stanovit hloubku invaze lymfomu s 89% senzitivitou a 97% specifitou [1]. Avšak ani EUS zobrazení není pro MALT lymfom patognomické. EUS obraz lymfomu může být hypoechogenní, jako tomu bylo u našeho pacienta, stejně tak se může jednat o hyperechogenní masu nebo smíšenou lézi [15]. Ke stanovení diagnózy jsou tedy biopsie nutné. Klešťová biopsie však může být nevýtěžná, proto je potřeba při podezření na lymfom volit k minimalizaci potenciální chyby při získávání vzorku další odběr, např. s použitím EUS-FNA nebo KHB. Tradiční biopsie bývají pozitivní pouze v 50 % [1]. Při podezření na lymfoproliferaci je důležité odebrat alespoň 8 – 10 kvalitních vzorků. V případě nediagnostické biopsie lze zvážit použití konfokální laserové endomikroskopie (CLE). Ta by mohla být nápomocná k určení okrajů léze a k přesnému zacílení místa odběru biopsie z abnormálně vypadající tkáně. Použití CLE je limitováno v případech infiltrace buňkami lymfomu v hlubších vrstvách stěny, což je i omezením při použití CLE v diagnostice jiných SEL [16 – 18]. Vstupní určení klinického stadia MALT lymfomu zahrnuje CT s kontrastní látkou v rozsahu krk, hrudník, břicho a pánev a dále provedení biopsie kostní dřeně. Současně vyšetřujeme průkaz H. pylori a vyšetření na translokaci t(11;18). MALT lymfomy mají obecně velmi dobrou prognózu s mediánem přežití v pěti letech kolem 85 % [13]. Léčba je v kompetenci hematoonkologa a zahrnuje antibiotickou eradikaci H. pylori, která je základem léčby u pacientů s H. pylori pozitivními gastrickými MALT lymfomy stadia I + II/ 1 (dle „Lugano“ klasifikace). Podle posledních poznatků eradikační terapie H. pylori může vést k regresi lymfomu i v pokročilejších stadiích onemocnění, a to dokonce i u pacientů, kteří jsou H. pylori negativní [13,19]. Eradikace H. pylori se kontroluje minimálně šest týdnů po ukončení antibiotik a alespoň dva týdny po ukončení inhibitorů protonové pumpy. Pokročilejší stadia (II/ 2 a více) gastrických lymfomů, MALT lymfomy nereagující na eradikaci a H. pylori negativní pacienti jsou indikováni k radioterapii, případně kombinaci radioterapie a systémové imunochemoterapie obsahující protilátku anti-CD20 (rituximab) v různých režimech. Chirurgická léčba je indikována pouze při komplikacích, např. krvácení, perforaci či obstrukci [13]. I po úspěšné léčbě a eradikaci je vhodné pacienty s MALT lymfomem žaludku dále sledovat. Makroskopické odlišení reziduálního lymfomu je obtížné a je opět vyžadován odběr vzorků k histologickému vyšetření. Pacienti mají několikanásobně vyšší riziko vzniku karcinomu žaludku.
Závěr
Optimální management terapie a sledování zejména malých SEL zůstává nadále kontroverzní. Studie ukazují, že samotné EUS nálezy nestačí k jednoznačnému posouzení, zda má být submukózní léze v žaludku resekována či ponechána ke sledování. EUS nemůže nahradit histologicky stanovenou diagnózu. V diferenciální diagnostice SEL je třeba pomýšlet i na takové nálezy, jako je lymfom. Získání histologie může zásadním způsobem ovlivnit léčbu pacienta.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 8. 2015
Přijato: 2. 10. 2015
MU Dr. Martina Ďurovcová
Interna Městská nemocnice Ostrava, p. o.
Nemocniční 898/ 20A
728 80 Ostrava
durovcovamartina@seznam.cz
Sources
1. Hawes R, Fockens P. Submucosal lesions et EUS in the evaluation of gastric wall layer abnormalities – Non-Hodgkin lymphoma and other causes. In: Hawes R, Fockens P, Varadarajulu S (eds). Endosonography. Philadelphia: Saunders Elsevier 2006; 99 – 109, 127 – 146.
2. Karaca C, Turner BG, Cizginer S et al. Accuracy of EUS in the evaluation of small gastric subepithelial lesions. Gastrointest Endosc 2010; 71(4): 722 – 727. doi: 10.1016/ j.gie.2009.10.019.
3. Linke Z. Gastrointestinální stromální nádor. Lékařské listy 2012. [online]. Dostupné z: http:/ / zdravi.e15.cz/ clanek/ priloha-lekarske-listy/ gastrointestinalni-stromalni-nador-463623.
4. Zezulová M, Melichar B. Adjuvantní terapie imatinibem u gastrointestinálních stromálních tumorů. Onkologie 2010; 4(5): 318 – 321.
5. Plank L. Bioptická diagnostika gastrointestinálnych stromálnych nádorov. Onkologie 2007; 1(2): 73 – 78.
6. Zoundjiekpon V, Urban O, Rydlo M et al. Diagnostika gastrointestinálních stromálních tumorů. Onkologie 2014; 8(6): 249 – 256.
7. Kliment M, Urban O. Endosonograficky (EUS)-navigovaná biopsia v gastroenterológii – klinické doporučenie Európskej spoločnosti pre gastrointestinálnu endoskopiu (ESGE). Endoskopie 2011; 20(3 – 4): 104 – 107.
8. Žiak D, Dvořáčková J, Hurník P et al. Gastrointestinální stromální tumory, morfologická a imunohistochemická vyšetření z pohledu bioptického a cytologického odběru. Onkologie 2014; 8(6): 259 – 263.
9. Fernández-Esparrach G, Sendino O, Solé M et al. Endoscopic ultrasound-guided fine-needle aspiration and trucut biopsy in the diagnosis of gastric stromal tumors: a randomized crossover study. Endoscopy 2010; 42(4): 292 – 299. doi: 10.1055/ s-0029-1244074.
10. Šufliarsky J. Pokroky v liečbě gastrointestinálnych stromálných tumorov. Onkologie 2007; 1(2): 61 – 65.
11. Oliverius M, Varga M. Chirurgická léčba gastrointestinálních stromálních nádorů. Onkologie 2010; 4(1): 9 – 12.
12. Sopirjaková P, Belada D, Kopáčová M. Lymfomy tenkého střeva. Gastroent Hepatol 2013; 67(5): 377 – 380.
13. Janíková A, Zambo I, Baumeisterová A et al. Lymfomy gastrointestinálního traktu – klinicko-patologický přehled. Transfuze Hematol dnes 2013; 19(3): 140 – 151.
14. Tomíška M, Vášová I. Současná terapie primárních lymfomů gastrointestinálního traktu. Klin Farmakol Farm 2004; 18 : 153 – 159.
15. Baek HD, Kim GH, Song GA. Primary esophageal mucosa-associated lymphoid tissue lymphoma treated with endoscopic resection. Gastrointest Endosc 2012; 75(6): 1282 – 1283. doi: 10.1016/ j.gie.2011.06.003.
16. Dolak W, Kiesewetter B, Muellauer L.A pilot study of confocal laser endomicroscopy for staging and follow up of gastrointestinal MALT-lymphoma: interim analysis of 15 consecutive cases. Gastrointest Endosc 2013; 77 (Suppl 5): AB260 – AB261.
17. Kav T, Ozen M, Uner A. How confocal laser endomicroscopy can help us in diag-nosing of gastric lymfomas? Bratisl Lek Listy 2012; 113(11): 680 – 682.
18. Ono S, Kato M, Ishigaki S et al. In vivo cellular imaging of gastric mucosa-associated lymphoid tissue lymphoma in a Helicobacter pylori-negative patient. Gastrointest Endosc 2014; 79(1): 163 – 164. doi: 10.1016/ j.gie.2013.08.008.
19. Fischbach W. Gastric mucosa-associated lymphoid tissue lymphoma: a challenge for endoscopy. Gastrointest Endosc 2008; 68(4): 632 – 634. doi: 10.1016/ j.gie.2008.05.021.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 3-
All articles in this issue
- Digestivní endoskopie a endoterapie
- Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie
- Terapeutická endosonografia – súčasné postavenie
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
- První endoskopická submukózní resekce subepiteliálního nádoru (GIST) jícnu v ČR
- Lymfom imitující GIST
- Stenóza tlustého střeva neobjasněné etiologie
- Využití panelu somatických genových mutací a amplifikací pro odhad prognózy pacientů s karcinomem žaludku
- Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci
- The 38th Czech and Slovak Endoscopic Days
- 15th Czech-Slovak IBD symposium and IBD work ing days, Hořovice 2016
- Výběr z mezinárodních časopisů
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Těžký (komplikovaný) průběh virové hepatitidy A v Cotonou (Benin) u nedostatečně očkovaného pacienta španělského původu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza tlustého střeva neobjasněné etiologie
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

