-
Medical journals
- Career
Multiband mukozektómia včasného spinocelulárneho karcinómu pažeráka
Authors: R. Husťak 1; P. Fojtík 2; M. Kliment 2; Přemysl Falt 2; M. Hanousek 2; V. Zoundjiekpon 2; E. Kundratová 2; I. Ferák 3
Authors‘ workplace: Interná klinika Nemocnica Košice-Šaca a. s., 1. súkromná nemocnica 1; Vzdělávací a výzkumný institut AGEL, o. p. s. – pobočka Ostrava-Vítkovice, Vítkovická nemocnice a. s., Centrum péče o zažívací trakt 2; Oddělení patologie, Nemocnice Nový Jičín 3
Published in: Gastroent Hepatol 2013; 67(3): 188-193
Category: Digestive Endoscopy: Case Report
Overview
Aj keď kvalita liečby skvamocelulárneho karcinómu pažeráka je v našich krajinách na vysokej úrovni, stále zaostávame v záchyte jeho včasných štádií, nakoľko u väčšiny prípadov v čase endoskopického vyšetrenia je ochorenie už v pokročilom štádiu. V prípade superficiálnych neoplazií GIT je základným predpokladom pre úspešnú endoskopickú liečbu, aby potenciálna mortalita sprevádzajúca chirurgický výkon bola vyššia než riziko úmrtia na disseminované ochorenie. Pri povrchových neopláziach sa jedná hlavne o lymfatické postihnutie. Rozhodujúcou a smerodajnou sa javí depistáž rizikových skupín populácie. Formou kazuistiky prezentujeme prípad pacientky so záchytom včasného skvamocelulárneho karcinómu pažeráka liečeného endoskopickou resekciou využívajúc multiband techniku. Táto metóda je relatívne jednoduchá a v naších podmienkach dostupná. Predstavuje alternatívu formy endoskopickej resekčnej techniky oproti zaužívanej mukozálnej resekcii realizovanej pomocou nadstavca, tzv. capu.
Kľúčové slová:
multiband mukozektómia – high-grade intraepiteliálna neoplázia – skvamocelulárny karcinóm pažerákaPopis prípadu
Začiatkom januára 2013 sme vyšetrili 63-ročnú pacientku v anamnéze s kardiovaskulárnym predchorobím – komorovej extrasystólie a esenciálnej artériovej hypertenzie, bez inej závažnej anamnézy, pre neoplastickú slizničnú léziu strednej tretiny pažeráka typu 0-IIb + Is (podľa parížskej klasifikácie) veľkosti približne 20 mm (obr. 1A). Prvotné endoskopické vyšetrenie pre horný dyspeptický syndróm bolo realizované v spádovej gastroenterologickej ambulancií. Vzhľadom na nález popisovanej lézie bola následne poukázaná na vyššie špecializované pracovisko. Laboratórny nález pri prijatí bol až na hraničnú leukocytózu (10,6 × 109/l) bez výraznejšej patológie.
Po podpísaní informovaného súhlasu, v analgosedácii frakcionovaným intravenóznym podávaním midazolamu a butylskopolamínu, sme pristúpili k úvodnému endoskopickému vyšetreniu prístrojom Olympus GIF H180. V NBI móde (obr. 1B) a následnou chromodiagnostikou Lugolovým roztokom (obr. 1C) sme verifikovali za rezákmi vo vzdialenosti 28 cm orálny a v 30 cm aborálny okraj Lugol-negatívnej lézie. Kontrolná rebiopsia potvrdila high-grade intraepiteliálnu neopláziu (HGIN).
Image 1. Endoskopické snímky včasného ESCC. A – zobrazenie bielym svetlom, B – zobrazenie v NBI, C – farbenie Lugolovym roztokom. Fig. 1. Endoscopic images of an early ESCC. A – white light endoscopy, B – narrow band imaging, C – Lugolʹs staining. 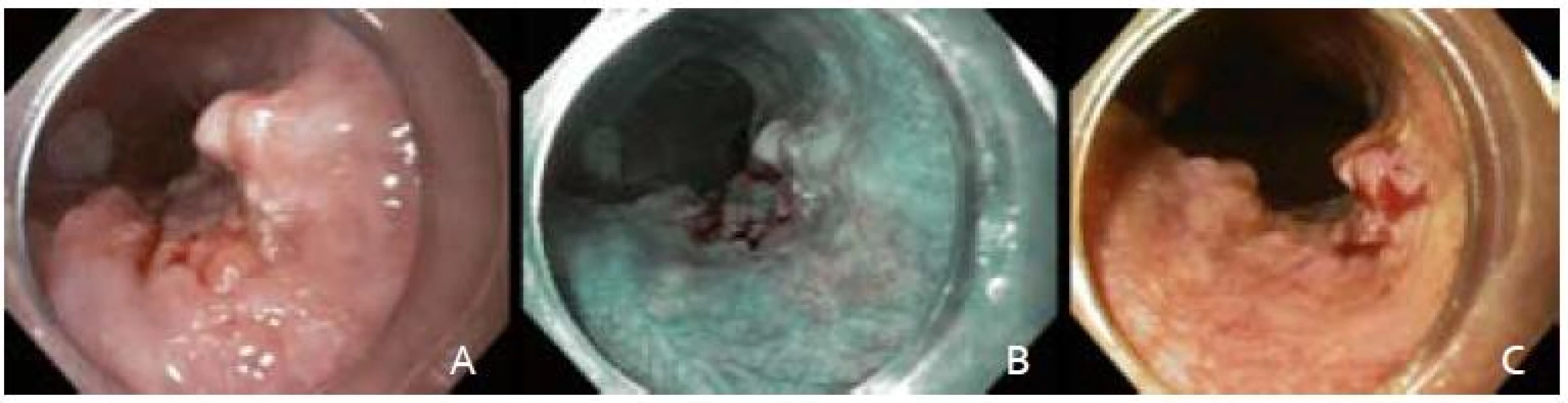
K posúdeniu stagingu lézie následne pacientka podstúpila endosonografické vyšetrenie (EUS) radiálnou sondou Olympus GF-UE 160 + Aloka SSD Alpha 5. EUS vyšetrením sme léziu zobrazili ako nehomogénne hypoechogénne ložisko lokalizované v I. a II. EUS vrstve (histologicky odpovedajúcej mukóze). V mieste lézie stena pažeráka dosahovala 4,2 mm a zaberala približne 25 % obvodu lumenu pažeráka. IV. a V. EUS vrstva (histologicky odpovedajúce muscularis proprii a adventícii) boli intaktné. Otvorený ostával sporný nález troch diskrétnych pruhov vybiehajúcich z mukózy do priľahlej submukózy (v EUS obraze je to III. vrstva) v centrálnej časti lézie (obr. 2). Injekciu s fyziologickým roztokom k dosiahnutiu eventuálneho liftingu sme nerealizovali. Mediastinálna ani celiakálna lymfadenopatia EUS vyšetrením nebola zistená. Podľa uvedených skutočností sme ultrazvukový staging lézie hodnotili ako uT1bN0M0.
Image 2. EUS obraz lézie s desmoplastickou reakciou. Fig. 2. EUS imaging of the lesion with desmoplastic reaction. 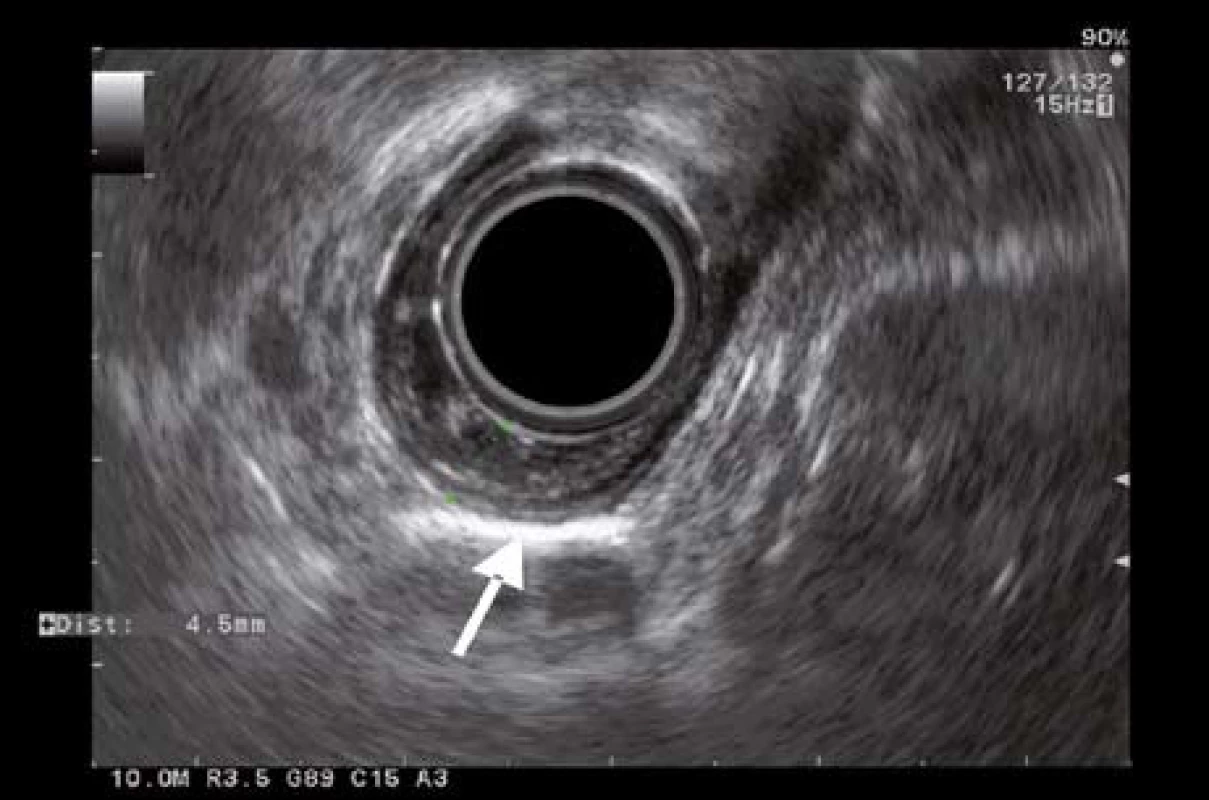
Následne s odstupom jedného mesiaca pacientka podstúpila endoskopickú resekciu lézie sliznice pažeráka využitím multiband techniky. Vo frakcionovanej analgosedácii za insuflácie CO2, pod zrakovou kontrolou vleže na ľavom boku, sme zaviedli videoendoskop Olympus GIF H180 s MBM kitom (Duette™ Multi-Band Mucosectomy, Cook Medical, Bloomington, IN, USA). Ten pozostával z prehľadného nadstavca (capu) a naň navlečených modifikovaných ligačných krúžkov.
Po opätovnej chromodiagnostike Lugolovym roztokom a následnom označení okrajov lézie koagulačnými bodmi sme patologickú časť sliznice od jej vyznačených okrajov nasali do nadstavca (capu) a navliekli gumový ligačný krúžok s cieľom vytvorenia pseudopolypu. Ten sme polypektomickou kľučkou navlečenou pod ligačný krúžok odstránili a pokračovali podobným spôsobom so zvyšnou časťou patologickej sliznice. Aplikáciu submukóznej injekcie k dosiahnutiu liftingu sme pred navliekaním ligačných krúžkov nerealizovali. K odstraňovaniu pseudopolypov sme využili prúd Endo cut 60W (Olympus PSD-20). Sprievodné ľahké slizničné krvácanie z resekčnej plochy spontánne ustalo ešte počas výkonu. Metódou ligate and cut sme neoplastickú léziu takto odstranili v troch častiach, pričom endoskopicky sa jednalo o úplnú resekciu (obr. 3B).
Resekáty sme extrahovali tripodom a fixovali na korkovej podložke v 10% roztoku formaldehydu (obr. 3C). Dľžka výkonu bola 50 min. Pacientku sme po výkone hospitalizovali na gastroenterologickom oddelení. Vyžadovala jednorázové intravenózne podanie analgetika. Po výkone sme nezaznamenali prípadnú signifikantnú eleváciu CRP a počtu leukocytov, preto sme nepristúpili k profylaktickému podaniu antibiotika. Druhý pooperačný deň bola pacientka prepustená do domácej starostlivosti.
Image 3. A – navliekanie ligačných krúžkov, B – slizničný defekt pažeráka po odstránení patologickej lézie, C – fixácia na korkovú platničku. Fig. 3. A – the view through the multiband mucosectomy cap with rubber bands, B – the resection wound after completion of endoscopic resection, C – fixation on cork plate. 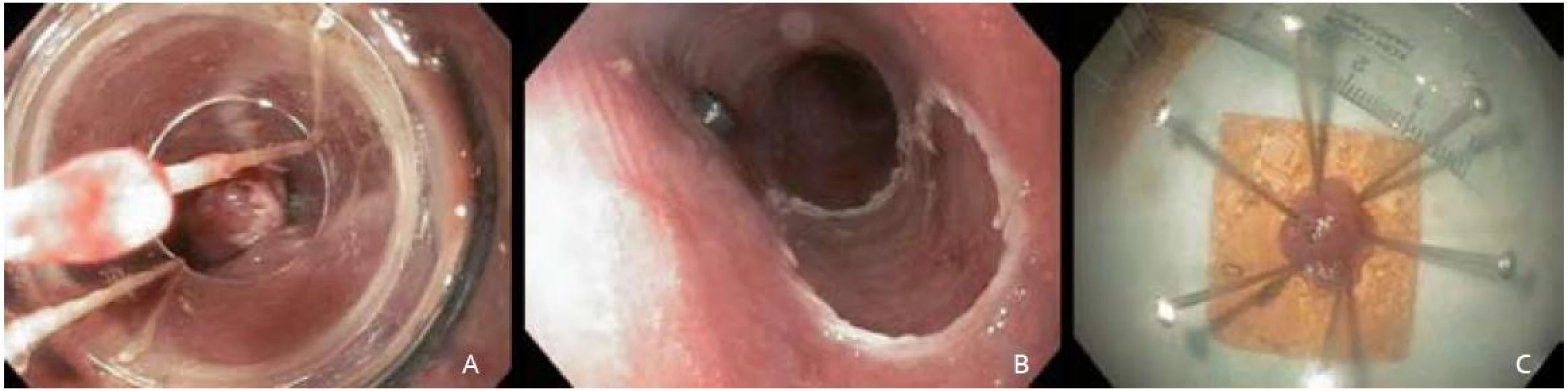
Patológ pri histologickom rozbore resekátov dokladoval v ich centre multifokálnu léziu tvorenú početnými čapmi dysplastického dláždicovitého epitelu ťažkého stupňa, miestami s prechodom do štruktúr karcinoma in situ (obr. 4A). Najhlbší čap dosahoval 1,32 mm. U väčšiny čapov bola prítomná súvislá neporušená bazálna membrána, miestami bolo hodnotenie sťažené rozsiahlou desmoplastickou reakciou okolia, do ktorej bola zavzatá aj muscularis mucosae. V centrálnej časti resekátu bol však prítomný aj jeden infiltratívne rastúci čap karcinómu dosahujúci v desmoplastickom teréne muscularis mucosae takmer k resekčnej spodine, čo dokladovalo aj imunohistochemické vyšetrenie (obr. 4C). Angio či lymfangio invázia nebola prítomná. Imunohistochemicky Ki67 (obr. 4B) a MIB-1 bola dokázaná vysoká proliferačná aktivita v čapoch. Laterálne resekčné okraje boli v zdravom tkanive a od lézie boli vzdialené minimálne 5 mm. Patológ po spoločnej konferencii zhodnotil odstránenú léziu ako R0 resekciu včasného skvamocelulárneho karcinómu pažeráka v štádiu pT1aN0M0.
Image 4. – invadujúce čapy ESCC, B – vysoká proliferačná aktivita Ki-67 v čapoch, C – imunohistochémia – cykeratín, čap dosahujúci spodinu resekátu. Fig. 4. A – invasive squamous cell carcinoma of esophagus with infiltrating border, B – high proliferative activity of Ki-67, C – cytoceratin immunohistochemical staining, ESCC reached base of resection specimen. 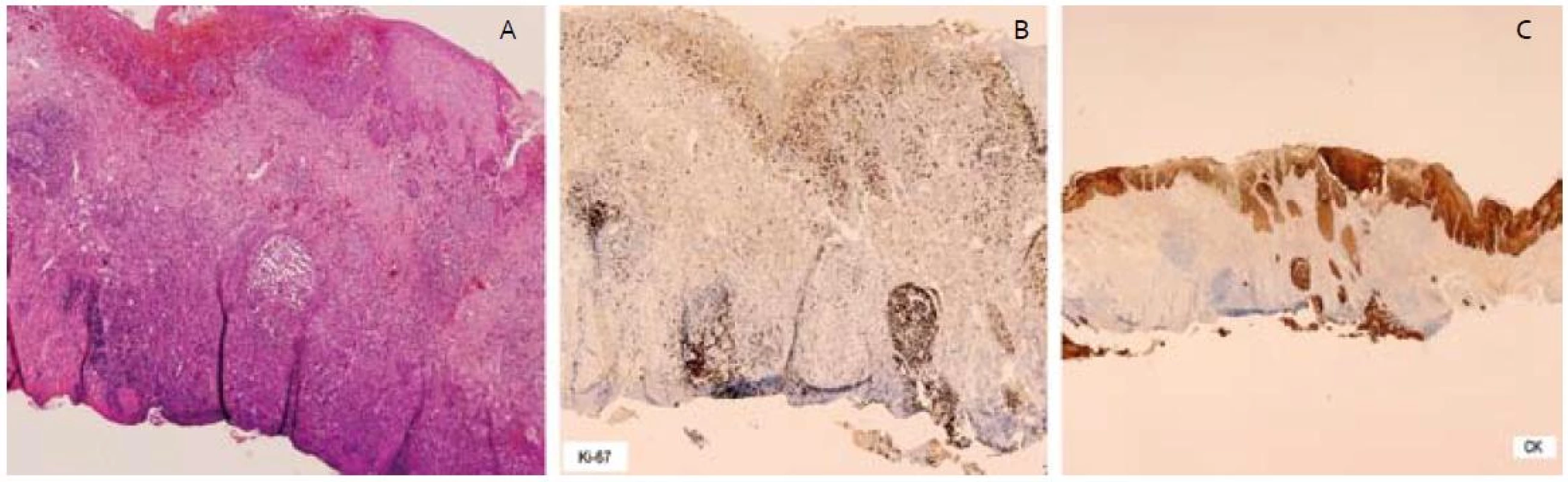
Následné kontrolné endoskopické vyšetrenie podstúpila pacientka po cca dvoch mesiacoch od endoskopickej slizničnej resekcie. V NBI zobrazení a ani pri chromodiagnostike Lugolovym roztokom (obr. 4) sme neidentifikovali prípadnú recidívu podozrivého areálu patologickej sliznice pažeráka. Chromoskopicky bola postupne zhodnotená sliznica ako celého proximálneho, tak aj distálneho pažeráka. Z centrálnej časti a okrajov jazvy po slizničnej resekcii bolo odobratých celkovo šesť bioptických vzoriek pomocou jumbo-klieští. V jednej zo vzoriek patológ pripúšťa hraničný nález low-grade intraepiteliálnej neoplázie, ostatné vzorky dokladovali fyziologickú štruktúru sliznice pažeráka.
CT hrudníka a mediastína, ktoré pacientka podstúpila tesne pred endoskopickou kontrolou, nepreukázalo prípadné submukózne a ani vzdialené metastatické šírenie nádorového procesu. Regionálne lymfatické uzliny neboli zväčšené. Ako vedľajší nález rádiológ popisoval parciálnu stenózu strednej tretiny pažeráka, ktorá odpovedala miestu predchádzajúcej slizničnej resekcie. Následným kontrolným endoskopickým vyšetrením sme verifikovali len minimálnu retrakciu sliznice v mieste jazvy (obr. 5A). Pacientka bola počas celého pooperačného obdobia bez dysfagických ťažkostí. Najbližšie kontrolné gastroskopické vyšetrenie sme naplánovali za šesť mesiacov vzhľadom na nález LGIN.
Image 5. A – zhojená jazva po EMR, B – zobrazenie v NBI, C – farbenie Lugolovym roztokom. Fig. 5. A – resection scar with white light endocopy, B – narrow band imaging, C – Lugolʹs staining. 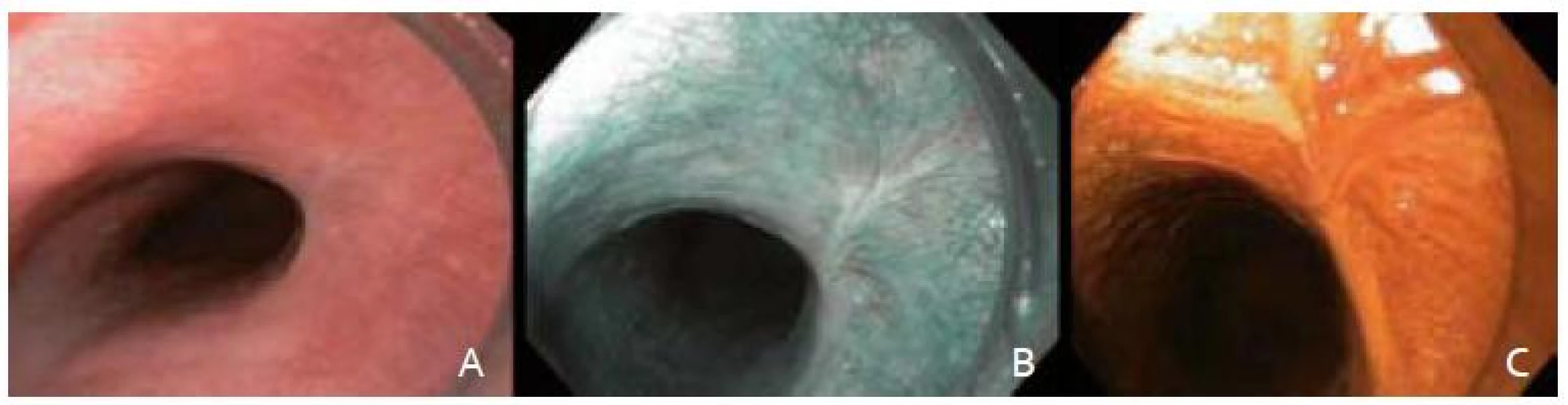
Diskusia
V liečbe povrchových neoplastických lézí tráviaceho traktu sa v posledných rokoch jednoznačne stále viac presadzujú metódy endoskopickej resekcie (ER) ako endoskopická mukozálna resekcia (EMR) a endoskopická submukózna disekcia (ESD). Ich efektívnosť a bezpečnosť využitia v klinickej praxi dokladovalo už množstvo štúdií.
Spinocelulárny karcinóm pažeráka (esophageal squamous cell carcinoma – ESCC) je celosvetovo najčastejším zhubným ochorením pažeráka. Avšak v priebehu posledných dvoch dekád narastá incidencia adenokarcinómu na podklade Barrettovho pažeráka hlavne v západnej Európe a USA [1].
Aj keď diagnostika a management nádorov pažeráka je na vysokej úrovni, výzvou naďalej ostáva záchyt včasných štádií ESCC pri endoskopických vyšetreniach. Kľúčovou sa javí depistáž pacientov (pozitívna rodinná anamnéza ESCC, karcinóm hlavy a krku, achalázia, tylosis, Plummer-Vinson syndrom a nadmerné fajčenie a požívanie alkoholu) v kombinácii s využitím chromodiagnostiky Lugolovým roztokom [2,3,15]. Princíp metódy vychádza z dôkazu farebnej zmeny sliznice obsahujúcej bunky s glykogénom, ktoré pri reakcii s jódom hnednú (tmavnú). Bunky v oblasti dysplastických a neoplastických zmien neobsahujú glykogén – vytvárajú tzv. Lugol-negatívne oblasti, tie po cca 2 min od začiatku farbenia ostávajú ružové – „pink color sign“. Takto (ružovo) kolorované oblasti maju až 95% senzitivitu v diagnostike ESCC. Lugolov roztok je kontraindikovaný pri alergii na jód!
Inou, citlivou metódou vo včasnej diagnostike ESCC je využitie napr. narrow-bang imaging (NBI) Olympus [4]. Ku kvalitnému posúdeniu týchto ložísk je vhodný endoskop kombinujúci NBI techniku s optickým zväčšením. Okrem spomenutej NBI na našom trhu máme variantnosť podobných techník: FICE (Fujinon) a I-scan (Pentax). Širšiemu uplatneniu napr. balónkovej cytológie v klinickej praxi pravdepodobne zabránila možnosť jej využitia len v endemických oblastiach výskytu ESCC, ako je napr. Čína [5]. V našom prípade pacientka nemala rizikovú návykovú ani rodinnú anamnézu a superficiálna lézia sliznice pažeráka bola skôr náhodným nálezom.
SCC pažeráka môžeme rozdeliť na včasný, zahrňajúci mukózu a submukózu, a pokročilý SCC, presahujúci do lamina muscularis mucosae, adventíciu alebo šíriaci sa na okolité štruktúry. Pravdepodobnosť metastatického postihnutia lymfatických uzlín (LU) je závislá od hľbky invázie a diferenciácie patologickej lézie. Lézie lokalizované len do epitaliálnej vrstvy (m1) alebo lamina propria (m2) majú riziko metastázovania < 5 %; lézie, penetrujúce do muscularis mucosae (m3) alebo prvej 1/3 submukózy (sm1), majú stredné riziko (5–15 %) a lézie prestupujúce do submukózy ( sm2, sm3) majú vysoké riziko LU metastázovania a vaskulárnej invázie. V diagnostike postihnutia regionálnych LU má najvyššiu senzitivitu a špecificitu EUS vyšetrenie, nasledované FDG-PET (fluorodeoxyglukózová pozitronová emisná tomografia) a CT (počítačová tomografia). Pri detekcii vzdialených metastáz je senzitivita vyššia u FDG-PET, zatiaľ čo špecificita CT a FDG-PET ostáva približne rovnaká [11]. Jedným z najdôležitejších faktorov prognózy ESCC je teda rozsah postihnutia v čase diagnózy. V súčasnosti možnosti liečby spinocelulárneho karcinómu pažeráka možno rozdeliť na endoskopické (EMR, ESD, osobitné postavenie má radiofrekvenčná ablácia – RFA) a pri pokročilých štádiach ochorenia ezofagektómiu, prípadne kombinovanú chemo/rádioadjuvantnú liečbu. Prevláda názor, že superficiálne lézie lokalizované v m1 a m2 sú jednoznačne indikované k endoskopickej liečbe [6]. V prípade lézií v m3 a sm1 sa doporučuje individuálne posúdenie prístupu na základe zhodnotenia benefitu vyplyvajúceho z menej invazívneho a rizikového endoskopického výkonu (EMR/ESD) oproti podstatne rizikovému a invazívnemu chirurgickému výkonu – ezofagektómii, ktorá je spájaná s pomerne vysokou mortalitou [6,7]. Kvôli efektu ER sa za kľúčovú považuje invázia do submukózy. Rozhodujúce postavenie v rozlíšení intramukózneho (T1a) a submukózneho karcinómu (T1b) má hlavne EUS vyšetrenie. Senzitivita vyšetrenia pre obidve uvedené štádia karcinómu sa podľa posledných prác pohybuje od 86 do 87 %. Presnosť metódy ale závisí od niekoľkých faktorov, napr. skúsenosti endoskopistu, typu EUS sondy, lokalizácie lézie [18]. Pri endoskopickej liečbe včasných nádorov pažeráka rozoznávame tzv. nízko rizikové a vyššie rizikové indikačné kritéria. Nízko rizikové kritéria predstavujú lézie limitované na mukózu, bez dokázanej invázie do lymfatických uzlín, s histologickým gradingom G1 – G2 a s makroskopicky elevovaným (Is, IIa, IIb) typom lézie, pričom jej veľkosť by nemala presiahnuť 20 mm [16]. V prezentovanej kazuistike endosonografický nález okrem jednoznačnej lokalizácie lézie v I. a II. EUS vrstve, teda mukóze, popisoval aj niekoľko diskrétnych prúžkov vybiehajúcich z mukózy do priľahlej III. EUS vrstvy, teda submukózy. Na prvom mieste sme ale v diferenciálnej diagnostike uvažovali o fibróznych zmenách. Regionálna lymfadenopatia EUS vyšetrením nebola preukázaná. Ultrazvukový staging hodnotil predbežne léziu ako uT1bN0M0. Podľa niektorých štúdií priaznivú odpoveď na slizničnú endoskopickú liečbu majú ale aj lézie zasahujúce do muscularis mucosae (m3) a hornej tretiny submukózy (sm1) pri chýbaní vzdialených metastáz [17]. Najdôležitím kritériom postihnutia LU je stupeň diferenciácie tumoru v najhlbších vrstvách lézie, prítomnosť invázie v krvných a lymfatických cievach. Riziko lokálnej recidívy ESCC vyplýva aj z posúdenia bezpečnostného lemu z okraja resekátu. Tieto údaje môže posúdiť až patológ pri histologickom rozbore daného resekátu.
Po spoločnej konferencii s patológom sme odstránenú léziu hodnotili ako pT1aN0M0 štádium spinocelulárneho karcinómu pažeráka na podklade HGIN, pritom sa jednalo o R0 resekciu lézie. Náš úvodný endosonografický staging lézie (uT1bN0M0) ju teda nadhodnotil. Závažnú periprocedurálnu alebo postprocedurálnu komplikáciu sme nezaznamenali.
Multiband mukozektómia je už zaužívanou formu endoskopickej resekčnej metódy. Bezpečný profil a efektívnosť tejto metódy dokladovali štúdie resekcií včasných štádií Barettovho pažeráka [8], ako aj včasného ESCC [9]. Výhodami MBM oproti EMR s capom sú: a) relatívne jednoduchá inštrumentálna náročnosť spojená s nižšími finačnými prevádzkovými nákladmi, b) upustenie od aplikácie submukóznej injekcie k dosiahnutiu liftingu, c) bezpečný profil techniky potencionálne využiteľný aj u menej skúsených endoskopistov, d) minimálne riziko perforácie steny pažeráka po naložení ligačných krúžkov, nakoľko nedochádza k zachyteniu všetkých vrstiev steny, a tým nezasahuje do línie rezu. Multiband mukozektómiou sa niektorým autorom podarilo u pacientov s HGIN/intramukóznym karcinómom dosiahnuť 7-ročné prežívanie až u 77 % pacientov [19].
Diskusiu k tejto kazuistike otvára ešte otázka možnosti využitia ESD vyvinutej k odstráneniu lézií (zväčša nad 20 mm) en bloc. En bloc resekcia uľahčuje histologický rozbor resekátu a znižuje riziko lokálnej recidívy. Ishihara et al porovnali riziko lokálnej rekurencie ESCC po predošlom odstránení lézie > 20 mm metódou EMR en bloc vs piecemeal. Súbor pacientov zahŕňal pacientov so včasným ESCC (m1–sm1), bez lymfangiovaskulárneho postihnutia. Záverom študie autori zistili, že silnými prediktormi rekurencie ESCC po predošlej EMR sú: a) veľkosť lézie nad 20 mm, b) využitie ESD, c) najsilnejším prediktorom bol celkový počet kúskov, v koľkých bola lézie odstránená (piecemeal resekcia), pričom veľmi vysoké riziko rekurencie bolo asociované s ≥ 5 odstránenými kúskami [10]. Prevedenie ESD v našich centrách je však spájané s potencionálne vyšším rizikom komplikácií a je výrazne závislé od skúsenosti endoskopistu [14].
I napriek úspešnej endoskopickej liečbe superficiálnych lézií ESCC ostáva riziková lokálna rekurencia a prípadné metachrónne lézie. Je preto nevyhnutné pravidelné endoskopické sledovanie pacientov s využitím chromodiagnostiky Lugolovym roztokom [3,15]. Podľa nedávnej štúdie Boerwinkel et al priniesla dispenzarizácia pacientov po odstránení včasného ESCC zaujímavé závery, kde u vysokého počtu pacientov došlo k objaveniu sa LGIN (low-grade intraepitelial neoplasia) mimo pôvodné ložisko odstránenej lézie. Pritom riziko progresie LGIN do karcinómu je až 24 % [13]. Tento jav pravdepodobne súvisí s „genetickou predispozíciou“ malígnej transformácie epitelových buniek, a je preto nevyhnutné identifikovať skupinu pacientov, u ktorých lokálna resekcia high-grade intraepiteliálnej neoplázie, event. včasného ESCC nebude dostatočne efektívna [8], pochopiteľne z hľadiska dlhodobého sledovania. Ako (alternatívna) záchranná metóda v prípade recidívy plochých lézií s high--grade intraepiteliálnou neopláziou v pažeráku po predošlej EMR sa javí RFA (radiofrekvenčná ablácia) [12]. Detailný opis využitia RFA a jej indikácie presahujú obsah tohto článku.
Pri kontrolnom endoskopickom vyšetrení, ako bolo už vyššie spomenuté, sme u našej pacientky po opätovnej chromodiagnostike Lugolovym roztokom nepreukázali recidívu patologických ložísk ako v mieste jazvy, tak aj mimo nej. Slizničný defekt s odstupom cca dvoch mesiacov po EMR bol už zhojený. Vzhľadom na nález LGIN len v jednej z kontrolných bioptických vzoriek navrhujeme u pacientky endoskopické sledovanie v 6-mesačných intervaloch prvý rok sledovania, doplnené o CT mediastina a hrudníka. Dostupne literárne zdroje pripúšťajú aj intenzívnejšie, 3-mesačné intervaly endoskopických kontrôl v prvom roku sledovania. V prípade recidívy HGIN/včasného ESCC je na zvážení opätovné využitie EMR, resp. RFA a pod. Aktuálny zdravotný stav pacientky jej umožňuje bežnú fyzickú aktivitu.
Záver
MBM je efektívna, bezpečná a jednoduchá endoskopická resekčná metóda aj v liečbe včasného štádia spinoceluárneho karcinómu pažeráka. Záchyt včasných štádií ESCC vychádza z aktívneho prístupu ku screeningu rizikových skupín využívajúc hlavne chromodiagnostiku Lugolovym roztokom.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 4. 2013
Přijato: 3. 6. 2013
MUDr. Rastislav Husťak
Interná klinika Nemocnica Košice-Šaca
1. súkromná nemocnica
Lúčna 57, 040 15 Košice-Šaca
rhustak@gmail.com
Sources
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin 2013; 63(1): 11–30.
2. Kajzrlíková IM, Vitek P, Falt P et al. Recurrent oesophageal intramucosal squamous carcinoma treated by endoscopic mucosal resection and subsequent radiofrequency ablation using HALO system; BMJ Case Reports 2010.
3. Vítek P, Komínek P, Kajzrlíková IM et al. Endoskopická diagnostika a léčba časného spinocelulárního karcinomu jícnu je možná i v populaci s nízkou incidencí tohoto onemocnění. Endoskopie 2009; 18(4): 161–166.
4. Uedo N, Fujishiro M, Goda K et al. Role of narrow band imaging for diagnosis of early-stage esophagogastric cancer: current consensus of experienced endoscopists in Asia-Pacific region. Dig Endosc 2011; 23 (Suppl 1): 58–71.
5. Roth MJ, Liu SF, Dawsey SM et al. Cytologic detection of esophageal squamous cell carcinoma and precursor lesions using balloon and sponge samplers in asymptomatic adults in Linxian, China. Cancer 1997; 80(11): 2047–2059.
6. Bollschweiler E, Baldus SE, Schröder W et al. High rate of lymph-node metastasis in submucosal esophageal squamous-cell carcinomas and adenocarcinomas. Endoscopy 2006; 38(2): 149–156.
7. Katada C, Muto M, Momma K et al. Clinical outcome after endoscopic mucosal resection for esophageal squamous cell carcinoma invading the muscularis mucosae – a multicenter retrospective cohort study. Endoscopy 2007; 39(9): 779–783.
8. Soehendra N, Seewald S, Groth S et al. Use of modified multiband ligator facilitates circumferential EMR in Barett‘s esophagus. Gastrointest Endosc 2006; 63(6): 847–852.
9. Zhang YM, Boerwinkel DF, He S et al. Prospective feasibility study on the use of multiband mucosectomy for endoscopic resection of early squamous neoplasia in the esophagus. Endoscopy 2013; 45(3): 167–173.
10. Ishihara R, Iishi H, Takeuchi Y et al. Local recurrence of large squamous-cell carcinoma of the esophagus after endoscopic resection. Gastrointest Endosc 2008; 67(6): 799–804.
11. van Vliet EP, Heijenbrok-Kal MH, Hunink MG et al. Staging investigations for oesophageal cancer: a meta-analysis. Br J Cancer 2008; 98(3): 547–557.
12. Falt P, Kajzrlíková IM, Urban O et al. Radiofrekvenční ablace v terapii časného spinocelulárního karcinomu jícnu. Endoskopie 2010; 19(2): 71–74.
13. Wang GQ, Abnet CC, Shen Q et al. Histological precursors of oesophageal squamous cell carcinoma: results from a 13 year prospective folow up study in a high risk population. GUT 2005; 54(2): 187–192.
14. Urban O, Vítek P, Fojtík P et al. Endoscopic submucosal dissection: initial experience in the Czech Republic. Folia Gastroenterol Hepatol 2006; 4(1): 4–10.
15. Komínek P, Vítek P, Urban O et al. Chromoendoscopy to detect early synchronous second primary esophageal carcinoma in patients with squamous cell carcinomas of the head and neck? Gastroenterol Res Pract 2013; doi: 10.1155/2013/236264.
16. Ell C. Endoscopic treatment of early esoph cancer. UEGW, Prague GUT 2004; (A 58).
17. Yoshii T, Ohkawa S, Tamai S et al. Clinical outcome of endoscopic mucosal resection for esophageal squamous cell cancer invading muscularis mucosa and submucosal layer. Dis Esophagus 2012; doi: 10.1111/j.1442-2050.2012.01370.x.
18. Thosani N, Singh H, Kapadia A et al. A Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis. Gastrointest Endosc 2012; 75(2): 242–253.
19. Pech O, May A, Gossner L et al. Curative endoscopic therapy in patients with early esophageal squamous-cell carcinoma or high-grade intraepithelial neoplasia. Endoscopy 2007; 39(1): 30–35.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 3-
All articles in this issue
- Novinky v digestivní endoskopii
- Praktická realizace kontroly kvality kolonoskopie – zkušenosti z Beskydského Gastrocentra
- Multiband mukozektómia včasného spinocelulárneho karcinómu pažeráka
- Oddelenie digestívnej endoskopie Univerzitnej polikliniky Agostina Gemelliho v Ríme: niekoľko postrehov zo študijného pobytu
- Nitrergická inervácia tenkého čreva potkana po ischemicko-reperfúznom poškodení
- Inkontinence stolice
- Současnost a budoucnost v léčbě ulcerózní kolitidy
- Ohlédnutí za Kazuistikami 2013
- Zpráva o endoskopickém workshopu Iscare 2013
- 8th ECCO Congress in Vienna
- ESGE + ESDO workshop, Lisabon 2013: hold Mařatkovi, kvalita endoskopie a revoluční přístup k neoplaziím jícnu a žaludku
- XVII. Hradec gastroenterology and hepatology days and 7th international endoscopic workshop
- Asacol™ 800 mg tablety
- Zdravotní rizika endoskopie pro endoskopisty v České republice – pilotní studie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inkontinence stolice
- Asacol™ 800 mg tablety
- Současnost a budoucnost v léčbě ulcerózní kolitidy
- Zdravotní rizika endoskopie pro endoskopisty v České republice – pilotní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

