-
Medical journals
- Career
Mycobacterium avium subsp. paratuberculosis, etiologický faktor u Crohnovy choroby?
Authors: B. Fixa 1,5; I. Pavlík 4; J. Bedrna 2; O. Komárková 1; Z. Nožička 3; I. Slaná 4; P. Králík 4; T. Vaňásek 5; M. Volfová 5
Authors‘ workplace: II. interní klinika, LF UK a FN Hradec Králové 1; Chirurgická klinika, LF UK a FN Hradec Králové 2; Fingerlandův ústav patologické anatomie, LF UK a FN Hradec Králové 3; Výzkumný ústav veterinárního lékařství, v. v. i., Brno 4; Hepato-gastroenterologie s. r. o., Hradec Králové 5
Published in: Gastroent Hepatol 2010; 64(2): 7-13
Category: Original Article
Overview
Úvod:
Etiologie Crohnovy choroby zůstává neobjasněná. Význam infekce Mycobacterium avium subsp. paratuberculosis (MAP) pro vznik Crohnovy choroby byl dlouhodobě ovlivněn jeho obtížnou kultivací. Cílem studie bylo určit výskyt MAP pomocí vysoce citlivé metody PCR (hsPCR) pro průkaz specifického úseku DNA IS900 a posoudit na základě výsledků i literárních údajů význam MAP v etiologii Crohnovy choroby. Materiál a metodika: U 106 pacientů operovaných pro Crohnovu chorobu bylo v resekátech provedeno vyšetření na MAP metodou hsPCR. Resekce terminálního ilea a céka – primooperace – byla provedena u 61 pacientů, reoperace u 32 pacientů, dominantní operace tlustého střeva u 11 pacientů, resekce jejuna u 2 pacientů. Výsledky ze vzorků z postižené tkáně byly srovnány s výsledky z makroskopicky nepoškozené tkáně (kontrolní vzorky). Výsledky: V postižené tkáni bylo MAP prokázáno u 58 pacientů (54,7 %). U 14 z nich (13,2 %) bylo MAP prokázáno i v kontrolních vzorcích. U 4 pacientů (3,8 %) bylo MAP zjištěno jenom v nepoškozené tkáni. Celkem bylo MAP prokázáno u 62 pacientů (58,5 %). Závěr: Významně vyšší výskyt MAP u pacientů s Crohnovou chorobou v oblasti střevního postižení ve srovnání s výskytem v oblasti nepostiženého střeva podporuje úvahy o možné účasti MAP v etiologii Crohnovy choroby.Klíčová slova:
Crohnova choroba – Mycobacterium avium subsp. paratuberculosis – paratuberkulóza – Johneho chorobaÚvod
Crohnova choroba (MC) je závažné systémové multifaktoriální onemocnění zahrnující genetické, imunologické, environmentální a bakteriální faktory. Je charakterizována chronickým granulomatózním zánětem postihujícím celou stěnu zejména tenkého a tlustého střeva, bez sklonu ke kazeifikaci, charakteristickým pro tuberkulózu. Postižena může být kterákoli oblast od úst až po konečník a může se projevovat i extraintestinálními příznaky. Granulomatózní zánět vedl k úvahám o tuberkulózním původu MC, odlišnost od tuberkulózy prokázali již v roce 1932 Crohn et al [1]. Pátrání po infekčním původu však přetrvává až do současnosti (Campylobacter jejuni, Campylobacter faecalis, Listeria monocytogenes, Escherichia coli, spalničkový virus atd.). Již v roce 1913 bylo upozorněno na vztah mezi chronickou enteritidou u lidí a paratuberkulózou (tj. Johneho chorobou v anglosaské literatuře podle svého objevitele v roce 1895) u skotu [2] vyvolávanou infekcí Mycobacterium avium subsp. paratuberculosis (MAP). MAP je nyní prokazován i u jiných živočišných druhů, včetně primátů, ale též v mléce včetně mléka pasterizovaného, a dokonce i ve vodě. Incidence paratuberkulózy i MC paralelně stoupá, ve Velké Britanii asi od konce čtyřicátých let, u nás asi od konce padesátých let.
Studie zaměřené na MAP jako na příčinu MC byly výrazně ovlivněny jeho obtížnou kultivací. Až v roce 1984 byla poprvé kultivačně prokázána přítomnost MAP u 3 pacientů s MC [3–4]. Ve studiích bylo pokračováno, kultivace byla úspěšná vždy jen v ojedinělých případech. Sami jsme prokázali MAP kultivačně u 3 ze 49 pacientů ze střevních resekátů [5]. K výraznému zvýšení úspěšnosti průkazu MAP zásadně přispělo zdokonalení molekulární techniky vysoce citlivé PCR (hsPCR) k průkazu specifického fragmentu DNA IS900 pro MAP, která byla použita i v předkládané práci.
Materiál a metodika
V období 1993–2003 byly na pracovišti Výzkumného ústavu veterinárního lékařství (VÚVeL) v Brně vyšetřeny vzorky tkáně ze střevních resekátů od 106 pacientů s MC operovaných na chirurgické klinice ve Fakultní nemocnici v Hradci Králové. Šlo o 66 mužů a 40 žen.
Průměrný věk pacientů byl 36,1 let (16–76 let). Pacienti, kteří byli v průběhu studie s odstupem několika let operováni dvakrát, byli ponecháni v souboru vyšetřených. Celkem bylo z resekátů vyšetřeno na přítomnost MAP 291 vzorků. Průměrná doba trvání MC od diagnózy do operace byla 11,7 let (1–21 let).
U všech pacientů byly vyšetřeny 2–4 vzorky z makroskopicky postižené tkáně. Jako kontroly sloužily 1–2 vzorky z periferie resekátů s makroskopicky normální tkání. Peroperačně získaná tkáň byla bezprostředně po odběru očištěna a zmražena na -40 °C až do vyšetření.
DNA ze vzorků byla izolována pomocí komerčně dostupné soupravy DNeasy Blood and Tissue od firmy Qiagen (Hilden, Německo) přesně podle instrukcí výrobce. K průkazu MAP byla použita metoda high sensitivity IS900 PCR (hsPCR) s interním standardem vyvinutá ve VÚVeL [6]. Pro amplifikaci specifického detekčního cíle IS900 byl použit Taq PCR Master Mix Kit (Qiagen) s primery IS900-P3N: 5‘ - GGG TGT GGC GTT TTC CTT CG-3‘ a IS900 - P4N: 5‘-TCC TGG GCG CTG AGT TCC TC-3’ v koncentraci 10 pmol na reakci. Velikost PCR produktu specifického detekčního cíle je 257 bp. Pro kontrolu inhibice hsPCR reakce byl použit interní standard o velikosti 591 bp.
Ke kultivaci MAP byla použita dříve popsaná metoda [7–8]. Vzorky tkáně byly homogenizovány (Laboratory Blender Stomacher, Kleinfeld Labortechnik, Německo) a dekontaminovány pomocí 0,75% hexa-decyl-pyridinium chloride (HPC; Merck, Darmstadt, Německo) po dobu 20 hod při laboratorní teplotě. Pro kultivaci dekontaminovaných vzorků bylo použito Herroldovo vaječno-žloutkové médium (HEYM) s Mykobaktinem J po dobu nejméně 12 měsíců.
Charakteristika pacientů podle dominantního chirurgického výkonu je uvedena v tab. 1.
Table 1. Rozdělení nemocných podle dominantního chirurgického výkonu. Tab. 1. Division of patients by dominant surgical procedure. 
Výsledky
Výsledky průkazu MAP za použití metody hsPCR jsou uvedeny v tab. 2.
Table 2. Výsledky – pozitivní průkaz MAP. Tab. 2. Results – positive detection of MAP. 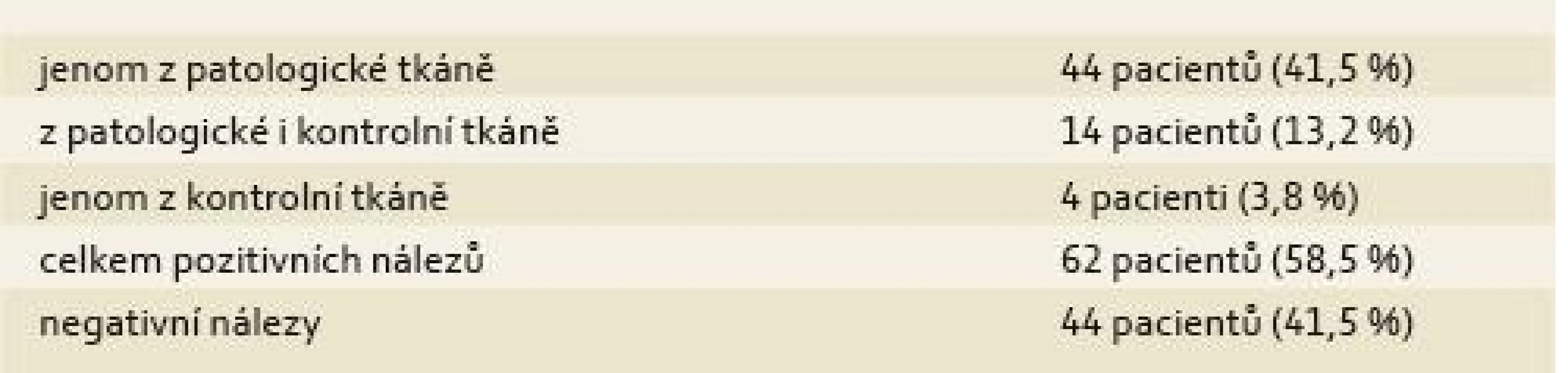
Významně vyšší výskyt MAP byl prokázán z oblasti střevního postižení než z oblasti nepostiženého střeva.
Ze 20 případů, kde byla přítomna píštěl, bylo zjištěno 8 pozitivních nálezů. Průměrná doba trvání MC byla téměř identická ve skupině s prokázaným MAP (11,9 let) se skupinou, kde nebylo MAP prokázáno (11,7 let). U jednoho z pacientů s MAP prokázaným metodou hsPCR bylo v rámci dříve publikované studie [5] MAP rovněž prokázáno kultivačně. U 2 pacientů z této studie, kde bylo MAP rovněž kultivačně prokázáno, byl však nález metodou hsPCR negativní.
Diskuze
Výsledky o výskytu MAP a jeho možné účasti na etiopatogenezi MC se liší, a vedou tak k přetrvávajícím názorům ve smyslu jak „pro“ tuto patogenezi, tak „proti“ ní. Poněvadž MAP u pacientů s MC pravděpodobně nevytváří buněčnou stěnu a nelze jej proto barvit dle Ziehl-Neelsena, znamená možnost detekovat inzerční element IS900 pomocí PCR velký pokrok [9]. Naše výsledky založené na amplifikaci MAP DNA odpovídají výsledkům několika publikovaných prací, které jsou obvykle brány jako „pro“. Nálezy MAP i v makroskopicky zdravé tkáni u našich nemocných s MC však ukázaly, že přítomnost MAP není vázána jen na patologicky změněnou tkáň, ale lze jej nalézt i ve zdravé tkáni od pacientů s MC. Není proto vhodné nálezy MAP z této tkáně brát jako optimální kontroly. To nás také vedlo ke změně systému výběru kontrol v naší další, současně probíhající studii. Vedle toho naopak i negativní nález metodou hsPCR nemusí vždy znamenat nepřítomnost MAP u nemocného s MC. Ukazuje to naše zkušenost, kdy u dvou nemocných s kultivačně prokázaným MAP [5] byla vyšetření metodou hsPCR negativní. Současné stanovení MAP oběma metodami se jeví jako optimální postup, který by umožnil optimalizovat záchyt a průkaz MAP.
Z deseti publikovaných prací z období 1994–2000 [9–18], založených na průkazu MAP prostřednictvím amplifikace specifického fragmentu IS900, byl v sedmi z nich zjištěn významně vyšší výskyt MAP u pacientů s MC než v kontrolních skupinách. Pozitivní nález se pohyboval v rozmezí od 13 do 100 %. V jednom z nich byl dokonce nález MAP ve 100 % a ani v jednom případě u kontrol [16]. Ve dvou pracích nebyl zjištěn nález MAP ani v jednom případě jak u MC, tak v kontrolách [14–15], v jedné práci ve 100 %, ale též v 87 % u kontrol [13]. Z těchto výsledků je zřejmé, že v řadě z uvedených prací se na výsledcích téměř s jistotou podílela nedokonalá technika (žádný pozitivní výsledek u MC i u kontrol apod.).
V pozdějším období se nesetkáváme s tak rozdílnými výsledky. V analogické, dobře dokumentované a kontrolované studii bylo prokázáno MAP ve střevních resekátech od nemocných s MC pomocí PCR v 52 % (v 67 % u kolitidy, ve 33 % u ileitidy) a ve 2 % u ulcerózní kolitidy [19]. Z této práce vyplývá zvláště vysoký záchyt MAP u pacientů s MC s postižením tlustého střeva. Tuto zkušenost, jak vyplývá z výsledků, jsme svými výsledky nepotvrdili.
Nadějnou se jeví detekce MAP metodou PCR v čerstvých bioptických vzorcích z postižené tkáně od nemocných s MC [20]. Autoři, kteří jako první použili tento způsob vyšetření, prokázali MAP v 34 případech z 37 (92 %) a u 9 z 34 (26 %) kontrolních nemocných, u nichž nešlo o nespecifický střevní zánět. Na výsledcích z bioptických střevních vzorků byla také založena zajímavá práce ze Sardinie [21]. MAP bylo prokázáno u 25 z 30 nemocných s MC pomocí IS900 PCR (83 %) a u 3 kontrol (10 %). Z 25 PCR pozitivních případů bylo MAP překvapivě prokázáno u 19 pacientů i kultivačně. Výsledky ze Sardinie jsou zajímavé již proto, že Sardinie má sice pouhých 1,6 milionů obyvatel, ale chovají zde 3,5 milionu ovcí a 100 000 kusů skotu, a paratuberkulóza se zde vyskytuje endemicky.
Přes uvedené výsledky dosažené pomocí PCR jsou tyto nálezy poněkud zpochybňovány tím, že používané metody nejsou jednotné. Tomu potom odpovídá i výrazná heterogenita výsledků [22]. Podle některých autorů nelze stále vyloučit, že MAP nevyvolává zánět střevní sliznice, ale jenom se usídluje na preexistujícím zánětu. Průkaz MAP pomocí PCR v granulomech u MC získaných jejich mikrodisekcí pomocí laseru spíše podporuje aktivní účast MAP na vzniku zánětu [23]. Tato představa však byla významně oslabena nálezem nejen MAP, ale též Escherichia coli v granulomech u MC zpracovaných stejnou technikou [24].
Přijmeme-li za prokázaný vysoký výskyt MAP u nemocných s MC, nabízí se otázka, zda by mohla být MC řazena mezi infekční onemocnění. Předpokladem je tradičně zvažovaná podmínka splnění Kochových postulátů, tj. zda můžeme řadit MAP mezi lidské patogeny. První podmínka, přítomnost mikroorganizmu ve všech případech onemocnění, je zatím splněna jenom částečně. Splněn je předpoklad izolace mikroorganizmu od hostitele a růstu v čisté kultuře a jeho nález u experimentálně infikovaného hostitele. Je třeba připomenout, že Kochovy postuláty vždy plně neodpovídají ani v případech, kde jde jasně o infekční onemocnění (např. některé pneumonie, záněty močových cest, AIDS, který se sice nedaří vyvolat experimentálně přenosem HIV na zvířata, ale existují nákazy laboratorních pracovníků atd.). Za nejvýznamnější doklad, že MAP je patogenem, je považován fakt, že MAP bylo prokázáno určením MAP DNA v krvi nemocných s MC (sami jsme potvrdili), a takto získané MAP bylo i vykultivováno a byla prokázána i jeho životnost [25]. Vysvětlení nálezu MAP v krvi vlivem větší střevní propustnosti je nepravděpodobné, protože jiné střevní bakterie, zejména E. coli, v krvi nemocných s MC prokazatelné nejsou. Jako příklad etiopatogenetické významnosti MAP u člověka je uváděn případ cervikální lymfadenitidy u pacienta pět let po prodělané terminální ileitidě, kde šlo pravděpodobně o MC vyvolanou MAP [26]. Je však s podivem, že další podobné případy v literatuře zaznamenány nebyly. Stále se většina autorů kloní k názoru, že ke tkáňovému poškození nedochází u MC přímým účinkem MAP, ale pravděpodobněji imunitním mechanizmem ve smyslu odpovědi buňkami zprostředkované imunitní odpovědi na muramyldipeptidy (MDP), hsp60 nebo na jiné antigeny hojně obsažené v bakteriální stěně MAP.
Někteří autoři řadí MC mezi imunodeficitní stavy. Vycházejí z pozorování, že u pacientů s MC je prokazatelná porucha funkce neutrofilních granulocytů umožňující snadné pronikání mikroorganizmů do organizmu. U pacientů s MC vede traumatické poškození sliznice rekta, ilea, ale i kůže, na rozdíl od zdravých kontrol, k významně nižší mobilizaci neutrofilních granulocytů do místa traumatu a k nižší produkci prozánětlivého interleukinu 8 a interleukinu 1beta [27]. Podle některých prací má významnou úlohu v této regulaci a v odpovědi Panethových buněk na střevní mikroflóru genotyp NOD2 [28]. Tato otázka je však otevřená, poněvadž redukce v expresi alfa defenzinů 5 a 8 nebyla závislá na tomto genotypu, ale na poškození povrchového epitelu, a jeví se tedy spíše jako následek zánětlivých změn, nikoli jako jejich příčina [29]. Defekt v oblasti NOD2 byl zjištěn asi u 30 % pacientů s MC, ale v malém počtu i u zdravých jedinců [30].
Genetická analýza byla provedena na Sardinii na vzorku 37 nemocných s MC a 34 bez MC [31]. Více než 70 % pacientů s MC bylo nositeli nejméně jedné z 15 alel vázaných na NOD2 a všichni byli infikováni MAP. Poněkud rozporuplně se jeví uvedená fakta z pohledu známé skutečnosti, že MC je charakterizována zvýšeným hromaděním a retencí efektorových ma-krofágů, neutrofilů a T buněk v oblasti zaníceného střeva, kde jsou aktivovány a uvolňovány prozánětlivé cytokiny [32]. Je zřejmé, že otázka imunodeficitního stavu u MC a jeho vztahu k nejčastěji studovanému genotypu NOD2 zůstává otevřená.
Uvedené otázky úzce souvisejí obecně s problémem defenzinů. Defenziny jsou endogenní antibiotika charakteru peptidů a jsou kódovány na 8. chromozomu. Jejich významným lokálním zdrojem jsou Panethovy buňky střevní sliznice. Defenziny mají baktericidní efekt na Gram-negativní a Gram-pozitivní bakterie, houby, některé viry a protozoa. Jejich deficitem se vysvětlují i patogenetické mechanizmy u MC vázané na bakterie [33]. Mutace v oblasti NOD2, ovlivňující deficit alfa-defenzinu z Panethových buněk, jsou úzce vázány zejména na MC s postižením ilea [34].
MC je většinou považována za autoimunitní onemocnění. Důležitým předpokladem autoimunitní reakce jsou tzv. molekulové mimikry, tj. strukturní podobnost mikrobiálních antigenů a tkáňových molekul, v našem případě především antigenů z buněk střevní sliznice. Trvale diskutovanou je proto otázka, zda MAP neindukuje imunitní odpověď, která by byla zodpovědná za tkáňové poškození. Stanovení protilátek proti antigenům z MAP mělo sloužit především k diagnostickým účelům, tj. k průkazu infekce MAP u nemocných s MC. Výsledky sice ukázaly v některých pracích vyšší výskyt specifických protilátek u MC, současně však byla nápadná heterogenita výsledků s vysokým výskytem protilátek proti MAP u osob bez nespecifických střevních zánětů. Vysvětlení se nachází především v antigenní podobnosti mezi MAP a jinými mykobakteriemi, včetně M. tuberculosis, kde již samotné proočkování populace v některých zemích proti této infekci je zdrojem nepřesných výsledků [22,35–36].
Obecně závažnější pro posouzení významu imunitních odpovědí v etiopatogenezi onemocnění je průkaz specifických buněčných reakcí. Jejich význam byl potvrzen u mnohých autoimunitních onemocnění a sami jsme se tomuto problému věnovali před mnoha lety ve vztahu k ulcerózní kolitidě, kde za induktora buněčných imunitních reakcí byla určena zkřížená reaktivita mezi E. coli a antigeny z buněk tlustého střeva [37]. Výsledky jedné z prvních prací zaměřených na posouzení vztahu specifických buněčných imunitních reakcí k MAP u MC nepodpořily úvahu o etiopatogenezi MAP u MC [38]. První práce studující profil cytokinové odpovědi (IL-4 a IL-2) ve střevní sliznici u MC ukázaly významnou změnu funkce T buněk závislou na přítomnosti MAP [39]. IL-2 a IL-4 se mohou účastnit na vzniku cytotoxických T buněk přes CD8 - a CD4-slezinné lymfocyty. Toto pozorování považují autoři za průkaz vztahu MAP k patogenezi MC.
Závěry o významu buňkami zprostředkované imunity jsou stále nejednotné a lze předpokládat, že studií buněčné imunity ve vztahu k MAP bude přibývat. Zatím lze jenom říci, že v případě MC jsou především prokazované abnormální imunologické odpovědi cílené na střevní bakterie, pokojně koexistující s lidským organizmem. Je tedy označení MC jako autoimunitní velmi volné a je správnější mluvit o onemocnění z imunitní dysfunkce. Formálně je přesnější definice taková, že MC je onemocnění z dysregulace a nepřiměřené imunitní odpovědi na jinak neškodnou střevní flóru u geneticky vnímavého hostitele [30]. Již samotný přehled registrovaných změn cytokinů u MC naznačuje, jak složité změny imunitních mechanizmů probíhají u MC [32].
Vztah MAP k výskytu MC je posuzován také podle vazby k prevalenci paratuberkulózy. Obecně se zvyšující incidence paratuberkulózy a MC ukazovala na možný kauzální vztah obou onemocnění. Angličtí autoři upozornili na vztah mezi vzrůstajícím počtem paratuberkulózy u skotu a MC u lidí. Proti tomu jakoby svědčilo pozorování, že u farmářů pracujících se skotem nebyl pozorován vyšší výskyt MC [40]. Vlastní nepublikované kazusitické pozorování výskytu čtyř případů MC v rodině pracovníka pečujícího o skot s endemickým výskytem paratuberkulózy přece jen vzbuzuje podezření na příčinnou souvislost MC a paratuberkulózy. Jde o výskyt MC u dvou dcer uvedeného pracovníka a u jeho bratra. Bude třeba rodinu vyšetřit i geneticky, poněvadž možnost vlivu genetických faktorů, jak bylo uvedeno, je možná.
Proti kauzálnímu významu MAP pro vznik MC bývá uváděna i skutečnost, že kdyby byla MC chronickou mykobakteriální infekcí, nevedla by léčba suprimující TNF ke zlepšení stavu, ale naopak ke zhoršení mykobakteriálního onemocnění [41]. Obvykle se však zapomíná, že většina léků, standardně užívaných u MC, s výjimkou prednisonu, jako jsou imunosupresiva, preparáty 5-ASA, ale i antiTNF preparáty mají inhibiční efekt na růst MAP ve tkáňové kultuře [42–43].
Zdá se také, že výskyt MC je relativně nízký ve vztahu k současnému širokému výskytu MAP u skotu a jiných živočichů. Je třeba si však připomenout, že v době, kdy byly tuberkulózou postiženy dvě miliardy obyvatel, tj. v té době asi dvě třetiny lidstva, jenom asi u 10 % z nich došlo k manifestaci onemocnění [30]. Také infekce MAP prokazatelná nyní u skotu až v 70 % případů nevede u něj ke klinickým projevům zdaleka ve všech případech.
I když uvedené údaje ve smyslu „pro“ a „proti“ účasti MAP v etiologii MC nedovolují jasnou odpověď, část pracovníků předpokládajících důležitost MAP pro vznik MC se pokusila posoudit vliv léčby MAP na průběh MC. První pokusy o léčbu byly neúspěšné, pravděpodobně vlivem neadekvátní léčby. Tradiční antituberkulotika se ukázala při testování in vitro převážně jako neúčinná: izoniazid, ethambutol a rifampicin [44]. Jako nejúčinnější v léčbě MAP jsou uváděny kombinace s klaritromycinem a azitromycinem. Malá, placebem kontrolovaná studie z roku 1995 [45] vedla k prodloužení remise na více než jeden rok. V další studii z roku 1997, kde byl podáván rifabutin s jedním makrolidovým preparátem (klaritromycinem nebo azitromycinem) po dobu více než 18 měsíců, došlo ke klinické remisi u 93 % ze 46 pacientů [46]. Metaanalýza publikovaná v roce 2000 naznačila, že antimykobakteriální léčba může být účinná v udržování remise dosažené kortikosteroidy [47]. Z australského pracoviště byla publikována studie založená na kombinované dlouhodobé léčbě (6 měsíců až 9 let) rifabutinu (až 600 mg d.), klofaziminu (až 100 mg d.) a klaritromycinu (až 1 000 mg d.) [48]. Šlo o 39 pacientů s MC. U 22 z 39 pacientů (56,4 %) došlo ke zhojení neobvyklou jizvou, která byla rozvětvená, stužkovitá a elevovaná. U 12 z 15 pacientů (80 %), vždy se zhojenou střevní sliznicí, šlo o longitudinální zjizvení. Takovéto hojení, které je prognosticky výhodnější, nebývá pozorováno po standardní protizánětlivé a imunosupresivní léčbě a bylo autory doporučeno jako perspektivní standardní léčba. Optimistická předpověď antimykobakteriální léčby však nevyplývá z jiné, rovněž australské studie [49]. Do prospektivní, paralelní, placebem kontrolované, dvojitě slepé a randomizované dva roky trvající studie bylo zařazeno celkem 213 pacientů s aktivní formou MC. Léčba zahrnovala klaritromycin (750 mg d.), rifabutin (450 mg d.) a klofazimin (50 mg d.) a placebo. Za 16 týdnů byl významně zlepšený stav pacientů léčených antimykobakteriálně v 66 % a léčených placebem v 50 %. Ze 122 pacientů, kteří vstoupili do udržovací fáze, již nebyl na konci 104. týdne významný rozdíl mezi oběma skupinami. Během dalšího roku došlo k relapsu v antibiotické skupině v 59 % a v placebo skupině v 50 %. Autoři proto konstatovali, že MAP nemá u většiny pacientů s MC patogenetický význam. Příčinu rozdílných výsledků jistě objasní dostatečně velké studie, které jsou již připraveny a budou realizovány i za spolupráce českých pracovišť. Rozdílnost výsledků antimykobakteriální léčby přesto vede k přípravě vakcíny, která by měla zásadním způsobem ovlivnit epidemiologii MAP i chápání vztahu mezi MAP a MC.
Závěr
U 106 operovaných pacientů s MC jsme prokázali v operačních resekátech citlivou metodou PCR vysoký výskyt MAP. V postižené tkáni bylo MAP prokázáno významně častěji než v makroskopicky nepoškozené střevní tkáni. Výskyt MAP nebyl závislý na trvání MC. U pacientů s prokázanou píštělí byl výskyt MAP přibližně stejný jako u pacientů bez píštěle. Zajímavým se jeví průkaz MAP u dvou pacientů s postižením jejuna.
Získané výsledky spíše podporují účast MAP v etiopatogenezi MC, avšak neodpovídají na otázku, zda je možno brát MAP jako faktor přímo poškozující střevní stěnu nebo jenom účastnící se na rozvoji patologických změn cestou imunitních odpovědí. Tento problém neřeší ani citované pokusy o antimykobakteriální léčbu. Za významné zjištění, bude-li potvrzeno v dalších pracích, je třeba brát příznivější způsob hojení po antimykobakteriální než po standardní léčbě.
Vzhledem k vysokému a stále se zvyšujícímu výskytu paratuberkulózy u zvířat, ale i prokazovanému častému výskytu MAP v pasterizovaném i sušeném mléce (kojenecké dětské výživě), užívané k výživě novorozenců [50] a prokázané dokonce v mléce kojící ženy s MC [51], bude třeba studii vztahu mezi MAP a MC věnovat podstatně více pozornosti, než tomu bylo dosud.
prof. MUDr. Bohumil Fixa, DrSc.
Poděbradova 656, Hradec Králové 2
bohumil.fixa@tiscali.cz
Sources
1. Crohn BB, Ginzburg L, Oppenheimer GD. Regional ileitis: a pathologic and clinical entity. JAMA 1932; 99 : 1323–1329.
2. Dalziel TK. Chronic intestinal enteritis. BMJ 1913; 2 : 1068–1069.
3. Thayer WR, Coutu JA, Chiodini RJ et al. Possible role of Mycobacteria to inflammatory bowel disease. Dig Dis Sci 1984; 29(12): 1080–1085.
4. Chiodini RJ, Van Kruiningen HJ, Thayer WR et al. Possible role of mycobacteria in inflammatory bowel disease. I. An unclassified Mycobacterium species isolated from patients with Crohn’s disease. Dig Dis Sci 1984; 29(12): 1073–1079.
5. Fixa B, Komárková O, Bedrna J et al. Crohnova choroba a Mycobacterium avium subspecies paratuberculosis. Čes a Slov Gastroent 2000; 54(5): 56–61.
6. Ayele WY, Bartos M, Svastova P et al. Distribution of Mycobacterium avium subsp. paratuberculosis in organs of naturally infected bull-calves and breeding bulls. Vet Microbiol 2004; 103(3–4): 209–217.
7. Pavlík I, Bejčková L, Pavlas M et al. Characterization by restriction endonuclease analysis and DNA hybridization using IS900 of bovine, ovine, caprine and human dependent strains, of Mycobacterium paratuberculosis isolated in various localities. Vet Microbiol 1995; 45(4): 311–318.
8. Pavlik I, Horvathova A, Dvorska L et al. Standardisation of restriction fragment length polymorphism for Mycobacterium avium subspecies paratuberculosis. J Microbiol Meth 1999; 38(1–2): 155–167.
9. Sanderson JD, Moss MT, Tizard ML et al. Mycobacterium paratuberculosis DNA in Crohn’s disease tissue. Gut 1992; 33(7): 890–896.
10. Dell’Isola B, Poyart C, Goulet O et al. Detection of Mycobacterium paratuberculosis by polymerase chain reaction in children with Crohn’s disease. J Infect Dis 1994; 169(2): 449–451.
11. Lisby G, Andersen J, Engbaek K et al. Mycobacterium paratuberculosis in intestinal tissue from patients with Crohn’s disease demonstrated by a nested primer polymerase chain reaction. Scand J Gastroenterol 1994; 29(10): 923–929.
12. Fidler HM, Thurrell W, Johnson NM et al. Specific detection of Mycobacterium paratuberculosis DNA associated with granulomatous tissue in Crohn’s disease. Gut 1994; 35(4): 506–510.
13. Suenaga K, Yokoyama Y, Nishimori I et al. Serum antibodies to Mycobacterium paratuberculosis in patients with Crohn’s disease. Dig Dis Sci 1999; 44(6): 1202–1207.
14. Rowbotham DS, Mapstone NP, Trejdosiewicz LK et al. Mycobacterium paratuberculosis DNA not detected in Crohn’s disease tissue by fluorescent polymerase chain reaction. Gut 1995; 37 : 660–667.
15. Dumonceau JM, Van Bossum A, Adler M et al. No Mycobacterium paratuberculosis found in Crohn’s disease using the polymerase chain reaction. Dige Dis Sci 1996; 41(2): 421–426.
16. Mishina D, Kastel P, Brown ST et al. On the etiology of Crohn disease. Proc Nat Acad Sci - US 1996; 93(18): 9816–9820.
17. Del Prete R, Quaranta M, Lippolis A et al. Detection of Mycobacterium paratuberculosis in stool samples of patients with inflammatory bowel disease by IS900-based PCR and colorimetric detection of amplified DNA. J Microbiol Methods 1998; 33 : 105–114.
18. Collins MT, Lisby G, Moser C et al. Results of multiple diagnostic tests for Mycobacterium avium subsp. paratuberculosis in patients with inflammatory bowel disease and in controls. J Clin Microbiol 2000; 38(12): 4373–4381.
19. Autschbach F, Eisold S, Hinz U et al. High prevalence of Mycobacterium avium subspecies paratuberculosis IS900 DNA in gut tissues from individuals with Crohn’s disease. Gut 2005; 54(7): 944–949.
20. Bull TJE, McMinn EJ, Sidi-Boumedine K et al. Detection and verification of Mycobacterium avium subsp. paratuberculosis in fresh ileocolonic mucosal biopsy specimens from individuals with and without Crohn’s disease. J Clin Microbiol 2003; 41(7): 2915–2923.
21. Sechi LA, Scanu AM, Molicotti P et al. Detection and isolation of Mycobacterium avium subspecies paratuberculosis from intestinal mucosal biopsies of patients with and without Crohn’s disease in Sardinia. Am J Gastroenterol 2005; 100(7): 1537–1538.
22. Feller M, Huwiler K, Stephan R et al. Mycobacterium avium subspecies paratuberculosis and Crohn’s disease: a systematic review and meta-analysis. Lancet Infect Dis 2007; 7 : 607–613.
23. Ryan P, Bennett MW, Aarons S et al. PCR detection of Mycobacterium paratuberculosis in Crohn’s disease granulomas isolated by laser capture microdissection. Gut 2002; 51 : 665–670.
24. Ryan P, Kelly RG, Lee G et al. Bacterial DNA within granulomas of patients with Crohn’s disease-detection by laser capture microdissection and PCR. Am J Gastroenterol 2004; 99(8): 1539–1543.
25. Naser SA, Ghobrial G, Romero C et al. Culture of Mycobacterium avium subspecies paratuberculosis from the blood of patients with Crohn’s disease. Lancet 2004;364(9439): 1039–1044.
26. Hermon-Taylor J, Barnes N, Clarke C et al. Mycobacterium paratuberculosis cervical lymphadenitis, followed five years later by terminal ileitis similar to Crohn’s disease. BMJ 1998; 316(7129): 449–453.
27. Marks DJ, Harbord MW, MacAllister R et al. Defective acute inflammation in Crohn’s disease: a clinical investigation. Lancet 2006; 367(9511): 668–678.
28. Simms LA, Doecke JD, Walsh MD et al. Reduced alpha-defensin expression is associated with inflammation and not NOD2 mutation status in ileal Crohn’s disease. Gut 2008; 57 : 903–910.
29. Ogura Y, Lala S, Xin W et al. Expression of NOD2 in Paneth cells: a possible link to Crohn’s ileitis. Gut 2003; 52(11): 1591–1597.
30. Stabel JR. Transitions in immune responses to Mycobacterium paratuberculosis. Vet Microbiol 2000; 77(3–4): 465–473.
31. Sechi LA, Gazouli M, Ikonomopoulos J et al. Mycobacterium avium subsp. paratuberculosis, genetic susceptibility to Crohn’s disease, and Sardinians: the way ahead. J Clin Microbiol 2005; 43(10): 5275–5277.
32. Sartor RB. Mechanisms of disease: pathogenesis of Crohn’s disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol 2006; 3(7): 390–407.
33. Wang G, Stange EF, Wehkamp J. Host-microbe interaction: mechanisms of defensin deficiency in Crohn’s disease. Expert Rev Anti Infect Ther 2007; 5(6): 1049–1057.
34. Wehkamp J, Wang G, Kübler I et al. The Paneth cell alpha-defensin deficiency of ileal Crohn’s disease is linked to Wnt/Tcf-4. J Immunol 2007; 179(5): 3109–3118.
35. Fixa B, Komárková O, Bedrna J et al. Crohnova choroba a protilátky proti Mycobacterium avium subspecies paratuberculosis. Česká a slovenská gastroenterologie 2000; 54(2): 175–179.
36. Hermon-Taylor J. Mycobacterium avium subspecies paratuberculosis in the causation of Crohn’s disease. World J Gastroenterol 2000; 6(5): 630–632.
37. Fixa B, Komárková O, Skaunic V et al. Inhibition of leucocyte migration by antigens from human colon and E. coli O 14 in patients with ulcerative colitis. Scand J Gastroenterol, 1975; 10 : 491–493.
38. Rowbotham DS, Howdle PD, Trejdosiewicz LK. Peripheral cell-mediated immune response to mycobacterial antigens in inflammatory bowel disease. Clin Exp Immunol 1995;102(3): 456–461.
39. Ren Z, Turton J, Borody T et al. Selective Th2 pattern of cytokine secretion in Mycobacterium avium subsp. paratuberculosis infected Crohn’s disease. J Gastroenterol Hepatol 2008; 23(2): 310–314.
40. Jones PH, Farver TB, Beaman B et al. Crohn’s disease in people exposed to clinical cases of bovine paratuberculosis. Epidemiol Infect 2006; 134(1): 49–56.
41. Sartor RB. Does Mycobacterium avium subspecies paratuberculosis cause Crohn’s disease? Gut 2005; 54(7): 896–898.
42. Greenstein RJ, Su L, Haroutunian V et al. On the Action of Methotrexate and 6-Mercaptopurine on M. avium subspecies paratuberculosis. PLoS One 2007; 2(1): e161.
43. Greenstein RJ, Su L, Shahidi A et al. On the Action of 5-Amino-Salicylic Acid and Sulfapyridine on M. avium including Subspecies paratuberculosis. PLoS One 2007; 2(6): e516.
44. Mendoza JL, Lana R, Díaz-Rubio M. Mycobacterium avium subspecies paratuberculosis and its relationship with Crohn’s disease. World J Gastroenterol 2009; 15(4): 417–422.
45. Graham DY, Al-Assi MT, Robinson M. Prolonged remission in Crohn’s disease following therapy for Mycobaterium paratuberculosis. Gastroenterol 1995; 108: A826.
46. Gui GP, Thomas PR, Tizard ML et al. Two-year-outcomes analysis of Crohn’s disease treated with rifabutin and macrolide antibiotics. J Antimicrob Chemother 1997; 39 : 393–400.
47. Borgaonkar MR, MacIntosh DG, Fardy JM. A meta-analysis of antimycobacterial therapy for Crohn’s disease. Am J Gastroenterol 2000; 95 : 725–729.
48. Borody TJ, Bilkey S, Wettstein AR et al. Anti-mycobacterial therapy in Crohn’s disease heals mucosa with longitudinal scars. Dig Liver Dis 2007; 39(5): 438–444.
49. Selby W, Pavli P, Rotty B et al. Two-Year Combination Antibiotic Therapy With Clarithromycin, Rifabutin, and Clofazimine for Crohn’s Disease. Gastroenterol 2007; 132(7): 2313–2319.
50. Hruska K, Bartos M, Kralik P et al. Mycobacterium avium subsp. paratuberculosis in powdered infant milk: paratuberculosis in cattle – the public health problem to be solved. Vet Med-Czech 2005; 50 : 327–335.
51. Naser S.A, Schwartz D., Shafran I. Isolation of Mycobacterium avium subsp paratuberculosis from breast milk of Crohn’s disease patients. AJG 2000; 95(4): 1094–1095.
Autoři děkují za významnou pomoc při získávání a ukládání vzorků ze střevních resekátů paní Ireně Šulcové z 2. interní katedry LF UK v Hradci Králové.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2010 Issue 2-
All articles in this issue
- Ohlédnutí za IV. kongresem ČGS
- Standardy – jak dále? (Projekt Mzd ČR)
- Mycobacterium avium subsp. paratuberculosis, etiologický faktor u Crohnovy choroby?
- Diagnostika a liečba pacientov s Peutz-Jeghersovým syndrómom
- Výsledky prospektívneho sledovania slizničných zmien v tenkom čreve kapsulovou enteroskopiou u pacientov s Crohnovou chorobou liečených biologickou liečbou
- 5. ECCO kongres, Kongresové centrum v Praze, 25.–27. 2. 2010
- Hepatologický dodatek ke článku: Doporučení pro vakcinaci a profylaxi infekčních chorob u nemocných s Crohnovou chorobou a ulcerózní kolitidou léčených imunosupresivy a biologickou léčbou (Česká a slovenská gastroenterologie a hepatologie 2010; 64(1): 40–
- Redukce příjmu kuchyňské soli ve stravě – účinný a levný prostředek ke zlepšení zdraví a prodloužení věku
- Za docentem MUDr. Jaroslavem Šetkou, CSc. (20. 8. 1925–10. 11. 2009)
- Za prof. MUDr. Zdeňkem Mařatkou, DrSc.(27. 6. 1914–24. 3. 2010)
- Zřízení nové sekce IBD v našem časopise
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika a liečba pacientov s Peutz-Jeghersovým syndrómom
- Mycobacterium avium subsp. paratuberculosis, etiologický faktor u Crohnovy choroby?
- Za docentem MUDr. Jaroslavem Šetkou, CSc. (20. 8. 1925–10. 11. 2009)
- Výsledky prospektívneho sledovania slizničných zmien v tenkom čreve kapsulovou enteroskopiou u pacientov s Crohnovou chorobou liečených biologickou liečbou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

