-
Medical journals
- Career
Konsenzuálny terapeutický algoritmus pre liečbu pomocou inzulínovej pumpy a kontinuálne meranie glykémie (v súlade s aktuálnym znením indikačných obmedzení)
: Emil Martinka 1; Marián Mokáň 2; Vladimír Uličiansky 3; Silvia Dókušová 1; Miriam Čiljaková 6; Ingrid Dravecká 4; Michaela Mišaníková 1,2; Ľubomír Barák 5; Miroslav Paľko 4; Darina Návratová 6; Výbor Sds
: Národný endokrinologický a diabetologický ústav n. o. v Ľubochni 1; I. interná klinika Jesseniovej LF UK a UNM, Martin 2; Via medica, s. r. o., Košice 3; I. interná klinika LF UPJŠ a UN LP Košice 4; Detské diabetologické centrum SR pri I. detskej klinike DFNsP, Bratislava 5; V. interná klinika LF UK a UN Bratislava, Nemocnica Ružinov 6
: Forum Diab 2016; 5(2): 111-120
: Guidelines
Podávanie inzulínu pomocou inzulínovej pumy umožňuje prostredníctvom vopred naprogramovaných opakovaných minidávok individualizáciu bazálnej substitúcie inzulínu pre jednotlivé časové obdobia dňa v hodinových intervaloch, s možnosťou diferenciácie o 0,05 až 0,01 U/hodinu. Umožňuje tak zohľadniť a prispôsobiť terapeutickú substitúciu inzulínu požiadavkám fyziologického diurnálneho rytmu ako aj dlhodobo či aktuálne sa meniacim denným potrebám vyplývajúcim z pracovných požiadaviek alebo požiadaviek životného štýlu. Predkladaný text predstavuje v súlade s aktuálnym znením indikačných obmedzení konsenzuálny terapeutický algoritmus pre liečbu pomocou inzulínovej pumpy a kontinuálne meranie glykémie, ktorý formuloval výbor Slovenskej diabetologickej spoločnosti.
Kľúčové slová:
individualizované podávanie – inzulínová pumpa – inzulínové pero – kontinuálne podávanie – subkutánna infúziaÚvod
Podávanie inzulínu pomocou inzulínovej pumpy (IP), alebo tiež kontinuálna subkutánna infúzia inzulínu (continuous subcutaneous insulin infusion – CSII) patrí v súčasnosti medzi najdokonalejšie spôsoby podávania inzulínu. Tento terapeutický prístup umožňuje prostredníctvom vopred naprogramovaných opakovaných minidávok individualizáciu bazálnej substitúcie inzulínu pre jednotlivé časové obdobia dňa v hodinových intervaloch, s možnosťou diferenciácie o 0,05 až 0,01 U/hodinu (podľa typu pumpy a celkovej hodinovej dávky). Umožňuje tak zohľadniť a prispôsobiť terapeutickú substitúciu inzulínu požiadavkám fyziologického diurnálneho rytmu (graf 1a, b), ako aj dlhodobo či aktuálne sa meniacim denným potrebám vyplývajúcim z pracovných požiadaviek alebo požiadaviek životného štýlu, vrátane športových aktivít. Okrem toho, naprogramovanú hodinovú dávku inzulínu pumpa infunduje v niekoľkých dielčích dávkach (podľa typu pumpy rozložených až do 20 dávok za hodinu), čím podávanie inzulínu pomocou IP napodobňuje aj pulzný charakter fyziologickej sekrécie inzulínu [9]. Rozdiely v CSII oproti bežnému depotnému podávaniu pomocou inzulínových pier (IIT – intensive insulin tharapy, alebo tiež MDI – multiple daily insulin injections) sú uvedené v tab. 1.
Graf 1a Fyziologická sekrécia inzulínu, resp. potreba inzulínu v priebehu dňa a nedostatky depotného podávania bazálneho inzulínu na príklade NPH inzulínu 
Kinetika uvoľňovania a vstrebávania sa bazálnych inzulínov pre depotné podávanie nedokáže plne kopírovať fyziologické požiadavky na bazálnu potrebu inzulínu. Vznikajú tak obdobia s nadbytkom, resp. nedostatkom inzulínu. Dôsledkom sú hypoglykémie, resp. hyperglykémie. Graf 1b Substitúcia bazálnej potreby inzulínu pomocou inzulínovej pumpy 
1. Niektoré rozdiely medzi depotným podávaním bazálneho inzulínu a substitúciou bazálnej potreby inzulínu pomocou inzulínovej pumpy 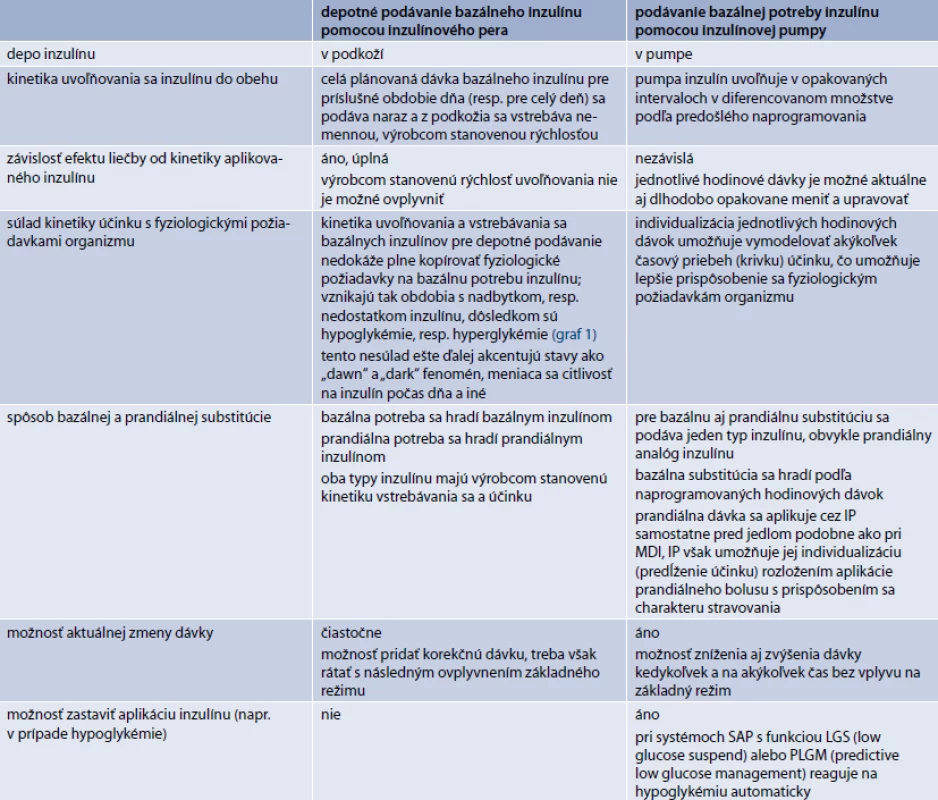
MDI – multiple daily insulin injection (depotné podávanie inzulínu pomocou viacerých injekcií, resp. IIT) SAP – sensor augmented pump / pumpa spolupracujúca zo senzorom Hoci inzulínová pumpa umožňuje individualizáciu hlavne bazálnej substitúcie inzulínu, umožňuje do určitej miery individualizovať aj spôsob prandiálnej substitúcie, a to možnosťou rozloženia aplikácie prandiálneho bolusu s prispôsobením sa charakteru stravovania (trvanie jedla, glykemický index potravy). Pri programovaní podávania inzulínu sa vychádza z glykemických profilov. V komplikovanejších prípadoch je vhodné využiť kontinuálne monitorovanie glykémie.
Indikácie pre podávanie inzulínu pomocou inzulínovej pumpy sú viaceré. Medzi najčastejšie patrí častý výskyt hypoglykémií pri depotnom podávaní inzulínu, obzvlášť nočných, syndróm neuvedomovania si hypoglykémie, rezistentný „dawn“, resp. „dark“ fenomén, prejavujúce sa prudkým vzostupom glykémie ráno pred raňajkami, resp. pred večerou, ktoré sa nedarí vyriešiť ani použitím bazálnych analógov inzulínu. Pre aplikáciu inzulínu pomocou IP sa v uvedených prípadoch rozhodujeme obzvlášť promptne v prípade, že sa jedná o tehotnú ženu alebo ženu pripravujúcu sa na otehotnenie. Rozhodnosť je nevyhnutná aj pri predčasnom výskyte a rýchlej progresii diabetických komplikácií a u pacientov s náročným pracovným režimom vyžadujúcim si vysoký stupeň flexibility.
K dispozícii máme celý rad dôkazov „evidence based medicine“ (EBM), že liečba IP prispieva k zásadnému zlepšeniu glykemickej kontroly, predovšetkým k redukcii rizika hypoglykémie, času zotrvávania v hypoglykémii, ale aj úpravy hyperglykémie, HbA1c, nadmerných vnútrodenných oscilácií a medzidennej variability glykémií [13]. Tieto benefity sa umocňujú, ak sa súčasne využíva aj kontinuálny monitoring glykémie [12–17].
Kontinuálne monitorovanie glykémie
Kontinuálne monitorovanie glykémie (continuous glucose monitoring – CGM; (tab. 2) je významným prínosom, a to tak pre diagnostické účely ako aj pre zlepšenie efektu liečby. Umožňuje napríklad identifikáciu asymptomatických, skrytých a nočných hypoglykémií, hodnotenie rozsahu vnútrodenných oscilácií či medzidenných variácií, ako aj identifikáciu obdobia dňa ich výskytu apod. Terapeutický benefit CGM spočíva vo významnom príspevku k poklesu HbA1c, poklese času stráveného vo vysokých a nízkych rozsahoch glykémie a vo zvýšení podielu času stráveného v cieľovom rozmedzí [4,14]. V kombinácii s IP prispieva CGM nielen k ďalšiemu zlepšeniu glykemickej kontroly charakterizovanej aditívnym poklesom HbA1c a zvýšením podielu pacientov s HbA1c < 7 % bez zvýšeného rizika hypoglykémie. Rovnako prispieva aj k nižšiemu výskytu hypoglykémií, redukcii jej závažnosti, resp. skráteniu času strávenému v hypoglykémii, nižšiemu rozsahu glykemickej variability a zlepšeniu kvality života, a to tak u dospelých [2,3,6–8,12–16] ako aj u detí [2,7,16]. Benefit pritom narastá s frekvenciou používania senzora [2,12].
2. Základné charakteristiky senzora a CGM 
Pumpy spolupracujúce so senzorom
Pumpy spolupracujúce so senzorom (sensor augmented pump – SAP) sú schopné priamo komunikovať so CGM (tab. 3) a dokonca priamo reagovať na hypoglykémiu, nízke hodnoty glykémie, resp. nebezpečný trend k poklesu glykémie s rizikom hypoglykémie tým, že zastavia podávanie inzulínu (systém LGS – low glucose suspend, alebo PLGM – predictive low glucose management) a následne, po vymiznutí rizikovej situácie podávanie inzulínu opäť obnovia [5,6,16], aby sa predišlo následnému vzostupu glykémie. Dokážu tak znížiť frekvenciu výskytu hypoglykémie, zamedziť progresii do ťažkej hypoglykémie a minimalizovať trvanie hypoglykémie. Najnovší systém IP s funkciou PLGM dokáže okrem ďalšej redukcie trvania a závažnosti hypoglykémie dokonca rozvoju hypoglykémie predchádzať [15].
3. Inzulínové pumpy aktuálne dostupné na slovenskom trhu 
Tieto benefity majú u mnohých pacientov zásadný a nenahraditeľný význam, a to nielen z hľadiska redukcie rizika rozvoja chronických komplikácií, ale aj akútnych, život ohrozujúcich stavov, obzvlášť u pacientov so syndrómom neuvedomovania si hypoglykémie a vysokým kardiovaskulárnym rizikom. Je reálny predpoklad, že u týchto pacientov môžu znížiť riziko úmrtia v dôsledku hypoglykémie. U tehotných žien a u žien s diabetom pripravujúcich sa na tehotenstvo sa benefit liečby prejavuje v zabezpečení optimálneho prostredia pre vyvíjajúci sa plod, v eliminácii rizika vývojových vád a v priaznivom priebehu tehotenstva pre matku aj dieťa.
Hoci sa liečba pomocou IP využíva hlavne u pacientov s diabetes mellitus 1. typu (DM1T) čoraz častejšie uplatnenie nadobúda aj u pacientov s diabetom 2. typu (DM2T), a to nielen u tých, u ktorých sa jedná o nerozpoznaný DM1T charakteru LADA, ale aj u pacientov s dlhodobo neuspokojivou glykemickou kontrolou v zmysle rezistentných hyperglykémií [9–11], u ktorých dosahuje oproti bežnému depotnému podávaniu aditívny pokles HbA1c bez zvýšenia rizika hypoglykémie, obzvlášť u pacientov s vysokými hodnotami HbA1c a vysokými dávkami inzulínu [1]. Benefitom naviac je nižšia spotreba inzulínu [1].
Softvérové vybavenie napomáhajúce optimalizácii výsledku liečby
Efektivitu liečby pomocou IP s využívaním CGM významne zvyšuje aj softvérové vybavenie, ktoré uľahčuje, resp. napomáha zlepšiť vedenie pacientov liečených IP ako aj tých, ktorí využívajú CGM. Medzi takéto softwérové pomôcky patrí napríklad poradca bolusu (bolus advisor, bolus wizard) či program sprehľadňujúci vývoj glykémií v závislosti od podávania inzulínu a celého radu zohľadňovaných okolností (napr. CareLink)
Podmienky hradenia liečby zo zdravotného poistenia
Liečba pomocou IP predstavuje finančne náročnú liečbu. Preto jej realizácia z prostriedkov zdravotného poistenia podlieha schvaľovaciemu procesu, súčasťou ktorého sú aj indikačné obmedzenia.
Predpokladom úspešnosti používania IP je okrem správnej indikácie vylúčenie inak riešiteľných situácií a situácií, ktoré tento spôsob liečby nevyrieši, spolupráca, motivácia a schopnosti pacienta podmienené absolvovaním adekvátnej edukácie a osvojením si jej zásad pacientom, odskúšanie efektu liečby, zabezpečenie pravidelných kontrol, zabezpečenie medicínskej a technickej asistencie, kontinuálne vyhodnocovanie údajov a výsledkov liečby prostredníctvom registra.
Nedostatky liečby pomocou inzulínovej pumpy a kontinuálneho monitorovania glykémie
Hoci je podávanie inzulínu pomocou IP v súčasnosti najdokonalejším spôsobom podávania inzulínu v reálnej klinickej praxi, v porovnaní s fyziologickou sekréciou pretrvávajú viaceré nevýhody, ktoré súvisia hlavne s podkožnou aplikáciou inzulínu (variácia absorpcie, kožný metabolizmus, spomalenie začiatku účinku, inzulín sa nefyziologicky najskôr dostáva do periférie, obchádza pečeň, možné zápalové reakcie a pod). Nevýhodou je tiež, že pumpa na rozdiel od fyziologickej sekrécie pracuje podľa „predošlého“ naprogramovania na základe selfmonitoringu a klinickej úvahy lekára, nie podľa aktuálnej glykémie. Rovnako CGM má niektoré nevýhody súvisiace s meraním intersticiálnej glukózy a určitým oneskorením aktuálnej informácie o glykémii (lag time), potrebu kalibrácie a pod.
Kontraindikácie liečby inzulínovou pumpou
Absolútne kontraindikácie podávania inzulínu inzulínovou pumpou nie sú známe. Za relatívne kontraindikácie sa pokladajú zásadné nedostatky v spolupráci pacienta (nedostatky v edukácii, odmietanie intenzívneho selfmonitoringu, nevedomosť a neochota kalkulácie dávok jedla, sklony k sebapoškodzovaniu, mentálna zaostalosť a technická neschopnosť, ktoré sa nedajú korigovať pomocou inej osoby). Relatívnou kontraindikáciou sú aj prípady, u ktorých dôvodom neuspokojivej kompenzácie je iná príčina, než sú nedostatky v dynamike účinku a vstrebávania inzulínu. Takými sú poruchy trávenia, zápalové ochorenia, endokrinopatie a pod, u ktorých je potrebné riešiť najskôr základné ochorenie. Úvahu o vhodnosti liečby pomocou IP vyžadujú aj situácie s častým výskytom diabetickej ketoacidózy a zápalovými ochoreniami kože. Riziko diabetickej ketoacidózy môže byť v niektorých prípadoch dokonca zvýšené. Napokon, relatívnu kontraindikáciu predstavujú aj psychologické problémy (strach, hanba z ochorenia) a najmä závažnejšia psychiatrická choroba, ktorá nie je pod kontrolou, ale aj situácia, keď nie sú zabezpečené pravidelné lekárske kontroly a technická asistencia [9–11].
A. Postup pri realizácii liečby/podávanie inzulínu pomocou inzulínovej pumpy
1 Indikácia pacienta pre hradenú liečbu pomocou inzulínovej pumpy
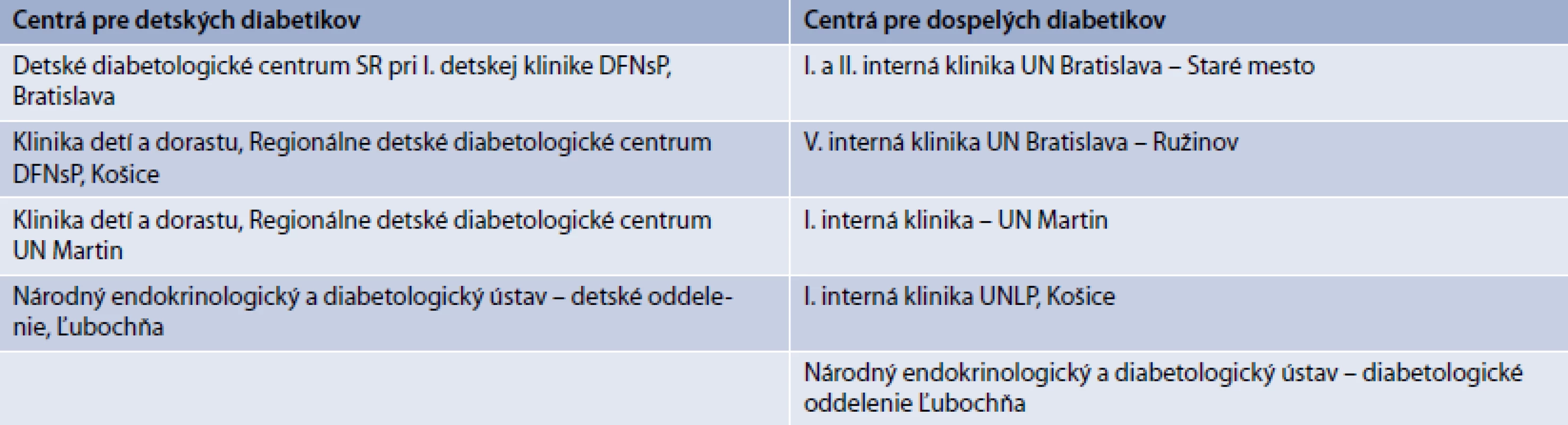
Indikácia pacienta pre hradenú liečbu pomocou inzulínovej pumpy (IP) sa riadi znením indikačného obmedzenia (tab. 4). Indikáciu môže navrhnúť iba lekár so špecializáciou v odbore diabetológia, poruchy metabolizmu a výživy (kód 050), alebo detská endokrinológia a diabetológia, poruchy metabolizmu a výživy (kód 153), pričom za detský vek sa považuje vek do 18 rokov + 364 dní.
4. Preskripčné obmedzenia a indikačné obmedzenia liečby pomocou inzulínovej pumpy. Hradená liečba v skupine D 10.1 podlieha predchádzajúcemu súhlasu zdravotnej poisťovne. 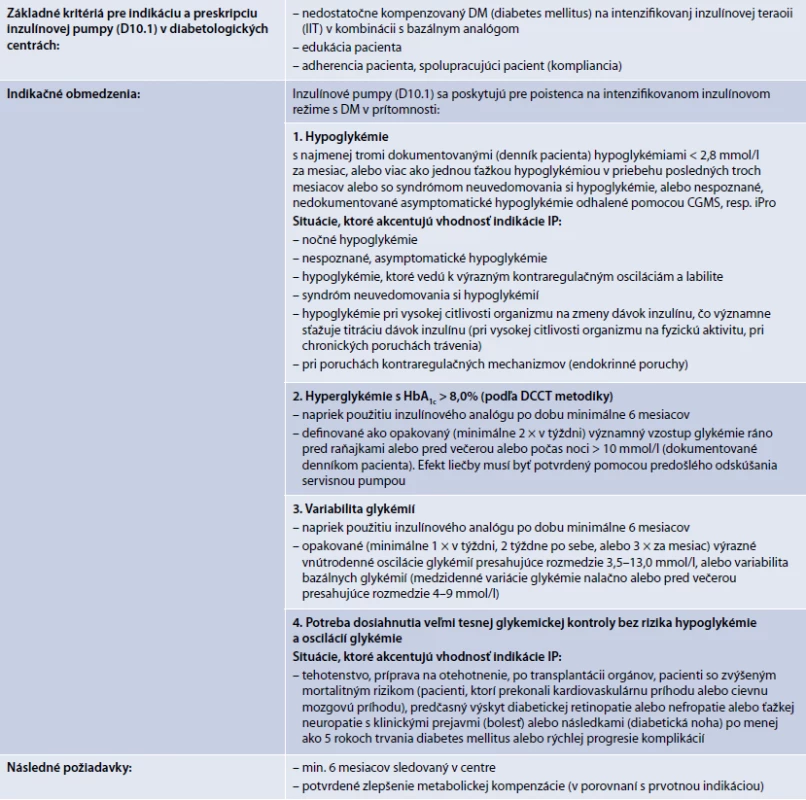
Postup je možné rozdeliť do niekoľkých krokov:
1.1 Úloha ambulantného diabetológa
Ambulantný diabetológ sa pre liečbu pomocou IP rozhoduje u pacienta, u ktorého sa bežným depotným podávaním inzulínu dlhodobo nedarí dosiahnuť adekvátnu glykemickú kontrolu a ktorý rámcovo spĺňa požiadavky indikačného obmedzenia pre takúto liečbu (tab. 4).
Ak sa ambulantný diabetológ na základe svojho klinického úsudku rozhodol pre liečbu pomocou IP, oboznámi o tomto návrhu pacienta a po získaní jeho súhlasu následne vyplní:
- a) žiadosť o liečbu pomocou IP, v ktorej vyplní všetky príslušné požadované údaje
- b) krátku žiadosť o hospitalizáciu v príslušnom diabetologickom centre (tab. 5), v ktorej uvedie dôvod svojho rozhodnutia pre liečbu pomocou IP.
Obe žiadosti odošle na príslušné diabetologické centrum. Je vítané (nie však nutné), ak ambulantný diabetológ pacientovi ešte pred odoslaním poskytne základnú edukáciu vrátane uvedenia typu IP, pre ktorú pacienta predškolil, čo významne urýchli proces samotného nastavovania.
Pokiaľ ambulantný diabetológ iba zvažuje vhodnosť liečby pomocou IP, odosiela do diabetologického centra:
žiadosť o hospitalizáciu s uvedením „vhodnosti zváženia liečby pomocou IP“, z dôvodu, ktorý vyšpecifikuje v zmysle znenia indikačných obmedzení (tab. 4)
1.2 Úloha diabetologického centra (DC) pri indikácii pre liečbu IP
Diabetológ DC pri zvažovaní liečby pomocou IP vychádza z troch možných situácií:
- a) zo žiadosti ambulantného diabetológa
- b) z návrhu ambulantného diabetológa „zvážiť liečbu pomocou IP“
- c) z vlastného klinického zhodnotenia pacienta, u ktorého liečba IP síce nebola primárne iniciovaná zo strany ambulantného diabetológa, podľa názoru DC by však bola vhodná
V takomto prípade diabetológ centra informuje pacienta aj jeho ambulantného diabetológa o zámere liečby pomocou IP, pričom pacient aj ambulantný diabetológ musia s liečbou pomocou IP súhlasiť.
Diabetológ DC v následných krokoch overí splnenie medicínskych a formálnych podmienok pre liečbu pomocou IP, zabezpečí adekvátnu medicínsku a technickú edukáciu pacienta a vyplní a odošle žiadosť na príslušnú zdravotnú poisťovňu (ZP).
1.3 Nastavenie pacienta na liečbu pomocou inzulínovej pumpy
prebieha v diabetologických centrách [9–11] na to určených (tab. 5) a pozostáva z niekoľkých krokov:
1.3.1 Zhodnotenie predošlej liečby depotným podávaním inzulínu s identifikáciou nedostatkov depotného podávania a problémových období. Identifikáciu problémových období urýchľuje súčasné použitie kontinuálneho monitorovania glykémie (CGMS).
1.3.2 Dôkladná edukácia pacienta (technická edukácia a nácvik zručností ohľadom technického a mechanického ovládania pumpy, technika výmeny zásobníka a kanýl, upravovania dávok inzulínu, identifikácie možných technických problémov a nedostatkov a postup pri ich riešení, znalosť možných komplikácií pri liečbe IP a pod).
1.3.3 Iniciálny návrh bazálnych a prandiálnych dávok inzulínu zohľadňujúci predošlé dávky a režim podávania inzulínu a problémové obdobia.
Postup pri nastavovaní iniciálnych dávok a ich rozloženie
Iniciálna dávka inzulínu sa vypočíta nasledovne:
Pôvodná celodenná dávka inzulínu (CDI) sa zredukuje o 0 %–20 % a následne sa prerozdelí v pomere 40 % na bazálnu substitúciu a 60 % pre prandiálnu substitúciu. Dávka pripadajúca na bazálnu substitúciu sa rozdelí do 24 hodinových dávok tak, aby dávky pre jednotlivé hodiny dňa čo najlepšie vyhovovali očakávanej fyziologickej potrebe, ktorá má tvar sinusoidy a predpokladá 2 denné maximá a 2 denné minimá (graf 1). Prepočet sa obvykle robí pomocou softvéru (www.nedu.sk) po zadaní celkovej dávky pre bazálnu substitúciu, pričom jednotlivé hodinové dávky sa obvykle pohybujú v rozsahu 0,2–1,6 U/hod. Prandiálne dávky (pred raňajkami, pred obedom a pred večerou) sa prerozdelia v pomere 20 : 20 : 20 % z celkovej dennej dávky.
1.3.4 Úprava jednotlivých hodinových dávok inzulínu na základe monitorovania glykémie.
Dolaďovanie dávok (titrácia) pre bazálnu substitúciu
Jednotlivé hodinové dávky pre bazálnu substitúciu inzulínu sa upravujú podľa glykémií v glykemickom profile, ktorý identifikuje tzv. problémové obdobia. Po identifikácii problémového obdobia sa dávka inzulínu zvýši alebo zníži o 0,1 U/hodinu v intervale 2–3 hodín pred identifikovaným problémovým obdobím. Dôvodom tohto predsunutia je, aby sa vrchol kinetiky účinku inzulínu v pumpe (prandiálny analóg) prejavil práve v problémovom období. Napríklad, ak je vysoká hodnota glykémie pred obedom (12 : 00), dávku inzulínu zvýšime o 0,1 U v intervale už od 09 : 00 do 12 : 00 hod. Ak je zvýšenie pred obedom len mierne, obvykle postačuje zvýšenie v intervale od 10 : 00 do 12 : 00 hod. U detí a pacientov s vysokou citlivosťou na inzulín je možné k úpravám využiť aj kroky v zmene hodinových dávok o 0,05 až 0,01 (podľa typu pumpy a hodinovej dávky inzulínu).
Dolaďovanie dávok (titrácia) pre prandiálnu substitúciu
Jednotlivé prandiálne dávky sa upravujú podľa postprandiálnych glykémií v glykemickom profile, pričom sa uplatňujú rovnaké princípy ako pri bežnom depotnom podávaní inzulínu, nakoľko aj pri liečbe IP si pacient obvykle aplikuje celú dávku prandiálneho bolusu naraz. IP však umožňuje aj tzv. „rozloženú“ aplikáciu prandiálneho bolusu s prispôsobením sa charakteru stravovania (trvanie jedla, glykemický index potravy). Optimalizáciu prandiálnej dávky umožňuje softvérová funkcia bolus advisor, resp. bolus wizard. Dolaďovanie dávok môže trvať rôzne dlho (spravidla do 7 dní), pričom po iniciálnom vystabilizovaní glykémií (najmä nočnej potreby) počas hospitalizácie možno s úpravami ďalej pokračovať v domácich podmienkach. Počas nastavovania je možné naprogramovať viacero bazálnych režimov podľa rôznych podmienok (napr. obdobie pracovného týždňa, režim počas voľných dní, tréningový režim u športovca a pod). Titráciu dávok urýchľuje súčasné použitie kontinuálneho monitorovania glykémie (CGMS).
Dočasné prerušenie podávania inzulínu IP
Podávanie inzulínu pomocou IP je možné dočasne (cca do 2 hodín trvania) odpojiť (napr. počas plávania a pod), predtým je však potrebné formou bolusu vytvoriť podkožné depo v dávke, ktorá by bola bežne podaná v nasledujúcich 2–3 hodinách. Dôvodom je prekrytie obdobia, počas ktorého je podávanie pomocou IP zastavené.
Výmena kanýl (infúznych setov)
Výmena kanýl (infúznych setov) sa odporúča v trojdenných intervaloch. Vzhľadom k očakávanej fyziologickej reakcii kože sa neodporúča kanyly ponechávať na jednom mieste dlhšie. Z rovnakého dôvodu je u niektorých pacientov potrebná častejšia výmena kanýl. Za optimálne miesto aplikácie sa považuje oblasť brucha. Pri výmene sa odporúča striedanie miest vpichu a dezinfekcia. Výber kanýl (dĺžka a uhol zavedenia) závisí od klinickej úvahy lekára a predošlých skúseností u pacienta. Pri výbere sa zohľadňuje najmä miesto aplikácie (prirodzený pohyb tela) a hrúbka podkožia.
2 Zaradenie pacienta do registra IP
Vyplnia sa všetky údaje požadované registrom. Register je zastrešený NCZI.
3 Prepustenie pacienta z hospitalizácie
Pacient by mal byť prepustený v stave dobrej glykemickej kontroly, po absolvovaní edukácie a overení schopností ovládať pumpu, vymieňať kanyly a pod. Je optimálne, ak v čase do demitácie prebehne celý schvaľovací proces ZP a pacient odchádza s vlastnou pumpou a vybavený vlastným spotrebným materiálom (zásobník, kanyly, resp. infúzne sety) na najbližší mesiac liečby.
4 Kontroly počas prvých 6 mesiacov po prepustení
S cieľom dosiahnuť čo najlepšie výsledky liečby, DC po prepustení pacientovi poskytuje paralelnú ambulantnú kontrolu a to 1, 3 a 6 mesiacov po prepustení. Je ideálne ak kontrolné vyšetrenia pacient absolvuje v centre, ktoré ho nastavovalo. Avšak, v prípade okolností je možné kontrolnú starostlivosť poskytnúť v najbližšom centre podľa miesta bydliska. Pri všetkých kontrolných návštevách sa s pacientom preberú všetky skúsenosti, problémy a eventuálne komplikácie, ponechá sa miesto na kladenie otázok pacienta, poskytne sa doplnková edukácia, upravia sa jednotlivé dávky inzulínu a aktualizujú aj údaje v registri IP.
5 Následné kontroly a kritériá pre konzultácie v DC
Následné kontroly sa realizujú v ambulancii spádového diabetológa, ktorý podľa potreby využíva konzultácie DC. Spádový diabetológ odosiela pacienta na konzultáciu, resp. neplánovanú ambulantnú kontrolu (hospitalizáciu) v DC na základe svojej klinickej úvahy, obzvlášť ak u pacienta došlo k zhoršeniu parametrov glykemickej kontroly oproti poslednej kontrole v DC, alebo sa objavili komplikácie, či iné relevantné klinické okolnosti. Za takéto možno považovať vzostup HbA1c o viac ako 0,5 % (DCCT), nárast počtu hypoglykémií, objavenie sa ťažkých hypoglykémií, zvýraznenie oscilácií glykémie, ketoacidotickú príhodu, zápalové reakcie kože v mieste vpichu, tehotenstvo alebo príprava na otehotnenie, zásadnú zmenu v zdravotnom stave pacienta, zásadnú zmenu životného štýlu pacienta a pod.
6 Pokračovanie v liečbe pomocou IP. Výmena pumpy po skončení jej životnosti
Podmienkou pre pokračovanie v liečbe pomocou IP po skončení jej životnosti je zlepšenie v parametroch, pre ktoré bola IP indikovaná. Ak bola pumpa indikovaná z dôvodu otehotnenia alebo prípravy na otehotnenie, môže žena IP používať až do ukončenia životnosti IP. Následne sa indikácia prehodnotí. O pokračovaní liečby rozhoduje príslušné DC, po predošlom súhlase pacienta a spádového diabetológa.
7 Dôvody pre ukončenie liečby pomocou IP pred ukončením jej životnosti
Liečbu pomocou IP je možné ukončiť kedykoľvek, ak o to požiada pacient alebo z medicínskych dôvodov. Medzi medicínske dôvody patrí najmä zhoršenie parametrov glykemickej kontroly, opakovaná diabetická ketoacidóza pri liečbe IP, kožné reakcie v mieste zavedenia kanyly, ak pacient dlhodobo nezvláda technickú obsluhu IP, ak nedošlo k zlepšeniu glykemickej kontroly a pacient vedome, resp. úmyselne a hrubo porušuje režim a spoluprácu a iné, ktoré lekár považuje za prekážku liečby pomocou IP.
B. Postup pri realizácii kontinuálneho monitorovania glykémie
1 Indikácia pacienta pre kontinuálne monitorovanie glykémie (CGM)
Kontinuálne monitorovanie glykémie hradené zo zdravotného poistenia sa riadi znením indikačného obmedzenia (tab. 6). Indikáciu môže navrhnúť iba lekár so špecializáciou v odbore diabetológia, poruchy metabolizmu a výživy (kód 050) alebo detská endokrinológia a diabetológia, poruchy metabolizmu a výživy (kód 153), pričom za detský vek sa považuje vek do 18 rokov + 364 dní. Postup je možné rozdeliť do niekoľkých krokov:
6. Množstvové limity a indikačné obmedzenia pre glukózové senzory 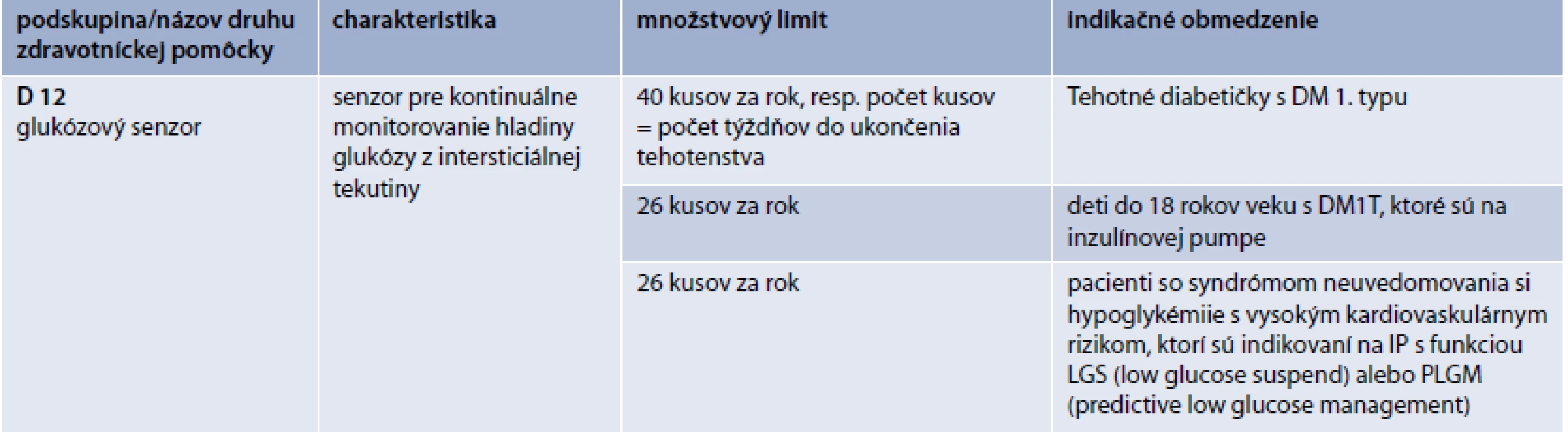
Následné požiadavky:
- min. 6 mesiacov sledovaný v centre
- potvrdené zlepšenie metabolickej kompenzácie (v porovnaní s prvotnou indikáciou)
Preskripcia pre skupinu D12 (tab. 5, s. 116)
1.1 Úloha ambulantného diabetológa
Ambulantný diabetológ sa pre CGM rozhoduje u pacienta, u ktorého predpokladá, že napriek bežnému monitorovaniu glykémie pomocou 7 až 8-bodového profilu toto dostatočne neodráža stav a priebeh glykémií, čo komplikuje adekvátne vedenie liečby alebo pacienta vystavuje zvýšenému morbiditno-mortalitnému riziku:
- pri podozrení na skryté, asymptomatické alebo nočné hypoglykémie, ktoré nie je možné odhaliť bežným monitorovaním glykémie
- pri syndróme neuvedomovania si hypoglykémie
- pri podozrení na výrazné oscilácie a medzidennú variabilitu glykémie, ktoré dostatočne nereprezentuje bežné monitorovanie glykémie
- pri nepravidelných a nejasných prejavoch glykémií v glykemickom profile
- pri pretrvávaní vysokých glykémií s HbA1c > 8,0 % napriek pravidelnému selfmonitoringu
- pri zvažovaní liečby pomocou IP
- za účelom zhodnotenia vplyvu fyzickej aktivity a diétnych faktorov na priebeh glykémií
- iné klinické prejavy
Indikáciu CGM akcentuje tehotenstvo, detský vek, syndróm neuvedomovania si hypoglykémie, časté dekompenzácie glykemickej kontroly, rizikovosť pacienta a ďalšie klinické stavy.
1.2 Indikácie pre CGM (jednorazové alebo dlhodobé)
1.2.1 Jednorazová, resp. intermitentná (diagnostická) indikácia CGM – otvorené meranie real–time monitoring, alebo zaslepené monitorovanie napr. iPro. Nastavenie sa realizuje sa v DC (pri pátraní po asymptomatických, skrytých alebo nočných hypoglykémiách, pri hodnotení rozsahu vnútrodenných oscilácií alebo medzidennej variability glykémií, pri hodnotení vplyvu intenzity fyzickej záťaže alebo diétnych vplyvov na glykémie, pri overovaní terapeutického efektu liečby a pod). Po zavedení CGM v DC môže monitorovanie prebiehať počas hospitalizácie alebo v domácich podmienkach.
1.2.2 Dlhodobá (terapeutická) indikácia CGM (otvorené meranie, real-time monitoring). CGM dlhodobo hradené z prostriedkov zdravotného poistenia je možné použiť za účelom zlepšenia glykemickej kontroly:
- u tehotných pacientiek s DM1T (množstvové limity a indikačné obmedzenie pre jednotlivé skupiny je uvedené v tab. 6)
- u detí s DM1T, ktoré sú na liečbe pomocou IP, do veku 18 rokov
- u dospelých pacientov so syndrómom neuvedomovania si hypoglykémie, v spojitosti s liečbou pomocou IP s funkciou LGS (low glucose suspend) alebo PLGM (predictive low glucose management) s vysokým kardiovaskulárnym morbiditno-mortalitným rizikom
Pre dlhodobé používanie hradené zo zdravotného poistenia by CGM mal byť indikovaný iba u pacientov, ktorí spĺňajú požiadavky indikačného obmedzenia, a okrem toho:
- u ktorých je predpoklad a technické zabezpečenie, že CGM bude využívaný aspoň 50 % času (t.j. 26 týždňov v roku)
- ktorí sú schopní adekvátne využívať jeho informácie pre úpravu glykémie s cieľom zlepšenia glykemickej kontroly, eliminácie hypoglykémií a nadmerných oscilácií glykémií (zabezpečuje sa medicínskou edukáciou a inštrukciami)
- ktorí predtým pravidelne využívali selfmonitoring glykémií (SMBG) a efektívne využívali jeho informácie
- ktorí sú liečení pomocou IP (všetky skupiny) alebo aspoň intenzifikovaným podávaním inzulínu (iba tehotné ženy)
- u dospelých pacientov so syndrómom neuvedomovania si hypoglykémie a vysokým kardiovaskulárnym rizikom by sa mali uprednostňovať pumpy spolupracujúce so senzorom (systém SAP – senzor augmented pump) využívajúci technológiu LGS alebo PLGM
2 Nastavenie pacienta na CGM
Nastavenie prebieha v diabetologických centrách [8,9] na to určených (tab. 5) a pozostáva z niekoľkých krokov:
- a) potvrdenie (overenie) indikácie
- b) technické zaškolenie pacienta (kalibrácia, zapisovanie udalostí, reakcia na výsledky)
- c) samotné napojenie CGM – spočíva v s.c. zavedení senzora (pomocou zavádzača) a jeho fixácii, adaptácii transmitera (vysielača), v bezdrôtovom nadviazaní spojenia medzi senzorom a monitorom, resp. inzulínovou pumpou; pre správne fungovanie CGM je potrebná kalibrácia, prvá do 2 hodín a následne každých 6 hodín počas prvého dňa. V následných dňoch minimálne každých 12 hodín (optimálne 3–4-krát denne), pre kalibráciu sa využívajú hodnoty v daných časových intervaloch paralelne namerané glukometrom. Pri inzulínovej pumpe s funkciou LGS a PLGM sa okrem rôznych alarmov nastavujú aj parametre ochrannej funkcie pred hypoglykémiou (PLGM) alebo pri hypoglykémii (LGS), kedy pumpa automaticky zareaguje pozastavením podávania inzulínu. Bežné CGM umožňuje nastavenie rôznych hlásení/alarmov (upozornenie pri vysokej alebo nízkej glykémii, ako aj pri trendoch k týmto odchýlkam podľa predošlého nastavenia lekárom), pacientovi sa odporúča počas monitorovania zapisovať klinicky relevantné udalosti (pohyb, príjem potravy, akútne ochorenia, fyziologické stavy ako menzes a pod), ktoré uľahčujú vyhodnotenie monitoringu
- d) vyhodnotenie CGM (systém, umožňuje podrobnú grafickú, tabuľkovú a textovú analýzu, čomu napomáha aj softvérové vybavenie (napr. CareLink)
- e) navrhnutie vhodných diagnosticko-terapeutických úprav u pacienta
3 Kontroly pri dlhodobom monitorovaní
S cieľom dosiahnuť čo najlepšie výsledky liečby, DC po prepustení pacientovi poskytuje paralelnú ambulantnú kontrolu, a to 1, 3 a 6 mesiacov po prepustení. Je ideálne ak kontrolné vyšetrenia pacient absolvuje v centre, ktoré ho nastavovalo. Avšak, v prípade okolností je možné kontrolnú starostlivosť poskytnúť v najbližšom centre podľa miesta bydliska. Pri všetkých kontrolných návštevách sa s pacientom preberú všetky skúsenosti, problémy a eventuálne komplikácie, ponechá sa miesto na kladenie otázok pacienta, poskytne sa doplnková edukácia, upravia sa jednotlivé dávky inzulínu a aktualizujú sa údaje v registri IP.
4 Dôvody pre ukončenie používania CGM
Používanie CGM je možné ukončiť kedykoľvek, ak o to požiada pacient alebo z medicínskych dôvodov. Medzi medicínske dôvody patrí najmä zhoršenie parametrov glykemickej kontroly, kožné reakcie v mieste zavedenia senzora, ak pacient dlhodobo nezvláda technickú obsluhu CGM, ak nedošlo k zlepšeniu glykemickej kontroly alebo očakávaného efektu CGM, ak pacient vedome, resp. úmyselne a hrubo porušuje režim a spoluprácu a iné, ktoré lekár považuje za neefektívne používanie pomôcky.
doc. MUDr. Emil Martinka, PhD.
martinkaemil@hotmail.com
Národný endokrinologický a diabetologický ústav n. o. v Ľubochni
www.nedu.sk
Doručené do redakcie 29. 4. 2016
Sources
1. Aronson R, Cohen O, Conget I et al. OpT2mise: a randomized controlled trial to compare insulin pump therapy with multiple daily injections in the treatment of type 2 diabetes-research design and methods. Diabetes Technol Ther 2014; 16(7): 414–420. Dostupné z DOI: <http://dx.doi.org/doi:10.1089/dia.2013.0363>.
2. Bergenstal RM, Tamborlane WV, Ahmann A et al. Sensor-augmented pump therapy for A1C reduction (STAR 3) study: results from the 6-month continuation phase. Diabetes Care 2011; 34(11): 2403–2405.
3. Conget I, Battelino T, Giménez M et al. [SWITCH Study Group]. The SWITCH Study (Sensing With Insulin pump Therapy to Control HbA1c): Design and Methods of a Randomized Controlled Crossover Trial on Sensor-Augmented Insulin Pump Efficacy in Type 1 Diabetes Suboptimally Controlled with Pump Therapy. Diabetes Technol Ther 2011; 13(1): 49–54. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2010.0107>.
4. Deiss D, Bolinder J, Riveline JP et al. Improved Glycemic Control in Poorly Controlled Patients with Type 1 Diabetes Using Real-Time Continuous Glucose Monitoring. Diabetes Care 2006; 29(12): 2730–2732.
5. Garg SK, Brazg RL, Bailey TS et al. Reduction in duration of hypoglycemia by automatic suspension of insulin delivery: the in-clinic ASPIRE study. Diabetes Technol Ther 2012; 14(3): 205–209.
6. Hermanides J, Nørgaard K, Bruttomesso D et al. Sensor-augmented pump therapy lowers HbA(1c) in suboptimally controlled Type 1 diabetes; a randomized controlled trial. Diabet Med 2011; 28(10): 1158–1167. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1464–5491.2011.03256.x>.
7. Kordonouri O, Pankowska E, Rami B et al. Sensor-augmented pump therapy from the diagnosis of childhood type 1 diabetes: results of the Paediatric Onset Study (ONSET) after 12 months of treatment. Diabetologia 2010; 53(12): 2487–2495. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–010–1878–6>.
8. Ly TT, Nicholas JA, Retterath A et al. Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: a randomized clinical trial. JAMA 2013; 310(12): 1240–1247.
9. Martinka E. Liečba diabetes mellitus 1. typu. In: Mokáň M, Martinka E, Galajda P. Diabetes mellitus a vybrané metabolické ochorenia. Vydavateľstvo P+M: Martin 2008. ISBN 9788096971398.
10. National Institute for Health and Care Excellence (NICE). Type 1 diabetes in adults: diagnosis and management. NICE guidelines [NG17] 2015. Dostupné z WWW: <https://www.nice.org.uk/guidance/ng17/resources/type-1-diabetes-in-adults-diagnosis-and-management-1837276469701>.
11. National Institute for Health and Care Excellence (NICE). Diabetes (type 1 and type 2) in children and young people: diagnosis and management. NICE guidelines [NG18]. 2015. Dostupné z WWW: <https://www.nice.org.uk/guidance/ng18>.
12. Nørgaard K, Scaramuzza A, Bratina N et al. [Interpret Study Group]. Routine sensor-augmented pump therapy in type 1 diabetes: the INTERPRET study. Diabetes Technol Ther 2013; 15(4): 273–280. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2012.0288>.
13. Pickup JC, Sutton AJ. Severe hypoglycaemia and glycaemic control in Type 1 diabetes: meta-analysis of multiple daily insulin injections compared with continuous subcutaneous insulin infusion. Diabet Med 2008; 25(7): 765–774.
14. Tamborlane WV, Beck RW, Bode BW et al. [Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group]. Continuous Glucose Monitoring and Intensive Treatment of Type 1 Diabetes. N Engl J Med 2008; 359(14): 1464–1476.
15. The PILGRIM study: in silico modeling of a predictive low glucose management system and feasibility in youth with type 1 diabetes during exercise. Diabetes Technol Ther 2014; 16(6): 338–347. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2013.0327>.
16. Raccah D, Sulmont V, Reznik Y et al. Incremental Value of Continuous Glucose Monitoring When Starting Pump Therapy in Patients With Poorly Controlled Type 1 Diabetes: The Real Trend Study. Diabetes Care 2009; 32(12): 2245–2250.
17. Ly TT, Nicholas JA, Retterath A et al. Analysis of glucose responses to automated insulin suspension with sensor-augmented pump therapy. Diabetes Care 2012; 35(7): 1462–1465.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2016 Issue 2-
All articles in this issue
-
The quality of the care for patients with diabetes in the Czech Republic.
The VZP Data Analysis - Iatrogenic hypoglycemia as a serious medical problem
- The Prevalence of Diabetic Retinopathy in Slovakia
- Kidney transplantation and metabolic syndrome
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
-
The quality of the care for patients with diabetes in the Czech Republic.
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Kidney transplantation and metabolic syndrome
- Iatrogenic hypoglycemia as a serious medical problem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career