-
Medical journals
- Career
Iatrogénna hypoglykémia ako závažný medicínsky problém
: Emil Martinka 1; Michaela Mišaníková 1,2
: Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa 1; Jesseniova lekárska fakulta Univerzity Komenského v Martine 2
: Forum Diab 2016; 5(2): 76-85
: Topic
Iatrogénna hypoglykémia predstavuje závažný medicínsky problém. Tento fenomén nielenže limituje intenzifikáciu glykemickej kontroly, ale spája sa aj so zvýšeným rizikom kardiovaskulárnej a celkovej morbidity a mortality. Jedná sa pritom o častý nežiadúci účinok, ktorého frekvencia narastá s intenzifikáciou glykemickej kontroly, ako aj stupňovaním terapeutických krokov. Otázka iatrogénnej hypoglykémie, ako nežiaduceho účinku a potentného kardiovaskulárneho aj celkového rizika je veľmi často diskutovanou témou. Na túto problematiku je však potrebné pozerať z viacerých uhlov pohľadu. Hypoglykémia, obzvlášť ťažká, predstavuje nepochybne závažný rizikový faktor, ktorý zvyšuje kardiovaskulárnu (KV) aj celkovú mortalitu. V prípade KV-mortality sa jedná najmä o indukciu ischémie a fatálnych arytmií srdca. Na celkovej mortalite sa podieľajú úrazy, pády a neurologické príčiny (kóma, kŕče, kognitívna dysfunkcia). Mortalitné riziko hypoglykémie je však nezávislé od intenzity glykemickej kontroly a dosiahnutej úrovne kompenzácie. Veľmi dôležitou otázkou pri hodnotení rizika hypoglykémie je „terén“ pacienta, s potrebou individualizácie pri rozhodovaní o cieľoch a spôsobe glykemickej kontroly. Sklon k hypoglykémii u individuálnych pacientov pri rovnakej liečbe a dosiahnutých hodnotách glykemickej kontroly je totiž rôzny a podľa viacerých autorov identifikuje akýchsi „zraniteľnejších, resp. viac chorých“ pacientov s komorbiditou (hepatálnou, renálnou, endokrinologickou či onkologickou) a labilnejšími obrannými systémami, čo môže samo osebe zvyšovať kardiovaskulárnu aj celkovú mortalitu. Hypoglykémia teda predstavuje nielen rizikový faktor ale aj marker identifikujúci rizikových pacientov. Aj keď vzťah medzi hypoglykémiou a zvýšenou mortalitou zostáva predmetom diskusií, sú preferované terapeutické postupy s nízkym rizikom hypoglykémie a overenou kardiovaskulárnou a onkologickou bezpečnosťou.
Kľúčové slová:
diabetes – hypoglykémia – mortalitaÚvod
Iatrogénna (liečbou navodená) hypoglykémia predstavuje závažný medicínsky problém. Tento fenomén nielenže limituje intenzifikáciu glykemickej kontroly, ale spája sa aj so zvýšeným rizikom kardiovaskulárnej a celkovej morbidity a mortality, zhoršuje kvalitu života pacienta a zvyšuje ekonomické nároky na liečbu. Jedná sa pritom o pomerne častý nežiadúci účinok liečby, ktorého frekvencia narastá s intenzifikáciou glykemickej kontroly, ako aj stupňovaním jednotlivých terapeutických krokov [1,30,36,39,53,56].
Podľa Britskej pracovnej skupiny pre hypoglykémie (UK Hypoglycaemia Study Group) je hypoglykémia u pacientov s diabetes mellitus (DM) definovaná ako všetky epizódy zníženej glykémie, ktoré pacienta vystavujú potenciálnemu riziku (poškodeniu), pričom za hypoglykémiu sa považuje už hodnota glykémie < 3,9 mmol/l [57]. Táto relatívne vysoká hodnota zohľadňuje najmä bezpečnostný prvok s ohľadom na dynamiku vývoja glykémie. Kategórie hypoglykémie podľa klasifikácie Americkej diabetologickej asociácie (ADA) sú uvedené v tab. 1.
1. Kategórie hypoglykémie podla ADA (2013) 
Iatrogénna hypoglykémia sa v klinickej praxi považuje za najvýznamnejší faktor limitujúci intenzifikáciu glykemickej kontroly, pričom významná časť pacientov nedosahuje požadované kritériá liečby práve pre prekážku v dôsledku hypoglykémie. Výskyt hypoglykémie súvisí inverzne s dosiahnutým poklesom HbA1c, pričom farmaká a postupy s nižším rizikom hypoglykémie umožňujú dosiahnuť lepšiu glykemickú kontrolu, resp. požadované kritériá liečby sa dosahujú u väčšieho podielu pacientov bez výskytu hypoglykémie.
Hypoglykémia zásadným spôsobom zhoršuje aj kvalitu života pacienta a limituje jeho ekonomické možnosti. Najmä ťažká hypoglykémia znamená pre pacienta veľmi nepríjemné subjektívne prežívanie, nedôveru v liečbu, skepticizmus, strach a odmietanie intenzívnej kontroly. U pacientov s hypoglykémiou je limitovaný výber zamestnania, sú častejšie práceneschopní a sú aj častejšie invalidizovaní. Hypoglykémia významne zvyšuje aj ekonomické nároky na liečbu pacienta (výjazdy RZP, časté hospitalizácie, časté indikácie inzulínovej pumpy, zvýšené náklady na liečbu komplikácií súvisiacich s hypoglykémiou), tab. 2.
2. Hypoglykémia predstavuje závažný medicínsky problém 
Hypoglykémia (iatrogénna aj spontánna) sa však predovšetkým združuje so zvýšenou kardiovaskulárnou aj celkovou morbiditou a mortalitou, a to tak u pacientov s DM, ako aj u pacientov bez diabetu [6,7,13,16,19,25]. Otázka iatrogénnej hypoglykémie, ako nežiaduceho účinku a potentného kardiovaskulárneho (KV) aj celkového rizika je veľmi často diskutovanou témou, na ktorú je potrebné pozerať z viacerých uhlov pohľadu. Hypoglykémia, obzvlášť ťažká, predstavuje nepochybne závažný rizikový faktor, ktorý priamo zvyšuje mortalitu najmä indukciou ischémie, fatálnych arytmií srdca, pádov, úrazov, nehôd a neurologických príčin (kóma, kŕče, kognitívna dysfunkcia). Avšak, ako ukázali viaceré analýzy, mortalitné riziko hypoglykémie je nezávislé od intenzity glykemickej kontroly [1,4,9]. Ak sa berie do úvahy mortalita s ohľadom na absolútny počet hypoglykémií, ktoré sa objavili v príslušnej skupine, je riziko vyššie u pacientov s horšou glykemickou kontrolou a vyššími hodnotami HbA1c [4,58]. Podobne u kriticky chorých pacientov bolo mortalitné riziko vyššie u tých pacientov s hypoglykémiou, ktorí mali vyššie hodnoty HbA1c [12], čo poukazuje na zvýšené riziko združené s hypoglykémiou predovšetkým u pacientov s dlhodobo vyššími glykémiami, teda u ktorých pokles glykémie predstavoval väčšiu odchýlku od pôvodného stavu. Ak pripustíme, že organizmus sa na dlhodobo zvýšenú glykémiu „adaptuje“, potom náhly pokles môže predstavovať významný zásah do tejto adaptácie. To sa môže negatívne odraziť aj na zníženom vychytávaní a metabolizme glukózy v ischemickom myokarde a prehĺbiť jeho nedostatočnosť, obzvlášť v teréne sekundárnej inzulínovej rezistencie, čo by mohlo byť aj jedným z vysvetlení zvýšeného mortalitného rizika pri snahe o intenzívnu glykemickú kontrolu ako na to po prvýkrát poukázala štúdia ACCORD [1].
Ako dôležitý faktor pri hodnotení morbiditno-mortalitného rizika hypoglykémie sa javí „terén“ pacienta. Sklon k hypoglykémii u individuálnych pacientov je totiž pri rovnakej liečbe a rovnakých dosiahnutých hodnotách glykémie rôzny a podľa viacerých autorov častejší výskyt hypoglykémie identifikuje akýchsi „zraniteľnejších, resp. viac chorých“ pacientov s komorbiditou (hepatálnou, renálnou, endokrinnou či onkologickou) a labilnejšími obrannými systémami, čo môže samo o sebe zvyšovať kardiovaskulárnu aj celkovú mortalitu [24,53,58]. Rázny pokles glykémie, resp. rozvinutá hypoglykémia teda predstavuje nielen rizikový faktor, ale aj marker identifikujúci pacientov so zvýšeným morbiditno-mortalitným rizikom [24,53,58]. Aj keď vzťah medzi hypoglykémiou a zvýšenou mortalitou zostáva predmetom diskusií, sú preferované terapeutické postupy s nízkym rizikom hypoglykémie, nízkou variabilitou glykémií a overenou kardiovaskulárnou a onkologickou bezpečnosťou [28].
Intenzita glykemickej kontroly a morbiditno mortalitné riziko
Intenzita glykemickej kontroly a spôsob jej dosiahnutia a ovplyvnenie morbiditno-mortalitného rizika je predmetom dlhodobých a rozsiahlych diskusií s kontinuálne sa upresňujúcimi názormi. S ohľadom na výsledky klinických štúdií je tieto otázky potrebné vidieť aj v ďalších súvislostiach. Tie je možné rozdeliť do niekoľkých okruhov:
- akí pacienti boli predmetom skúšania? t. j. či sa jednalo o pacientov s novozisteným DM bez komplikácií, alebo pokročilým DM s už prítomnými komplikáciami a komorbiditami, napr. s už prekonanou KV-príhodou, alebo o akútnych, kriticky chorých pacientov
- aká otázka bola študovaná, t. j. či predmetom sledovania účinku liečby bol efekt na mikrovaskulárne vs makrovaskulárne komplikácie, resp. či sa jednalo o zámer primárnej prevencie KV-príhod (IM, CMP) alebo o redukciu mortalitných dôsledkov týchto ochorení, včasnú mortalitu pri akútne vzniknutej príhode a pod, a tiež, aká bola homogenita kompozitného cieľa v účinku liečby na jeho jednotlivé zložky
- obdobie, v ktorom sledovanie prebiehalo, najmä s ohľadom na vtedajšie možnosti liečby
- terapeutické pozadie (s ohľadom na iné farmaká s dokázaným morbiditno-mortalitným benefitom/rizikom) a samozrejme
- aká liečba (farmakum) bola hodnotená (s ohľadom na známe benefity, riziká a nežiadúce účinky, medzi ktoré patrí vplyv na telesnú hmotnosť a predovšetkým riziko hypoglykémie)
Ako ukázali viaceré epidemiologické pozorovania, výskyt mikrovaskulárnych ako aj kardiovaskulárnych komplikácií DM narastá so zhoršujúcou sa glykemickou kontrolou a s trvaním ochorenia. Takéto pozorovania však neznamenajú automaticky, že s úpravou (normalizáciou) glykémií sa toto riziko vytráca. Naopak, efekt môže byť paradoxne aj opačný.
Je známe, že intenzívna glykemická kontrola znižuje riziko mikrovaskulárnych komplikácií u všetkých typov diabetu bez ohľadu na trvanie ochorenia a prítomnosť komplikácií [1,6,20] a tiež, že pokiaľ bola intenzívna glykemická kontrola začatá v úvode ochorenia, z dlhodobého hľadiska prispieva aj k primárnej prevencii KV-príhod [6,20] a sekundárnej prevencii nefatálneho infarktu myokardu (IM) aj u pacientov s vysokým KV-rizikom [1].
Viaceré práce však upozornili aj na možné dôsledky „príliš agresívnej“ snahy o úpravu glykémie u pacientov s už preexistujúcim kardiovaskulárnym ochorením, u ktorých ochorenie trvá dlhšie, intenzifikácia sa dosahuje ťažšie a u ktorých sa častejšie vyskytuje hypoglykémia. Riziko sa prejavilo vo vyššej mortalite v intenzívne liečenej skupine, čo bolo aj dôvodom na predčasné ukončenie jednej z týchto štúdií (ACCORD) [1]. Hoci príčin zvýšenej mortality v skupine pacientov s intenzívnou glykemickou kontrolou môže byť viacero (od náhodného pozorovania, cez neglykemické aspekty liečby, vedľajšie nežiadúce účinky liekov, ovplyvnenie vychytávania a metabolizmu glukózy v ischemickom myokarde a pod), ako jedna z hlavných príčin zvýšenej mortality sa uvažovala práve hypoglykémia, ktorej výskyt v ramenách intenzívnej stratégie liečby bol v priemere 2,5 až 3-krát vyšší než v ramenách so štandardnou terapeutickou stratégiou (tab. 3) [4,13,15–17,19,24,44]. V analýzach štúdie ACCORD sa ťažká symptomatická hypoglykémia združovala so zvýšeným rizikom úmrtia a ročná mortalita medzi pacientmi v intenzívnom ramene, ktorí mali jednu alebo viac epizód hypoglykémie vyžadujúcej akúkoľvek pomoc bola 2,8 % v porovnaní s 1,2 % u pacientov, ktorí nemali žiadnu hypoglykémiu. Aj v štúdii VADT bola nedávna (predošlá) ťažká hypoglykémia významným prediktorom kardiovaskulárneho úmrtia (HR 3,72; 95% CI 1,34–10,4; P < 0,01) ako aj úmrtia z akejkoľvek príčiny (HR 6,37; 95% CI 2,57–15,8; P = 0,0001) [10,39].
3. Výskyt ťažkej hypoglykémie u pacientov s DM2T 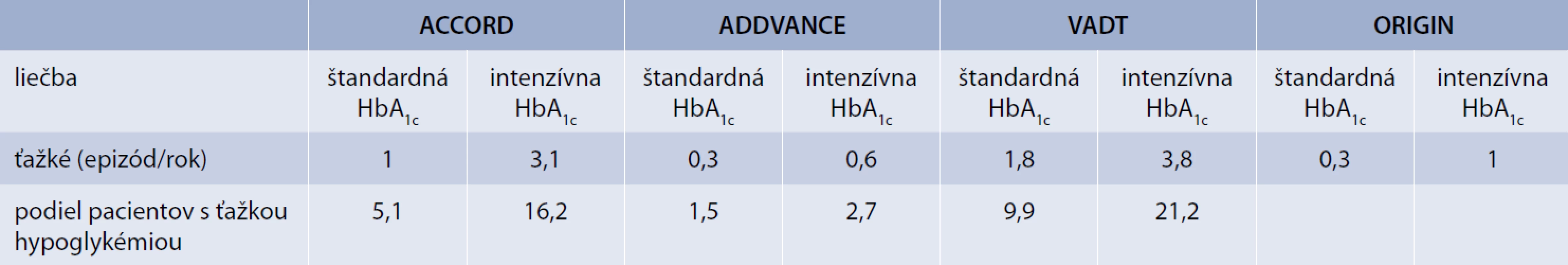
Pozn. Vo všetkých troch štúdiách bola ťažká hypoglykémia signifikantne častejšia v intenzívne liečenej skupine v porovnaní so štandardne liečenou skupinou pacientov. Relatívne nižší výskyt hypoglykémie v štúdii ADVANCE bol zrejme vďaka kratšie trvajúcemu a menej pokročilému DM, s nižšou frekvenciou inzulínovej terapie a lepšími vstupnými hodnotami HbA1c. Niet pochýb že ťažká hypoglykémia môže mať priame fatálne dôsledky a k dispozícii je viacero údajov z kazuistík, epidemiologických pozorovaní, prospektívnych štúdií a experimentálnych prác s definíciou potenciálnych patofyziologických mechanizmov, ktoré môžu vysvetľovať zvýšené riziko kardiovaskulárnej aj celkovej mortality v súvislosti s hypoglykémiu, a to tak u pacientov s diabetes mellitus ale aj bez neho [7,8,13,16]. Podľa niektorých prác u pacientov s DM1T môže hypoglykémia zapríčiňovať až 4–10 % úmrtí [32,38,43].
Na vzťah medzi úmrtím a hypoglykémiou sa začalo intenzívnejšie poukazovať v 60. rokoch minulého storočia. Detailnejšie sa však tejto problematike venovala až práca Tattersall et al z roku 1991 vedená pod dohľadom Britskej diabetologickej asociácie na základe série úmrtí mladých pacientov s DM1T, a teda aj obavy, že liečba inzulínom môže viesť k fatálnej hypoglykémii [47]. Po vylúčení iných príčin úmrtia bolo identifikovaných 22 pacientov s DM1T vo veku < 50 rokov, ktorí napriek tomu, že boli predtým bez významnejších ťažkostí, zomreli podobným spôsobom. Boli nájdení v posteli bez znakov „smrteľného zápasu“ (v nerozhádzanej posteli) a tento scenár bol nazvaný „dead-in-bed syndróm“. Po týchto pozorovaniach nasledovalo niekoľko ďalších podobných pozorovaní, ktoré ukázali, že náhle a neočakávané úmrtie je u pacientov s DM1T 4-krát častejšie než u nediabetikov [5,4]. Ako ďalšie príklady vrátane potenciálneho mechanizmu môžu slúžiť kazuistiky, v ktorých spontánna hypoglykémia vyprovokovala srdcové arytmie, od bradykardie cez predsieňovú fibriláciu až po ventrikulárne arytmie [15,44] a iné, ktoré opísali vzťah medzi hypoglykémiou a akútnym koronárnym syndrómom s typickými EKG-zmenami po ťažkej hypoglykémii [17], či ischemické zmeny na EKG po indukcii hypoglykémie [25]. Svenson et al [43] u pacientov s akútnym koronárnym syndrómom ukázali, že krátkodobá (počas hospitalizácie) aj dlhodobá mortalita (v priebehu 2 rokov) narastá nielen s hyperglykémiou v čase príjmu a počas hospitalizácie, ale aj v prípade, že sa počas hospitalizácie objavila hypoglykémia (hypoglykémia vs normálna glykémia: HR 1,77; 95% CI 1,09, 2,86). Rovnako McCoy et al [29] nedávno ukázali, že riziko úmrtia počas 5 rokov je 3,4-násobne vyššie u tých pacientov s DM, ktorí predtým uvádzali prekonanie ťažkej hypoglykémie. Podobné zistenia priniesli aj ďalšie práce. V práci Pinta et al [33] u pacientov s akútnym koronárnym syndrómom s eleváciou ST-segmentu bola 30-dňová mortalita vyššia u pacientov s najvyššími a najnižšími (< 4,5 mml/l) polohami glykémie meranými v dobe príjmu do nemocnice a mortalita tak nadobudla charakter krivky písmena „U“. Na ďalšie asociácie poukazujú pozorovania zvýšenej mortality a nízkych hodnôt HbA1c. Pozoruhodné pozorovania priniesli výsledky veľkého multicentrického japonského registra s počtom 3 571 pacientov, ktorí sa podrobili koronárnej revaskularizácii a u ktorých sa hodnotil vzťah medzi preoperačnými hodnotami HbA1c a kompozitným cieľom kardiovaskulárnych príhod (kardiovaskulárne úmrtie, infarkt myokardu, cievna mozgová príhoda) po koronárnej revaskularizácii. Spomedzi 3 571 pacientov 1 504 malo DM2T a výsledky boli hodnotené po rozdelení do štyroch skupín podľa HbA1c (< 6 %, 6–7 %, 7–8 % a > 8 %). Neprítomnosť kompozitného cieľa bola podobná u nediabetikov a diabetikov s HbA1c 6–7 %, zatiaľ čo pacienti s hodnotami HbA1c > 7 % mali signifikantne vyšší výskyt kompozitného cieľa oproti nediabetikom. Avšak, u pacientov s HbA1c < 6 % bol výskyt kardiovaskulárnych príhod po revaskularizácii rovnaký, resp. ešte vyšší než u pacientov s najvyššími hodnotami HbA1c [22]. V ďalšej veľkej multicentrickej randomizovanej štúdii z Austrálie (NICESUGAR) [51] sa hodnotil vzťah glykemickej kontroly u pacientov s kritickým ochorením liečených na JIS. „Striktná“ glykemická kontrola (4,5–6,0 mmol/l) sa porovnávala so štandardnou kontrolou (< 10,0 mmol/l). Mortalita bola vyššia u pacientov so striktnou kontrolou, u ktorých bola signifikantne častejšia (6,8 % vs 0,5 %; P < 0,001) aj ťažká hypoglykémia definovaná ako glykémia < 2,2 mmol/l. Napokon, Desouza et al [8], s využitím paralelného 72-hodinového kontinuálneho monitorovania EKG a glykémie u 19 pacientov s DM2 so známou ischemickou chorobou srdca, zaznamenal 54 epizód hypoglykémie s hodnotou < 3,9 mmol/l, z ktorých 10 bolo prevádzaných bolesťou na hrudníku a zmenami na EKG. Hypoglykémie a nadmerné oscilácie glykémie (rýchle zmeny glykémie > 5,6 mmol/l/l/hod) sa pritom s prejavmi kardiálnej ischémie združovali viac než hyperglykémie (> 11,1 mmol/l) [8].
S ohľadom na uvedené vyššie možno konštatovať, že normalizácia glykémie prispieva k spomaleniu rozvoja mikrovaskulárnych komplikácií a zníženiu rizika nefatálneho IM. Nie je však jasné, či je normalizácia glykémie výhodná aj pre ischemický myokard, obzvlášť ak je náhla a doprevádzaná zvýšeným rizikom hypoglykémie, u pacientov s predtým dlhodobou a rezistentnou hyperglykémiou a v prípade akútnej ischémie alebo srdcového zlyhávania v teréne sekundárne akcentovanej inzulínovej rezistencie, keď metabolizmus, resp. utilizácia glukózy v myokarde je nedostatočná a nižšia hladina glykémie, resp. hypoglykémia môže tento nedostatok ďalej akcentovať.
Je známe, že mnohé kardiovaskulárne príhody a zákroky sú doprevádzané vzostupom glykémie, ktorá je často rezistentná na liečbu. Je otázne, či možno takúto reakciu vždy považovať iba za maladaptáciu organizmu a či je vždy (samozrejme s výnimkou extrémnych situácií) prospešné snažiť sa ju terapeuticky ovplyvňovať. Náhly a „násilný“ pokles glykémie a hypoglykémia okrem toho môžu aktivovať celý rad mechanizmov, ktoré zvyšujú riziko náhlej smrti a ktoré sú opísané v ďalšom texte.
Aj rozdiely v KV-benefite/riziku jednotlivých farmák môžu okrem iného súvisieť práve s vplyvom a zlepšením metabolizmu glukózy v myokarde, ktorý je v ischemickom myokarde výhodnejší než energeticky náročnejšia oxidácia mastných kyselín. Je napríklad známe, že exenatid (agonista GLP-1 receptorov), ktorý prejavuje priaznivý efekt na myokard počas ischémie, zlepšuje, resp. moduluje v ischemickom myokarde dostupnosť, transport a utilizáciu glukózy [14,34]. U pacientov s nízkym bazálnym vychytávaním glukózy v myokarde exenatid tento zvyšuje a udržiava ho aj počas hypoglykémie u pacientov s inzulínovou rezistenciou [14,34]. Nedávno (Medscape 4. 3. 2016) boli oznámené prvé správy referujúce o signifikantnom benefite liraglutidu (ďalší agonista GLP-1 receptorov) na riziko kardiovaskulárnych príhod (KV-úmrtie, nefatálny infarkt myokardu, nefatálna mozgová príhoda) pochádzajúce z 5-ročnej štúdie LEADER na populácii viac ako 9 000 pacientov s vysokým KV-rizikom [21]. Tento efekt by mohol (okrem iného) súvisieť aj s nízkym rizikom hypoglykémie a priaznivým ovplyvnením metabolizmu glukózy v ischemickom myokarde.
Nízke riziko hypoglykémie bolo zrejme aj jednou z výhod, ktoré sa uplatnili na významnom poklese KV-mortality (-38 %) v štúdii EMPA-REG OUTCOME pri empagliflozíne (inhibítor SGLT2). Toto pozorovanie patrí medzi najvýznamnejšie poznatky v diabetológii za posledné roky [59].
Mechanizmy, ktorými hypoglykémia môže ovplyvniť morbiditu a mortalitu
Hypoglykémia indukuje v organizme celý rad reakcií a kontraregulačných mechanizmov. Tie sa uplatňujú postupne s poklesom glykémie a zahŕňajú inhibíciu sekrécie inzulínu, zvýšenie sekrécie glukagónu, zvýšenú sympatoadrenálnu odpoveď (vzostup hladín plazmatického adrenalínu a noradrenalínu ako aj zvýšenú sekréciu ACTH/glukokortikoidov). Tieto odpovede sa zapájajú postupne s prehlbujúcim sa poklesom glykémie (tab. 4) [8,13,31].
4. Hypoglykémia a reakcia organizmu 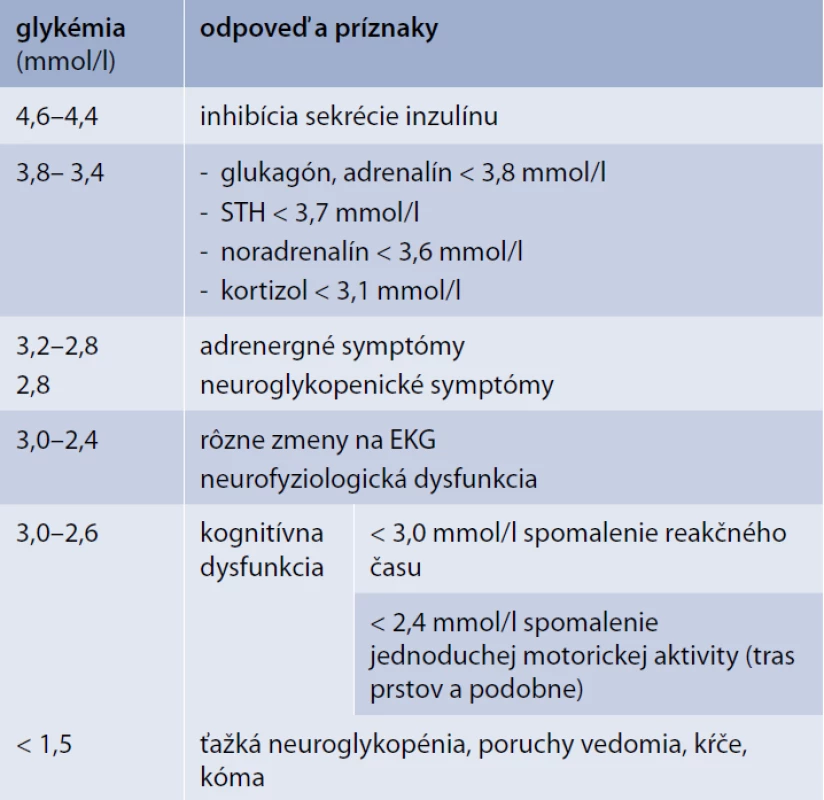
Okrem hormonálnej reakcie dochádza aj k niekoľkým nepriamym zmenám indukovaných hypoglykémiou, ktoré ovplyvňujú sekréciu zápalových cytokínov, funkciu endotelu, koaguláciu a fibrinolýzu. Všetky tieto odpovede majú potenciálne negatívne kardiovaskulárne dôsledky na morbiditu a mortalitu [8,13,31,54].
Sympatoadrenálna odpoveď
Hypoglykémia stimuluje uvoľňovanie katecholamínov, ktoré majú na myokard a cievy celý rad zásadných účinkov. Zvyšujú kontraktilitu, pracovnú záťaž myokardu a srdcový výdaj. U pacientov s postihnutím koronárnych ciev tieto efekty môžu indukovať ischémiu, nakoľko zvýšené požiadavky myokardu sú v dôsledku rigidity ciev a dysfunkcie endotelu so zlyhaním vazodilatácie obmedzené. Viaceré štúdie ukázali, že hypoglykémia sa združuje so signifikantným predlžením QTc-intervalu u pacientov s diabetom aj bez diabetu. Predĺženie QTc pritom zvyšuje riziko komorovej tachykardie a náhlej smrti [8,13,31,42,54,55]. Medzi ďalšie EKG-abnormality pozorované v súvislosti s hypoglykémiou patrí bradykardia (obzvlášť počas noci), komorové extrasystoly, predĺženie PR-intervalu, redukcia amplitúdy s oploštením až inverziou vlny T, pozitivita vlny U, či mierne depresie ST-segmentu [8,13,31,54,55]. Tieto zmeny pravdepodobne rovnako súvisia so zvýšeným uvoľňovaním katecholamínov počas hypoglykémie. Niektoré štúdie ukázali, že hyperinzulinémia a zvýšená sekrécia katecholamínov počas hypoglykémie môžu viesť k hypokalémii a potencovať tak zmeny repolarizácie. Týmto dôsledkom možno predísť, alebo ich zvrátiť blokádou b-receptorov a kontrolou hladín kália. So zvýšenou mortalitou sa združuje aj kardiálna autonómna neuropatia (KAN), ktorá je častou komplikáciou diabetu, najmä u pacientov s dlhším trvaním ochorenia. Charakteristickými prejavmi sú poruchy variability srdcového rytmu, sklon k arytmiám, zmeny cirkadiánneho rytmu TK, ortostatická hypotenzia, či tichá ischémia myokardu. Hypoglykémia indukuje aj kardiálnu autonómnu dysfunkciu [2].
Subklinický zápal, koagulácia a dysfunkcia endotelu počas hypoglykémie
Hyoglykémia ovplyvňuje aj intravaskulárnu hemoreologiu, koagulabilitu a viskozitu plazmy [8,11,20,23,31,54,56]. Zvýšená viskozita plazmy sa objavuje v súvislosti so zvýšenou koncentráciou erytrocytov, zatiaľ čo koaguláciu akcentuje aktivácia trombocytov a vzostup faktora VIII a von Willebrandovno faktora. Počas hypoglykémie dochádza k vzostupu viacerých markerov zápalu, ako sú C-reaktívny proteín (CRP), interleukin (IL) 6, IL8, tumor necrosis factor alfa (TNFa) a endotelin 1. Táto situácia môže viesť k poškodeniu a dysfunkcii endotelu s poruchou vazodilatácie a abnormalitám koagulácie, čo vedie k zvýšenému riziku kardiovaskulárnych príhod. Po epizóde hypoglykémie dochádza tiež k vzostupu hladín niektorých rastových faktorov ako VEGF (vascular endothelial growth factor) a aktivácii, resp. akcentácii oxidačného stresu. V štúdii u pacientov s DM1T sa zistilo, že aj mierna hypoglykémia vedie v cirkulácii k náhlemu vzostupu hladiny PAI1, VEGF, vaskulárnych adhezívnych molekúl VCAM, ICAM a E-selectin, IL6, a markera aktivácie trombocytov (P-selectin). U pacientov s DM1T s dlhším trvaním v porovnaní s pacientmi s kratším trvaním diabetu bola počas hypoglykémie pozorovaná tiež zvýšená tuhosť cievnej steny. Hypoglykémia tak prejavuje komplexný vaskulárny efekt, ktorý zahŕňa protrombotickú a proinflamačnú aktivitu, hyperkoagulačný stav a aktiváciu proaterogénnych mechanizmov. Tieto abnormality sú navzájom úzko prepojené a môžu byť akcentujúcimi faktormi, ktoré sa môžu podieľať na zvýšenom KV-riziku pri ťažkej hypoglykémii, obzvlášť u pacientov s preexistujúcim KV-ochorením, dlhším trvaním diabetu a ťažkou autonómnou neuropatiou [8,10,11,20,23,31,54,55].
S hypoglykémiou združené autonómne zlyhania, oslabená sympatoadrenálna a symptomatická reakcia na hypoglykémiu
Ťažká hypoglykémia môže zvyšovať riziko KV-úmrtia obzvlášť u pacientov s preexistujúcim kardiovaskulárnym ochorením. A toto riziko môže ďalej zvyšovať aj rozvoj poruchy vnímania hypoglykémie (syndróm neuvedomovania si hypoglykémie), obzvlášť u pacientov s koexistujúcou kardiálnou autonómnou neuropatiou (KAN) – silným rizikovým faktorom náhlej smrti. Nedávna analýza štúdie ACCORD ukázala, že riziko úmrtia pacientov, ktorí v čase zaradenia mali KAN, bolo cca 2-krát vyššie v porovnaní s pacientmi, ktorí KAN nemali. Každá epizóda iatrogénnej hypoglykémie oslabuje kontraregulačnú obrannú reakciu na nasledovnú hypoglykémiu, čím sa vytvára circulus vitiosus pre vznik opakovaných hypoglykémií. Oslabenie sa týka najmä reakcie drene nadobličky, ktorá sa spolu s oslabenou sekréciou glukagónu podieľa na rozvoji klinického syndrómu defektnej glykemickej kontraregulácie a rozvoji syndrómu neuvedomovania si hypoglykémie, čo sú komponenty s hypoglykémiou združeného autonómneho zlyhania (hypoglycemia-associated autonomic failure – HAAF). Opakovaná, predošlá hypoglykémia tiež redukuje senzitivitu srdcového vagálneho baroreflexu a odpoveď sympatika na liekmi indukovanú hypotenziu, oslabujúc tak autonómnu odpoveď na kardiovaskulárny stres (až na 16 hodín) a zvyšuje sa aj riziko fatálnych ventrikulárnych arytmií [8,10,13,31,42,54,55].
HAAF môže mať adaptačný význam ale aj maladaptačné dôsledky. Na jednej strane môže predstavovať adaptáciu na opakovaný stres a redukovať dôsledky sympatoadrenálneho „výboja“ na srdce a znižovať tak pravdepodobnosť fatálnej arytmie a úmrtia, na strane druhej zvyšuje riziko následnej ťažkej hypoglykémie a obzvlášť nízka glykémia môže vyvolať mohutný a potenciálne fatálny sympatoadrenálny výboj [8–10,31,54]. Riziko nemusí predstavovať iba opakovaná ale aj jednotlivá (aktuálna) hypoglykémia. Potrebné je tiež zdôrazniť, že hypoglykémia a jej dôsledky nie sú krátkodobou záležitosťou. Väčšina vyššie opísaných reakcií sa môže uplatňovať aj niekoľko dní po prekonaní epizódy hypoglykémie.
Hypoglykémia ako marker rizikového („viac chorého“) pacienta
Aj keď niet pochybností, že ťažká hypoglykémia môže byť fatálna a predstavuje zvýšené riziko úmrtia počas intenzívnej liečby, asociácia medzi hypoglykémiou a mortalitou neznamená automaticky kauzálne spojenie a podľa niektorých autorov hypoglykémia môže byť nielen príčinným faktorom mortality, ale aj markerom identifikujúcim skupinu pacientov, ktorí sú „viac rizikoví, resp. viac chorí“, t.j. u ktorých v pozadí prebieha iné vážne ochorenie paralelne zvyšujúce aj predispozíciu k hypoglykemickej reakcii aj zvýšenej morbidite/ mortalite. Podkladov pre takúto úvahu sa objavilo hneď niekoľko aj po prehodnotení vzťahov zvýšenej mortality v intenzívne liečenom ramene v štúdii ACCORD, v ktorej neboli zistené žiadne priame dôkazy, že priamou príčinou by bola hypoglykémia [4,30]. Zatiaľ čo mortalita v intenzívne liečenej skupine bola vyššia v celej skupine a v podskupine bez hypoglykémií, situácia sa zmenila, ak sa zohľadnil výskyt hypoglykémií v oboch skupinách. Ak sa vytvorili podskupiny s rovnakým počtom hypoglykémií v oboch skupinách, bola mortalita dokonca vyššia v štandardne liečenej skupine [4,30,44,54] a u pacientov s počtom ťažkých hypoglykémií ≥ 3 bola mortalita v štandardne liečenej skupine viac ako 2-násobná v porovnaní s intenzívne liečenou skupinou. Kosiborod et al [24] nedávno ukázali, že mortalitné riziko u pacientov s akútnym infarktom myokardu vzťahujúce sa k výskytu hypoglykémie bolo signifikantne vyššie u pacientov, u ktorých sa hypoglykémia rozvinula spontánne (napr. ako dôsledok ťažkého systémového ochorenia – šoku, sepsy, pečeňového alebo multiorgánového zlyhávanie, malnutrície či adrenálnej insuficiencie) zatiaľ čo epizódy iatrogénnej hypoglykémie u pacientov liečených inzulínom riziko mortality nezvyšovali [24]. Podobne v štúdii ADVANCE, v ktorej však bol výskyt ťažkej hypoglykémie nižší (tab. 3), nebola zistená zvýšená KV-mortalita v intenzívne liečenom ramene. Zoungas et al [58] v analýze tejto štúdie ukázala, že ťažká hypoglykémia sa združovala so zvýšeným rizikom rôznych klinických stavov (príhod) s úmrtím z akejkoľvek príčiny, kardiovaskulárnymi ochoreniami, rakovinou, ochoreniami kože, ochoreniami respiračného aj tráviaceho systému) [58]. V štúdii DIGAMI 2 (DM2T s akútnym infarktom myokardu randomizovaní na intenzívnu liečbu inzulínom vs štandardnú glykemickú kontrolu), pacienti so symptomatickými hypoglykemickými epizódami, nezávisle od toho v ktorej skupine boli randomizovaní, boli starší chudší a mali viac komorbidít [26]. Mortalitné riziko u pacientov s hypoglykémiami v porovnaní s tými, ktorí nemali hypoglykemické epizódy, bolo síce cca 3-krát vyššie, avšak po zohľadnení základných charakteristík (vek, komorbidity) zvýšené riziko vymizlo [26]. Aj v štúdiách porovnávajúcich rôzne terapeutické stratégie ako BARI-2D (porovnávala inzulín senzitizačné vs inzulín substitučnú liečbu), či HEART 2D (prandiálny inzulín vs bazálny inzulín) napriek vyššej incidencii epizód ťažkej hypopoglykémie, riziko celkovej ani kardiovaskulárnej mortality či infarktu myokardu sa nelíšilo medzi skupinami [35,50]. Rovnako v štúdii ORIGIN [37,52], zameranej na intenzívnu glykemickú kontrolu inzulínom glargin a kardiovaskulárne riziko, bolo síce riziko hypoglykémie, vrátane závažnej, 3-násobne vyššie oproti štandardnej skupine (tab. 3), jej vyšší výskyt však neviedol k nárastu definovaných kardiovaskulárnych príhod. Hypoglykémia v danej kompozícii teda buď nepredstavovala zvýšené riziko, alebo riziko bolo vyvážené „inými benefitmi“ liečby. U pacientov s DM1T je príkladom štúdia Diabetes Control and Complications Trial (DCCT – intenzívna vs štandardná glykemická kontrola inzulínom), v ktorej napriek významne vyššiemu výskytu hypoglykémie v intenzívnej skupine kardiovaskuláírne riziko bolo dokonca nesignifikantne nižšie [6]. A hypotézu vzťahu medzi ťažkou hypoglykémiou a kardiovaskulárnymi ochoreniami u pacientov s DM1T nepodporili ani výsledky štúdie EURODIAB [19]. Hypoglykémia sa teda združuje nielen so zvýšenou kardiovaskulárnou ale aj celkovou mortalitou a tiež nekardiovaskulárnou morbiditou, čo poukazuje, že hypoglykémia môže nielen spolupôsobiť, ale môže byť aj markerom iného vážneho základného ochorenia (hepatálneho, renálneho, endokrinologického či onkologického) a vulnerability k týmto príhodám [56]. Sklon k hypoglykémii u individuálnych pacientov pri rovnakej liečbe a dosiahnutých hodnotách glykemickej kontroly je rôzny a podľa viacerých autorov sklon k častejšej a ťažkej hypoglykémii identifikuje akýchsi „zraniteľnejších, resp. viac chorých“ pacientov s labilnejšími obrannými systémami, čo môže samo osebe zvyšovať kardiovaskulárnu aj celkovú mortalitu [24,53,58].
Výskyt hypoglykémie u pacientov s diabetes mellitus
Údaje o výskyte hypoglykémie v literatúre sú rôznorodé, a to jednak pre rôzne spôsoby jej zaznamenávania (subjektívne a klinické prejavy, intenzita selfmonitoringu, kontinuálne monitorovanie glykémie), jednak pre rôzne kritériá, ktoré sa v jednotlivých štúdiách použili. Čím sú kritériá prísnejšie a metódy záznamu jednoduchšie, tým je výskyt hypoglykémie nižší a naopak. Ak sa za hypoglykémiu stanoví už hodnota < 3,9 mmol/l a využíva sa kontinuálne monitorovanie, výskyt hypoglykémií narastá a narastá aj podiel tzv. asymptomatických hypoglykémií, ktoré sa vyskytujú najmä počas noci a pri bežnom monitorovaní ich pacient obvykle nezaznamená [45,46]. Údaje o výskyte hypoglykémie ovplyvňuje aj obdobie, v ktorom bolo sledovanie realizované, a liečba, ktorá sa v tom čase používala.
Výskyt hypoglykémie závisí od výberu pacientov a spôsobu terapeutickej stratégie a použitých farmák. Je vyšší u pacientov s DM1T [6] v porovnaní s DM2T [15]. Podľa údajov UK Hypoglycaemia Study Group z roku 2007 bol celkový výskyt hypoglykémie u pacientov s DM1T, resp. DM2T 43, resp. 16 za rok, pričom výskyt ťažkých hypoglykémií predstavoval 2 za rok (DM1T), resp. 1 za 3 roky (DM2T) [57].
Na vyššom výskyte hypoglykémií sa podieľa dlhšie trvanie ochorenia, vyšší vek pacienta, liečba inzulínom alebo sulfonylureou. Opäť, podľa údajov UK Hypoglycaemia Study Group výskyt hypoglykémií u pacientov s DM1T v trvaní < 5 rokov predstavoval 110 epizód na 100 pacient rokov, zatiaľ čo u pacientov s DM1T v trvaní > 15 rokov výskyt predstavoval 320 epizód a výskyt hypoglykémií u pacientov s DM2T liečených inzulínom v trvaní > 2 roky predstavoval 10 epizód na 100 pacient rokov [57]. Riziko hypoglykémie u pacientov s DM2T narastá s trvaním ochorenia a stupňovaním liečby od režimu a diéty, cez orálne antidiabetiká po kompletnú substitúciou inzulínom. Zatiaľ čo riziko hypoglykémie pri liečbe režimom a diétou predstavuje < 1 %, pri liečbe sulfonylureou je to už 8 % a pri liečbe kompletnou substitúciou inzulínu v režime bazálny + prandiálny inzulín sa aspoň jedna epizóda hypoglykémie vyskytuje u viac ako 1/3 pacientov s DM2T, čo sa približuje výskytu u pacientov s DM1T [57].
Výskyt hypoglykémie narastá najmä s intenzifikáciou glykemickej kontroly a je obvykle vyšší u pacientov s najnižšími hodnotami HbA1c (tab. 3). Výskyt je v priemere 2,5 až 10-krát vyšší u pacientov na intenzívnej liečbe v porovnaní so štandardnou liečbou. V dávnejšej štúdii UKPDS (vtedy so skromnejšími možnosťami liečby), bol výskyt hypoglykémie u pacientov s novozisteným DM2T na intenzifikovanej liečbe (HbA1c 7 %) v porovnaní so štandardným ramenom (HbA1c 7,9 %) 4-krát vyšší [20]. Obdobne v novších štúdiách ACCORD, ADVANCE, VADT, ORIGIN (tab. 3) u pacientov s DM2T, avšak s dlhšie trvajúcim ochorením a polymorbiditou bol výskyt hypoglykémie v intenzívne liečenom ramene 3-násobne vyšší (3,1 vs 1 epizóda ťažkej hypoglykémie/rok) v porovnaní so štandardným ramenom [1,10,49,52]. Údaje o výskyte a riziku hypoglykémie sa samozrejme menia so zavádzaním novších terapeutických stratégií.
Podľa výsledkov Dia Regis registra [53] je incidencia hypoglykémie zvýšená aj pri viacerých komorbiditách, ktoré zvyšujú riziko spontánnej hypoglykémie, resp. vytvárajú terén pre ľahší rozvoj iatrogénne navodenej hypoglykémie. Riziko je zvýšené jednak pri akútnych ochoreniach ako sepsa, šok, pečeňové či multiorgánové zlyhávanie, malnutrícia, adrenálna insuficiencia, či chronických ochoreniach, ako koronárna choroba srdca, srdcové zlyhanie, periférna neuropatia, onkologické ochorenia, ochorenia respiračného a tráviaceho traktu, neproliferatívna aj proliferatívna diabetická retinopatia, ochorenia kože či depresia [24,54]. Obzvlášť významnou je prítomnosť chronického ochorenia obličiek, ktoré výskyt hypoglykémie zdvojnásobuje [57]. S ohľadom na uvedené vyššie možno konštatovať, že sú skupiny pacientov, u ktorých sa pri rovnakej liečbe a rovnakých základných podmienkach hypoglykémia vyskytuje častejšie, nakoľko sú k takejto reakcii viac predisponovaní [24,54,58]. Práve u takýchto pacientov je morbitida a mortalita asociovaná s hypoglykémiou (neznamená však hypoglykémiou priamo zapríčinená) najvyššia.
Minimalizácia rizika hypoglykémie ako základná požiadavka liečby pacienta s DM
Predchádzanie hypoglykémiím je základnou súčasťou úvah diabetológa pri voľbe terapeutickej stratégie. Do úvahy sa berie jednak „terén“ pacienta (teda akého pacienta máme pred sebou s ohľadom na jeho vek, trvanie diabetu, či prítomné komorbidity) a terapeutické ambície (teda aké sú ciele liečby u daného pacienta optimálne) a následne sa volí terapeutická stratégia s preferenciou postupov s nízkym rizikom hypoglykémie. Medzi moderné farmaká s nízkym rizikom hypoglykémie patrí metformín, inhibítory DPP4 (gliptíny), inhibítory SGLT2 a agonisty GLP1-receptorov. Naopak riziko je relatívne vysoké pri prípravkoch sulfonylurey (výnimku predstavuje gliklazid MR), glinidoch a inzulíne [53]. Okrem rôzneho rizika zvýšenej frekvencie hypoglykémie je pri jednotlivých prípravkoch potrebné zohľadniť aj rozdiely v jej pretrvávaní a spôsobe liečby. Zatiaľ čo pacienti s hypoglykémiou navodenou inzulínom sú po dosiahnutí úpravy glykémie následne obvykle riešení ambulantne, pri hypoglykémii navodenej sulfonylureou sa všeobecne odporúča hospitalizácia, keď vzhľadom k dlhodobému pretrvávaniu účinku, oneskorenej „clearance“ lieku a jeho metabolitou je vysoká pravdepodobnosť následného zopakovania sa hypoglykémie. Ďalšími faktormi sú okolnosti podávania (napr. SU môže predstavovať prídavné riziko u pacientov s infarktom myokardu, ktorí sa podrobujú koronárnej intervencii) mortalitné dôsledky [12,27].
Keďže liečba DM2T sa obvykle začína metformínom, v tomto kroku je riziko hypoglykémie iba minimálne. V ďalších krokoch, keď sa pridáva druhý, resp. ďalší liek sa však už riziko zvyšuje a závisí od voľby prípravku. Najvyššie je pri použití sulfonylurey alebo inzulínu [53]. Naopak, pri použití inhibítora DPP4 (gliptíny), napr. sitagliptínu, je riziko viac ako 6-krát nižšie v porovnaní so sulfonylureou, pri porovnateľnom efekte na pokles HbA1c a naviac, pri dlhšom pretrvávaní účinku liečby, hmotnostnej neutralite a dokázanej KV-bezpečnosti [18]. To sú dôvody, pre ktoré sú glipítny s dokázanou KV-bezpečnosťou preferovanou voľbou do kombinovanej liečby k metformínu aj v odporúčaniach SDS [28]. KV-neutralita však nie je jednoznačná pri všetkých gliptínoch. Pri niektorých prípravkoch (saxagliptín a čiastočne alogliptín) sa vynorila obava z potenciálneho zvýšeného rizika srdcového zlyhávania, ak sa podáva pacientom s vysokým KV-rizikom [41].
Nízke riziko hypoglykémie je tiež pri inhibítoroch SGLT2 (gliflozíny), ktoré sa pre dokázaný významný mortalitný benefit s redukciou KV-mortality o 38 % (zatiaľ dokázané pri empagliflozíne v štúdii EMPA-REG OUTCOME u vysokorizikových pacientov) [59], stali preferovanou voľbou najmä v trojkombinácii a v kombinácii s inzulínom [28], a tiež pri agonistoch GLP1, ktoré v prípade liraglutidu rovnako preukázali morbiditno-mortalitný benefit [21]. V prípade prípravkov inzulínu sú voľbou s významne (> 30 %) nižším rizikom hypoglykémie (obzvlášť nočnej) novšie bazálne analógy, ako je inzulín degludek a nový prípravok koncentrovaného inzulínu glargín 300 U. Riziko hypoglykémie samozrejme ovplyvňuje aj spôsob stravovania. K poklesu výskytu a frekvencie hypoglykémie vedie aj využívanie diabetes špecifických nutričných produktov [48].
Súhrn
Iatrogénna hypoglykémia predstavuje závažný medicínsky problém. Tento fenomén nielenže limituje intenzifikáciu glykemickej kontroly, ale spája sa aj so zvýšeným rizikom kardiovaskulárnej a celkovej morbidity a mortality. Jedná sa pritom o častý nežiadúci účinok, ktorého frekvencia narastá s intenzifikáciou glykemickej kontroly, ako aj stupňovaním terapeutických krokov. Otázka iatrogénnej hypoglykémie ako nežiaduceho účinku a potentného kardiovaskulárneho aj celkového rizika je veľmi často diskutovanou témou. Na túto problematiku je však potrebné pozerať z viacerých uhlov pohľadu. Hypoglykémia, obzvlášť ťažká, predstavuje nepochybne závažný rizikový faktor, ktorý zvyšuje kardiovaskulárnu aj celkovú mortalitu. V prípade KV-mortality sa jedná najmä o indukciu ischémie a fatálnych arytmií srdca. Na celkovej mortalite sa podieľajú úrazy, pády a neurologické príčiny (kóma, kŕče, kognitívna dysfunkcia). Mortalitné riziko hypoglykémie je však nezávislé od intenzity glykemickej kontroly a dosiahnutej úrovne kompenzácie. Veľmi dôležitou otázkou pri hodnotení rizika hypoglykémie je „terén“ pacienta s potrebou individualizácie pri rozhodovaní o cieľoch a spôsobe glykemickej kontroly. Sklon k hypoglykémii u individuálnych pacientov pri rovnakej liečbe a dosiahnutých hodnotách glykemickej kontroly je totiž rôzny a podľa viacerých autorov identifikuje akýchsi „zraniteľnejších, resp. viac chorých“ pacientov s komorbiditou (hepatálnou, renálnou, endokrinologickou či onkologickou) a labilnejšími obrannými systémami, čo môže samo osebe zvyšovať kardiovaskulárnu aj celkovú mortalitu. Hypoglykémie teda predstavuje nielen rizikový faktor ale aj marker identifikujúci rizikových pacientov. Aj keď vzťah medzi hypoglykémiou a zvýšenou mortalitou zostáva predmetom diskusií, sú preferované terapeutické postupy s nízkym rizikom hypoglykémie a overenou kardiovaskulárnou a onkologickou bezpečnosťou.
doc. MUDr. Emil Martinka, PhD.
martinkaemil@hotmail.com
Národný endokrinologický a diabetologický ústav n. o. v Ľubochni
www.nedu.sk
Doručené do redakcie 16. 4. 2016
Prijaté po recenzii 10. 5. 2016
Sources
1. Gerstein HC, Miller ME, Byington RP et al. Action to Control Cardiovascular Risk in Diabetes Study Group. Effect of intensive glucose lowering in patients with type 2 diabetes. N Engl J Med 2008; 358(24): 2545–2559.
2. Adler KG, Bonyhay I, Failing H et al. Antecedent hypoglycemia impairs autonomic cardiovascular function. Implications for rigorous glycemic control. Diabetes 2009; 58(2): 360–366.
3. Arechavaleta R, Seck T, Chen Y et al. Efficacy and safety of treatment with sitagliptin or glimepiride in patients with type 2 diabetes inadequately controlled on metformin monotherapy: a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2011; 13(2): 160–168.
4. Bonds DE, MillerME, Bergenstal RM et al. The association between symptomatic, severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemiological analysis of the ACCORD study. BMJ 2010; 340: b4909. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.b4909>.
5. Dahlquist G, Källén B. Mortality in childhood-onset type 1 diabetes: a population-based study. Diabetes Care 2005; 28(10): 2384–2387.
6. Nathan DM, Cleary PA, Backlund JY et al. [DCCT /EDIC Study research Group]. Intensive diabetes treatment and cardiovascvular disease in patient s with type 1 diabetes. New Engl J Med 2005; 353(25): 2643–2653.
7. Desouza C, Bolli G, Fonseca V. Hypoglycemia, Diabetes, and Cardiovascular Events. Diabetes Care 2010; 33(6): 1389–1394.
8. Desouza C, Salazar H, Cheong B et al. Association of hypoglycemia and cardiac ischemia: a study based on continuous monitoring. Diabetes Care 2003; 26(5):1485–1489.
9. Dormandy JA, Charbonnel B, Eckland DJ et al. [PROactive investigators]. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366(9493): 1279–1289.
10. Duckworth W, Abraira C, Moritz T et al. Glucose Control and Vascular Complications in Veterans with Type 2 Diabetes. N Engl J Med 2009; 360(2): 129–139. Erratum in N Engl J Med 2009; 361(10): 1028.
11. Dotson S, Freeman R, Failing HJ et al. Hypoglycemia increases serum interleukin-6 levels in healthy men and women. Diabetes Care 2008; 31(6): 1222–1223.
12. Egi M, Krinsley JS, Maurer P et al. Pre-morbid glycemic control modifies the interaction between acute hypoglycemia and mortality. Intensive Care Med 2016; 42(4): 562–571. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–016–4216–8>.
13. Frier BM, Schernthaner G, Heller SR. Hypoglycemia and Cardiovascular Risks. Diabetes Care 2011; 34(Suppl 2): S132-S137.
14. Gejl M, Søndergaard HM, Stecher C et al. Exenatide alters myocardial glucose transport and uptake depending on insulin resistance and increases myocardial blood flow in patients with type 2 diabetes. J Clin Endocrinol Metab 2012; 97(7): E1165-E1169. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–3456>.
15. Gill GV, Woodward A, Casson IF et al. Cardiac arrhythmia and nocturnal hypoglycemia in type-1 diabetes – the dead in bed syndrome revisited. Diabetologia 2009; 52(1): 42–45.
16. Goto A, Arah OA, Goto M et al. Severe hypoglycemia and cardiovascular disease: systematic review and meta-analysis with bias analysis. BMJ 2013; 347: f4533. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.f4533>.
17. Graveling AJ, Frier BM. Review: Does hypoglycaemia cause cardiovascular events? Br J Diabetes Vasc Dis 2010; 10(1): 5–13.
18. Green JB, Bethel MA, Armstrong PW et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015; 373(3): 232–242.
19. Gruden G, Barutta F, Chaturvedi N et al. Severe hypoglycemia and cardiovascular disease incidence in type 1 diabetes. The EURODIAB Prospective Complications Study. Diabetes Care 2012; 35(7): 1598–1604.
20. Holman R, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
21. Informácie dostupné z WWW: <http://www.medscape.com/viewarticle/859905>.
22. Ishihara M, Kojima S, Sakamoto T et al. Comparison of blood glucose values on admission for acute myocardial infarction in patients with versus without diabetes mellitus. Am J Cardiol 2009; 104(6): 769–774.
23. Joy NG, Hedrington MS, Briscoe VJ et al. Effects of Acute Hypoglycemia on Inflammatory and Pro-atherothrombotic Biomarkers in Individuals with Type 1 Diabetes and Healthy Individuals. Diabetes Care 2010; 33(7): 1529–1535. Erratum in Diabetes Care 2010; 33(9): 2129.
24. Kosiborod M, Inzucchi SE, Goyal A et al. Relationship between spontaneous and iatrogenic hypoglycemia and mortality in patients hospitalized with acute myocardial infarction. JAMA 2009; 301(15): 1556–1564. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2009.496>.
25. Lindström T, Jorfeldt L, Tegler L et al. Hypoglycaemia and cardiac arrhythmias in patients with type 2 diabetes mellitus. Diabet Med 1992; 9(6): 536–541.
26. Malmberg K, Ryden L, Wedel H et al. [DIGAMI-2 investigators]. Intense metabolic control by mof nsulin in paicetients with diabetes mellitus and acute myocardial infarction (DIGAMI-2): effects on mortality and morbidity. Eur Heart J 2005; 26(7): 650–661.
27. Mahmoodpoor A, Hamishehkar H, Beigmohammadi M et al. Predisposing Factors for Hypoglycemia and Its Relation With Mortality in Critically Ill Patients Undergoing Insulin Therapy in an Intensive Care Unit. Anesth Pain Med 2016; 6(1): e33849. Dostupné z DOI: <http://dx.doi.org/10.5812/aapm.33849>.
28. Martinka E, Uličiansky V, Mokáň M et al (v spolupráci členov výboru Slovenskej diabetologickej spoločnosti). Konsenzuálny terapeutický algoritmus pre diabetes mellitus 2. typu (v súlade s SPC, aktuálnym znením indikačných obmedzení a odporúčaní ADA/EASD). Diabetes a obezita 2016 (v tlači).
29. McCoy RG, Van Houten HK, Ziegenfuss JY et al. Increased mortality of patients with diabetes reporting severe hypoglycemia. Diabetes Care 2012; 35(9): 1897–1901.
30. Miller ME, Bonds DE, Gerstein HC et al. [ACCORD Investigators]. The effects of baseline characteristics, glycaemia treatment approach, and glycated haemoglobin concentration on the risk of severe hypoglycaemia: post hoc epidemiological analysis of the ACCORD study. BMJ 2010; 340: b5444. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.b5444>.
31. Mitrakou A, Ryan C, Veneman T et al. Hierarchy of glycemic thresholds for counterregulatory hormone secretion, symptoms, and cerebral dysfunction. Am J Physiol 1991; 260(1 Pt 1): E67-E74.
32. Patterson CC, Dahlquist G, Harjutsalo V et al. Early mortality in EURODIAB population-based cohorts of type 1 diabetes diagnosed in childhood since 1989. Diabetologia 2007; 50(12): 2439–2442.
33. Pinto DS, Kirtane AJ, Pride YB et al. Association of blood glucose with angiographic and clinical outcomes among patients with ST-segment elevation myocardial infarction (from the CLARITYTIMI 28 study). Am J Cardiol 2008; 101(3): 303–307.
34. Ravassa S, Zudaire A, Diez J. GLP-1 and cardioprotection: from bench to bedside. Cardiovasc Res 2012; 94(2): 316–323. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvs123> .
35. Raz I, Wilson PW, Strojek K et al. Effects of prandial versus fasting glycemia on cardiovascular outcomes in tye 2 diabetes: the HEART2D trial. Diabetes Care 2009; 32(3): 381–386.
36. Riddle MC, Ambrosius WT, Brillon DJ et al. Epidemiologic relationships between A1C and all-cause mortality during a median 3.4-year follow-up of glycemic treatment in the ACCORD trial. Diabetes Care 2010; 33(5): 983–990.
37. Riddle M. New analyses of glycemic control in ORIGIN. 48th annual meeting of Euroapean Association for study of diabetes. Berlin 2012. Dostupné z WWW: <http://www.easdvirtualmeeting.org/resources/2946>.
38. Skrivarhaug T, Bangstad HJ, Stene LC et al. Longterm mortality in a nationwide cohort of childhood-onset type 1 diabetic patients in Norway. Diabetologia 2006; 49(2): 298–305.
39. Saremi A, Bahn GD, Reaven PE et al. [Veterans Affairs Diabetes Trial (VADT)].A Link Between Hypoglycemia and Progression of Atherosclerosis in the Veterans Affairs Diabetes Trial (VADT) Diabetes Care 2016; 39(3): 448–454. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–2107>.
40. Sartor G, Dahlquist G. Short-term mortality in childhood onset insulin-dependent diabetes mellitus: a high frequency of unexpected deaths in bed. Diabet Med 1995; 12(7): 607–611.
41. Scirica BM, Bhatt DL, Braunwald E et al. [SAVOR-TIMI 53 Steering Committee and Investigators]. Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. N Engl J Med 2013; 369(14): 1317–1326.
42. Snell-Bergeon JK, Wadwa RP. Hypoglycemia, diabetes, and cardiovascular disease. Diabetes Technol Ther 2012; 14(Suppl 1): S51-S58.
43. Svensson AM, McGuire DK, Abrahamsson P et al. Association between hyperand hypoglycaemia and 2 year all-cause mortality risk in diabetic patients with acute coronary events. Eur Heart J 2005; 26(13): 1255–1261.
44. Schernthaner G. Diabetes and cardiovascular disease: is intensive glucose control beneficial or deadly? Lessons from ACCORD, ADVANCE, VADT, UKPDS, PROactive, and NICE-SUGAR. Wien Med Wochenschr 2010; 160(1–2): 8–19.
45. Streja D. Can continuous glucose monitoring provide objective documentation of hypoglycemia unawareness? Endocr Pract 2005; 11(2): 83–90.
46. Swinnen SG, Mullins P, Miller M et al.: Changing the glucose cut-off values that define hypoglycaemia has a major effect on reported frequencies of hypoglycaemia. Diabetologia 2009; 52(1): 38–41. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–008–1147–0>.
47. Tattersall RB, Gill GV. Unexplained deaths of type 1 diabetic patients. Diabet Med 1991; 8(1): 49–58.
48. Tatti P, Di Mauro P, Neri M. Effect of a slow release formula (Glucerna SR) on the risk of Hypoglycemia and blood glucose profile. Seventh Annual Diabetes Technology Meeting. San Francisco, CA, October 2007. A167. Dostupné z WWW: <http://chinacdn.abbottnutrition.com/cms/GLU_CN/MEDIA/Glucerna_Tatti2007_External.pdf>.
49. Patel A, MacMahon S, Chalmers J et al. ADVANCE Collaborative Group. Intensive Blood Glucose Control and VascularOutcomes in Patients with Type 2 Diabetes. N Engl J Med 2008; 358(24): 2560–2572.
50. Frye RL, August P, Brooks MM et al. [BARI-2D Study Goup]. A randomized trial of therapies for type 2 diabwetes and coronary artery disease. N Eng J Med 2009; 360(24): 2503–2515.
51. Finfer S, Chittock DR, Su SY et al. [NICE-SUGAR Study Investigators]. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360(13): 1283–1297.
52. Gerstein HC, Bosch J, Dagenais GR et al. [Origin Trial Investigators] Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Engl J Med, 2012; 367(4): 319–328.
53. Tschope D, Bramlage P, Binz C et al. Incidence and predictors of hypoglycaemia in type 2 diabetes – an analysis of the prospective DiaRegis registry. BMC Endocr Disord 2012; 12 : 23. Dostupné z DOI: <http://dx.doi.org/10.1186/1472–6823–12–23>.
54. Yakubovich N, Gerstein H. Serious cardiovascular outcomes in diabetes. The role of hypoglycaemia. Circulation 2011; 123(3): 342–348.
55. White VB, Cannon CP, Heller SR et al. [EXAMINE Investigators]. Alogliptin after Acute Coronary Syndrome in Patients with Type 2 Diabetes. N Engl J Med 2013; 369(14): 1327–1335.
56. Wright RJ, Frier BM. Vascular disease and diabetes: is hypoglycaemia an aggravating factor? Diabetes Metab Res Rev 2008; 24(5): 353–363.
57. Wright AD, Cull CA, MacLeod KM et al. [UKPDS Group]. Hypoglycemia in type 2 diabetic patients randomized to and maintained on monotherapy with diet, sulfonylurea, metformin, or insulin for 6 years from diagnosis (UKPDS 73). J Diabetes Complications 2006; 20(6): 395–401.
58. Zoungas S, Patel A, Chalmers J et al. Severe hypoglycemia and risks of vascular events and death. N Engl J Med 2010; 363(15): 1410–1418.
59. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373(22): 2117–2128.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2016 Issue 2-
All articles in this issue
-
The quality of the care for patients with diabetes in the Czech Republic.
The VZP Data Analysis - Iatrogenic hypoglycemia as a serious medical problem
- The Prevalence of Diabetic Retinopathy in Slovakia
- Kidney transplantation and metabolic syndrome
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
-
The quality of the care for patients with diabetes in the Czech Republic.
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Kidney transplantation and metabolic syndrome
- Iatrogenic hypoglycemia as a serious medical problem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

