-
Medical journals
- Career
Surveillance antibiotické rezistence u Streptococcus pneumoniae v České republice, výsledky respirační studie za roky 2010–2017
Authors: L. Mališová 1; P. Urbášková 1; V. Jakubů 1,4; P. Španělová 1; J. Kozáková 2; M. Musílek 2; H. Žemličková 1,4
Authors‘ workplace: Centrum epidemiologie a mikrobiologie, Národní referenční laboratoř pro antibiotika, Státní zdravotní ústav, Praha 1; Centrum epidemiologie a mikrobiologie, Národní referenční laboratoř pro streptokokové nákazy, Státní zdravotní ústav, Praha 2; Centrum epidemiologie a mikrobiologie, Národní referenční laboratoř pro meningokokové nákazy, Státní zdravotní ústav, Praha 3; Ústav klinické mikrobiologie, Lékařská fakulta Univerzity Karlovy v Hradci Králové a Fakultní nemocnice, Hradec Králové 4
Published in: Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 2, s. 75-81
Category: Original Papers
Overview
Cíl: Účelem surveillance prováděné v období říjen až prosinec v letech 2010–2017 v České republice bylo sledování stavu a trendů citlivosti k betalaktamovým a makrolidovým antibiotikům u kmenů Streptococcus pneumoniae izolovaných od pacientů s infekcí dýchacích cest.
Materiál a metody: Studie se každoročně zúčastnilo 42–55 laboratoří. Do studie byly konsekutivně zařazeny neduplicitní izoláty pneumokoků izolované z relevantních mikrobiologických vzorků od pacientů s komunitní bakteriální respirační infekcí dýchacích cest. Laboratoře zaznamenávaly do protokolu kvalitativní výsledky vyšetření citlivosti k penicilinu a erytromycinu, citlivost k antibiotikům byla stanovena diskovým difuzním testem. Izoláty necitlivé k penicilinu a/nebo rezistentní k erytromycinu byly zasílány do Národní referenční laboratoře pro antibiotika, kde byla pomocí mikrodiluční bujónové metody vyšetřena minimální inhibiční koncentrace antibiotik, v Národní referenční laboratoři pro streptokokové nákazy byl stanoven sérotyp. U 26 izolátů z roku 2017 byla provedena molekulární typizace pomocí multilokusové sekvenace.
Výsledky: Celkem bylo vyšetřeno 7 491 kmenů pneumokoků, 53,7 % (4 023) pocházelo z materiálu z horních cest dýchacích, 47,7 % (3 573) tvořily vzorky od dětí mladších 15 let. Necitlivost k penicilinu klesla z 2,6 % v roce 2010 na 1,2 % v roce 2017, rezistence k erytromycinu ve stejném období stoupla ze 7,4 % na 9,7 %. Penicilin necitlivé izoláty patřily zejména do sérotypů 19A, 19F a 15A. Izoláty rezistentní k makrolidům, ale citlivé k penicilinu byly zastoupeny především sérotypem 19A a 3. Multilokusová sekvenace u penicilin necitlivých izolátů prokázala přítomnost klonu Taiwan19F-14, nejčastějším detekovaným sekvenčním typem (ST) izolátů rezistentních k makrolidům byl ST416, který patří do klonu Netherlands15B-37.
Závěry: Respirační studie antibiotické rezistence u S. pneumoniae potvrdila klesající trend výskytu rezistence k penicilinu, ale odhalila narůstající rezistenci k makrolidovým antibiotikům v České republice. Výsledky naší studie potvrzují, že antibiotická rezistence je v éře vakcinace spojena především s nevakcinačními sérotypy a klonální expanze sérotypu 19A rezistentního k makrolidům byla patrně navíc podpořena narůstající preskripcí makrolidových antibiotik.
Klíčová slova:
Streptococcus pneumoniae – respirační studie – penicilin – erytromycin – MLST
ÚVOD
Antibiotická rezistence je jedním z nejzávažnějších problémů moderní medicíny. Narůstající spotřeba antibiotik a zejména používání širokospektrých antibiotik vytváří selekční tlak, jehož důsledkem je vzestup rezistence vůči antibiotikům. Infekce respiračního traktu jsou jednou z nejčastějších příčin léčby antibiotiky v primární péči [1]. Ačkoliv akutní infekce dýchacích cest jsou obvykle virového původu, akutní bronchitida je léčena antibiotiky u více než poloviny pacientů [2].
Streptococcus pneumoniae (pneumokok) je nejčastějším bakteriálním patogenem, který se u respiračních infekcí komunitního původu uplatňuje [3]. Historicky je antibiotikem volby pro léčbu infekcí způsobených pneumokoky penicilin. Pneumokoky se sníženou citlivostí vůči penicilinu se začaly objevovat již v 60. letech minulého století, avšak až popis vysoce rezistentních kmenů v Jihoafrické republice v roce 1977 znamenal větší impuls pro sledování tohoto fenoménu [4, 5]. Na konci 70. a v 80. letech prudce narůstala prevalence penicilin necitlivých kmenů v zemích západní Evropy, především ve Španělsku, kde překročila hranici 50 % [6]. Souběžně s rozvojem rezistence k penicilinu narůstala rezistence i k dalším skupinám antibiotik, zejména makrolidům, tetracyklinům, kotrimoxazolu a chloramfenikolu. V rámci evropského sledování antimikrobní rezistence (European Antimicrobial Resistance Surveillance Network, EARS-Net) překračuje v současnosti v řadě zemí rezistence k makrolidům rezistenci k penicilinu. V roce 2017 se pohyboval podíl penicilin necitlivých izolátů mezi 0,2 % (Belgie) až 45,5 % (Kypr), izoláty rezistentní k makrolidům tvořily 3,6 % (Lotyšsko, Dánsko) až 36 % (Malta) [7].
V České republice se rezistence vůči antibiotikům u bakteriálních původců komunitních infekcí respiračního traktu sleduje od roku 1996 [8]. Informace o stavu a trendech rezistence vůči antibiotikům jsou podkladem pro výběr optimální antibiotické léčby komunitních respiračních infekcí. Surveillance organizuje Národní referenční laboratoř pro antibiotika (NRL pro ATB) ve spolupráci se členy Pracovní skupiny pro monitorování rezistence (PSMR). U pneumokoků se v rámci surveillance sleduje antibiotická rezistence k betalaktamům a makrolidům, antibiotikům používaným k léčbě bakteriálních respiračních infekcí.
Tato práce poskytuje informaci o trendech rezistence u pneumokoků vyvolávajících komunitní respirační infekce v České republice v období let 2010–2017. Vybrané rezistentní izoláty byly podrobeny detailnější fenotypové a genotypové charakterizaci.
MATERIÁL A METODY
Respirační studie
Studie se v období říjen až prosinec v letech 2010–2017 zúčastnilo v průměru 48 (v rozmezí 42–55) laboratoří reprezentujících všechny oblasti ČR. Do studie byly konsekutivně zařazovány neduplicitní izoláty pneumokoků izolované ze vzorků z dolních cest dýchacích (sputum, pleurální punktát) a horních cest dýchacích (punktát z vedlejších nosních dutin, hnis z paracentézy) odebraných pacientům s komunitní bakteriální respirační infekcí dýchacích cest. Ke vzorkům z dolních cest dýchacích byly rovněž zařazeny vzorky z krve od pacientů s komunitní pneumonií. Podle věku byli pacienti rozděleni do dvou věkových kategorií, děti (≤ 14 let) a dospělí (> 15 let). Laboratoře zaznamenávaly do protokolu kvalitativní výsledky vyšetření citlivosti k penicilinu a erytromycinu podle doporučení NRL pro ATB. Citlivost k antibiotikům byla stanovena diskovým difuzním testem podle aktuální verze doporučení EUCAST (dostupné na www.eucast.org). Pro screening rezistence k penicilinu byl použit oxacilinový disk (1 μg). Výsledky vyšetření citlivosti byly intepretovány podle EUCAST, kmeny vytvářející kolem disku s oxacilinem průměr inhibiční zóny < 20 mm byly označeny jako penicilin necitlivé. V průběhu studie prováděly laboratoře rutinní kontrolu kvality diskové difuzní metody pomocí kontrolního kmene S. pneumoniae ATCC 49619 podle EUCAST.
Bakteriální izoláty
Izoláty necitlivé k penicilinu a/nebo rezistentní k erytromycinu byly zasílány do NRL pro ATB k bližší charakterizaci.Kmeny byly identifikovány jako pneumokoky testem rozpustnosti v deoxycholátu a latexovou aglutinací (Slidex pneumo-kit, bioMérieux, Francie). Sérotyp pneumokoků byl v NRL pro streptokokové nákazy určen pomocí typově specifických antisér (Statens Serum Institut, Dánsko) [9] a multiplex PCR metodou [10].
Minimální inhibiční koncentrace (MIC) penicilinu, cefotaximu, erytromycinu, klindamycinu, tetracyklinu, chloramfenikolu a kotrimoxazolu byla vyšetřena mikrodiluční metodou [11]. Kontrola kvality vyšetření probíhala pomocí kontrolního kmene S. pneumoniae ATCC 49619. Minimální inhibiční koncentrace byly intepretovány do kategorií citlivosti podle EUCAST v.8.1.
Molekulární typizace
Molekulární typizace izolátů rezistentních vůči antibiotikům zaslaných do NRL pro ATB v průběhu studie v roce 2017 (26 izolátů) byla provedena pomocí multilokusové sekvenace (multi locus sequence typing, MLST) podle standardního protokolu [12]. Sekvenční typ (ST) byl určen na základě kombinace sekvenačních produktů sedmi interních fragmentů o velikosti cca 550–600 bp genů aroE, gdh, gki, recP, spi, xpt a ddl. Sekvence byly analyzovány programem Bionumerics 7.6 (Applied Maths, Belgie), který k určení výsledného ST porovnává sekvence s veřejně přístupnou databází Streptococcus pneumoniae MLST Databases (http://pubmlst.org/spneumoniae/). Pomocí eBURST analýzy (http://eburst.mlst.net) byly ST na základě jejich příbuznosti zařazeny do klonálních komplexů (CC).
VÝSLEDKY
Antibiotická citlivost
Ve sledovaném období 2010–2017 bylo vyšetřeno celkem 7 491 kmenů pneumokoků, 53,7 % (4 023) pocházelo z materiálu z horních cest dýchacích (HCD), 47,7 % (3 573) tvořily vzorky od dětí mladších 15 let. Vzorky z dolních cest dýchacích (DCD) převažovaly u dospělé populace (90,5 %; 3 137), vzorky od dětí tvořily 80,6 % (3 242) izolátů z HCD. Ve sledovaném období osmi let byla průměrná necitlivost k penicilinu 2,3 % a měla spíše klesající trend, z 2,6 % v roce 2010 na 1,2 % v roce 2017 (tab. 1, tab. 2). Průměrná rezistence k erytromycinu byla 9,1 % a měla naopak zvyšující se tendenci. V letech 2010–2017 stoupla rezistence k erytromycinu ze 7,4% na 9,7%, (tab. 3, tab. 4). Četnost rezistence izolátů vyvolávajících infekce HCD (sinusitis acuta, otitis media acuta) byla ve srovnání s izoláty z infekcí DCD (komunitní pneumonie, akutní exacerbace chronické bronchitidy) nižší u penicilinu (1,9 % HCD vs. 2,3 % DCD), i erytromycinu (6,6 % HCD vs. 9,6 % DCD).
Table 1. Necitlivost k penicilinu (%) u Streptococcus pneumoniae v letech 2010–2017 podle druhu vzorku
Table 1. Insensitivity to penicillin (%) in Streptococcus pneumoniae in 2010–2017 by sample type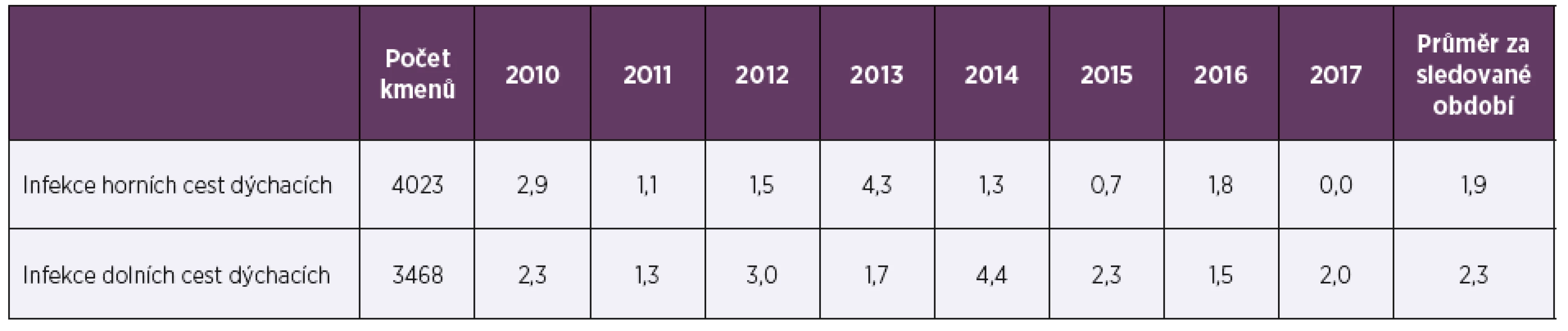
Table 2. Necitlivost k penicilinu (%) u Streptococcus pneumoniae v letech 2010–2017 podle věku
Table 2. Insensitivity to penicillin (%) in Streptococcus pneumoniae in 2010–2017 by age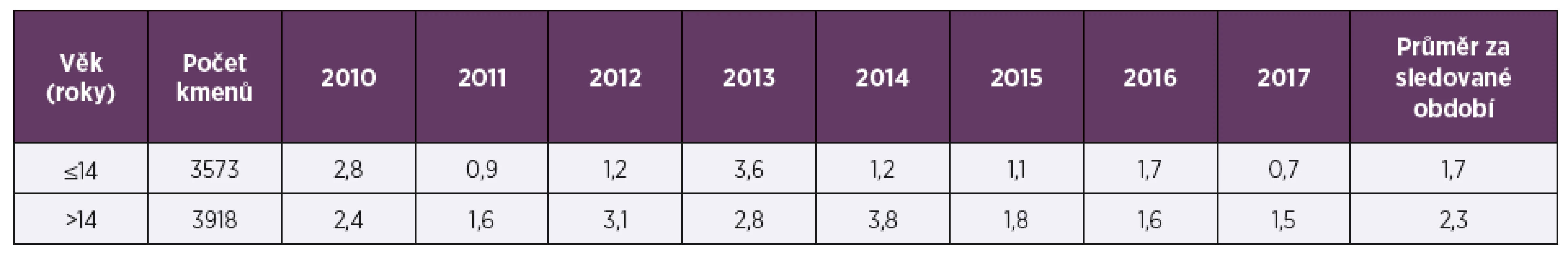
Table 3. Rezistence k erytromycinu (%) u Streptococcus pneumoniae v letech 2010–2017 podle druhu vzorku
Table 3. Resistance to erythromycin (%) in Streptococcus pneumoniae in 2010–2017 by sample type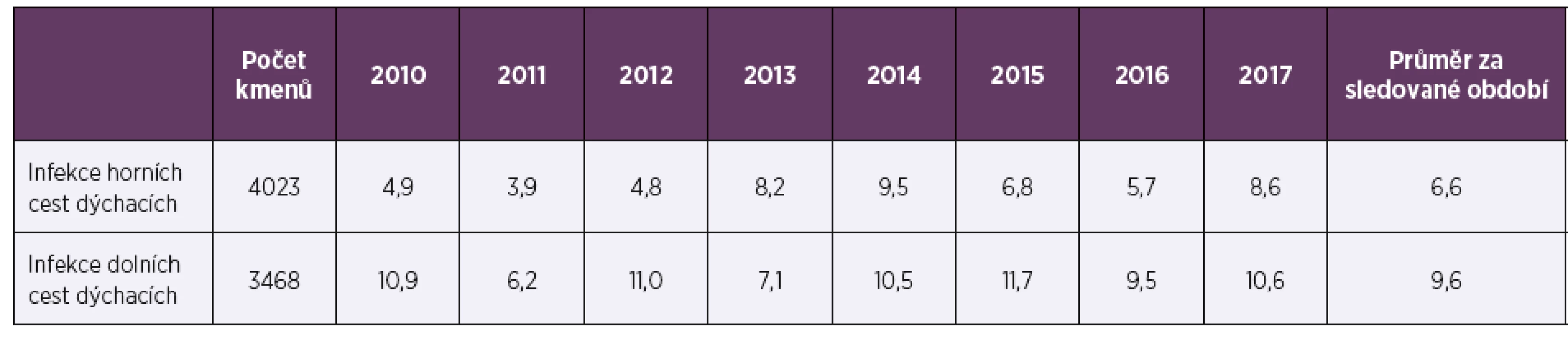
Table 4. Rezistence k erytromycinu (%) u Streptococcus pneumoniae v letech 2010–2017 podle věku
Table 4. Age-related resistance to erythromycin (%) in Streptococcus pneumoniae in 2010–2017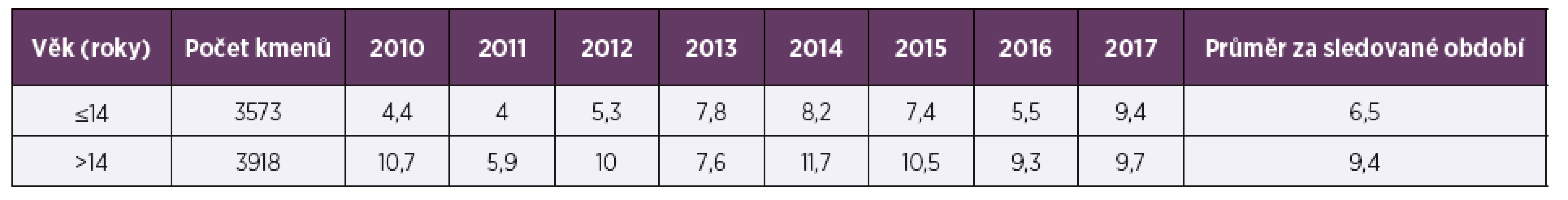
V rámci respirační studie bylo NRL pro ATB vyšetřeno 126 izolátů necitlivých k penicilinu a/nebo rezistentních k erytromycinu (tab. 5; Vysvětlivky: PEN – penicilin, CTX – cefotaxim, TET – tetracyklin, ERY – erytromycin, CLI – klindamycin, CMP – chloramfenikol, COT – trimetoprim/sulfamethoxazol, R – rezistentní, I – intermediární; Explanation: PEN – penicillin, CTX – cefotaxime, TET – tetracycline, ERY – erythromycin, CLI – clindamycin, CMP – chloramphenicol, COT – trimethoprim/sulfamethoxazole, R – resistant, I – intermediate). Z celkem 53 izolátů necitlivých k penicilinu bylo 40 (75,5 %) izolátů intermediárně citlivých (MIC penicilinu 0,125–2 mg/l), 13 (24,5 %) izolátů vykazovalo k penicilinu rezistenci (MIC 4–8 mg/l). Třicet (56,6 %) izolátů necitlivých k penicilinu bylo intermediárně citlivých (MIC 1–2 mg/l) k cefotaximu, tři (5,3 %) izoláty byly k cefotaximu rezistentní (MIC 1–2 mg/l). Penicilin necitlivé izoláty byly dále obvykle rezistentní k erytromycinu (75,5 %; 40), klindamycinu (66 %; 35), tetracyklinu (71,7 %; 38), a kotrimoxazolu (73,6 %; 39). Sérotyp byl vyšetřen u všech zaslaných izolátů (126). Sérotypizace klasifikovala penicilin necitlivé izoláty (53) do 12 sérotypů (6A, 6B, 6C, 9V, 12F, 14, 15A, 19A, 19F, 23B, 23F, 35B), většina izolátů ale patřila pouze ke třem sérotypům: 19A (30,2 %; 16), 19F (26,4 %; 14) a 15A (11,3 %; 6). U izolátů rezistentních k erytromycinu, ale citlivých k penicilinu (73) bylo identifikováno 13 sérotypů (3, 4, 6B, 6C, 7C, 9V, 11A, 14, 15A, 15B, 15C, 19A, 19F), většina izolátů náležela pouze k dvěma sérotypům: 19A (71,2 %; 52) a 3 (9,6 %; 7). U sérotypů, které byly v analyzovaném souboru zastoupeny alespoň 5 izoláty (19A, 19F, 15A, 3, 14 a 9V), byla necitlivost k penicilinu nejčastěji sdružena se sérotypem 19F (93,3 %; 14/15), 15A (75 %; 6/8), 14 a 9V (oba 80 %; 4/5). Oproti tomu rezistence k makrolidům byla nejfrekventnější u sérotypů 19A (96 %; 66/68), 19F (80 %; 12/15), 15A (100 %; 8/8) a 3 (100 %; 7/7). Molekulární analýza byla provedena u všech rezistentních izolátů (26) zaslaných v rámci studie v roce 2017 (tab. 6; Vysvětlivky: PEN – penicillin, CTX – cefotaxime, TET – tetracyklin, ERY – erythromycin, CLI – klindamycin, CMP – chloramfenikol, COT – trimetoprim/sulfamethoxazole, ST – sekvenační typ, PMEN – Pneumococcal Molecular Epidemiology Network; Explanation: PEN – penicillin, CTX – cefotaxime, TET – tetracycline, ERY – erythromycin, CLI – clindamycin, CMP – chloramphenicol, COT – trimethoprim/sulfamethoxazole, ST – sequencing type, PMEN – Pneumococcal Molecular Epidemiology Network). Analyzovány byly izoláty 8 sérotypů (3, 6C, 7C, 15A, 19A, 19F, 23F a 35B), které vykazovaly 13 ST. U izolátů necitlivých k penicilinu byla prokázána přítomnost mezinárodních klonů sdružených s penicilinovou rezistencí: Denmark14-32, Taiwan19F-14, Poland6B-20, Sweden15A-25 a Spain23F-1. Izoláty rezistentní k erytromycinu, ale citlivé k penicilinu, byly zastoupené zejména klonem Netherlands15B-37 a Netherlands3-31.
Table 5. Charakteristika rezistentních pneumokových izolátů (126) zaslaných do NRL pro ATB v letech 2010–2017
Table 5. Characteristics of resistant pneumococcal isolates (126) sent to the NRL for ATB 2010–2017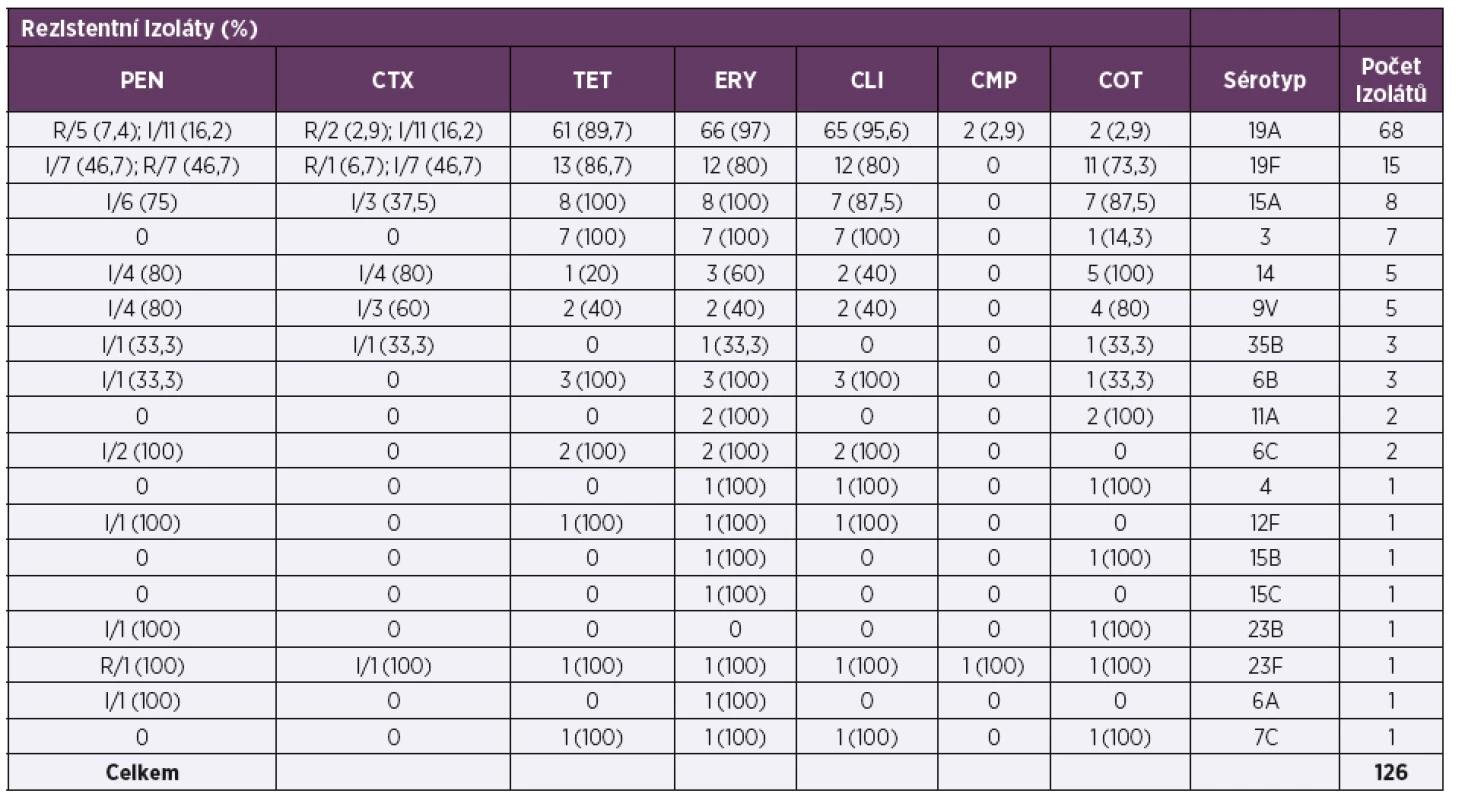
Table 6. Molekulární charakterizace pneumokokových izolátů (26) vyšetřovaných v NRL pro ATB v roce 2017 v rámci respirační studie
Table 6. Molecular characterization of pneumococcal isolates (26) examined in NRL for ATB in 2017 as part of a respiratory study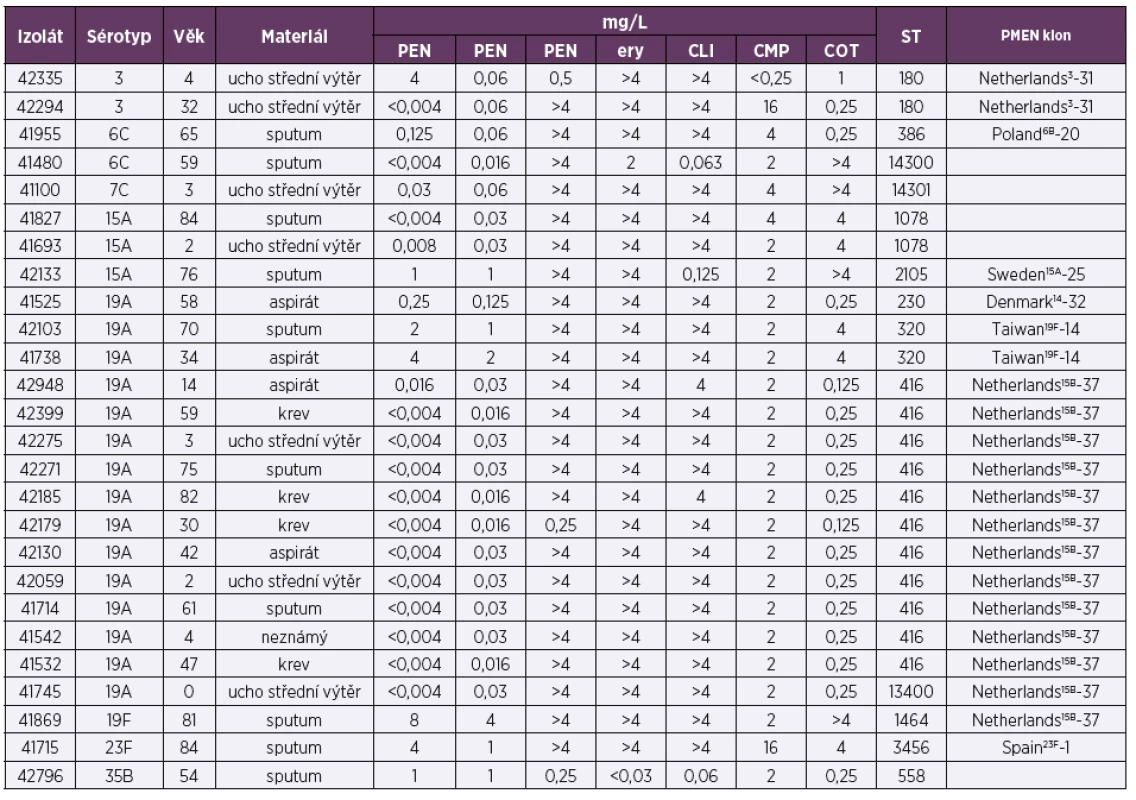
DISKUSE
Respirační studie antibiotické rezistence u S. pneumoniae probíhající v letech 2010–2017 potvrdila klesající trend výskytu rezistence k penicilinu, ale odhalila narůstající rezistenci k makrolidovým antibiotikům v České republice. Po mírném poklesu od začátku sledování dosáhla necitlivost k penicilinu vrcholu v roce 2013, v následujících letech 2014–2017 četnost klesla pod výchozí úroveň roku 2010. Rezistence k makrolidům klesla v roce 2011, ale pak opět stoupala a od roku 2014 je podíl izolátů rezistentních k makrolidům stabilní. Výsledky respirační studie jsou zcela srovnatelné s národními údaji v rámci evropské surveillance antimikrobní rezistence u invazivních pneumokokových izolátů (the European Antimicrobial Resistance Surveillance Network, EARS-Net) [7].
Ačkoliv k rizikovým faktorům, které jsou asociovány s výskytem infekce vyvolané rezistentním mikrobem, patří mladší věk (< 24 měsíců) a infekce HCD [13], v našem souboru byla četnost rezistence vyšší u izolátů vyvolávající infekce DCD, které pocházely zejména od dospělých, ve srovnání s izoláty z HCD, které z poloviny tvořily vzorky od dětí. Důvodem může být relativně nízké poměrné zastoupení dospělé populace v celém souboru a celkový přístup k indikaci mikrobiologického vyšetření, které je u dospělých osob využíváno obvykle až po předchozím selhání antibiotické terapie.
Souvislost mezi spotřebou antibiotik a rezistencí byla opakovaně prokázána [14]. V České republice trvale klesá ambulantní spotřeba penicilinu a amoxicilinu, oproti tomu narůstá používání aminopenicilinů s inhibitory betalaktamáz, makrolidových antibiotik a cefalosporinů 2. generace, dostupné na https://ecdc.europa.eu/en/antimicrobial-consumption/surveillance-and-disease-data/database. Trvalý pokles penicilinové rezistence tedy může být důsledkem poklesu spotřeby penicilinu. Výskyt penicilinové rezistence však může být ovlivněn nejen celkovou spotřebou všech betalaktamových antibiotik, ale i poměrem spotřeby aminopenicilinů k cefalosporinům [15]. Tento poměr ve prospěch vyšší spotřeby cefalosporinů je nepříznivým faktorem pro nárůst rezistence k penicilinu u pneumokoků. Fakt, že se narůstající spotřeba těchto skupin antibiotik v rezistenci k penicilinu v České republice neprojevila, může být zapříčiněn i tím, že v období 2010–2015 byl poměr spotřeby aminopenicilinů vůči cefalosporinům 1. a 2. generace > 2,5 (dostupné na https://ecdc.europa.eu/en/antimicrobial-consumption/surveillance-and-disease-data/database).
Vzrůstající rezistence pneumokoků k makrolidům odráží trvale se zvyšující spotřebu makrolidových antibiotik. Nárůst výskytu makrolidové rezistence může souviset i s vlastním mechanismem rezistence k makrolidovým antibiotikům. Genetická analýza recentních izolátů sérotypu 19A a 19F rezistentních k makrolidům prokázala přítomnost transposonů Tn6002, respektive Tn2010 [16]. Oba tyto transposony nesou ermB gen kódující konstitutivní rezistenci k makrolidovým antibiotikům, a gen tetM, který kóduje rezistenci k tetracyklinu. Transposon Tn2010 má navíc i mefE/mel operon, který tvoří genetický základ dalšího mechanismu rezistence k makrolidům, tvz. efluxu [17]. Šíření makrolidové rezistence má obvykle klonální charakter. Oba genetické elementy byly nalezeny u stejných klonů, které byly prokázány i v našem souboru. Izoláty rezistentní k makrolidovým antibiotikům byly dominantně zastoupeny klonem Netherlands15B-37 u sérotypu 19A a klonem Taiwan19F-14 u sérotypu 19F. Zatímco sérotyp 19A reprezentovaný klonem Netherlands15B-37 byl současně rezistentní pouze k tetracyklinu, sérotyp 19F, zastoupený klonem Taiwan19F-14 byl, vyjma duálního mechanismu rezistence k makrolidům a rezistence k tetracyklinu, současně necitlivý k penicilinu.
Historicky byla v České republice penicilinová rezistence sdružena zejména se sérotypem 9V a klonem Spain9V-3, avšak v tomto souboru byl sérotyp 9V spíše raritní a penicilin necitlivé kmeny náležely zejména k sérotypu 19A a 19F zastoupeného klonem Taiwan19F-14 [18]. Změny v zastoupení jednotlivých sérotypů a klonů mohou souviset se zavedením plošného očkování vůči pneumokokovým infekcím. Nárůst multirezistentního klonu Taiwan19F-14 exprimující sérotyp 19A byl po implementaci 7valentní konjugované vakcíny (PCV7), zahrnující sérotypy 4, 6B, 9V, 14, 18C, 19F, 23F, zaznamenán nejprve ve Spojených státech [19]. Nárůst sérotypu 19A rezistentního k makrolidům náležící ke klonu Netherlands15B-37 byl popsán v Itálii a Německu [20, 21]. Používání 13valentní konjugované vakcíny (PCV13), která obsahuje navíc sérotypy 1, 3, 5, 6A, 7F a 19A, se odrazilo i v poklesu záchytu kmenů tohoto sérotypu [22]. V České republice je od zavedení plošné vakcinace pneumokokovými konjugovanými vakcínami PCV10 (PCV7 + sérotypy 1, 5, 7F) a PCV13 (PCV10 + sérotypy 3, 6A, 19A) zřetelný pokles celkové prevalence sérotypu 9V u invazivních pneumokokových infekcí (IPO), naopak výskyt sérotypu 19A od roku 2010 stoupá a v roce 2017 to byl druhý nejčetnější sérotyp vyvolávající IPO [23]. Sérotypy 19A a 19F byly také dominantně zastoupeny ve studii nosičství pneumokoků u dětí v České republice [24]. Výsledky naší studie potvrzují, že antibiotická rezistence je v éře vakcinace spojena především s nevakcinačními sérotypy a klonální expanze sérotypu 19A rezistentního k makrolidům byla patrně navíc podpořena narůstající preskripcí makrolidových antibiotik.
ZÁVĚRY
Surveillance antibiotické rezistence je nezbytná pro sledování trendů vývoje citlivosti k antibiotikům. Kontinuální sledování poskytuje údaje nezbytné pro rozhodování o volbě antibiotika pro úvodní léčbu pacienta. Tato studie potvrdila velmi dobrou citlivost k penicilinu u pneumokoků vyvolávajících respirační infekce, naopak byl pozorován nárůst rezistence k makrolidovým antibiotikům, který souvisí s rozšířením mezinárodního rezistentního klonu sérotypu 19A v České republice a jehož šíření zřejmě podporuje nezdůvodněná obliba makrolidů, často aplikovaných místo penicilinu nebo amoxicilinu u respiračních infekcí.
Poděkování
Autoři děkují kolegům z Pracovní skupiny pro monitorování rezistence (PSMR). Členové PSMR spolupracující na Respirační studii 2017: V. Adámková (Ústav lékařské biochemie a laboratorní diagnostiky, Klinická mikrobiologie a ATB centrum, Všeobecná fakultní nemocnice v Praze), N. Bartoníková (Odd. lékařské mikrobiologie a ATB středisko, Krajská nemocnice T. Bati, a.s., Zlín), T. Bergerová (Ústav mikrobiologie, Fakultní nemocnice Plzeň), L. Čekanová (pracoviště Olomouc – bakteriologie, Laboratoře Mikrochem a.s.), P. Čermák (Odd. klinické mikrobiologie, Thomayerova nemocnice Praha), L. Dvořáková (Odd. klinické mikrobiologie, Krajská zdravotní, a.s. – Masarykova nemocnice, Ústí nad Labem), D. Fáčková (Odd. klinické mikrobiologie a imunologie, Krajská nemocnice Liberec, a.s.), E. Chmelařová (Klinická mikrobiologie, Laboratoře AGEL a.s., Ostrava), M. Glasnák (Odd. klinické mikrobiologie, Nemocnice Rudolfa a Stefanie Benešov, a.s.), M. Hanslianová (Odd. klinické mikrobiologie, Fakultní nemocnice Brno), V. Hásková (Laboratoř lékařské mikrobiologie Hořovice, Zdravotní ústav se sídlem v Ústí nad Labem), M. Horníková (Antibiotické středisko, Centrální laboratoře – laboratoř bakteriologie, Nemocnice České Budějovice, a.s.), J. Janečková (Odd. infekční diagnostiky a ATB středisko, Litomyšlská nemocnice, a.s.), P. Ježek (Odd. klinické mikrobiologie a parazitologie, Oblastní nemocnice Příbram, a.s.), D. Jurčová (Mikrobiologická laboratoř Mediekos Labor, s.r.o., Zlín), Z. Keyzlarová (Laboratoř Znojmo, Synlab Czech s.r.o.), O. Kopecký (Odd. klinické imunologie a mikrobiologie, Oblastní nemocnice Náchod a.s.), D. Krčková (Mikrobiologická laboratoř IFCOR-99, s.r.o., Brno), E. Krejčí (ATB středisko při Odd. bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě), H. Křemečková (Odd. klinické mikrobiologie, Nemocnice Kyjov), I. Kyptová (Laboratoř Praha CUBE Synlab Czech s.r.o.), E. Martínková (Klinické laboratoře DIA-GON MP, spol. s r.o., Cheb), H. Nedvědová (Odd. klinických laboratoří – mikrobiologie, Klatovská nemocnice, a.s.), V. Němečková (Laboratoře Černý Most - Lékařská mikrobiologie, VIDIA-DIAGNOSTIKA, spol. s r.o., Praha), P. Novotná (Centrální laboratoře – stanice lékařské mikrobiologie, Nemocnice Tábor, a.s.), O. Nyč (Ústav lékařské mikrobiologie UK 2. LF a FN Motol, Praha), E. Nyčová (Odd. klinické mikrobiologie a ATB středisko, Nemocnice Na Bulovce, Praha), B. Ochvatová (Laboratoř klinické mikrobiologie SPADIA Lab, a.s., Ostrava), P. Paterová (Ústav klinické mikrobiologie LF UK a FN Hradec Králové), J. Pomykal (Odd. lékařské mikrobiologie, Oblastní nemocnice Kolín, a.s.), F. Prusík (Ústav laboratorní diagnostiky – Úsek mikrobiologie a ATB středisko, FN Královské Vinohrady, Praha), B. Puchálková (Odd. klinické mikrobiologie, Karlovarská krajská nemocnice, a.s.), M. Rumlerová (ATB středisko při Klinické laboratoři, úsek mikrobiologie, Oblastní nemocnice Kladno, a. s., Nemocnice Středočeského kraje se sídlem v Kladně), A. Sekáčová (Odd. lékařské mikrobiologie, Vsetínská nemocnice, a.s.), H. Skačáni (Odd. klinické biochemie, mikrobiologie a imunologie, Nemocnice Jihlava), M. Smolíková (Odd. klinické mikrobiologie, Oblastní nemocnice Jičín, a.s.), M. Sosíková (Úsek lékařské mikrobiologie, Slezská nemocnice v Opavě), M. Staněk (Mikrobiologické oddělení, Nemocnice Znojmo), A. Steinerová (Poliklinika Lípa centrum, Odd. bakteriologie, CITYLAB spol. s r.o., Praha), L. Šemberová (Mikrobiologická laboratoř Česká laboratorní s.r.o., Praha), E. Šimečková (Centrální laboratoře – klinická mikrobiologie a ATB středisko, Nemocnice Strakonice, a.s.), R. Tejkalová (Mikrobiologický ústav, Fakultní nemocnice u sv. Anny v Brně), H. Typovská (Laboratoř klinické mikrobiologie – Šternberk, Laboratoře AGEL a.s.), J. Valenta (Laboratoř Chomutov, klinická mikrobiologie, Synlab Czech s.r.o.), V. Vaniš (Odd. klinické mikrobiologie a ATB stanice, Nemocnice Na Homolce, Praha), D. Veselá (Odd. lékařské mikrobiologie, Nemocnice Jindřichův Hradec, a.s.), E. Vítová (Odd. lékařské mikrobiologie a imunologie, Oblastní nemocnice Trutnov a.s.), E. Zálabská (Odd. klinické mikrobiologie, Pardubická krajská nemocnice, a.s.), D. Zamazalová (OKLT klinických lab. – Mikrobiologická laboratoř, Nemocnice Nové Město na Moravě), R. Záruba (Mikrobiologické odd., Krajská zdravotní, a.s. – Nemocnice Most, o.z.).
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-27109A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 10. 12. 2018.
Adresa pro korespondenci:
doc. MUDr. Helena Žemličková, Ph.D.
Centrum epidemiologie a mikrobiologie
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
email: helena.zemlickova@szu.cz
Sources
1. Goossens H, Ferech M, Vander Stichele R, Elseviers M. ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet, 2005;365 : 579–587.
2. Mainous AG, Hueston WJ, Davis MP, Pearson WS. Trends in antimicrobial prescribing for bronchitis and upper respiratory infections among adults and children. Am J Public Health, 2003;93 : 1910–1914.
3. Jacobs MR, Felmingham D, Appelbaum PC, Grüneberg RN, et al. The Alexander project 1998–2002: susceptibility of pathogens isolated from community-acquired respiratory tract infection to commonly used antimicrobial agents. J Antimicrob Chemother, 2003;52 : 229–246.
4. Appelbaum PC, Bhamjee A, Scragg JN, et al. Streptococcus pneumoniae resistant to penicillin and chloramphenicol. Lancet, 1977;2 : 995–997.
5. Jacobs MR, Koornhof JH, Robins-Browne RM, et al. Emergence of multiply resistant pneumococci. N Engl J Med, 1978;299 : 735–740.
6. Reinert RR, Reinert S, van der Linden M, et al. Antimicrobial susceptibility of Streptococcus pneumoniae in eight European countries from 2001 to 2003. Antimicrob Agents Chemother, 2005;49 : 2903–2913.
7. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2017. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2017.
8. Urbášková P. Rezistence k antibiotikům u Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae a Moraxella catarrhalis v České republice v letech 1996 a 1997. Klin Microbiol Inf Lék, 1998;4 : 292–298.
9. Sorensen UB. Typing of pneumococci by using 12 pooled antisera. J Clin Microbiol, 1993; 31 : 2097–2100.
10. Vacková Z, Klímová M, Kozáková J. Nová metoda a schéma typizace Streptococcus pneumoniae. Epidemiol Mikrobiol Imunol, 2013;62 : 10–18.
11. European Committee on Antimicrobial Susceptibility Testing (EUCAST) of the European Society of Clinical Microbiology and Infectious Diseases (ESCMID). Determination of minimum inhibitory concentrations (MICs) of antibacterial agents by broth dilution. Clin Microbiol Infect, 2003;9 : 1–7.
12. Enright MC, Spratt BG. A multilocus sequence typing scheme for Streptococcus pneumoniae: identification of clones associated with serious invasive disease. Microbiology, 1998;144 : 3049–3060.
13. Klugmann KP. Risk factors for antibiotic resistance in Streptococcus pneumoniae. S Afr Med J, 2007;97 : 1129–1132.
14. Riedel S, Beekmann SE, Heilmann KP, et al. Antimicrobial use in Europe and antimicrobial resistance in Streptococcus pneumoniae. Eur J Clin Microbiol Infect Dis, 2007; 26 : 485–490.
15. Baquero F. Trends in antibiotic resistance of respiratory pathogens: an analysis and commentary on a collaborative surveillance study.
J Antimicrob Chemother, 1996;38 (Suppl A):117–132.16. Žemličková H, Mališová L, Španělová P, et al. Molecular characterization of serogroup 19 Streptococcus pneumoniae in the Czech Republic in the post-vaccine era. J Med Microbiol, 2018;67 : 1003–1011.
17. Del Grosso M, Northwood JGE, Farell DJ, Pantosti A. The macrolide resistance genes erm(B) and mef(E) are carried by Tn2010 in dual-gene Streptococcus pneumoniae isolates belonging to clonal complex CC271. Antimicrob Agents Chemother, 2007;51 : 4184–4186.
18. Zemlickova H, Melter O, Urbaskova P. Epidemiological relation-
ships among penicillin non-susceptible Streptococcus pneumoniae strains recovered in the Czech Republic. J Med Microbiol, 2006;55 : 437–442.19. Moore RM, Gertz RE, Woodbury RL, et al. Population snapshot of emergent Streptococcus pneumoniae serotype 19A in the United States, 2005. J Infect Dis, 2008;197 : 1016–1027.
20. Del Grosso M, Camilli R, D’Ambrosio F, et al. Increase of pneumococcal serotype 19A in Italy is due to expansion of the piliated clone ST416/CC199. J Med Microbiol, 2013;62 : 1220–1225.
21. van der Linden M, Reinert RR, Kern WV, Imohl M. Epidemiology of serotype 19A isolates from invasive pneumococcal disease in German children. BMC Infect Dis, 2013;13 : 70.
22. Camilli R, D’Ambrosio F, Del Grosso M, et al. Impact of pneumo-
coccal conjugate vaccine (PCV7 and PCV13) on pneumococcal invasive diseases in Italian children and insight into evolution of pneumococcal population structure. Vaccine, 2017;35 : 4587–4593.23. Kozáková J, Okonji Z, Šebestová H, Křížová P. Invasive pneumococcal disease in the Czech Republic in 2015. Bull Centre Epidemiol Microbiol, 2018;27 : 49–55.
24. Vancikova Z, Trojanek M, Zemlickova H, et al. Pneumococcal urinary antigen positivity in healthy colonized children: is it age dependent? Wien Klin Wochenschr, 2013;125 : 495–500.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2019 Issue 2-
All articles in this issue
- Stanovení antimikrobiálních účinků slizu plže Achatina reticulata
- Surveillance antibiotické rezistence u Streptococcus pneumoniae v České republice, výsledky respirační studie za roky 2010–2017
- Tularémie – zoonóza s rizikem bioterorismu
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Diagnostika a léčba bartonelových endokarditid
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
- Snížení dávkování thymoglobulinu ze 7,5 mg/kg na 6 mg/kg v rámci přípravného transplantačního režimu prodloužilo dobu do první detekce lidského cytomegaloviru u pacientů po alogenní transplantaci krvetvorných buněk
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Tularémie – zoonóza s rizikem bioterorismu
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

