-
Medical journals
- Career
Nová definice sepse (Sepsis-3): cíle, přednosti a kontroverze
: J. Máca 1,2; P. Sklienka 1,2; P. Reimer 1; M. Holub 3
: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava-Poruba 1; Katedra intenzivní medicíny a forenzních oborů, Lékařská fakulta, Ostravská univerzita v Ostravě 2; Klinika infekčních nemocí 1. lékařské fakulty Univerzity Karlovy a Ústřední vojenské nemocnice – Vojenské fakultní nemocnice 3
: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 1, s. 36-43
: Review Article
Sepse je život ohrožující stav vznikající na podkladě dysregulované odpovědi hostitelského organismu na infekci. Pohled na problematiku sepse se v posledních desetiletích dramaticky vyvíjí, což je dáno rychlým nárůstem nových poznatků o její epidemiologii, patofyziologii i léčbě. Z tohoto důvodu byla v roce 2016 představena nová mezinárodní kritéria a definice sepse a septického šoku „The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)“, která vznikla na podkladě konsenzuálního stanoviska mezinárodního panelu expertů (The Society of Critical Care Medicine a The European Society of Intensive Care Medicine). Hlavním cílem zavedení nových kritérií a definice sepse bylo rozšířit povědomí odborné veřejnosti o sepsi jako onemocnění s vysokou mortalitou, a to především v situacích, kdy není včas diagnostikována a léčena. Sepsis-3 má být východiskem pro preklinický i klinický výzkum, ale také pro rozvoj nových diagnostických metod a pro léčbu pacientů se sepsí a septickým šokem.
Klíčová slova:
sepse – septický šok – orgánové dysfunkce – definice – kritériaÚVOD
Sepse je důležitý klinický syndrom, který lidstvo provází od počátku jeho existence. Ačkoliv v minulosti nebyla jeho podstata přesně chápána, byla sepse vždy považována za smrtelné onemocnění („infekční otrava krve“) vznikající v souvislosti s infekcí. V současné době je sepse vnímána jako život ohrožující stav, kdy infekcí napadený organismus reaguje neadekvátní reakcí, převážně imunitního charakteru, která vede k funkčnímu a strukturálnímu poškození vlastních orgánových systémů [1–3]. Přestože došlo v posledních desetiletích k významnému pokroku v oblasti poznání patofyziologie syndromu a rozšířilo se spektrum diagnostických a léčebných postupů, zůstává sepse v rozvinutých zemích nadále jednou z nejčastějších příčin úmrtí kriticky nemocných pacientů na jednotkách intenzivní péče s výjimkou koronárních jednotek [4]. I když je popisován relativní pokles mortality, v absolutních číslech počet pacientů zemřelých následkem sepse stoupá. Každoročně je uváděn nárůst incidence sepse přibližně o 8,7 % [5, 6]. Příčinu lze najít především v demografických faktorech, kdy stárnutí populace a současně stoupající počet závažných komorbidit vedou ke zvýšenému počtu vulnerabilních pacientů (extrémní věkové kategorie; pacienti s imunitními onemocněními anebo imunosupresivní léčbou; onkologická a hematoonkologická onemocnění atd.). Nezanedbatelným faktorem je také zvýšené povědomí, spojené s lepší identifikací sepse [8, 9]. Počet úmrtí v souvislosti se sepsí a ekonomické náklady na její diagnostiku a léčbu jsou v korelaci se stupněm závažnosti orgánových dysfunkcí [10]. Pacienti, kteří sepsi přežijí, často trpí dlouhodobými zdravotními omezeními, a to především fyzického a psychosomatického (kognitivní dysfunkce) a psychosociálního charakteru, spojených s významným ovlivněním kvality života a zvýšenou zátěží pro zdravotní systém [11]. Náklady spojené s léčbou stoupají a v současné době se udává rozmezí cca 25 000–40 000 USD na jednu septickou epizodu [12]. Náklady na hospitalizace spojené se sepsí byly v roce 2011 v USA odhadnuty na 20,3 miliardy USD, což odpovídá 5,2 % celkových nákladů na zdravotní péči ve stejném roce. To sepsi zařadilo na 1. místo mezi 20 nejnákladnějšími klinickými jednotkami, zatímco například infarkt myokardu na 5. místě měl náklady zhruba poloviční [13].
Maximálně přesná a standardizovaná definice a kritéria sepse jsou stěžejní nejen pro běžnou klinickou praxi v podmínkách intenzivní péče, ale především mimo ni, kde vzniká velká část nových případů. Význam mají také pro klinický výzkum a z ekonomického hlediska, např. pro metodiku kódování diagnóz. Sepse tedy představuje významný medicínský i socioekonomický problém.
Historie a vývoj kritérií sepse
První lékařský popis sepse je možné najít v egyptském papyru datovaném 1600 let před Kristem, který byl nalezen v roce 1860 v Luxoru. Předpokládá se, že tento papyrus je kopií jiného mnohem staršího, pravděpodobně vzniklého ve Staré říší kolem 3. tisíciletí před Kristem. V tomto prastarém lékařském textu jsou mimo jiné popisována válečná poranění, která, pokud jsou komplikována hnisáním, vedou ke smrti poraněného. Další velmi zajímavý popis sepse je možné vystopovat u perského lékaře Avicenny známého také jako Ibn Sīnā, který vypozoroval souvislost mezi poraněním a horečkou mající nepříznivou prognózu. V moderní době pak lze chápat za „otce zakladatele“ vědeckého pohledu na sepsi především vídeňského profesora Ignáce Semmelweise, francouzského badatele Louise Pasteura a skotského chirurga Josepha Listera. První opravdu vědeckou definici pak v odborné literatuře publikoval v roce 1914 německý bakteriolog Hugo Schottmüller, který sepsi popsal jako přítomnost ložiska bakteriální infekce v těle, ze kterého se do krevního řečiště uvolňují bakterie. To vede k celkovým symptomům a metastatickým infekcím. I přes pokroky ve výzkumu sepse toto chápání přežilo až do 2. poloviny 80. let a počátku 90. let minulého století, kdy Američan Roger Bone definoval sepsi jako syndrom systémové zánětové reakce (SIRS, systemic inflammatory response syndrome) při infekci. Vedle vytvoření definice SIRS, která byla úplnou novinkou, Roger Bone zcela změnil pohled na mikrobiální původ sepse. Mezi původce sepse nyní zahrnujeme nejen bakterie, ale i viry (např. virus chřipky nebo cytomegaloviry u imunosuprimovaných pacientů), plísně (zvláště kandidy a aspergily) a parazitární agens (např. Plasmodium falciparum, původce tropické malárie).
Boneova definice přišla několik desetiletí po nástupu antibiotické éry, kdy se ukázalo, že problém sepse antibiotika zcela nevyřeší. Díky pokrokům řady oborů medicíny včetně významného zlepšení péče o kriticky nemocné pacienty na jednotkách intenzivní péče se objevila i zcela nová forma sepse, která nemohla být v předchozích dobách patrná. Klasickým příkladem jsou nozokomiální sepse, septicky probíhající virové infekce imunosuprimovaných nemocných či septické komplikace po velkých chirurgických výkonech, které byly umožněny technologickými pokroky. Významně se začaly také uplatňovat populační faktory zahrnující stárnutí obyvatelstva či rychlé přibývání chronicky nemocných s civilizačními chorobami. Je logické, že tyto změny vedly a vedou k intenzivní snaze o přesnější definici sepse.
V roce 1992 byla publikována výše zmíněná první konsenzuální definice sepse. Byla založena na třech klinických a jednom laboratorním příznaku, které vycházely z Boneova konceptu SIRS (tab. 1). Sepse byla pak definována jako SIRS vyvolaný potvrzenou nebo předpokládanou infekcí [9]. Pro stanovení diagnózy sepse bylo nutné splnění alespoň dvou výše uvedených příznaků SIRS. Termínem „těžká sepse“ („severe sepsis“) se pak označoval stav, kdy byla přítomna alespoň jedna akutní orgánová dysfunkce spojená s hypoperfuzí nebo hypotenzí. Sepse, spojená s přetrvávající hypotenzí/hypoperfuzí i přes adekvátní tekutinovou resuscitaci, byla označována jako „septický šok“. I přesto, že jsou tato kritéria, především pro svou jednoduchost, doposud v klinické praxi používána, byla v odborné literatuře opakovaně kritizována pro nepřijatelné nízkou senzitivitu [14, 15].
1. Kritéria podle Boneho et al. (1992 [1]) Table 1. The Bone et al. criteria (1992 [1]) ![Kritéria podle Boneho et al. (1992 [1])
Table 1. The Bone et al. criteria (1992 [1])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c67d2943eb63570d231a6925e194ec6d.jpg)
Pozn: Předpokládaná anebo prokázaná infekce + splnění alespoň dvou z klinicko-laboratorních kritérií Note: Suspected or confirmed infection + at least two of the clinical and laboratory criteria are met V roce 2001 byla panelem expertů prezentována rozšířená revize konsenzuální definice sepse. Terminologie zahrnující sepsi, těžkou sepsi a septický šok byla ponechána pro účely klinické praxe a výzkumu. Definice sepse byla rozšířena o rozsáhlý celý panel klinických symptomů a laboratorních parametrů ke zvýšení senzitivity a specificity (tab. 2). Hlavní cílem revize bylo přiblížit identifikaci sepse reálné klinické praxi a zdůraznit nutnost časného pátrání po zdroji infekce u pacientů s deteriorací klinického stavu. Termín „těžká sepse“ byl vyhrazen pro sepsi komplikovanou orgánovými dysfunkcemi definovanými podle Sequential Organ Failure Assessment (SOFA) skóre. Ve snaze o „staging“ sepse byl navíc prezentován koncept Predisposition-Infection-Response-Organ Dysfunction (PIRO). Septický šok byl u dospělých definován jako přítomnost akutního oběhového selhání s přetrvávající arteriální hypotenzí (systolický arteriální tlak < 90 mm Hg; střední arteriální tlak < 60 mm Hg anebo pokles systolického arteriálního tlaku o více než 40 mm Hg výchozí hodnoty) i přes adekvátní tekutinovou resuscitaci, a při absenci jiných příčin hypotenze [2]. Vzhledem k omezenému množství vědeckých důkazů a relativní složitosti se kritéria z roku 2001 do širší klinické praxe neprosadila tak, jak bylo očekáváno.
2. Kritéria podle Levyho et al. (2001 [2]) Table 2. Levy et al. criteria (2001 [2]) ![Kritéria podle Levyho et al. (2001 [2])
Table 2. Levy et al. criteria (2001 [2])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d8ef1b84930e0741d7e365285aa53299.jpg)
Pozn: Předpokládaná anebo prokázaná infekce + některá z následující klinických a laboratorních kritérií Legenda: SD – směrodatná odchylka, sTK – systolický tlak krve Note: Suspected or confirmed infection + some of the following clinical and laboratory criteria are met Abbreviations: SD – standard deviation; sTK – systolic blood pressure Zjednodušeně lze tedy říci, že definice sepse, septického šoku a orgánových dysfunkcí zůstala po čtvrtstoletí téměř beze změny. I přes obecné uznání definice sepse z roku 1992 ovšem nadále přetrvávaly mezi jednotlivými lékaři značné rozdíly ve schopnosti adekvátního stanovení diagnózy sepse. Z tohoto důvodu a vzhledem k rozšiřujícímu se spektru nových poznatků o epidemiologii sepse, patofyziologii orgánových dysfunkcí, buněčné biologii, biochemii, imunologii a cirkulaci a terapii sepse navrhl celosvětový panel expertů v problematice sepse novou konsenzuální revizi definice sepse a asociovaných pojmů, tzv. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) [3].
SEPSIS-3: HISTORIE A ZÁKLADNÍ CÍLE
V lednu 2014 byla založena pracovní skupina složená z 19 expertů na problematiku infekční, chirurgické, plicní a intenzivní medicíny. Setkání proběhlo z iniciativy dvou významných odborných společností, European Society of Intensive Care Medicine (ESICM) a americké Society of Critical Care Medicine (SCCM). Diskuze probíhaly 12 měsíců do ledna 2015 formou osobních jednání a emailové korespondence. Jako podklad pro argumentaci a statistickou analýzu byly použity údaje z databáze Pittsburgh University Medical Center zahrnující 148 907 pacientů s podezřením na infekční onemocnění (mikrobiologické vyšetření tělesných tekutin a podávání antibiotik). Výsledky analýzy byly poté ověřeny v dalších čtyřech databázích jak v USA, tak i mimo USA, které obsahovaly údaje více než 700 000 pacientů [3].
Panel expertů si jako dva hlavní cíle stanovil:
- snahu o vytvoření nových kritérií, která umožní odlišení nekomplikované infekce od potenciálně život ohrožujícího infekčního onemocnění (sepse), a
- aktualizaci definice sepse a septického šoku v souladu se současným poznáním patofyziologie sepse.
Bylo konstatováno, že sepse není onemocnění, ale syndrom, pro který aktuálně neexistují obecně platná a ověřená diagnostická kritéria. Absence těchto kritérií je zásadním faktorem, který vedl ke značným rozdílům v popisované incidenci a mortalitě spojené se sepsí a septickým šokem. Klinické a laboratorní parametry vedoucí k identifikaci a diagnóze sepse by měly zahrnout všechna stadia sepse (infekční inzult, odpověď hostitelského organismu, orgánové dysfunkce), měly by být jednoduše a rychle stanovitelné a ekonomicky minimálně zatěžující. Tyto parametry by měly být rychle dostupné také pro lékaře v přednemocniční péči, na urgentních příjmech a standardních odděleních nemocnic, aby bylo možné lépe a časněji identifikovat pacienty s infekcí, s rizikem progrese do život ohrožujícího klinického stavu.
SEPSIS-3: PATOFYZIOLOGiCKÉ POZNÁMKY
Sepse již není vnímána jako izolovaný prozánětlivý exces v rámci odpovědi na infekci, ale za komplexní reakci organismu zahrnující skupinu pro - i anti-inflamatorních imunitních procesů vedoucích k rozvoji orgánových dysfunkcí. Zároveň bývají významně ovlivněny i procesy neimunitního charakteru: kardiovaskulární, autonomní, humorální, metabolický a koagulační systém [16]. Přestože orgánové dysfunkce bývají obvykle závažného stupně, nebyla nalezena v selhávajících orgánech přítomnost významného množství buněčných nekróz [17].
Odpověď organismu může být ovlivněna řadou endogenních a exogenních faktorů, které zvyšují biologickou a klinickou heterogenitu sepse. Patří sem věk pacienta, akutní i chronické komorbidity, intervence (např. chirurgický výkon), medikace, typ a lokalizace zdroje infekce [3].
Patofyziologie orgánových dysfunkcí je komplexní a není vysvětlitelná pouhým součtem souběžného patologického vlivu probíhající infekce a zánětlivé odpovědi.
SEPSIS-3: KLÍČOVÉ KONCEPTY
Pracovní skupina doporučila zjednodušení terminologie:
- sjednocení termínů sepse a těžká sepse pod souhrnný výraz sepse,
- nepoužívat nadbytečné termíny, např. septický syndrom, septický stav, a
- nepoužívat úzce vymezené termíny, např. septikémie.
Doposud užívané kritérium splnění alespoň dvou ze čtyř SIRS parametrů je považováno za nedostatečné. Změny v počtu leukocytů, tepové a dechové frekvenci a tělesné teplotě totiž odráží pouze prozánětlivé procesy, které mohou být vyvolány infekčním i neinfekčním inzultem (pankreatitida, rozsáhlá chirurgie, popáleniny).
Parametry SIRS nedostatečně indikují dysregulaci odpovědi a tím stanovení diagnózy život ohrožujícího stavu. Řada hospitalizovaných pacientů splňující definici SIRS nikdy nerozvinou závažnou infekci a jejich klinický výsledek se v zásadě neliší od ostatní populace pacientů [18]. Navíc, jeden z osmi pacientů přijatých do kritické péče pro infekci a orgánovou dysfunkci nesplňuje požadovaný počet dvou ze čtyř SIRS parametrů [15].
Mezi klíčové koncepty sepse podle Sepsis-3 patří:
- Sepse je hlavní příčinou úmrtí na infekci, a to především v případech, kdy není časně rozpoznána a léčena. Diagnostika sepse vyžaduje nejvyšší prioritu a pozornost.
- Sepse je syndrom interakce mezi faktory patogenu i faktory hostitele (genetická predispozice, pohlaví, rasa, věk, komorbidity, prostředí), které se v průběhu času mohou vyvíjet.
- Sepsi odlišuje od prosté infekce nepřiměřená anebo dysregulovaná odpověď organismu a přítomnost orgánových dysfunkcí.
- Orgánové dysfunkce způsobené sepsí můžou probíhat skrytě, jejich přítomnost má být zvážena u každého pacienta s probíhající infekcí. Naopak, nepoznaná infekce může být příčinou nově vzniklé orgánové dysfunkce. Jakákoliv jinak nevysvětlitelná orgánová dysfunkce zvyšuje pravděpodobnost skryté infekce.
- Klinický a biologický fenotyp sepse může být modifikován preexistujícím akutním onemocněním, chronickými komorbiditami, medikací a intervencemi.
- Specifické infekce mohou vyústit v orgánovou dysfunkci bez generalizované a dysregulované systémové odpovědi.
SEPSIS-3: DEFINICE SEPSE A SEPTICKÉHO ŠOKU
Podle návrhu Sepsis-3 je sepse aktuálně definovaná jako život ohrožující orgánová dysfunkce způsobená nepřiměřenou, dysregulovanou odpovědí hostitelského organismu na infekci. Důraz je kladen na fakt, že tato nepřiměřená odpověď organismu na infekci nevede ve svém výsledku k obnovení homeostázy, ale naopak k poškození vlastních tkání a orgánů. Může tedy pacienta ohrozit na životě a díky tomu vyžaduje včasné rozpoznání. Již mírný stupeň orgánových dysfunkcí je spojen se zásadním zvýšením mortality. Patologické procesy vedoucí k orgánové dysfunkci probíhají zejména na buněčné úrovni.
Septický šok je podle Sepsis-3 definován jako podskupina sepse (tab 3.). Lze ho definovat jako přítomnost sepse a:
- přetrvávající hypotenze vyžadující aplikaci vazopresorické podpory, např. noradrenalinu, k dosažení hodnot středního arteriálního tlaku (MAP) ≥ 65 mm Hg;
- elevace hladiny sérového laktátu ≥ 2 mmol/l i přes adekvátní tekutinovou resuscitaci.
3. Kritéria Sepsis-3, podle Singera et al., terminologie [3] Table 3. Sepsis-3 criteria according to Singer et al., terminology [3] ![Kritéria Sepsis-3, podle Singera et al., terminologie [3]
Table 3. Sepsis-3 criteria according to Singer et al., terminology [3]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/000e27f9580963487bf31422ab7b5c54.jpg)
Legenda: SOFA, Sequential (Sepsis-related) Organ Failure Assessment; qSOFA, quick SOFA; MAP, mean arterial pressure *Odhad mortality je přibližně 10% ve všeobecné nemocniční populaci s podezřením na infekci. Abbreviations: SOFA – Sequential (Sepsis-related) Organ Failure Assessment; qSOFA – quick SOFA; MAP – mean arterial pressure *The estimated mortality is around 10% for the general hospital population with suspected infection. Probíhající patologické procesy se u septického šoku dostávají z buněčné úrovně na systémovou, především kardiovaskulární, úroveň, a mají intenzitu dostatečnou k zásadnímu ovlivnění klinického výsledku. Nemocniční mortalita septického šoku přesahuje 40 %.
SEPSIS-3: KLINICKÉ PARAMETRY PRO IDENTIFIKACI SEPSE
Ke stanovení diagnózy sepse je – podle Sepsis-3 – nutná přítomnost orgánových dysfunkcí, které vznikají na podkladě infekce. Tyto funkční orgánové změny jsou spojovány s významně komplexnější patofyziologií sepse ve srovnání s prostým infekčním onemocněním, a je faktorem vedoucím k významnému vzestupu mortality. Jak bylo výše uvedeno, již kritéria z roku 2001 se snažila diagnostiku sepse zpřesnit zařazením celé řady doplňujících klinických a laboratorních parametrů (n = 21), které mohou sloužit k identifikaci orgánových dysfunkcí (viz tab. 2) [2].
Sepsis-3 doporučuje pro identifikaci pacientů s rizikem sepse použití tzv. Sequential Organ Failure Assessment (SOFA) skóre (tab. 4). Orgánová dysfunkce v rámci sepse je nově definovaná jako akutní změna v celkové hodnotě SOFA skóre o ≥ 2 vznikající v souvislosti s infekcí. Výchozí hodnota SOFA skóre je považována za nulovou, pokud pacient neměl známky akutní či chronické orgánové dysfunkce před rozvojem infekce. Hodnota SOFA skóre ≥ 2 znamená přibližně 10% riziko úmrtí v obecné populaci pacientů s infekcí [19], což je například více než riziko celkové mortality na infarkt myokardu s elevací ST úseku (8,1 %) [20]. Dále vzestup SOFA skóre o ≥ 2 představuje 2–25násobný vzestup rizika úmrtí oproti pacientům se SOFA skóre < 2 [19].
4. Sequential Organ Failure Assessment (SOFA) skóre Table 4. Sequential Organ Failure Assessment (SOFA) score 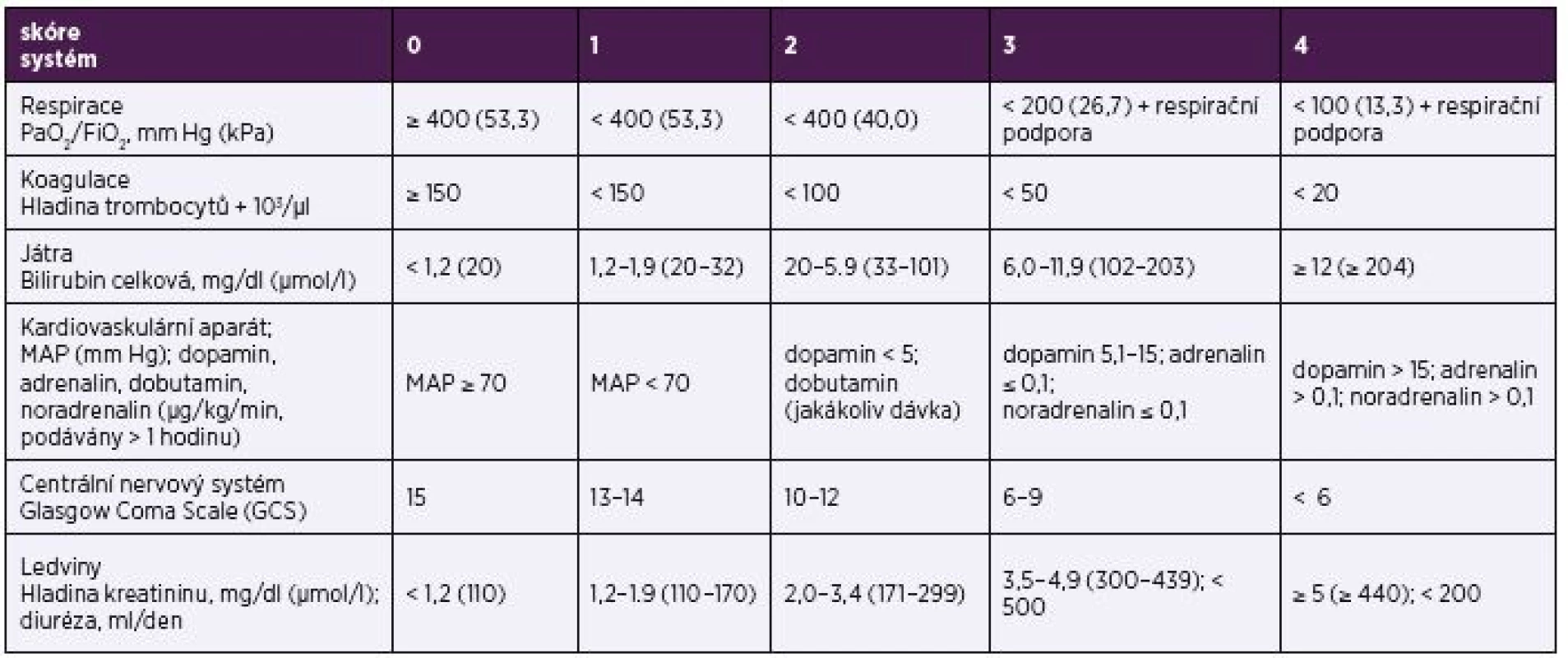
Legenda: SOFA – Sequential Organ Failure Assessment, MAP – mean arterial pressure, GCS – Glasgow Coma Scale, PaO2 – partial pressure of oxygen, FiO2 (fraction of inspired oxygen) – inspirační koncentrace kyslíku Abbreviations: SOFA – Sequential Organ Failure Assessment; MAP – mean arterial pressure, GCS – Glasgow Coma Scale, PaO2 – partial pressure of oxygen; FiO2 – fraction of inspired oxygen Prediktivní hodnota SOFA skóre ve vztahu k mortalitě (AUROC = 0,74; 95% CI, 0,73–0,76; p < 0,001) u pacientů v intenzivní péči je signifikantně vyšší než prediktivní hodnota parametrů SIRS (AUROC = 0,64; 95% CI, 0,62 až 0,66). U pacientů mimo intenzivní péči byla prediktivní hodnota SOFA skóre (AUROC 0,79; 95% CI, 0,78–0,80) a změny SOFA skóre (o ≥ 2 body) srovnatelná s parametry SIRS (AUROC 0,76; 95% CI, 0,7500,77). SOFA skóre je určeno především pro použití v podmínkách intenzivní péče [3].
Nespornou výhodou SOFA skóre je, že:
- jeho význam byl již ve vztahu k riziku mortality extenzivně ověřen,
- je přijata větší částí odborné veřejnosti zabývající se péčí o kriticky nemocné a
- některé z použitých parametrů jsou ve standardní praxi součástí rutinní krevní analýzy.
Na druhou stranu, z hlediska praktické aplikovatelnosti, je právě velký počet hodnocených parametrů, z nichž celá řada vyžaduje provedení odběrů krve, nevýhodou SOFA skóre. Tato skutečnost může být vnímána i jako nevýhoda i z ekonomického hlediska, snižující použitelnost SOFA skóre v zemích s nízkými a středními příjmy, tzv. low and middle income countries (LMICs) [21]. Skóre obsahuje některé již minimálně užívané parametry, např. dávkování dopaminu. Navíc, v současnosti existuje řada nových biomarkerů zrychlujících a zpřesňujících diagnostiku orgánových dysfunkcí, které nejsou v SOFA skóre zohledněny. Přestože nejsou tyto biomarkery v současnosti dostatečně validovány ve vztahu k sepsi, autoři Sepsis-3 připouštějí nutnost budoucí aktualizace parametrů SOFA skóre.
Pro screening pacientů s infekcí a vyšším mortalitním rizikem v podmínkách mimo intenzivní péči je doporučeno použití skóre quick SOFA (qSOFA), založeného na jednoduchém klinickém hodnocení stavu vědomí, krevního tlaku a dechové frekvence (tab. 5). Prediktivní hodnota qSOFA (AUROC = 0,81; 95% CI, 0,80–0,82) je u této populace pacientů srovnatelná se SOFA skóre.
5. Quick Sequential Organ Failure Assessment (qSOFA) skóre Table 5. Quick Sequential Organ Failure Assessment (qSOFA) score 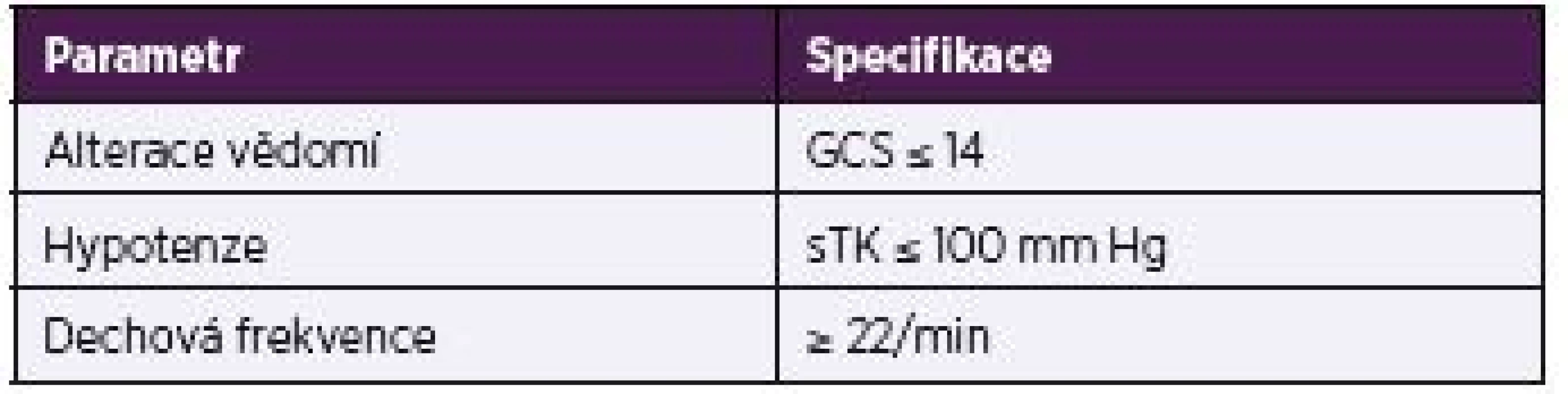
Pozn: musí být splněna alespoň 2 kritéria Legenda: GCS – Glasgow Coma Scale, sTK – systolický krevní tlak Note: at least two criteria are met Abbreviations: GCS – Glasgow Coma Scale; sTK – systolic blood pressure Shrnutí: stanovení SOFA skóre je často mimo intenzivní péči z mnoha důvodů obtížné, především díky sporadické indikaci k některým pravidelným laboratorním vyšetřením (viz dříve). Na druhou stranu validní výpočet qSOFA je zase obvykle významně ztížen v podmínkách intenzivní péče, a to především vzhledem k ovlivnění jednotlivých parametrů užitím některých intervencí, především umělé plicní ventilace a farmakoterapie (např. analgosedativní a vazoaktivní terapie) [3].
SEPSIS-3: PŘEDNOSTI
Za jednoznačný a hlavní přínos Sepsis-3 lze považovat snahu o rozšíření obecného povědomí o závažnosti sepse i mimo prostřední intenzivní péče. Jedná se o hodnocení pacientů již v přednemocniční péči, na příjmových ambulancích, urgentním oddělení, ale především na odděleních standardní péče nemocnic nižšího i vyššího typu. Právě zde vzniká velká většina nových případů sepse.
Od nové definice se očekává jednodušší a efektivnější identifikace pacientů, kteří jsou ohroženi rizikem rozvoje orgánových dysfunkcí. U těchto pacientů by pak měly být zahájeny nebo eskalovány příslušné monitorovací a terapeutické intervence, popř. by měl být indikován překlad na oddělení intenzivní péče. Časné zahájení adekvátní terapie je hlavním faktorem pozitivně ovlivňujícím klinický výsledek pacientů se sepsí, především ve smyslu snížení mortality.
Za další výhody Sepsis-3 lze považovat:
- Zařazení orgánových dysfunkcí do diagnózy sepse, což by mohlo přinést lepší odlišení sepse od nekomplikovaného infekčního onemocnění.
- V podmínkách mimo intenzivní péči je k diagnostice sepse výhodné použít jednoduché zhodnocení základních vitálních funkcí pomocí qSOFA skóre, kdy k jejímu hodnocení stačí pouze fyzikální vyšetření a tlakoměr. U kriticky nemocných pacientů je problematika diagnostiky sepse podstatně obtížnější. Stanovení diagnózy je komplikováno kombinací symptomatologie základního a přidružených onemocnění, dynamikou klinického stavu, efektem terapie, komplikacemi klinického stavu a intervencí. V intenzivní péči má z těchto důvodů qSOFA skóre jen omezenou použitelnost, a je doporučeno použití SOFA skóre a jeho změna o ≥ 2.
- SOFA skóre je historicky ověřeno a přijato nejen pro svou schopnost hodnocení orgánových dysfunkcí, ale i pro významnou prediktivní hodnotu stran stanovení klinického výsledku. Zařazení změny SOFA skóre ≥ 2 do diagnostiky lze v tomto kontextu chápat jako snahu o výraznější respektování dynamiky klinického stavu a individualizaci přístupu k pacientovi.
- Od Sepsis-3 se očekává přesnější definice orgánové dysfunkce a septického šoku, snížení nepřesnosti ve stanovení reálné incidence a mortality sepse. Popis incidence septického šoku se doposud v různých publikacích výrazně lišil, a to až 10krát u septického šoku a 4krát u mortality [22]. Předpokladem je také, že Sepsis-3 by mohla zvýšit schopnost epidemiologických studií adekvátně zhodnotit reálný dopad sepse na zdravotní péči.
- Definice septického šoku je podle Sepsis-3 primárně určena ke zvýšení přesnosti kódování diagnózy a epidemiologického sledování.
SEPSIS-3: KONTROVERZE
Sepsis-3 definice byla akceptována řadou významných odborných společností (SCCM, ESICM, Surviving Sepsis Campaign, American Thoracic Society, American Association of Critical Care Nurses a další) s doporučením co nejrychlejšího zavedení do běžné klinické praxe. Význam definice byl navíc zvýrazněn i recentní aktualizací doporučení pro léčbu sepse tzv. Surviving Sepsis Campaign Guidelines [23]. Na druhou stranu, řada dalších odborných společností (American College of Emergency Physicians, Society for Academic Emergency Medicine, American College of Chest Physicians, Infectious Diseases Society of America, a další) novou definici z důvodu jejích kontroverzí nepodpořila.
Za kontroverze nové definice a kritérií lze považovat:
- qSOFA skóre bylo primárně určeno jako prediktor klinického výsledku (mortality) a ne jako diagnostického nástroje sepse.
- Senzitivita parametrů SOFA je stále relativně nízká.
- Redukce počtu parametrů v rámci qSOFA, může vést k dalšímu omezení diagnostické senzitivity zvyšující riziko opožděné diagnózy.
- Některé z parametrů v SOFA skóre (vazopresorická podpora) i v definici septického šoku (elevace laktátu) přesouvají těžiště diagnózy do již závažnějšího stavu, čímž se opět může oddálit včasné stanovení diagnózy.
- Změna definice v situaci, kdy Sepsis-1 byla již téměř zcela akceptovaná na akademické úrovni a také mimo univerzitní nemocniční prostředí, může vést u některých lékařů paradoxně k prohloubení diagnostické nejistoty.
- Některé laboratorní parametry, které jsou součástí SOFA skóre (bilirubin) a diagnózy septického šoku (laktát) nepatří mezi standardně vyšetřované parametry v LMICs.
- Kódování a vykazování diagnózy, které je v řadě zemí založeno na kritériích z roku 1992 (sepse, těžká sepse, septický šok), přičemž proces změn bude pravděpodobně legislativně, administrativně i ekonomicky náročný.
- Opuštění parametrů SIRS je podle řady odborníků chybné, protože tyto parametry jsou také schopny uspokojivě identifikovat vyšší riziko orgánových dysfunkcí, a tím morbidity a mortality, a dále stratifikovat stupeň závažnosti klinického stavu [21].
Je nutné zdůraznit, že především první definice sepse z roku 1992 představovala, i přes své limitace, široce akceptovaný standard diagnostiky sepse v klinické praxi i v rámci významných klinických studií. Přitom právě na podkladě výsledků těchto prací byla následně postulována doporučení pro léčbu sepse a septického šoku, která vedla ke snížení mortality v souvislosti se sepsí o 20–40 % [12].
Autoři Sepsis-3 připouštějí, že z pohledu managementu sepse nová kritéria nepřináší jednoznačnou a definitivní představu o komplexnosti problematiky. Jakékoliv pokroky v této problematice vždy byly, jsou a budou pouze pozvolné a postupné. Dále autoři uvádí, že v budoucnu bude nutné opětovně přehodnocovat nové poznatky o sepsi, a navrhují výhledově například úpravu parametrů SOFA skóre do podoby SOFA-lite skóre vhodnějšího, např. pro LMICs [3].
SEPSIS-3: SHRNUTÍ ZMĚN
Nejdůležitější změny, které Sepsis-3 přináší, lze tedy shrnout do několika bodů:
- Sepse je život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí organismu hostitele na infekci.
- Žádný z dříve používaných klinických ani laboratorních parametrů SIRS není zahrnut. Autoři ovšem zároveň uvádějí, že parametry SIRS mají nadále své místo v klinické praxi a mají být pro kliniky podnětem k intenzivnímu pátrání po případném zdroji infekce.
- Orgánová dysfunkce je definována jako akutně vzniklá změna v SOFA skóre.
- Skórovací systém qSOFA je doporučen k jednoduchému klinickému hodnocení a identifikaci rizikových pacientů.
- Používání termínu „těžká sepse“ není doporučeno. Tento stav je nově zahrnut pod souhrnný termín „sepse“.
- Septický šok je definován paralelní přítomností oběhové nedostatečnosti a abnormit na úrovni buněčného metabolismu (sérový laktát ≥ 2 mmol/l) vzniklých na podkladě sepse.
- Sepse je ve srovnání se závažnou infekcí vnímána jako život ohrožující stav.
ZÁVĚR
Sepsis-3 je dalším důležitým mezníkem na náročné cestě s cílem optimalizace diagnostiky a managementu sepse. Snaží se o výraznější respektování patofyziologie orgánových dysfunkcí vznikajících při tomto závažném klinickém stavu, způsobeném infekcí. Klade si za cíl zpřesnit a zrychlit identifikaci skupiny pacientů s infekcí, kteří jsou v riziku rozvoje život ohrožujících orgánových dysfunkcí, především v podmínkách mimo intenzivní péči. Současně dává na vědomí, že každá změna klinického stavu ve smyslu zhoršujících se orgánových funkcí má být pro kliniky podnětem pro aktivní pátrání po případném zdroji infekce. Vzhledem k aktuálnímu postoji odborné veřejnosti je zřejmé, že vzhledem ke komplexnosti syndromu bude pravděpodobně tato konsenzuální definice přijímána odbornou veřejností a zdravotnickou administrativou spíše pomalu a obtížně. Navíc je nutné vzít v úvahu fakt, že až budoucí prospektivní epidemiologické a klinické studie a vlastní klinická praxe, přinesou odpověď, zda je zavedení Sepsis-3 smysluplné, a získá převahu nad parametry SIRS v rámci diagnostiky jednoho z nejzávažnějších a nejnebezpečnějších syndromů v medicíně – sepsi.
Poděkování
Práce byla podpořena projektem MO1012 a SVV č. 260 369.
Do redakce došlo dne 24. 4. 2017.
Adresa pro korespondenci:
MUDr. Jan Máca
KARIM Fakultní nemocnice Ostrava-Poruba
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jan.maca@fno.cz
Sources
1. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992;101(6):1644–1655.
2. Levy MM, Fink MP, Marshall JC, et al.; SCCM/ESICM/ACCP/ATS/SIS. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med 2003;31(4):1250–1256.
3. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315(8):801–810.
4. Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis. Virulence 2014;5(1):4–11.
5. Singer M. The new sepsis consensus definitions (Sepsis-3): the good, the not-so-bad, and the actually-quite-pretty. Intensive Care Med 2016;42(12):2027–2029.
6. Dombrovskiy VY, Martin AA, Sunderram J, et al. Facing the challenge: decreasing case fatality rates in severe sepsis despite increasing hospitalizations. Crit. Care Med 2005;33(11):2555–2562.
7. Dombrovskiy VY, Martin AA, Sunderram J, et al. Rapid increasein hospitalization and mortality rates for severe sepsis in the Uni-ted States: a trend analysis from 1993 to 2003. Crit Care Med 2007;35(5):1244–1250.
8. Iwashyna TJ, Cooke CR, Wunsch H, et al. Population burden of long-term survivorship after severe sepsis in older Americans. J Am Geriatr Soc 2012;60(6):1070–1077.
9. Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign Guidelines Committee Including the Pediatric Subgroup. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 2013;41(2):580–637.
10. Vincent J-L, Marshall JC, Namendys-Silva SA, et al. ICON Investigators. Assessment of the worldwide burden of critical illness: the Intensive Care Over Nations (ICON) audit. Lancet Respir Med 2014;2(5):380–386.
11. Iwashyna TJ, Ely EW, Smith DM, et al. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA 2010;304(16):1787–1794.
12. Martin GS, Mannino DM, Eaton S, et al. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med 2003;348(16):1546–1554.
13. Torio CM, Andrews RM. National inpatient hospital costs: the most expensive conditions by payer, 2011. Statistical Brief #160. Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. August 2013. Dostupné na www: http://www.ncbi.nlm.nih.gov/books/NBK169005/. Accessed October 31, 2015.
14. Vincent JL Dear SIRS, I‘m sorry to say that I don‘t like you... Crit Care Med 1997;25(2):372–374.
15. Kaukonen KM, Bailey M, Pilcher D, et al. Systemic inflammatory response syndrome criteria in defining severe sepsis. N Engl J Med 2015;372 : 1629–1638.
16. Singer M, De Santis V, Vitale D, et al. Multiorgan failure is an adaptive, endocrine mediated, metabolic response to overwhelming systemic inflammation. Lancet 2004;364(9433):545–548.
17. Hotchkiss RS, Swanson PE, Freeman BD, et al. Apoptotic cell death in patients with sepsis, shock,and multiple organ dysfunction. Crit Care Med 1999;27(7):1230–1251.
18. Churpek MM, Zadravecz FJ, Winslow C, et al. Incidence and prognostic value of the systemic inflammatory response syndrome and organ dysfunctions in ward patients. Am J Respir Crit Care Med 2015;192(8):958–964.
19. Seymour CW, Coopersmith CM, Deutschman CS, et al. Application of a Framework to Assess the Usefulness of Alternative Sepsis Criteria. Crit Care Med 2016;44(3):e122–130.
20. Shah RU, Henry TD, Rutten-Ramos S, et al. Increasing percutaneous coronary interventions for ST-segment elevation myocardial infarction in the United States: progress and opportunity. JACC Cardiovasc Interv 2015;8(1ptB):139–146.
21. Sprung CL, Schein RMH, Balk RA. The new sepsis consensus definitions: the good, the bad and the ugly. Intensive Care Med 2016;42(12):2024–2026.
22. Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315 : 775–787.
23. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017;43(3):304–377.
Labels
Allergology and clinical immunology Dermatology & STDs Paediatric dermatology & STDs Hygiene and epidemiology Medical virology Clinical microbiology Laboratory
Article was published inEpidemiology, Microbiology, Immunology

2018 Issue 1-
All articles in this issue
- Viral hepatitis A – seroprevalence and vaccine coverage rate in the South Moravian Region
- A new definition of sepsis (Sepsis-3) – aims, advantages, and controversies
- West Nile virus (lineage 2) in mosquitoes in southern Moravia – awaiting the first autochthonous human cases
- Nosocomial candidemia in the Czech Republic in 2012–2015: results of a microbiological multicentre study
- Human Rhinoviruses A9, A49, B14 and Echovirus 3, 9 among the patients with acute respiratory infection
- Lectins from Eichornia crassipens and Lemna minor may be involved in Vibrio Cholerae El Tor adhesion
- The invasive mosquito Aedes albopictus (Diptera, Culicidae) firstly recorded in Bohemia, Czech Republic
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A new definition of sepsis (Sepsis-3) – aims, advantages, and controversies
- Nosocomial candidemia in the Czech Republic in 2012–2015: results of a microbiological multicentre study
- West Nile virus (lineage 2) in mosquitoes in southern Moravia – awaiting the first autochthonous human cases
- Viral hepatitis A – seroprevalence and vaccine coverage rate in the South Moravian Region
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

