-
Medical journals
- Career
Průtoková cytometrie v mikrobiologii
: A. Lochmanová 1,2; D. Chmelař 1,3; V. Beran 1; M. Hájek 1,4
: Katedra biomedicínských oborů, Lékařská fakulta Ostravské univerzity, Ostrava 1; Oddělení imunologie a alergologie, Zdravotní ústav se sídlem v Ostravě, Ostrava 2; Referenční laboratoř ČR pro anaerobní bakterie, Lékařská fakulta Ostravské univerzity, Ostrava 3; Centrum hyperbarické medicíny, Městská nemocnice, Ostrava 4
: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 4, s. 182-188
: Review Article
Průtoková cytometrie je metoda, která umožňuje simultánní měření a analýzu fyzikálních a chemických vlastností buňky nebo jiných biologických částic během jejich průchodu laserovým paprskem. I když je tato metoda využívána především při studiu buněčné diferenciace a funkční analýzy eukaryotických buněk, základní principy průtokové cytometrie se dají aplikovat i na mikroorganismy. Metody založené na analýze jedné buňky, jako je průtoková cytometrie v kombinaci s měřením buněčné viability pomocí speciálních fluorescenčních sond umožňují hlubší vhled do různorodosti populací a fungování mikrobiálních společenstev a také usnadňují pochopení fyziologické různorodosti zdánlivě podobně působících populací. Při užití specifických fluorescenčních barviv pro selektivní značení vybraných druhů mikroorganismů, je metoda potenciálně velmi specifická. Cílem tohoto sdělení je stručný přehled aplikací průtokové cytometrie, které je možno využít v mikrobiologii.
Klíčová slova:
průtoková cytometrie – mikrobiologie – buněčná identifikace – buněčná viabilita – fluorescenční sondaÚVOD
Cytometrie je obecný název pro skupinu biologických metod používaných pro měření různých parametrů buněk. Parametry, které mohou být měřeny cytometrickými metodami, zahrnují např. velikost a morfologii buněk, fáze buněčného cyklu, obsah DNA, existenci nebo neexistenci specifických proteinů na buněčném povrchu nebo v cytoplazmě a řadu dalších. Metody klasické (analytické) cytometrie využívají pro analýzu vlastností buněk optické technologie založené především na bázi mikroskopie. Průtoková cytometrie je moderní analytická metoda umožňující simultánní měření a analýzu fyzikálních a chemických vlastností buňky nebo jiných biologických částic během jejich průchodu laserovým paprskem. Její jedinečnost spočívá v možnosti analýzy mnoha vlastností a charakteristik na úrovni jedné buňky, a to opakovaně ve vzorku o velkém množství buněk během velmi krátkého časového úseku. I když většina komerčně dostupných průtokových cytometrů byla původně konstruována pro analýzu eukaryotních buněk (např. lymfocytů), v současné době je stále častěji využívána i v dalších oblastech buněčné biologie. Průtoková cytometrie může být využita např. ke studiu autofluorescenčních vlastností fotosyntetického planktonu, na základě kterých lze určit jeho množství a strukturu jednotlivých společenství. V proteinovém inženýrství se průtoková cytometrie používá pro identifikaci buněk založené na základě exprese povrchových proteinových variant spojených s určitými požadovanými vlastnostmi. V posledních letech roste počet aplikací průtokové cytometrie i v mikrobiologii.
První informace o průtokové cytometrii byla publikována v roce 1934 Moldavanem, jako praktická metoda využívaná pro analýzu buněk v suspenzi byla zavedena až ve 40. letech minulého století. V roce 1947 aplikoval Gucker tuto metodu pro detekci bakterií v aerosolu. Následný rozvoj této techniky vedl k dalšímu využití v mikrobiologii jako např. sledování kinetiky buněčného cyklu, rozlišení grampozitivních a gramnegativních bakterií, stanovení životaschopnosti buněk na základě sledování metabolické aktivity buňky nebo integrity buněčné membrány [12, 28, 31].
Průtokový cytometr je složen z několika základních součástí, a to excitačního zdroje, měřící optické cely, fotodetektorů, systému zrcadel, optických filtrů a několika fluorescenčních detektorů seřazených podle vzrůstající vlnové délky emitované fluorescence. Excitačním zdrojem bývá nejčastěji laser, nejčastěji používaným laserem je vzduchem chlazený argonový laser, který emituje záření s vlnovou délkou 488 nm. V měřící cele dochází ke střetu světla z excitačního zdroje a procházejícími buňkami. Světlo se pak rozptýlí, odrazí nebo vyvolá fluorescenci. Při průchodu buňky paprskem světla je analyzováno kvantum fotonů dopadajících na fotodetektor zařazený jednak ve směru původního paprsku (označovaný jako „forward scatter“ – FSC) a dále pod úhlem 90° („side scatter“ – SSC). Intenzita paprsků dopadajících na FSC je přímo úměrná velikosti buňky, intenzita paprsků tvořících úhel bočního lomu světla (SSC) odráží vnitřní komplexitu buněk a je úměrná granularitě buňky (stav cytosolu, buněčné inkluze, granula atd.) – obrázek 1. Fluorescence patří mezi fotoluminiscenční jevy vyvolané světelným zářením z oblasti viditelného popř. ultrafialového světla. K fluorescenci dochází pouze při dodávání energie, respektive při ozařování excitačním zářením. Fluorescence emitovaná jednotlivými fluorochromy je detekována pomocí specifických fluorescenčních kanálů umožňujících volbu vlnové délky analyzovaného signálu pomocí soustavy optických filtrů a zrcadel. Základní vlastností všech fluorochromů je schopnost absorbovat a emitovat světlo o specifické vlnové délce. Po absorpci světelné energie se fluorochromy dostávají do nestabilního excitovaného stavu, kdy jsou elektrony posunuty do vyšší energetické hladiny. Při návratu elektronů do stabilního neexcitovaného stavu dochází k uvolnění energie ve formě emitovaného světla. Vlnová délka použitá k excitaci fluorochromu je vždy kratší než vlnová délka světla emitovaného (tzv. Stokesův posun). Každá fluorescenční látka má svá charakteristická excitační a emisní pásma. Některé fluorochromy (DAPI, ethidium bromid, propidium jodid) se samy o sobě vážou na určité molekuly a jsou zodpovědné za přirozenou fluorescenci vzorku. Pro většinu struktur v buňce ovšem neexistuje fluorofor, který by se na ně specificky vázal. Pro biologický výzkum se proto využívají tzv. nevlastní fluorochromy, které se uměle zavedou do studovaného systému a které nesou jasně definované excitační a emisní maxima. Pokud v experimentu používáme více fluorochromů, může dojít k situaci, kdy z důvodu překryvu vlnových délek signál určitého fluorochromu zároveň obsahuje určitý podíl i signálu fluorochromu sousedícího. To může v konečném důsledku vést k chybným interpretacím signálu a být důvodem nesprávných experimentálních výsledků. Pro experimenty se simultánní detekcí dvou a více fluorochromů je třeba kombinovat fluorochromy s optimálními spektry. Problém překryvu lze vyřešit i korekcí emisního pásma tzv. kompenzací.
1. Dvouparametrový dot plot zobrazující bakteriální populaci na základě přímého (FSC) a bočního (SSC) rozptylu světla Figure 1. Two-parameter dot plot representing the bacterial population based on forward scatter (FSC) and side scatter (SSC) 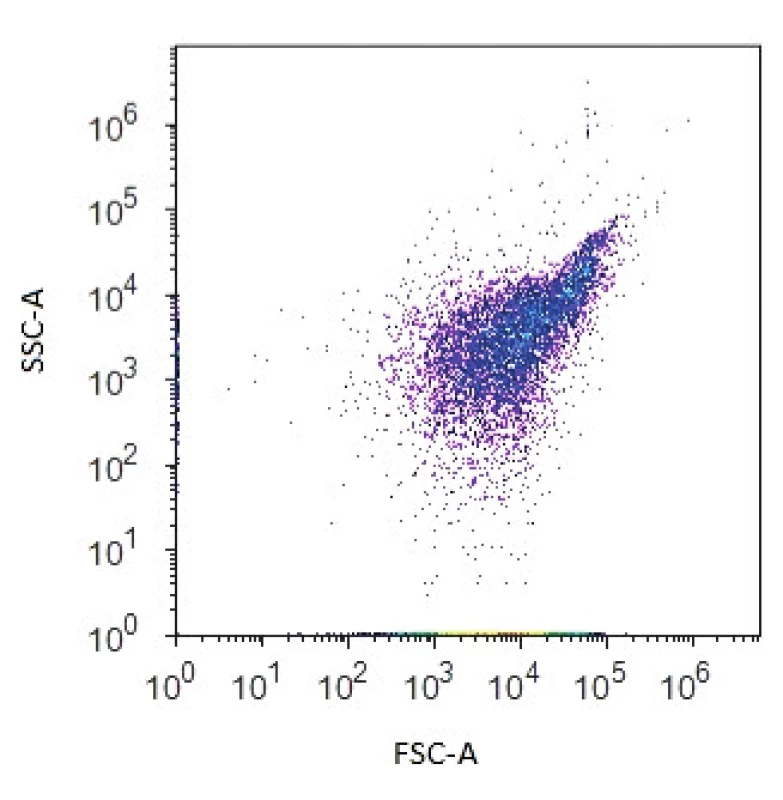
Optické signály jsou v detektorech převáděny na elektrické impulsy, které jsou dále digitálně zpracovávány. Výsledek je vyjádřen graficky v podobě jednoparametrového histogramu nebo dvouparametrově pomocí tzv. dot plotů (obr. 2).Detekovat je možno několik zdrojů buněčné fluorescence, od autofluorescence pigmentů přes použití různých fluorochromů , které se vážou nebo reagují s jednotlivými molekulami buněk. Hlavní výhodou této techniky je tzv. multiparametrová analýza, což je možnost simultánního shromáždění dat o jednotlivých buňkách vztahujících se k jejich velikosti, granularitě a intracelulárním komponentám, které lze následně kombinovat [11, 24, 36].
2. Grafické vyjádření výsledku v podobě dvouparametrového dotplotu. Na osu x se vynáší jeden z parametrů, v tomto případě přítomnost elementů značených FITC (Fluoresceinisothiocyanate). Na osu y se vynáší druhý z parametrů, v tomto případě se jedná o navázání fluorochromu PE (Phycoerythrin). Graf bývá rozdělen do 4 kvadrantů: – v levém horním kvadrantu jsou buňky pozitivní pouze pro znak vynesený na ose y, v tomto případě buňky pozitivní pro znak značený PE; – v pravém horním kvadrantu jsou buňky pozitivní pro znaky vynesené na obou osách (x, y), resp. dvojitě pozitivní buňky exprimující znaky vázající jak PE, tak FITC; – v levém dolním kvadrantu jsou buňky negativní pro oba sledované znaky; – v pravém dolním kvadrantu jsou buňky pozitivní pouze pro znak vynesený na ose x, v tomto případě buňky pozitivní pro znak značený FITC. Figure 1. Graphical expression of the result in the form of a two-parameter dot plot One of the parameters, in this case the presence of FITC (fluoresceinisothiocyanate) labelled elements, is plotted on the x axis. The other parameter, in this case fluorochrome-PE (phycoerythrin) conjugate, is plotted on the y axis. The graph is divided into four quadrants: – in the upper-left quadrant, there are cells positive only for the parameter plotted on the y axis; in this case, the cells positive for the PE labelled element; – in the upper-right quadrant, there are cells positive for the parameters plotted on both the x and y axes, i.e. double positive cells expressing the elements binding both PE and FITC; – in the lower-left quadrant, there are cells negative for both elements studied; – in the lower-right quadrant, there are cells positive only for the parameter plotted on the x axis, in this case, for the FITC-labelled element. 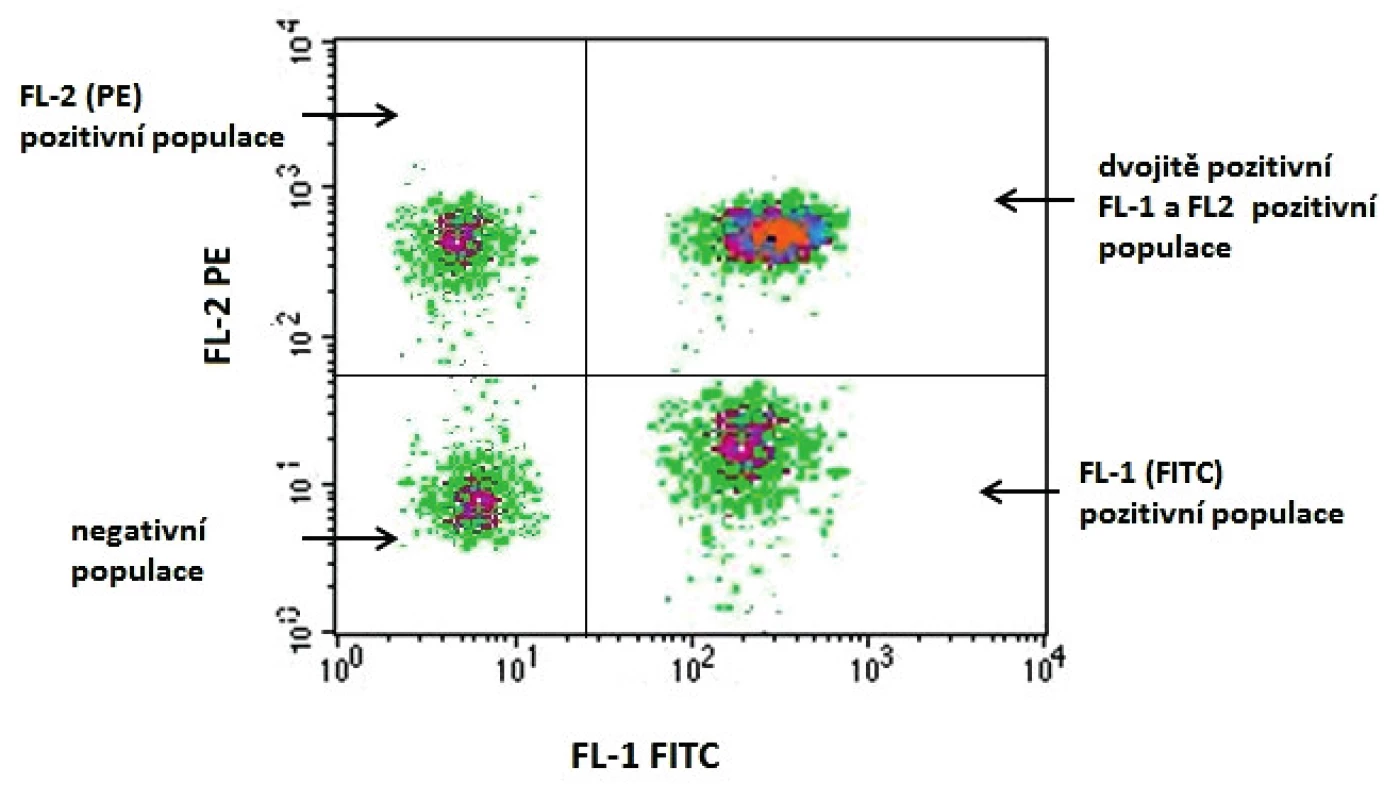
ÚSKALÍ PRŮTOKOVÉ CYTOMETRIE V MIKROBIOLOGII
I když průtoková cytometrie byla využívána od roku 1960 především jako nástroj pro analýzu krevních buněk, pokrok ve vývoji přístrojové optiky a elektroniky stejně jako v oblasti fluorescenčních sond umožnily využít tuto metodu i ke studiu dalších biologických systémů. Hlavním faktorem, který omezuje použití průtokové cytometrie na poli prokaryot, respektive bakterií, je jejich malá velikost, která znesnadňuje jejich detekci v důsledku obtížného rozlišení mezi malými buňkami a buněčnou drtí. Průběh analýzy průtokovým cytometrem mohou narušit i buněčné agregáty tvořené bakteriálními řetězci nebo shluky buněk, protože tato technika identifikuje buňky procházející vyšetřovacím bodem jako jednotlivé události a nemůže rozlišovat mezi jednotlivými buňkami a buněčnými agregáty. Z tohoto důvodu je nutné vzorek před analýzou na průtokovém cytometru dobře zhomogenizovat.
Druhým problémem aplikace průtokové cytometrie v oblasti mikrobiologie je otázka použití fluorescenčních barviv, respektive sond. Bakterie jsou obecně méně propustné pro fluorochromy než savčí buňky, navíc řada bakterií má velmi účinné efluxní pumpy. V takových případech může být barvivo vyloučeno ven z buňky velmi rychle. Svou roli hraje i stavba zevní buněčné membrány, např. na rozdíl od G+ bakterií, zevní membrána G-bakterií vylučuje většinu lipofilních nebo hydrofobních molekul, jako jsou např. cyaninová barviva [35,40].
Používané fluorochromy lze rozdělit podle mechanismu účinku zhruba do tří skupin. Do první skupiny řadíme barviva, jejichž vstupu do buňky brání intaktní buněčná membrána, např. propidium iodid (PI). Významným cílovým místem pro vazbu PI po prostupu buněčnou membránou je DNA, a proto se často využívá nejen k určení životnosti buněk, ale zejména u eukoaryotních buněk k analýze buněčného cyklu. Další skupinu tvoří barviva, která se akumulují v metabolicky aktivních buňkách (např. rhodamine 123), do třetí skupiny je možno zařadit non-fluorogenní prekurzory, které jsou konvertovány do stadia fluorochromu prostřednictvím specifických enzymů přítomných v životaschopné buňce (např. diacetylfluorescein). Pokud se molekula barviva váže na biologickou matici kovalentně, nazývá se fluorescenční značka, pokud se váže nekovalentně, označuje se jako fluorescenční sonda [29].
Významné uplatnění při detekci a identifikaci savčích buněk na základě exprese určitých specifických znaků (CD markerů) našly v průtokové cytometrii fluorescenčně značené monoklonální protilátky. V mikrobiologii není jejich využití tak široké, limitujícím faktorem může být i jejich poměrně vysoká cena. Použití značených protilátek je preferováno při detekci bakterií, hub nebo prvoků zejména tam, kde buňky jsou přítomny buňky ve velmi nízkých koncentracích, např. ve vzorcích pitné vody nebo kontrole potravinářských výrobků. Další oblastí využití je studium exprese povrchových struktur důležitých pro imunitní rozpoznání a adhezi.
Specifické struktury na povrchu bakterií představují lektiny. I ty mohou být konjugovány s fluorescenčními barvivy a následně sloužit k přímé detekci určitého proteinu [11, 28].
Buněčná viabilita
Jednou z nejvýznamnějších vlastností buňky je její viabilita, respektive životaschopnost. Viabilita je definována jako schopnost buněk se množit a vykazovat metabolickou aktivitu v daných podmínkách. Tradiční přístup ke sledování mikrobiální viability je založen na tvorbě kolonií životaschopných buněk a jejich následném počítání. Průtoková cytometrie umožňuje rychlou in situ analýzu na úrovni jedné buňky, která umožňuje rozlišit buňky reproduktivně životaschopné, metabolicky aktivní, intaktní (s neporušenou membránou, respektive živé) a buňky permeabilizované (s porušenou membránou, respektive mrtvé). Metabolická aktivita buňky nezaručuje reprodukční růst, ale může svědčit o průběhu určitých metabolických pochodů, které mohou vést k biodegradaci, přeměně organické hmoty nebo hromadění toxinů [2, 4].
- a) Membránová integrita
Všechny mikrobiální buňky jsou pokryty cytoplazmatickou membránou, která umožňuje jejich selektivní kontakt s bezprostředním okolím. Pro plně funkční, zdravé buňky je nezbytná neporušená polarizovaná cytoplazmatická membrána a aktivní dopravní systémy. Pouze několik fluorescenčních barviv používaných v průtokové cytometrii může procházet neporušenou buněčnou membránou. Pro měření integrity buněčné membrány proto mohou být použita pouze barviva, která jsou obvykle nepropustná pro buněčnou membránu a mají specifická intracelulární nebo periplazmatická vazební místa [19].
Nejčastěji používanou barevnou kombinací pro průkaz membránové integrity je použití propidium iodidu (PI) a fluorescenčních barviv z řady SYTO. PI je vůbec nejrozšířenější fluorescenční sonda využívaná pro detekci buněčné viability. Jedná se o fenantrolinové interkalační činidlo, které se váže na nukleové kyseliny. Barviva řady SYTO představují permeabilní barviva, jejichž fluorescence se výrazně zvyšuje jejich vazbou na DNA a RNA. Jednotlivá barviva se od sebe liší v několika charakteristikách, jako je např. permeabilita, excitační a emisní spektrum, selektivita k DNA nebo RNA atd. Zatímco barviva řady SYTO vstupují do buňky neporušenými membránami, PI prostupuje pouze poškozenými membránami bakteriálních buněk. K posouzení životaschopných buněk se v kombinaci s PI nejčastěji používá SYTO9. Obě barviva emitují fluorescenci různých vlnových délek, která je detekována pomocí specifických fluorescenčních kanálů (obr. 3). Fluorescence emitovaná jednotlivými fluorochromy v rámci analyzované bakteriální populace pak umožňuje samostatné vyhodnocení buněk jak s neporušenými, tak porušenými membránami [11, 23, 24, 34].
3. Sledování životnosti bakteriální populace E. coli za užití dvoubarevného značení Syto9 a PI a) zastoupení živých a mrtvých buněk v bakteriální kultuře E. coli vystavené pokojové teplotě; b) zastoupení živých a mrtvých buněk v bakteriální kultuře E. coli vystavené teplotě 80°C po dobu 30 min. (vlastní výsledky, měřeno na průtokovém cytometru Attune) Figure 3. Study of the viability of the bacterial population of E. coli using two-colour Syto 9 and PI labelling a) Living and dead cells in a bacterial culture of E. coli exposed to room temperature; b) Living and dead cells in a bacterial culture of E. coli exposed to a temperature of 80°C for 30 min. (authors' own results, measured using an Attune flow cytometer) 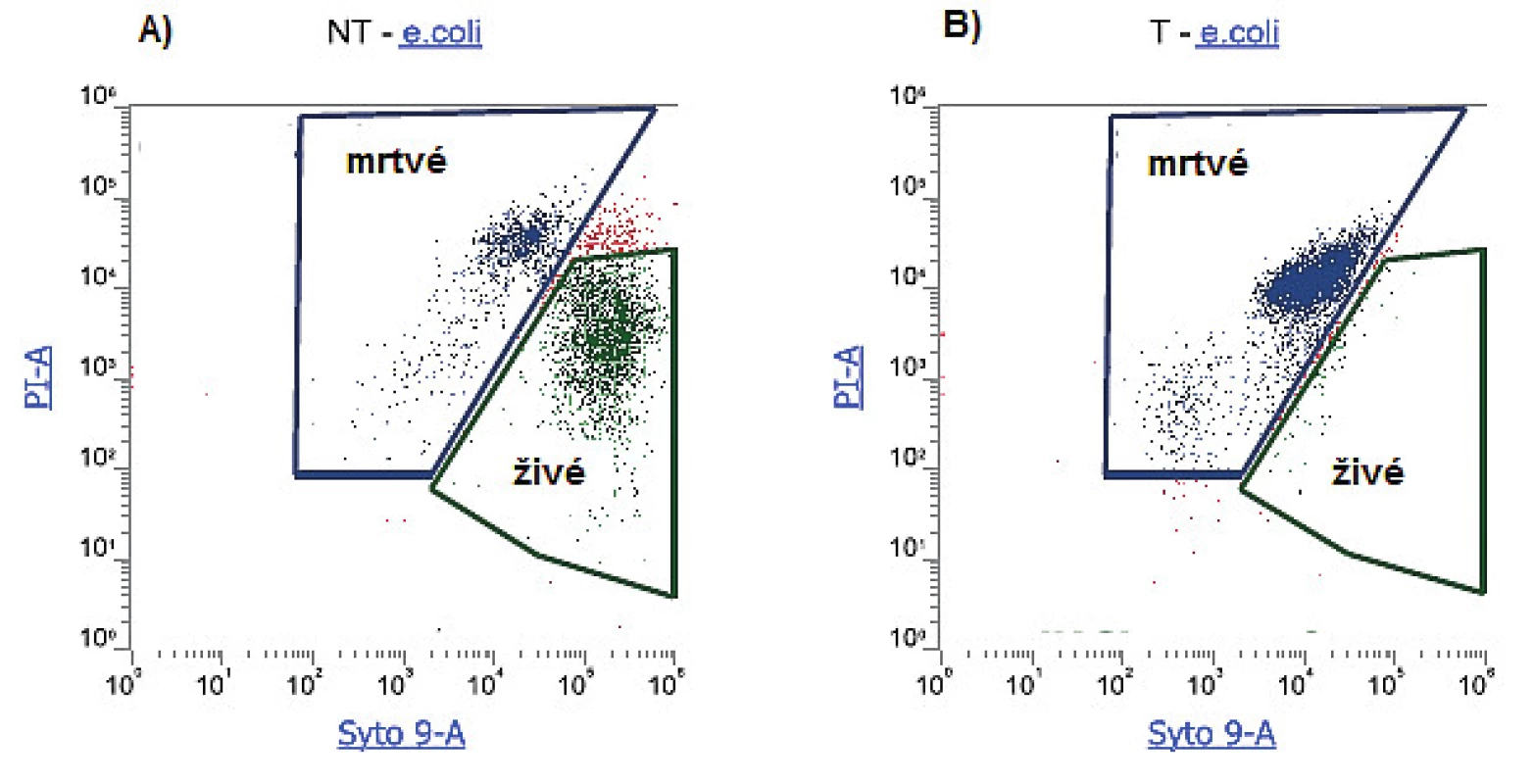
- b) Membránový potenciál
Eukaryotní buňky stejně jako mikroorganismy mohou reagovat na změnu životních podmínek zvýšením nebo snížením svého membránového potenciálu. Ten je udržován na cytoplazmatické membráně činností iontových pump. Membránový potenciál je závislý na energetickém metabolismu buňky a k jeho snížení dochází již během několika minut po odstranění zdroje energie. Na velikosti membránového potenciálu se významnou měrou podílí propustnost buněčné membrány. Pouze metabolicky aktivní buňky, jejichž membrány nebyly poškozeny, jsou schopny generovat a udržovat normální membránový potenciál. V současné době je k dispozici řada fluorescenčních barviv, které mohou být použity pro měření membránového potenciálu pomocí průtokové cytometrie jak u eukaryotních, tak prokaryotních buněk. Jedná se vesměs o lipofilní barviva, která mohou volně procházet cytoplazmatickou membránou do buněk a hromadí se v nich v závislosti na jejich náboji. K běžně používaným fluorochromům pro stanovení membránového potenciálu patří kationové karbocyaniny (např. DiOC6), rhodamin 123 a aniontové oxonoly (bis-(1,3-dibutylbarbituric acid) trimethine oxonol), resp. DiBAC4(3). Tato fluorescenční barviva jsou schopná na základě měnicího se potenciálu měnit svoje spektrální charakteristiky a tím podávat optické informace o membránovém potenciálu do svého okolí [6, 21, 26].
- c) Metabolická aktivita
Sledování intracelulární enzymové aktivity je další možností sledování buněčné viability. Fluorogenní barviva používaná k určení metabolické aktivity bakterií jsou často využívána v kombinaci s fluorochromy užívanými ke stanovení membránové integrity. Metabolická fluorogenní barviva pasivně pronikají do buněk a primárně nemají fluorescenční vlastnosti. K jejich přeměně na fluoreskující produkt dochází až působením určitých intracelulárních enzymatických aktivit.
Fluorogenní substráty esteráz mohou pasivně pronikat do buněk a měří zachování enzymatické aktivity buněčných esteráz, které je převádí na fluoreskující produkt. Z barviv je možno jmenovat např. fluorescein diacetát (FDA), dalšími vhodnými indikátory vitality jsou např. calcein AM, a různé fluorescenční diacetátové deriváty jako např. CFDA (5,6-dikarboxyfluorescein-diacetát). Určení enzymových aktivit pomocí fluorescenčních sond je spíše orientační a určuje, která buňka má vyšší enzymovou aktivitu v porovnání s jinou [13, 29].
Významným a důležitým faktorem ovlivňujícím metabolismus bakterií je jejich afinita ke kyslíku. Obecně toxicita kyslíku pro anaerobní i pro mikroaerofilní bakterie nespočívá v přímém působení kyslíku na tyto buňky, ale je realizována prostřednictvím látek se silným oxidačním účinkem, které vznikají v prostředích, kde je přítomen kyslík. Tyto látky jsou obecně označovány jako reaktivní formy kyslíku (ROS – Reactive Oxygen Species) a jedná se zejména o superoxidový radikál (O2-), peroxid vodíku (H2O2), hydroxylový radikál (-OH) a singletový kyslík (1O2*). Většina organismů se brání účinkům těchto látek tvorbou celé řady enzymů s katalytickým účinkem, jako jsou katalázy, peroxidázy nebo superoxiddismutázy, které představují základní prvky obranného systému organismů proti oxidačnímu stresu. K průkazu metabolické aktivity se využívají tzv. „dihydro“ deriváty, např. rhodamin, DCFH-DA (dichlorodihydrofluorescein diacetate). Jedná se o bezbarvá, nefluorescenční barviva, která prostřednictvím některé z forem reaktivních kyslíkatých radikálů oxidují na fluoreskující formu [5,9].
APLIKACE PRŮTOKOVÉ CYTOMETRIE
Většina aplikací průtokové cytometrie je zaměřena na výzkum lidských, živočišných a rostlinných buněk. V posledních letech se tato metoda nabízí i jako analytický nástroj ke zjišťování stavu mikroorganismů.
Screeningové vyšetření bakteriurie a bakteriální kontaminace
V současné době jsou běžně dostupné komerční automatické analyzátory moči umožňující automatickou analýzu močového sedimentu založenou na principu fluorescenční průtokové cytometrie. Pomocí plně automatického přístroje se barví DNA a membrána formovaných elementů v nativní moči, a lze tak diagnostikovat všechny buněčné elementy – erytrocyty, leukocyty, epitelové buňky včetně bakterií. Vyšetření má poměrně vysokou negativní předpovědní hodnotu, a přístroj tak lze využít pro předkultivační vyšetření vzorků moči při diagnostice močových infekcí. Metodu je také možno využít pro screeningové vyšetření bakteriální kontaminace v biologických preparátech, např. buněčných izolátech [14].
Identifikace G - a G+ bakterií
Gramovo barvení je považováno za základní z hlediska bakteriální taxonomie. Průtoková cytometrie představuje alternativní metodu pro klasické Gramovo barvení. Využívá kombinace dvou fluorescenčních barviv hexidium jodidu (HI) a SYTO 13. Zatímco HI proniká grampozitivními, ale nikoliv gramnegativními organismy, SYTO 13 proniká obojími. Různé emisní vlnové délky těchto dvou fluorochromů umožňují rychlou identifikaci a počítání gramnegativních a grampozitivních bakterií v suspenzi [20, 27].
Stanovení citlivosti k antibakteriálním látkám
Vzhledem ke zvyšujícímu se počtu rezistentních kmenů je velká pozornost věnována i novým metodám ve výzkumu antibakteriálních látek. Konvenční metody stanovení citlivosti k antibakteriálním látkám zpravidla informují jen o průměrné hodnotě citlivosti vztažené na celou bakteriální populaci. Průtoková cytometrie umožňuje detekci smíšených populací, které mohou reagovat na účinky antimikrobiálních látek různými způsoby [1]. Metodu lze s úspěchem využít i při testování nových léčiv v kombinaci s jejich případnou toxicitou [38, 39].
Bakteriální buňky reagují na různé antimikrobiální látky snížením nebo zvýšením membránového potenciálu [30, 39]. Pro zjišťování membránového potenciálu se v tomto případě využívá především lipofilních barviv (Rhodamin 123, DiBAC4(3), která vstupují do depolarizovaných buněk, kde se váží na intracelulární struktury bohaté na lipidy. Buňky, které jsou vůči testovanému antibiotiku resistentní a mají zachovaný membránový potenciál, proto vykazují nízkou intenzitu fluorescence, naproti tomu citlivost k danému antibiotiku vyvolá depolarizaci membrány vedoucí ke vstupu sondy do buňky a zvýšení intenzity fluorescence [16]. Metodu je možno využít i ke stanovení minimální inhibiční koncentrace a k testování antifungální citlivosti [3, 26].
Zejména antibiotika s baktericidním účinkem ničí bakteriální buňky různými mechanismy v důsledku specifické interakce s cílovými strukturami. Jedním z nich je stimulace produkce vysoce škodlivých hydroxylových radikálů, které lze rovněž detekovat za užití specifických fluorescenčních sond [25, 33]. Ke sledování stupně účinnosti antibiotik, která mají vliv na strukturální integritu buněčné stěny, lze použít i fluorescenční barviva z řady SYTO [8, 34]. Navíc antibiotika působící svým účinkem na buněčnou stěnu vyvolávají změny i v morfologii cílových buněk, což bylo využito při průkazu methicillin-rezistentních kmenů S. aureus [33, 37]. Metoda průtokové cytometrie byla použita i pro detekci ESBL (extended-spectrum b-lactamases, respektive širokospektrých beta-laktamáz). Kromě inkubace s beta-laktamovými antibiotiky byly buněčné izoláty inkubovány jak v přítomnosti, tak i v nepřítomnosti kyseliny klavulanové. Depolarizace buněčné membrány detekovaná prostřednictvím fluorescenčního barviva DiBAC4(3) identifikovala všechny izoláty citlivé k beta-laktamovým antibiotikům, u producentů ESBL pouze ty, které byly inkubovány kromě beta-laktamů i s kyselinou klavulanovou [15].
V případě sporulujících bakterií průtoková cytometrie může přispět k určení fyziologického stavu jednotlivých spor a různorodosti bakteriální populace ve vzorku z hlediska sledování klíčivosti a početního nárůstu bakteriálních spor [10].
BIOTECHNOLOGIE A POTRAVINÁŘSTVÍ
Průtoková cytometrie se stala cenným nástrojem i pro studium vodních organismů a mikrobiálního ekologického výzkumu půdy a přírodních vodních biotopů. Kombinace parametrů stanovujících počet, velikost a další biochemické a fyziologické vlastnosti jednotlivých buněk umožňuje lépe definovat heterogenitu studované populace nebo komunity [17, 40, 41].
Řada aplikací průtokové cytometrie se objevila i v oblasti průmyslové biotechnologie, potravinářství a farmaceutické kontroly kvality, rutinního monitorování pitné vody a odpadních systémů [32]. Zejména při výrobě potravin je nezbytné sledovat a kontrolovat bakteriální kontaminaci v různých stupních výrobního procesu. Výhodou průtokové cytometrie je v tomto případě časová úspora [7, 22]. Metodu průtokové cytometrie lze využít i k přímému sledování růstu bakterií při výrobě čistých fermentačních kultur. Jedná se zejména o čisté mlékárenské kultury, které se podílejí na výrobě zakysaných mléčných výrobků. Buněčná viabilita je také klíčovým analytickým parametrem v pivovarství lihovarství a při výrobě moštů [18].
ZÁVĚR
Průtoková cytometrie je v současné době považována za standardní metodu analýzy částic v suspenzi. I když je tato technika využívána především ke studiu eukaryotických buněk, stále širší uplatnění nachází i v oblasti mikrobiologie, kde představuje nový metodický přístup odlišný od dosud používaných klasických mikrobiologických metod. K výhodám této metody patří rychlost měření a možnost vzájemné kombinace různé druhy parametrů v originálním vzorku (multiparametrová analýza), což vede k lepšímu poznání funkční buněčné aktivity a detailnějšímu rozlišení heterogenity zkoumaných populací. Využití této metody v mikrobiologii je zatím stále poměrně malé, širší využití nachází průtoková cytometrie při rutinní analýze např. v potravinářství.
Nevýhodou je finanční náročnost zejména přístrojového vybavení, k obsluze cytometru je zapotřebí i speciálně školený personál. I přesto lze předpokládat, že v blízké budoucnosti dojde k jejímu rozšíření i do dalších oblastí mikrobiologie, včetně klinické laboratorní praxe.
Do redakce došlo dne 21. 10. 2016.
Adresa pro korespondenci:
RNDr. Alexandra Lochmanová, Ph.D.
Lékařská fakulta Ostravská univerzita
Syllabova 19
703 00 Ostrava-Zábřeh
e-mail: alexandra.lochmanova@osu.cz
Sources
1. Alvarez-Barrientos A, Arroyo J, Cantón R, Nombela C, Sánchez-Pérez M. Applications of flow cytometry to clinical microbiology. Clin Microbiol Rev, 2000;13(2): 167–195.
2. Ambriz-Aviña V, Contreras-Garduño JA, Pedraza-Reyes M. Applications of flow cytometry to characterize bacterial physiological responses. Biomed Res Int, 2014;2014 : 461941. doi: 10.1155/2014/461941. Epub 2014 Sep 9.
3. Assunção P, Antunes NT, Rosales RS, Poveda C, de la Fe C, Poveda JB, Davey HM. Application of flow cytometry for the determination of minimal inhibitory concentration of several antibacterial agents on Mycoplasma hyopneumoniae. J Appl Microbiol, 2007;102(4): 1132–1137.
4. Barbesti S, Citterio S, Labra M, Baroni MD, Neri MG, Sgorbati S. Two and three-color fluorescence flow cytometric analysis of immunoidentified viable bacteria. Cytometry, 2000;40(3): 214–218.
5. Bhupathiraju VK, Hernandez M, Landfear D, Alvarez-Cohen L. Application of a tetrazolium dye as an indicator of viability in anaerobic bacteria. J Microbiol Methods, 1999;37(3): 231–243.
6. Branská B, Linhová M, Patáková P, Paulová L, Melzoch K. Stanovení viability mikroorganismů pomocí fluprescencnčí analýzy. Chem Listy, 2011;105 : 586–593.
7. Broger T, Odermatt RP, Huber P, Sonnleitner B. Real-time on-line flow cytometry for bioprocess monitoring. J Biotechnol, 2011;154(4): 240–247. doi: 10.1016/j.jbiotec.2011.05.003. Epub 2011 May 14.
8. Chau F, Lefort A, Benadda S, Dubée V, Fantin B. Flow cytometry as a tool to determine the effects of cell wall-active antibiotics on vancomycin-susceptible and -resistant Enterococcus faecalis strains. Antimicrob Agents Chemother, 2011;55(1): 395–398.
9. Créach V, Baudoux AC, Bertru G, Rouzic BL. Direct estimate of active bacteria: CTC use and limitations. J Microbiol Methods, 2003;52(1): 19–28.
10. Cronin UP, Wilkinson MG. The use of flow cytometry to study the germination of Bacillus cereus endospores. Cytometry Part A, 2007;71(3): 143–153.
11. Davey HM, Winson MK. Using flow cytometry to quantify microbial heterogeneity. Curr Issues Mol Biol, 2003;5(1): 9–15.
12. Davis C. Enumeration of probiotic strains: Review of culture-dependent and alternative techniques to quantify viable bacteria. J Microbiol Methods, 2014;103 : 9–17.
13. Dive C, Cox H, Watson JV, Workman P. Polar fluorescein derivatives as improved substrate probes for flow cytoenzymological assay of cellular esterases. Mol Cell Probes, 1988;2(2): 131–45.
14. Dreier J, Vollmer T, Kleesiek K. Novel flow cytometry-based screening for bacterial contamination of donor platelet preparations compared with other rapid screening methods. Clin Chem, 2009;55(8): 1492–1502.
15. Faria-Ramos I, Espinar MJ, Rocha R, Santos-Antunes J, Rodrigues AG, Cantón R, Pina-Vaz C. A novel flow cytometric assay for rapid detection of extended-spectrum beta-lactamases. Clin Microbiol Infect, 2013;19(1): E8–E15.
16. Gauthier C, St-Pierre Y, Villemur R. Rapid antimicrobial susceptibility testing of urinary tract isolates and samples by flow cytometry. J Med Microbiol, 2002;51(3): 192–200.
17. Gruden C, Skerlos S, Adriaens P. Flow cytometry for microbial sensing in environmental sustainability applications: current status and future prospects. FEMS Microbiol Ecol, 2004;49(1): 37–49.
18. Herrero M, Quirós C, García LA, Díaz M. Use of flow cytometry to follow the physiological states of microorganisms in cider fermentation processes. Appl Environ Microbiol, 2006;72(10): 6725–6733.
19. Hewitt CJ, Nebe-Von-Caron G. An industrial application of multiparameter flow cytometry: assessment of cell physiological state and its application to the study of microbial fermentations. Cytometry, 2001;44(3): 179–187.
20. Holm C, Jespersen L. A flow-cytometric gram-staining technique for milk-associated bacteria. Appl Environ Microbiol, 2003;69(5): 2857–2863.
21. Jepras RI, Paul FE, Pearson SC, Wilkinson MJ. Rapid assessment of antibiotic effects on Escherichia coli by bis-(1,3-dibutylbarbituric acid) trimethine oxonol and flow cytometry. Antimicrob Agents Chemother, 1997;41(9): 2001–2005.
22. Józwa W, Czaczyk K. Flow cytometric analysis of microbial contamination in food industry technological lines – initial study. Acta Sci Pol Technol Aliment, 2012;11(2): 110–119.
23. Kennedy D, Cronin UP, Wilkinson MG. Responses of Escherichia coli, Listeria monocytogenes, and Staphylococcus aureus to simulated food processing treatments, determined using fluorescence-activated cell sorting and plate counting. Appl Environ Microbiol, 2011;77(13): 4657–4668.
24. Khan MM, Pyle BH, Camper AK. Specific and rapid enumeration of viable but nonculturable and viable-culturable gram-negative bacteria by using flow cytometry. Appl Environ Microbiol, 2010;76(15): 5088–5096.
25. Kohanski MA, Dwyer DJ, Hayete B, Lawrence CA, Collins JJ. A common mechanism of cellular death induced by bactericidal antibiotics. Cell, 2007;130(5): 797–810.
26. Lee W, Kwak Y. Antifungal susceptibility testing of Candida species by flow cytometry. J Korean Med Sci, 1999;14(1): 21–26.
27. Mason DJ, Shanmuganathan S, Mortimer FC, Gant VA. A fluorescent Gram stain for flow cytometry and epifluorescence microscopy. Appl Environ Microbiol, 1998;64(7): 2681–2685.
28. Müller S, Nebe-von-Caron G. Functional single-cell analyses: flow cytometry and cell sorting of microbial populations and communities. FEMS Microbiol Rev, 2010;34(4): 554–587.
29. Novák J, Basařová G, Fiala J, Dostálek P. Průtoková cytometrie ve výzkumu kvasinek Saccharomyces cerevisiae a její aplikace v praxi. Chem Listy, 2008;102 : 183–187.
30. Novo DJ, Perlmutter NG, Hunt RH, Shapiro HM. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob Agents Chemother, 2000;44(4): 827–834.
31. Nuding S, Zabel LT. Detection, Identification and Susceptibility Testing of Bacteria by Flow Cytometry. J Bacteriol Parasitol, 2013: S5.
32. Prest EI, Hammes F, Kötzsch S, van Loosdrecht MC, Vrouwenvelder JS. Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method. Water Res, 2013;47(19): 7131–7142.
33. Renggli S, Keck W, Jenal U, Ritz D. Role of autofluorescence in flow cytometric analysis of Escherichia coli treated with bactericidal antibiotics. J Bacteriol, 2013;195(18): 4067–4073.
34. Roth BL, Poot M, Yue ST, Millard PJ. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl Environ Microbiol, 1997;63(6): 2421–2431.
35. Shapiro HM, Nebe-von-Caron G. Multiparameter Flow Cytometry of Bacteria, 33–43 From Methods in Molecular Biology: Flow Cytometry Protocols, 2nd ed. Edited by: T.S. Hawley and R.G. Hawley, Human Press Inc. Totowa NJ
36. Shapiro HM. Practical Flow Cytometry, 3. Vyd. Wiley-Liss, Inc., USA 1995.
37. Shrestha NK, Scalera NM, Wilson DA, Procop GW. Rapid differentiation of methicillin-resistant and methicillin-susceptible Staphylococcus aureus by flow cytometry after brief antibiotic exposure. J Clin Microbiol, 2011;49(6): 2116–2120.
38. Shubar HM, Mayer JP, Hopfenmüller W, Liesenfeld O. A new combined flow-cytometry-based assay reveals excellent activity against Toxoplasma gondii and low toxicity of new bisphosphonates in vitro and in vivo. J Antimicrob Chemother, 2008;61(5): 1110–1119. doi: 10.1093/jac/dkn047. Epub 2008 Feb 19.
39. Suller MT, Stark JM, Lloyd D. A flow cytometric study of antibiotic-induced damage and evaluation as a rapid antibiotic susceptibility test for methicillin-resistant Staphylococcus aureus. J Antimicrob Chemother, 1997;40(1): 77–83.
40. Vives-Rego J, Lebaron P, Nebe-von Caron G. Current and future applications of flow cytometry in aquatic microbiology. FEMS Microbiol Rev, 2000;24(4): 429–448.
41. Wikström P, Johansson T, Lundstedt S, Hägglund L, Forsman M. Phenotypic biomonitoring using multivariate flow cytometric analysis of multi-stained microorganisms. See comment in PubMed Commons below. FEMS Microbiol Ecol, 2001;34(3): 187–196.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2017 Issue 4-
All articles in this issue
- The prevalence, incidence, persistence and transmission ways of human papillomavirus infection (HPV)
- Flow cytometry in microbiology
- Crohn’s disease and ulcerative colitis – current view on genetic determination, immunopathogenesis and biologic therapy
- Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
- Human alveolar echinococcosis and an overview of the occurrence of Echinococcus multilocularis in animals in the Czech Republic
- Detection of the etiological agents of hospital-acquired pneumonia – validity and comparison of different types of biological sample collection: a prospective, observational study in intensive care patients
- Detection of antigen-specific T cells in patients with neuroborreliosis
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Human alveolar echinococcosis and an overview of the occurrence of Echinococcus multilocularis in animals in the Czech Republic
- Crohn’s disease and ulcerative colitis – current view on genetic determination, immunopathogenesis and biologic therapy
- Flow cytometry in microbiology
- Mycological diagnosis of pulmonary Aspergillus infections with a focus on serological methods
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

