-
Medical journals
- Career
Nespecifická imunoterapie inhibuje angiogenezi – výsledky monitorování sérových hladin vaskulárního endotelového růstového faktoru a matrixmetaloproteinázy 8 v průběhu adjuvantní léčby vysokodávkovaným interferonem u pacientů s maligním melanomem
Authors: J. Prošvicová 1; J. Grim 2; J. Kopecký 2; P. Priester 2; I. Slánská 2; P. Trojanová 2; A. Paulík 2; V. Jílková 2; S. Filip 2; Š. Lukešová 1,3; P. Prošvic 1; J. Knížek 4; C. Andrýs 5
Authors‘ workplace: Onkologické oddělení, Oblastní nemocnice Náchod 1; Klinika onkologie a radioterapie, Fakultní nemocnice Hradec Králové 2; Ústav klinické mikrobiologie, Lékařská fakulta v Hradci Králové, Univerzita Karlova 3; Ústav biofyziky a biostatistiky, Lékařská fakulta v Hradci Králové, Univerzita Karlova 4; Oddělení klinické imunologie, Fakultní nemocnice Hradec Králové 5
Published in: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 1, s. 15-23
Category: Original Papers
Overview
Cíl práce:
V současné době se objevují zajímavé informace o tom, že aktivace angiogeneze má kromě přímého vlivu na nádorovou vaskulaturu i imunosupresivní působení, a to jak lokálně, tak systémově. Cílem práce bylo prokázat antiangiogenní účinky interferonu alfa-2b (IFN), a poukázat tak na provázanost komplexních dějů imunomodulace a angiogeneze prostřednictvím stanovování sérových hladin vaskulárního endotelového růstového faktoru (VEGF) a matrixové metaloproteinázy 8 (MMP8) před a po podání vysokodávkovaného interferonu (HDI) v adjuvantní léčbě vysoce rizikových pacientů s resekovaným maligním melanomem. Hodnotili jsme i klinické výstupy pacientů.Materiál a metodiky:
Prospektivně jsme hodnotili sérové hladiny VEGF a MMP8 u 29 pacientů s vysoce rizikovým resekovaným maligním melanomem, podstupujících adjuvantní léčbu HDI. Vzorky krve byly odebírány před zahájením léčby HDI a v horizontu 1 týdne po jejím ukončení. Měřeny byly metodou ELISA.Výsledky:
Pro větší přehlednost výsledků byli pacienti rozděleni do dvou skupin. První skupina pacientů, u nichž došlo k poklesu hladiny VEGF po HDI (66 % pacientů), dospěla do dlouhodobé kompletní remise. Průměrné sérové hodnoty VEGF poklesly ze 779,4 pg/ml na 446,2 pg/ml po podání interferonů. Byl zachycen statisticky signifikantní trend k poklesu hladin sérového VEGF po podání vysokodávkovaného interferonu. Druhá skupina pacientů, u nichž nedošlo k poklesu VEGF po HDI (34 % pacientů), neprokázala klinický benefit podané léčby. Průměrné sérové hodnoty VEGF byly 408 pg/ml a 500 pg/ml. Výsledky s MMP8 jsou v našem sledování ambivalentní.Závěry:
Nespecifická imunoterapie interferony oslabuje angiogenezi. Naše výsledky jsou ve shodě se současným vnímáním relevantního propojení angiogeneze a imunomodulace/imunosuprese. Nespecifická imunoterapie interferony narušuje supresivní působení angiogeneze na rozvoj imunitní reakce a naopak podporuje reakci protinádorovou, přímo i nepřímo. Tento vstup interferonů do procesu aktivace angiogeneze zřejmě vysvětluje dobré klinické výsledky těch pacientů z našeho souboru, u kterých došlo k poklesu hladiny VEGF po HDI. Závěry stran MMP8 jsou nejednoznačné a nenaplňují představu MMP8 jakožto tumor supresoru.KLÍČOVÁ SLOVA:
angiogeneze – imunomodulace – interferon alfa-2b – adjuvantní léčba – maligní melanomÚVOD
Angiogeneze a imunomodulace jsou komplexní a provázané procesy. Vaskulární endotelový růstový faktor (VEGF), matrixmetaloproteinázy (MMP) a interferony (IFN) působí v obou sférách. VEGF je nejenom faktor angiogenní, ovlivňující endotelie krevní, lymfatické i nádorové (TECs) ve smyslu jejich aktivace, podpory přežívání, proliferace, migrace, invaze, ale také faktor imunosupresivní, a to jak lokálně (zodpovědný za imunosupresivní nastavení nádorového mikroprostředí), tak systémově (proangiogenní solubilní chemoatraktant supresivních progenitorů MDSC, Tregs, TAMs, Tie-2 + monocytů z kostní dřeně). Ovlivňuje imunitní odpověď negativním působením na migraci, zrání a přežívání DC a T-ly [1]. Podporuje rozvoj imunosupresivního až tumorigenního mikroprostředí. Dochází k posunu k Th2 odpovědi, vzniká chronicky inflamatorní prostředí. Hovoří se o imunosupresi indukované nádorem a nádorové angiogenezi [2]. VEGF tak představuje jeden z pomocníků nádoru v úniku před imunitním dohledem. Ovlivňuje také funkci a průtok cév – vazodilatací a zvýšenou permeabilitou – čímž přispívá k snazšímu vstupu nádorových buněk do oběhu, extravazaci lymfocytů, nehomogennímu prokrvení nádorových oblastí a vzniku hypoxických oblastí a nekróz. Hypoxie opětovně stimuluje angiogenezi, aby do neprokrvených oblastí začala proudit krev, a začarovaný kruh se uzavírá.
Aktivace/inhibice angiogeneze není prosté vypnutí/zapnutí, jako je tomu s obsazením CTLA4 a PD-1 receptorů, ale moduluje ji více signalizačních cest. Tak je nastavena i fyziologicky, i s přítomností přirozených inhibitorů. Limity současné imunoterapie (protilátky proti CTLA4 a PD-1 receptorům) jsou vnímány v nedostatečné odpovědi či přímo rezistenci nádorového mikroprostředí, které je imunosupresivně nastaveno. Angiogeneze může být jednou z příčin.
Maligní melanom, stejně jako většina solidních tumorů, dokáže integrovat hostitelskou vaskulaturu. Angiogenní potenciál maligního melanomu – schopnost podmanit si hostitelskou vaskulaturu – je obrovský, a přichází velmi časně. Angiogenní switch – změna charakteru růstu z radiální na vertikální – je regulován sekvenční aktivací onkogenů a inaktivací tumor-supresorových genů. Tyto geny jsou zapojeny v procesu angiogeneze, ale také proliferace a apoptózy. Jedná se o komplexní změnu charakteru nádoru. Představuje vznik tumorigenního fenotypu, agresivního nádoru schopného metastazovat. Vertikální fáze růstu je doprovázena ostrým zvýšením exprese proteinu VEGF a z druhé strany lze říci, že „pouhou“ transfekcí genu pro VEGF vzniká high grade maligní progresivně rostoucí buněčná linie [3]. Aktivace VEGFR-2 exprimovaného na TECs navázáním VEGF-A je zásadním mechanismem, jak nádorové buňky podporují angiogenní switch nádoru [4]. Autokrinní VEGF-A řízená zpětná klička aktivuje VEGFR-1 na nádorových buňkách. VEGF-A je považován za primární, přímo-působící proangiogenní růstový faktor, který si je tumor schopen secernovat k podpoře růstu a invazitivy [3]. Tumor rostoucí s přispěním hostitelské vaskulatury by měl být od počátku považován za systémové onemocnění.
Nádorové buňky maligního melanomu za podmínek hypoxie cestou transkripčního faktoru HIF-1 stimulují novotvorbu cév autokrinně i parakrinně produkcí proangiogenních solubilních faktorů. Ty mají pleiotropní působení. Receptory pro solubilní faktory mají jak nádorové buňky, tak endotelové či stromální a imunitní buňky; ne zdravé melanocyty [5]. Exprese VEGFR-1 charakterizuje také proces epitelo-mezenchymální tranzice [6]. Transkripční faktor HIF reguluje stovky v buňkách přítomných genů. Tyto geny jsou zahrnuty v procesech angiogeneze (geny pro VEGF, MMP), glykolýzy a invazivity. Vysoké hladiny VEGF korelují s úrovní hypoxie v nádoru, avšak indukce nebo zvýšení exprese VEGF není způsobena jen hypoxií. Může ji vyvolat řada jiných environmentálních (epigenetických) faktorů, nízké pH, chronických zánět apod. Kyselé extracelulární pH podporuje expresi VEGF-C na buňkách maligního melanomu prostřednictvím transkripčního faktoru NF-κB. Zde funguje negativní zkřížení s TNF-α indukovanou genovou expresí. Dochází tak k časnému poklesu exprese IRF [7]. Zde se na genové úrovni potkává přímé supresivní působení VEGF s působením interferonů. Obsazením IFN receptoru a fosforylací STAT1 a STAT2 vzniká komplex ISGF3 a transkripční faktor nazývaný IRF, který aktivuje transkripci ISGs a dochází k inhibici VEGF [8]. Hlubší pochopení vzájemné interakce angiogeneze a regulace imunitních funkcí nám poukáže nové možnosti kombinovaných protinádorových léčebných postupů i nové biomarkery.
Signifikantní změny v genové expresi provázející angiogenní switch se jeví jako potenciální terapeutický cíl (např. zvýšení počtu kopií PHIP, jež dává do souvislosti procesy angiogeneze s ulcerací, glykolýzou a potenciálem metastazovat). Faktor ulcerace je u nádoru vždy prognosticky nepříznivý. Již pouhým pohledem na ulcerovaný melanom je možno z množství granulační tkáně usuzovat na značnou aktivaci angiogeneze a zapojení imunitního systému. Do hloubky je pak proces ulcerace spojen s aktivací WNT beta-kateninové dráhy a NF-κB [9]. U melanomu se ulcerace odráží i ve stagingu nádoru (b stadium) a je prokázaným prediktorem citlivosti k léčbě interferonem [10].
Interferony působí antiangiogenně a prolamují imunotoleranci. Imunomodulační efekt antiangiogenních preparátů je významný, jen mu doposud nebyla věnována patřičná pozornost. Interferonům je připisováno i přímé protinádorové působení. Interferony dokáží inhibovat sekreci VEGF [11]. MMP-8 je považována za tumor supresor [12].
Maligní melanom patří mezi nádory s nejvyšší frekvencí tvorby neoepitopů. Je to nádor silně imunogenní, a poskytuje tak dobré předpoklady pro úspěch imunoterapie. Nádor, jako je maligní melanom, je schopen generovat mnohočetné metastázy i před detekcí samotného nádoru. Tyto časně diseminované nádorové buňky mohou být dlouho spící a být pak zdrojem i velmi pozdního relapsu choroby, u melanomu i za dobu delší 15 let, za podmínek neznámých (oslabení imunitního systému, či overexprese VEGF) dochází k aktivaci dormantních melanomových buněk [3]. Efektivní adjuvantní léčba by měla tyto stavy pokrýt. Stejně tak jako reziduální mikrometastázy nedetekabilní žádnou zobrazovací metodou, jež však v budoucnu mohou být zdrojem rekurence MM a úmrtí na něj. Úspěšná adjuvantní léčba by se měla promítnout do zlepšení období do relapsu a celkového přežívání.
V adjuvantní léčbě maligního melanomu se užívá interferonů již skoro 30 let. Za toto období se vyprofilovala tři základní terapeutická dávková schémata (vysokodávkované, střední dávkování a nízkodávkované schéma), mezi nimiž nebylo nalezeno vítěze. Ze souhrnných dat studií E1684, E1690, E1694, EORTC 18952, a EORTC 18991 vychází, že HD IFN-α zlepšuje RFS o zhruba 33 %, a o něco méně OS [13]. Jeho efekt je mírný, ale konzistentní a reprodukovatelný. Ve světě se v adjuvantní léčbě podává i pegylovaný interferon, který přináší nespornou uživatelskou výhodu v aplikaci pouze 1x týdně. V ČR tento preparát dostupný a podávaný není. Antiangiogenní působení IFN je méně definováno. Nejvýznamnější pokles hladiny VEGF po podání interferonů je popisován u pacientů s renálním karcinomem, kde je nadprodukce VEGF dána genetickým defektem. Antiangiogenní působení IFN u ostatních malignit jde cestou aktivace Janus-kinase-STAT signální dráhy a pokles VEGF je spojen s jeho sníženou produkcí nádorovými buňkami [11]. Mají imunostimulační působení. Narušují imunotoleranci nádoru zvýšením jeho imunogenity. Zvyšují expresi STAT1 a snižují hladiny cirkulujících Tregs [14].
MATERIÁL A METODY
Studie se týkala 29 pacientů, kteří podstoupili adjuvantní léčbu maligního melanomu vysokodávkovaným interferonem alfa-2b na Klinice onkologie a radioterapie ve Fakultní nemocnici v Hradci Králové. Soubor tvořilo 16 mužů a 13 žen ve věkovém rozmezí 26–72 roků (me-dián 56,6). Byli to pacienti indikovaní k adjuvantní léčbě podle standardního doporučení, s maligním melanomem stadia IIb, IIIa a IIIb MM podle AJCC (s tloušťkou podle Breslowa > 2 mm, úrovní invaze podle Clarka > III, s přítomností in-tranzitních metastáz – regionální metastázy v kůži lokalizované od 2 cm od primárního ložiska do první drénující uzliny), tj. pT3N0M0 (1,5–4 mm), pT4NOMO, s pozitivní sentinelovou uzlinou nebo pTxN1-2M0 s klinicky zjevnými metastázami do uzlin, s rekurencí do uzlin nebo s postiženými uzlinami a neznámým primárním ložiskem.
Hladiny VEGF a MMP-8 zaznamenané v tabulce představují naměřené hladiny u pacienta před zahájením léčby HDI v den přijetí k léčbě (čili v rozsahu 4–6 týdnů od chirurgického výkonu) a hladiny naměřené při ukončení léčby (1–7 dní od ukončení podávání).
Pacientům byl v adjuvantní léčbě podáván intravenózně vysokodávkovaný interferon alfa-2b, v dávce 20 MIU/m25 dní v týdnu první 4 týdny, pak udržovací schéma subkutánní 10 MIU/m2 do celkové doby 1 roku (klasické „Kirkwoodovo schéma“). Adjuvantní léčbu zahájili do 6 týdnů od radikální operace maligního melanomu, či disekce uzlinové recidivy. Po dobu léčby byl kladen důraz na dostatečnou hydrataci (min. 2 l/den, optimálně pomalá parenterální hydratace přes noc), kontrolu hematologických a biochemických parametrů, zejména jaterních funkcí, a profylaxi antidepresivem. Ve shodě s doporučením psychiatrů dobré zkušenosti byly se sertralinem. Podávání bylo zahájeno ještě před zahájením adjuvantní léčby a dávka sertralinu byla postupně navýšena až na 200 mg/den.
Měření odebraných vzorků probíhalo na katedře Humorální imunologie Kliniky alergologie a imunologie Fakultní nemocnice v Hradci Králové. Hladiny VEGF a MMP-8 byly stanoveny pomocí komerčních ELISA souprav od firmy R&D Systems (USA), a to Quantikine Human VEGF Immunoassay a Quantikine Human Total MMP-8 ELISA Kit. V obou případech se jednalo o sandwichovou ELISA techniku. V jamkách mikrotitračních destiček se cytokin nebo matrixová metaloproteináza váže na specifickou protilátku. Tento komplex je následně označen druhou protilátkou konjugovanou s enzymem křenová peroxidáza. Po přidání substrátu TMB dojde k barevné změně, která je úměrná koncentraci příslušného analytu. I zde se postupovalo podle doporučení výrobce. Pro měření barevné změny (absorbance) byl použit u všech měřených parametrů ELISA reader Multiskan a software Genesis od firmy Thermo Fisher Scientific (USA). Koncentrace VEGF a MMP-8 byly vypočteny z kalibračních křivek. Měřicí rozsah pro VEGF byl 15–1000 pg/ml a pro MMP-8 5–1000 pg/ml. Vzorky mimo rozsah měření byly ředěny 20krát.
Cílem sledování hladin VEGF před léčbou IFN a po ní je prokázat, že tato léčba má antiangiogenní působení, čili že po ní hladina VEGF klesá. Statisticky byla testována nulová hypotéza H0, že hladina VEGF před a po léčbě IFN se vzájemně rovnají, proti jednostranné hypotéze alternativní HA, že hladina VEGF po léčbě IFN klesá. H0 byla zamítnuta (p = 0,071) ve prospěch alternativní hypotézy (www.ncss.com). Podle těchto výsledků testů toto bylo statisticky prokázáno, čili byl zachycen jistý trend (p < a = 0,1) k poklesu hladiny sérového VEGF v odpovědi na podání vysokodávkovaného interferonu.
Nebyl prokázán statisticky signifikantní pokles MMP8 po podání HDI, či jiná asociace, mezi hladinou MMP-8 a podanou léčbou, ačkoli ve skupině pacientů, u kterých došlo k poklesu sérového VEGF po HDI, pokles této hodnoty korespondoval s poklesem MMP8 (80 %).
VÝSLEDKY
Výsledky jsou prezentovány s mediánem follow-up 2 roky. Pro větší přehlednost výsledků jsou pacienti rozděleni do dvou skupin:
1. Pacienti, u nichž došlo k poklesu hladiny VEGF po vysokodávkovaném podání interferonu alfa - 2b (tab. 1)
Table 1. Pacienti s poklesem hladiny VEGF po podání HDI Table 1. Patients who did show a decrease in VEGF serum level after HDI 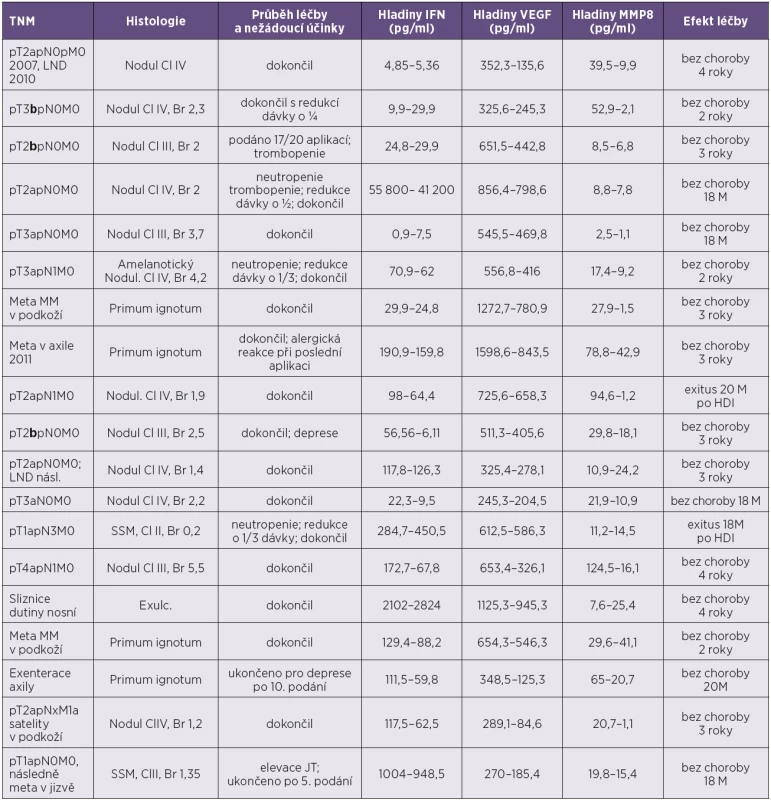
MM – maligní melanom, meta – metastázy, Cl – hodnota podle Clarka, Br – hodnota podle Breslowa, SSM – superficiálně se šířící melanom, Nodul – nodulární, JT – jaterní testy, LND – disekce lymfatických uzlin, HDI – vysokodávkovaný interferon, M – měsíce Tučně vyznačeno b stadium ulcerace. MM – malignant melanoma; meta – metastasis; Cl –Clark level, Br – Breslow value; SSM – superficial spreading melanoma; Nodul – nodulary; JT – liver function tests; LND – lymph node dissection; HDI – high-dose interferon; M – month Stage b ulceration is in bold. Po podání vysokodávkovaného interferonu došlo k poklesu hladiny sérového VEGF u 19 z 29 pacientů (66 %). Dva z nich zemřeli, u 17 došlo k dosažení dlouhodobé kompletní remise (2 roky od ukončení léčby bez známek choroby). Oba pacienti, kteří zemřeli, byli bez ulcerace primárního ložiska, měli postižené uzliny, ale primární nádor nebyl nikterak velký (v jednom případě dokonce pT1a). 90 % pacientů, kteří zareagují na HDI poklesem sVEGF-A, dosahuje dlouhodobě dobré terapeutické odpovědi.
V této podskupině pacientů byla vstupní hodnota VEGF v průměru 779,4 pg/ml. Hodnota po léčbě byla v průměru VEGF 446,2 pg/ml.
Tři pacienti z uvedených 19 nedokončili léčebné schéma kvůli projevům toxicity.
2. Pacienti, u nichž nedošlo k poklesu hladiny VEGF po vysokodávkovaném podání interferonu alfa-2b (tab. 2)
Table 2. Pacienti bez poklesu VEGF po podání HDI Table 2. Patients who did not show a decrease in VEGF serum level after HDI 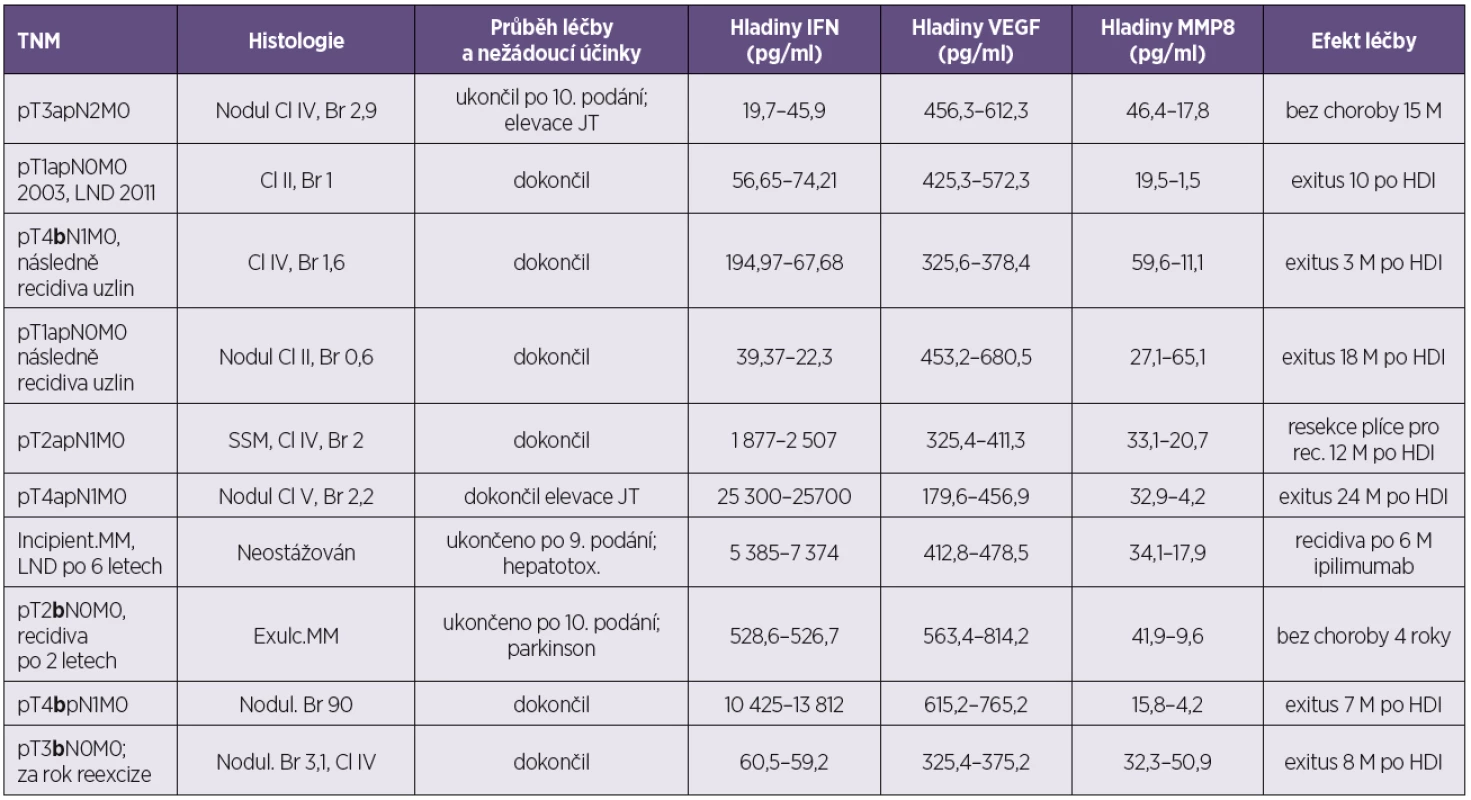
MM – maligní melanom; meta – metastázy; Cl – hodnota dle Clarka, Br – hodnota podle Breslowa; SSM – superficiálně se šířící melanom; Nodul – nodulární; LND – disekce lymfatických uzlin; JT – jaterní testy; HDI – vysokodávkovaný interferon; M – měsíce Tučně vyznačeno b stadium ulcerace. MM – malignant melanoma; meta – metastasis; Cl –Clark level, Br – Breslow value; SSM – superficial spreading melanoma; Nodul – nodulary; JT – liver function tests; LND – lymph node dissection; HDI – high-dose interferon; M – month Stage b ulceration is in bold. U 10 pacientů z 29 nedošlo k poklesu – ba naopak ke vzestupu – sérového VEGF po podání HDI (34 %). Osm pacientů z nich zemřelo (80 %). Pouze 2 z nich měli ulcerovaný primární melanom. Dva dosahují dlouhodobé kompletní remise.
Je to skupina pacientů, ve které najdeme až zarážející nízká vstupní stadia choroby, jež však (po relativně dlouhém čase) recidivovala do uzlin. Představují tak ty v jádru rizikové pacienty, u kterých zjevně již od počátku onemocnění byly aktivní určité mechanismy, které představují systémové onemocnění již od počátku. U této skupinky pacientů proto ani nedošlo k poklesu VEGF po léčbě HDI. Onemocnění je od samého začátku řízeno mechanismy, které neznáme a neumíme podchytit, ani vstupně tyto pacienty odlišit. Předléčebná hladina v této skupině pacientů byla VEGF A 408 pg/ml. Po léčbě byla hladina VEGF 500 pg/ml.
Tři pacienti z 10 nedokončili léčebné schéma v důsledku projevů toxicity.
V 80 % došlo k poklesu MMP-8 po podání HDI, ale jako tumor supresorové by se toto pozorování dalo označit pouze v polovině případů (40 %). Tento pokles není statisticky signifikantní.
MMP-8 je považována za tumor supresor, dala by se formulovat hypotéza o tom, že u pacientů s dlouhodobým CR bude její hladina stoupat, či při poklesu VEGF bude stoupat. Taková asociace v našich výsledcích pozorována nebyla. MMP8 klesají po podání HDI v 76 %, ale nelze popsat terapeutický a klinický dopad tohoto poklesu, protože k němu došlo rovnoměrně u pacientů s dobrými i špatnými klinickými výsledky. Dalších, obsáhlejších a komplexnějších sledování je třeba k popsání vztahu MMP a VEGF a k plnému porozumění jejich role v procesu angiogeneze, imunomodulace, progrese choroby a metastazování.
Ve skupině pacientů, kteří na léčbu HDI zareagovali poklesem VEGF, tento pokles v 80 % korespondoval s poklesem hladin MMP-8, což nenaplňuje představu tumor supresivního působení MMP-8. Ve skupině pacientů, kde hladina VEGF rostla po podání HDI, nebyla pozorována žádná asociace mezi hladinami VEGF a MMP-8.
Průměrné hodnoty MMP-8 v úvodu léčby v naší studované populaci byly 34,9 pg/ml a na konci léčby 16,4 pg/ml. Jednotlivá pozorování poskytují ambivalentní výsledky a statisticky nebyl prokázán žádný trend ke snižování nebo zvyšování hladiny MMP-8 po léčbě HDI.
Souhrnně k výsledkům celé studované skupiny můžeme říci, že byl statisticky potvrzen trend ke snížení hladin VEGF-A po intravenózním podání vysokodávkovaného interferonu alfa-2b. V našem pozorování se tento pokles hladiny VEGF v reakci na HDI jeví pro pacienty prognosticky významnější než samotná vstupní hodnota VEGF. Zřejmě je odrazem „interferování“ interferonů do procesu angiogeneze a progrese choroby. Vstupní hodnota VEGF byla v průměru vyšší v podskupině pacientů, kteří zareagovali na terapii poklesem a měli dobré dlouhodobé terapeutické výsledky.
Nezaznamenali jsme cut-off hodnoty VEGF, při jehož dosažení či překročení, by pacienti ve svých klinických výstupech dopadali hůře.
Po podání intravenózního vysokodávkovaného interferonu alfa-2b došlo k poklesu hladiny VEGF-A ve více než polovině léčených případů (66 %), bez ohledu na vstupní stadium maligního melanomu. Navzdory tomu, že pracujeme s malými čísly a nedosahujeme statistické signifikance, tento pokles hladiny VEGF-A po léčbě se jeví prognosticky pozitivně (90 % pacientů, u nichž došlo k poklesu hladiny VEGF-A po podání vysokodávkovaného interferonu, dosáhlo dlouhodobě kompletní remise).
Tento soubor pacientů představuje skupinu, léčenou povětšinou před érou léčby mutačními inhibitory či blokátory imunologických checkpointů.
Zaznamenali jsme antiangiogenní potenciál interferonu alfa-2b při jeho vysokodávkovaném podání.
DISKUSE
Angiogeneze a imunomodulace jsou komplexní a provázané procesy. VEGF je faktor angiogenní a imunosupresivní. Interferony působí antiangiogenně a prolamují imunotoleranci. Je jim připisováno i přímé protinádorové působení. Stojí tedy funkčně proti sobě. Interferony dokáží inhibovat sekreci VEGF [11]. MMP-8 je považována za tumor supresor [12].
Maligní melanom, stejně jako většina solidních tumorů, dokáže integrovat hostitelskou vaskulaturu. Angiogenní switch je doprovázen overexpresí VEGF. VEGF-A je považován za primární, přímo působící proangiogenní růstový faktor, který si je tumor schopen secernovat k podpoře růstu a invazivity [3]. Tumor rostoucí s přispěním hostitelské vaskulatury by měl být od počátku považován za systémové onemocnění. Autokrinní VEGF-A řízená zpětná klička aktivuje VEGFR-1 na nádorových buňkách.
VEGF ovlivňuje rozvoj imunosupresního mikroprostředí, funkci T lymfocytů a DC. Transkripční faktor HIF, aktivovaný v prostředí hypoxie, reguluje stovky v buňkách přítomných připravených genů, zahrnutých v procesech angiogeneze (geny pro VEGF, MMP), glykolýzy a invazivity. Na aktivaci angiogeneze a imunosupresních procesů se podílí kromě hypoxie i nízké pH a chronických zánět. Hlubší pochopení vzájemné interakce angiogeneze a regulace imunitních funkcí nám ukáže nové možnosti kombinovaných protinádorových léčebných postupů i nové biomarkery.
VEGF produkce byla popsána u řady nádorů, a jeho hladina je významně nižší u zdravých kontrol [15–17]. Není jasně definovaný „cut-off“ normální a elevované hladiny VEGF, není ani jednotný materiál odběru (plazma, sérum) a postup při odběru a po něm (přidání inhibitoru aktivátoru destiček) [18]. Yuan ve své práci, monitorující předléčebnou hladinu VEGF u MM pacientů stadia IV léčených ipilimumabem, definoval cut-off 43 pg/ml a vyšší hladiny asociované s kratším přežíváním [19]. Sabatino definoval cut-off 125 pg/ml při predikci klinické odpovědi na IL-2. Pacienti mající v séru vyšší hladinu VEGF pak prokazovali nedostatečnou klinickou odpověď na léčbu [20]. Podobné pozorování ve vztahu k HDI jsme v naší práci nezaznamenali. V našem souboru nejvyšší předléčebná hladina u pacienta, který po léčbě dosáhl dlouhodobé CR, byla 1 598 pg/ml (ale zareagoval na léčbu poklesem hladiny), kdežto pacient, který zemřel 3 měsíce po skončení HDI, měl vstupní hladinu VEGF 325 pg/ml, ale při léčbě tato hladina rostla, a zároveň poklesla hladina MMP8. Průměr vstupní hladiny VEGF v celém souboru činí 593,5 pg/ml; vztaženo na pacienty, kteří dospěli do dlouhodobé CR, je průměr jejich vstupních hodnot 609,3 pg/ml. Nezaznamenali jsme cut-off hodnoty VEGF, při jejímž dosažení, či překročení, by pacienti ve svých klinických výstupech dopadali hůře. V tomto aspektu se naše pozorování shoduje s kritiky užívání VEGF v souvislosti s nádorovou angiogenezí – Niersem et al. [18].
Vysoké hladiny VEGF jsou asociovány s akcentovanou schopností nádoru metastazovat [5, 16, 17, 21–23] a tím pádem se špatnou prognózou [17, 20, 21, 24–31]. Exprese VEGF vzrůstá s agresivitou onemocnění, proto jsou detekovány vyšší hladiny VEGF u pacientů s metastazujícím onemocněním v porovnání s nemetastazujícím [15]. Mozillo pozoroval, že vyšší hladiny VEGF v séru jsou spojeny s DFS u melanomu kůže. Hodnotil 33 pacientů, medián sérové hodnoty VEGF v čase diagnózy byl 249 ng/l (resp. 9–1 215). Pacienti s vyššími sérovými hodnotami VEGF měli kratší DFS (25 vs. 60) [14]. S vyšší hladinou VEGF se zkracuje DFS a v případě negativního uzlinového statusu vysoká hladina VEGF predikuje časnou rekurenci [16]. V naší skupině takováto pozorování nemáme, nicméně delší follow-up to může odkrýt.
Hladiny VEGF monitorují léčebnou odpověď a mají klinický význam jak u MM [19], tak u jiných nádorů [32]. Demirkesen popsal korelaci mezi angiogenezí a metastazováním [15]; klinický význam poklesu VEGF je ve shodě s touto korelací. VEGF podporuje angiogenezi a s rozvojem angiogeneze jde ruku v ruce metastazování [23]. Byla pozorována rovněž korelace hladin VEGF s rozvojem mikrometastáz [21]. Cascinu popisuje, že VEGF může predikovat event-free survival, a být tak použitelným rádcem vhodnosti adjuvantní léčby [16]. Fontanini prospektivně hodnotil výpovědní hodnotu VEGF jakožto prognostického indikátoru angiogeneze ve vztahu k celkovému přežívání [25]. Alabi popsal, že před léčbou jsou hladiny VEGF asociovány s rozvojem metastáz [22]. V naší práci jsme spíše pozorovali, že pokles hladiny VEGF při léčbě HDI může predikovat event-free survival a prognosticky být příznivý, ačkoli jsme pracovali s malými čísly.
Yurkovetsky, Kirkwood et al. zaznamenali hladiny VEGF u zdravé kontroly v průměru 76,6 pg/ml (34,9–151,5), u pacientů s MM 215 pg/ml (192,1–783,1). V jejich sledování terapie HDI snižuje hladiny VEGF [33]. V naší skupině adjuvantně léčených pacientů byla průměrná hladina VEGF vyšší, ale shodně jsme prokázali její pokles při terapii HDI. Význam tohoto poklesu má vztah k RFS. Pacienti, kteří odpověděli na léčbu poklesem VEGF, dosahovali dlouhodobé terapeutické odpovědi, a byli bez známek choroby v průměru 30,8 měsíce s follow-up 2 roky. Vysvětlení tohoto terapeutického úspěchu vnímáme v komplexnosti role VEGF v progresi nádorového onemocnění, kterou se terapeutickým zásahem podařilo narušit. VEGF hraje zřejmě roli v supresi imunitní odpovědi, a moduluje supresivní nastavení nádorového mikroprostředí, proto se inhibice VEGF jeví jako atraktivní partner nových imunoterapeutických postupů (kombinace ipilimumab a bevacizumab, kombinace s blokátory angiopoetinů aj.).
Hladiny cirkulujících cytokinů korelují s infiltrací nádoru buňkami imunitního systému [34]. Raig et al. popisují, že interferon inhibuje VEGF [11]. Naše pozorování je v souladu s Raigem et al. Také v naší práci se potvrdilo, že sekrece VEGF může být inhibována IFN-α, a že pacienti, kteří na léčbu IFN-α imunoterapií odpoví poklesem sérové hladiny VEGF, mají dlouhý PFS.
V literatuře najdeme ambivalentní výsledky prací s MMP8 a stejně ambivalentní jsou i výsledky našeho měření. MMP8 je vnímána jako tumor supresor, který má i potenciál snižovat schopnost nádorové kolonie metastazovat [35, 36]. Oproti tomu v práci Lempinena nízké hladiny MMP-8 korelovali s delším celkovým přežíváním [37]. Väyrynen et al. stanovovali hladinu MMP-8 a podle jejich výsledků MMP-8 má protinádorové působení, které se projevuje ovlivněním imunitní odpovědí vedoucí k nekróze nádorové tkáně [38]. Obdobně postavenou studii jako naše kohorta publikoval nedávno Vihinen et al. MMP-8 měřil jako prediktor odpovědi na adjuvantní léčbu interferonem u pacientů operovaných pro vysoce rizikový kožní melanom stadia IIB-IIIC. U pacientů s vysokými předléčebnými hladinami MMP-8 adjuvantní léčba signifikantně prodloužila RFS (36,8 vs. 10,6 měsíce) [39]. Takové výsledky z naší práce neplynou. Role MMP se zřejmě mění tak, jak se mění nastavení mikroprostředí, a je ovlivnitelná na mnoha frontách. Naše výsledky s MMP tak jen dokládají, že ještě mnoho preklinické práce je potřeba na poli MMP i jejich inhibitorů, protože in vivo není jasné, na které straně hrají, zda pro/antiangiogenní, zda růst nádoru inhibují, nebo podporují.
Terapeutická inhibice VEGF ovlivňuje imunosupresi také “normalizací cév”, a cévy normalizující dávky antiangiogenních preparátů napomáhají reprogramování imunosupresivního nádorového mikroprostředí a tím i zlepšení imunitní odpovědi a imunoterapie [40]. Úprava nastavení mikroprostředí, kterou přináší antiangiogenní léčba, však nedokáže reaktivovat imunitní odpověď proti nádoru. Hovoří se proto o možnostech kombinace antiangiogenních preparátů a imunoterapie jakožto způsobu, jak zvýšit efektivitu imunoterapie. Strategie imunoterapie se stále více zaměřuje na překonávání bariér v TME.
VEGF hraje zřejmě roli v supresi imunitní odpovědi, a moduluje nastavení nádorového mikroprostředí. Inhibice VEGF se jeví jako atraktivní partner nových imunoterapeutických postupů (např. ipilimumab a bevacizumab, kombinace s blokátory angiopoetinů aj.).
Antiangiogenní léčba ani imunoterapeutické postupy nemají definovaný biomarker nebo prediktor. Jedním z nejvíce a nejdéle diskutovaných prediktorů léčby interferonem je ulcerace nádoru. Ulcerovaný melanom je svébytnou biologickou jednotkou, se špatnou prognózou, ale vyšším benefitem z podávání interferonů, jak plyne ze dvou retrospektivních a jedné prospektivní studie [10]. Když vztáhneme výsledky na skupinu ulcerovaných melanomů z našeho souboru, nelze popsat lepší výsledky nad rámec celé skupiny.
Před příchodem přelomových imunoterapeutických preparátů byla angiogeneze jednou z nejsledovanějších cest v patogenezi maligního melanomu – od neoplastických fází, přes progresi po metastazování. Nyní za sebou máme skoro 10 let s cílenými a imunoterapeutickými preparáty ve výzkumu, v klinice 5 let. Ukázaly se jejich limity, a prostor pro zkoumání angiogeneze, a zejména kombinace s imunoterapií a její role v rezistenci na imunoterapii, se opět otevírá (v adjuvantní i paliativní léčbě).
Hodnocení adjuvantních studií trvá dlouho a na výsledky probíhajících adjuvantních studií si budeme muset 5 – 10 let počkat. Ale zdá se zjevné, že lepší a trvalé výsledky bude přinášet kombinovaná léčba. I průlomové nové inhibitory checkpointů (anti CTLA-4 a anti-PD protilátky) v imunoterapii pracují pouze na pilíři adaptivní imunity. Stále nemáme v klinice preparáty fungující na úrovni přirozené imunity. Odstranit imunosupresní složky nerovná se nastartovat efektivní protinádorovou imunitní odpověď. Optimální imunoterapeutické režimy teprve hledáme, ale s určitostí můžeme říci, že příchod imunoterapie zásadně změnil léčebná schémata i výhledy pacientů s maligním melanomem a interferon si v nich hledá své místo.
ZÁVĚRY
I incipientní stadia maligního melanomu mohou být fatální. Klíčem není TNM stadium, ale (angiogenní) potenciál nádoru státi se systémovou chorobou.
Byl statisticky potvrzen trend ke snížení hladin VEGF-A po intravenózním podání vysokodávkovaného interferonu alfa-2b, nehledě na vstupní stadium. Tato reakce na HDI je zřejmě odrazem „interferování“ interferonů do procesu angiogeneze a progrese choroby a navzdory tomu, že pracujeme s malými čísly a nedosahujeme statistické signifikance, jeví se pro pacienty prognosticky významnější než samotná vstupní hladina VEGF. Vysokodávkovaný interferon alfa-2b má podle našeho pozorování mj. antiangiogenní působení.
Role MMP-8 zůstává nejasná. Naše pozorování poskytuje ambivalentní výsledky a nenaplňuje představu tumor supresivního působení MMP-8.
Neznáme prediktor ani biomarker pro antiangiogenní léčbu, ani pro imunoterapii. Jejich vstup do klinické praxe je stále kýženě očekáván.
Změny nastavení nádorového mikroprostředí mohou podpořit nebo naopak inhibovat angiogenezi a růst samotného nádoru.
Působení IFNs (komunikačních proteinů IS) na VEGF (angiogenní a imunosupresní promotor) a dobré terapeutické výsledky pacientů, u kterých se toto působení projevilo poklesem VEGF, dávají naše výsledky do kontextu se současným trendem v preklinických i klinických modelech, že angiogeneze jde ruku v ruce s imunosupresí jakožto jeden z mechanismů úniku imunitnímu dohledu. Kombinace antiangiogenní léčby s imunoterapeutickými metodami, která využívá jejich synergistického působení, je cestou k překonání jejích současných limitů.
Optimální imunoterapeutické režimy hledáme. Imunoterapie zásadně změnila léčebná schémata i výhledy pacientů s maligním melanomem a interferony i antiangiogenní preparáty si hledají své místo v kombinovaných schématech.
Použité zkratky:
CTLA4 cytotoxic T-lymphocyte-associated protein 4
DC dendritické buňky
EORTC European Organisation for Research and Treatment of Cancer
HDI high dose interferon (vysokodávkovaný interferon)
HIF hypoxií inducibilní transkripční faktor
IRF interferonem regulovaný transkripční faktor
ISGs interferonem stimulované geny
MDSCs myeloid derived supressor cells
MM maligní melanom
MMP matrixmetaloproteinázy
NF-κB nuclear factor kappa-light-chain-enhancer of
activated B cells
PHIP pleckstrin homology domain-interacting protein
PD receptor programované buněčné smrti
STAT signal transducer and transcription activator
TAMs makrofágy asociované s tumorem
TECs tumor endothelial cells (endotelie nádorových cév)
T-ly T lymfocyty
TNF/R tumor necrosis factor/receptor
Tregs regulační T lymfocyty
VEGF/R vaskulární endotelový růstový faktor/receptor
WNT Wingless/Int-1 (signalizační dráha)
Adresa pro korespondenci:
MUDr. Jarmila Prošvicová
Pálenecká 380
503 11 Hradec Králové 15
e-mail: Jaja.vanaskova@seznam.cz
Do redakce došlo dne 20. 3. 2016.
Sources
1. Voron T, Marcheteau E, Pernot S, Colussi O, Tartour E, Taieb J, Terme M. Control of the immune response by pro-angiogenic factors. Front Oncol, 2014;4 : 70. doi: 10.3389/fonc.2014.00070.
2. Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell, 1996;86 : 353–364.
3. Bayko L, Rak J, Man S, Bicknell R, Ferrara N, Kerbel RS. The dormant in vivo phenotype of early stage primary human melanoma: termination by overexpression of vascular endothelial growth factor. Angiogenesis, 1998;2(3):203–217.
4. Erhard H, Rietveld FJ, Van Altena MC, Brockner EB, Ruiter DJ, De Waal RM. Transition of horizontal to vertical growth phase melanoma is accompanied by induction of vascular endothelial growth factor expression and angiogenesis. Melanoma Res, 1997;7 Suppl 2:S19–26.
5. Rajabi P, Neshat A, Mokhtari MA, Eftekhari M, Tavakoli P. The role of VEGF in melanoma progression. J Res Med Sci, 2012;17(6):534–539.
6. Bates RC, Goldsmith JD, Bachelder RE, et al. Flt-1-dependent survival characterizes the epithelial-mesenchymal transition of colonic organoids. Curr Biol, 2003;13(19):1721–1727.
7. Huang H, Langenkamp E, Georganaki M, et al. VEGF suppresses T-lymphocyte infiltration in the tumor microenvironment through inhibition of NF-κB-induced endothelial activation. FASEB J, 2015;29(1):227–238.
8. Tarhini AA. Neoadjuvant therapy for melanoma: a promising therapeutic approach and an ideal platform in drug development. Am Soc Clin Oncol Educ Book, 2015:e535–542.
9. Rakosy Z, Ecsedi S, Toth R, et al. Integrative genomics identifies gene signature associated with melanoma ulceration. PLoS One, 2013;8(1):e54958. doi: 10.1371/journal.pone.0054958. Epub 2013 Jan 30.
10. Eggermont AM, Suciu S, Rutkowski P, et al. Long term follow up of the EORTC 18952 trial of adjuvant therapy in resected stage IIB-III cutaneous melanoma patients comparing intermediate doses of interferon-alpha-2b (IFN) with observation: Ulceration of primary is key determinant for IFN-sensitivity. Eur J Cancer, 2016;55 : 111–121. doi: 10.1016/j.ejca.2015.11.014. Epub 2016 Jan 17.
11. Raig ET, Jones NB, Varker KA, et al. VEGF Secretion is Inhibited by Interferon-Alpha in Several Melanoma Cell Lines. J Interferon Cytokine Res, 2008;28(9):553–561.
12. Gutiérez-Fernández A, Fueyo A, Folgueras AR, et al. Matrix metalloproteinase-8 functions as a metastasis suppressor through modulation of tumor cell adhesion and invasion. Cancer Res, 2008;68(8):2755–2763.
13. Tarhini AA, Lin Y, Zahoor H, Shuai Y, et al. Pro-Inflammatory Cytokines Predict Relapse-Free Survival after One Month of Interferon-α but Not Observation in Intermediate Risk Melanoma Patients. PLoS One, 2015;10(7).
14. Mozzillo N, Ascierto P. Reduction of circulating regulatory T cells by intravenous high-dose interferon alfa-2b treatment in melanoma patients. Clin Exp Metastasis, 2012;29(7):801–805.
15. Demirkesen C, Buyukpinarbasili N, Ramazanoglu R, et al. The correlation of angiogenesis with metastasis in primary cutaneous melanoma: a comparative analysis of microvessel density, expression of vascular endothelial growth factor and basic fibroblastic growth factor. Pathology, 2006;(38):132–137.
16. Cascinu S, Staccioli MP, Gasparini G, et al. Expression of vascular endothelial growth factor can predict event-free survival in stage II colon cancer. Clin Cancer Res, 2000;6(7):2803–2807.
17. Seo HY, Park JM, Park KH, et al. Prognostic significance of serum vascular endothelial growth factor per platelet count in unresectable advanced gastric cancer patients. Jpn J Clin Oncol, 2010;40(12):1147–1153.
18. Niers TM, Richel DJ, Meijers JC, et al. Vascular Endothelial Growth Factor in the Circulation in Cancer Patients May Not Be a Relevant Biomarker. Plos One, 2011;6:e19873 : 1–6.
19. Yuan J, Zhou J, Dong Z, et al. Pretreatment serum VEGF is associated with clinical response and overall survival in advanced melanoma patients treated with ipilimumab. Cancer Immunol Res, 2014;2(2):127–132.
20. Sabatino M, Kim-Schulze S, Panelli MC, et al. Serum vascular endothelial growth factor and fibronectin predict clinical response to high-dose interleukin-2 therapy. J Clin Oncol, 2009;27(16):2645–2652.
21. Crosby MB, Yang H, Gao W, et al. Serum vascular endothelial growth factor levels correlate with number and location of micrometastases in a murine model of uveal melanoma. Br J Ophtalmol, 2011;95 : 112–117.
22. Alabi AA, Suppiah A, Madden LA, et al. Preoperative serum levels of serum VEGF-C is associated with distant metastasis in colorectal cancer patients. Int J Colorectal Dis, 2009;24 : 269e74.
23. Rofstad EK, Halsor EF. Vascular endothelial growth factor, interleukin 8, platelet-derived endothelial cell growth factor, and basic fibroblast growth factor promote angiogenesis and metastasis in human melanoma xenografts. Cancer Res, 2000;60(17):4932–4938.
24. Brychtova S, Bezdekova M, Brychta T, et al. The role of vascular endothelial growth factors and their receptors in malignant melanomas. Neoplasma, 2008;55(4):273–279.
25. Fontanini G, Lucchi M, Vignati S, et al. Angiogenesis as a prognostic indicator of survival in non-small-cell lung carcinoma: a prospective study. J Natl Cancer Inst, 1997;89 : 881–886.
26. Mouawad R, Spano JP, Comperat E, et al. Tumoural expression and circulating level of VEGFR-3 (Flt-4) in metastatic melanoma patients: correlation with clinical parameters and outcome. Eur J Cancer, 2009;45(8):1407–1414.
27. Ascierto PA, Leonardi E, Ottaiano A, et al. Prognostic value of serum VEGF in melanoma patients: a pilot study. Anticancer Res, 2004;24 : 2455–2458.
28. Osella-Abate S, Quaglino P, Savoia P, et al. VEGF-165 serum levels and tyrosinase expression in melanoma patients: correlation with the clinical course. Melanoma Res, 2002;12(4):325–334.
29. Mehnert JM, Mccarthy MM, Jilaveanu L, et al. Quantitative expression of VEGF, VEGF-R1, VEGF-R2, and VEGF-R3 in melanoma tissue microarrays. Hum Pathol, 2010;41(3):375–384.
30. Potti A, Moazzam N, Tendulkar K, et al. Immunohistochemical determination of vascular endothelial growth factor (VEGF) overexpression in malignant melanoma. Anticancer Res, 2003;23(5A):4023–4026.
31. Poon RT, Fan ST, Wong J. Clinical implications of circulating angiogenic factors in cancer patients. J Clin Oncol, 2001;19(4):1207–1225.
32. Vidal O, Metges JP, Elizalde I, et al. High preoperative serum vascular endothelial growth factor levels predict poor clinical outcome after curative resection of gastric cancer. Br J Surg, 2009;96 : 1443–1451.
33. Yurkovetsky ZR, Kirkwood JM, Edington HD, et al. Multiplex analysis of serum cytokines in melanoma patients treated with interferon-alfa2b. Clin Cancer Res, 2007;13(8):2422–2428.
34. Roland CL, Lynn KD, Toombs JE, et al. Cytokine Levels Correlate with Immune Cell Infiltration after Anti-VEGF Therapy in Preclinical Mouse Models of Breast Cancer. PlosOne, 2009;11(4): e7660 : 1–13.
35. Friedl P, Alexander S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell, 2011;147(5):992–1009.
36. Kohrmann A, Kammerer U, Kapp M, et al. Expression of matrix metalloproteinases (MMPs) in primary human breast cancer and breast cancer cell lines: New findings and review of the literature. JBMC Cancer, 2009;9 : 188.
37. Lempinen M, Lyytinen I, Nordin A, et al. Prognostic value of serum MMP-8, -9 and TIMP-1 in patients with hepatocellular carcinoma. Ann Med, 2013;45(7):482–487.
38. Vayrynen JP, Vornanen J, Tervahartiala T, et al. Serum MMP-8 levels increase in colorectal cancer and correlate with disease course and inflammatory properties of primary tumors. Int J Cancer, 2012;131(4):E463–474.
39. Vihinen P, Tervahartiala T, Sorsa T, Hansson J, Bastholt L, Aamdal S, Stierner U, Pyrhonen S, Syrjanen K, Lundin J, Hernberg M. Benefit of adjuvant interferon alfa-2b (IFN-α) therapy in melanoma patients with high serum MMP-8 levels. Cancer Immunol Immunother, 2015;64(2):173–180.
40. Yuhui H, Jianping Y, Elda R, et al. Vascular normalizing doses of antiangiogenic treatment reprogram the immunosuppressive tumor microenvironment and enhance immunotherapy. Proc Natl Acad Sci U S A, 2012;109(43):17561–17566.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2017 Issue 1-
All articles in this issue
- Prevalence protilátek proti viru hepatitidy E v České republice – sérologický přehled
- Infekční choroby a laboratorní diagnostika v podmínkách Židovského ghetta Terezín
- Nespecifická imunoterapie inhibuje angiogenezi – výsledky monitorování sérových hladin vaskulárního endotelového růstového faktoru a matrixmetaloproteinázy 8 v průběhu adjuvantní léčby vysokodávkovaným interferonem u pacientů s maligním melanomem
- Management akutní anafylaxe v klinické praxi v kontextu doporučených postupů
- Alimentárny botulizmus – staronová výzva pre verejné zdravotníctvo
- Možnosti implementace sekvenace celého genomu (WGS) Neisseria meningitidis do molekulární surveillance invazivního meningokokového onemocnění v České republice
- Trend a výzva v prenose syfilisu z matky na dieťa
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Management akutní anafylaxe v klinické praxi v kontextu doporučených postupů
- Prevalence protilátek proti viru hepatitidy E v České republice – sérologický přehled
- Alimentárny botulizmus – staronová výzva pre verejné zdravotníctvo
- Infekční choroby a laboratorní diagnostika v podmínkách Židovského ghetta Terezín
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

