-
Medical journals
- Career
Stenotrophomonas maltophilia jako původce ventilátorové pneumonie u pacientky s toxickou epidermální nekrolýzou a klostridiovou kolitidou: čas na off-label podání tigecyklinu?
: B. Lipový 1,2; H. Řihová 1; M. Hanslianová 3; I. Suchánek 1; P. Brychta 1,2
: Klinika popálenin a rekonstrukční chirurgie FN Brno 1; Lékařská fakulta Masarykovy univerzity Brno 2; Oddělení klinické mikrobiologie, FN Brno 3
: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 3, s. 177-181
: Original Papers
Toxická epidermální nekrolýza (TEN) je autoimunitní onemocnění, způsobené většinou medikamenty, projevující se dominantně v oblasti kůže a sliznic. Jedná se o vzácné onemocnění s vysokou mortalitou. Dominantní podíl na mortalitě pacientů s TEN mají infekční komplikace. Vzhledem k tomu, že antimikrobiální přípravky, mohou indukovat rozvoj tohoto syndromu, je antimikrobiální management velmi komplikovaný. Tigecyklin je stále relativně nové antibiotikum, které je v Evropě schváleno pro komplikované nitrobřišní infekce a komplikované infekce kůže a měkkých tkání. Mezi základní výhody použití tigecyklinu u pacientů s TEN patří jeho dobrá prostupnost do tkání, široké spektrum umožňující v řadě případů monoterapii a v neposlední řadě, v porovnání s jinými antimikrobiálními přípravky, minimální provokační potenciál z pohledu zhoršení závažnosti základního onemocnění další stimulací imunitního systému. V kazuistice prezentujeme případ úspěšné terapie 81leté pacientky s TEN a mnohočetnými infekčními komplikacemi v různých kompartmentech, z nichž byla nejzávažnější ventilátorová pneumonie způsobená Stenotrophomonas maltophilia. Celkový stav byl dále zdramatizován současným rozvojem klostridiové kolitidy. Jako jedno z terapeutických možností bylo podání tigecyklinu, byť v souvislosti s léčbou ventilátorové pneumonie šlo o „off-label“ podání.
Klíčová slova:
toxická epidermální nekrolýza – tigecyklin – „off-label“ indikace – klostridiová kolitidaÚVOD
Toxická epidermální nekrolýza (TEN) je vzácné systémové onemocnění, které se dominantně manifestuje v oblasti kůže a sliznice. TEN je nejzávažnější onemocnění ze skupiny tzv. Burn-like syndromů, mortalita se pohybuje okolo 25–35 %. Výskyt v populaci se udává někde mezi 0,5–1,5 případů na 1 milion obyvatel za rok [1]. Základem pro rozvoj tohoto syndromu je CD4+ mediovaná T lymfocytární toxicita indukující apoptózu v oblasti dermoepidermální junkce. Dochází tak k různě rozsáhlé kožní a slizniční exfoliaci. Vzhledem k tomu, že se jedná o autoimunitní onemocnění, je základem v terapeutickém přístupu podávání imunosupresiv a tzv. symptomatická doplňková terapie (celková i lokální). Vzhledem ke ztrátě kožního krytu a tedy kompromitaci funkce lokální bariéry, spolu s farmakologicky indukovanou imunosupresí, představují tito pacienti jednu z nejohroženějších skupin z pohledu rozvoje infekčních komplikací nejrůznějšími potenciálně patogenními mirkoorganismy (PPM) včetně oportunních zástupců [2].
Precizní a individualizovaná mikrobiologická surveillance, spolu s antimikrobiální terapií, představuje dnes nejdůležitější část léčby, která mnohdy rozhoduje o přežití pacientů s TEN. Z pohledu dodatečné senzibilizace představuje terapie infekčních komplikací u pacientů s TEN jednu z nejnáročnějších kapitol vůbec. Každý antimikrobiální přípravek musí být podroben velmi kritickému zhodnocení nejen z pohledu citlivosti, eventuálně rezistence PPM, ale také z pohledu dodatečné provokace imunitního systému.
V kazuistice prezentujeme případ úspěšné terapie 81leté pacientky s TEN a mnohočetnými infekčními komplikacemi v různých kompartmentech, z nichž byla nejzávažnější ventilátorová pneumonie způsobená Stenotrophomonas maltophilia. Celkový stav byl dále zdramatizován současným rozvojem klostridiové kolitidy. Jako jedno z terapeutických možností bylo podání tigecyklinu, byť v souvislosti s léčbou ventilátorové pneumonie šlo o „off-label“ podání.
KAZUISTIKA
81letá pacientka byla primárně hospitalizovaná v únoru 2015 na neurologické klinice pro ztrátu vědomí a následně generalizované konvulze. Bylo provedeno CT vyšetření mozku bez nálezu krvácení nebo ischémie. Pro pokračující záchvaty u pacientky dochází k zavedení terapie antikonvulzivy – valproát a fenytoin. Během 4 dní dochází k rozvoji hnisavé tracheobronchitidy a sepse. Primárně nasazen oxacilin a ceftriaxon. Za 9 dní od začátku hospitalizace dochází k postupnému výsevu exfoliativních lézí v oblasti zad a dorzální strany horních i dolních končetin. I přes vysazení všech medikamentů podezřelých z indukce kožních erupcí a nasazení kortikosteroidů spolu s terapií intravenózními imunoglobuliny, dochází k další propagaci, proto byla pacientka přeložena na naši kliniku.
Primární evaluace rozsahu a lokalizace exfoliovaných ploch byla provedena na operačním sále, pacientka měla provedenu tracheostomii. Početné splývající defekty kůže na zádech a dorzálních partiích obou horních i dolních končetin (obr. 1, 2). Přítomné buly byly vyplněny serózní tekutinou, klinicky byl pozitivní Nikolského fenomén. Celkový rozsah exfoliace byl zhodnocen na 33 % TBSA (total body surface area), histologické vyšetření dvou kožních odběrů (obr. 3) potvrdilo apoptotickou indukci v oblasti dermo-epidermální junkce. Nebylo shledáno postižení sliznic. SCORTEN (SCORe of Toxic Epidermal Necrosis) při přijetí byl 5, což představuje více než 90% mortalitu.[3]
1. Rozsah exfoliovaných ploch v oblasti zad Fig.1. Extent of exfoliated surfaces in the back areas 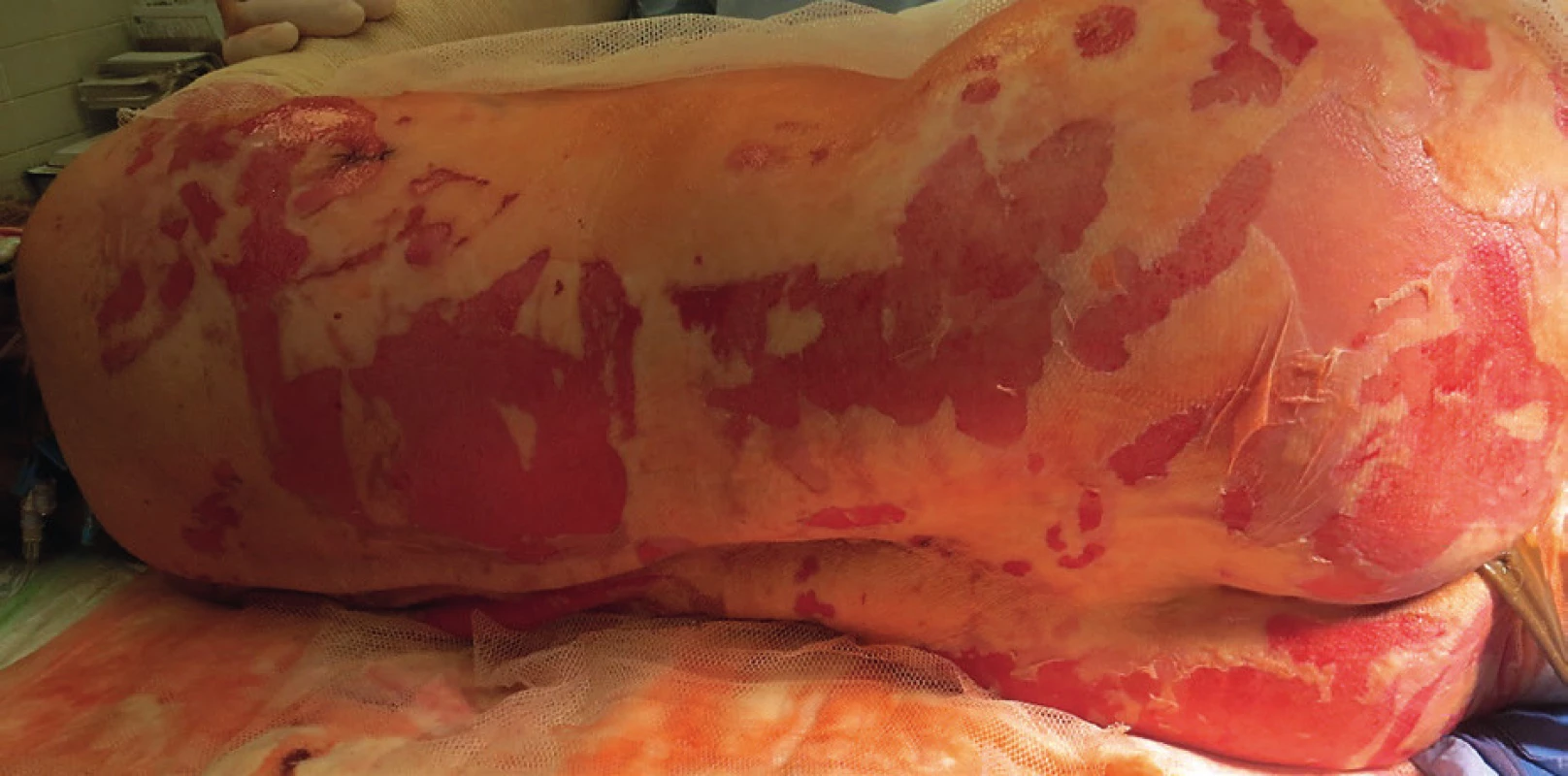
2. Rozsah exfoliovaných ploch v oblasti dorzální strany stehen Fig. 2. Extent of exfoliated surfaces on the posterior thighs 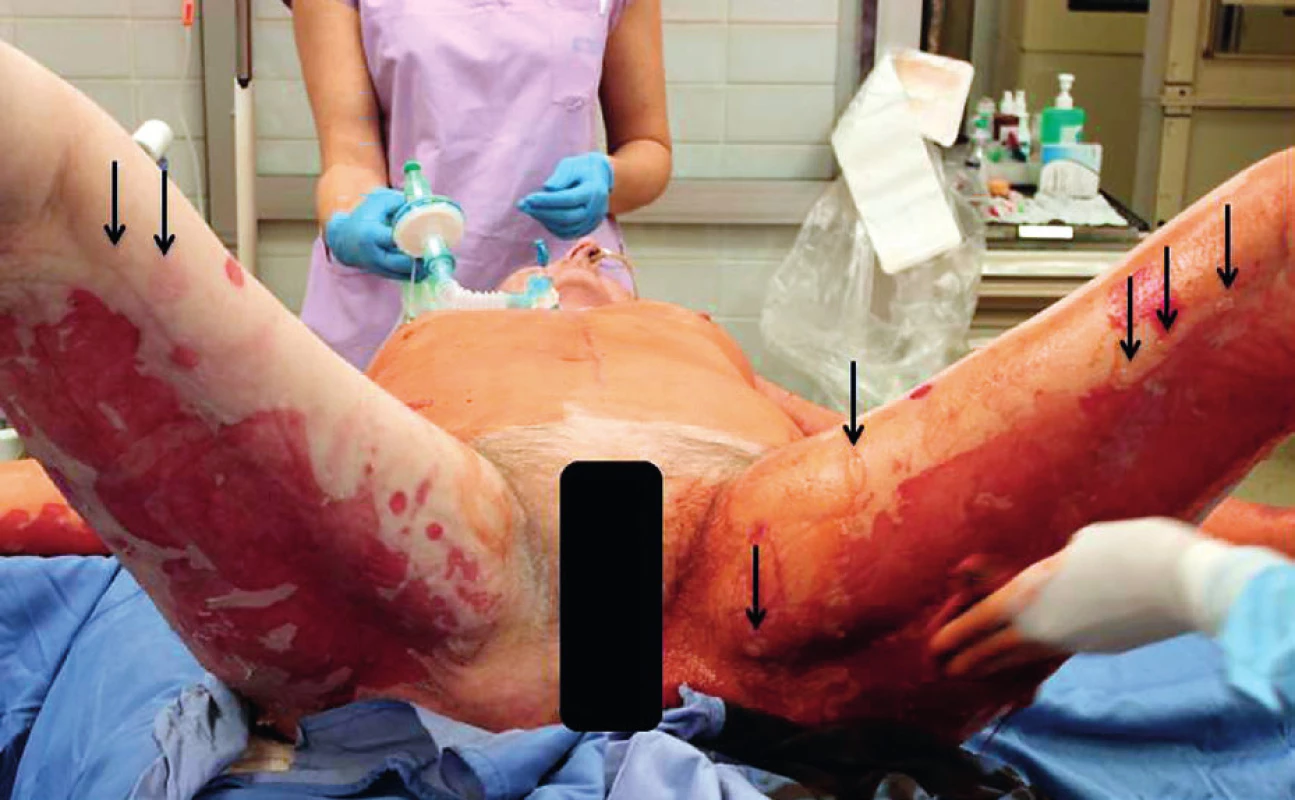
Černé šipky označují čerstvě vznikající buly. Black arrows indicate freshly formed bullae. 3. Odběr kožní biopsie v histologickému vyšetření a potvrzení diagnózy TEN Fig. 3. Collection of a skin biopsy specimen for histopathologic examination and confirmation of the diagnosis of TEN 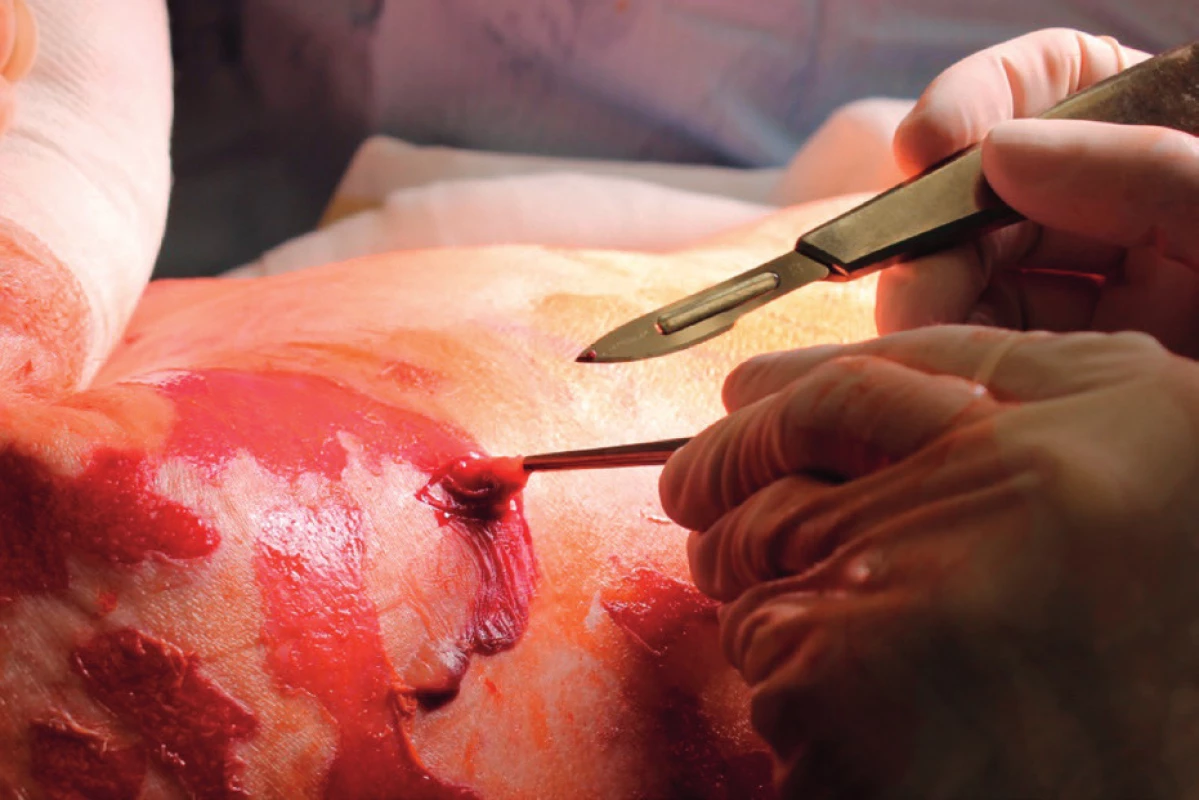
Do zavedené imunosupresivní terapie byl přidán cyklosporin A v dávkovacím schématu 5 mg/kg rozděleného do dvou dávek po dobu 5 dní. Bylo prováděno pravidelné monitorování plazmatické koncentrace cyklosporinu A. Pro potenciaci imunosupresivního efektu byly ponechány kortikosteroidy v redukované dávce (methylprednisolon 80 mg á 8 hod) a první aplikace IVIG terapie v dávce 60 g/den (při hospitalizaci na spádové neurologii) byla redukována na 15 g/den po dobu 5 dní. V průběhu terapie byly pravidelně monitorovány klíčové imunologické parametry, zejména hodnoty CD4+ lymfocytů. Vzhledem k vysokému riziku rozvoje infekčních komplikací byla prováděna individuální a precizní imunologická surveillance, doplněná o pravidelné monitorování hodnot CD14+ monocytů.
Následně byly prováděny pravidelné převazy na operačním sále v celkové anestezii. Během prvního týdne hospitalizace se podařilo zastavit další propagaci kožních defektů a navodit reepitelizační potenciál v oblasti exfoliovaných ploch (obr. 4). Pacientka byla po 28 dnech hospitalizace přeložena na spádovou neurologii se zbytkovými defekty v rozsahu cca 6 % TBSA ke konzervativnímu dohojení.
4. Zbytkové defekty v oblasti zad s potenciálem reepitelizace Fig. 4. Residual defects in the back area with potential for reepithelialisation 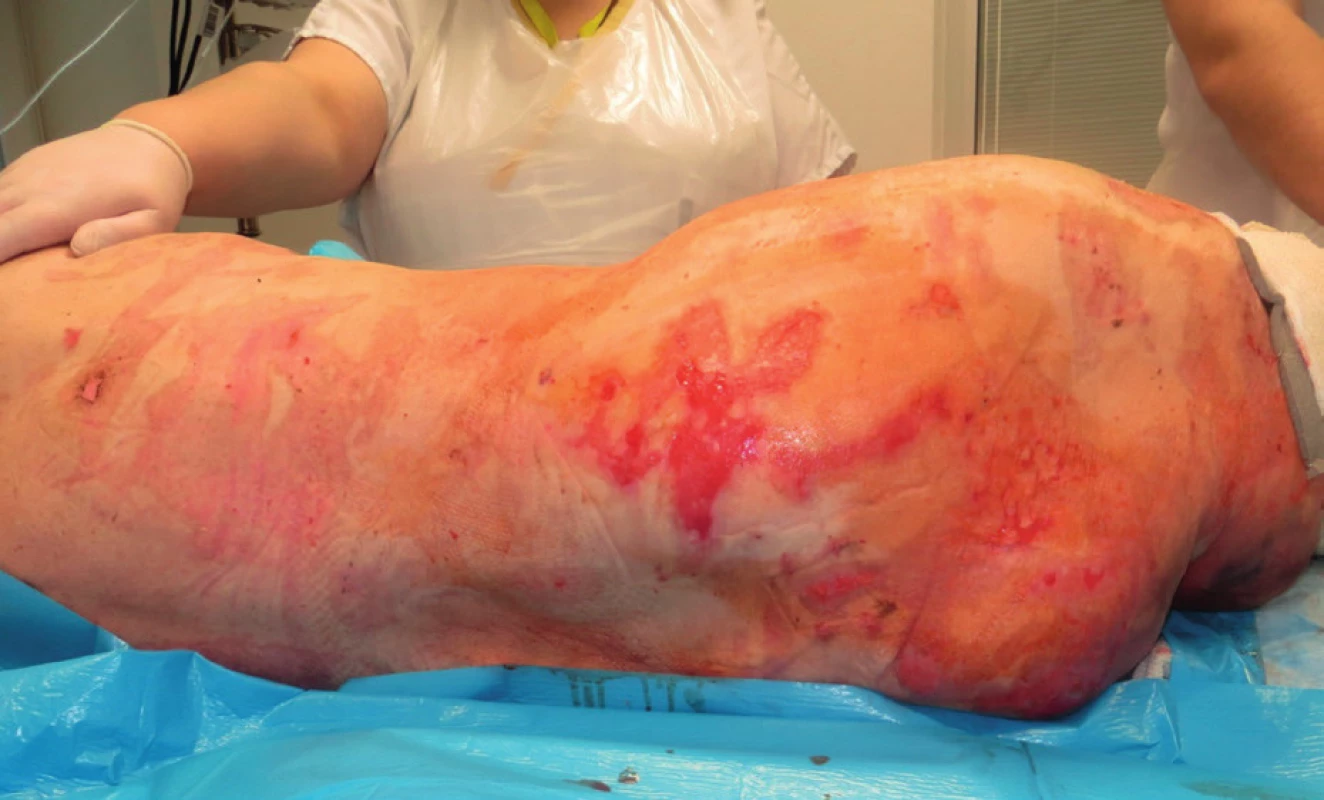
MIKROBIOLOGIE
Semikvantitativní otisková metoda v oblasti exfoliovaných ploch identifikovala několik PPM (potenciálně patogenních mikrobů), které byly vykultivovány v koncentraci svědčící pro lokální infekci (Pseudomonas aeruginosa, Enterobacter cloacae s produkcí širokospektré betalaktamázy typu AmpC, Escherichia coli). V této fázi vzhledem k imunosupresi a redukci počtu leukocytů klasické známky lokální infekce chybí nebo jsou alterovány.
Po vstupním bronchoskopickém vyšetření byla z bronchoalveolární laváže vykultivována P. aeruginosa a Klebsiella pneumoniae v koncentraci 104 CFU (colony-forming unit)/ml z levé plíce a P. aeruginosa a E. cloacae rovněž s produkcí betalaktamázy AmpC z pravé plíce. Závažnost kultivačního nálezu potvrzoval i mikroskopický preparát se záplavou leukocytů a gramnegativních tyček. U P. aeruginosa šlo o tzv. wild-type s dobrou citlivostí k antibiotikům, K. pneumoniae nebyla producentem širokospektré betalaktamázy, ale pro citlivost, respektive rezistenci kmene E. cloacae byl do terapie zvolen meropenem. Po 7 dnech terapie byla kontrolní bronchoskopie bez nálezu PPM v oblasti dolních dýchacích cest. Po dalších 3 dnech došlo ke zhoršení stavu pacientky a z bronchoalveolární laváže byl ze všech plicních polí vykultivován kmen již rezistentní k většině antimikrobiálních přípravků – S. maltophilia v koncentraci >104 CFU/ml. Do terapie byl zařazen ciprofloxacin. Bohužel i přes probiotika po třech dávkách tohoto flourochinolonu došlo k rozvoji průjmovitých stolic a identifikaci původce komplikací – Clostridium difficile (toxigenní kmen).
S. maltophilia je bakteriální druh přirozeně rezistentní k řadě antibiotik, vzhledem k antibiogramu přicházela v úvahu pouze terapie chloramfenikolem nebo tigecyklinem. Chloramfenikol vzhledem k jeho nežádoucím účinkům by nadále zhoršoval situaci rizikem útlumu hematopoézy, proto padla volba na tigecyklin. V případě „off-label“ indikace tigecyklinu, zejména v terapii nozokomiálních pneumonií, je preferována dvojnásobná dávka. Přesto jsme se rozhodli podat standardizovanou dávku, tedy 100 mg iniciálně a dále 50 mg á 12 hodin. Tigecyklin v této fázi byl nejen jedinou terapeutickou možností, ale navíc v kombinaci s perorálním vankomycinem (125 mg á 6 hod) byl s výhodou použit v terapii klostridiové kolitidy, ale také v eradikaci PPM na epitelizujících kožních defektech (koaguláza negativní stafylokok, E. coli), což bylo zásadní pro správný a úspěšný postup v hojení rány.
Díky tigecyklinu dochází k úplné eradikaci stenotrofomonády, ale na ranných plochách se opět objevuje kultivační záchyt kmene P. aeruginosa, která si ponechává citlivost k cefalosporinům IV. generace. Do kombinace s tigecyklinem byl proto dále přidán cefepim (2 g á 12 hod). Následně dochází k úplné eradikaci všech PPM v oblasti dolních dýchacích cest a exfoliovaných ploch, kombinace tigecyklinu spolu s vankomycinem navíc zajistila ústup klinických příznaků klostridiové kolitidy.
DISKUSE
Rozvoj infekce v různých kompartmentech představuje jednu z nejobávanějších komplikací v průběhu terapie pacientů s TEN. Přítomnost farmakologicky indukované imunoparalýzy, eventuálně imunosuprese, zhoršuje u pacientů možnosti konvenční antimikrobiální terapie. Dochází velmi rychle ke kontaminaci exfoliovaných ploch a poté přes kolonizaci a lokální infekci k rozvoji sepse. Selhání terapeutických postupů poté mohou mít fatální následky, zejména pokud jde o infekci v oblasti krevního řečiště nebo dolních dýchacích cest.
Infekční komplikace v oblasti dolních dýchacích cest se dají rozdělit na dvě nozologické jednotky s odlišným průběhem a prognózou – tracheobronchitida, pneumonie. Ventilátorová pneumonie je definována jako pneumonie, která se vyvine minimálně 48 hodin po intubaci a zahájení umělé plicní ventilace. Na rozdíl od ventilátorové tracheobronchitidy pro diagnostiku pneumonie je nezbytný pozitivní RTG nález [4]. Diagnostika ventilátorové pneumonie je založena na třech nosných pilířích. Systémové známky infekce, nový nebo progrese stávajícího plicního infiltrátu a pozitivní kultura materiálu odebraného z dolních dýchacích cest. U pacientů s TEN mohou někdy známky systémové infekce chybět nebo být neadekvátně redukované, zejména díky imunosupresivní terapii. Podobně také pro tvorbu samotného infiltrátu v oblasti plic je nezbytná součinnost imunitního systému, proto u léčených pacientů s TEN nemusí být infiltrát tak intenzivně manifestován jako u jiné skupiny kriticky postižených pacientů. Za standard v odběru materiálu k mikrobiologické diagnostice se v dnešní době považuje bronchoalveolární laváž [5]. Ventilátorová pneumonie je zatížena vysokou mortalitou. Závažnost ventilátorové pneumonie je dána zejména infekčním agens, které etiologicky participuje na jejím rozvoji. Gramnegativní kmeny bakterií mají horší prognózu než grampozitivní koky. S. maltophilia patří mezi nejobávanější PPM v intenzivní péči vůbec, zejména pro svoji vysokou úroveň rezistence k řadě antibiotik. Problematikou antimikrobiální terapie u multirezitentních kmenů S. maltophilia se zabývá řada prací. Betts et al. ve své práci popisují výhody potenciace účinku tigecyklinu, eventuálně rifampicinu, spolu s kolistinem právě proti multirezistentním kmenům S. maltophilia [6]. Tekçe et al. se naopak zabývají problematikou alternativního přístupu k pacientům, kteří mají infekční komplikaci způsobenou S. maltophilia, a nemohou být léčeni trimethoprim-sulfamethoxazolem [7]. Během 3 let srovnávali základní ukazatele, jako mortalitu a klinickou efektivitu, u populace pacientů léčených trimethoprim-sulfamethoxazolem (26 pacientů) a pacientů léčených tigecyklinem (19 pacientů). Závěry potvrdily skutečnost, že tigecyklin je více než dobrá alternativa v terapii nozokomiálních infekcí způsobených S. maltophilia u pacientů, kteří nemohou být léčeni trimethoprim-sulfamethoxazolem.
Tigecyklin stále patří do skupiny novějších antimikrobiální přípravků. Jedná se o první zástupce ze skupiny glycylcyklinů. Tento přípravek obdržel povolení od Food and Drug Administration (FDA) a European Medicines Agency (EMEA) k terapii komplikovaných infekcí kůže a měkkých tkání (SSTIs) a komplikované intraabdominální infekce (IAIs) [8, 9]. FDA také povolila používat tento přípravek v terapii komunitní pneumonie (CAP) [10]. V Evropě povolení pro terapii ať již komunitní, tak i nozokomální pneumonie chybí. Přesto narůstá počet popsaných případů, kdy „off-label“ použití tigecyklinu vedlo k záchraně života pacienta.
V rámci retrospektivní analýzy pacientů, kteří dostali minimálně jednu dávku tigecyklinu v Univerzitní nemocnici del Mar v Barceloně bylo zaznamenáno celkem 150 pacientů [11]. Ovšem z těchto pacientů pouze 104 pacientům (69,3 %) byl podán tigecyklin ve schválené indikaci FDA a EMEA 59 ( 56,7 %) pro SSTI a 45 (43,3 %) pro IAI). Celkem u 46 pacientů (30,7 %) byl podán tigecyklin v „off-label“ indikaci. Z tohoto počtu bylo celkem 20 pacientů s nozokomiální pneumonií (14 pacientů, 70 %) byli pacienti s ventilátorovou pneumonií).
V této skupině byla off-label indikace tigecyklinu závislá také na potenciálně patogenním mikroorganismu (PPM). Zejména infekce kmeny S. maltophilia vykazovaly statisticky signifikantní rozdíl (10, 21,7 %) v „off-label“ indikaci vs. 2 (1,9 %) ve schválené indikaci (p < 0,001).
Curcio et al. analyzovali preskripci tigecyklinu u 209 pacientů z 23 centrech Latinské Ameriky [12]. Z tohoto počtu pouze 66 pacientů (31,5 %) obdrželi tigecyklin ve schválené indikaci. Zbylý počet 143 pacientů (68,5%) mělo podání tigecyklinu „off-label“. Nejčastěji byl tigecyklin podán v „off-label“ indikaci u pacientů s VAP (76 pacientů). Pouze u 88 pacientů byl stanoven původce infekčních komplikací. V tomto souboru byly nejčastější patogeny, u kterých byla indikována terapie tigecyklinem, Acinetobacter spp. (54,5 %, v 65 % případů – karbapenem rezistentní kmeny), methicillin-rezistentní Staphylococcus aureus (12 %), a Enterobacteriaceae produkující širokospektrou betalaktamázu (10 %).
Mouloudi et al. ve své studii poukazují na efektivitu podávání tigecyklinu u pacientů s infekčními komplikacemi způsobenými karbapenem-rezistentní K. pneumoniae po transplantaci jater [13]. Z celkem 18 pacientů byl tigecyklin předepsán v „off-label“ indikaci u 10 pacientů (7 BSI, 1 UTI, 2 VAP). U 5 pacientů ze souboru se v průběhu terapie tigecyklinem objevila superinfekce způsobená P. aeruginosa. Guner et al. popisují použití tigecyklinu u jiného multirezitentního kmene bakterií, Acinetobacter spp. [14]. Opět se jednalo o karbapenem rezistentní formu. Celkem bylo v souboru 33 pacientů. Klinická odpověď byla pozorována u 23 pacientů (69,7 %). U 10 pacientů (30 %) nebylo podání tigecyklinu efektivní. Ve skupině byli pacienti s BSI a VAP, tedy tigecyklin byl podán „off-label“ indikaci. U 13 pacientů (43,3 %) byla zaznamenána superinfekce, opět se nejčastěji jednalo o kmeny P. aeruginosa. U obou článků autoři popisují jako základní důvod podávání tigecyklinu v „off-label“ indikaci absenci jiných terapeutických možností.
V případě průjmu způsobeného C. difficile začíná přibývat počet pacientů, kteří byli úspěšně léčení tigecyklinem [15]. I když pro iniciální terapii těchto pacientů se stále doporučuje vankomycin a metronidazol, u rekurentních infekcí jednoznačná strategie chybí. Vzhledem k tomu, že mnoho studií demonstruje výbornou in vitro aktivitu tigecyklinu proti kmenům C. difficile, může být právě tento antimikrobiální přípravek účinný i in vivo. Tigecyklin má zjištěnou nízkou minimální inhibiční koncentraci (MIC) i pro multirezistentní kmeny C. difficile (průměr MIC90 0,25 mg/L; rozmezí ≤ 0,06–2 mg/l) [16]. Navíc byla zaznamenána také jeho aktivita vůči toxinům, které produkují kmeny C. difficile [17].
Antimikrobiální terapie u pacientů s TEN je stále velmi komplikovaná, protože právě antibiotika a chemoterapeutika patří k jedné z nejrizikovějších skupin léků, které mají za následek rozvoj TEN. Rozhodování o použití daného antimikrobiálního přípravku proto musí respektovat také jeho potenciál v dodatečné provokaci alergické reakce na kůži vedoucí ke zhoršení lokálního i celkového stavu. Relevantní data o antimikrobiálních přípravcích způsobující rozvoj TEN jsou vzhledem k raritnosti tohoto onemocnění velmi obtížně dohledatelná. Přesto existuje práce, která hodnotí základní epidemiologická data, včetně užívaných léků, u kohorty čítající i několik stovek pacientů s TEN. Jedná se EuroSCAR studii (SCAR-Severe Cutaneous Adverse Reactions) [18]. V této multicentrické studii, která byla provedena u 379 pacientů v jednotlivých evropských zemích, byla také hodnocena jednotlivá antibiotika a chemoterapeutika. Bylo zjištěno, že i mezi jednotlivými antibiotiky existuje podstatný rozdíl v riziku rozvoje TEN. Nejrizikovějším přípravkem mezi antiinfektivy je podle této studie trimetoprim/sulfamethoxazol (6,3 % pacientů užívalo tento přípravek před rozvojem TEN), následovaný cefalosporiny (5 %), aminopeniciliny a makrolidy (shodně 4,8 %) a chinolony (3,4 %). Naopak nejbezpečnější skupinou z pohledu rozvoje TEN byly tetracykliny (1,9 %).
ZÁVĚR
V kazuistice prezentujeme případ pacientky s multifokální infekcí různými PPM, navíc se základním onemocněním, u kterého je použití kombinací antimikrobiálních přípravků spojeno s vyšším rizikem zhoršení stavu. Prakticky beznadějná situace byla úspěšně řešena „off-label“ podáním tigecyklinu.
Do redakce došlo dne 6. 1. 2016.
Adresa pro korespondenci:
MUDr. Břetislav Lipový, Ph.D.
Klinika popálenin a rekonstrukční chirurgie FN Brno
Jihlavská 20
625 00 Brno
e-mail: b.lipovy@seznam.cz
Sources
1. Harr T., French LE. Toxic epidermal necrolysis and Steven-Johnson syndrome. Orphanet J Rare Dis 2010;5 : 39–50.
2. de Prost N, Ingen-Housz-Oro S, Duong T et al. Bacteremia in Stevens-Johnson syndrome and toxic epidermal necrolysis: epidemiology, risk factors, and predictive value of skin cultures. Medicine (Baltimore). 2010;89(1):28–36.
3. Bastuji-Garin S, Fouchard N, Bertocchi M, et al. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol. 2000;115(2):149–153.
4. Craven DE, Hjalmarson KI. Ventilator-associated tracheobronchitis and pneumonia: thinking outside the box. Clin Infect Dis. 2010;51(Suppl 1):S59–66.
5. Vélez L, Correa LT, Maya MA, et al. Diagnostic accuracy of bronchoalveolar lavage samples in immunosuppressed patients with suspected pneumonia: analysis of a protocol. Respir Med. 2007;101(10):2160–2167.
6. Betts JW, Phee LM, Woodford N, Wareham DW. Activity of colistin in combination with tigecycline or rifampicin against multidrug-resistant Stenotrophomonas maltophilia. Eur J Clin Microbiol Infect Dis. 2014;33(9):1565–1572.
7. Tekçe YT, Erbay A, Cabadak H, Sen S. Tigecycline as a therapeutic option in Stenotrophomonas maltophilia infections. J Chemother. 2012;24(3):150–154.
8. Fomin P, Beuran M, Gradauskas A, et al. Tigecycline is efficacious in the treatment of complicated intra-abdominal infections. Int J Surg. 2005;3(1):35–47.
9. Breedt J, Teras J, Gardovskis J, et al. Safety and efficacy of tigecycline in treatment of skin and skin structure infections: results of a double-blind phase 3 comparison study with vancomycin-aztreonam. Antimicrob Agents Chemother. 2005;49(11):4658–4666.
10. Dartois N, Cooper CA, Castaing N, et al. Tigecycline versus levofloxacin in hospitalized patients with community-acquired pneumonia: an analysis of risk factors. Open Respir Med J. 2013;7 : 13–20.
11. Conde-Estévez D, Grau S, Horcajada JP et al. Off-label prescription of tigecycline: clinical and microbiological characteristics and outcomes. Int J Antimicrob Agents. 2010;36(5):471–472.
12. Curcio D, Vargas SW, Ugarte Ubiergo S, et al. Tigecycline treatment of critically ill patients: the LatinUser experience. Curr Clin Pharmacol. 2011;6(1):18–25.
13. Mouloudi E, Massa E, Piperidou M, et al. Tigecycline for treatment of carbapenem-resistant Klebsiella pneumoniae infections after liver transplantation in the intensive care unit: a 3-year study.Transplant Proc. 2014;46(9):3219–3221.
14. Guner R, Hasanoglu I, Keske S, et al. Outcomes in patients infected with carbapenem-resistant Acinetobacter baumannii and treated with tigecycline alone or in combination therapy. Infection. 2011;39(6):515–518.
15. Theriot CM, Schumacher CA, Bassis CM, et al. Effects of tigecycline and vancomycin administration on established Clostridium difficile infection. Antimicrob Agents Chemother. 2015;59(3):1596–1604.
16. Britt NS, Steed ME, Potter EM, et al. Tigecycline for the Treatment of Severe and Severe Complicated Clostridium difficile Infection. Infect Dis Ther. 2014;3(2): 321–331.
17. Aldape MJ, Heeney DD, Bryant AE, et al. Tigecycline suppresses toxin A and B production and sporulation in Clostridium difficile. J Antimicrob Chemother. 2015;70(1):153–159.
18. Mockenhaupt M, Viboud C, Dunant A, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: assessment of medication risks with emphasis on recently marketed drugs. The EuroSCAR-study. J Invest Dermatol. 2008;128(1):35–44.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2016 Issue 3-
All articles in this issue
- The incidence of viral hepatitis A in the Hradec Králové Region in the Czech Republic in the last decade
- Effect of lipophosphonoxins on inhibition of bacterial colonization of bone cements
- Stenotrophomonas maltophilia as the cause of ventilator-associated pneumonia in a female patient with toxic epidermal necrolysis and Clostridium colitis: time for off-label tigecycline?
- HIV/AIDS epidemics in sub-Saharan regions in the 2010s: Regional analysis of UNAIDS data
- Avidity of selected autoantibodies – usefulness of their determination for clinical purposes
-
The occurrence of Ixodes ricinus ticks and important tick-borne pathogens in areas with high tick-borne encephalitis prevalence in different altitudinal levels of the Czech Republic
Part II. Ixodes ricinus ticks and genospecies of Borrelia burgdorferi sensu lato complex - Campylobacteriosis in the South Bohemian Region – a Recurrent Problem
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenotrophomonas maltophilia as the cause of ventilator-associated pneumonia in a female patient with toxic epidermal necrolysis and Clostridium colitis: time for off-label tigecycline?
- Avidity of selected autoantibodies – usefulness of their determination for clinical purposes
-
The occurrence of Ixodes ricinus ticks and important tick-borne pathogens in areas with high tick-borne encephalitis prevalence in different altitudinal levels of the Czech Republic
Part II. Ixodes ricinus ticks and genospecies of Borrelia burgdorferi sensu lato complex - HIV/AIDS epidemics in sub-Saharan regions in the 2010s: Regional analysis of UNAIDS data
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

