-
Medical journals
- Career
Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
Authors: J. Bardoň 1,2,3; I. Koláčková 4; V. Husičková 1; M. Röderová 1,3; R. Karpíšková 4,5; T. Štosová 6; M. Kolář 1,3
Authors‘ workplace: Ústav mikrobiologie, Lékařská fakulta UP v Olomouci 1; Státní veterinární ústav Olomouc 2; Ústav molekulární a translační medicíny, Lékařská fakulta UP v Olomouci 3; Výzkumný ústav veterinárního lékařství, v. v. i. Brno 4; Ústav hygieny a technologie mléka, Fakulta veterinární hygieny a ekologie, VFU Brno 5; Fakultní nemocnice Olomouc 6
Published in: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 232-237
Category: Review articles, original papers, case report
Overview
Cíl práce:
Sledování výskytu bakterií Campylobacter spp. u drůbeže na jatkách, u drůbeže a vepřových jater v tržní síti a kravského mléka na Moravě. Stanovení rezistence animálních izolátů k vybraným antibiotikům a porovnání s antibiogramem humánních kmenů.Materiál a metodika:
V průběhu roku 2013 byly v Jihomoravském a Olomouckém kraji na jatkách odebírány směsné vzorky obsahu slepých střev brojlerů, v tržní síti chlazená i mražená kuřata, chlazená vepřová játra a syrové kravské mléko z mléčných automatů. Vzorky byly kvalitativně i kvantitativně vyšetřeny na přítomnost bakterií Campylobacter spp. Získané izoláty byly testovány na rezistenci k antibiotikům. Současně byla rezistence sledována i u humánních izolátů pocházejících ze stejné oblasti.Výsledky:
Ve 41,8 % testovaných vzorků potravin byly prokázány bakterie Campylobacter spp. Nejvyšší míra kontaminace (73,2 %) byla zjištěna u chlazené drůbeže. Ve vzorcích syrového kravského mléka Campylobacter spp. prokázán nebyl. Izoláty vykazovaly vysokou míru rezistence k chinolonovým antibiotikům, v případě C. coli navíc i k tetracyklinu a streptomycinu.Závěr:
Byla zjištěna častá kontaminace sledovaných komodit kampylobaktery. Míra kontaminace v CFU/g se u jednotlivých komodit liší a zřejmě tak ovlivňuje reálné riziko infekce člověka. V případě nutnosti antibiotické terapie nelze použít chinolonová antibiotika. Dobrá úroveň bezpečného zacházení s potravinami u spotřebitelů je zásadním předpokladem pro prevenci vzniku onemocnění.Klíčová slova:
Campylobacter spp. – prevalence – potravina – rezistence k antibiotikůmÚVOD
Kampylobakterióza je alimentární bakteriální zoonóza způsobená termotolerantními druhy rodu Campylobacter. Nejčastějším původcem tohoto onemocnění je Campylobacter jejuni, následovaný C. coli a C. lari, popř. C. upsaliensis. V klinických projevech onemocnění dominuje postižení gastrointestinálního traktu s průjmy, někdy s příměsí krve, časté bývají horečky. K významným postinfekčním komplikacím, které způsobuje zejména C. jejuni, náleží Guillainův-Barrého syndrom [1, 2].
Počet onemocnění člověka způsobených bakterií Campylobacter spp. se v Evropské unii v posledních pěti letech stále zvyšuje. Kampylobakterióza je nejčastější bakteriální zoonózou v Evropě. V roce 2011 bylo podle Evropského úřadu pro bezpečnost potravin (EFSA – European Food Safety Authority) hlášeno v rámci Evropy přes 220 tisíc potvrzených onemocnění člověka, což představuje nárůst o 2,2 % v porovnání s rokem 2010. Průměrná incidence kampylobakteriózy ve 25 členských státech, které podaly hlášení o výskytu humánních kampylobakterióz, tak v roce 2011 dosáhla 50,3 případů na 100 tisíc obyvatel. Předpokládá se, že skutečný výskyt této infekce bude v evropské populaci mnohonásobně vyšší. Přes vysoký počet onemocnění je mortalita nízká, v rámci Evropy se pohybuje kolem 0,04 %. Nehledě na tuto skutečnost však kampylobakterióza představuje významný zdravotní i socioekonomický problém [1].
Česká republika patří v rámci Evropy k zemím s nejvyšším počtem hlášených infekcí (kolem 180 případů na 100 tisíc obyvatel ročně). Podle statistiky Státního zdravotního ústavu EPIDAT za rok 2007 převýšil v ČR počet hlášených kampylobakterových infekcí člověka počet evidovaných salmonelóz (24 tisíc případů vs. 18 tisíc případů). V letech 2011 a 2012 se počet hlášených onemocnění pohyboval přes 18 tisíc a obdobný výskyt se očekává po zpracování dat i za rok 2013 [3]. Porovnávání humánní prevalence podle evropských zemí však není objektivní, protože záleží na systému surveillance jednotlivých států, který konečná čísla významně ovlivňuje.
Termotolerantní druhy Campylobacter spp. jsou v přírodě široce rozšířeny, hlavním rezervoárem je intestinální trakt ptáků a savců jak domácích, tak divoce žijících. Kampylobakterióza člověka má v naprosté většině charakter alimentární infekce, zdrojem infekce jsou převážně maso a vnitřnosti drůbeže, prasat, případně skotu. Významným zdrojem rodinných epidemií kampylobakteriózy je křížová kontaminace potravin a kuchyňského náčiní v domácnostech spotřebitele. Jsou evidovány i případy, kdy k onemocnění došlo po konzumaci syrového mléka, případně mléčných výrobků z nepasterizovaného mléka (sýry). Obecně však lze říct, že v Evropě se Campylobacter spp. na vzniku alimentárních epidemií příliš nepodílí. V roce 2011 bylo v EU oficiálně hlášeno 701 alimentárních epidemií způsobených zoonotickými agens. Z tohoto počtu se Campylobacter spp. uplatnil jako etiologické agens v 5,6 %. Jednou z možných příčin nižšího epidemického potenciálu kampylobakterů (např. ve srovnání se Salmonella spp.) je jeho vyšší citlivost vůči podmínkám vnějšího prostředí (nároky na mikroaerofilní prostředí, teplotu 30–42 °C, vlhkost). Zatímco kampylobaktery nemají v potravinách vhodné podmínky pro pomnožování, salmonely jsou mnohem odolnější a potravinách se pomnožují běžně.
Dalším možným zdrojem infekce, zejména pro děti, jsou infikovaná domácí zvířata, především pes a kočka. Interhumánní přenos této nákazy je málo častý [1, 2]. Přesto například Gaudreau et al. popisují epidemii (10 případů) u homosexuálních mužů v Kanadě [4]. V rámci alimentárních infekcí jsou nejvíce postiženou věkovou skupinou v Evropě malé děti [1]. Většina nekomplikovaných kampylobakterových infekcí u imunokompetentních osob proběhne bez nutnosti antibiotické terapie, jsou však případy, kdy jsou antibiotika nezbytná. To je jeden z důvodů, proč řada Evropských zemí provádí monitorování antibiotické rezistence u izolátů Campylobacter spp. humánní i animální provenience. Naprostá většina testovaných izolátů náleží k druhu C. jejuni a C. coli. Podle údajů EFSA a ECDC (European Centre for Disease Prevention and Control) je v rámci Evropy hlášena nejvyšší rezistence kampylobakterů ke kyselině nalidixové (evropský průměr cca 48 % izolátů) a ciprofloxacinu (cca 44 %). Následuje ampicilin (35 %) a tetracyklin (31 %). Lékem volby v případě nutnosti antibiotické terapie jsou makrolidy (in vitro je testován erytromycin). Rezistence humánních izolátů kampylobakterů k makrolidům je v Evropě relativně nízká a pohybuje se průměrně kolem 2 %. Nejvyšší rezistenci k erytromycinu v roce 2011 hlásila u humánních izolátů Itálie (6 %) a Španělsko (5 %). Přestože jsou již několik let známy údaje o vysoké rezistenci kampylobakterů k chinolonovým antibiotikům, v řadě Evropských států je ciprofloxacin po makrolidech stále lékem druhé volby. Například Španělsko evidovalo v roce 2011 rezistenci k ciprofloxacinu u 87 % humánních izolátů a Litva 83% rezistenci [5]. V ČR testovali rezistenci C. jejuni a C. coli k antibiotikům mikrodiluční metodou např. Bardoň et al. V případě izolátů C. jejuni a C. coli z drůbeže byla prokázána rezistence ke kyselině oxolinové (64 %, respektive 86 %) a ciprofloxacinu (54 %, respektive 76 %). U humánních izolátů C. jejuni byla v ČR zjištěna rezistence ke kyselině oxolinové u 60 % izolátů, rezistence k ciprofloxacinu u 55 % izolátů. Naopak pouze 1 % humánních izolátů bylo rezistentních k erytromycinu [6, 7].
MATERIÁL A METODY
Sběr materiálu
Na základě vyhlášky Ministerstva zemědělství č. 356/2004 Sb., o sledování (monitoringu) zoonóz a původců zoonóz [8], která je dále rozpracována Metodickým návodem Státní veterinární správy ČR č. 1/2005 [9], bylo na území Moravy od ledna do prosince 2013 na drůbežích jatkách odebráno a vyšetřeno celkem 48 směsných vzorků slepých střev brojlerů (Gallus gallus). Slepá střeva jsou predilekčním místem výskytu termotolerantních kampylobakterů v gastrointestinálním traktu drůbeže. Veterinární inspektor odebíral vždy z jedné partie (pomocí sterilního skalpelu a pinzety) během porážky 10 slepých střev z 10 kusů náhodně zvolených jatečně upravených těl (JUT) brojlerů. Všech 10 střev vložil do jednoho plastového sáčku (1 směsný vzorek), který byl odeslán k vyšetření do laboratoře. Odebírala se slepá střeva brojlerů ve stáří cca 35 až 40 dnů. Pro pokrytí sezonního výskytu byly vzorky odebírány vždy jedenkrát měsíčně po celý kalendářní rok.
Od května do prosince 2013 byly dále cca v dvouměsíčních intervalech provedeny 4 odběry drůbeže, vepřových jater a syrového kravského mléka. V případě drůbeže se jednalo o balenou chlazenou a mraženou drůbež, v případě jater o chlazená vepřová játra. Vzorky těchto komodit byly odebírány ve spotřebitelském balení přímo v tržní síti supermarketů v Olomouckém a Jihomoravském kraji. Syrové kravské mléko bylo odebíráno z mléčných automatů ze stejné oblasti do sterilních skleněných nádob. Celkem bylo odebráno a vyšetřeno 165 vzorků potravin podle následujícího rozdělení: kuře chlazené – 41 vzorků, kuře mražené – 40 vzorků, chlazená vepřová játra – 41 vzorků a syrové kravské mléko – 43 vzorků.
Humánní izoláty Campylobacter spp. byly získány z laboratoří, které v rámci komunity Olomouckého a Jihomoravského kraje vyšetřují průjmová onemocnění a nemocničních laboratoří.
Kvalitativní a kvantitativní bakteriologické vyšetření materiálu
Směsné vzorky obsahu slepých střev brojlerů byly po homogenizaci inokulovány roztěrem přímo na pevnou půdu mCCDA (Trios spol. s r. o.) a CampyCount Agar (Thermo Fisher Scientific). Plotny byly inkubovány mikroaerofilně (GENbox microaer – bioMérieux) 48 hodin při teplotě 42,5 °C.
Laboratorní analýzy zaměřené na průkaz termotolerantních druhů Campylobacter spp. u drůbeže, vepřových jater a mléka byly provedeny podle ISO 10272-1 (kvalitativní vyšetření) [10]. K vyšetření byla u drůbeže odebírána kůže z krku o hmotnosti 25 g, dále 25 g jater a 25 ml mléka. Stanovení počtů Campylobacter spp. bylo provedeno podle ISO 10272-2 (kvantitativní vyšetření) [11].
Identifikace izolátů
Suspektní izoláty byly pro účely identifikace přeočkovány na krevní agar (Trios spol. s r. o.) a po 48hodinové mikroaerofilní inkubaci při 42,5 °C identifikovány metodou MALDI-TOF MS (Biotyper Microflex, Bruker). V případě nejednoznačné identifikace MALDI-TOF (identifikační skóre méně než 2) byla provedena identifikace metodami PCR [12, 13] a komerčním kitem pro real-time PCR (Taq Man Campylobacter spp. Kit, AB Applied Biosystems). Pro kontrolu kvality byl použit referenční kmen C. jejuni ATCC 33560.
Humánní kmeny kampylobakterů z externích laboratoří byly zasílány již identifikované, před dalším testováním však byla jejich identifikace ověřena metodou MALDI-TOF MS.
Testování rezistence izolátů k antibiotikům
U konfirmovaných izolátů Campylobacter spp. byla testována rezistence k vybraným antimikrobiálním látkám mikrodiluční metodou [14]. Testování bylo prováděno na mikrotitračních destičkách v roztoku příslušného antibiotika a Mueller-Hinton bujónu s 2,5 % lyzované koňské krve (Trios spol. s. r. o.). Inokulované destičky byly inkubovány v mikroaerofilní atmosféře (GENbox microaer – bioMérieux) 48 hodin při teplotě 37 °C. Rezistence byla testována k osmi vybraným antibiotikům (erytromycin, ciprofloxacin, tetracyklin, streptomycin, gentamicin, chloramfenikol, ampicilin a kyselina nalidixová). Parametry pro jednotlivá antibiotika, včetně interpretačních kritérií, vycházela z doporučení Evropské referenční laboratoře pro antibiotickou rezistenci a Zprávy antibiotické komise při Francouzské mikrobiologické společnosti [15, 16]. Přehled použitých antibiotik, včetně parametrů, je uveden v tabulce 1. Kontrola kvality byla v pravidelných intervalech prováděna referenčním kmenem C. jejuni ATCC 33560. Výše uvedeným způsobem bylo otestováno 70 potravinových a 93 humánních kmenů Campylobacter spp.
Table 1. Použité parametry testování rezistence mikrodiluční metodou Table 1. Parameters used for antimicrobial susceptibility testing by the microdilution method 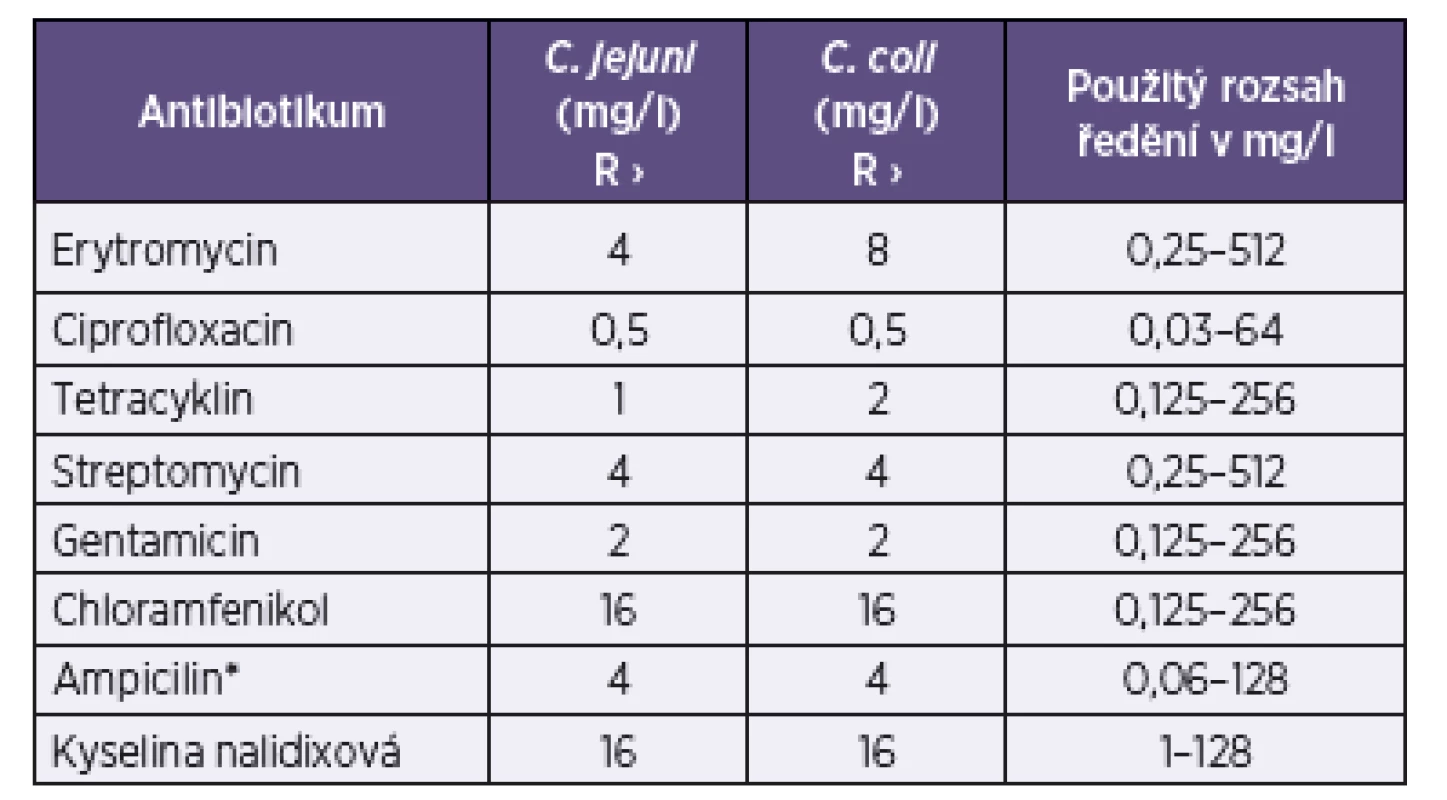
* parametry převzaty z Communique [16], ostatní ATB dle EU-RL [15] R – rezistentní * parametry převzaty z Communique [16], ostatní ATB dle EU-RL [15] R – rezistentní VÝSLEDKY
Prevalenci sledovaných druhů Campylobacter spp. v jednotlivých komoditách vzorků ukazuje tabulka 2.
Table 2. Výskyt kampylobakterů ve vzorcích slepých střev a kůže drůbeže, vepřových jater a syrového mléka na Moravě Table 2. Detection of <i>Campylobacter</i> spp. in samples of broiler cecal contents, poultry skin, pork liver, and raw cow’s milk in Moravia 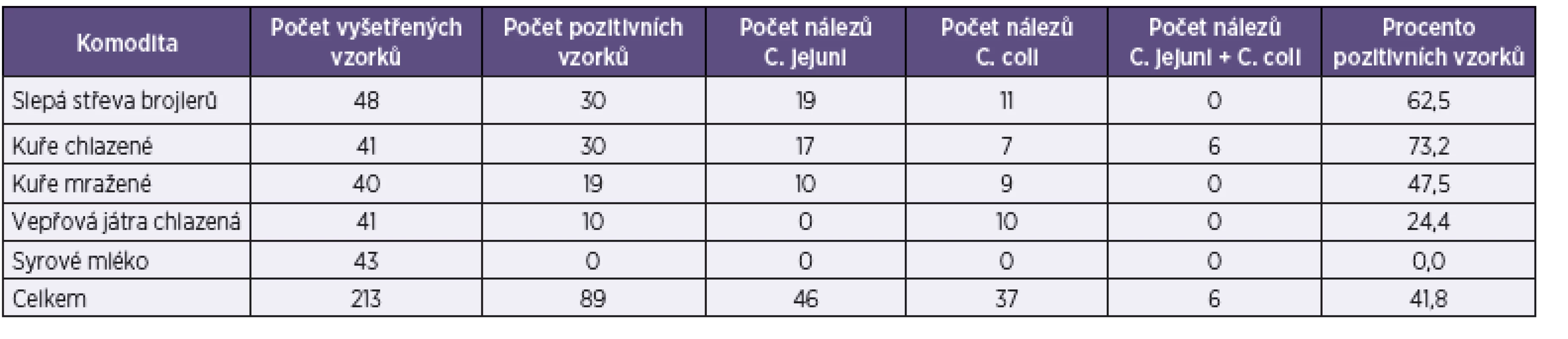
Z tabulky je patrný velmi vysoký podíl (73,2 %) chlazené drůbeže v tržní síti, která je povrchově kontaminovaná bakteriemi Campylobacter spp. V šesti vzorcích chlazené drůbeže byla prokázána duální kontaminace C. jejuni a C. coli. U mražené drůbeže byla prokázána 47,5% kontaminace kampylobaktery. Zdrojem kontaminace povrchu JUT je gastrointestinální trakt brojlerů, 62,5 % směsných vzorků obsahu slepých střev odebraných na drůbežích jatkách obsahovalo bakterie Campylobacter spp. U drůbeže převažují nálezy C. jejuni (58,2 %) nad C. coli (34,2 %). V případě chlazených vepřových jater byla prokázána kontaminace kampylobaktery u 24,4 % vzorků odebraných v tržní síti, ve všech případech se jednalo o C. coli. Další druhy termotolerantních kampylobakterů (C. upsaliensis a C. lari) nebyly ve sledovaných komoditách vzorků prokázány.
Syrové kravské mléko, které je považováno za jeden z možných zdrojů infekce, bylo v našem souboru 43 vzorků vždy negativní.
U pozitivních vzorků potravin byl nález bakterií Campylobacter spp. kvantifikován v CFU/gram vzorku. Rozsah zjištěné kontaminace uvádí tabulka 3.
Table 3. Úroveň kontaminace vyšetřovaných vzorků potravin bakteriemi <i>Campylobacter</i> spp. (v CFU/g) Table 3. The level of <i>Campylobacter</i> contamination of the food samples tested (in CFU/g) 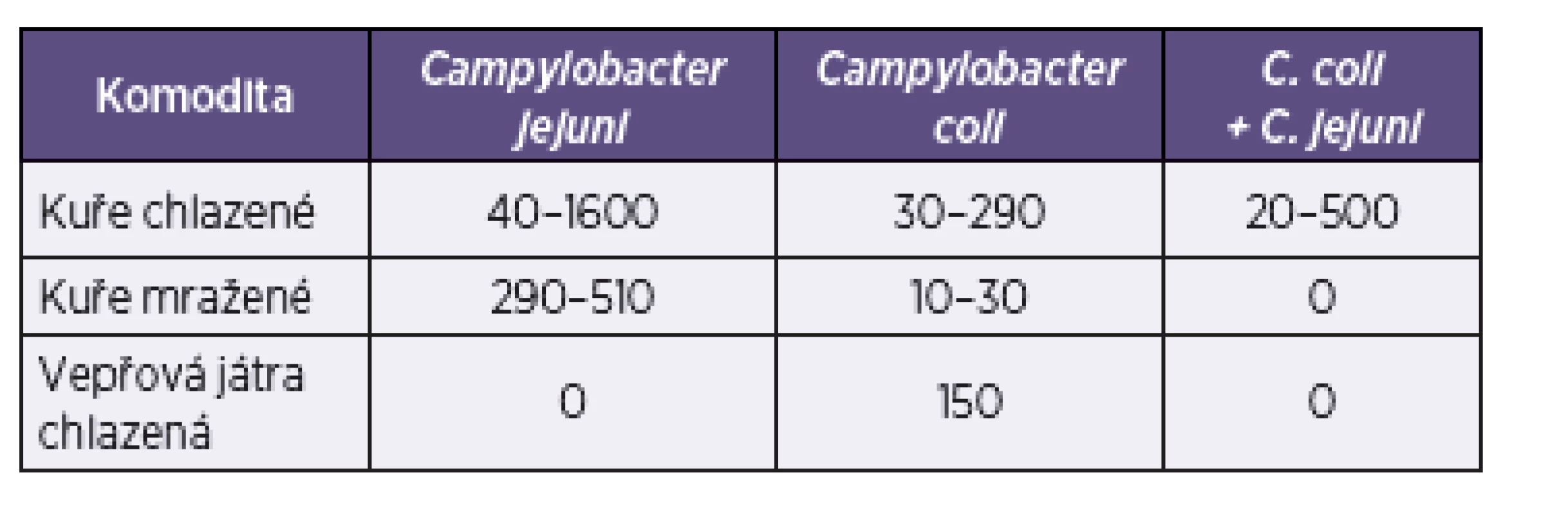
Z tabulky je zřejmé, že nejvyšší míra kontaminace byla prokázána v případě C. jejuni na povrchu chlazené drůbeže (1,6.103 CFU/g). Detekované počty C. coli byly u vzorků drůbeže nižší, rovněž detekovaná úroveň kontaminace vepřových jater byla relativně nízká.
Izoláty obou druhů kampylobakterů z drůbeže (slepá střeva, chlazená a mražená drůbež), prasat (vepřová játra) a člověka (rektální výtěry) byly testovány mikrodiluční metodou na rezistenci k vybraným antibiotikům. Dosažené výsledky jsou uvedeny v tabulkách 4 a 5.
Table 4. Přehled rezistence k antimikrobiálním látkám u izolátů C. jejuni Table 4. Overview of antimicrobial resistance in C. jejuni isolates 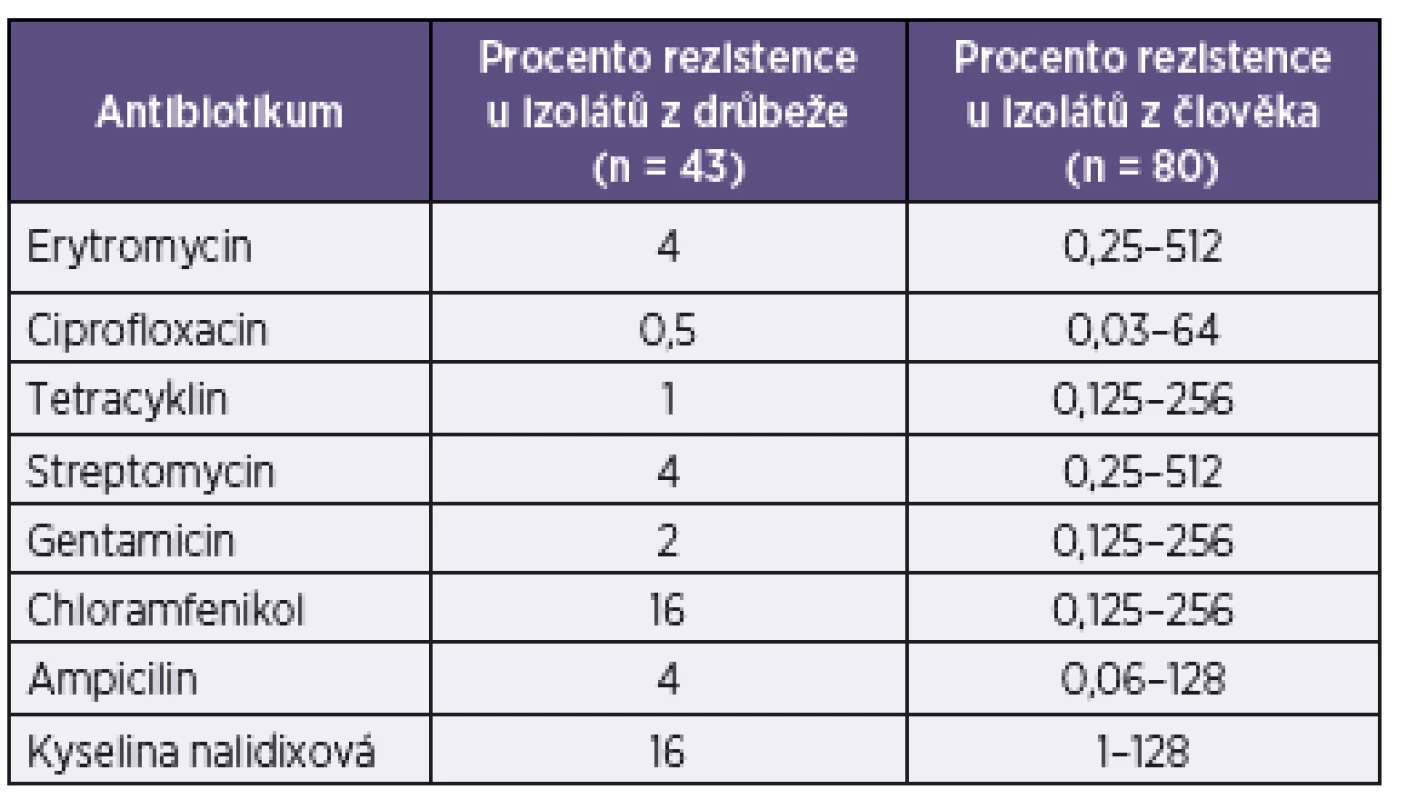
n – počet testovaných izolátů n – number of isolates tested Table 5. Přehled rezistence k antimikrobiálním látkám u izolátů C. coli Table 5. Overview of antimicrobial resistance in C. coli isolates 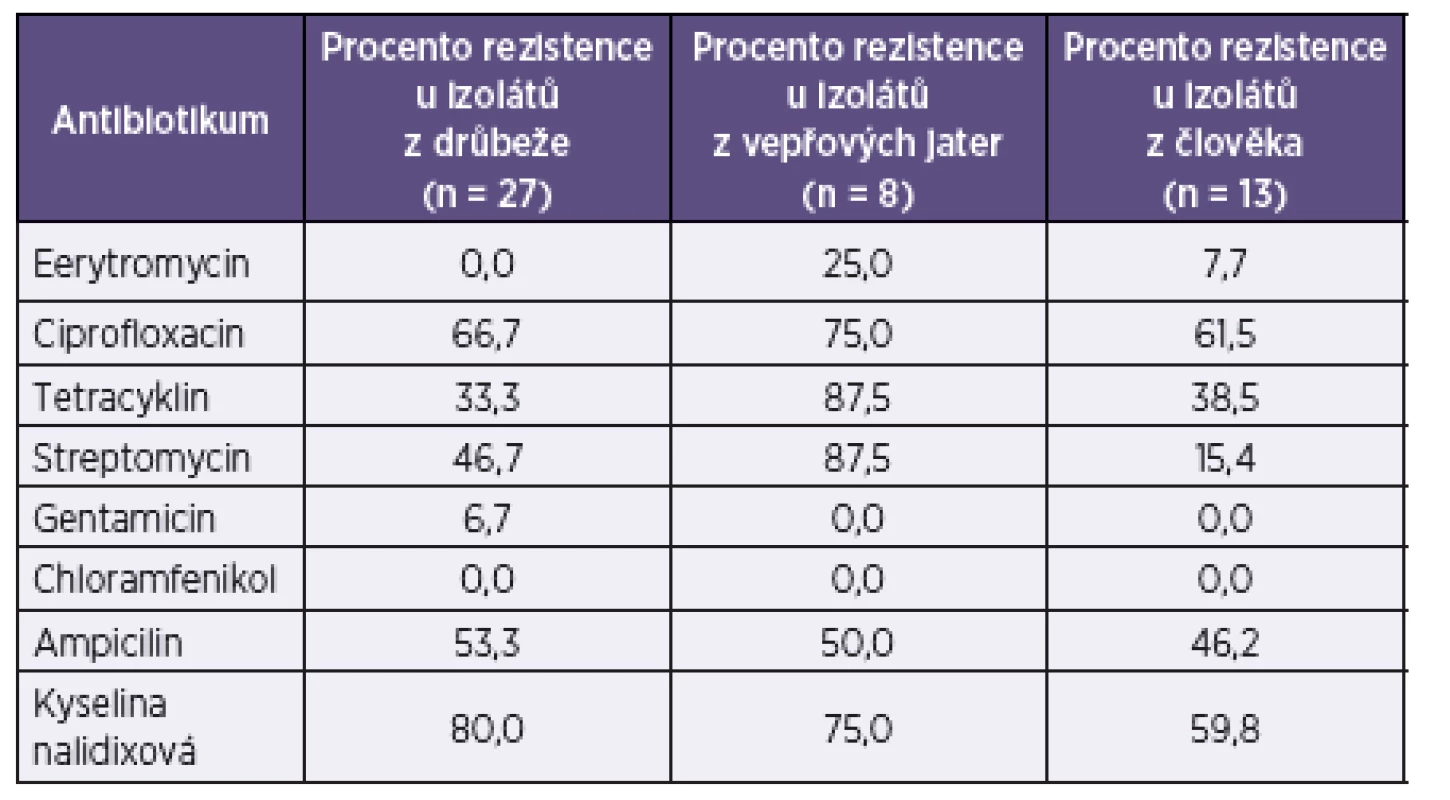
n – počet testovaných izolátů n – number of isolates tested Je zřejmé, že se rezistence k antibiotikům u druhu C. jejuni a C. coli liší. V případě izolátů C. jejuni z drůbeže i člověka byla prokázána vysoká míra rezistence k chinolonům, u C. coli je patrná navíc vyšší rezistence k tetracyklinu a streptomycinu.
DISKUSE
K významným zdrojům kampylobakterových infekcí člověka patří suroviny a potraviny živočišného původu, především drůbeží maso a vnitřnosti. Polská studie provedená v letech 2007–2008 prokázala výskyt kamplylobakterů v 52 % vyšetřených vzorků syrového drůbežího masa a 47 % vzorků drůbežích drobů [17]. Výskyt kampylobakterů v drůbežím mase v obchodní síti byl sledován i v Irsku [18]. Bylo odebráno 510 vzorků syrových kuřat a u 84 % vzorků byl detekován Campylobacter spp., v 67 % se jednalo o C. jejuni a ve 32 % o C. coli. V naší práci jsme v rámci tržní sítě na Moravě zjistili povrchovou kontaminaci kampylobaktery v 73 % vzorků chlazené a 48 % mražené drůbeže. Zdá se, že vyšší počet kontaminovaných surovin drůbežího původu má v ČR setrvalý stav. Sledování výskytu kampylobakterů u drůbeže z tržní sítě celé ČR provedené v roce 2009 prokázalo obdobně vysoký výskyt kampylobakterů, a to u 75 % chlazené drůbeže a 37 % drůbeže mražené [6]. Komplexní data o výskytu kampylobakterů v tržní síti jednotlivých krajů ČR z dřívějších let pro podrobnější porovnání trendů však nejsou k dispozici. Ke kontaminaci povrchu JUT kampylobaktery dochází hlavně na jatkách. Vysoké procento jatečné drůbeže obsahuje tyto bakterie ve svém gastrointestinálním traktu, zejména ve slepých střevech. Podle výsledků prezentovaných EFSA [1] byl zaznamenán výskyt kampylobakterů ve vzorcích slepých střev drůbeže na jatkách v roce 2011 následovně: Irsko 81 %, Slovinsko 77 %, ČR 63 %, Island jen 9 %. V naší práci jsme v roce 2013 u brojlerů porážených na Moravě prokázali výskyt kampylobakterů u 63 % vyšetřených vzorků slepých střev. Bhaduri et al. ve výsledcích své studie upozorňují, že chlazení ani mražení drůbeže po porážce (individuálně či v kombinaci) kampylobaktery spolehlivě nedevitalizuje, a nemůže proto nahradit zásady bezpečného zacházení se syrovou drůbeží a následné důkladné tepelné opracování [19].
Další komoditou sledovanou v naší práci byla chlazená vepřová játra, kde jsme prokázali výskyt bakterií Campylobater spp. ve 24 % vyšetřených vzorků, ve všech případech se jednalo o C. coli. Relevantních literárních údajů o výskytu kampylobakterů ve vepřových játrech je v porovnání s drůbeží o něco méně. Například von Altrock et al. prokázali bakterie Campylobacter spp. v 10 % vzorků odebraných z povrchu 1 500 vepřových jater na jatkách v Německu [20]. Většinu izolátů tvořil C. coli (76 %), následovaný C. jejuni (21 %). Ve starší studii Moora et al. autoři sledovali výskyt kampylobakterů v játrech u stokilových prasat na jatkách v Severním Irsku. Ze 400 vzorků jater bylo 6 % pozitivních s nálezem C. coli (67 %), C. jejuni (30 %) a C. lari (3 %) [21]. Mimo Evropu řešili obdobnou problematiku např. Sasaki et al., kteří v japonské studii zjistili výskyt kampylobakterů v 13 % vepřových jater odebraných na jatkách [22].
Nezbytným předpokladem objektivní analýzy rizika pro spotřebitele při manipulaci se syrovými živočišnými produkty a jejich následné konzumaci je vedle výskytu bakterií také míra kontaminace potraviny. Bakterie Campylobacter spp. se vzhledem ke svým specifickým růstovým požadavkům v domácnosti spotřebitele (mraznička, lednička, pracovní plochy a nástroje) ani v potravinách nepomnožuje. Infekční dávka je u kampylobakterových infekcí relativně nízká. Je známo, že 500 CFU C. jejuni požitých dobrovolníkem ve 180 ml pasterizovaného mléka vyvolalo klinické onemocnění, včetně pozitivní kultivace ve stolici [23]. Další autoři uvádějí pro vznik onemocnění o něco vyšší infekční dávky, např. 800–1000 CFU [24, 25]. Vzhledem k těmto skutečnostem lze s určitou opatrností zvažovat, zdali pozitivní drůbež, či vepřová játra s nálezy do 102 CFU/g opravdu představují reálné zdravotní riziko pro imunokompetentního spotřebitele. Z kvantitativního vyšetření pozitivních vzorků sledovaných komodit (viz tab. 3) vyplývá, že nejvyšší míru kontaminace (až 1,6.103 CFU/g) vykazuje chlazená drůbež. Mražení počty kampylobakterů na povrchu drůbeže snižuje (mražená drůbež – max. 5,1.102 CFU/g). Míra kontaminace povrchu drůbeže druhem C. jejuni je vyšší než v případě C. coli. Nelze pominout fakt, že v šesti případech byla drůbež kontaminována současně druhy C. jejuni i C. coli, což v případě alimentární infekce může znamenat těžší klinický průběh. Zjištěná kontaminace vepřových jater (1,5.102 CFU/g) je ze sledovaných komodit nejnižší. Je zřejmé, že úroveň rizika infekce člověka není ovlivňována jen prevalencí pozitivních nálezů v potravinovém řetězci, tzn. s jakou frekvencí přichází spotřebitel do styku s možným zdrojem infekce. Významnějším faktorem bude spíš frekvence pozitivních nálezů s vyššími počty kampylobakterů, které dosahují infekční dávky pro konkrétního spotřebitele. Zásadní roli však stále sehrává úroveň hygienických návyků při manipulaci a způsobu zpracování živočišných potravin. Při dodržení základních hygienických pravidel, která eliminují křížovou kontaminaci, a po odpovídající tepelné úpravě je riziko infekce minimální. Reálný výskyt kampylobakterióz v humánní populaci, především ve věkové skupině 0–4letých, však dokladuje, že zmíněné hygienické návyky představují u spotřebitelů stále velký problém.
Mezi rizikové faktory patří i konzumace syrového mléka. V naší studii jsme sice výskyt pozitivních nálezů ve vzorcích syrového mléka z mléčných automatů nepotvrdili, ale jiná práce z roku 2010 prokázala kampylobaktery v 5 % vzorků mléka. Mléko pocházelo z 15 farem a C. jejuni byl na dvou farmách potvrzen opakovaně [26].
Kampylobakterióza vyvolaná termotolerantními druhy rodu Campylobacter patří k nejčastějším bakteriálním alimentárním infekcím člověka v Evropě. Z vyhodnocení výskytu hlášených onemocnění v humánní populaci členských států Evropské unie vyplývá, že Česká republika je zemí s nejvyšší incidencí této nákazy [1]. Absolutní porovnávání těchto údajů mezi státy, které hlásí roční výskyt onemocnění, je však zavádějící. Počty hlášených infekcí jsou výrazně ovlivňovány systémem surveillance, úrovní laboratorní diagnostiky a přístupem k odběru vzorků od pacientů s průjmovým onemocněním. Například Krištúfková et al. v této souvislosti upozorňují na fakt, že Česká a Slovenská republika jsou jediné dva státy EU, kde je v případě alimentárních infekcí (kampylobakterióza, salmonelóza apod.) aplikován aktivní systém surveillance těchto nákaz [27]. To lze názorně dokumentovat na porovnání dat ČR se sousedním Polskem. Podle databáze EPIDAT byla v ČR v roce 2011 incidence této nákazy 179 případů na 100 tisíc obyvatel [3]. Sadkowska-Todys et al. uvádí v témže roce incidenci v Polsku 0,92 případů na 100 tisíc obyvatel [28]. Z uvedeného vyplývá, že epidemiologická data mají pro členské státy význam při sledování trendu výskytu v dané lokalitě, vzájemné porovnávání zemí mezi sebou při nejednotném systému sběru dat však zjevně postrádá smysl.
Přestože nekomplikované infekce gastrointestinálního traktu u zdravých jedinců většinou nevyžadují antibiotickou terapii, je problematika rezistence těchto bakterií u lidí i zvířat sledována. Animální i humánní izoláty C. jejuni testované v naší práci vykazovaly vysokou míru rezistence k chinolonům. U drůbeže bylo 71 % izolátů rezistentních k ciprofloxacinu a 70 % izolátů rezistentních ke kyselině nalidixové. V případě humánních izolátů to bylo 70 % respektive 69 %. V případě nutnosti infekci léčit jsou antibiotikem volby makrolidy. U izolátů z drůbeže jsme nezaznamenali rezistenci k erytromycinu, u humánních izolátů bylo 4 % izolátů k tomuto makrolidu rezistentních. U izolátů C. coli z drůbeže, vepřových jater i člověka jsme prokázali vysokou rezistenci k ciprofloxacinu (drůbež 67 %, vepřová játra 75 %, člověk 62 %) i kyselině nalidixové (drůbež 80 %, vepřová játra 75 %, člověk 60 %). Zajímavé byly výsledky u tetracyklinu, popř. streptomycinu, u izolátů z různých zdrojů. Zatímco úroveň rezistence izolátů z drůbeže a člověka byla u těchto antibiotik relativně podobná (např. tetracyklin: drůbež 33 %, člověk 39 %), izoláty C. coli z vepřových jater vykazovaly shodně u obou antibiotik rezistenci 88 %. Přestože se, zejména v případě C. coli, jedná o menší soubory, na základě kterých nelze dělat jednoznačné závěry, zdá se, že charakter rezistence drůbežích a humánních izolátů vykazuje větší podobnost, než je tomu v případě izolátů z vepřových jater. Avšak i mezi antibiogramy drůbežích a humánních kmenů jsou určité rozdíly, které naznačují, že drůbež zdaleka nebude jediným zdrojem infekcí pro člověka.
MALDI-TOF se jeví jako velmi vhodná a rychlá metoda k druhové identifikaci izolátů Campylobacter spp., výsledky této metody byly ověřeny metodou PCR a bylo dosaženo 100% shody. Obdobné výsledky dosáhli také např. Bessède et al., kteří identifikovali 1007 kmenů konvenční metodou, metodou PCR (zlatý standard) a metodou MALDI-TOF. Autoři doporučili MALDI-TOF jako vysoce efektivní metodu pro druhovou identifikaci Campylobacter spp., protože touto metodou bylo v uvedeném souboru zaznamenáno pouze 0,4 % diskrepancí v identifikaci ve srovnání s 5% diskrepancí u konvenčních metod [29].
Počty hlášených onemocnění člověka kampylobakteriózou vykazují v Evropě vzestupný trend [1]. V rámci prevence této alimentární zoonózy je nezbytné zmapovat podrobně zdroje a cesty šíření původce této nákazy od zemědělské prvovýroby, přes zpracovatelský průmysl a tržní síť až na stůl spotřebitele. Tyto poznatky umožní adresně směřovat intervenční opatření snižující rizika infekce člověka. Jedná se např. o tzv. „biosecurity“ opatření přímo v chovech jatečné drůbeže, úpravu provozních podmínek na jatkách (způsob chlazení drůbeže, omezení křížové kontaminace atp.), organizaci porážek drůbeže (nejdříve se poráží drůbež z farem s nízkým výskytem kampylobakterů, nakonec drůbež z farem s vysokou prevalencí). Poznatky z epidemiologie této nákazy jsou také základem edukace populace vedoucí ke snižování výskytu této nákazy. Jde o detailní porovnání rizik alimentárních zdrojů (drůbež, vepřové maso, mléko), rizika kontaktu se zvířaty (průjmující koťata a štěňata), nebo rizika environmentálních zdrojů (koupání v přírodě) pro vznik nákazy u člověka.
ZÁVĚR
Kampylobakterové infekce člověka představují závažný medicínský problém. Významným zdrojem infekce pro člověka jsou suroviny a potraviny živočišného původu, zejména drůbež. U 73 % chlazené drůbeže a 48 % mražené drůbeže odebrané v supermarketech na Moravě jsme prokázali kontaminaci bakteriemi Campylobacter spp. Na drůbežích jatkách jsme zjistili u 63 % směsných vzorků slepých střev jatečné drůbeže výskyt kampylobakterů. Chlazená vepřová játra v tržní síti byla ve 24 % kontaminována kampylobaktery. V případě syrového kravského mléka jsme v této studii nezaznamenali žádný pozitivní vzorek. Pro vznik alimentární infekce člověka má význam vedle počtu pozitivních potravin zejména míra jejich kontaminace. Dodržování základních hygienických pravidel při manipulaci s potravinami a jejich konzumaci riziko vzniku infekce výrazně snižuje. Izoláty Campylobacter spp. vykazují častou rezistenci k chinolonovým antibiotikům, izoláty C. coli se vyznačují větším rozsahem rezistence v porovnání s C. jejuni.
Tato práce byla podpořena grantem Ministerstva zdravotnictví IGA č. NT/14392 a Státní veterinární správou ČR. Infrastrukturální část projektu (Ústav molekulární a translační medicíny) byla podpořena Operačním programem VaV (projekt CZ.1.05/2.1.00/01.0030) a projektem LO1218 v rámci programu NPU I.
Do redakce došlo dne ??. ??. 2014.
Adresa pro korespondenci:
Doc. MVDr. Jan Bardoň, Ph.D., MBA
Státní veterinární ústav Olomouc
Jakoubka ze Stříbra č. 1
779 00 Olomouc
email: jbardon@svuol.cz
Sources
1. European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union Summary Report on Trends and Sources of Zoonoses, Zoonotic Agents and Food-borne Outbreaks in 2011. EFSA Journal, 2013;11(5). doi:10.2903/j.efsa.2013.3129. Available from: http://www.efsa.europa.eu/efsajournal.
2. Táborská J. Kampylobakterové infekce. In: Beneš J, et al. Infekční lékařství. Praha: Galén, 2009 : 242–244.
3. EPIDAT Infekce v ČR [online]. [cit. 2014-01-26]. Available from: http://www.szu.cz/publikace/data/vybrane-infekcni-nemoci-v-cr.
4. Gaudreau C, Helferty M, Sylvestre JL, Allard R, et al. Campylobacter coli Outbreak in Men Who Have Sex with Men, Quebec, Canada, 2010 – 2011. Emerging Infectious Diseases, 2013;19(5):764–767.
5. European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union Summary Report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in 2011. EFSA Journal, 2013;11(5): 3196, [359 pp.]. doi:10.2903/j.efsa.2013.3196. Available from: http://www.efsa.europa.eu/efsajournal.
6. Bardoň J, Kolář M, Karpíšková R, Hricová K. Prevalence of thermotolerant Campylobacter spp. in broilers at retail in the Czech Republic and their antibiotic resistance. Food Control, 2011;22(2):328–332.
7. Bardoň J, Kolář M, Čekanová L, Hejnar P, et al. Prevalence of Campylobacter jejuni and its resistance to antibiotics in poultry in the Czech Republic. Zoonoses and Public Health, 2009;56(3):111–116.
8. Vyhláška Ministerstva zemědělství ze dne 1. června 2004 č. 356/2004 Sb., o sledování (monitoringu) zoonóz a původců zoonóz a o změně vyhlášky č. 299/2003 Sb., o opatřeních pro předcházení a zdolávání nákaz a nemocí přenosných ze zvířat na člověka.
9. Metodický návod Státní veterinární správy č. 1/2005. stanovující pravidla pro pravidelné mikrobiologické vyšetření původců zoonóz, prováděné státním veterinárním dozorem v podnicích podle vyhlášky č. 356/2004 Sb., o sledování (monitoringu) zoonóz a původců zoonóz.
10. ISO 10272-1 : 2006 Microbiology of food and animal feeding stuffs-Horizontal method for detection and enumeration of Campylobacter spp.
11. ISO 10272-2 : 2007 Microbiology of food and animal feeding stuffs-Horizontal method for detection and enumeration of Campylobacter spp.
12. Ertaş HB, Cetinkaya B, Muz A, Ongor H. Identification of chicken originated Campylobacter coli and Campylobacter jejuni by polymerase chain reaction (PCR). Turkish Journal of Veterinary and Animal Sciences, 2002;26(6):1447–1452.
13. Lund M, Nordentoft S, Pedersen K, Madsen M. Detection of Campylobacter spp. in chicken fecal samples by real-time PCR. Journal of Clinical Microbiology, 2004;42(11): 5125–5132.
14. McDermott PF, Bodeis-Jones SM, Fritsche TR, Jones RN, et al. Broth microdilution susceptibility testing of Campylobacter jejuni and the determination of quality control ranges for fourteen antimicrobial agents. Journal of Clinical Microbiology, 2005;43(12):6136–6138.
15. EU Reference Laboratory for Antimicrobial Resistance (EURL-AR). Cut-off values recommended by the EU Reference Laboratory for Antimicrobial Resistance (EURL-AR) Updated September 24th 2012, Page 1 of 3 website. Available from: http://www.eurl-ar.eu.
16. Communique, 2005: Comité de l‘ Antibiogramme de la Société Francaise de Microbiologie. Société Francaise de Microbiologie, Edition de Jenvier, 49 pp. Available from: http://www.sfm.asso.fr/.
17. Maćkiw E, Rzewuska K, Stoś K, Jarosz M, et al. Occurrence of Campylobacter spp. in poultry and poultry products for sale on the Polish retail market. Journal of Food Protection, 2011;74(6):986–989.
18. Madden RH, Moran L, Scates P, McBride J, et al. Prevalence of Campylobacter and Salmonella in raw chicken on retail sale in the republic of Ireland. Journal of Food Protection, 2011;74(11):1912–1916.
19. Bhaduri S, Cottrell B. Survival of cold-stressed Campylobacter jejuni on ground chicken and chicken skin during frozen storage. Applied and Environmental Microbiology, 2004; 70(12):7103–7109.
20. von Altro A, Hamedy A, Merle R, Waldmann KH. Campylobacter spp. – prevalence on pig livers and antimicrobial susceptibility. Preventive Veterinary Medicine, 2013;109(1–2): 152–157. doi: 10.1016/j.prevetmed.2012.09.010.
21. Moore JE, Madden RH. Occurrence of thermophilic Campylobacter spp. in porcine liver in Northern Ireland. Journal of Food Protection, 1998;61(4):409–413.
22. Sasaki Y, Haruna M, Murakami M, Hayashida M, et al. Prevalence of Campylobacter spp., Salmonella spp., Listeria monocytogenes, and hepatitis E virus in swine livers collected at an abattoir. Japanese Journal of Infectious Diseases, 2013;66(2):161–164.
23. Robinson DA. Infective dose of Campylobacter jejuni in milk. British Medical Journal (Clinical Research Ed), 1981;282(6276):1584.
24. Wallis MR. The pathogenesis of Campylobacter jejuni. British Journal of Biomedical Science, 1994;51(1):57–64.
25. Nachamkin I. Campylobacter and Arcobacter. In: Murray, PR, et al. Manual of clinical microbiology. Washington, D.C.: ASM Press, 1995, s. 1482.
26. Karpíšková R, Koláčková I, Vyletělová M, Janštová B. Studie „Mléčné automaty“ – nálezy původců alimentárních onemocnění v syrovém mléce. Zprávy CEM, 2011;20(6):2012–2014.
27. Krištúfková Z, Beneš Č, Micska M, Čižnár I. Is really the morbidity rate of samonellosis in the Slovak and Czech Republic the highest in EU? 4thscientific congress with international participation. Zoonoses – common protection of human and animal health. Bratislava 16.–18. 10. 2013. Abstract. ISBN 978-80-970552-7-1.
28. Sadkowska-Todys M, Kucharczyk B. Campylobacteriosis in Poland in 2011. Przegląd Epidemiologiczny, 2013;67(2): 227–229, 341–342.
29. Bessède E, Solecki O, Sifré E, Labadi L, et al. Identification of Campylobacter species and related organisms by matrix assisted laser desorption ionization-time of flight (MALDI-TOF) mass spectrometry. Clinical Microbiology and Infection, 2011;17(11):1735–1739.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2014 Issue 3-
All articles in this issue
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

