-
Medical journals
- Career
Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
Authors: K. Malíčková 1; I. Janatková 1; M. Bortlík 2,3; V. Komárek 2; M. Lukáš 1,2
Authors‘ workplace: Ústav klinické biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze 1; Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE IVF a 1. LF UK v Praze 2; Ústav biologie a lékařské genetiky VFN a 1. LF UK v Praze 3
Published in: Epidemiol. Mikrobiol. Imunol. 57, 2008, č. 4, s. 147-153
Overview
Úvod:
Vyšetření fekálního kalprotektinu je neinvazivní, jednoduchá, časově i finančně nenáročná diagnostická metoda, sloužící k odlišení funkčních poruch zažívacího ústrojí od zánětem provázeného organického postižení a k predikci hrozícího relapsu nespecifického střevního zánětu. V posledním roce se objevily komerčně dostupné diagnostické soupravy, využívající monoklonálních nebo polyklonálních protilátek proti heterodimetickému komplexu kalprotektinu k detekci koncentrace fekálního kalprotektinu metodou enzymové imunoanalýzy (ELISA).Cíl práce:
Srovnání dvou ELISA metod stanovení fekálního kalprotektinu, které se navzájem liší použitou protilátkou (monoklonální versus polyklonální).Materiál a metodiky:
Byly studovány ELISA soupravy Calprotectin ELISA (Bühlmann, Bazilej, Švýcarsko), ve které je použita monoklonální protilátka, a PhiCalTM Calprotectin ELISA (R-Biopharm, Darmstadt, Německo) využívající polyklonální protilátku proti kalprotektinu. Vyšetřili jsme eluáty stolice nemocných s Crohnovou nemocí (CN, n = 36), ulcerózní kolitidou (UC, n = 29) a kontrolní vzorky, kterými byly eluáty stolice zdravých osob (n = 98). Analýzou získaných dat byly pomocí softwaru Statistica CZ 8.0 (Statsoft, Tulsa, USA) stanoveny parametry variability měření (linearita, opakovatelnost, stabilita), senzitivita a specificita testů a bylo provedeno srovnání metod.Výsledky:
Obě studované soupravy vykázaly velmi uspokojivé hodnoty přesnosti stanovení (intra - a inter-assay < 10%). Dilučním testem linearity byly prokázány lepší hodnoty u soupravy firmy Bühlmann, a to zejména u vysokých koncentrací kalprotektinu. Výsledky získané dvěma metodami navzájem uspokojivě korelovaly: Pearsonův korelační koeficient r = 0,83, limitní diference podle Blanda-Altmana se pohybovaly v rozmezí –17% až 30%. Diagnostická senzitivita testů byla 79 % pro soupravu Calprotectin ELISA Bühlmann a 74 % pro soupravu Calprotectin ELISA R-Biopharm, specificita 87 % pro soupravu Calprotectin ELISA Bühlmann a 84 % pro soupravu Calprotectin ELISA R-Biopharm.Závěry:
Obě studované soupravy mají dobré a srovnatelné parametry měření, u testu využívající monoklonální protilátky proti kalprotektinu jsme zjistili vyšší hodnoty senzitivity a specificity. Dostupnost, citlivost a výkonnost ELISA testů fekálního kalprotektinu lze dobře využít v klinické praxi.Klíčová slova:
fekální kalprotektin – idiopatické střevní záněty – ELISA – monoklonální protilátka – polyklonální protilátka.Idiopatické střevní záněty (inflammatory bowel disease, IBD) jsou chronická zánětlivá onemocnění, postihující primárně tenké a/nebo tlusté střevo. Nejdůležitějšími představiteli této medicínsky i socioekonomicky významné skupiny chorobných stavů jsou Crohnova nemoc a ulcerózní kolitida.
V uplynulých letech došlo k významnému pokroku v objasnění imunologických pochodů, souvisejících se vznikem a vývojem IBD. Dosud však není zcela jasné, zda jsou chronické zánětlivé změny střevní stěny u IBD vyvolány patologickou imunitní odpovědí vůči normálním antigenům ve střevě, nebo zda jde spíše o primárně správnou reakci imunitního systému proti dosud neznámému střevnímu antigenu, či o kombinaci obou možností. Je však zřejmé, že zánět střevní sliznice u IBD je výsledkem kaskády dějů, které vznikly jako reakce na antigen, přičemž primární „chyba“ vzniká nejspíše při předkládání tohoto antigenu T - lymfocytům, kterého se účastní enterocyty a leukocyty jako antigen-prezentující buňky nebo jako zdroje cytokinů, chemokinů a dalších prozánětlivých působků [32].
Souběžně s narůstajícím rozsahem informací o imunopatologických pochodech u IBD vzniká otázka, do jaké míry lze různé imunologické laboratorní parametry využít k diagnostice, diferenciální diagnostice, monitorování průběhu a odhadu prognózy nemoci. V diagnostice IBD se v současné době uplatňují především endoskopické a zobrazovací metody a histologické vyšetření bioptických vzorků – tedy invazivní, časově i finančně nákladné metody [25,26,27,31]. Rutinně prováděná laboratorní vyšetření přispívají k diagnostice a k určení aktivity probíhajícího zánětu, avšak mnohdy mají omezenou senzitivitu a specificitu. Systémové zánětlivé markery (sérový C-reaktivní protein, další sérové proteiny akutní fáze, sedimentace erytrocytů, krevní obraz, sérové autoprotilátky) mohou mít normální hodnoty i v případě již probíhajícího zánětu střevní sliznice [19, 20, 23, 29].
Jedním z úkolů klinické laboratorní diagnostiky je proto nalezení neinvazivního, jednoduchého, časově i finančně dostupného vyšetření, které by pomohlo detekovat zánětlivé změny na střevní sliznici, odlišit funkční poruchy zažívacího ústrojí od organického postižení a upozornit na možnost relapsu u pacienta se známou diagnózou IBD.
Podle řady recentních studií by některé z výše vyjmenovaných vlastností mohl mít fekální kalprotektin [1,2,6,16,18].
Kalprotektin (synonyma: kalgranulin A/B, S100A8/S100A9, MRP8/14) je hlavní antigenní složkou cytoplazmy neutrofilních granulocytů. Jde o 36 kDa heterodimer, složený z lehkého a těžkého řetězce, patřící do rodiny S-100 proteinů vázajících vápník. Je produkován nejenom neutrofilními granulocyty, ale i monocyty/makrofágy a některými epitely, a má významné antimikrobiální vlastnosti. Jako adhezin se účastní přestupu leukocytů z cirkulace do míst zánětu. Po aktivaci neutrofilů a adhezi monocytů k endotelu je uvolňován, působí bakteriostaticky a ovlivňuje lokální cytokinovou odpověď [3,8,30]. V posledních letech byla provedena řada studií, potvrzujících stabilitu uvolňovaného kalprotektinu ve stolici, což z něj činí vhodný marker pro rutinní laboratorní diagnostiku [5,7,9,10,14,15].
Do klinické laboratorní praxe v ČR se v posledním roce dostalo několik diagnostických souprav k detekci fekálního kalprotektinu. Jedná se t.č. výhradně o metody enzymové imunoanalýzy (sandwich ELISA), používající buď polyklonální, nebo monoklonální protilátky proti kalprotektinu. V literatuře je doposud málo informací o tom, do jaké míry jsou výstupy z různých souprav navzájem srovnatelné. Cílem této práce bylo proto srovnání dvou komerčně dostupných ELISA souprav k detekci fekálního kalprotektinu. U obou souprav jsme stanovili parametry variability měření (linearita, opakovatelnost, stabilita), senzitivitu a specificitu testů a provedli jsme srovnávací analýzu výsledků.
Materiál a metodiky
Soubor pacientů
Vyšetřili jsme vzorky stolice 61 nemocných, kteří absolvovali gastroenterologické vyšetření včetně kolonoskopie pro dolní dyspeptický syndrom, tj. pro bolesti břicha, průjmy, křeče v břiše a meteorismus. Soubor pacientů tvořilo 27 mužů a 34 žen ve věku 19 – 69 let (medián 38,4 roku). Na základě klinického vyšetření, kolonoskopie a dalších (zobrazovacích, histopatologických) vyšetření byla u 47 z vyšetřených osob stanovena diagnóza IBD (25 nemocných s Crohnovou nemocí a 22 nemocných s ulcerózní kolitidou), u 14 pacientů nebylo prokázáno zánětlivé střevní onemocnění.
Kontrolní skupinu tvořilo 98 zdravých osob, 50 mužů ( věk 16–66 let, medián 47,1 roku) a 48 žen (věk 17-63 let, medián 39,9 roku). Tyto osoby neměly akutní ani chronické zažívací obtíže, v rodinné ani osobní anamnéze nebyl údaj o výskytu IBD.
Provedení studie bylo schváleno Etickou komisí VFN v Praze.
Laboratorní vyšetření
Studovali jsme ELISA soupravy Calprotectin ELISA (Bühlmann, Bazilej, Švýcarsko), ve které je použita monoklonální protilátka proti kalprotektinu, a PhiCalTM Calprotectin ELISA (R-Biopharm, Darmstadt, Německo) využívající polyklonální protilátky proti kalprotektinu. Vzorek stolice o hmotnosti 50-100 mg byl odebrán do speciálních odběrových zkumavek Faecal Sample Preparation Kit Roche, umožňujících přesné zhotovení eluátu.
Byly analyzovány eluáty stolice, naředěné v poměru 1 : 50 eluačním roztokem podle pokynů výrobců souprav. Při analýzách (realizovaných manuálně) bylo postupováno podle pokynů výrobců. Referenční rozmezí normálních hodnot bylo stanoveno analýzou ROC křivek a srovnáno s výrobci doporučovaným referenčním rozmezím.
Technické parametry studovaných souprav uvádí tabulka 1.
Table 1. Charakteristika studovaných souprav Table 1. Kit characteristics 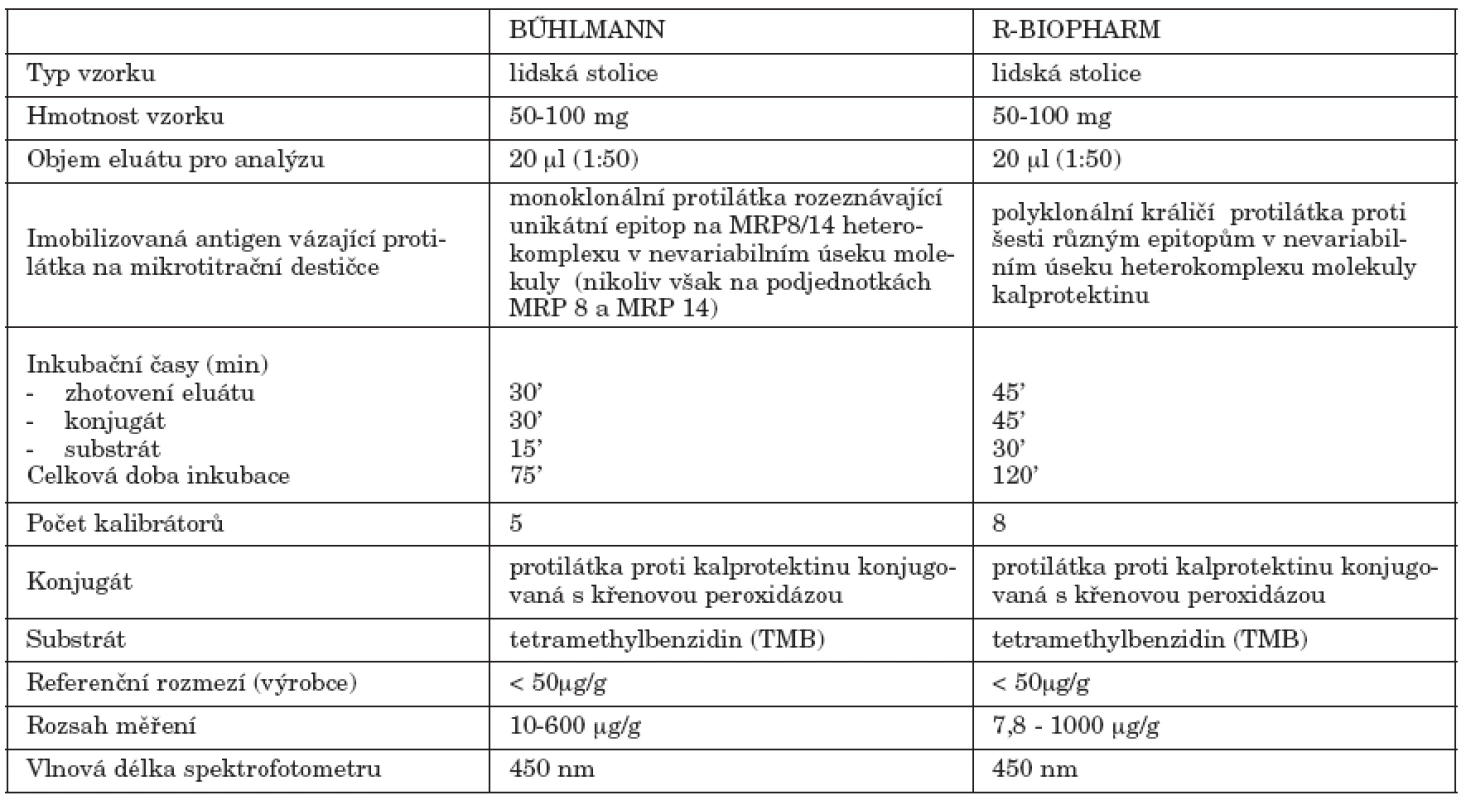
Statistická analýza
Statistická analýza dat byla provedena s pomocí softwaru Statistica CZ 8.0 (Statsoft, Tulsa, USA). U obou souprav byly stanoveny parametry variability měření – linearita, opakovatelnost a stabilita, diagnostická hodnota testů – jejich senzitivita a specificita pro diagnózu IBD, a nakonec bylo provedeno srovnání výsledků vyšetření provedených dvěma testy (Pearsonův korelační koeficient, Bland-Altmanova analýza) [4]. ROC analýza byla provedena pomocí kalkulátoru JROCFIT 1.0.2 [12].
Za statisticky významný výsledek byla brána p-hodnota menší nebo rovna 0,05.
Výsledky
Linearita – diluční pokus
Linearita měření pomocí studovaných souprav byla hodnocena po naředění eluátu stolice se známou vysokou hodnotou fekálního kalprotektinu vzorkem neobsahujícím kalprotektin v rozmezí od 0 % do 100 % v krocích po 10 %, neboli od poměru 1 : 9 po 9 : 1. Každý vzorek se měřil v duplikátu. Pořadí měření jednotlivých vzorků bylo randomizované.
U obou souprav byly zjištěny dobré parametry linearity měření, u soupravy firmy R-Biopharm však nebyl uspokojivý tvar křivky u vysokých koncentrací – obrázek 1.
Image 1. Linearita měření. Dilučním testem byla ověřena platnost rozsahu linearity měření. Tento rozsah vymezuje interval, v němž lze bezpečně očekávat, že platí výrobci deklarované a validačními experimenty ověřené hodnoty přesnosti a vychýlení metody. Jelikož nejsou k dispozici komerčně dostupné referenční materiály, byl k posouzení linearity měření použit diluční pokus Při validaci byla vyhodnocena výtěžnost dosažená u jednotlivých vzorků (R %) podle vzorce R = (výsledek měření/teoretická hodnota)x100 s hodnotou R = 93 % pro soupravu Bühlmann a R = 86 % pro soupravu R-Biopharm. Fig. 1. Measurement linearity. The dilution assay was used to test the validity of the measurement linearity range. Within this range, the method accuracy and deviation, as declared by the manufacturer and experimentally validated, should be guaranteed. As no commercially available reference was provided, the dilution assay was used to test the measurement linearity. Within the validation, the method efficiency was calculated for individual samples (R %) according to the formula: R = (measurement result/theoretical value) x100. R was 93 % for the Bühlmann kit and 86 % for the R-Biopharm kit 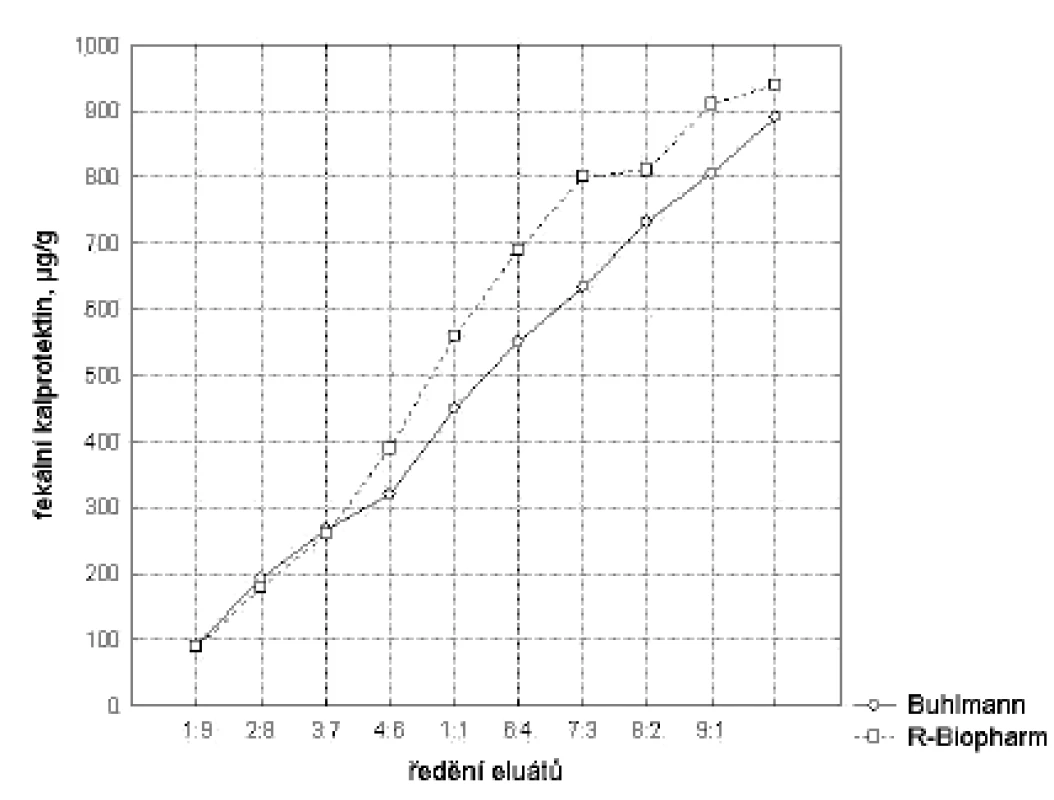
Variace v rámci testu a mezi testy (intra-assay a inter-assay charakteristiky)
Vyšetřili jsme 15 alikvot jednoho vzorku s vysokou a jednoho vzorku s nízkou koncentrací kalprotektinu v jeden den na různých pozicích mikrotitrační destičky. U obou souprav byly variační koeficienty měření vysokého i nízkého vzorku nižší než 10% - viz tabulka 2a.
Dále jsme připravili 8 alikvot jednoho vzorku s vysokou a jednoho vzorku s nízkou koncentrací kalprotektinu, které jsme zamrazili při teplotě - 20°C. Alikvoty jsme postupně rozmrazovali a v období od listopadu 2007 do března 2008 postupně stanovovali koncentrace kalprotektinu. Vzorky nebyly opakovaně rozmrazovány a zamrazovány. Variační koeficienty měření opět u obou souprav nepřevýšily hodnotu 10% - viz tabulka 2b.
Table 2. Přesnost stanovení fekálního kalprotektinu při použití dvou srovnávaných metod. Míra shodnosti výsledků testů je vyjádřena hodnotami variačního koeficientu opakovatelnosti (tj. jedna metoda, jeden operátor, jedna laboratoř) (a) intra-assay opakovatelnost (b) inter-assay opakovatelnost Table 2. Accuracy of fecal calprotectin detection. The level of agreement of the results was expressed by the repeatability coefficient of variation (i.e. one method, one operator, one laboratory) (a) intra-assay repeatability (b) inter-assay repeatability 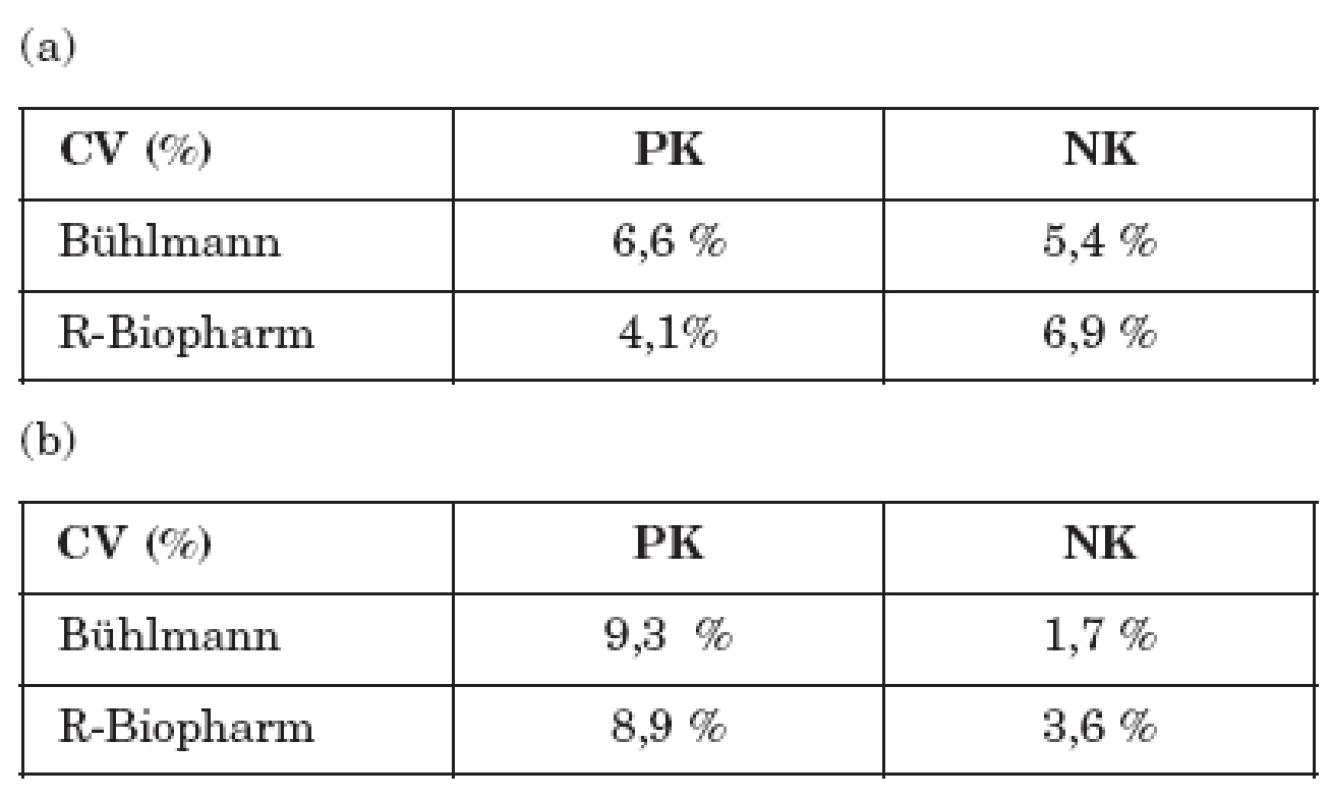
CV – variační koeficient PK – pozitivní vzorek NK – negativní vzorek CV – coefficient of variation PK – positive specimen NK – negative specimen Srovnání metod
Pro sledování závislosti mezi dvěma soubory měření byl použit výběrový korelační koeficient. Vypočtená hodnota r = 0,83 pro n = 159, α = 0,05 a kritickou hodnotu rk z tabulek = 0,197 svědčí pro signifikantní závislost.
Jak známo, korelační koeficient posuzuje míru závislosti mezi metodami, není kritériem pro posouzení shody výsledků [4]. Provedli jsme proto Bland-Altmanovu analýzu získaných dat. Rozdílový graf podle Blanda a Altmana uvádí na ose X průměr hodnot získaných dvěma srovnávanými metodami a na ose Y rozdíl hodnot získaných studovanými metodami. Obrázek 2a uvádí data bez transformace – vyplývá z něj heteroskedasticita naměřených hodnot (s rostoucí koncentrací rostou diference naměřených hodnot). Po logaritmické transformaci dat (obrázek 2b) jsou patrné limitní diference metod v rozmezí –17% až 30%.
Image 2. Shoda výsledků měření pomocí dvou studovaných souprav (a) Rozdílový Bland-Altmanův graf, (b) Bland-Altmanův graf po logaritmické transformaci dat Fig. 2. Congruence of measurement results (a) Bland-Altman plot for variation, (b) Bland-Altman plot for log-transformed data 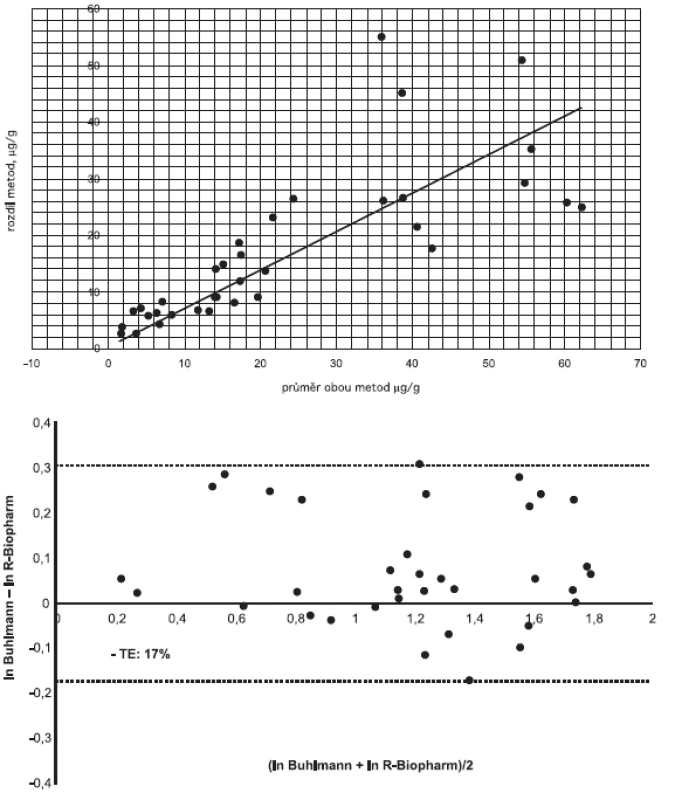
Senzitivita a specificita
Pro obě studované imunoanalytické metody byly vypočteny hodnoty senzitivity a specificity testů pro diagnózu IBD.
Nejdříve jsme pomocí on-line kalkulátoru parametrů ROC křivek pro obě metody vypočetli hodnotu plochy pod křivkou: u soupravy Bühlmann byla plocha pod křivkou (ROC Area) 0,989 a u soupravy R-Biopharm 0,980. Tyto hodnoty se statisticky významně navzájem nelišily. Rovněž tak optimální cut-off bod (s nejvyšší senzitivitou a specificitou testu) byl pro obě soupravy podobný a nepatrně vyšší než cut-off hodnota udávaná výrobcem: 70 μg/g proti doporučovaným 50 μg/g. Diagnostická senzitivita a specificita obou testů je uvedena v tabulce 3.
Table 3. Senzitivita a specificita studovaných ELISA testů pro diagnózu IBD (cut-off bod 70 μg/g) Table 3. Sensitivity and specificity of ELISA kits for the diagnosis of IBD (cut-off point: 70 μg/g) 
Diskuse
Výskyt IBD v naší zemi neustále stoupá. Incidence ulcerózní kolitidy je odhadována na 8-12 na 100 000 obyvatel, incidence Crohnovy nemoci na 6-8 na 1 000 000 obyvatel. Obě nemoci postihují především osoby v produktivním věku a přes obrovské pokroky v diagnostice a léčbě se nepodařilo významně ovlivnit průběh těchto chorob, spočívající v opakovaných relapsech aktivity a nutnosti chirurgické léčby. Relapsy a komplikace IBD pacienty významně invalidizují, diagnostická a léčebná péče o ně je velmi nákladná. S přihlédnutím k ekonomické náročnosti diagnostických a léčebných postupů, které představuje především biologická léčba IBD, by zavedení jednoduché a neinvazivní diagnostické metody identifikace pacientů s aktivním zánětem střevní stěny mohlo mít významné preventivní dopady a umožnilo by posoudit časnou odpověď na podávanou léčbu.
V této souvislosti je v centru zájmu gastroenterologů a laboratoří vyšetřujících nemocné s IBD mimo jiného stanovení fekálního kalprotektinu. K nejrecentnějším zjištěním zahraničních autorů patří dobrá korelace hodnot fekálního kalprotektinu se stupněm postižení střeva ulcerózní kolitidou stanoveným podle Sutherlandových kritérií (r = 0,866) [34] nebo vynikající senzitivita (téměř 100%) a nižší specificita (67 – 80 %) u dětí s různými IBD [13,22,24]. Von Roonova kvantitativní meta-analýza prospektivních studií [33] poukazuje mj. na vyšší stupeň přesnosti vyšetření fekálního kalprotektinu při vyšší než běžně doporučované cut-off hodnotě tohoto analytu. V meta-analýze Lashnera et al. [21] bylo v databázích Medline, Ovid, Embase a Cochrane nalezeno na 30 klinických studií, v rámci kterých byl vyšetřen kalprotektin ve stolici u více než 6000 osob. U nemocných s IBD byl medián koncentrace kalprotektinu v séru 219,23 μg/g (95% interval spolehlivosti 174,5 – 263,9), což bylo signifikantně více než medián hodnot zdravých osob (p < 0,001).
V naší studii jsme prokázali dobré parametry přesnosti stanovení u obou studovaných ELISA souprav (intra - a inter-assay < 10%). Dilučním testem linearity byly prokázány lepší hodnoty u soupravy používající monoklonální protilátku, a to zejména u vysokých koncentrací kalprotektinu. Výsledky získané dvěma metodami navzájem uspokojivě korelovaly: Pearsonův korelační koeficient r = 0,83, limitní diference podle Blanda-Altmana–17% až 30%. Diagnostická senzivita testů byla 79 % pro soupravu Calprotectin ELISA Bühlmann a 74 % pro soupravu Calprotectin ELISA R-Biopharm, specificita 87 % pro soupravu Calprotectin ELISA Bühlmann a 84 % pro soupravu Calprotectin ELISA R-Biopharm. Obě studované soupravy tedy měly dobré a srovnatelné parametry měření, příznivější hodnoty vykázala souprava využívající monoklonální protilátky proti kalprotektinu.
Při posuzování imunoanalytických metod stanovení kalprotektinu ve stolici je třeba vzít v úvahu, že kalprotektin je organická makromolekula, která je do určité míry variabilní a která se navíc vyskytuje v heterokomplexech (především v dimerech) [11,17]. Formátem obou studovaných diagnostických souprav je sendvičová enzymová imunoanalýza se dvěma protilátkami cílenými proti různým epitopům kalprotektinu. U soupravy firmy Bühlmann je podle informací výrobce na mikrotitrační destičce imobilizována monoklonální protilátka rozeznávající unikátní epitop na heterokomplexu molekuly kalprotektinu v nevariabilním úseku molekuly, přičemž tento epitop není imunogenní na samostatných podjednotkách molekuly (tj. MRP 8 a MRP 14). Tím je na minimum redukován vliv variabilního složení molekuly kalprotektinu na výsledky stanovení. Souprava firmy R-Biopharm využívá polyklonální králičí protilátky proti šesti různým epitopům v nevariabilním úseku heterokomplexu molekuly kalprotektinu, čímž je zajištěna minimalizace výskytu falešně negativních výsledků. Je potěšitelnou skutečností, že studované komerčně dostupné metody mezi sebou uspokojivě korelují, a tudíž není naléhavě nutné zavedení referenčních kalibrátorů. Je nicméně zřejmé, že zavedením referenčních materiálů lze zdokonalit korelaci komerčně dostupných metod [28]. Vyvstane-li potřeba deklarovat některou z dostupných metod jako neformální “zlatý standard”, přikláníme se k enzymové imunoanalýze s využitím monoklonálních protilátek, a to z důvodu lepších parametrů variability, jakož i senzitivity a specificity. Ačkoliv by výběr takové metody mohl přispět ke zlepšení reprodukovatelnosti mezi metodami, otázkou je, jak by takovou volbu vnímali výrobci konkurenčních souprav a jaká by byla ochota výrobce “zlatého standardu” odkrýt část důvěrných know-how informací.
Vyšetření stolice je zcela neinvazivním přístupem. Ve srovnání s obvyklými imunoanalytickými metodami vyšetření krve však analýza fekálních vzorků vyžaduje ještě větší pečlivost v preanalytické fázi vyšetření, při které hrozí zvýšené riziko preanalytické chyby – odběrem stolice počínaje, přes správné uchovávání primárního vzorku až po přesné zhotovení eluátu. Na rozdíl od jiných biologických materiálů ovlivňuje složení vzorku stolice např. relativní poměr pevných a tekutých složek, který má vliv na nutné konstantní množství stolice pro testování, což rovněž může způsobit analytické chyby.
Závěrem konstatujeme, že obě studované ELISA soupravy k detekci fekálního kalprotektinu jsou dostatečně robustní, mají dobré a srovnatelné parametry měření. Dostupnost, citlivost a výkonnost ELISA testů fekálního kalprotektinu lze (s vědomím specifik fekálních vzorků) dobře využít v klinické praxi.
Poděkování
Tato práce byla podpořena grantem IGA MZd ČR č. NR/9094-4/2006.
Do redakce došlo 23. 7. 2008
MUDr. Karin Malíčková
Klinická imunologie a alergologie, ÚKBLD VFN a LF UK
Karlovo nám. 32
121 11 Praha 2
e-mail: kmali@lf1.cuni.cz
Sources
1. Aadland, E., Fagerhol, M.K. Faecal calprotectin: a marker of inflammation throughout the intestinal tract. Eur J Gastroenterol Hepatol. 2002, 14, 823-825.
2. Amati, L., Passeri, M.E., Selicato, F. New insights into the biological and clinical significance of fecal calprotectin in inflammatory bowel disease. Immunopharmacol Immunotoxicol 2006, 28, 665-681.
3. Berni Canani, R., Terrin, G., Rapacciuolo, L. Faecal calprotectin as reliable non-invasive marker to assess the severity of mucosal inflammation in children with inflammatory bowel disease. Dig Liver Dis 2008, 40(7), 547-53.
4. Bland, J.M., Altman, D.G. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet 1986, 1(8476), 307-310.
5. Bremner, A., Roked, S., Robinson, R. et al. Faecal calprotectin in children with chronic gastrointestinal symptoms. Acta Paediatr 2005, 94, 1855-1858.
6. Bunn, S.K., Bisset, W.M., Main, M.J. Fecal calprotectin as a measure of disease activity in childhood inflammatory bowel disease. Pediatr Gastroenterol Nutr. 2001, 32, 171-177.
7. Carroccio, A., Iacono, G., Cottone, M. et al. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin Chem 2003, 49, 861-867.
8. Costa, F., Mumolo, M.G., Bellini, M. et al. Role of faecal calprotectin as non-invasive marker of intestinal inflammation. Dig Liver Dis 2003, 35, 642-647.
9. Costa, F., Mumolo, M.G., Ceccarelli, L. et al. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn’s disease. Gut 2005, 54, 364-368.
10. De Jong, N.S., Leach, S.T., Day, A.S. Fecal S100A12: a novel noninvasive marker in children with Crohn’s disease. Inflamm Bowel Dis 2006, 12, 566-572.
11. D’Inca, R., Dal Pont, E., Di Leo, V. et al. Calprotectin and lactoferrin in the assessment of intestinal inflammation and organic disease. Int J Colorectal Dis 2007, 22, 429-437.
12. Eng, J. Receiver operating characteristic analysis: a primer. Acad Radiol 2005, 12(7), 909-916.
13. Fagerberg, U.L., Loof, L., Lindholm, J. Fecal calprotectin: a quantitative marker of colonic inflammation in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007, 45, 414-420.
14. Fagerberg, U.L., Loof, L., Merzoug, R.D. et al. Fecal calprotectin levels in healthy children studied with an improved assay. J Pediatr Gastroenterol Nutr 2003, 37, 468-472.
15. Fagerberg, U.L., Loof, L., Myrdal, U. Colorectal inflammation is well predicted by fecal calprotectin in children with gastrointestinal symptoms. J Pediatr Gastroenterol Nutr 2005, 40, 450-455.
16. Fagerhol, M.K. Calprotectin, a faecal marker of organic gastrointestinal abnormality. Lancet 2000, 356, 1783-1784.
17. Johnson, M.W., Maestranzi, S., Duffy, A.M. et al. Faecal calprotectin: a noninvasive diagnostic tool and marker of severity in pouchitis. Eur J Gastroenterol Hepatol 2008, 20, 174-179.
18. Kaiser, T., Langhorst, J., Wittkowski, H. Faecal S100A12 as a non-invasive marker distinguishing inflammatory bowel disease from irritable bowel syndrome. Gut 2007, 56, 1706-1713.
19. Langhorst, J., Elsenbruch, S., Koelzer, J. et al. Noninvasive markers in the assessment of intestinal inflammation in inflammatory bowel diseases: performance of fecal lactoferrin, calprotectin, and PMN-elastase, CRP, and clinical indices. Am J Gastroenterol 2008, 103, 162-169.
20. Langhorst, J., Elsenbruch, S., Mueller, T. et al. Comparison of 4 neutrophil-derived proteins in feces as indicators of disease activity in ulcerative colitis. Inflamm Bowel Dis 2005, 11, 1085-1091.
21. Lashner, B.A. How useful is fecal calprotectin for the diagnosis of IBD and colorectal cancer ? Nat Clin Pract Gastroenterol Hepatol 2008, 5, 16-17.
22. Leach, S.T., Yang, Z., Messina, I. et al. Serum and mucosal S100 proteins, calprotectin (S100A8/S100A9) and S100A12, are elevated at diagnosis in children with inflammatory bowel disease. Scand J Gastroenterol 2007, 42, 1321-1331.
23. Lundberg, J.O., Hellstrom, P., Fagerhol M.K. et al. Technology insight: calprotectin, lactoferrin and nitric oxide as novel markers of inflammatory bowel disease. Nat Clin Pract Gastroenterol Hepatol 2005, 2, 96-102.
24. Olafsdottir, E., Aksnes, L., Fluge, G. et al. Faecal calprotectin levels in infants with infantile colic, healthy infants, children with inflammatory bowel disease, children with recurrent abdominal pain and healthy children. Acta Paediatr 2002, 91, 45-50.
25. Pardi, D.S., Sandborn, W.J. Predicting relapse in patients with inflammatory bowel disease: what is the role of biomarkers? Gut 2005, 54, 321-322.
26. Parry, S., Forgacs, I. Intestinal infection and irritable bowel syndrome. Eur J Gastroenterol Hepatol 2005, 17, 5-9.
27. Roseth, A.G., Aadland, E., Jahnsen, J. et al. Assessment of disease activity in ulcerative colitis by faecal calprotectin, a novel granulocyte marker protein. Digestion 1997, 58, 176-180.
28. Schoepfer, A.M., Trummler, M., Seeholzer, P. et al. Accuracy of four fecal assays in the diagnosis of colitis. Dis Colon Rectum 2007, 50, 1697-1706.
29. Schoepfer, A.M., Trummler, M., Seeholzer, P. et al. Discriminating IBD from IBS: comparison of the test performance of fecal markers, blood leukocytes, CRP, and IBD antibodies. Inflamm Bowel Dis 2008, 14, 32-39.
30. Summerton, C.B., Longlands, M.G., Wiener, K. Faecal calprotectin: a marker of inflammation throughout the intestinal tract. Eur J Gastroenterol Hepatol 2002, 14, 841-845.
31. Tibble, J., Teahon, K., Thjodleifsson, B. et al. A simple method for assessing intestinal inflammation in Crohn’s disease. Gut 2000, 47, 506-513.
32. Vermeire, S., Van Assche, G., Rutgeerts, P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006, 55, 426-431.
33. Von Roon, A.C., Karamountzos, L., Purkayastha, S., Reese, G.E., Darzi, AW. et al. Diagnostic precision of fecal calprotectin for inflammatory bowel disease and colorectal malignancy. Am J Gastroenterol 2007, 102(4), 803-813.
34. Xiang, J.Y., Ouyang, Q., Li, G.D. Clinical value of fecal calprotectin in determining disease activity of ulcerative colitis. World J Gastroenterol 2008, 14, 53-57.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2008 Issue 4-
All articles in this issue
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
- Rezistence enterobakterií ke karbapenemům
- Charakteristika a prevalence klonů Listeria monocytogenes izolovaných od pacientů v letech 2001-2008 v České republice
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rezistence enterobakterií ke karbapenemům
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

