-
Medical journals
- Career
Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
: L. Černohorská; T. Andrysík
: Mikrobiologický ústav Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice u sv. Anny v Brně
: Epidemiol. Mikrobiol. Imunol. 57, 2008, č. 4, s. 141-146
ß-laktamázy typu AmpC, enzymy produkované řadou gramnegativních bakterií, které hydrolyzují peniciliny, monobaktamy, cefalosporiny a cefamyciny, nejsou inhibovány inhibitory ß-laktamáz. Jsou šířeny cestou plazmidů a představují velký epidemiologický a také diagnostický problém.
Zjišťovali jsme produkci ß-laktamáz typu AmpC u různých gramnegativních bakterií. Kmeny, izolované z močí pacientů s diagnózou močové infekce, byly vybrány na základě rezistence k cefalosporinům 3. generace a přitom nebyly určeny jako producenti ESBL (extended-spectrum beta lactamases). Produkce inducibilních AmpC byla zjišťována pomocí DDST (double disk synergy test) a produkce konstitutivních AmpC pomocí agaru s oxacilinem, který slouží jako inhibitor enzymů AmpC. U všech kmenů s produkcí konstitutivních AmpC byla testována také citlivost k amikacinu, piperacilinu s tazobaktamem, cefoperazonu se sulbaktamem, imipenemu, meropenemu a kolistinu pomocí diskové difuzní metody na MH-agaru.
Celkem bylo testováno 119 kmenů (z toho 68 kmenů Klebsiella pneumoniae, 20 Escherichia coli a 12 Enterobacter aerogenes). Bylo zachyceno 38 konstitutivních AmpC producentů. Produkce byla nejvýraznější u kmenů K. pneumoniae (17), E. coli (10) a E. aerogenes (4). Produkce inducibilní AmpC ß-laktamázy byla prokázána u 32 kmenů (z toho 21 bylo kmenů K. pneumoniae, 6 kmenů Morganella morganii a 3 kmeny E. aerogenes). U 2 kmenů (K. pneumoniae) byla zjištěna současná produkce ESBL a AmpC. Kmeny s konstitutivními AmpC byly poměrně dobře citlivé k cefepimu (84,2 %), také citlivost ke karbapenemům zůstala zachována.Klíčová slova:
AmpC – ESBL – gramnegativní bakterie – infekce močových cest.Objev penicilinu, jeho uvedení do klinické praxe a vývoj dalších antibiotik přinesl naději, že bakteriální onemocnění již přestanou být problémem. Na základě těchto názorů se začalo podceňovat dodržování hygienicko-epidemiologického režimu ve zdravotnických zařízeních a docházelo též k nadměrnému a neúčelnému užívání antibiotik [17, 18, 19]. To vedlo k rozšíření bakteriálních kmenů rezistentních k jednotlivým antibiotikům a následně i kmenů multirezistentních. Jako hlavní příčina rezistence se ukazuje právě selekční tlak antibiotik [17, 27]. Mechanismů vzniku rezistence je celá řada, nejčastější příčinou rezistence bakterií k ß-laktamovým antibiotikům je však produkce ß-laktamáz [11, 15]. Geny pro tvorbu ß-laktamáz mohou být přítomny jak na bakteriálním chromozomu, tak i na plazmidech [3, 10, 28]. ß-laktamáz existuje celá řada, pro jejich klasifikaci se používá buď klasifikace podle Amblera, nebo klasifikace podle Bushové-Jacobyho-Madeirose [2, 4, 14]. Klinicky nejvýznamnější je produkce ß-laktamáz typu ESBL (extended-spectrum beta lactamases) a AmpC [5, 10, 11, 14, 23].
ß-laktamázy typu AmpC
Amp C jsou řadou mikrobů produkovány inherentně, hydrolyzují peniciliny, monobaktamy, cefalosporiny a cefamyciny, nehydrolyzují karbapenemy a většinou nejsou inhibovány inhibitory ß-laktamáz. Díky svému spektru účinku jsou někdy označovány jako cefalosporinázy [9, 10]. Podle Amblerovy klasifikace se řadí do skupiny C, podle klasifikace Bushové-Jacoby-Meiderose do skupiny 1 [2, 4]. Geny pro ß-laktamázy typu AmpC jsou přítomny v chromozomu u celé řady bakteriálních druhů, např. Pseudomonas aeruginosa, Enterobacter spp., Morganella morganii, Serratia spp.,Providencia spp., Citrobacter freundii aj. [9, 10, 11, 25]. Původně byly identifikovány pouze chromozomální ß-laktamázy AmpC, později byly popsány i ß-laktamázy AmpC kódované geny přítomnými na plazmidech [9, 10, 25]. První ß-laktamáza AmpC tohoto typu byla identifikována u druhu Proteus mirabilis, lze se s ní setkat i u ostatních bakteriálních druhů, jako např. Salmonella enterica, Shigella sp., Escherichia coli aj., nicméně klinicky a epidemiologicky je nejzávažnější výskyt u druhu Klebsiella pneumoniae [5, 9, 10, 25]. Právě přítomnost genů pro tyto enzymy na plazmidech je příčinou jejich rychlého šíření u stále většího množství gramnegativních bakterií na všech kontinentech [5, 21].
Inducibilní enzymy AmpC (iAmpC) nejsou exprimovány bez přítomností induktoru. Tím může být např. imipenem, cefoxitin nebo inhibitory ß-laktamáz (kyselina klavulanová, sulbaktam, tazobaktam). V mechanismu indukce hrají důležitou roli proteiny vážící penicilin [6, 10, 13]. Mutace v regulačním systému AmpC vede ke konstitutivní nadprodukci ß-laktamáz (tzv. hyperprodukci), tato změna bývá ireverzibilní [21].
Klinický význam bakterií produkujících AmpC
Klinický význam ß-laktamáz AmpC je srovnatelný s ESBL [10]. Zatímco producenti ESBL jsou považováni za rezistentní ke všem ß-laktamům kromě karbapenemů, bez ohledu na výsledky vyšetření citlivosti, a účinek cefoxitinu a kombinace penicilinů s inhibitory ß-laktamáz je nejistý, producenti AmpC jsou rezistentní k inhibitorům ß-laktamáz, cefamycinům a k většině cefalosporinů [3, 10, 11]. I když nebyl ve skupině AmpC dosud popsán žádný enzym schopný hydrolyzovat karbapenemy, je již popisována rezistence k této skupině [10, 20]. Tato rezistence je dána obvykle snížením permeability vnější buněčné stěny [20, 21]. Dále je u producentů AmpC popisována rezistence k ostatním skupinám antibiotik, kódovaná geny nesenými na stejném mobilním elementu [21]. Další nebezpečí selhání léčby u producentů AmpC spočívá v projevujícím se efektu inokula. Jedná se o jev, kdy MIC není konstantou, ale je závislá na množství přítomných bakterií. Při standardním vyšetření se používá inokulum 105 CFU/ml, přičemž v organismu při infekci může být koncentrace bakterií i o několik řádů vyšší, a tak přítomná koncentrace antibiotika nemusí být účinná [10].
Terapeutická doporučení u infekcí způsobených producenty AmpC
U producentů AmpC je podání ß-laktamových antibiotik omezené. Možné je podání cefalosporinů 4. generace (např. cefepimu), je-li k němu kmen citlivý a neprodukuje-li daná bakterie zároveň ESBL [11, 23]. I v případě cefepimu byl však prokázán efekt inokula, proto je třeba posuzovat každý případ individuálně [10]. U producentů inducibilních enzymů lze zvážit podání cefalosporinů 3. a 4. generace pouze u kmenů izolovaných z močových cest. V ostatních případech se podání těchto antibiotik nedoporučuje [10, 11, 24]. Lékem volby jsou zde karbapenemy, pokud k nim je daný kmen citlivý. U producentů AmpC se lze často setkat s rezistencí k chinolonům, která může být podmíněna přítomností genů přítomných na stejném mobilním elementu jako AmpC. Podání chinolonů je možné v případě, že kmen je k antibiotiku citlivý [10]. V krajních případech, při rezistenci ke karbapenemům a jiným antibiotikům, lze použít polymyxiny (kolistin). Je třeba se vyhýbat kombinacím s inhibitory ß-laktamáz. Během léčby je třeba sledovat případný vývoj adaptivní rezistence pravidelným vyšetřováním [10, 23].
Diagnostika AmpC v klinické praxi
K detekci AmpC byla vyvinuta celá řada metod, včetně metod molekulárně biologických [5, 6, 7, 10]. Ty se ale k rutinní diagnostice vzhledem k časové a ekonomické náročnosti zatím moc nehodí. Podobně je tomu u metod využívajících bakteriálních extraktů jak testovaného kmene, tak referenčních kmenů – např. E. coli citlivých k cefalosporinům [10]. Pro účely rutinní laboratorní diagnostiky se jeví jako nejvhodnější metody využívající antibiotických disků na Muellerově-Hintonové agar (MH). Některé testy jsou shodné s testy na produkci ESBL, což umožňuje zařadit testování produkce AmpC do algoritmů diagnostiky ESBL. Jde zejména o modifikace DDST (double disk synergy test), kdy se využívá detekce deformace inhibičních zón mezi disky s cefalosporiny (cefotaximem, ceftazidimem), aztreonamem a diskem s amoxicilinem/kyselinou klavulanovou. Tento test slouží jak k detekci ESBL [16], tak inducibilní AmpC. Pro detekci hyperprodukce AmpC nebo pro detekci kmenů současně produkujících AmpC a ESBL se používá poznatku, že některé látky jsou schopny inhibovat enzymy AmpC. Jde například o kyselinu boritou nebo oxacilin [6, 7, 10, 11].
Materiál a metody
Bylo testováno 68 kmenů K. pneumoniae, z dalších bakterií byly vyšetřovány kmeny Klebsiella oxytoca (2), E. aerogenes (12), E. coli (20), M. morganii (9), Providentia stuartii (2), Proteus mirabilis/Proteus vulgaris (1/3), Serratia marcescens (2). Tyto kmeny byly izolovány z močí zaslaných k vyšetření na Mikrobiologický ústav LF a FN u sv. Anny v Brně z urologické, I. a II. interní kliniky s diagnózou močové infekce. Všichni původci pocházeli od pacientů z komunity. Hraniční koncentrace bakterií v moči, od které byly izolované bakterie považovány za původce onemocnění, byla 104/ml. Identifikace kmenů proběhla soupravou Enterotest 16 (Lachema, Cz). Kmeny byly shromažďovány a průběžně testovány od března 2007 do března 2008.
Testovací kritérium pro výběr kmenů AmpC: Nejprve byly vyloučeny kmeny pouze ESBL-pozitivní. K rutinní detekci těchto kmenů byla použita metoda DDST [11, 16] a metoda CLSI (metoda platí pouze pro rod Klebsiella, E. coli a P. mirabilis) [11]. Námi testované kmeny byly CLSI-negativní i DDST-negativní a vykazovaly rezistenci k některému nebo ke všem cefalosporinům 3. generace.
Testovací kritérium pro výběr kmenů iAmpC: Pro detekci inducibilních enzymů typu AmpC bylo využito DDST testu. Producenti iAmpC vytvářeli zvětšenou inhibiční zónu ve tvaru písmene D u aztreonamu (30 μg), cefotaximu (30 μg) a u ceftazidimu (30 μg) na straně sousedící s diskem amoxicilin/klavulanová kys. (20/10 μg). Vzdálenost disků byla 25 mm.
Ke konfirmaci konstitutivních AmpC stejně jako inducibilních AmpC byla použita metoda využívající inhibici AmpC oxacilinem. Byla připravena suspenze bakterií ve fyziologickém roztoku s glukózou o hustotě 0,5 McFarlanda. Tímto inokulem byly naočkovány Petriho misky s MH a současně s MH se 128 mg/l oxacilinu (MH+OXA). Na obě půdy byl umístěn doprostřed misky disk s amoxicilinem/kyselinou klavulanovou: AMC (20/10 μg). Do vzdálenosti 25 mm od tohoto disku byly pravidelně umístěny disky s 30 μg aztreonamu (ATM), 30 μg ceftazidimu (CAZ), 30 μg cefepimu (FEP) a 30 μg cefotaximu (CTX). Po 24hodinové kultivaci byly odečítány a interpretovány výsledky následovně:
U kmenů s hyperprodukcí AmpC vznikl rozdíl ve velikosti nedeformované inhibiční zóny na agarech MH a MH+OXA, alespoň u jednoho antibiotika větší než 5mm.
V případě produkce ESBL došlo k deformaci inhibičních zón ve tvaru „šampusové zátky“, tzn. k rozšíření inhibiční zóny směrem k disku AMC.
Současná produkce AmpC a ESBL: Oxacilin inhiboval AmpC a umožnil detekci původně skryté ESBL. Došlo proto současně k deformaci inhibičních zón na MH+OXA a zároveň k rozdílu velikosti zón většímu než 5 mm alespoň u jednoho antibiotika oproti MH.
U kmenů bez produkce AmpC nebo ESBL inhibiční zóny na obou agarech nejevily žádné známky deformace a rozdíl mezi velikostí zón na obou agarech byl menší než 5 mm.
U všech kmenů s konstitutivní AmpC byla testována také citlivost k amikacinu, piperacilinu s tazobaktamem, cefoperazonu se sulbaktamem, imipenemu, meropenemu a kolistinu pomocí diskové difúzní metody na MH [28].
Během naší práce jsme kmeny, které se vyskytovaly u pacientů opakovaně, vyšetřili na produkci AmpC znovu, abychom zjistili možný posun rezistence. Těchto 6 kmenů bylo do statistiky zahrnuto pouze jedenkrát, tj. při prvním výskytu.
Výsledky
Celkem bylo ze 119 různých kmenů nalezeno 38 kmenů s hyperprodukcí AmpC a 32 kmenů iAmpC. Konstitutivní produkci AmpC vykazovalo 17 kmenů K. pneumoniae, 10 kmenů E. coli, 4 kmeny E. aerogenes a 3kmeny M. morganii, ostatní bakterie pak spíše ojediněle. Inducibilní produkci vykazovalo21 kmenů K. pneumoniae, 6 kmenů M. morganii a 3 kmeny E. aerogenes. Tento typ rezistence byl zachycen i u jiných námi testovaných bakterií (tab. 1).
1. Výskyt iAmpC, AmpC, ESBL a kombinovaných typů citlivosti u gramnegativních bakterií Table 1. Production of iAmpC, AmpC and ESBL and antibiotic resistance in Gram-negative bacteria Typ rezistence ESBL AmpC+ESBL iAmpC AmpC Jiný 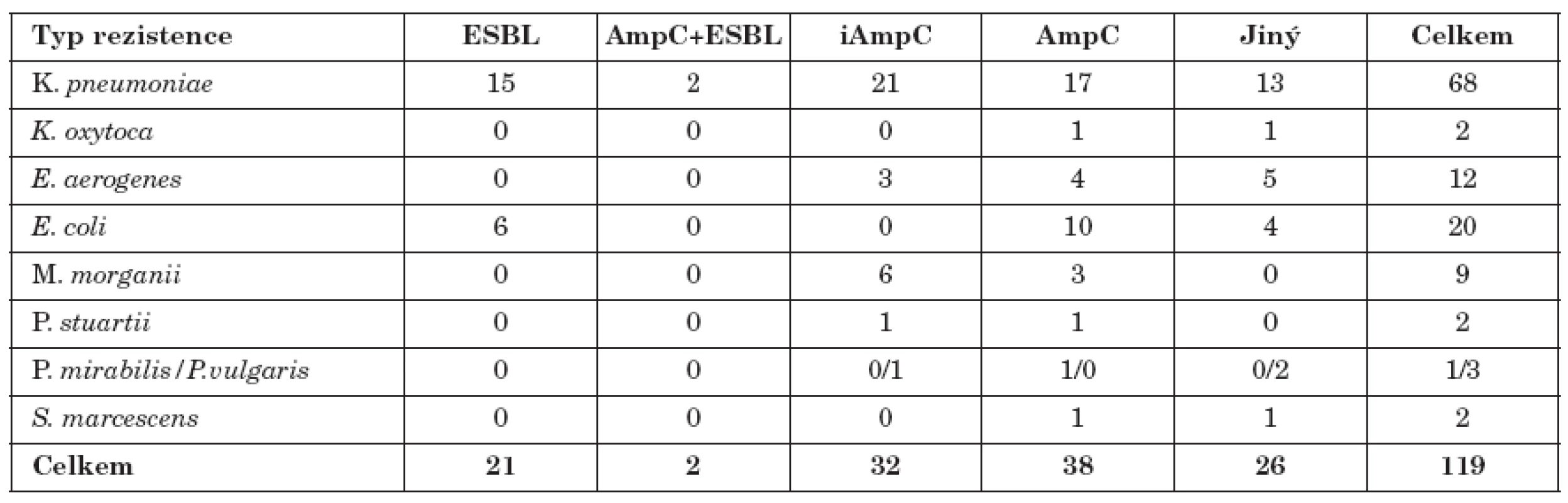
Pouze 2 kmeny (K. pneumoniae) produkovaly současně ESBL a AmpC.
Při opakovaném testování u žádného z testovaných kmenů nenastal zvrat do jiného typu rezistence, došlo pouze ke změnám ve velikosti průměrů inhibičních zón.
Citlivost 38 producentů konstitutivních AmpC byla poměrně dobrá k cefepimu (84,2 %), relativně příznivě vycházela i jiná antibiotika (graf 1). Nejméně byly tyto kmeny citlivé k piperacilinu s tazobaktamem (39,5 %). Citlivost ke karbapenemům zůstala zachována. Podobně citlivost ke kolistinu (pochopitelně s výjimkou přirozeně rezistentních kmenů jako jsou v našem případě M. morganii, P. stuartii, S. marcescens a P. mirabilis)i nadále zůstává dobrá.
1. Citlivost producentů AmpC k různým antibiotikům Fig. 1. Antibiotic susceptibility of AmpC producers Zkratky: tzp – piperacilin/tazobaktam, ak – amikacin, scf – cefoperazon/sulbaktam, fep - cefepim, imi – imipenem, mem- meropenem, ct – kolistin, R – rezistentní, C – citlivý Abbreviations: tzp – piperacillin/tazobactam, ak – amikacin, scf – cefoperazon/sulbactam, fep - cefepim, imi – imipenem, memmeropenem, ct – colistin, R – resistant, C – susceptible 
Diskuse
Námi použitá metoda DDST prováděná na MH-agaru a MH-agaru s inhibitorem AmpC (v našem případě oxacilinem) je relativně časově a finančně nenáročná, jednoduchá a snadno proveditelná, plně navazuje na algoritmus testování ESBL [11].
Zjistili jsme, že mezi kmeny K. pneumoniae, E. coli a E. aerogenes a M. morganii izolovaných z moče není produkce AmpC ß-laktamáz ojedinělou záležitostí. Na 126 „močových“ producentů ESBL získaných v průběhu 12 měsíců na naší laboratoři bylo detekováno 38 hyperproducentů AmpC, produkce AmpC je tedy asi třetinová ve srovnání s produkcí ESBL, není tedy ojedinělá [1, 5, 24]. Z tohoto důvodu doporučujeme rutinní testování kmenů klebsiell, enterobakterů a escherichií na produkci AmpC. Totéž bychom doporučili u kmenů M. morganii. Přestože v tomto případě počet námi získaných kmenů nebyl vysoký, neboť M. morganii byla méně častým původcem močových infekcí, bylo nalezeno překvapivě velké množství kmenů iAmpC i hyperproducentů AmpC.
Poměrně velké množství kmenů však nelze zařadit do žádného z typů námi testované rezistence. U některých kmenů (S. marcescens, K. oxytoca) lze spíše předpokládat přítomnost jiného typu rezistence jako např. hyperprodukci ß-laktamázy K 1 u K. oxytoca, je také vysoce pravděpodobné, že může jít o různé kombinované typy. U E. coli se nám touto metodou nepodařilo prokázat ani jediný kmen iAmpC, což však nemusí znamenat, že neexistují, protože konstitutivní produkce AmpC byla prokázána u 9 kmenů. Potvrzení produkce ESBL či detekce jiných typů rezistence by bylo možné zjistit např. pomocí moderních molekulárně-diagnostických metod [10, 12, 14]. V naší studii jsme nezachytili žádný kmen Citrobacter spp., i když je jako producent AmpC uváděn [11], nejspíše proto, že tyto kmeny nebyly tak častými původci močových infekcí a většina z nich se jevila jako dobře citlivá.
Přestože u žádného z opakovaně testovaných kmenů nenastal během naší práce zvrat do jiného typu rezistence a došlo poze k drobnému posunu ve velikostech zón, doporučujeme sledovat vývoj rezistence pravidelnými screeningy.
Problematická je otázka interpretace citlivosti. Z již dříve řečeného vyplývá, že podání ß-laktamových antibiotik je omezené na cefalosporiny 4. generace, pokud jsou citlivé, a pokud producent AmpC není zároveň producentem ESBL. U producentů inducibilních enzymů izolovaných z močových cest lze zvážit podání cefalosporinů 3. a 4. generace [10, 11, 24]. Naši hyperproducenti AmpC byli dobře citliví k cefepimu (84,2 %) i karbapenemům, tato antibiotika by tedy mohla představovat léky volby, v polovině případů dobře reagovali i na amikacin. S ohledem na již zmíněný efekt inokula v případě cefepimu, ale souhlasíme s názorem, že je nutné zvážit podání tohoto antibiotika přísně individuálně [10]. Přestože již v literatuře byla popsána rezistence ke karbapenemům [10, 20], u námi testovaných kmenů zatím rezistence zachycena nebyla. I když byly některé naše kmeny relativně dobře citlivé i k piperacilinu s tazobaktamem (39,5 % kmenů) či cefoperazonu se sulbaktamem, nelze preparáty s inhibitory ß-laktamáz doporučit [10]. Kolistin lze považovat za rezervní antibiotikum, ale pochopitelně jej nelze doporučit u kmenů s přirozenou rezistencí na toto antibiotikum. Bohužel faktem zůstává, že námi testovaná antibiotika jsou určena pouze pro intravenózní podání a u ambulantních pacientů, kteří náš soubor tvořili, mají jen omezené použití. V tomto případě přicházejí v úvahu i některé další preparáty, jako jsou chinolony, furantoin a doxycyklin, pokud je k nim vykazována citlivost. Jinak nezbývá než doufat, že se osvědčí nové preparáty jako je např. tigecyklin [10, 14] nebo produkty nepatogenních bakterií koliciny. Ty se začínají testovat u močových infekcí způsobených uropatogení E. coli jako prevence kolonizace močových katétrů a byly už s efektem vyzkoušeny i u některých zvířecích infekcí [22, 26].
Do redakce došlo 20. 6. 2008
MUDr. L. Černohorská
Mikrobiologický ústav LF MU a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: lenka.cernohorska@fnusa.cz
Sources
1. Alvarez, M., Tran, J. H., Chow, N. et al. Epidemiology of conjugative plasmid-mediated AmpC ß-lactamases in the United States. Antimicrob Agents Chemother, 2004, 48, 533-537.
2. Ambler, R. P. The structure of ß-lactamases. Phil Trans R Soc Lond Biol, 1980, B 289, 321-331.
3. Bradford, P. Extended-spectrum ß-lactamases in the 21st Century: Characterization, Epidemiology, and Detection of This Important Resistance Threat. Clin Microbiol Rev, 2001, 14, 933-951.
4. Bush, K., Jacoby, G. A., Medeiros, A. A. A functional classification scheme for ß-lactamases and its correlation with molecular structure. Antimicrob Agents Chemother, 1995, 39, 1211-1233.
5. Courdon, P. E., Moland, E. S., Thomson, K. S. Occurrence and detection of AmpC beta-lactamases among Escherichia coli, Klebsiella pneumoniae, and Proteus mirabilis Isolates at a Veterans Medical Center. J Clin Microbiol, 2000, 38, 1791-1796.
6. Dunne, W. M., Hardin, D. J. Use of several inducer and substrate antibiotic combinations in a disk approximation assay format to screen for AmpC induction in patient isolates of Pseudomonas aeruginosa, Enterobacter spp., Citrobacter spp., and Serratia spp. J Clin Microbiol, 2005, 43, 5945-5949.
7. Fortineau, N., Poirel, L., Nordmann, P. Plasmid-mediated and inducible cephalosporinase DHA-2 from Klebsiella pneumoniae. J Antimicrob Chemother, 2001, 47, 207-210.
8. Giamarellos-Bourboulis, E. J., Papadimitriou, E., Galanakis, N. et al. Multidrug resistance to antimicrobials as a predominant factor influencing patient survival. Int J Antimicrob Agents, 2006, 27, 476-481.
9. Hanson, N. D. AmpC ß-lactamases: what do we need to know for the future? J Antimicrob Chemother, 2003, 52, 2-4.
10. Hrabák, J. Klinicky významné ß-laktamázy gramnegativních bakterií: AmpC. Epidemiol Mikrobiol Imununol, 2007, 56, 155-165.
11. Hrabák, J., Vaniš, V., Bergerová, T. et al. Průkaz ß-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií. Zprávy CEM (SZÚ Praha), 2007, 16, 31-36.
12. Chromá, M., Kolář, M., Sauer, P. et al. Molekulárno-biologická analýza ESBL-pozitívnych izolátov Klebsiella pneumoniae od pacientov v intenzívnej starostlivosti. Klinická mikrobiologie a infekční lékařství, 2007, 13, 206-211.
13. Jacoby, G. A, Walsh, K. E., Walker, V. Identification of extended-spectrum, AmpC, and carbapenem-hydrolyzing ß-lactamases in Escherichia coli and Klebsiella pneumoniae by disk tests. J Clin Microbiol, 2006, 44, 1971-1976.
14. Kolář, M. Klinický význam širokospektrých ß-laktamáz a zkušenosti s jejich identifikací v mikrobiologické praxi. Klinická mikrobiologie a infekční lékařství, 2007, 13, 195-205.
15. Kolář, M. Vývoj bakteriální rezistence a nová antimikrobní léčiva. Interní med, 2007, 5, 213-216.
16. Kolář, M., Látal, T., Čermák, P. et al. Prevalence of extended-spectrum ß-lactamase-positive Klebsiella pneumoniae isolates in the Czech Republic. Int J Antimicrob Agents, 2006, 28, 49-53.
17. Kolář, M., Urbánek, K., Látal, M. Antibiotic selective pressure and development of bacterial resistance. Int J Antimicrob Agents, 2001, 17, 357-363.
18. Kolář, M., Urbánek, K., Lochmannová, J. Výchozí zdroje racionální antibiotické léčby bakteriálních infekcí. Prakt Lékáren, 2006, 1, 20-23.
19. Laxminarayan, R. Antibiotic resistance: The unfolding crisis. In: Laxminarayan, R., Malani, A., Howard, D. et al. Extending the cure - Policy responses to the growing threat of antibiotic resistance. Washington D.C., Resources for the Future, 2007, 25-34. ISBN 978-1-933115-57-3.
20. Padilla, E., Alonso, D., Doménech-Sánchez, A. et al. Effect of porins and plasmid-mediated AmpC ß-lactamases on the efficacy of ß-lactams in rat pneumonia caused by Klebsiella pneumoniae. Antimicrob Agents Chemother, 2006, 50, 2258-2260.
21. Philippon, A., Arlet, G., Jacoby, G. A. Plasmid-determined AmpC-type ß-lactamases. Antimicrob Agents Chemother, 2002, 46, 1-11.
22. Rijavec, M., Budič, M., Mrak, P. et al. Prevalence of COLE1-like plasmids and Colicin K production among uropathogenic Escherichia coli strains and quantification of inhibitory activity of Colicin K. Appl Environ Microbiol, 2007, 73, 1029-1032.
23. Song, W., Moland, E. S., Hanson, N. D. et al. Failure of cefepime therapy in treatment of Klebsiella pneumoniae Bacteremia. J Clin Microbiol, 43, 2005, 43, 4891-4894.
24. Taneja, N., Rao, P., Arora, J. et al. Occurrence of ESBL & Amp-C ß-lactamases & susceptibility to newer antimicrobial agents in complicated UTI. Indian J Med Res, 2008, 127, 85-88.
25. Thomson, K. S. Controversies about Extended-Spectrum and AmpC beta-lactamases. Emerg Inf Dis, 2001, 7, 333-336.
26. Trautner, B. W., Hull, R. A., Darouiche, R.O. Colicins prevent colonization of urinary catheters. J Antimicrob Chemoter, 2005, 56, 413-415.
27. Urbánek, K., Kolář, M., Lovečková, Y. et al. Influence of third-generation cephalosporin utilization on the occurrence of ESBL-positive Klebsiella pneumoniae strains. J Clin Pharm Therapeut, 2007, 32, 403-408.
28. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody, Trios, 1998.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2008 Issue 4-
All articles in this issue
- Ilya Ilich Metchnikov and Paul Ehrlich: 1908 Nobel Prize Winners for their Research on Immunity.
- Carbapenem Resistance in Enterobacteria
- Characterization and Prevalence of Clones of Listeria monocytogenes Isolated from Patients in 2001-2008 in the Czech Republic
- Detection of AmpC beta-Lactamases in Gram-negative Bacteria Isolated from Urine
- ecal Calprotectin Levels in Patients with Idiopathic Inflammatory Bowel Disease – Comparison of Two Commercial Tests
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Carbapenem Resistance in Enterobacteria
- ecal Calprotectin Levels in Patients with Idiopathic Inflammatory Bowel Disease – Comparison of Two Commercial Tests
- Detection of AmpC beta-Lactamases in Gram-negative Bacteria Isolated from Urine
- Ilya Ilich Metchnikov and Paul Ehrlich: 1908 Nobel Prize Winners for their Research on Immunity.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

