-
Medical journals
- Career
Kazuistika: Postižení ledvin u pacientky s Crohnovou chorobou
Authors: Olga Snížková 1; Eva Jančová 2; Eva Honsová 1
Authors‘ workplace: AeskuLab Patologie k. s. Praha 1; Klinika nefrologie VFN, Praha 2
Published in: Čes.-slov. Patol., 57, 2021, No. 2, p. 109-112
Category: Original Articles
Overview
Idiopatické střevní záněty (IBD) představují skupinu chronických relabujících střevních zánětlivých procesů zastoupených především ulcerózní kolitidou (UC) a Crohnovou chorobou (CD). Až polovina případů IBD je provázena extraintestinálními komplikacemi. Postižení ledvin, které se může objevit samostatně nebo spolu s dalšími komplikacemi, bylo popsáno u pacientů s UC i s CD. Mezi nejčastější renální postižení patří nefrolithiáza, tubulointersticiální nefritida, různé druhy glomerulonefritid a AA amyloidóza. Prezentujeme případ neobvyklé formy renálního postižení u mladé pacientky s těžkou kolickou formou Crohnovy choroby na terapii rekombinantními monoklonálními protilátkami.
Klíčová slova:
Idiopatické záněty střev – Crohnova choroba – glomerulonefritida – biopsie ledvin
Idiopatické záněty střev (IBD) jsou chronická relabující zánětlivá onemocnění zahrnující především ulcerózní kolitidu (UC) a Crohnovu chorobu (CD). Až polovina nemocných s IBD vyvine extraintestinální komplikace, které mohou postihovat prakticky jakýkoli orgán (1,2). Mezi nejčastěji postižené lokality patří klouby, kůže a hepatobiliární systém. Důvod, proč někteří pacienti tyto komplikace vyvinou, zůstává neznámý. Existují různé teorie, které předpokládají alterovanou imunitní odpověď při systémovém zánětu ovlivněnou genetickými faktory.
Postižení ledvin je uváděno u téměř čtvrtiny pacientů. Mezi nejčastější onemocnění patří nefrolitiáza při enterálně podmíněné hyperoxalurii. Vytvořené kaménky v močových cestách jsou současně predispozicí pro pyelonefritidu. Mezi další renální onemocnění doprovázející IBD lze řadit toxické postižení intersticia (tubulointersticiální nefritida při léčbě 5-aminosalicylovou kyselinou nebo při opakované léčbě hnisavých komplikací antibiotiky), IgA glomerulonefritidu (IgA GN) a také amyloidózu doprovázející chronická zánětlivá onemocnění (AA amyloidóza) (3,4).
Prezentujeme případ méně běžné renální komplikace u mladé pacientky s Crohnovou chorobou.
POPIS PŘÍPADU
Mladé 30leté ženě byla ve 23 letech diagnostikovaná Crohnova choroba. Onemocnění mělo komplikovaný průběh a bylo klasifikováno jako těžká kolická forma; pacientka byla indikovaná k léčbě rekombinantními monoklonálními protilátkami proti tumor nekrotizujícímu faktoru alfa (TNF-α) v obvyklém dávkování. V následujících 7 letech prodělala několik epizod uroinfekcí, které byly úspěšně zvládnuté antibiotiky. Během posledních 2 měsíců podstoupila operaci periproktálního abscesu s drenáží a antibiotickou léčbou. Pro náhle vzniklý otok celého těla s váhovým přírůstkem 10 kg za týden byla hospitalizovaná na interní klinice. Po nasazení diuretik a kortikosteroidů došlo k ústupu edému, renální funkce byly normální. Během hospitalizace pacientka udávala oligurii a tmavou moč. Laboratorně byla zjištěna nefrotická proteinurie (4,8g/den), která byla indikací k provedení biopsie ledviny. Klinická diagnóza favorizovala tubulointersticiální nefritidu při léčbě antibiotiky nebo se zánětem asociovanou AA amyloidózu.
Mikroskopické vyšetření a stanovení diagnózy
Punkce ledviny byla 11 mm dlouhá a byla rozdělena do segmentů pro zpracování všemi 3 technikami (imunofluorescence, světelná a elektronová mikroskopie). Ve vzorku pro imunofluoresci byly zastiženy 3 glomeruly. Detekce IgG odhalila difúzně globálně podél kapilárních kliček granulární depozita s nepravidelnou distribucí a s nepravidelnou velikostí, menší množství depozit bylo i v mezangiu (obr. 1). Stejný vzor a lehce vyšší intenzita imunofluorescence byla v průkazu C3 frakce komplementu. Lehké řetězce kappa a lambda kopírovaly rozložení depozit, intenzita byla nižší. Ostatní průkazy (IgA, IgM, C1q a AA amyloid) byly negativní.
Image 1. Imunofluorescenční detekce IgG s variabilní velikostí i distribucí granulárních depozit podél GBM. 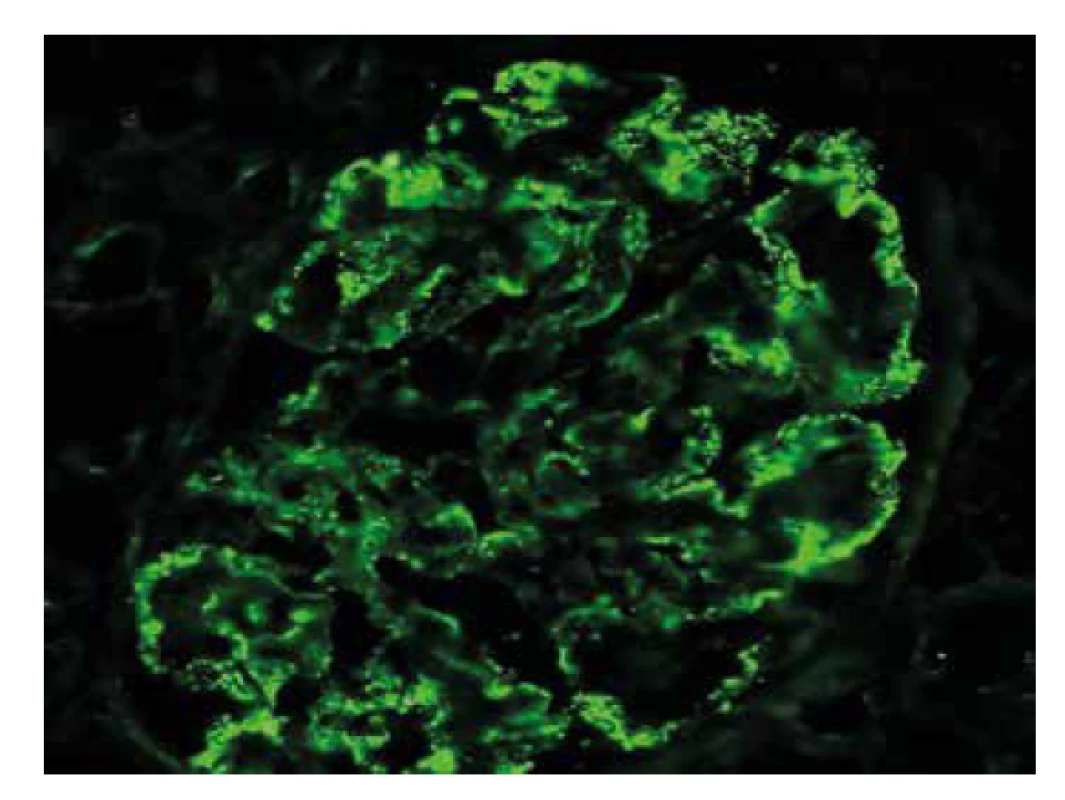
Ve vzorku pro světelnou mikroskopii bylo zastiženo 11-14 glomerulů, z toho byl 1 zaniklý. Glomeruly byly zvětšené se zvýšenou mezangiální a endokapilární buněčností, ve které dominovaly polynukleáry a zánět vyvolával lobulární členění trsů (obr. 2, 3). Glomeruly byly bez srpků a bez sklerotizací, glomerulární bazální membrány (GBM) byly bez dvojkontur. Intersticium bez fibrózy, fokálně pouze s edémem, bez zánětu. Cévy měly přiměřenou morfologii.
Image 2. Zvětšené glomeruly s četnými polynukleáry v luminech kapilárních kliček. Intersticium je bez zánětu (barvení PAS). 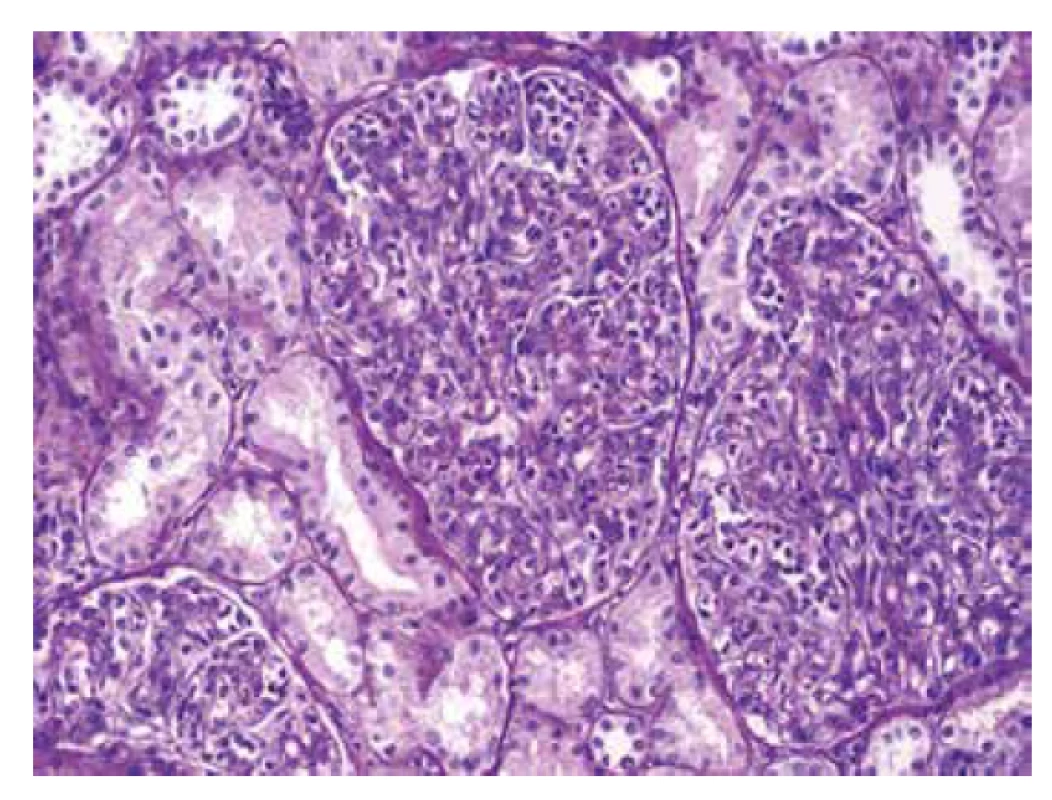
Image 3. Detail glomerulu s polynukleáry v kapilárách, které způsobují lobulární členění trsu (barvení PAS). 
Morfologie je typická pro klasickou postinfekční glomerulonefritidu (GN).
Imunofluorescence a světelná mikroskopie byly doplněny ultrastrukturálním vyšetřením, které bylo v souladu s diagnózou postinfekční GN (obr. 4).
Image 4. Ultrastruktura s úseky kapilárních kliček s několika depozity subepiteliálně (šipky). V okolí je fúze pedicel podocytů. 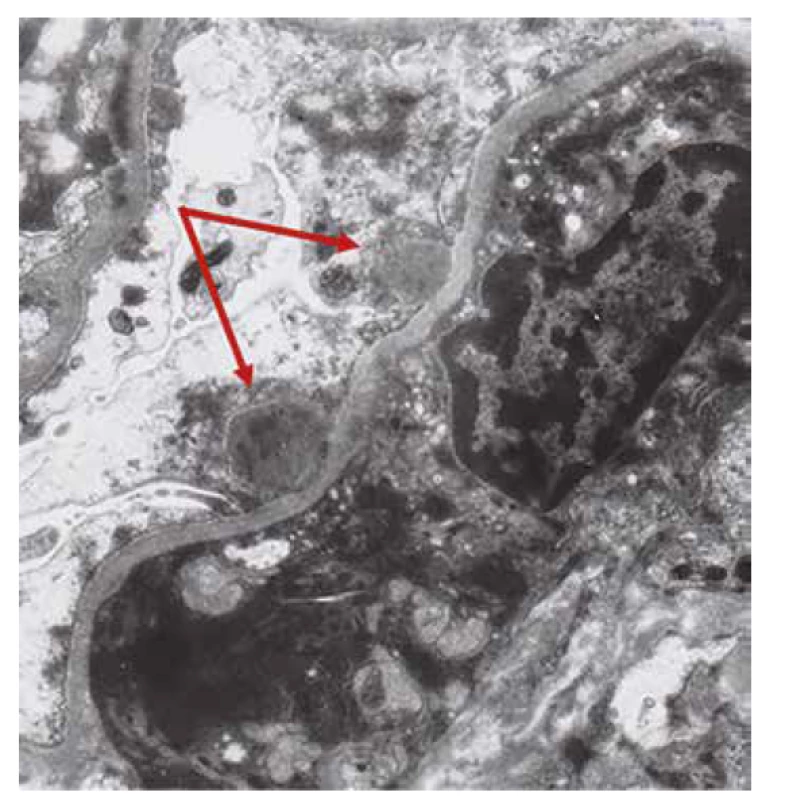
DISKUZE
Extraintestinální komplikace jsou udávány až u poloviny pacientů s IBD. Přítomnost jedné komplikace zvyšuje pravděpodobnost rozvoje některé další (5). Perianální projevy Crohnovy choroby, postižení tlustého střeva a kouření představují zvýšené riziko rozvoje extraintestinálních komplikací (2,3). Komplikace postihující ledviny se mohou objevit samostatně nebo spolu s dalšími komplikacemi a mohou přímo souviset s IBD; event. s léčbou IBD nebo mohou být s IBD asociovány dosud neznámým mechanismem. Nejčastějším onemocněním ledvin u pacientů s IBD je nefrolitiáza, event. urolitiáza močového traktu. Mezi další projevy choroby patří postižení intersticia ledvin obvykle v souvislosti s léčbou IBD. Onemocnění glomerulů doprovázející IBD jsou empiricky známá, ale nebyla dosud systematicky studovaná. Některá z nich jako např. IgA GN, která představuje autoimunní onemocnění s protilátkami proti částem molekuly IgA, lze u dalšího zánětlivého onemocnění s dysregulací imunity předpokládat (2,3,6-8). U jiných glomerulonefritid jako je např. u nefrotický syndrom s minimálními změnami (MCNS) se vedou diskuze, jestli jde o náhodný simultánní výskyt, komplikaci léčby nebo zda existuje nějaký důvod pro asociaci. I když se ledvinné komplikace objevují u ulcerózní kolitidy i Crohnovy choroby, část z nich, především nefrolitiáza, IgA GN a AA amyloidóza doprovází častěji Crohnovu chorobu (6,7,9).
Nefrolitiáza patří mezi nejběžnější renální komplikace u pacientů s IBD. Průjmy, malabsorpce a minerálová dysbalance ve střevě i v krvi představují rizikové faktory vzniku ledvinných kamenů. Zvláště u pacientů s Crohnovou chorobou po resekcích tenkého střeva dochází k enterálně podmíněné hyperoxalurii a s tím souvisí vznik kamenů, které jsou převážně kalcium-oxalátové nebo urátové. Kameny v močových cestách včetně ledvin se stávají rizikem pro vznik infekce močových cest a pyelonefritidy. Na rozvoji tzv. enterálně podmíněné hyperoxalurie se podílí několik mechanismů. Jedním z nich je nedostatečná absorpce žlučových kyselin v distálním ileu, což způsobuje malabsorpci tuku. Nevstřebaný tuk váže kalcium ze střevního obsahu; a to vede ke snížení množství vápníku vázaného na oxalát a ke zvýšené absorpci oxalátů ze střeva. Druhým mechanismem je zvýšená propustnost střevního epitelu a také porucha kolonizace střeva Oxalobacterem formigenes, což vede ke snížení koncentrace močových oxalátů. Nízká koncentrace magnesia a citrátu v moči, která má nízké pH (ztráty alkalických komponent stolicí) představují další riziko vzniku kamenů (3,4).
Akutní tubulární poškození (ATN) je nepochybnou součástí atak IBD a obvykle je subklinické. Citlivější jsou pacienti s vaskulární patologií, která sama o sobě zhoršuje prokrvení ledvin. Tubulární proteinurie a enzymurie se většinou zlepší a upraví po terapii ataky IBD (8).
Postinfekční GN představuje méně obvyklou komplikaci IBD i když její mírnější formy mohou zůstat skryté, protože v průběhu zánětlivé ataky v GIT je velmi obtížné identifikovat další onemocnění ledvin, které je nebolestivé a dlouho nemá klinické příznaky, které by pacient zaznamenal. Postinfekční glomerulonefritida (PIGN) je imunitně zprostředkované onemocnění způsobené nejčastěji bakteriální infekcí, která sama o sobě ledviny nepostihuje. Z celosvětového pohledu představuje klasická forma poststreptokokové PIGN nejčastější GN, která se vyskytuje především v dětské populaci méně rozvinutých zemí. V zemích Evropy a severní Ameriky se epidemiologie PIGN změnila a incidence klasické formy dramaticky poklesla. Modifikovaná forma onemocnění (tzv. IgA dominantní postinfekční GN) se stala onemocněním starších dospělých s komorbiditami (10). Klinická prezentace PIGN je velmi variabilní, od asymptomatických případů, přes mikroskopickou hematurii k plně vyvinutému nefritickému syndromu, proteinurii, která může být nefrotická, hypertenzi a někdy i akutnímu selhání ledvin. V našem případě šlo o méně běžnou manifestaci s nefrotickou proteinurií. Tmavá moč udávaná pacientkou svědčila pro hematurii, která nebyla v době biopsie součástí klinické zprávy. V případě pacientů s IBD patří obě varianty PIGN mezi neobvyklé extraintestinální komplikace i přesto, že abscesy a píštěle nejsou ani při současné léčbě výjimečnou komplikací. Studie posuzující postižení ledvin včetně GN jako komplikace IBD zahrnují PIGN do kategorie ostatní GN a i kazuistická sdělení s touto komplikací jsou vzácná (11).
IgA GN patří v Evropě a v Asii obecně k nejčastějším bioptickým diagnózám. Molekuly IgA reprezentují důležitou komponentu naší obrany proti infekcím a dalším antigenním stimulům sliznic, především v oblasti GIT. Proto můžeme IgA GN doprovázející IBD považovat za součást komplexní reakce při chronickém zánětu střevní sliznice a dysregulace produkce IgA, která je následovaná ztrátou tolerance a spuštěním tvorby protilátek proti antigenům molekuly IgA. Genetické studie z posledních let objevily určité HLA-DQ/DR antigeny, které bývají častější u obou onemocnění (9). Je opakovaně doloženo, že IgA GN se vyskytovala významně častěji u pacientů s IBD než v populaci bez idiopatického střevního zánětu. Většina pacientů s IgA GN měla ledvinné onemocnění diagnostikované v průběhu IBD, často s exacerbací střevního zánětu (6,7,9,12,13). Morfologie IgA GN se u primárního onemocnění a u IgA GN doprovázející IBD neliší. V klinice se onemocnění z počátku projeví hematurií, později s progresí postižení glomerulů se přidá proteinurie s poklesem renální funkce.
Postižení ledvin v souvislosti s léčbou IBD je známou komplikací a morfologické spektrum se spíše rozšiřuje. Cílem léčby IBD je dosažení zhojení sliznic GIT a navození dlouhodobé remise. V léčbě se po mnoho let používala 5-aminosalicylová kyselina (5-ASA) a její deriváty, o kterých se předpokládá, že u citlivých jedinců způsobují intersticiální nefritidu. Obvykle jde o chronické skrytě probíhající onemocnění s pozvolným rozvojem intersticiální fibrózy. Není prokázáno, že onemocnění způsobuje léčba a že není součástí imunitní dysregulace při IBD (8). Tubulointersticiální nefritidy jsou opakovaně dokumentované jako součást negativních vedlejších účinků léčby antibiotiky, kterými se kontrolují jednak záněty, které jsou součástí IBD (zvl. m. Crohn) nebo infekce, které jsou komplikací imunosupresivní léčby. Současná tzv. biologická léčba využívající monoklonální protilátky může být spojena s řadou vedlejších nežádoucích účinků. Mezi nejběžnějšími léky v této skupině jsou inhibitory TNF-α. TNF - α patří mezi prozánětlivé cytokiny a hraje důležitou roli také u pacientů s IBD, proto jeho inhibice monoklonálními protilátkami představuje účinnou léčebnou metodu, která bohužel není bez rizika. Mezi nežádoucí účinky léčby anti-TNF protilátkami patří bakteriální, virové a mykotické infekce. Současně může dojít k rozvoji autoimunitních reakcí včetně tvorby autoprotilátek (např. lupénka, revmatoidní artritida nebo lupus-like syndrom). U pacientů s IBD a současně s primární sklerotizující cholangoitidou (PSC) je doporučováno anti-TNF preparáty nepoužívat, vzhledem k opakovaně popsanému zhoršení průběhu PSC. V těchto situacích lze použít protilátky působící selektivně ve střevě bez systémové imunosupresivní aktivity (rizikem jsou především infekce, pro které je střevo ochrannou bariérou).
AA amyloidóza představuje závažnou komplikaci doprovázející chronická zánětlivá onemocnění, která mohou být infekční, autoimunní nebo může být na pozadí genetická porucha způsobující prozánětlivé prostředí (3,4). Ve skupině pacientů s IBD je AA amyloidóza častější u CD s hnisavými komplikacemi a s fistulami, obvykle u déle trvajícího onemocnění. V klinice se projeví nejčastěji proteinurií až nefrotickým syndromem. Proto byla také v našem případě AA amyloidóza z klinického pohledu na čelném místě v diferenciální diagnostice. Pacientka měla nefrotickou proteinurii, těžkou formu onemocnění a v nedávné době hnisavé komplikace, které i přes léčbu antibiotiky vyžadovaly chirurgickou drenáž. Přestože AA amyloidóza představuje závažnou komplikaci IBD, v současnosti neexistují žádná doporučení pro léčbu, kde by data byla získaná na základě prospektivních studií.
V poslední době byly publikované studie dokládající zvýšené riziko terminálního renálního selhání u pacientů s IBD, především u CD (14). Předpokládá se, že zánět u CD vyvolává významnou systémovou zánětlivou odpověď; a proto ho doprovází více renálních komplikací, které představují nezanedbatelné riziko chronického selhání ledvin.
Závěrem lze shrnout, že až polovina pacientů s IBD vyvine extraintestinální komplikace, které se mohou objevit izolovaně nebo se mohou projevit postižením několika různých orgánů. V případě ledvin jde o onemocnění v souvislosti s chronickým zánětem nebo s terapií ovlivňující průběh IBD a i zde může jít o samostatné projevy nebo je postižení ledvin součástí dalších komplikací. Diagnostika renálního postižení je u pacientů s IBD obtížná, protože symptomy jsou skryté pod příznaky dlouhodobého relabujícího zánětu v oblasti GIT. Časná diagnóza renálních komplikací představuje klíč k odpovídající terapii, která zabrání chronickému onemocnění se ztrátou funkce ledvin.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Olga Snížková
AeskuLab Patologie k. s. Praha
Evropská 2589/33b, 160 00 Praha 6
Email: snizkova.olga@aeskulab.cz
Sources
- Vavricka SR, Schoepfer A, Scharl M, et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21(8): 1982–1992.
- Ardizzone S, Puttini PS, Cassinotti A, et al. Extraintestinal manifestations of inflammatory bowel disease. Dig Liver Dis 2008; 40 (suppl 2): S253–S259.
- Corica D et Romano C. Renal Involvement in Inflammatory Bowel Diseases. Journal of Crohn‘s and Colitis 2016; 226–235.
- Braysh K, Gerges Geagea A, Matar C, et al. Kidney Manifestations of Inflammatory Bowel Diseases. Open Journal of Gastroenterology 2018; 8 : 172-191.
- Vavricka SR, Brun L, Ballabeni P, et al. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol 2011; 106 : 110–119.
- Filiopoulos V, Trompouki S, Hadjiyannakos D, et al. IgA nephropathy in association with Crohn’s disease: A case report and brief review of the literature. Ren Fail 2010; 32 : 523–527.
- Takemura T, Okada M, Yagi K, et al. An adolescent with IgA nephropathy and Crohn disease: Pathogenetic implications. Pediatr Nephrol 2002; 17 : 863–866.
- Fraser JS, Muller AF, Smith DJ, et al. Renal tubular injury is present in acute inflammatory bowel disease prior to introduce of drug therapy. Aliment Pharmacol Ther 2001; 15 : 1131-1137.
- Pipili C, Michopoulos S, Sotiropoulou M, et al. Is there any association between IgA nephropathy, Crohn’s disease and Helicobacter pylori infection? Ren Fail 2012; 34 : 506–509.
- Honsová E. Postinfekční glomerulonefritida u dospělých: skrytá tvář dlouho známého onemocnění. Cesk Patol 2016; 52(1): 61-64.
- Wilcox GM, Aretz HT, Roy MA, et al. Glomerulonephritis Associated With Inflammatory Bowel Disease. Gastroenterology 1990; 98 : 788-791.
- Kiryluk K, Li Y, Scolari F, et al. Discovery of New Risk Loci for IgA Nephropathy Implicates Genes Involved in Immunity against Intestinal Pathogens. Nature Genetics 2014; 46 : 1187-1196.
- Choi JY, Yu CH, Jung HY, et al. A case of rapidly progressive IgA nephropathy in a patient with exacerbation of Crohn’s disease. BMC Nephrol 2012; 13 : 84.
- Park S, Chun J, Han KD et al. Increased end-stage renal disease risk in patients with inflammatory bowel disease: A national population-based study. World J Gastroenterol 2018; 24 : 4798-4808.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2021 Issue 2-
All articles in this issue
- Novinky v gynekopatologii
- Patologové by měli mít větší prostor pro popularizaci svého oboru
- ′ NEUROPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ UROPATOLOGIE
- ′ KARDIOPATOLOGIE
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ ENDOKRINOPATOLOGIE
- ′ CYTODIAGNOSTIKA
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- Význam imunohistochemických metod v diagnostice karcinomu endometria
- Význam imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy
- Gynekologické léze u hereditárních nádorových syndromů
- Kazuistika: Gaucherova choroba v biopsii kostní dřeně 16 leté dívky vyšetřované pro podezření na myelodysplastický syndrom
- Kazuistika: Postižení ledvin u pacientky s Crohnovou chorobou
- Vilém Dušan Lambl na Charkovské císařské Univerzitě (1861-1871): biografie.
- Prof. MUDr. Rostislav Koďousek, Dr.Sc. in memoriam
- Spomienka na emeritného primára MUDr. Jozefa Maťošku, CSc.
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam imunohistochemických metod v diagnostice karcinomu endometria
- Gynekologické léze u hereditárních nádorových syndromů
- Kazuistika: Postižení ledvin u pacientky s Crohnovou chorobou
- Význam imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

