-
Medical journals
- Career
Význam imunohistochemických metod v diagnostice karcinomu endometria
Authors: Pavel Dundr 1; Kristýna Němejcová 1; Michaela Bártů 1; Rosalie Jana Bennett 1; Helena Skálová 1; Pavol Janega 2,3; Ivana Stružinská 1
Authors‘ workplace: Ústav patologie 1. LF UK a VFN v Praze 1; Ústav patologickej anatómie, Lekárska fakulta, Univerzita Komenského v Bratislave 2; Medirex Group Academy, Trnava, n. o. 3
Published in: Čes.-slov. Patol., 57, 2021, No. 2, p. 73-85
Category: Reviews Article
Overview
Cílem následujícího sdělení je podat přehled problematiky využití imunohistochemických metod u karcinomu endometria. Diskutováno je zejména využití imunohistochemie v diferenciální diagnostice základních histologických typů karcinomu endometria; rozlišení mezi primárním serózním karcinomem endometria a postižením při high grade serózním karcinomu jiného primárního zdroje; v diagnostice nediferencovaného / dediferencovaného karcinomu endometria a v diagnostice nádorů s neuroendokrinní diferenciací. Samostatně je zdůrazněna problematika hodnocení exprese p53 v kontextu diferenciální diagnostiky, ale i prognózy a predikce karcinomu endometria jako pomocného markeru při subtypizaci těchto nádorů.
Klíčová slova:
karcinom endometria – endometroidní karcinom – serózní karcinom – světlobuněčný karcinom – nediferencovaný / dediferencovaný karcinom – imunohistochemie
Karcinom endometria představuje heterogenní skupinu onemocnění zahrnující 4 základní histologické typy (endometroidní (EC), mucinózní (MC), serózní (SC) a světlobuněčný (CCC)) a v případě EC jeho subtypy (EC se skvamózní diferenciací, viloglandulární, sekreční, ciliární a „corded and hyalinized“ karcinom). Nejčastější je endometroidní karcinom (asi 80-90 % nádorů), zbylé nádory představují asi 10-20 % případů (1). Tradičně jsou karcinomy endometria na základě odlišné etiopatogeneze ale i prognózy děleny do dvou skupin – typ I. (estrogen dependentní; zahrnuje EC, MC; jedná se o nádory s dobrou prognózou) a typ II. (estrogen non-dependentní; zahrnuje SC a CCC; jedná se o nádory se špatnou prognózou). Do určité míry diskutabilní je zařazení EC grade 3 mezi nádory typu I. – část těchto nádorů je více agresivních a z tohoto i dalších ohledů spíše spadají do nádorů kategorie typu II (2,3). Další dělení karcinomů endometria více reflektující klinický význam je na low grade a high grade nádory, přičemž low grade nádory zahrnují EC grade 1 a 2, MC a high grade nádory zahrnují EC grade 3, SC a CCC (někdy je do této skupiny řazen i karcinosarkom). V současné době se však v souvislosti s molekulární klasifikací karcinomu endometria prokázalo, že histologický typ a grade nádoru vždy s jistotou nepredikuje jeho chování, jelikož karcinomy endometria představují heterogenní skupinu nádorů se 4 definovanými molekulárními subtypy a např. i EC grade 3 může mít v případě prokázané POLE mutace velmi dobrou prognózu (4,5). Naopak karcinomy s mutací TP53 či dalšími definovanými rysy jsou nádory agresivní (6). Molekulární rysy jsou tedy v tomto kontextu velmi důležité, nicméně nadále platí, že správná diagnostika s přesným stanovením histologického typu a grade nádoru je podstatná. Navíc i některé algoritmy stratifikující karcinom endometria na podkladě molekulárních charakteristik využívají kombinaci molekulárních markerů (mutace POLE, CTNN1B a TP53), morfologických rysů (přítomnost a rozsah lymfangioinvaze (LVSI)) a imunohistochemického profilu (exprese MMR proteinů, p53, L1CAM) (7,8). Toto je však nad rámec stávajícího sdělení zaměřeného na problematiku imunohistochemických (IHC) vyšetření. Dalšími, méně častými, avšak důležitými jednotkami, v jejichž diagnostice hraje IHC významnou roli, jsou nediferencovaný / dediferencovaný karcinom a nádory s neuroendokrinní diferenciací. V diferenciální diagnostice je také vždy nutno zohlednit i možnost adenokarcinomu smíšeného typu, byť i smíšené karcinomy endometria jsou poměrně vzácné. Do určité míry samostatnou problematiku představuje rozlišení mezi primárním serózním karcinomem endometria a postižením endometria při high grade serózním karcinomu jiného primárního zdroje (9-11). Obecně platí, že značnou část případů karcinomu endometria lze diagnostikovat na podkladě barvení hematoxylin-eozinem (HE), u části případů je však diagnostika složitá a vyžaduje využití speciálních (zejména IHC a v některých případech i molekulárních) metod. Výsledky těchto metod však vždy musí být hodnoceny v kontextu morfologického nálezu. Způsob hodnocení jednotlivých protilátek a výsledky hodnocení jsou uvedeny v tabulce 1. Tato tabulka představuje souhrnná data z více studií zabývajících se problematikou týkající se IHC vyšetření u karcinomu endometria (9-102). V obecné úrovni je nutné konstatovat, že výsledky jednotlivých studií analyzujících shodné markery jsou někdy překvapivě rozdílné a rozpětí výsledků je až zarážející – částečně to může souviset s chybnou vstupní diagnózou, zejména u málo diferencovaných karcinomů je častá záměna mezi EC a SC a obráceně (12). Problémem je tedy obecně v některých případech referenční soubor, na kterém jsou příslušné výsledky demonstrovány, a který ne vždy prošel v rámci jednotlivých studií oponenturou („vnitřním druhým čtením“) s cílem potvrzení diagnózy a selekce konsenzuálně diagnostikovaných případů. Dalším aspektem, který může výsledky zkreslit, je použitá metodika, typ protilátky a také způsoby skórování. Studie, které měly neobvyklý způsob hodnocení (např. pozitivita exprese hormonálních receptorů a proteinu p53 s cut-off daným H-skóre 150 není s ostatními studiemi srovnatelná), jsme z přehledu vyřadili, v některých případech to souvisí i s historickým vývojem, kdy např. hodnocení p53 se poměrně značně vyvíjelo (2). Problémem je nicméně i metodický aspekt s možností falešně pozitivních i negativních výsledků, některé studie se opravdu zásadně lišily a jejich výsledky jsou přinejmenším překvapivé.
Table 1. Procentuální výskyt výsledků IHC vyšetření v jednotlivých typech karcinomů endometria. 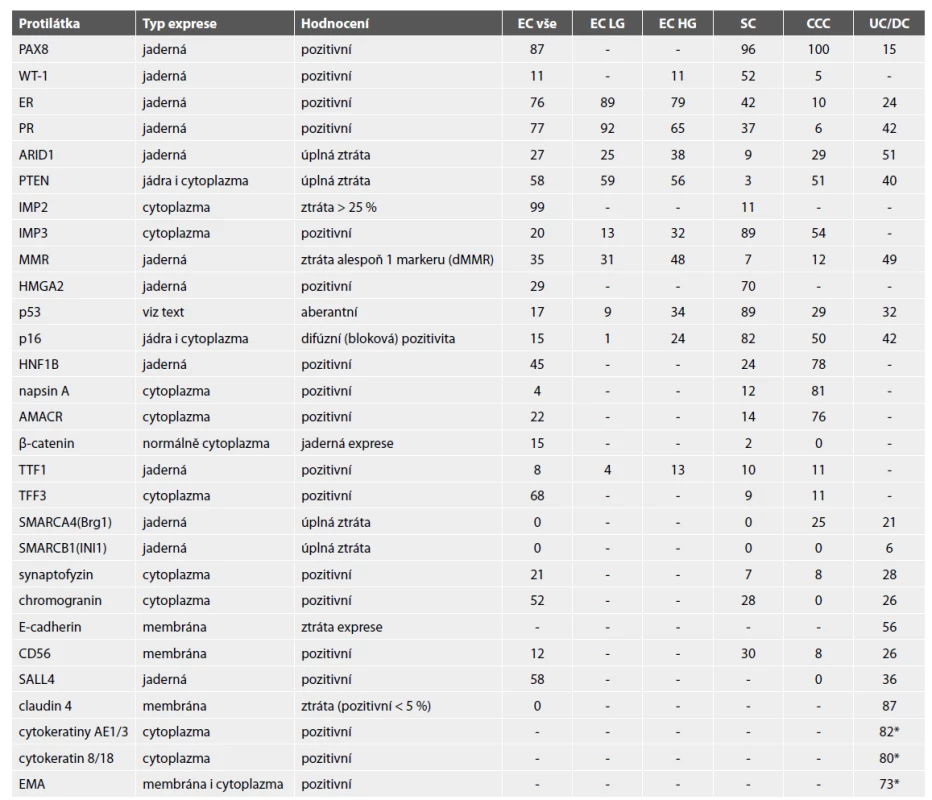
* vždy pouze fokální exprese
EC – endometroidní karcinom; SC – serózní karcinom endometria; CCC – světlobuněčný karcinom; UC/DC – nediferencovaný / dediferencovaný karcinomVyužití imunohistochemických metod v diagnostice základních histologických typů karcinomu endometria
S ohledem na stanovení histologického typu v rámci základních typů karcinomů se v reálné praxi nejčastěji setkáváme s problematikou diferenciální diagnostiky high grade karcinomů endometria, zejména s rozlišením mezi EC G3 (v některých případech však i LG EC, tedy G1 a G2) a SC. Další poměrně častou situací je rozlišení mezi světlobuněčným karcinomem a jiným typem nádoru se světlobuněčnou přeměnou, zejména EC, ale i SC. Tato diferenciální diagnostika je komplikována faktem, že interpersonální shoda v diagnostice CCC endometria je poměrně nízká a přesné diagnostické znaky tohoto typu nádoru jsou do určité míry diskutabilní, byť i v jednoznačných případech diagnóza CCC obvykle nečiní obtíže (103, 104). IHC metody mají také význam při diagnostice smíšeného karcinomu endometria. Obecně je nicméně nutné si uvědomit, že imunohistochemický profil jednotlivých typů nádorů vykazuje variabilitu a zejména EC může mít u minority případů aberantní imunofenotyp. Vyskytovat se mohou například případy s absencí exprese hormonálních receptorů, pozitivitou CDX2, GATA3, TTF1 a negativitou PAX8 atd., což může komplikovat diagnostiku zejména v případě metastáz neznámého zdroje či metachronních metastáz u pacientek s anamnézou EC (105). Nutné je však u těchto případů vždy zvážit možnost jiné diagnózy, zejména mezonefrického („mesonephric-like“) karcinomu, který může být s EC zaměněn (106). Tento nádor je charakterizován pozitivitou PAX8, variabilně GATA3 a TTF1, a ve většině případů negativitou ER a PR (obr. 1) (107). U minority případů se také může vyskytovat exprese HNF1B. Přesnější charakterizace těchto neobvyklých případů je však nad rámec stávajícího sdělení.
Image 1. Mezonefrický karcinom. Heterogenní architektonika nádoru s oblastmi tubulární, glandulární a mikrocystické úpravy (1A; HE, 100x). Nádorové buňky vykazují pozitivitu PAX8 (1B, 200x), CD10 (1C, 200x), TTF1 (1D, 200x) a GATA3 (1E, 200x). Vyšetření k průkazu estrogenových receptorů je negativní (1F, 200x). 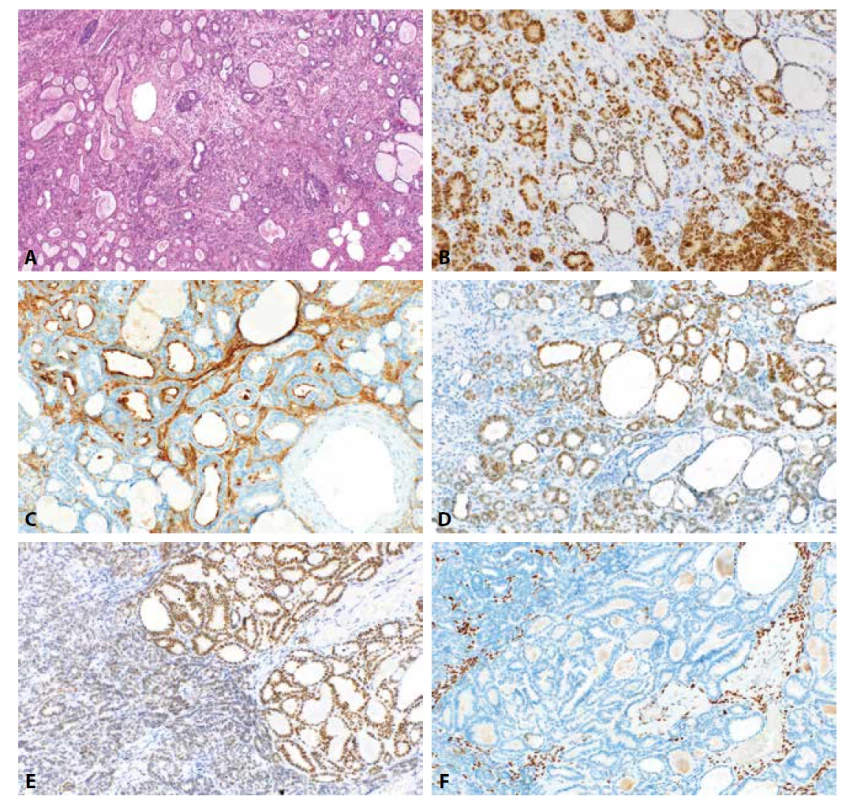
Endometroidní karcinom
Diferenciální diagnostika mezi grade 3 (grade 2) endometroidním a serózním karcinomem
Rozlišení mezi endometroidním a serózním karcinomem endometria je prognosticky i terapeuticky významné, klasifikace pouze na základě morfologie z barvení HE však může být obtížná či nemožná a interpersonální shoda v diagnostice těchto nádorů je poměrně nízká (108-110). Např. ve studii z roku 2016 zaměřené na diagnostickou shodu high grade karcinomů endometria při srovnání 2 pracovišť bylo reklasifikováno 38 % high grade karcinomů endometria diagnostikovaných ve Wyane State University (Detroit) a 17 % high grade karcinomů endometria diagnostikovaných v Memorian Sloan Kettering Cancer Center (New York) (109). V jiné studii byla diagnostická shoda high grade karcinomů endometria mezi 3 experty na gynekopatologii pouze 62,5 % (111). V tomto kontextu je tedy využití pomocných metod, které mohou diagnostickou shodu zvýšit, velmi žádoucí. V rámci diferenciální diagnostiky obvykle řešíme problematiku rozlišení EC G3 a SC, ještě závažnější klinické dopady však má diferenciální diagnostika mezi EC G2 a SC (112). Některé studie zaměřené na tuto problematiku zdůrazňují větší klinický význam stratifikace nádorů do low grade a high grade kategorie, nežli rozlišení na EC grade 3 a SC či jiný non-endometroidní typ (13). Při imunohistochemickém vyšetření za účelem této diferenciální diagnostiky je vždy doporučováno použít panel protilátek. Jeho optimální složení je obtížné definovat a každý může mít poněkud odlišný přístup, nicméně jako praktický se zdá být panel kombinující některé z protilátek zahrnujících ER, PR, p53, p16, IMP3, ARID1, PTEN a expresi MMR proteinů. V obecné úrovni využití těchto protilátek vychází z předpokladu, že EC je častěji ER / PR pozitivní, p53 wt, p16 negativní či vykazuje „mozaikový“ typ exprese, IMP3 negativní, PTEN a ARID1A vykazují ztrátu exprese a častěji se vyskytuje ztráta jednoho či více MMR proteinu (dMMR) (obr. 2, obr. 3). V praxi bývá také někdy využívána jaderná exprese ß-cateninu – nicméně byť i se jedná o marker s vysokou specificitou (u SC se jaderná exprese vyskytuje v 1-2 % případů), senzitivita je nízká (výskyt asi u 15 % EC) a negativní výsledek tedy není informativní (40). Možné je i využití dalších markerů, jako je HMGA2, jehož exprese se častěji vyskytuje u SC než EC (44). Navržené algoritmy často kombinují pouze 2-4 markery, např. p16, p53, PTEN a IMP3 (14). V jedné studii, využívající kombinaci ER, PR, TFF3 a IMP3, byly nádory s profilem ER+, PR+, TFF3+ a IMP3 - 110x pravděpodobněji EC než SC či CCC (16). Otázkou je nicméně nejen specificita, ale i senzitivita vyšetření, která je zejména při použití algoritmů kombinujících více protilátek nižší. Recentně se pro účely diferenciální diagnostiky v jedné studii zaměřili na expresi L1CAM (častěji používaného jako prognostický marker) v kombinaci s IMP3 (13). Výsledky studie prokázaly, že kombinace těchto markerů je významná při stratifikaci do low grade a high grade kategorií – kombinace IMP3-/L1CAM - se vyskytovala u 80,7 % EC G1/2, 46,3 % EC G3 a 3,1 % non-endometroidních (non-EC) nádorů. Naopak kombinace IMP3+/L1CAM+ byla u 3,6 % EC G1/2, 24,4 % EC G3 a 65,6 % non-EC nádorů. Ve skupině IMP3-/L1CAM - představovaly EC G1/2 92,5 % všech nádorů, EC G3 7,1 % a non-EC 0,4 %. V diferenciální diagnostice mezi EC a non-EC však bylo přínosné i samostatné využití každého z obou markerů, autoři však bohužel v kategorii non-EC nerozlišili mezi jednotlivými histologickými typy a tato skupina zahrnovala 19 SC, 8 CCC, 4 karcinosarkomy a 1 nediferencovaný karcinom. Existují i studie analyzující v této indikaci i celou řadu dalších protilátek jako je např. IMP2 a WT1. Exprese WT1 (často spíše fokální než difúzní) se může vyskytovat až u 50 % SC zatímco u EC je výskyt podstatně nižší a pohybuje se kolem 10 % případů (10,37,113). IMP2 se zdá být slibný marker, jehož ztráta exprese ve > 25 % buněk je popisována téměř u 100 % EC a asi pouze u 10 % SC, data jsou však poměrně limitovaná (61,62). Nadále však platí, že vždy je nutno zohlednit morfologii a počítat s možností překryvného či abnormálního imunofenotypu. Existuje také skupina nádorů s nejednoznačnými (morfologickými a IHC) rysy, u kterých rozlišení mezi EC a SC není s jistotou možné. Nedořešené však zatím je, jak tyto nádory označovat a klasifikovat (110). U těchto sporných případů a obecně u všech (zejména však high grade) karcinomů endometria může být potenciálně klinicky velmi významné molekulární testování a stratifikace nádorů do jednotlivých molekulárních subtypů a prognostických skupin.
Image 2. Endometroidní karcinom. Dobře diferencovaný (G1) endometroidní karcinom (HE, 100x). Nádorové buňky vykazují pozitivitu estrogenových receptorů ve více než 90 % nádorových buněk (2B, 200x), difúzní ztrátu exprese PTEN (2C, 100x) a „wild-type“ expresi p53 (2D, 200x). Středně diferencovaný endometroidní karcinom s fokální expresí p16 („mozaikovitý“ typ exprese) (2E, materiál z kyretáže, 200x). Středně diferencovaný endometroidní karcinom s klonálním typem exprese p53 (2F, 200x). 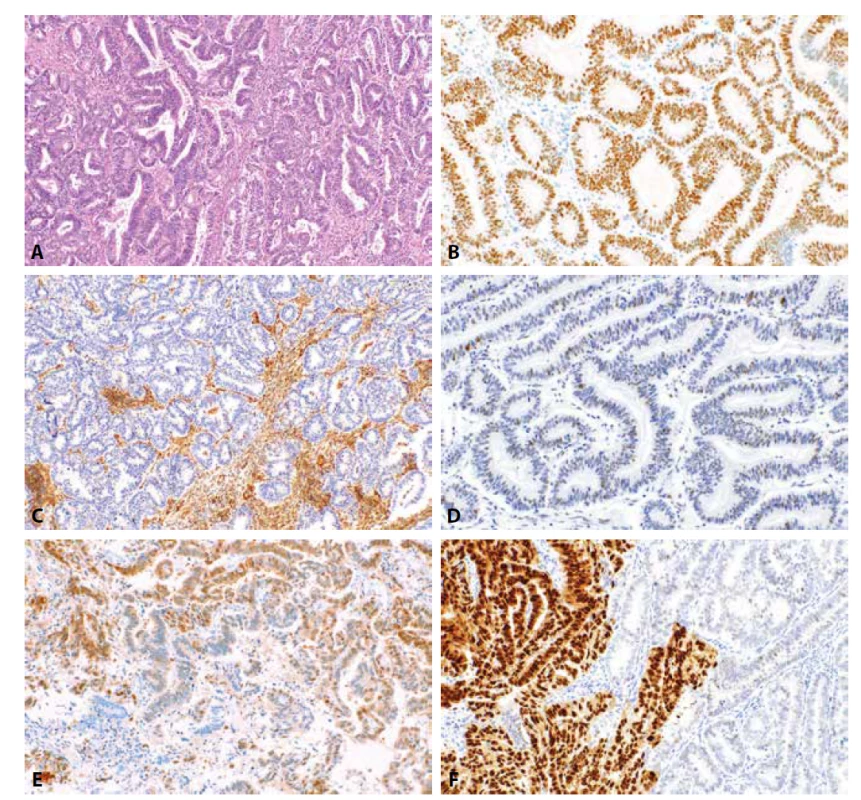
Image 3. Endometriální serózní karcinom. Převážně solidně uspořádaný nádor s minoritními oblastmi glandulární úpravy (HE, 100x). Nádorové struktury jsou negativní při průkazu estrogenových receptorů (3B, 200x). Difúzní pozitivita IMP3 (3C, 200x) a difúzní („bloková“) exprese p16 (3D, 100x). Glandulárně uspořádaný serózní karcinom s difúzní pozitivitou PTEN (3E, 100x). Příklady aberantního typu exprese p53 v serózním karcinomu: silně intenzivní jaderná pozitivita téměř ve 100 % nádorových buněk (3F, 200x) a úplná ztráta exprese p53 v nádorových buňkách s pozitivní vnitřní kontrolou v ojedinělých stromálních elementech (3G, 200x). Serózní karcinom s vysokou proliferační aktivitou přesahující 70 % (Ki-67, 200x). 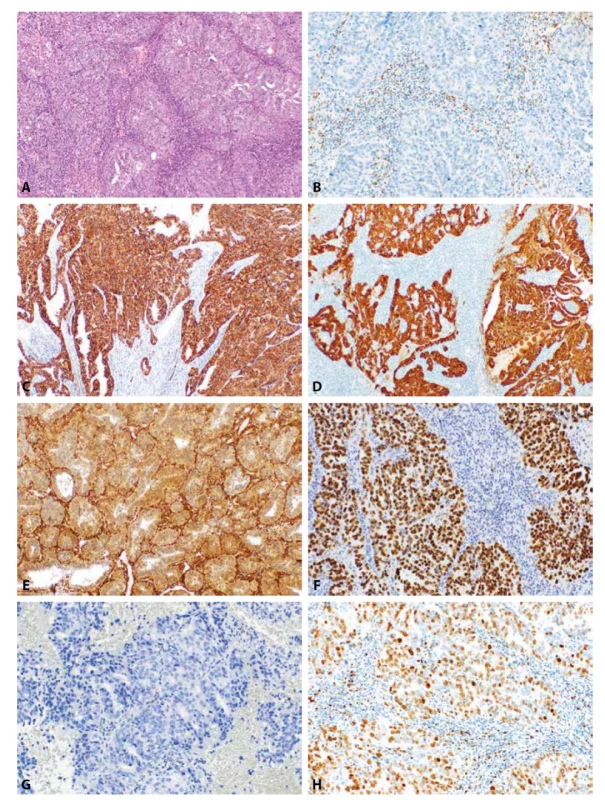
Světlobuněčný karcinom endometria
Diagnóza světlobuněčného karcinomu endometria je zatížena poměrně velkou interpersonální variabilitou (23,103,104). Problémem je poměrně značná morfologická heterogenita, určitý překryv možných morfologických znaků, které se mohou vyskytovat i u dalších typů nádorů (zejména SC) a fakt, že ostatní histologické typy karcinomu endometria (zejména tedy SC a EC) poměrně často vykazují oblasti tvořené buňkami se světlou cytoplazmou (21). V práci podrobně zaměřené na tuto problematiku byla u SC frekvence výskytu světlobuněčných oblastí ve 14 % případů, přičemž rozsah světlobuněčných oblastí byl 1-20 % objemu vyšetřené nádorové tkáně (21). Důležité je, že i oblasti se světlobuněčnou morfologií u těchto nádorů vykazovaly (s výjimkou mírně snížené exprese progesteronových receptorů) stejný imunofenotyp jako oblasti SC bez této přeměny. Použité protilátky zahrnovaly ER, PR, napsin A, HNF1B, p53, AMACR a Ki-67. Toto spektrum reflektuje v diagnostice CCC obecně nejčastěji používané protilátky, kdy mezi „pozitivní“ markery patří hlavně HNF1B, napsin A a AMACR (obr. 4) (22,27,68,72). Každý z těchto markerů má svá pozitiva i negativa. HNF1B se podle původní studie zdál být marker vysoce specifický, následné práce však toto zpochybnily, a i přes poměrně vysokou senzitivitu jde o marker málo specifický, jehož exprese je udávána i v dalších typech nádoru včetně EC a SC (24,114). Tyto studie však v rámci udávané nízké specificity zohledňují jakoukoliv jadernou expresi HNF1B, bez ohledu na její rozsah a intenzitu. Některé výsledky však ukazují, že v SC a EC je exprese HNF1B obvykle pouze limitovaná, naopak u CCC bývá exprese silná a difúzní (21). V naší studii jsme prokázali pozitivitu HNF1B u 51/180 EC (28 %), avšak z toho difúzní byla pouze u 9/180 případů (6 %) a u žádného z případů nebyla zaznamenána silná intenzita jaderné exprese (27). U SC jsme zaznamenali pozitivitu HNF1B u 7/27 případů (26 %), z toho difúzní byla u 5/27 případů (18,5 %), pouze u 1 případu jsme však zaznamenali silnou intenzitu exprese (3,7 %). Oproti tomu u CCC byla exprese 15/18 případů (83 %), z toho difúzní byla u 11/18 případů (61 %), a silná intenzita exprese byla vyjádřena u 14/18 případů (78 %). Z vlastní zkušenosti se tedy domníváme, že zohlednění zejména intenzity exprese specificitu HNF1B významně zvyšuje. Důležité je u tohoto markeru hodnotit pouze jadernou expresi, cytoplazmatická pozitivita je poměrně často přítomná (u různých nádorů), nejedná se však o pozitivitu specifickou. AMACR a zejména napsin A jsou markery více specifické, při praktickém využití je však u napsinu A nutno počítat s častějším fokálním typem exprese, což může být zejména u malých vzorků problematické. Exprese hormonálních receptorů je oproti tomu u CCC obecně nízká, často pouze fokální, z našeho přehledu se ER vyskytují u 9,5 % a PR u 6,3 % případů. Při použití širšího spektra protilátek je vždy nutné uvědomit si jaká je frekvence možného výskytu jejich exprese (či absence exprese) ve srovnání s jinými typy nádorů – to je zásadní krok pro správnou interpretaci výsledků. Např. úplná ztráta exprese ARID1A se podle našeho přehledu u CCC vyskytuje ve 29,1 %, ale zároveň u 26,7 % EC (u high grade EC dokonce u 38,4 %) a 8,5 % SC. Ztráta exprese PTEN je podle našeho přehledu u 51,2 % CCC, 57,9 % EC a pouze 3,1 % SC. Souhrnně tedy platí, že neexistuje jediný spolehlivý marker umožňující rozlišení mezi uvedenými typy nádorů a jak již bylo zdůrazněno, praktický význam uvedených protilátek je v jejich kombinaci s důslednou korelací s morfologickými znaky.
Image 4. Světlobuněčný karcinom endometria. Převáženě papilárně a glandulárně uspořádaný karcinom fokálně s hyalinizacemi stromatu papil (4A, HE, 200x). Nádorové struktury vakazují silně intenzivní jadernou pozitivitu HNF1B (4B, 200x), disperzní granulární cytoplazmatickou pozitivitu napsinu A (4C, 200x), negativitu estrogenových a progesteronových receptorů (4D, 4E, 200x) a „wild-type“ expresi p53 (4F, 200x). 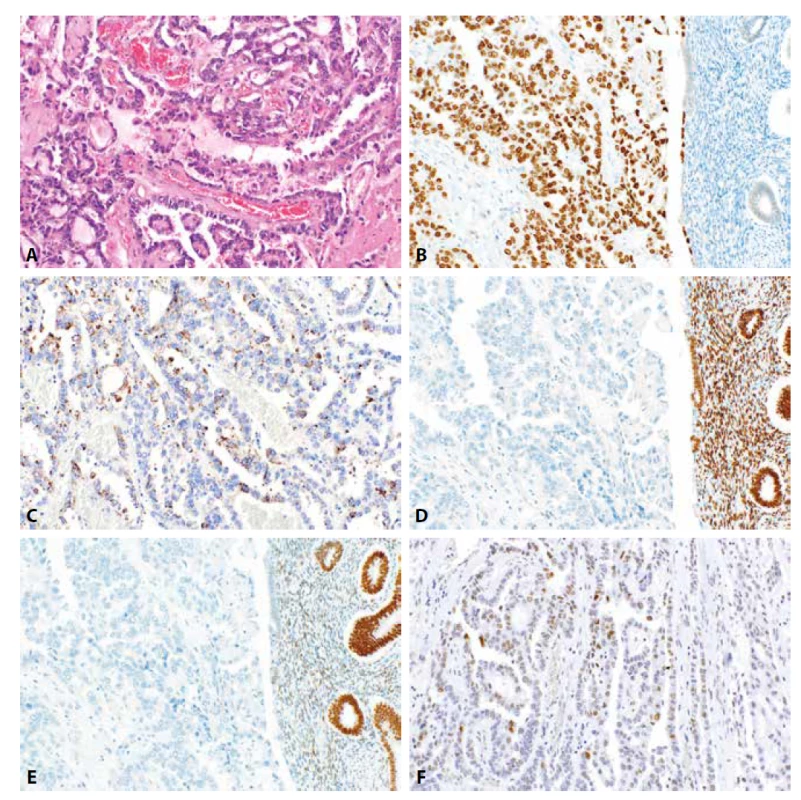
Smíšené karcinomy endometria
Smíšené karcinomy endometria jsou poměrně vzácné, tvořené 2 či více typy nádorů, přičemž z definice by se mělo jednat o nádory obsahující alespoň 5 % sekundární komponenty (a alespoň jedna komponenta je nádor II. typu). Nádorové komponenty by měly být rozdílné nejen na morfologické úrovni, ale vykazovat i rozdílný imunohistochemický profil. Role IHC je tedy u těchto nádorů zejména v tom, že podpoří morfologický dojem duální diferenciace (nebo jej vyvrátí u nádorů imunofenotypicky homogenních) (115,116). Principy využití IHC jsou v této indikaci shodné, jako je uvedeno u příslušných diferenciálních diagnóz či histologických typů nádorů. Ukazuje se však, že při podrobnějších analýzách na molekulární úrovni většina tzv. „smíšených“ karcinomů endometria vykazuje shodné molekulární aberace v obou komponentách a jde tedy o léze klonálního původu (115).
Serózní karcinom endometria vs. high grade serózní karcinom
Diferenciální diagnostika mezi SC endometria a metastázou HGSC (s primárním zdrojem v ovariu, děložní tubě či v oblasti pánevního peritonea) může být velmi komplikovaná, klinicky je však s ohledem na potenciální vliv na staging a případně i typ léčby významná. Na podkladě studie z roku 2002 se zdálo, že vhodným markerem v této diferenciální diagnóze by mohlo být využití WT1 (10). Podle této studie bylo WT1 pozitivní u 97 % serózních karcinomu ovaria, avšak u žádného SC endometria. Následné studie však prokázaly, že WT1 může být pozitivní i u SC endometria, a to až ve 44 % případů, zároveň potvrdily častou expresi WT1 u serózního karcinomu ovaria, kde je popisována asi u 90 % případů (9,52,117,118). Exprese WT1 u SC endometria nicméně byla s ohledem na rozsah i intenzitu udávána jako nižší. Některé studie však prokázaly, že i u SC endometria se může vyskytovat silná a difúzní exprese WT1, což význam tohoto markeru při jeho pozitivním výsledku významně limituje (37,38,119-121).
Samostatný význam využití WT1 v této diferenciální diagnóze je tedy zejména v případě negativního výsledku, který má s ohledem na primární endometriální SC poměrně vysokou specificitu, senzitivita je však nízká. Data s ohledem na možné využití v panelu s dalšími markery jsou velmi limitovaná. V jedné práci analyzující 22 SC endometria a 140 serózních karcinomů ovaria se jako vhodné složení panelu zdálo být použití protilátek proti ER, PR a WT1 (25). U ovariálních karcinomů byla v této studii exprese jednotlivých markerů 37 %, 49 % a 81 %; u SC endometria 18 %, 27 % a 36 %. Samostatné využití jednotlivých markerů tedy není podle jejich výsledků příliš přínosné, nicméně v kombinaci byla negativita všech 3 markerů u 41 % SC endometria a pouze 6,4 % SC ovaria a pozitivita všech 3 markerů u 33,6 % SC ovaria a žádného SC endometria. V rámci uvedených koordinátů je tedy dosaženo poměrně vysoké specificity, avšak senzitivita je poměrně nízká, což praktické využití limituje. Důležité je také hodnotit pouze jadernou expresi WT1, některé studie vyhodnocují i cytoplazmatickou expresi, to je však pro účely diferenciální diagnostiky nevhodné (113). Podle recentní studie se jako další vhodný marker jeví exprese HE4, která byla prokázána u 89,7 % SC ovaria a 39,1 % SC endometria (122). Studie však byla provedena na malém počtu pacientek, navíc výsledky nesvědčí pro příliš vysokou diskriminační hodnotu tohoto markeru. Dalším možným markerem je HER2, jehož pozitivita je udávaná u části SC endometria s tím, že podle některých studií je SC jiné lokality negativní (59).
Nediferencovaný a dediferencovaný karcinom
Diferenciální diagnostika nediferencovaného a dediferencovaného karcinomu (UC/DC) zahrnuje zejména EC G3, karcinosarkom a SC, méně často však může být problematické i odlišení od některých mezenchymálních či neuroektodermových nádorů. Morfologické znaky UC/DC jsou do určité míry charakteristické, nicméně přesto existuje poměrně výrazný překryv a na morfologické úrovni může být obraz poměrně komplikovaný. S ohledem na imunohistochemický profil neexistuje jednotlivý marker, který by diagnózu umožnil, a opět jde o využití panelu protilátek, jehož složení se odvíjí od zvažované diferenciální diagnózy (obr. 5). V obecné úrovni UC/DC často exprimuje keratiny (zejména CK8/18) či EMA, ve všech případech však pouze fokálně. Ve srovnání s dalšími typy nádorů je UC/DC obvykle PAX8 negativní (v našem přehledu je výskyt pozitivity u 14,8 %), u části případů se může vyskytovat pozitivita ER (23,8 %) a PR (42,1 %), častá je úplná ztráta exprese ARID1A (51,2 %) a PTEN (40 %) (123). Častá je také ztráta exprese E-cadherinu (55,6 %) a claudinu 4 (87,2 %) (79). Oproti jiným nádorům přicházejícím zejména v diferenciální diagnóze v úvahu se u UC/DC vyskytuje u části případů ztráta exprese SMARCA4 (Brg1) (podle našeho přehledu je to 21 % případů) a méně často SMARCB1 (INI1) (6,2 %) (92,94,99,124). Ztráta exprese SMARCA4 (Brg1) se však vyskytuje i u asi 25 % CCC. U části případů (asi u 25 %) se také může vyskytovat exprese neuroendokrinních markerů, jako je synaptofyzin, chromogranin a CD56 (125). V jedné studii byla popsána u 4/11 UC/DC případů exprese SALL4, ve srovnávaném souboru zahrnujícím 33 karcinomů endometria (vždy 11 případů ze skupiny EC G3, CCC a SC) byly všechny nádory negativní (87). Jiné práce však udávají expresi SALL4 u většiny EC (podle našeho přehledu u 57,9 %) a využití tohoto markeru je tedy diskutabilní (88,89).
Image 5. Dediferencovaný karcinom endometria. Struktury dediferencovaného karcinomu tvořeného splývajícími plochami oválných buněk vzniklého v terénu dobře diferencovaného endometroidního karcinomu s mucinózní diferenciací (5A, HE, 200x). Nádorové buňky vykazují expresi cytokeratinu 18 (4B, 400x), disperzní převážně slabou expresi PAX8 (5C, 400x) a fokální expresi synaptofyzinu (5D, 200x). 
Nádory s neuroendokrinní diferenciací
Tyto nádory zahrnují celé spektrum lézí (low grade NET – karcinoid, malobuněčný a velkobuněčný neuroendokrinní karcinom) morfologicky obdobných jako v jiných lokalitách (126). Nádory se mohou vyskytovat v čisté formě či smíšené s jiným typem karcinomu endometria. Důležité je zohlednit morfologii, samotná exprese neuroendokrinních markerů pro diagnózu nádoru s neuroendokrinní diferenciací nestačí a může být zavádějící. Stejně jako v jiných lokalitách lze uplatnit pravidlo, že pro diagnózu velkobuněčného neuroendokrinního karcinomu by měla být exprese NE markerů (někdo uvádí, že stačí jednoho, jiní preferují pozitivitu alespoň dvou) alespoň v 10 % (někdo udává ve 20 %) nádorových buněk. Přesné spektrum markerů s rozborem jejich výhod a nevýhod je nad rámec tohoto sdělení, nicméně v obecné úrovni lze doporučit např. synaptofyzin, chromogranin a INSM1. Při použití CD56 je nutno při hodnocení výsledků zohlednit jeho poměrně vysokou nespecifitu. V tomto kontextu je důležité počítat s tím, že exprese neuroendokrinních markerů se může vyskytovat i v jiných typech karcinomu endometria, které nemají neuroendokrinní diferenciaci. Byť i literární data jsou poměrně limitovaná, výskyt exprese synaptofyzinu je v našem přehledu u 21,2 % EC, 7 % SC a 8,3 % CCC, chromograninu u 51,5 % EC, 27,8 % SC a 0 % CCC a CD56 u 11,5 % EC, 30 % SC a 8,3 % CCC (63,101,102). Častý je také výskyt exprese těchto 3 markerů u nediferencovaného / dediferencovaného karcinomu, který se vyskytuje asi ve 25 % případů (81,87,98). Exprese neuroendokrinních markerů tedy sama o sobě nedělá diagnózu nádoru s neuroendokrinní diferenciací, vždy je nutné zohlednit morfologii a případně i výsledky dalších IHC vyšetření. Vhodné je zmínit, že pro diagnózu malobuněčného neuroendokrinního karcinomu není (stejně jako u plicních karcinomů) při splnění morfologických kritérií exprese neuroendokrinních markerů nutná.
Význam hodnocení exprese MMR proteinů
Problematika vyšetření exprese MMR proteinů v rámci screeningu Lynchova syndromu je nad rámec tohoto sdělení, diskutován je tedy pouze význam pro účely diferenciální diagnostiky. Ztráta exprese jednoho či více MMR proteinů (dMMR) je odlišná u jednotlivých histologických typů karcinomu endometria. U EC se MMR vyskytuje poměrně často, udávána je kolem 30-40 % případů (v našem přehledu to bylo 34,7 % případů, přičemž u LG EC byl výskyt u 30,8 % a u HG EC u 47,7 %). U serózního karcinomu je výskyt dMMR poměrně vzácný, podle našeho přehledu se jedná o 7,3 % případů. U CCC jsou literární data poměrně heterogenní a udávají dMMR ve velmi širokém rozmezí 6-68,8 % (34,127). Některé recentní studie však na případech, které byly přesně klasifikovány v kombinaci morfologie a IHC vyšetření, neprokázaly dMMR u žádného z nich (33,128). Autoři se domnívají, že tato diskrepance je vysvětlitelná tím, že další studie zahrnují i případy sporné, diagnosticky nejednoznačné, které představují jiný typ karcinomu (zejména EC) se světlobuněčnou přeměnou, či jde o nádory smíšené, u kterých se dMMR vyskytuje poměrně často (129). Jejich data podporují i další studie, které neprokázaly jediný případ s mikrosatelitovou instabilitou (58,130). Další recentní studie však opět v kontradikci k uvedeným nalezla dMMR u 15/45 případů (33,3 %) a nejasnosti tedy přetrvávají (71). U přesně klasifikovaných CCC je výskyt dMMR pravděpodobně poměrně nízký, v našem přehledu se dMMR vyskytlo u 12,3 % případů. Častý je výskyt dMMR u UC/DC, kde se vyskytuje asi u 50 % případů. Pro účely diferenciální diagnostiky se tedy dMMR zdá být jako vhodný doplňkový marker u EC, zejména v případě diferenciální diagnózy proti SC či CCC. Opět ale platí, že samostatný význam je limitovaný.
Význam hodnocení exprese p53
Exprese p53 je jeden ze základních markerů používaných v diagnostice karcinomů ovaria zejména při rozlišení mezi low grade a high grade serózním karcinomem, a abnormální exprese proteinu představuje pomocný marker detekce TP53 mutace (18). Nedávná studie provedená na karcinomech ovaria prokázala, že při správné validaci má IHC vyšetření s ohledem na konkordanci s mutačním stavem genu TP53 100% specificitu a 95,9% senzitivitu (93). U karcinomu endometria jsou data více heterogenní a v přehledové práci z roku 2018 analyzující data týkající se exprese p53 se ukázalo, že ve 12/36 studií byla frekvence výskytu aberantní exprese u SC < 80 % a u 9/36 studií byla naopak přítomna ve 100 % (131). Celkový výskyt aberantní exprese p53 byl v uvedených studiích přítomen u 1223/1445 případů (84,6 %). Určitým problémem je heterogenita skórování exprese p53, jako abnormální byla hodnocena exprese s různými cut-offs, včetně > 50 %, > 70 %, > 75 %, nulová exprese, ale i různé semikvantitativní způsoby skórování kombinující rozsah a intenzitu zbarvení. Současná kritéria normální a aberantní exprese jsou přesněji definována (tabulka 2). Poměrně výrazné rozdíly mezi jednotlivými studiemi mohou mít kromě metodiky a způsobu hodnocení i další vysvětlení, zejména již zmíněnou absenci „zlatého standardu“ umožňujícího jednoznačnou charakterizaci nádorů na morfologické úrovni vedoucí k nejednotnosti analyzovaných souborů tím, že jsou mezi SC zahrnuty i nádory napodobující jiné histogeneze (nejčastěji EC). Další skupinu představují nádory, u kterých je přítomna mutace TP53, která však není detekovatelná na imunohistochemické úrovni. Konečně se může jednat o SC, které nemají mutaci TP53 a tedy ani aberantní expresi p53. I přes uvedené heterogenní výsledky vycházející z historických dat, recentní studie srovnávající IHC stav exprese p53 s mutačním stavem TP53 prokázala vysokou přesnost IHC vyšetření i u těchto nádorů (18). Správně bylo diagnostikováno 92,3 % nádorů (senzitivita 90,8 %; specificita 94,3 %). Při vyloučení nádorů s POLE mutací či aberantním typem exprese MMR proteinů (dMMR), které často vykazují tzv. klonální typ exprese p53, se přesnost IHC vyšetření zvýšila na 95,1 %. IHC exprese p53 je tedy při správné validaci marker, který lze využít v rámci prognostické stratifikace nádorů endometria (CN-high, serous-like molekulární subtyp) i v rámci diferenciální diagnostiky. Je však nutné správné hodnocení s ohledem na rozsah a typ exprese, a uvědomění si, že abnormální exprese p53 není specifická pro SC a vyskytuje se poměrně často i u CCC a méně často u EC (v našem přehledu to bylo 31,9 % CCC a 17,3 % EC – daleko častější však byl u EC výskyt u HG nádorů (33,5 %) než LG nádorů (8,7 %)). Dále je nutné počítat s možností klonálního typu exprese p53 (definovaného jako heterogenní exprese p53 s oblastmi typu wild-type (normální typ) alternujícími s oblastmi s abnormální expresí), která se obvykle vyskytuje u nádorů s POLE mutací či dMMR a reflektuje fakt, že u těchto nádorů v rámci ultramutačního či hypermutačního stavu dochází k vzniku mutace TP53, která však není driver mutací a odráží pouze genomickou instabilitu příslušného nádoru. Vzhledem k faktu, že abnormální typ exprese p53 je prognosticky nepříznivý faktor i u EC G1 a G2, je někdy doporučováno testování exprese p53 u všech karcinomů endometria v rámci vstupní diagnózy. Někteří autoři dokonce navrhují při aberantní expresi p53 u EC G1 a G2 tyto nádory vzhledem ke špatné prognóze klasifikovat jako high grade EC (19). Toto však aktuálně není obecně akceptováno, uvedený postup spíše představuje určité prolnutí mezi morfologickou a molekulární subtypizací karcinomů endometria, molekulární klasifikaci však v plném rozsahu nenahrazuje. Praktické využití vyšetření exprese p53 je tedy poměrně široké, nutné je však vyšetření provádět správně. Prvním a zásadním krokem je správná validace protilátky. Neméně důležitý je pak i způsob hodnocení, který vyžaduje znalost nejen hraničních hodnot pozitivity (cut-offs), ale musí zohlednit i jednotlivé typy exprese p53 (obr. 2D, 2F, 3F, 3G, 4F) (132).
Table 2. Typy exprese p53 a interpretace výsledků. 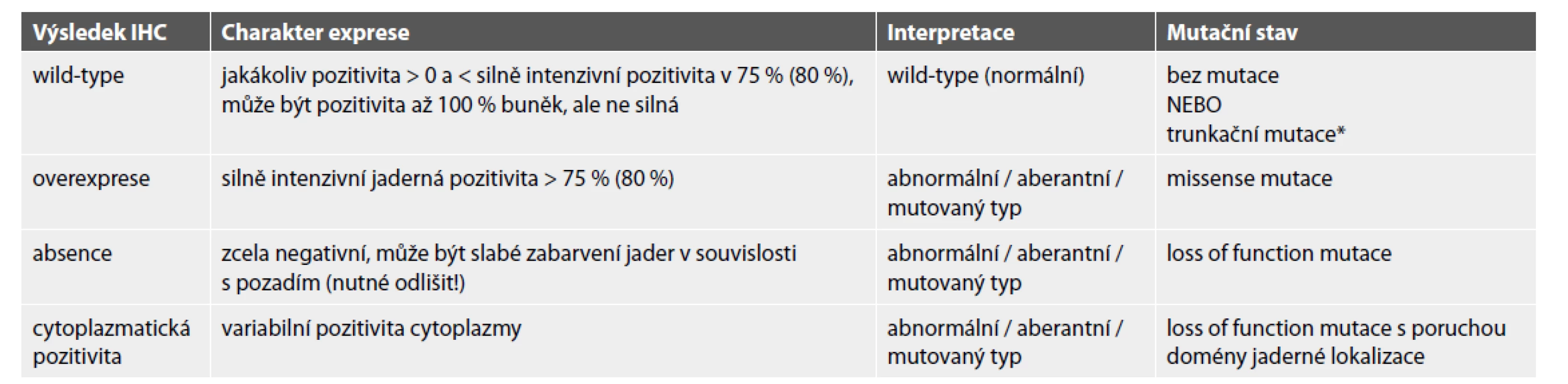
* jedná se o minoritu případů (< 5 %), u kterých mutace není doprovázená aberantním typem exprese p53 ZÁVĚR
Karcinomy endometria představují heterogenní skupinu nádorů, jejíž diagnostika je v jednoznačných případech poměrně přímočará, v rámci výše diskutované diferenciální diagnostiky však může být poměrně složitá a vyžaduje využití speciálních metod, nejčastěji imunohistochemických či molekulárních (tyto však nejsou předmětem stávajícího sdělení). Využití IHC metod je rutinní praxí všech patologů, stejně jako u jiných metodik je však zapotřebí uvědomit si zásady správné práce, možnosti, ale i limity a případná úskalí. Bez ohledu na vše uvedené je vždy základem morfologické hodnocení a histologický obraz nádoru musí být zohledněn jako rozhodující faktor. Za zásadní také pokládáme používání kombinace více protilátek, univerzálně doporučený panel však neexistuje a spektrum protilátek se mění dle zvažované diferenciální diagnózy. I přes literárně udávanou nízkou interpersonální shodu u určitých typů nádorů se domníváme, že při správném vyhodnocení morfologických znaků v kombinaci s IHC profilem lze naprostou většinu nádorů správně zařadit. Nadále však zůstává malá skupina nádorů, která je morfologicky i imunohistochemickým profilem nejednoznačná a tyto nádory nelze přesně klasifikovat – toto by se mělo objevit i v závěru bioptického vyšetření se zdůvodněním, proč tomu tak je. Pomoci v těchto případech může molekulární diagnostika, nicméně i v této oblasti existuje určitý překryv. V současné době je některými autory morfologická diagnostika (včetně histologické typizace a stanovení grade) karcinomů endometria zpochybňována a domnívají se, že vše „vyřeší“ molekulární profilování, tento názor však většina zatím nesdílí. Spíše se dle našeho názoru jedná o komplementární přístup s tím, že každý nádor by měl být správně klasifikován s ohledem na morfologii (histologický typ, grade, stage, stanovení LVSI a další morfologické parametry), v určitých (či optimálně všech?) případech doplněný o molekulární klasifikaci nádorů.
PODĚKOVÁNÍ
Práce byla podpořena MZČR (projekt RVO VFN 64165) a Univerzitou Karlovou (projekt Progres Q28/LF1). Práca bola podporená v rámci OP Výskum a vývoj pre projekt: Centrum pre biomedicínsky výskum – BIOMEDIRES – II. etapa, ITMS 313011W428, spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
Prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK a VFN v Praze
Studničkova 2, 128 00, Praha 2
Sources
1. Brinton LA, Felix AS, Mcmeekin DS, et al. Etiologic heterogeneity in endometrial cancer: Evidence from a gynecologic oncology group trial. Gynecol Oncol 2013; 129(2): 277-284.
2. Voss MA, Ganesan R, Ludeman L, et al. Should grade 3 endometrioid endometrial carcinoma be considered a type 2 cancer-a clinical and pathological evaluation. Gynecol Oncol 2012; 124(1): 15-20.
3. Zannoni GF, Vellone VG, Arena V, et al. Does high-grade endometrioid carcinoma (grade 3 figo) belong to type i or type ii endometrial cancer? A clinical-pathological and immunohistochemical study. Virchows Arch 2010; 457(1): 27-34.
4. Cancer Genome Atlas Research N, Kandoth C, Schultz N, et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497(7447): 67-73.
5. Meng B, Hoang LN, Mcintyre JB, et al. Pole exonuclease domain mutation predicts long progression-free survival in grade 3 endometrioid carcinoma of the endometrium. Gynecol Oncol 2014; 134(1): 15-19.
6. Haruma T, Nagasaka T, Nakamura K, et al. Clinical impact of endometrial cancer stratified by genetic mutational profiles, pole mutation, and microsatellite instability. PLoS One 2018; 13(4): e0195655.
7. Van Gool IC, Stelloo E, Nout RA, et al. Prognostic significance of l1cam expression and its association with mutant p53 expression in high-risk endometrial cancer. Mod Pathol 2016; 29(2): 174-181.
8. Bosse T, Peters EE, Creutzberg CL, et al. Substantial lymph-vascular space invasion (lvsi) is a significant risk factor for recurrence in endometrial cancer--a pooled analysis of portec 1 and 2 trials. Eur J Cancer 2015; 51(13): 1742-1750.
9. Al-Hussaini M, Stockman A, Foster H, Mccluggage WG. Wt-1 assists in distinguishing ovarian from uterine serous carcinoma and in distinguishing between serous and endometrioid ovarian carcinoma. Histopathology 2004; 44(2): 109-115.
10. Goldstein NS, Uzieblo A. Wt1 immunoreactivity in uterine papillary serous carcinomas is different from ovarian serous carcinomas. Am J Clin Pathol 2002; 117(4): 541-545.
11. Zhang Y, Garcia-Buitrago MT, Koru-Sengul T, Schuman S, Ganjei-Azar P. An immunohistochemical panel to distinguish ovarian from uterine serous papillary carcinomas. Int J Gynecol Pathol 2013; 32(5): 476-481.
12. Zaidi A, Gupta P, Gupta N, et al. Role of immunohistochemistry to distinguish grade 3 endometrioid carcinoma and uterine serous carcinoma. Appl Immunohistochem Mol Morphol 2020; 28(1): 42-48.
13. Visser NCM, Van Der Putten LJM, Van Egerschot A, et al. Addition of imp3 to l1cam for discrimination between low - and high-grade endometrial carcinomas: A european network for individualised treatment of endometrial cancer collaboration study. Hum Pathol 2019; 89 : 90-98.
14. Alkushi A, Kobel M, Kalloger SE, Gilks CB. High-grade endometrial carcinoma: Serous and grade 3 endometrioid carcinomas have different immunophenotypes and outcomes. Int J Gynecol Pathol 2010; 29(4): 343-350.
15. Mhawech-Fauceglia P, Herrmann FR, Rai H, et al. Imp3 distinguishes uterine serous carcinoma from endometrial endometrioid adenocarcinoma. Am J Clin Pathol 2010; 133(6): 899-908.
16. Mhawech-Fauceglia P, Wang D, Samrao D, et al. Trefoil factor family 3 (tff3) expression and its interaction with estrogen receptor (er) in endometrial adenocarcinoma. Gynecol Oncol 2013; 130(1): 174-180.
17. Zheng W, Yi X, Fadare O, et al. The oncofetal protein imp3: A novel biomarker for endometrial serous carcinoma. Am J Surg Pathol 2008; 32(2): 304-315.
18. Singh N, Piskorz AM, Bosse T, et al. P53 immunohistochemistry is an accurate surrogate for tp53 mutational analysis in endometrial carcinoma biopsies. J Pathol 2020; 250(3): 336-345.
19. Yano M, Ito K, Yabuno A, et al. Impact of tp53 immunohistochemistry on the histological grading system for endometrial endometrioid carcinoma. Mod Pathol 2019; 32(7): 1023-1031.
20. Allo G, Bernardini MQ, Wu RC, et al. Arid1a loss correlates with mismatch repair deficiency and intact p53 expression in high-grade endometrial carcinomas. Mod Pathol 2014; 27(2): 255-261.
21. Hariri N, Qarmali M, Fadare O. Endometrial serous carcinoma with clear-cell change: Frequency and immunohistochemical analysis. Int J Surg Pathol 2018; 26(2): 126-134.
22. Fadare O, Parkash V, Gwin K, et al. Utility of alpha-methylacyl-coenzyme-a racemase (p504s) immunohistochemistry in distinguishing endometrial clear cell carcinomas from serous and endometrioid carcinomas. Hum Pathol 2013; 44(12): 2814-2821.
23. Fadare O, Zheng W, Crispens MA, et al. Morphologic and other clinicopathologic features of endometrial clear cell carcinoma: A comprehensive analysis of 50 rigorously classified cases. Am J Cancer Res 2013; 3(1): 70-95.
24. Fadare O, Liang SX. Diagnostic utility of hepatocyte nuclear factor 1-beta immunoreactivity in endometrial carcinomas: Lack of specificity for endometrial clear cell carcinoma. Appl Immunohistochem Mol Morphol 2012; 20(6): 580-587.
25. Fadare O, James S, Desouki MM, Khabele D. Coordinate patterns of estrogen receptor, progesterone receptor, and wilms tumor 1 expression in the histopathologic distinction of ovarian from endometrial serous adenocarcinomas. Ann Diagn Pathol 2013; 17(5): 430-433.
26. Fadare O, Gwin K, Desouki MM, et al. The clinicopathologic significance of p53 and baf-250a (arid1a) expression in clear cell carcinoma of the endometrium. Mod Pathol 2013; 26(8): 1101-1110.
27. Nemejcova K, Ticha I, Kleiblova P, et al. Expression, epigenetic and genetic changes of hnf1b in endometrial lesions. Pathol Oncol Res 2016; 22(3): 523-530.
28. Wiegand KC, Lee AF, Al-Agha OM, et al. Loss of baf250a (arid1a) is frequent in high-grade endometrial carcinomas. J Pathol 2011; 224(3): 328-333.
29. Fadare O, Renshaw IL, Liang SX. Does the loss of arid1a (baf-250a) expression in endometrial clear cell carcinomas have any clinicopathologic significance? A pilot assessment. J Cancer 2012; 3 : 129-136.
30. Guan B, Mao TL, Panuganti PK, et al. Mutation and loss of expression of arid1a in uterine low-grade endometrioid carcinoma. Am J Surg Pathol 2011; 35(5): 625-632.
31. Kir G, Soylemez T, Olgun ZC, Aydin A, Mccluggage WG. Correlation of pd-l1 expression with immunohistochemically determined molecular profile in endometrial carcinomas. Virchows Arch 2020; 477(6): 845-856.
32. Ayhan A, Mao TL, Seckin T, et al. Loss of arid1a expression is an early molecular event in tumor progression from ovarian endometriotic cyst to clear cell and endometrioid carcinoma. Int J Gynecol Cancer 2012; 22(8): 1310-1315.
33. Baniak N, Fadare O, Köbel M, et al. Targeted molecular and immunohistochemical analyses of endometrial clear cell carcinoma show that pole mutations and DNA mismatch repair protein deficiencies are uncommon. Am J Surg Pathol 2019; 43(4): 531-537.
34. Bae HS, Kim H, Young Kwon S, et al. Should endometrial clear cell carcinoma be classified as type ii endometrial carcinoma? Int J Gynecol Pathol 2015; 34(1): 74-84.
35. Bosse T, Ter Haar NT, Seeber LM, et al. Loss of arid1a expression and its relationship with pi3k-akt pathway alterations, tp53 and microsatellite instability in endometrial cancer. Mod Pathol 2013; 26(11): 1525-1535.
36. Hashi A, Yuminamochi T, Murata S, et al. Wilms tumor gene immunoreactivity in primary serous carcinomas of the fallopian tube, ovary, endometrium, and peritoneum. Int J Gynecol Pathol 2003; 22(4): 374-377.
37. Dupont J, Wang X, Marshall DS, et al. Wilms tumor gene (wt1) and p53 expression in endometrial carcinomas: A study of 130 cases using a tissue microarray. Gynecol Oncol 2004; 94(2): 449-455.
38. Acs G, Pasha T, Zhang PJ. Wt1 is differentially expressed in serous, endometrioid, clear cell, and mucinous carcinomas of the peritoneum, fallopian tube, ovary, and endometrium. Int J Gynecol Pathol 2004; 23(2): 110-118.
39. Euscher ED, Malpica A, Deavers MT, Silva EG. Differential expression of wt-1 in serous carcinomas in the peritoneum with or without associated serous carcinoma in endometrial polyps. Am J Surg Pathol 2005; 29(8): 1074-1078.
40. Heckl M, Schmoeckel E, Hertlein L, et al. The arid1a, p53 and ss-catenin statuses are strong prognosticators in clear cell and endometrioid carcinoma of the ovary and the endometrium. PLoS One 2018; 13(2): e0192881.
41. Chen W, Husain A, Nelson GS, et al. Immunohistochemical profiling of endometrial serous carcinoma. Int J Gynecol Pathol 2017; 36(2): 128-139.
42. Mao TL, Ardighieri L, Ayhan A, et al. Loss of arid1a expression correlates with stages of tumor progression in uterine endometrioid carcinoma. Am J Surg Pathol 2013; 37(9): 1342-1348.
43. Mao TL, Ayhan A, Kuo KT, et al. Immunohistochemical study of endometrial high-grade endometrioid carcinoma with or without a concurrent low-grade component: Implications for pathogenetic and survival differences. Histopathology 2015; 67(4): 474-482.
44. Mccluggage WG, Connolly LE, Mcbride HA, Kalloger S, Gilks CB. Hmga2 is commonly expressed in uterine serous carcinomas and is a useful adjunct to diagnosis. Histopathology 2012; 60(4): 547-553.
45. Zhang ZM, Xiao S, Sun GY, et al. The clinicopathologic significance of the loss of baf250a (arid1a) expression in endometrial carcinoma. Int J Gynecol Cancer 2014; 24(3): 534-540.
46. Yen TT, Miyamoto T, Asaka S, et al. Loss of arid1a expression in endometrial samplings is associated with the risk of endometrial carcinoma. Gynecol Oncol 2018; 150(3): 426-431.
47. Werner HM, Berg A, Wik E, et al. Arid1a loss is prevalent in endometrial hyperplasia with atypia and low-grade endometrioid carcinomas. Mod Pathol 2013; 26(3): 428-434.
48. Taskin OC, Onder S, Topuz S, et al. A selected immunohistochemical panel aids in differential diagnosis and prognostic stratification of subtypes of high-grade endometrial carcinoma: A clinicopathologic and immunohistochemical study at a single institution. Appl Immunohistochem Mol Morphol 2017; 25(10): 696-702.
49. Pasanen A, Loukovaara M, Butzow R. Clinicopathological significance of deficient DNA mismatch repair and mlh1 promoter methylation in endometrioid endometrial carcinoma. Mod Pathol 2020; 33(7): 1443-1452.
50. An HJ, Lee YH, Cho NH, et al. Alteration of pten expression in endometrial carcinoma is associated with down-regulation of cyclin-dependent kinase inhibitor, p27. Histopathology 2002; 41(5): 437-445.
51. Djordjevic B, Hennessy BT, Li J, et al. Clinical assessment of pten loss in endometrial carcinoma: Immunohistochemistry outperforms gene sequencing. Mod Pathol 2012; 25(5): 699-708.
52. Hedley C, Sriraksa R, Showeil R, Van Noorden S, El-Bahrawy M. The frequency and significance of wt-1 expression in serous endometrial carcinoma. Hum Pathol 2014; 45(9): 1879-1884.
53. Fadare O, Desouki MM, Gwin K, et al. Frequent expression of napsin a in clear cell carcinoma of the endometrium: Potential diagnostic utility. Am J Surg Pathol 2014; 38(2): 189-196.
54. Chiesa-Vottero AG, Malpica A, Deavers MT, et al. Immunohistochemical overexpression of p16 and p53 in uterine serous carcinoma and ovarian high-grade serous carcinoma. Int J Gynecol Pathol 2007; 26(3): 328-333.
55. Iwamoto M, Nakatani Y, Fugo K, Kishimoto T, Kiyokawa T. Napsin a is frequently expressed in clear cell carcinoma of the ovary and endometrium. Hum Pathol 2015; 46(7): 957-962.
56. Kounelis S, Kapranos N, Kouri E, et al. Immunohistochemical profile of endometrial adenocarcinoma: A study of 61 cases and review of the literature. Mod Pathol 2000; 13(4): 379-388.
57. Lax SF, Pizer ES, Ronnett BM, Kurman RJ. Comparison of estrogen and progesterone receptor, ki-67, and p53 immunoreactivity in uterine endometrioid carcinoma and endometrioid carcinoma with squamous, mucinous, secretory, and ciliated cell differentiation. Hum Pathol 1998; 29(9): 924-931.
58. Nelson GS, Pink A, Lee S, et al. Mmr deficiency is common in high-grade endometrioid carcinomas and is associated with an unfavorable outcome. Gynecol Oncol 2013; 131(2): 309-314.
59. Ruba S, Doherty D, Stewart CJR. A detailed morphological and immunohistochemical comparison of primary endometrial and tubo-ovarian high-grade serous carcinomas and their corresponding omental metastases. Pathology 2020; 52(2): 197-205.
60. Yan Z, Hui P. Minimal uterine serous carcinoma with extrauterine tumor of identical morphology: An immunohistochemical study of 13 cases. Appl Immunohistochem Mol Morphol 2010; 18(1): 75-79.
61. Zhang L, Liu Y, Hao S, Woda BA, Lu D. Imp2 expression distinguishes endometrioid from serous endometrial adenocarcinomas. Am J Surg Pathol 2011; 35(6): 868-872.
62. Hiramatsu K, Yoshino K, Serada S, et al. Similar protein expression profiles of ovarian and endometrial high-grade serous carcinomas. Br J Cancer 2016; 114(5): 554-561.
63. Moritz AW, Schlumbrecht MP, Nadji M, Pinto A. Expression of neuroendocrine markers in non-neuroendocrine endometrial carcinomas. Pathology 2019; 51(4): 369-374.
64. Ervine A, Leung S, Gilks CB, Mccluggage WG. Thyroid transcription factor-1 (ttf-1) immunoreactivity is an adverse prognostic factor in endometrioid adenocarcinoma of the uterine corpus. Histopathology 2014; 64(6): 840-846.
65. Siami K, Mccluggage WG, Ordonez NG, et al. Thyroid transcription factor-1 expression in endometrial and endocervical adenocarcinomas. Am J Surg Pathol 2007; 31(11): 1759-1763.
66. Nili F, Tavakoli M, Izadi Mood N, Saffar H, Sarmadi S. Napsin-a expression, a reliable immunohistochemical marker for diagnosis of ovarian and endometrial clear cell carcinomas. Iran J Pathol 2020; 15(2): 81-85.
67. Al-Maghrabi JA, Butt NS, Anfinan N, et al. Infrequent immunohistochemical expression of napsin a in endometrial carcinomas. Appl Immunohistochem Mol Morphol 2017; 25(9): 632-638.
68. Pors J, Segura S, Cheng A, et al. Napsin-a and amacr are superior to hnf-1beta in distinguishing between mesonephric carcinomas and clear cell carcinomas of the gynecologic tract. Appl Immunohistochem Mol Morphol 2020; 28(8): 593-601.
69. Jin C, Hacking S, Komforti MK, Nasim M. A comparison of death domain-associated protein 6 in different endometrial carcinomas histotypes. Biomark Insights 2019; 14 : 1177271919864892.
70. Ju B, Wang J, Yang B, et al. Morphologic and immunohistochemical study of clear cell carcinoma of the uterine endometrium and cervix in comparison to ovarian clear cell carcinoma. Int J Gynecol Pathol 2018; 37(4): 388-396.
71. Zannoni GF, Santoro A, Angelico G, et al. Clear cell carcinoma of the endometrium: An immunohistochemical and molecular analysis of 45 cases. Hum Pathol 2019; 92 : 10-17.
72. Ji JX, Cochrane DR, Tessier-Cloutier B, et al. Use of immunohistochemical markers (HNF-1beta, napsin a, ER, CTH, and ASS1) to distinguish endometrial clear cell carcinoma from its morphologic mimics including arias-stella reaction. Int J Gynecol Pathol 2020; 39(4): 344-353.
73. Doulgeraki T, Vagios S, Kavoura E, et al. Mismatch repair status in high-grade endometrial carcinomas of endometrioid and non-endometrioid type. J BUON 2019; 24(5): 2020-2027.
74. Doghri R, Houcine Y, Boujelbène N, et al. Mismatch repair deficiency in endometrial cancer: Immunohistochemistry staining and clinical implications. Appl Immunohistochem Mol Morphol 2019; 27(9): 678-682.
75. Backes FJ, Haag J, Cosgrove CM, et al. Mismatch repair deficiency identifies patients with high-intermediate-risk (hir) endometrioid endometrial cancer at the highest risk of recurrence: A prognostic biomarker. Cancer 2019; 125(3): 398-405.
76. Pina A, Wolber R, Mcalpine JN, Gilks B, Kwon JS. Endometrial cancer presentation and outcomes based on mismatch repair protein expression from a population-based study. Int J Gynecol Cancer 2018; 28(8): 1624-1630.
77. Peterson LM, Kipp BR, Halling KC, et al. Molecular characterization of endometrial cancer: A correlative study assessing microsatellite instability, mlh1 hypermethylation, DNA mismatch repair protein expression, and PTEN, PIK3CA, KRAS, and BRAF mutation analysis. Int J Gynecol Pathol 2012; 31(3): 195-205.
78. Chapel DB, Yamada SD, Cowan M, Lastra RR. Immunohistochemistry for mismatch repair protein deficiency in endometrioid endometrial carcinoma yields equivalent results when performed on endometrial biopsy/curettage or hysterectomy specimens. Gynecol Oncol 2018; 149(3): 570-574.
79. Zhang X, Yu M. Undifferentiated endometrial carcinoma: A selected immunohistochemical panel including pax-8 and e-cadherin for aiding distinction from other endometrial carcinomas. Ann Diagn Pathol 2019; 39 : 36-41.
80. Tessier-Cloutier B, Soslow RA, Stewart CJR, Kobel M, Lee CH. Frequent loss of claudin-4 expression in dedifferentiated and undifferentiated endometrial carcinomas. Histopathology 2018; 73(2): 299-305.
81. Taraif SH, Deavers MT, Malpica A, Silva EG. The significance of neuroendocrine expression in undifferentiated carcinoma of the endometrium. Int J Gynecol Pathol 2009; 28(2): 142-147.
82. Strehl JD, Wachter DL, Fiedler J, et al. Pattern of smarcb1 (ini1) and smarca4 (brg1) in poorly differentiated endometrioid adenocarcinoma of the uterus: Analysis of a series with emphasis on a novel smarca4-deficient dedifferentiated rhabdoid variant. Ann Diagn Pathol 2015; 19(4): 198-202.
83. Stewart CJ, Crook ML. Fascin expression in undifferentiated and dedifferentiated endometrial carcinoma. Hum Pathol 2015; 46(10): 1514-1520.
84. Saad RS, Mashhour M, Noftech-Mozes S, et al. P16ink4a expression in undifferentiated carcinoma of the uterus does not exclude its endometrial origin. Int J Gynecol Pathol 2012; 31(1): 57-65.
85. Rosa-Rosa JM, Leskelä S, Cristóbal-Lana E, et al. Molecular genetic heterogeneity in undifferentiated endometrial carcinomas. Mod Pathol 2016; 29(11): 1390-1398.
86. Ramalingam P, Masand RP, Euscher ED, Malpica A. Undifferentiated carcinoma of the endometrium: An expanded immunohistochemical analysis including pax-8 and basal-like carcinoma surrogate markers. Int J Gynecol Pathol 2016; 35(5): 410-418.
87. Onder S, Taskin OC, Sen F, et al. High expression of sall4 and fascin, and loss of e-cadherin expression in undifferentiated/dedifferentiated carcinomas of the endometrium: An immunohistochemical and clinicopathologic study. Medicine (Baltimore) 2017; 96(10): e6248.
88. Li A, Jiao Y, Yong KJ, et al. Sall4 is a new target in endometrial cancer. Oncogene 2015; 34(1): 63-72.
89. Liu L, Zhang J, Yang X, et al. Sall4 as an epithelial-mesenchymal transition and drug resistance inducer through the regulation of c-myc in endometrial cancer. PLoS One 2015; 10(9): e0138515.
90. Li Z, Zhao C. Clinicopathologic and immunohistochemical characterization of dedifferentiated endometrioid adenocarcinoma. Appl Immunohistochem Mol Morphol 2016; 24(8): 562-568.
91. Lac V, Nazeran TM, Tessier-Cloutier B, et al. Oncogenic mutations in histologically normal endometrium: The new normal? J Pathol 2019; 249(2): 173-181.
92. Kolin DL, Quick CM, Dong F, et al. Smarca4-deficient uterine sarcoma and undifferentiated endometrial carcinoma are distinct clinicopathologic entities. Am J Surg Pathol 2020; 44(2): 263-270.
93. Kobel M, Piskorz AM, Lee S, et al. Optimized p53 immunohistochemistry is an accurate predictor of tp53 mutation in ovarian carcinoma. J Pathol Clin Res 2016; 2(4): 247-258.
94. Karnezis AN, Hoang LN, Coatham M, et al. Loss of switch/sucrose non-fermenting complex protein expression is associated with dedifferentiation in endometrial carcinomas. Mod Pathol 2016; 29(3): 302-314.
95. Hoang LN, Lee YS, Karnezis AN, et al. Immunophenotypic features of dedifferentiated endometrial carcinoma - insights from brg1/ini1-deficient tumours. Histopathology 2016; 69(4): 560-569.
96. Hacking S, Jin C, Komforti M, Liang S, Nasim M. Mmr deficient undifferentiated/dedifferentiated endometrial carcinomas showing significant programmed death ligand-1 expression (sp 142) with potential therapeutic implications. Pathol Res Pract 2019; 215(10): 152552.
97. Espinosa I, Lee CH, D’angelo E, Palacios J, Prat J. Undifferentiated and dedifferentiated endometrial carcinomas with pole exonuclease domain mutations have a favorable prognosis. Am J Surg Pathol 2017; 41(8): 1121-1128.
98. Abeler VM, Kjørstad KE, Nesland JM. Undifferentiated carcinoma of the endometrium. A histopathologic and clinical study of 31 cases. Cancer 1991; 68(1): 98-105.
99. Kihara A, Amano Y, Matsubara D, et al. Brg1, ini1, and arid1b deficiency in endometrial carcinoma: A clinicopathologic and immunohistochemical analysis of a large series from a single institution. Am J Surg Pathol 2020;
100. Pan XY, Li X, Che YC, et al. Overexpression of claudin-4 may be involved in endometrial tumorigenesis. Oncol Lett 2013; 5(4): 1422-1426.
101. Tamura T, Jobo T, Watanabe J, Kanai T, Kuramoto H. Neuroendocrine features in poorly differentiated endometrioid adenocarcinomas of the endometrium. Int J Gynecol Cancer 2006; 16(2): 821-826.
102. Alkushi A, Irving J, Hsu F, et al. Immunoprofile of cervical and endometrial adenocarcinomas using a tissue microarray. Virchows Arch 2003; 442(3): 271-277.
103. Fadare O, Parkash V, Dupont WD, et al. The diagnosis of endometrial carcinomas with clear cells by gynecologic pathologists: An assessment of interobserver variability and associated morphologic features. Am J Surg Pathol 2012; 36(8): 1107-1118.
104. Han G, Soslow RA, Wethington S, et al. Endometrial carcinomas with clear cells: A study of a heterogeneous group of tumors including interobserver variability, mutation analysis, and immunohistochemistry with hnf-1beta. Int J Gynecol Pathol 2015; 34(4): 323-333.
105. Salibay C, Fadare O. High-grade endometrioid carcinoma of the endometrium with a gata-3-positive/pax8-negative immunophenotype metastatic to the breast: A potential diagnostic pitfall. Int J Surg Pathol 2020; 28(6): 631-636.
106. Zhang L, Cai Z, Ambelil M, Conyers J, Zhu H. Mesonephric adenocarcinoma of the uterine corpus: Report of 2 cases and review of the literature. Int J Gynecol Pathol 2019; 38(3): 224-229.
107. Mcfarland M, Quick CM, Mccluggage WG. Hormone receptor-negative, thyroid transcription factor 1-positive uterine and ovarian adenocarcinomas: Report of a series of mesonephric-like adenocarcinomas. Histopathology 2016; 68(7): 1013-1020.
108. Hoang LN, Mcconechy MK, Kobel M, et al. Histotype-genotype correlation in 36 high-grade endometrial carcinomas. Am J Surg Pathol 2013; 37(9): 1421-1432.
109. Thomas S, Hussein Y, Bandyopadhyay S, et al. Interobserver variability in the diagnosis of uterine high-grade endometrioid carcinoma. Arch Pathol Lab Med 2016; 140(8): 836-843.
110. Murali R, Davidson B, Fadare O, et al. High-grade endometrial carcinomas: Morphologic and immunohistochemical features, diagnostic challenges and recommendations. Int J Gynecol Pathol 2019; 38 Suppl 1: S40-S63.
111. Gilks CB, Oliva E, Soslow RA. Poor interobserver reproducibility in the diagnosis of high-grade endometrial carcinoma. Am J Surg Pathol 2013; 37(6): 874-881.
112. Gatius S, Matias-Guiu X. Practical issues in the diagnosis of serous carcinoma of the endometrium. Mod Pathol 2016; 29 Suppl 1: S45-58.
113. Coosemans A, Moerman P, Verbist G, et al. Wilms’ tumor gene 1 (wt1) in endometrial carcinoma. Gynecol Oncol 2008; 111(3): 502-508.
114. Yamamoto S, Tsuda H, Aida S, et al. Immunohistochemical detection of hepatocyte nuclear factor 1beta in ovarian and endometrial clear-cell adenocarcinomas and nonneoplastic endometrium. Hum Pathol 2007; 38(7): 1074-1080.
115. Kobel M, Meng B, Hoang LN, et al. Molecular analysis of mixed endometrial carcinomas shows clonality in most cases. Am J Surg Pathol 2016; 40(2): 166-180.
116. Sholl AB, Aisner DL, Behbakht K, Post MD. Novel tp53 gene mutation and correlation with p53 immunohistochemistry in a mixed epithelial carcinoma of the endometrium. Gynecol Oncol Case Rep 2012; 3 : 11-13.
117. Heatley MK. Wt-1 in ovarian and endometrioid serous carcinoma: A meta-analysis. Histopathology 2005; 46(4): 468.
118. Mccluggage WG. Wt1 is of value in ascertaining the site of origin of serous carcinomas within the female genital tract. International Journal of Gynecological Pathology 2004; 23(2): 97-99.
119. Hirschowitz L, Ganesan R, Mccluggage WG. Wt1, p53 and hormone receptor expression in uterine serous carcinoma. Histopathology 2009; 55(4): 478-482.
120. Nofech-Mozes S, Khalifa MA, Ismiil N, et al. Immunophenotyping of serous carcinoma of the female genital tract. Modern Pathol 2008; 21(9): 1147-1155.
121. Kobel M, Kalloger SE, Carrick J, et al. A limited panel of immunomarkers can reliably distinguish between clear cell and high-grade serous carcinoma of the ovary. American Journal of Surgical Pathology 2009; 33(1): 14-21.
122. Celik B, Bulut T, Yalcin AD. Tissue he4 expression discriminates the ovarian serous carcinoma but not the uterine serous carcinoma patients. A new adjunct to the origin of the tumor site. Pathol Oncol Res 2020; 26(2): 1145-1151.
123. Coatham M, Li X, Karnezis AN, et al. Concurrent arid1a and arid1b inactivation in endometrial and ovarian dedifferentiated carcinomas. Mod Pathol 2016; 29(12): 1586-1593.
124. Stewart CJ, Crook ML. Swi/snf complex deficiency and mismatch repair protein expression in undifferentiated and dedifferentiated endometrial carcinoma. Pathology 2015; 47(5): 439-445.
125. Espinosa I, De Leo A, D’angelo E, et al. Dedifferentiated endometrial carcinomas with neuroendocrine features: A clinicopathologic, immunohistochemical, and molecular genetic study. Hum Pathol 2018; 72 : 100-106.
126. Pocrnich CE, Ramalingam P, Euscher ED, Malpica A. Neuroendocrine carcinoma of the endometrium: A clinicopathologic study of 25 cases. Am J Surg Pathol 2016; 40(5): 577-586.
127. Le Gallo M, Rudd ML, Urick ME, et al. Somatic mutation profiles of clear cell endometrial tumors revealed by whole exome and targeted gene sequencing. Cancer 2017; 123(17): 3261-3268.
128. Jin C, Hacking S, Liang S, Nasim M. Pd-l1/pd-1 expression in endometrial clear cell carcinoma: A potential surrogate marker for clinical trials. Int J Surg Pathol 2020; 28(1): 31-37.
129. Kobel M, Tessier-Cloutier B, Leo J, et al. Frequent mismatch repair protein deficiency in mixed endometrioid and clear cell carcinoma of the endometrium. Int J Gynecol Pathol 2017; 36(6): 555-561.
130. Hoang LN, Mcconechy MK, Meng B, et al. Targeted mutation analysis of endometrial clear cell carcinoma. Histopathology 2015; 66(5): 664-674.
131. Fadare O, Roma AA, Parkash V, Zheng W, Walavalkar V. Does a p53 “wild-type” immunophenotype exclude a diagnosis of endometrial serous carcinoma? Adv Anat Pathol 2018; 25(1): 61-70.
132. Kobel M, Ronnett BM, Singh N, et al. Interpretation of p53 immunohistochemistry in endometrial carcinomas: Toward increased reproducibility. Int J Gynecol Pathol 2019; 38 Suppl 1: S123-S131.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2021 Issue 2-
All articles in this issue
- Novinky v gynekopatologii
- Patologové by měli mít větší prostor pro popularizaci svého oboru
- ′ NEUROPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ UROPATOLOGIE
- ′ KARDIOPATOLOGIE
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ ENDOKRINOPATOLOGIE
- ′ CYTODIAGNOSTIKA
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- The value of immunohistochemical methods in diagnosing endometrial carcinoma
- The value of immunohistochemical methods in diagnosing mesenchymal tumours of the uterus
- Gynecological lesions in hereditary cancer predisposition syndromes
- Case report: Gaucher disease in trepanobiopsy of 16yo woman examined for suspected myelodysplastic syndrome
- Renal involvement of a patient with Crohn´s disease: A case report
- Vilém Dušan Lambl in the Imperial University of Kharkiv (Charkov) (1861–1871): biography outlines
- Prof. MUDr. Rostislav Koďousek, Dr.Sc. in memoriam
- Spomienka na emeritného primára MUDr. Jozefa Maťošku, CSc.
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The value of immunohistochemical methods in diagnosing endometrial carcinoma
- Gynecological lesions in hereditary cancer predisposition syndromes
- Renal involvement of a patient with Crohn´s disease: A case report
- The value of immunohistochemical methods in diagnosing mesenchymal tumours of the uterus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

