-
Medical journals
- Career
Transplantace plic v České republice – z pohledu patologa
Authors: Mária Chadimová 1; Daniela Kodetová 1; Robert Lischke 2; Jan Šimonek 2; Jiří Pozniak 2; Pavel Pafko 2
Authors‘ workplace: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 1; 3. chirurgická klinika 1. LF UK a FN Motol, Praha 2
Published in: Čes.-slov. Patol., 51, 2015, No. 4, p. 175-180
Category: Reviews Article
Overview
Transplantace plic se stala v ČR standardním terapeutickým výkonem u některých pacientů v terminálním stádiu plicních onemocnění. Na 3. chirurgické klinice 1. LF UK a FN Motol v Praze byla od prosince r. 1997 do konce listopadu 2014 provedena transplantace plic u 246 pacientů. Nejčastějšími indikacemi pro transplantaci byly chronická obstrukční plicní nemoc u 39,4 % pacientů, idiopatická plicní fibróza u 28,9 % a cystická fibróza u 19,1 % pacientů.
Pro sledování pacientů po transplantaci plic je důležitá transbronchiální biopsie. Biopsie pomáhá odhalit akutní celulární rejekci, kterou jsme nalezli u 63 % pacientů. U pacientů s akutní celulární rejekcí mírného a středního stupně se po antirejekční terapii stav zlepšil a stabilizoval. U 3 pacientů vedla těžká rejekce k šokovým změnám v plicích a respiračnímu selhání. Humorální rejekci nelze stanovit pouze z biopsie. Histologický obraz kapilaritidy a lineární vazba C4d frakce komplementu na kapiláry je nekonstantní a není patognomický. Klasifikace chronické rejekce, které odpovídá bronchiolitis obliterans, je v biopsii omezená pro obtížnost zastižení bronchiolů. Záchyt bronchiolitis obliterans byl v našem souboru proto pouze u 3,7 % pacientů.
Od první transplantace do konce námi sledovaného období přežívá 109 pacientů (44,3 %). Jeden rok po transplantaci žije cca 90 % pacientů, 3 roky 70,9 % pacientů a po 5 let žije 69,1 % pacientů. Pitva na našem ústavu byla provedena u 79 zemřelých po transplantaci. Nejčastější příčinou úmrtí byly infekce mykotické (aspergilóza, kandidóza), bakteriální (Klebsiela, Pseudomonas aeruginosa, Burkholderia cepacia) s následnou sepsí a infekce virové (CMV, varicella zoster). Při pitvě byla chronická rejekce s bronchiolotis obliterans zastižena u 13 pacientů a vedla k chronickému respiračnímu selhání, které bylo často komplikováno infekcí. Z nádorových onemocnění převažovaly jako příčiny smrti generalizované karcinomy.
Naše výsledky jsou srovnatelné s ostatními pracovišti provádějícími transplantaci plic ve světě.Klíčová slova:
transplantace plic – transbronchiální biopsie – akutní rejekce – humorální rejekce – chronická rejekce – infekce – nádorové onemocněníHISTORIE
Transplantace plic (TxP) je jedinou a poslední terapeutickou metodou u některých pacientů v terminálním stadiu plicního onemocnění nebo u plicních vaskulárních chorob. První úspěšnou transplantaci jedné plíce provedl v roce 1963 Američan James Hardy (1). Operovaný 58letý pacient přežil 18 dní. Následovalo 20 let ojedinělých a neúspěšných pokusů. Až v roce 1983 transplantační skupina z Toronta provedla úspěšnou transplantaci jedné plíce. Stejná skupina o tři roky později publikovala úspěšnou transplantaci obou plic en-bloc (tracheální anastomózou) (2). V roce 1989 skupina z Washingtonské univerzity provedla první úspěšnou sekvenční transplantaci obou plic, kdy je během výkonu nejdříve transplantováno jedno a pak druhé plicní křídlo. Tato technika se v uplynulých 10 letech nezměnila. Další historicky významnou událostí byla první úspěšná TxP od dárce s nebijícím srdcem v roce 2001 ve Švédsku (3).
V České republice byl transplantační program zahájen v roce 1997 na 3. chirurgické klinice 1. LF UK a FN Motol v Praze. První jednostranná transplantace plic byla provedena u pacienta s exogenní alergickou alveolitidou 21. 12. 1997 (4) a první bilaterální transplantace u pacientky s chronickou obstrukční plicní nemocí (CHOPN) 23. 7. 1998 (5). Nyní se v České republice provádí kolem 30 transplantací ročně s výsledky srovnatelnými s ostatními vyspělými centry. Do konce listopadu 2014 bylo v České republice provedeno 246 transplantací plic.
INDIKACE A KONTRAINDIKACE TxP
K transplantaci plic jsou indikováni pacienti s plicním onemocněním v jeho terminálním stádiu (6).
Kritéria indikace k TxP: Konečné stádium chronického onemocnění plic s vyčerpanými konzervativními léčebnými možnostmi, u nichž je očekávaná doba přežití snížená, ale je vyšší než předpokládaná doba strávená čekáním na vhodný orgán na čekací listině (12 – 18 měsíců). Jedná se o pacienty s chybějící kvalitou života, kteří jsou závislí na kyslíku a stávají se imobilními.
Základní onemocnění, pro které je transplantace indikována:
- CHOPN
- Emfyzém při alfa-1-antitrypsin deficienci
- Idiopatická plicní fibróza (UIP) a nespecifická intersticiální pneumonie (NSIP), exogenní alergická alveolitida (EAA)
- Sarkoidóza
- Lymfangioleiomyomatóza
- Granulomatóza z Langerhansových buněk (histiocytóza X)
- Plicní fibróza spojená se systémovým onemocněním (sklerodermie, revmatoidní artritida, onemocnění pojivové tkáně).
- Cystická fibróza (CF)
- Bronchiektázie
- Idiopatická plicní hypertenze
- Nádory plic
- Retransplantace u chronické rejekce, bronchiolitis obliterans
Absolutní kontraindikace:
- Malignita, kdy k transplantaci mohou být indikováni pacienti po 5 letech bez známek relapsu, výjimku tvoří kožní dlaždicový karcinom a bazaliom
- Neléčitelné selhání dalšího významného orgánového systému
- Ischemická choroba srdeční s významně sníženou ejekční frakcí levé komory
- Neléčitelná systémová infekce (např. hepatitida B, C, HIV)
- Významná hrudní či páteřní deformita
- Nespolupráce pacienta
- Neléčitelné psychiatrické onemocnění
- Absence sociálního zázemí
- Závislost (kouření, alkohol, drogy atd.)
Relativní kontraindikace:
- Věk nad 65 let
- Kritický či nestabilní klinicky těžký funkční stav s malým rehabilitačním potenciálem
- Kolonizace multirezistentními či vysoce virulentními mikroorganizmy
- Těžká obezita
- Těžká osteoporóza
- Těžké systémové onemocnění, nebo progresivní neuromuskulární onemocnění
- Ostatní přidružená onemocnění, která nevyplývají z terminální fáze orgánového poškození (např. diabetes mellitus, arteriální hypertenze, aj.)
Počet provedených transplantací je limitován počtem dárců. Při multiorgánovém odběru jsou plíce orgánem, který je možné akceptovat pouze v 15 – 20 %. Hlavními důvody, pro které nelze plíce použít, jsou plicní infekce, jež jsou důsledkem dlouhodobé umělé plicní ventilace dárce, a trauma hrudníku. Z obecného hlediska je k TxP vhodná plíce se zachovalou funkcí, velikostí odpovídající hrudníku příjemce, kompatibilní v systému AB0.
U TxP se neprovádí typizace HLA antigenů, provádí se pouze typizace krevních skupin a předoperační screening na protilátky (panel-reactive antibodies).
Dnes se provádějí dva typy chirurgického výkonu transplantace, a to jednostranná nebo bilaterální sekvenční TxP. V poslední době převažují bilaterální transplantace plic, které se provádějí hlavně u mladých pacientů. Další možností je transplantace pouze plicního laloku malému příjemci, kde anatomické poměry nedovolují transplantovat celou plíci.
Úspěch nekomplikovaného potransplantačního přežívaní pacientů je v optimalizaci strategie imunosupresivní terapie. Ta je založena na indukční terapii, udržovací imunosupresi a léčbě akutní a chronické rejekce. Indukční terapie spočívá v podávání antilymfocytárních protilátek nebo monoklonálních protilátek proti interleukinu-2 receptoru. Udržovací dávky imunosuprese jsou v kombinaci zahrnující kalcineurinový inhibitor - cyklosporin A (CyA), inhibitor buněčného cyklu a steroidy. V posledních letech je trend používat takrolimus místo CyA, neboť studie ukazují, že takrolimus u pacientů sníží četnost epizod akutní rejekce, ale i bronchiolitis obliterans (7). Stejně jako imunosupresivní protokol je vytvořen protokol antiinfekční profylaxe ve spolupráci s mikrobiology.
KOMPLIKACE TxP
Časné komplikace operačního výkonu jsou krvácení, bronchiální dehiscence a píštěle. Nejčastější pozdní komplikací operace jsou stenózy bronchiálních anastomóz, postischemické stenózy dýchacích cest.
Potransplantační období pacientů významně ovlivňují rejekce štěpu a nerejekční komplikace, zejména infekce. Výskyt hyperakutní rejekce je minimalizován předoperačním vyšetřením cross-match testu, jehož cílem je detekovat v séru příjemce protilátky namířené proti HLA antigenům dárce. HLA protilátky mohou být přítomny u pacientů, po transfuzích, u re-transplantací nebo po těhotenství. Studie mnoha transplantačních center sledují dynamiku vývoje de-novo HLA protilátek u pacientu po TxP, které zvyšují riziko vzniku humorální rejekce (HR), lymfocytární bronchiolitidy a účastní se patogeneze vzniku bronchiolitis obliterans (8-10).
Rejekce
Standardizace klasifikace rejekčních změn z morfologického hlediska je důležitá pro mezinárodní spolupráci transplantačních týmů a vzhledem k následné strategii terapie. V roce 1990 stanovila International Society for Heart and Lung Transplantation (ISHLT) první klasifikační schéma, které revidovala mezinárodní skupina patologů v roce 1996 v Pittsburgu (11). Diagnóza akutní celulární rejekce (ACR) byla stanovena na základě perivaskulární a intersticiální monocelulární infiltrace včetně postižení cév s obrazem endotelitidy. Každý grade určuje i koexistenci rejekční infiltrace bronchiolů a její intenzitu. Rejekční infiltrát tvoří antigen stimulované T-lymfocyty, převážně z CD4+ a CD8+ lymfocytů, s příměsí plazmocytoidních buněk, makrofágů a eozinofilů. V poměru CD4/CD8 lymfocytů se zvyšuje četnost cytotoxických lymfocytů se stoupajícím gradem rejekce (12). Chronickou rejekci (CHR) reprezentuje bronchiolitis obliterans (BO), s/nebo bez rejekční infiltrace (13), dále fibróza cévní stěny s obrazem akcelerované arteriální, nebo venózní sklerózy. BO je častou příčinou úmrtí po prvním roce transplantace plic. Její incidence se během prvních 5 let pohybuje mezi 43 – 80 %. Obstrukce bronchů je ireverzibilní, neodpovídá na bronchodilatační léčbu a vede k dysfunkci štěpu. Histologicky je BO diagnostikována jen v malém procentu případů a klinická diagnóza bronchiolitis obliterans syndromu (BOS) se stanovuje při trvalém poklesu plicních funkcí a po vyloučení jiných komplikací jako je akutní celulární rejekce, stenózy bronchiálních anastomóz, infekce (6).
Revize gradingu akutní a chronické rejekce se uskutečnila v roce 2006 pod vedením ISHLT (tab. 1), s doporučením zaměřit se i na sledování a hodnocení humorální rejekce (HR) (14). Pro diagnózu HR TxP není specifický morfologický obraz. Stanovená diagnostická kritéria HR zahrnují serologický průkaz protilátek, klinické zhoršení funkce štěpu a histologický nález kapilaritidy s neutrofily, současně s vazbou C4d frakce komplementu na stěny kapilár. Nález pouhé kapilaritidy s neutrofily může být způsoben poškozením kapilár, např. u infekcí nebo difúzního alveolárního poškození, a jde o nespecifický nález (15). Také samotný průkaz vazby C4d na kapiláry, pomocí imufluorescenčního nebo imunohistochemického vyšetření v TBB, není konstantní a nelze ho proto pokládat za senzitivní marker HR u TxP (16-18). Stanovení morfologické klasifikace a kriterií HR u TxP vyžaduje další studie.
Table 1. Klasifikace a grading akutní a chronické rejekce u TxP, ISHLT, 2007. 
TxP – transplantace plic ISHLT – International Society for Heart and Lung Transplantation Infekce
Představují nejčastější nerejekční komplikace v potransplantačním období. V prvním měsíci po transplantaci se vyskytují nozokomiální infekce, infekce způsobené předchozí kolonizací příjemce a vzácně infekce původem od dárce. Od půl roku po TxP se zvyšuje výskyt infekcí komunitních (6). Spektrum patogenů zahrnuje především bakterie, viry a mykózy. Nejčastější infekční komplikace je bakteriální pneumonie asi u 10 % pacientů a z virových onemocnění CMV-pneumonie v časném potransplantačním období. CMV infekce je současně i rizikovým faktorem pro rozvoj BO (19). Z mykotických infekcí jsou nejčastější aspergilóza a kandidóza.
Maligní nádorové onemocnění
Incidence maligního nádorového onemocnění po TxP se v podstatě shoduje s výskytem malignit po transplantaci ostatních organů. Potransplantační lymfoproliferativní onemocnění (PTLD), Kaposiho sarkom, karcinomy kůže, jater, ledvin a plic se vyskytují v jakémkoli časovém období po transplantaci (20). Rizikový faktor pro vznik plicního karcinomu po TxP je anamnéza kouření u dárce s následnou imunosupresí po transplantaci (21).
RETRANSPLANTACE
Re-TxP se provádí v případě časného selhání štěpu, nebo pokročilého stádia chronické rejekce. Výsledky jsou horší ve srovnání s primární TxP, v průměru jen cca 45 % pacientů přežívá 1 rok po re-TxP.
NAŠE ZKUŠENOSTI s TxP v ČR v r. 1997-2014
Na 3. chirurgické klinice 1. LF UK a FN Motol byla od roku 1997 do konce roku 2014 provedena TxP u 246 pacientů; žen bylo 96, mužů 150. Nejstaršímu pacientovi bylo 71 let, nejmladší pacientce 13 let. Indikace k TxP v našem souboru jsou uvedeny v tab. 2.
Table 2. Diagnózy k indikaci TxP v našem souboru. 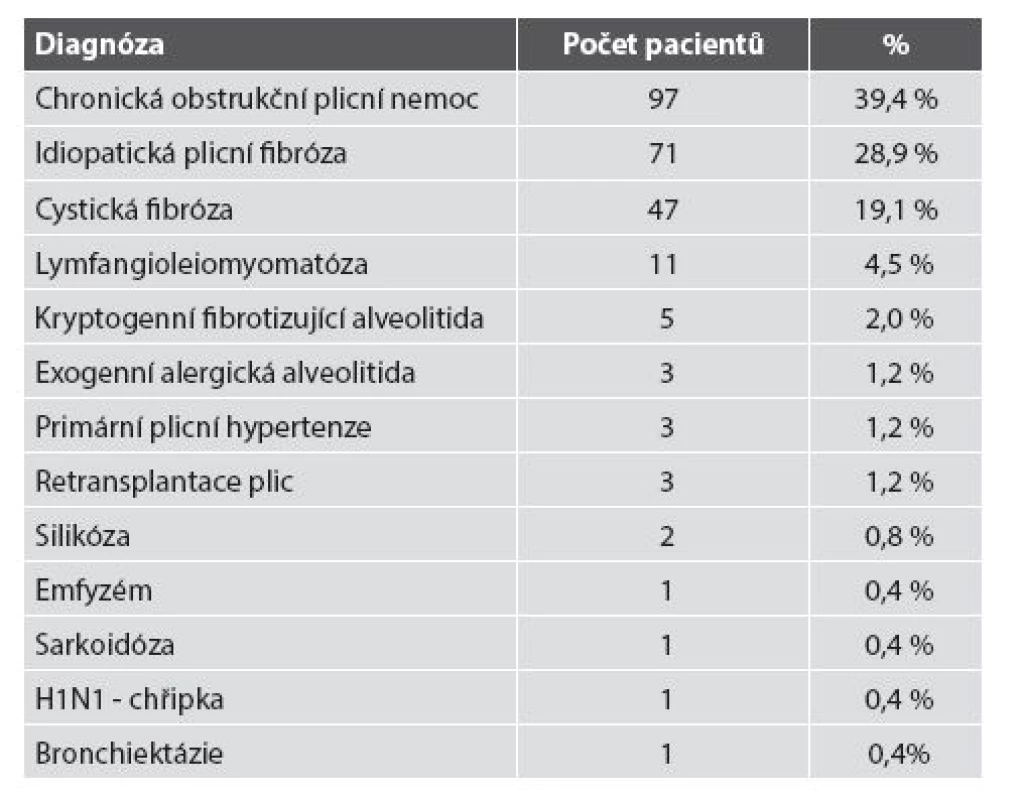
TxP – transplantace plic Transplantace pouze levé plíce byla provedena u 65 pacientů, pouze pravé plíce u 34 pacientů. Oboustranná transplantace byla uskutečněna ve 147 případech. Jednostranné transplantace plic se prováděly spíše v prvních letech transplantačního programu. V současné době jsou prováděny převážně oboustranné sekvenční TxP a transplantace jedné plíce spíše výjimečně. Důvodem je, že např. u pacientů s CHOPN je při jednostranné transplantaci riziko hyperinflace nativní plíce s útlakem štěpu nebo mohou být stav pacienta a funkce plic ovlivněny původním onemocněním nativní plíce.
Transbronchiální biopsie (TBB)
Po transplantaci jsou pacienti monitorováni a biopticky pravidelně kontrolováni. Pro hodnocení ACR je důležité histologické vyšetření plicní tkáně TBB. Protokolární TBB se provádějí pravidelně měsíc po transplantaci, nejčastěji ještě za hospitalizace pacienta a v průběhu prvního roku po TxP po třech měsících, po půl roce a po roce, a pak, pokud se objeví zhoršení plicních funkcí a je podezření na rejekci. Vzhledem k tomu, že změny bývají často fokální, je nutné odebraný materiál vždy pečlivě prokrájet. Pro správné hodnocení plicního parenchymu je nutný odběr alespoň 5 částek tkáně. V biopsii se hodnotí především zánětlivé změny a známky rejekce. Tkáň je vždy vyšetřena v barvení hematoxylinem eozinem, trichromem, barvením PAS a na elastiku. Pro průkaz celulární rejekce je vyšetření doplněno imunohistochemickým vyšetřením s protilátkami CD20, CD45RO, CD4, CD8, CD56 a CD68, které pomáhají odhalit i minimální lymfocytární infiltráty. Imunofluorescenční vyšetření C4d frakce komplementu se provádí sporadicky při podezření na humorální rejekci ze zmraženého materiálu. Pro průkaz infekčních agens se používá metoda PAS a Grocott. U virové infekce, nejčastěji CMV, se doplňuje histologie imunohistochemickým vyšetřením s příslušnou protilátkou. Vzhledem k tomu, že se při TBB jedná o limitovaný materiál milimetrových rozměrů, nepodaří se často zastihnout bronchiolus, a proto hodnocení bronchiální akutní nebo chronické rejekce je možné pouze u malého procenta případů.
Četnost rejekčních epizod a jejich klasifikace v našem souboru je uvedena v tab. 3. Z nálezů je zřejmé, že maximum zastižených změn odpovídalo ACR grade A. Zastižení bronchiálních změn v TBB bylo spíše vyjimečné a to jak akutní celulární bronchiální rejekce, tak chronické rejekce typu BO. Stav pacientů s ACR grade A1 (obr. 1), grade A2, A3 (obr. 2,3) se po antirejekční terapii zlepšil a stabilizoval. Ve dvou případech střední a těžké ACR (obr. 4, obr. 5) byl stav komplikován infekcí - u jednoho pacienta byla diagnostikovaná CMV, u druhého acinonodózní tuberkulóza, a oba pacienti zemřeli. BO (obr. 6) jsme v TBB zastihli pouze u 9 případů, u 3 z nich byla provedena re-TxP. Imunofluorescenční vyšetření vazby C4d frakce komplementu jsme provedli u 20 pacientů a ani u jednoho vyšetření jsme neprokázali difuzní linearitu kapilár. Pouze u 4 pacientů jsme zaznamenali nesignifikantní fokální pozitivitu intimy arteriol s negativitou kapilár. U těchto pacientů byl současně nález ACR mírného, nebo středního stupně. U jednoho pacienta byl nález C4d s lineární pozitivitou nečetných kapilár interalveolárních sept. V histologickém obraze tohoto pacienta byla současně ACR grade A3 s endotelitidou bez známek kapilaritidy. Stav pacientů se po antirejekční léčbě a protizánětlivé profylaxe zlepšil a stabilizoval. Také zánětlivé komplikace byly v TBB zachyceny spíše výjimečně, dvakrát byla diagnostikovaná mykotická infekce, jednou tuberkulóza a třikrát cytomegalovirová infekce.
Table 3. Hodnocení rejekce u 246 pacientů po TxP v našem souboru. 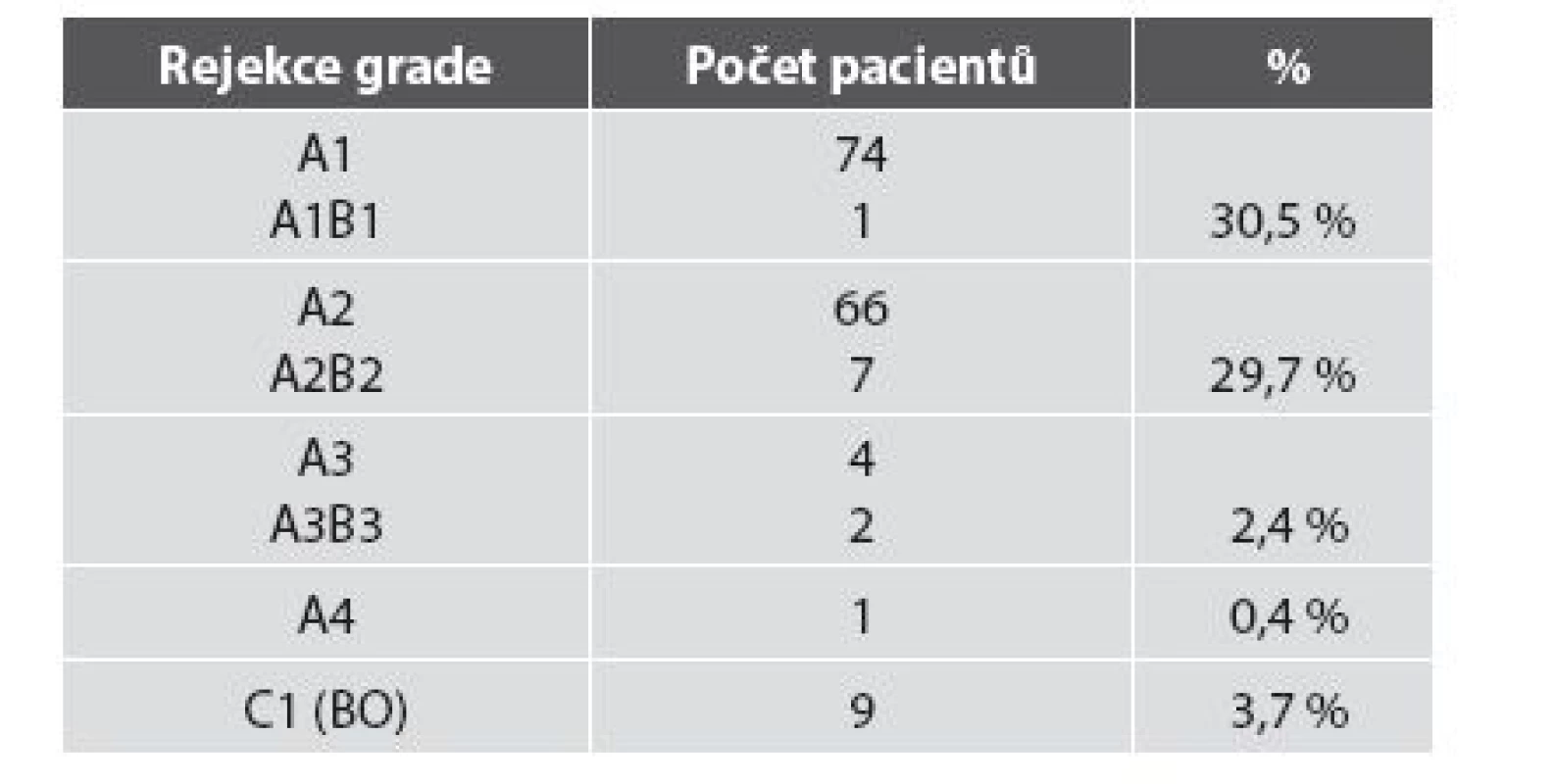
TxP – transplantace plic BO – bronchiolitis obliterans Image 1. Minimální akutní celulární rejekce, grade A1 (HE, x 400). 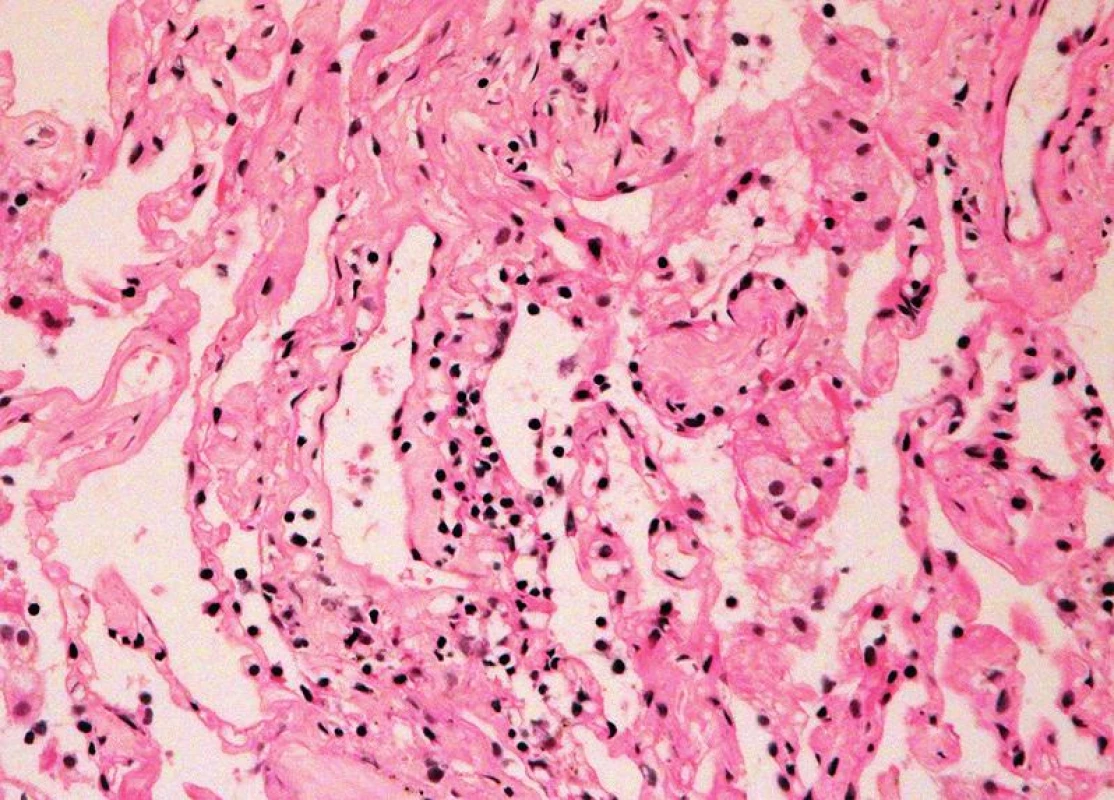
Image 2. Mírná akutní celulární rejekce, grade A2: perivaskulární infiltrát z aktivovaných lymfocytů, plazmocytoidních buněk a makrofágů (HE, x 400). 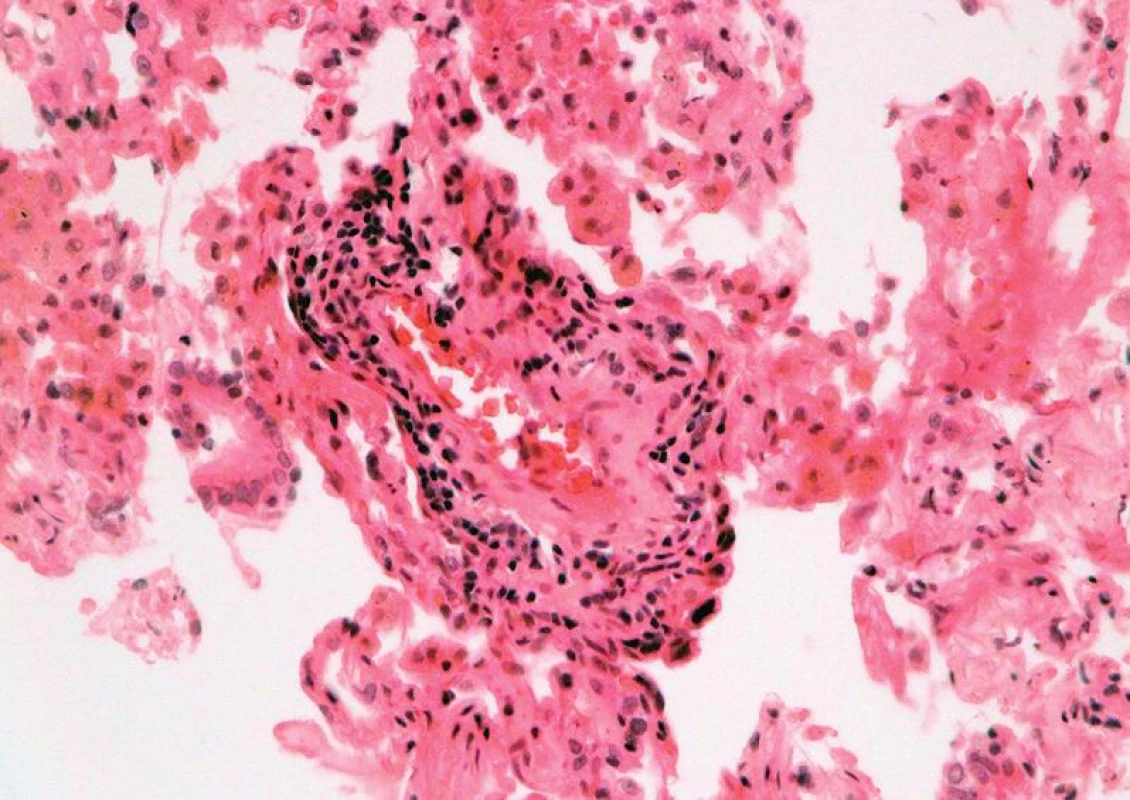
Image 3. Střední akutní celulární rejekce, grade A3: perivaskulární rejekční infiltráty šířící se do interalveolárních sept okolního parenchymu (HE, x 400). 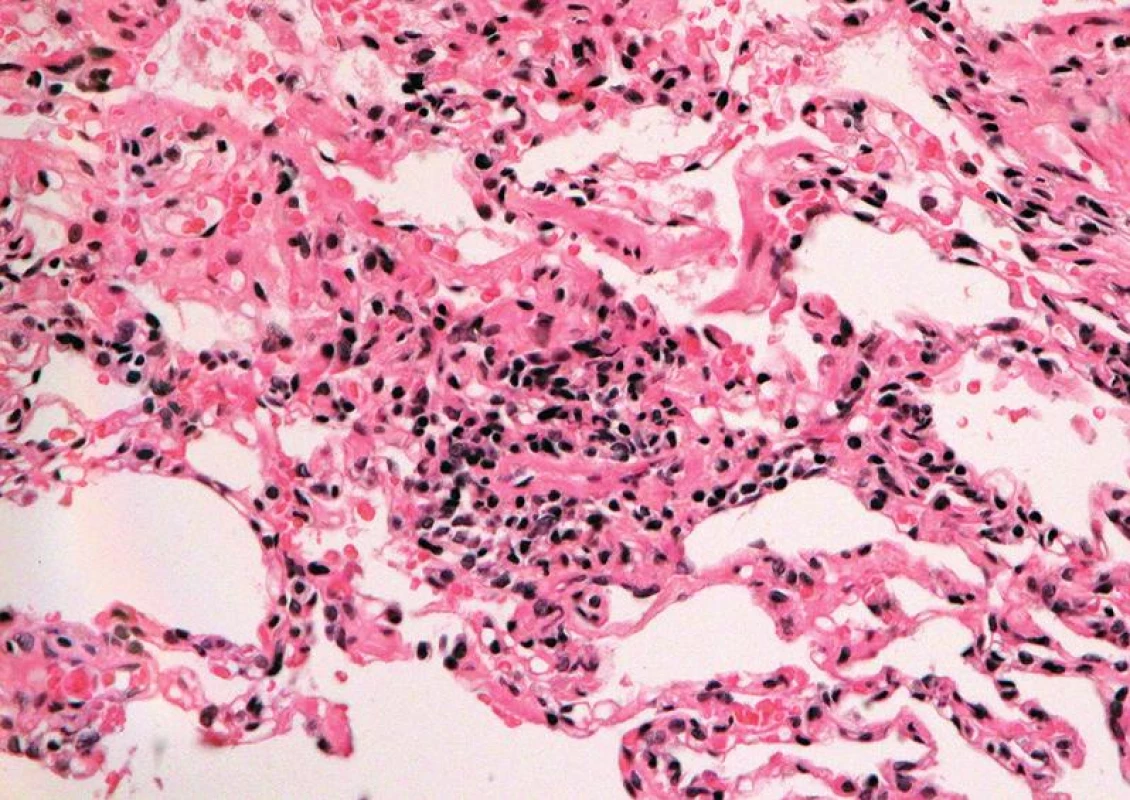
Image 4. Těžká akutní celulární rejekce, grade A4: difuzní rejekční celulizace s regresí až nekrózou pneumocytů, s fibrinem intraalveolárně (HE, x 400). 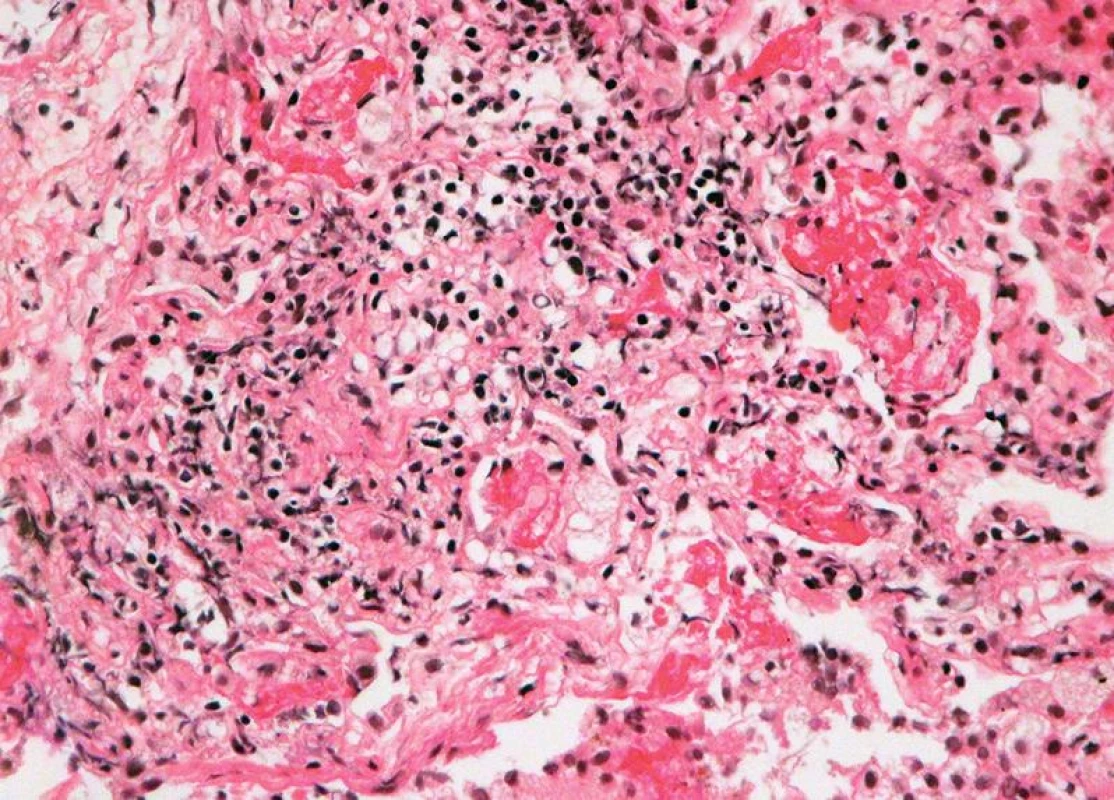
Image 5. Endotelitis s regresí endotelu a rejekční celulizaci intimy (HE, x 400). 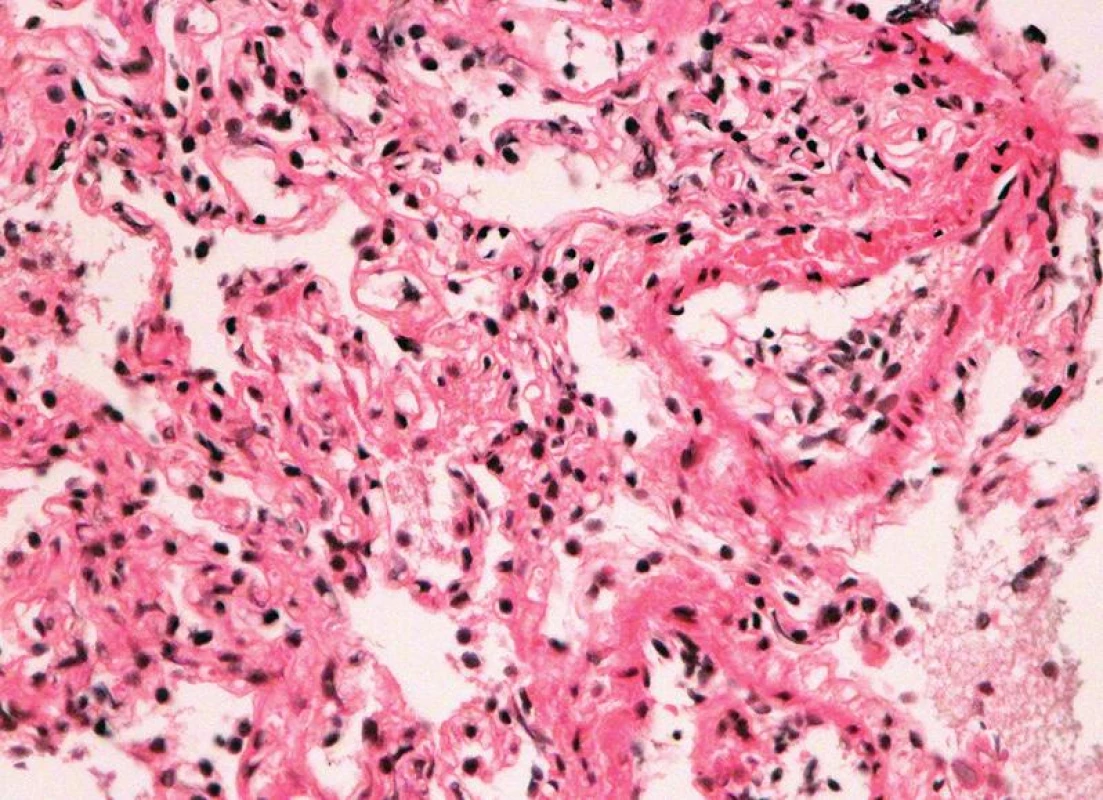
Image 6. Chronická rejekce, grade C1, bronchiolitis obliterans (HE, x 400). 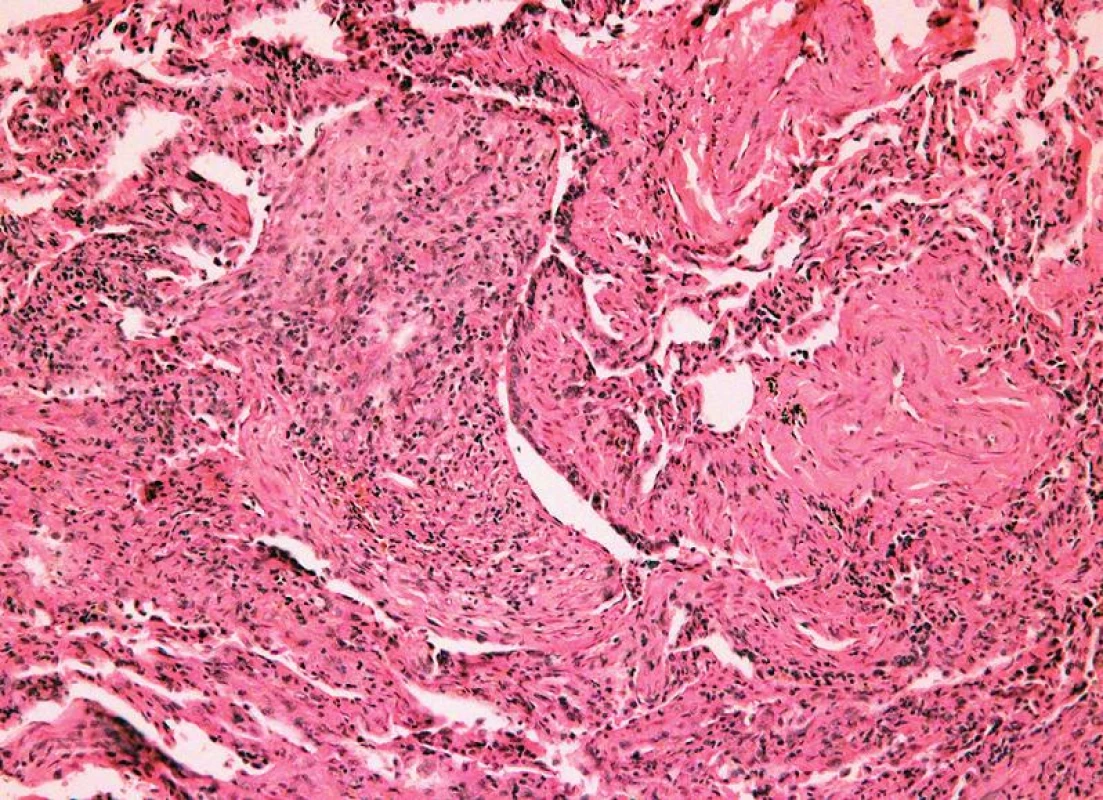
Celkem 137 (55,6 %) pacientů po TxP zemřelo. Pitva byla na našem pracovišti provedena v 79 případech. Časné komplikace, které vedly k úmrtí pacientů, byly dvakrát reperfúzní edém plic. Pacienti zemřeli 5 a 7 dnů po transplantaci. U 6 pacientů se objevily komplikace v podobě poruchy koagulace a to buď embolie nebo krvácení do hrudní dutiny případně pneumorhagie. Jeden pacient zemřel na infarkt myokardu. Chirurgické komplikace byly při pitvě zjištěny pouze ve 4 případech. U dvou pacientů byly zastiženy stenózy bronchů, u jednoho pacienta stenóza a. pulmonalis a u jednoho stenóza plicních žil. Nejčastější příčinou úmrtí byly infekční komplikace. Mykotická pneumonie v 19 případech – nejčastěji byl prokázán Aspergillus, dvakrát Candida a v jednom případě mucormykóza. U 6 pacientů byla nalezena infekce CMV, v jednom případě varicella zoster a virus influenza H1N1. Při bakteriálních infekcích byly nalezeny klebsiely, Pseudomonas aeruginosa a infekce Burkholderia cepacia, které komplikovaly pooperační průběh u pacientů s CF. Dvakrát byla příčinou úmrtí tuberkulóza. Infekční komplikace byly často provázeny septickým stavem.
Známky ACR byly při pitvě zjištěny u 13 pacientů, z toho ve 3 případech byly těžšího stupně a vedly v plicích k rozvoji hyalinních blanek a k akutní respirační insuficienci. Chronická rejekce typu BO byla zjištěna u 13 pitvaných pacientů, vedla k chronické respirační insuficienci, která byla ve většině případů komplikovaná infekcí.
U 9 pacientů bylo příčinou úmrtí generalizované nádorové onemocnění. U dvou pacientů karcinom plic, který se vyvinul v transplantované plíci. U dvou pacientů byl diagnostikován karcinom tlustého střeva. Jedna pacientka zemřela na karcinom pankreatu, 2 pacienti na B lymfom – jeden na B potransplantační lymfom, u druhého byl diagnostikován DLBCL. Jeden pacient zemřel na Kaposiho sarkom a jeden na maligní glomus tumor žaludku.
U několika pacientů po TxP byl zjištěn maligní nádor kůže – dvakrát bazaliom, dvakrát dlaždicový karcinom a jednou morbus Bowen. U jednoho pacienta byla provedena nefrektomie pro papilární karcinom ledviny a u jedné pacientky byla provedena resekce bronchu pro hemangioendoteliom. Všichni tito pacienti žijí.
Ze 246 pacientů žije 109 pacientů, což je 44,3 %. V posledních letech 1 rok po transplantaci žije cca 90 % pacientů, 3 roky 70,9 % pacientů a po 5 letech žije 69,1 % pacientů. Nejdéle žijící pacientkou je žena, které byla provedena bilaterální transplantace pro CF 11. 2. 1999. Pacientka je k 19. 1. 2015 po transplantaci v pořádku 5781 dní. Naše výsledky korelují s ostatními transplantačními centry a to jak ve výběru pacientů pro transplantaci, tak v typu a četnosti komplikací po výkonu. Neliší se ani doba přežívání pacientů po transplantaci. Různá transplantační centra udávají 79 %, 64 %, 53 % po 1, 3 a 5 letech. 10 let přežívá 30 % pacientů (22,23,26). Časné přežití je nejlepší u pacientů s CHOPN a CF. Delší přežití po transplantaci je u pacientů s CF a plicní hypertenzí. Nejnižší přežívání je u pacientů s IPF (23).
ZÁVĚR
Transplantace plic je jediná terapeutická metoda, která zlepšuje přežití a kvalitu života u pacientů s respirační insuficiencí v terminálním stadiu plicního onemocnění. Úspěch transplantace závisí na chirurgickém výkonu, na pečlivém monitorování pacientů po transplantaci, na včasném odhalení rejekce a infekčních komplikací, které ovlivňují přežití pacientů v časném období po transplantaci. V pozdějším období je důležitá diagnostika bronchiolitis obliterans, která se podílí na selhání plicního štěpu. U vybraných pacientů z této skupiny je možná retransplantace, která byla provedena i u 3 našich pacientů. Další studie především humorální rejekce může přinést další zlepšení výsledků dlouhodobého přežívání pacientů po transplantaci plic (18,24,25).
Poděkování
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Mária Chadimová
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha
V Úvalu 84, Praha 5, 15006
tel: 224435623
e-mail: mimachadimova@post.cz
Sources
1. Hardy J, Webb W, Dalton M, et al. Lung homotransplantations in man. J Am Assoc 1963; 186 : 1065-1074.
2. Toronto Lung Transplant Group. Unilateral lung transplantation for pulmonary fibrosis. N Engl J Med 1986; 314(18): 1140-1145.
3. Steen S, Sjoberg T, Pierre L, et al. Transplantation of lung from a non-heart-beating donor. Lancet 2001; 357(9259): 825-829.
4. Pafko P, Kabát J, Schűtzner J, et al. První transplantace plic v České republice. Rozhl Chir 1999; 78(4): 148-149.
5. Pafko P, Schűtzner J, Lischke R, et al. The first sequential transplantation of both lungs in the Czech Republic. Rozhl Chir 1999; 78(5): 235-236.
6. Lischke R, Šimonek J, Pozniak J, et al. Transplantace plic. Rozhl Chir 2011; 90(11): 612-620.
7. Treede H, Glanville AR, Klepetko W, et al. Tacrolimus and cyclosporine have differential effects on the risk of development of bronchiolitis obliterans syndrome: results of a prospective, randomized international trial in lung transplantation. J Heart Lung Transpl 2012; 31(8): 797-804.
8. Sundaresan S, Mohanakumar T, Smith MA, et al. HLA-A locus mismatches and development of antibodies to HLA after lung transplantation correlate with the development of bronchiolitis obliterans syndrome. Transplantation 1998; 65(5): 648-653.
9. Hachem PR. Antibodies to human leukocyte antigens in lung transplantation. Clin Transpl 2011 : 327-332.
10. Morrel MR, Pilewski JM, Gries CJ, et al. De novo donor-specific HLA antibodies are associated with early and high-grade bronchiolitis obliterans syndrome and death after lung transplantation. J Heart Lung Transpl 2014; 33(12): 1288-1294.
11. Yousem S. A perspective on the revised working formulation for the grading lung allograft rejection. Transpl Proc 1996; 28(1): 477-479.
12. De Blic J, Peuchmaur M, Carnot F, et al. Rejection in lung transplantation-an immunohistochemical study of transbronchial biopsies. Transplantation 1992; 54(4): 639-644.
13. Estenne M, Maurer JR, Boehler A, et al. Bronchiolitis obliterans syndrome 2001: an update of the diagnostic criteria. J Heart Lung Transplant 2002; 21(3): 297-310.
14. Stewart S, Fishbein MC, Snell GI, et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection. J Heart Lung Transpl 2007; 26(12): 1229-1242.
15. Ramsey H. Antibody-mediated lung transplant rejection. Curr Respir Care Rep 2012; 1(3): 157-161.
16. Haas M, Sis B, Racusen LC, et al. Banff 2013 meeting report: Inclusion of C4d-negative antibody-mediated rejection and antibody associated arterial lesions. Am J Transpl 2014; 14 : 272-283.
17. Salvadori M, Bertoni E: What´s new in clinical solid organ transplantation by 2013. World J Transplant 2014; 4(4): 243-266.
18. Lefaucheur C, Nochy D, Andrade J, et al. Comparison of combination plasmapheresis/IVIG/anti-CD20 versus high-dose IVIG in the treatment of antibody-mediated rejection. Am J Transplant 2009; 9 : 1099-1107.
19. Khalifah AP, HachemRR, Chakinala MM, et al. Respiratory viral infection are a distinct risk for bronchiolitis obliterans syndrome and death. Am J Respir Crit Care Med 2004; 170(2): 181-187.
20. Trofe J, Beebe TM, Buell JF et al. Posttransplant malignancy. Progress in Transplantation 2004; 14(3): 193-200.
21. Olland BM, Falcoz PE, Santelmo N, et al. Primary lung cancer in lung transplant recipients. Ann Thorac Surg 2014; 98 : 362-371.
22. Whitson BA, Hayes D Jr. Indications and outcomes in adult lung transplantation. J Thorac Dis 2014; 6(8): 1018-1023.
23. Kistler KD, Nalysnyk L, Rotella P, et al. Lung transplantation in idiopathic pulmonary fibrosis: a systematic review of the literature. BMC Pulm Med 2014; 14 : 139.
24. McManigle W, Pavlisko EN, Martinu T. Acute cellular and antibody-mediated allograft rejection. Semin Respir Crit Care Med 2013; 34(3): 320-335.
25. Westall GP, Snell GI. Antibody-mediated rejection in lung transplantation: fable, spin, or fact? Transplantation 2014; 98 : 927-930.
26. Kirkby S, Hayes Jr D. Pediatric lung transplantation: indications and outcomes. J Thorac Dis 2014; 6(8): 1024-1031.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2015 Issue 4-
All articles in this issue
- Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
- Morfologie chirurgických komplikací v biopsiích jater časně po transplantaci
- Diagnostika rejekce v transplantovaných játrech
- Rekurence primárních chorob po transplantaci jater
- Transplantace plic v České republice – z pohledu patologa
- Chirurgické techniky orgánových transplantací
- Periostální osteosarkom - osobní zkušenost s pěti případy
- Biopsie renálních štěpů: průvodce spletitými detaily pro získání nejlepších výsledků
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Periostální osteosarkom - osobní zkušenost s pěti případy
- Transplantace plic v České republice – z pohledu patologa
- Diagnostika rejekce v transplantovaných játrech
- Chirurgické techniky orgánových transplantací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

