-
Medical journals
- Career
Rekurence primárních chorob po transplantaci jater
Authors: Víta Žampachová 1; Eva Honsová 2
Authors‘ workplace: I. patologicko-anatomický ústav FN u sv. Anny v Brně a LF MU 1; Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha 2
Published in: Čes.-slov. Patol., 51, 2015, No. 4, p. 170-174
Category: Reviews Article
Overview
Velká většina primárních chorob, indikovaných k ortotopické transplantaci jater, zvláště u dospělých pacientů, může postihnout jako rekurentní léze i jaterní štěp. Díky zdokonalení indikačních kritérií, technik vlastní transplantace i potransplantační péče se přežívání pacientů stále prodlužuje, ale zároveň s ním stoupá i incidence a celková závažnost rekurentních chorob, které tvoří významnou část příčin pozdního selhání jaterního štěpu. Frekvence, následky i možnosti terapie jednotlivých rekurentních chorob se značně liší. V nedávné době měla relativně nejhorší prognózu hepatitida C se 100% reinfekcí, ale situace se mění s novou generací antivirotik, stejně jako se to již zdařilo s hepatitidou B. Přes vysokou, 30 – 50 % incidenci vykazuje velmi mírné následky rekurence primární biliární cirhózy. Primární sklerozující cholangitida vede k selhání štěpu s nutností retransplantace až u 10 % případů. Autoimunitní hepatitidu s rekurencí až 30 % dlouhodobě přežívá díky adekvátním imunosupresivním režimům většina pacientů. Neabstinující pacient s alkoholickou hepatopatií je po transplantaci ohrožen převážně extrahepatálními komplikacemi abusu alkoholu. Rekurentní nealkoholická steatohepatitida vede v průběhu 5 – 10 let po transplantaci k selhání štěpu sporadicky. Diagnostika rekurentních lézí po transplantaci jater je do značné míry založena na histopatologických změnách v biopsii, zásadní důležitost má diferenciální diagnóza oproti jiným příčinám dysfunkce jaterního štěpu, stejně jako posouzení možného souběhu několika různých lézí.
Klíčová slova:
transplantace jater – rekurence – biopsie
Rekurence primárních chorob v jaterním štěpu představují u pacientů po ortotopické transplantaci jater (OLT) závažný problém, vedoucí k dysfunkci až možnému jaternímu selhání se ztrátou štěpu. V pozdějším období (> 12 měsíců po OLT) jsou to jednoznačně příčiny nejčastější a s prodloužením přežívání pacientů po transplantaci i se zvyšováním počtu transplantací jejich důležitost ještě stoupá. Histopatologická diagnostika těchto lézí tvoří ve většině případů nezbytnou součást celkového posuzování stavu, prognózy a terapie pacienta (1).
Problematika rekurencí z hlediska patologa se ovšem neomezuje na vlastní biopsii štěpu. Základem diagnostiky primární léze před OLT, neboť optimální možností snížení počtu rekurencí ve štěpu, je – alespoň v případě některých chorob – jejich prevence. Spektrum specifických terapeutických zákroků se v tomto směru rozšiřuje; k běžným metodikám, jako je udržení abstinence u alkoholické hepatopatie (ALD), úprava životního stylu u nealkoholické steatohepatitidy (NASH), specifická antivirová terapie hepatitidy B, přistupuje i rychle se rozvíjející vysoce účinná kombinovaná terapie hepatitidy C (HCV) čistě perorálními antivirotiky. Přes tyto pokroky však možnosti terapie samozřejmě stále nepokrývají celé spektrum rekurujících chorob (2). Jednotlivé primární choroby rekurují do jaterního štěpu se značně variabilní frekvencí a vedou k rozdílným klinickým následkům.
REKURENCE VIROVÉ HEPATITIDY C
Reinfekce HCV nastává pravidelně během několika hodin po OLT a zhruba 70 – 80 % příjemců vyvine chronickou hepatitidu. Progrese do cirhózy je u pacientů po OLT vyšší než v autologních játrech (3). Komplexní vztahy mezi imunitním systémem, virem a imunosupresí vedou k různorodým morfologickým obrazům s odlišným biologickým chováním, kde zvláště hrozivá je manifestace fibrocholestatické hepatitidy. Diagnóza re-HCV je obvykle bioptická a ve většině případů u konvenční morfologie nečiní velké obtíže. Někdy může vzniknout problém v odlišení re-HCV od akutní rejekce, i zde většinu případů dokáže zkušený hepatopatolog odlišit z HE. V některých situacích zvl. v případě koincidence rejekce a re-HCV je rozlišení v biopsii komplikované nebo nemožné. Naštěstí v dnešní době existují spolehlivé metody detekce počtu kopií viru a v morfologicky komplikovaných nebo nejistých případech mají tyto techniky rozhodující slovo při výběru následující terapie.
Re-HCV se může projevit několika typy prezentací; nejčastější rozdělení je na re-HCV s konvenční morfologií a na fibrocholestatický typ virové hepatitidy.
a. Re-HCV s konvenční morfologií přináší pro patologa jednu z méně obvyklých situací, kterou představuje možnost seznámit se s morfologií HCV v akutní fázi. Akutní HCV patolog v autologních játrech prakticky nezná, v případě rekurence je několik morfologických znaků, které spolehlivě vedou k diagnóze. První se objevuje dilatace sinusů centrolobulárně spolu s nečetnými acidofilními tělísky (individuálním zánikem hepatocytů). V této době nemusí být žádná další zánětlivá morfologie v lobulech ani v portálních polích (obr. 1), ta narůstá postupně v čase a během 3. – 9. měsíce se morfologie srovná s konvenční, klasickou HCV. Nejprve jde o převážně lobulární zánět s resorptivními uzlíky, posléze narůstá portální a periportální zánětlivá celulizace, která přejde do morfologie běžné chronické hepatitidy s interface a lobulární aktivitou různého stupně.
Image 1. Re-HCV konvenčního typu časně po transplantaci, v morfologii je dilatace sinusů centrolobulárně a snadno identifikovatelná acidofilní tělíska, jako korelát individuálního zániku hepatocytů. Prakticky chybí zánětlivá celulizace. Patolog, který tento typ reakce nezná, by mohl nález hodnotit jako nespecifické změny (HE, objektiv 20x). 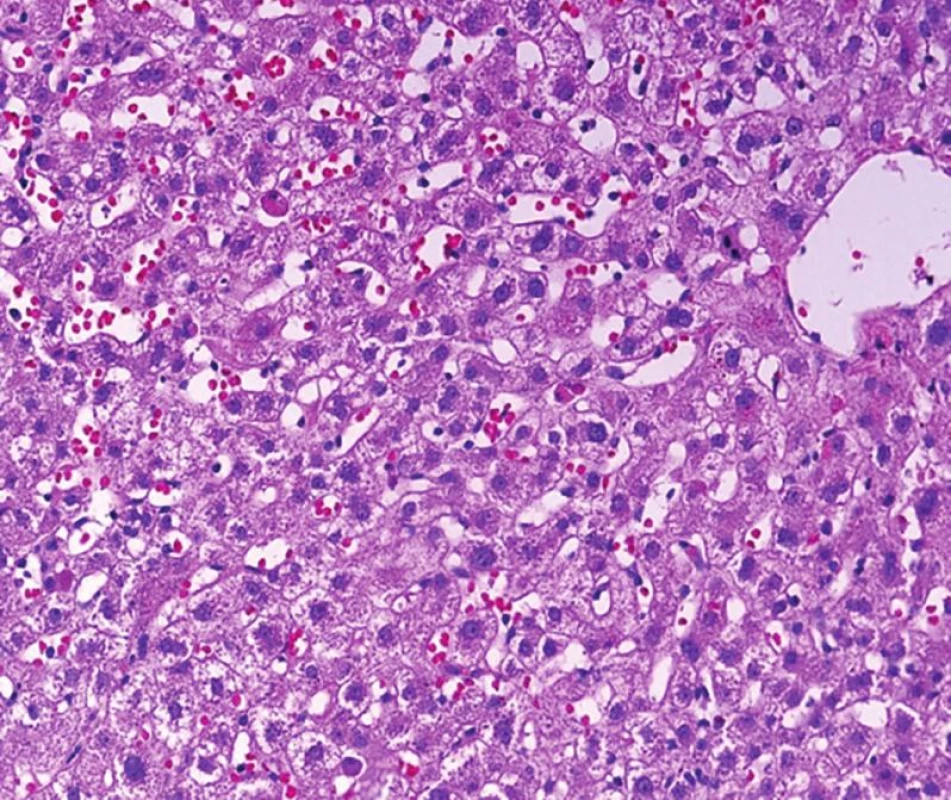
b. Re-HCV: fibrocholestatická hepatitida (FCH). FCH představuje velmi závažné onemocnění, které bylo původně odhaleno u příjemců s re-HBV. Posléze se ukázalo, že stejný typ hepatitidy mohou mít pacienti s re-HCV a také, že stejným typem hepatitidy mohou onemocnět pacienti s „de novo“ HCV nebo HBV po transplantacích kostní dřeně nebo solidních orgánů. FCH mohou onemocnět také pacienti s prodělanou HBV a s léčbou ovlivňující imunitní odpověď např. anti-CD20 u léčby hematologických malignit. Předpokladem pro vznik FCH je imunosuprese pacienta. Imunosupresivní léčba velmi pravděpodobně vede k nekontrolované replikaci viru, který se na rozdíl od běžné infekce stává pro hepatocyty patogenní a přímo je poškozuje, což vede k dramatickým klinickým příznakům s rychlou progresí do selhání jater, obvykle během několika týdnů až měsíců. Jde o velmi závažné onemocnění, bez včasné diagnózy s vysokou mortalitou. Bohužel, FCH patří mezi obtížné histopatologické diagnózy a pokud na ni patolog nepomýšlí, snadno ji mine. V časných fázích, kdy je v biopsii pouze centrolobulární cholestáza v nápadně zduřelých hepatocytech, bez zánětu, lze afekci snadno interpretovat jako součást poruchy žlučové drenáže (4). Většina morfologických znaků obou afekcí je prakticky totožná. Pro FCH je na rozdíl od konvenčních průběhů virových hepatitid typická minimální nebo žádná zánětlivá celulizace v portálních polích i v sinusech. U lytické formy FCH jsou projevem poškození hepatocytů četná acidofilní tělíska a metabolické změny hepatocytů, prakticky bez zánětu (obr. 2). Pro neškoleného patologa může tato nezánětlivá morfologie vyvolat dojem mírného nepříznačného poškození. Cholestáza je nejprve centrolobulární, později panlobulární. Morfologický obraz doplňuje fibróza, která z počátku onemocnění chybí a narůstá postupně (obr. 3). Pokud je onemocnění součástí infekce HBV, lze provést imunohistochemickou detekci HBsAg a HBcAg, kde masivní pozitivita HBcAg vede k diagnóze. Pro infekci HCV neexistuje imunohistochemické vyšetření, které by onemocnění potvrdilo. Klinický údaj o negativní sérologii infekčních hepatitid může být zavádějící, protože pacienti v imunosupresi nemusí tvořit protilátky a diagnózu proto verifikuje vyšetření se stanovením počtu kopií viru. Znalost tohoto typu morfologie je velmi důležitá a může být i život zachraňující. Onemocnění probíhá velmi rychle a vyčkávání s diagnózou není na místě; zvlášť nebezpečný je tento typ hepatitidy po léčbě hematologických malignit, kdy klinik poskytuje zavádějící informace a klinická diagnóza téměř vždy směřuje k toxické reakci na chemoterapii (5).
Image 2. Fibrocholestatická hepatitida (lytická forma) s nápadným individuálním zánikem hepatocytů (četná acidofilní tělíska) a metabolickými změnami hepatocytů. Ve vzorku je patrná aktivita Kupfferových buněk a minimum zánětu (HE, objektiv 40x). 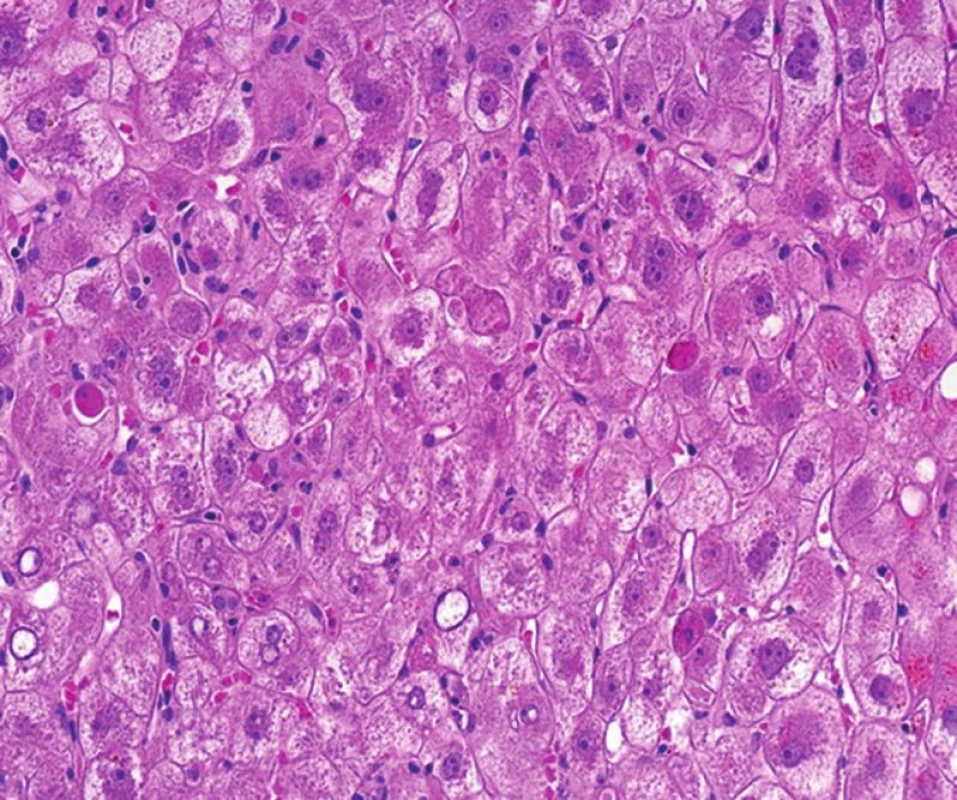
Image 3. Fibrocholestatická hepatitida s metabolickými změnami hepatocytů, které vytvářejí cholestatické rozety. Minimum zánětlivé celulizace a peritrabekulární fibróza (HE, objektiv 20x). 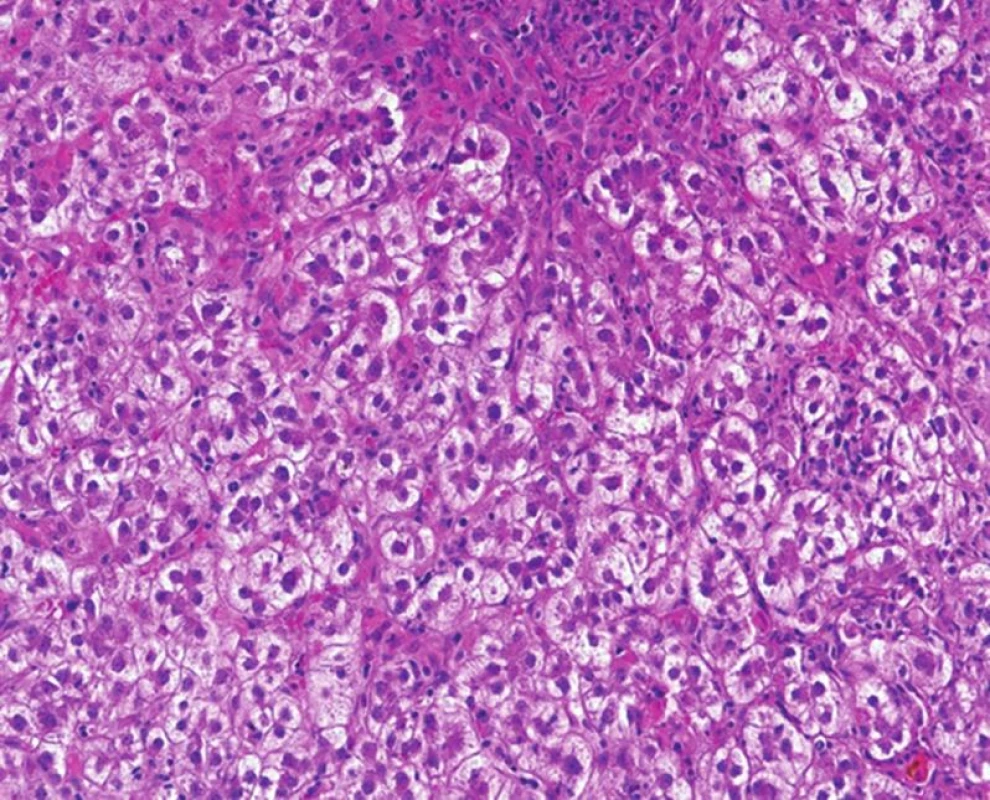
Existují i další diagnosticky komplikovanější varianty jako již zmíněná koincidence hepatitidy a rejekce a také morfologie hepatitidy s dominující plazmocytární celulizací. Tato okrajová kategorie je problematická z obecného pohledu, protože při hodnocení biopsie nemáme k dispozici údaje, které by mohly interpretaci četných plazmocytů v zánětlivém infiltrátu klasifikovat jako součást definovaných kategorií. Klasickým příkladem je existence polymorfismů některých znaků a reakce na ně. Příjemce při transplantaci obdrží játra, u kterých se polymorfismy nezjišťují a proti některým z těchto znaků (pokud je neměl a teď je obdržel v transplantovaných játrech) reaguje jako proti cizímu antigenu. Jde tedy vlastně o specifický typ rejekce (reakce proti štěpu), který se překrývá s autoimunitou, protože polymorfní znaky jsou orgánově specifické a nikoli dárcovsky specifické. Pokud má stejný pacient re-HCV, je zařazen v kategorii re-HCV s dominující plazmocytární infiltrací, i když z obecného pohledu určitě nejde jen o rekurenci infekce.
REKURENCE AUTOIMUNNÍ HEPATITIDY
Rekurence autoimunní hepatitidy (AIH) představuje problém v oblasti terminologie. Transplantovaná játra nejsou „auto“, proto někteří autoři měli problém s termínem re-AIH a chtěli používat jinou terminologii. Po letech došlo k dohodě a termín re-AIH je většinově akceptován, s tím že antigeny, proti kterým je reakce namířena jsou orgánově specifické a že tedy lze akceptovat terminologii rekurence. Fakticky vzato jde o situaci, kdy se rozdíl mezi alloantigeny (rejekcí) a autoantigeny (orgánově specifickými sdílenými antigeny, autoimunitou) stírá a zánět je ve skutečnosti allo/auto reakcí proti štěpu. Do komplexnosti dějů u příjemce s dysregulovaným imunitním systémem po transplantaci vstoupí ještě genetické faktory dárce (polymorfismy), stav štěpu v době transplantace a imunosuprese, která modifikuje imunitní odpověď.
Pokud přistoupíme k této terminologii, pak se re-AIH považuje za poměrně běžnou, kde prevalence dosahuje až 20 – 40 % a narůstá v čase. Vysoká rekurence může být ovlivněna faktem, že transplantaci podstoupí jenom část pacientů s AIH a to ti, u kterých onemocnění nereagovalo na standardní terapii (steroidy, azathioprin) a dospělo do cirhózy, anebo jde o pacienty s fulminantním průběhem AIH . V autologních játrech se diagnóza AIH opírá o kombinaci klinických, sérologických a morfologických znaků spolu s vyloučením jiných příčin chronického poškození jater. Po OLT nelze kriteria platná pro diagnózu v autologních játrech spolehlivě použít a diagnostika re-AIH je složitější (6,7). Je tomu tak proto, že existuje mnoho různorodých příčin, které mají podobnou zánětlivou morfologii a mohou se na poškození štěpu podílet nebo spolupodílet. Navíc protilátky, u pacientů s AIH často v nízkém titru přetrvávají i bez zánětu ve štěpu a také mohou být identifikovány i u příjemců transplantovaných kvůli jiné diagnóze. Morfologie re-AIH často o několik let předchází biochemické abnormality, které charakterizují dysfunkci štěpu. To je jedním z důvodů k indikaci protokolárních biopsií (protokolární biopsie jsou biopsie, které se provádějí v pravidelných ročních nebo 2letých intervalech, i když příjemce má normálními laboratorní výsledky a nemá žádné klinické známky „de novo“ nebo rekurence onemocnění).
Histopatologické znaky jsou podobné jako v autologních játrech, problémem je, že tyto znaky nejsou specifické pro re-AIH a mohou se vyskytovat u širokého spektra jiných diagnóz. Proto je diferenciální diagnostika velmi široká a zahrnuje všechny možnosti zánětlivé morfologie, zvl. rejekce. Orientačně lze shrnout, že morfologie má zánětlivé rysy s různým stupněm aktivity, někdy s centrolobulárními nekrózami a variabilním stupněm fibrózy (obr. 4). V zánětlivém infiltrátu jsou plazmocyty, obvykle ve skupinách, s příměsí různého množství eozinofilů.
Image 4. Re-AIH s interface aktivitou zánětlivé celulizace, která z port. pole přestupuje hluboko do tkáně a ve které jsou četné plazmocyty s příměsí eozinofilů (HE, objektiv 40x). 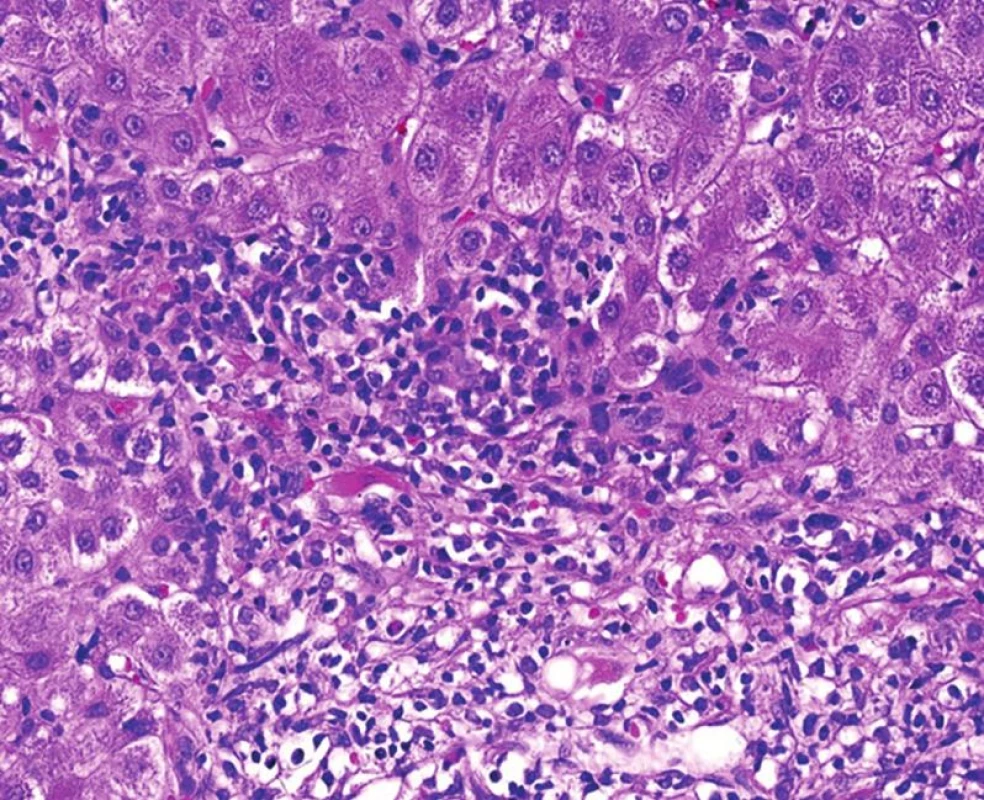
REKURENCE PRIMÁRNÍ BILIÁRNÍ CIRHÓZY
Rekurence primární biliární cirhózy (PBC) je nejčastěji diagnostikovaná náhodně v protokolárních biopsiích. Pacienti mají obvykle normální nebo téměř normální laboratorní výsledky a klinicky jsou asymptomatičtí. Antimitochondriální protilátky v diagnostice nepomohou, protože u většiny pacientů po transplantaci přetrvávají a to i tam, kde onemocnění nerekuruje. PBC rekuruje v závislosti na době od transplantace a v 5. roce se udává cca u 20 % příjemců (8). U většiny příjemců rekurence nepředstavuje závažné ohrožení funkce štěpu a 15 let po OLT přežívání pacientů přesahuje 80 %.
Histopatologické znaky jsou podobné jako v autologních játrech. Typickou charakteristikou je velmi fokální postižení žlučovodů a také fokální zánětlivá celulizace portálních polí, kdy část portálních polí může mít denzní zánět s plazmocyty a s interface aktivitou a další jsou bez zánětu s normální morfologií. Toho se využívá v diferenciální diagnostice, protože rejekce i AIH mají obvykle zánětlivou celulizaci téměř difúzně ve většině portálních polí. Granulomy poškozující žlučovody mají u re-PBC stejnou morfologii jako před transplantací (obr. 5).
Image 5. Re-PBC s typickou morfologií denzního zánětu v portálním poli a s destrukcí žlučovodu. Pro PBC v autologních i transplantovaných játrech je typická nepravidelná distribuce zánětu, která střídá portální pole se zánětem různého stupně a portální pole bez zánětu s normální morfologií (PAS/D, objektiv 40x). 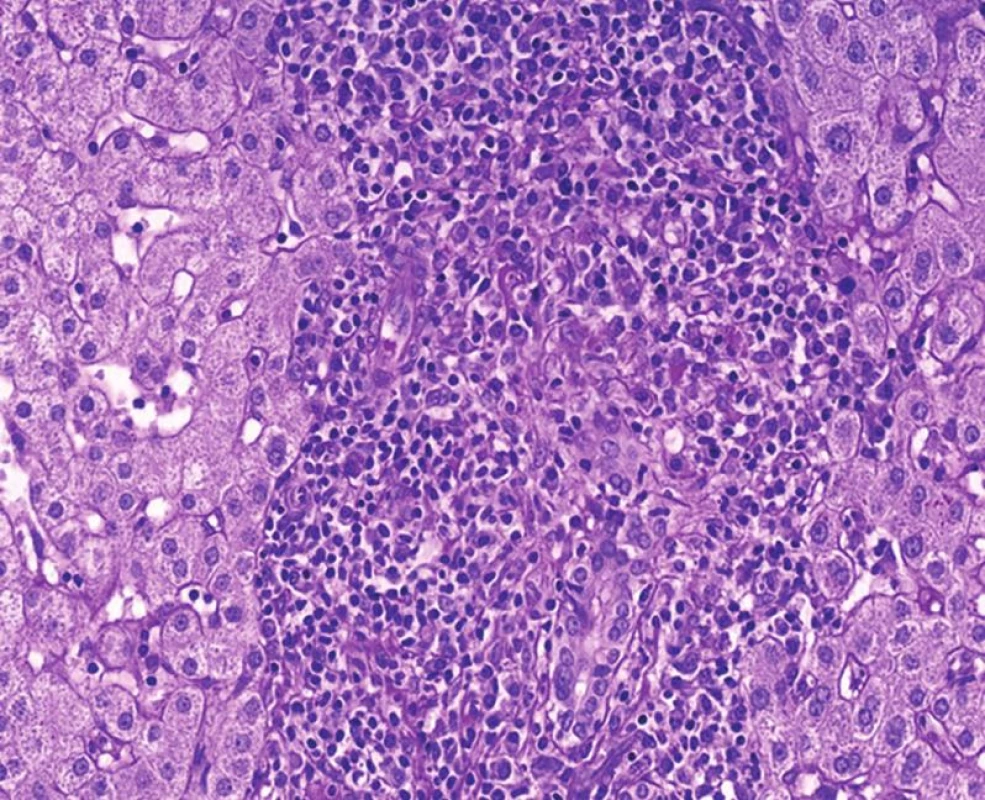
REKURENCE PRIMÁRNÍ SKLEROZUJÍCÍ CHOLANGITIDY
Diagnóza rekurence primární sklerozující cholangitidy (PSC) patří k těm komplikovanějším a vyžaduje interpretaci nejenom bioptických znaků, ale mnoha dalších klinických dat od cholestatického obstrukčního laboratorního profilu, po klinický průběh a event. výsledky zobrazovacích metod, až po časové údaje. Protože jde o typ onemocnění, které se postupně vyvíjí a pomalu progreduje, nepovažují se podle dohodnutých kriterií neanastomotické stenózy vzniklé do 90 dnů od transplantace za rekurenci onemocnění (9). V těchto případech se na poškození žlučovodů daleko pravděpodobněji podílela ischemie. Ischemií způsobené poškození žlučovodů může být buď izolované (poškozené jsou pouze žlučovody a k ischemii vedla např. protrahovaná hypotenze se septickým stavem) nebo mohou být žlučovody postiženy sekundárně jako důsledek stenózy/trombózy arterie (viz článek „Morfologie chirurgických komplikací“ v tomto čísle časopisu).
Morfologické znaky re-PSC jsou stejné jako v autologních játrech. Jde o morfologii poruchy žlučové drenáže, která je stejná pro striktury hilových žlučovodů jakékoli etiologie a v biopsii jaterní tkáně z periferie jater nelze tyto kategorie (s problémem v hilu nebo extrahepatálně) odlišit. Charakteristické znaky jsou tedy skupinové; a jde o edém periferie portálních polí, řídkou zánětlivou celulizaci, ve které dominují polynukleáry s eozinofily, duktulární proliferaci spolu s akumulací metaloproteinu v periportálních hepatocytech (obr. 6). V hilových žlučovodech je kulatobuněčná celulizace ve stěně s četnými plazmocyty, ulcerace epitelu a periduktální fibróza.
Image 6. Rekurence PSC s morfologií poruchy žlučové drenáže, s edémem periferie port. polí a s nápadnou chronickou cholestázou s cholestatickými rozetami (HE, objektiv 10x). 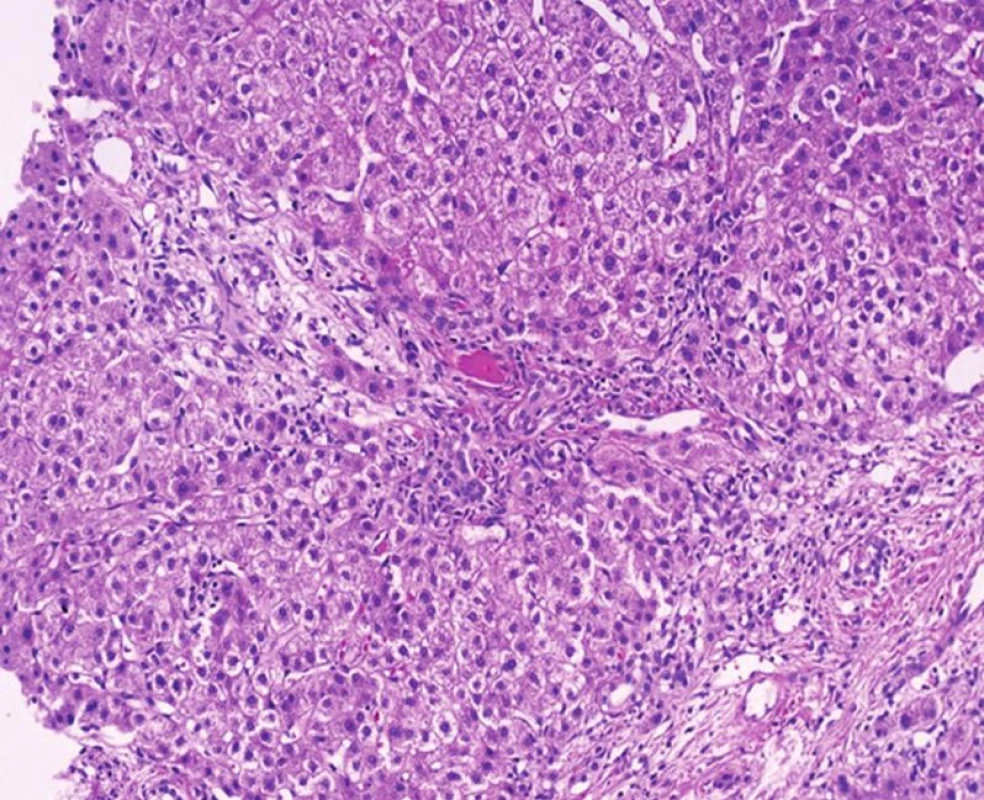
REKURENCE ALKOHOLICKÉ HEPATOPATIE
Po virových hepatitidách je alkoholická hepatopatie (alcoholic liver disease, ALD) s 33% zastoupením, druhým nejčastějším důvodem OLT v Evropě, další 4 % pacientů mají souběh alkoholické a další léze, zvláště HCV, HCC, metabolických onemocnění jako hemochromatóza nebo deficit α1-antitrypsinu. Přesnou incidenci opakovaného pití nelze s jistotou zjistit, odhaduje se celkově kolem 30 %, pokud se počítá vše mimo striktní abstinenci. Těžkých pijáků s rekurencí, která ohrožuje štěp i život pacientů, je málo, obvykle udávaná data jsou kolem 3 – 5 % (10). Rekurence etylismu může být diagnostikována na podkladě klinických údajů (anamnéza, stanovení hladiny alkoholu v krvi), nebo může být rekurence pravděpodobná na základě histopatologických změn v biopsii.
Histopatologické znaky jsou podobné jako v autologních játrech a zahrnují steatózu, steatohepatitidu a peritrabekulární fibrózu centrolobulárně.
REKURENCE NEALKOHOLICKÉ STEATÓZY/STEATOHEPATITIDY
NASH pravděpodobně vede ke značné části případů kryptogenní cirhózy a můžeme očekávat nárůst pacientů transplantovaných pro tuto diagnózu, která je již nyní v některých centrech čtvrtou nejčastější indikací (11). Po OLT může dojít k její rekurenci, ačkoliv v mnoha případech nelze odlišit vliv sekundárních rizikových faktorů spojených s transplantací (steroidy a inzulinová rezistence až potransplantační DM II. typu, nárůst BMI, změna životního stylu apod.), údaje o frekvenci rekurence se tudíž výrazně liší (12). Re-NASH má na střednědobé (5 – 10 let) přežití štěpu minimální význam.
Diagnóza re-NASH je stejně jako v nativních játrech diagnózou bioptickou, protože neexistují žádné sérologické nebo jiné markery, které by dokázaly biopsii nahradit. Přibližně třetina příjemců s rekurující chorobou je asymptomatická, s normálními jaterními testy. Proto i u této diagnózy mají význam protokolární biopsie.
Histopatologické znaky jsou stejné jako v autologních játrech.
REKURENCE HEPATOCELULÁRNÍHO KARCINOMU
Samostatnou kapitolou jsou tzv. rekurence maligních onemocnění tj. především hepatocelulárního karcinomu (HCC). Pokud pod pojmem rekurence rozumíme, že se nádor znovu objeví „na stejném“ místě, asi lze takový slovní obrat akceptovat. Problémem je, že nejde o stejné místo, tak jak jsme zvyklí termín používat např. rekurence karcinomu tl. střeva v anastomóze. V případě štěpu jater se „nový“ HCC objevuje v játrech bez cirhózy a i jinak jde o tkáň bez „prekancerózního stavu“ a není tedy důvod, aby se zde karcinom vyvinul. Ve skutečnosti jde velmi pravděpodobně o metastázy HCC zpět do jater. Podle dobře doložených experimentálních prací stimuluje odstranění primárního ložiska nádoru růst skrytých (v době diagnózy nedetekovatelných) metastáz, lze se tedy oprávněně domnívat, že osídlení „nových“ a z onkologického pohledu „zdravých“ jater je metastatické. Tomu odpovídají i rizikové faktory udávané pro znovu postižení jater, kterými jsou celková velikost nádoru (více ložisek nebo velká velikost jednoho ložiska), vaskulární invaze a špatná diferenciace (grade) nádoru.
ZÁVĚR
Rekurence primárních chorob v jaterních štěpech zahrnuje značně heterogenní soubor lézí s dosti rozdílnou frekvencí výskytu i odlišnými následky. Celkově představují velmi významnou příčinu dysfunkce štěpů a také jsou pravidelnou součástí diferenciálně diagnostických rozvah v histopatologii již od časného potransplantačního období. Z virových hepatitid má v Evropě nejzávažnější následky rekurentní hepatitida C, z imunitně podmíněných chorob primární sklerozující cholangitida a autoimunitní hepatitida, z metabolických lézí se kromě alkoholické hepatopatie dostává do popředí nealkoholická steatohepatitida.
Rekurence různých chorob patří ke komplikovaným diagnózám, které často vyžadují bioptickou verifikaci. Histopatologické znaky rekurencí jednotlivých onemocnění jsou zřídkakdy specifické, často se překrývají s jinými patologickými změnami nebo se s dalšími příčinami dysfunkce štepů kombinují. U velké většiny rekurencí představuje histopatologické vyšetření biopsie štěpu klíč k diagnóze a úloha hepatopatologa je v transplantačním týmu nezastupitelná.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Sources
1. Banff Working Group, Demetris AJ, Adeyi O, et al. Liver biopsy interpretation for causes of late liver allograft dysfunction. Hepatology 2006; 44(2): 489-501.
2. Hübscher SG. What is the long-term outcome of the liver allograft. J Hepatol 2011; 55 : 702-717.
3. Demetris AJ. Evolution of hepatitis C virus in liver allografts. Liver Transplantation 2009; 15: S35-S41.
4. Salomao M, Verna EC, Lefkowitch JH et al. Histopathologic distinction between fibrosing cholestatic hepatitis C and biliary obstruction. Am J Surg Pathol 2013; 37(12): 1837-1844.
5. Sperl J, Frankova S, Kieslichova E et al. Urgent liver transplantation for chemotherapy-induced HBV reactivation: a suitable option in patients recently treated for malignant lymphoma. Transplant Proc 2013; 45(7): 2834-2837.
6. Duclos-Vallee J-C, Sebagh M. Recurrence of autoimmune disease, primary sclerosing cholangitis, primary biliary cirrhosis, and autoimmune hepatitis after liver transplantaton. Liver Transpl 2009; 15: S25-S34.
7. Czaja A. Diagnosis, pathogenesis, and treatment of autoimmune hepatitis after liver transplantaton. Dig Dis Sci 2012; 57 : 2248-2266.
8. Liberal R, Zen Y, Mieli-Vergani G, Vergani D. Liver Transplantation and Autoimmune Liver Diseases. Liver Transpl 2013; 19 : 1065-1077.
9. Carbone M, Neuberger J. Liver transplantation in PBC and PSC: Indication and disease recurrence. Clin Res Hepatol Gastroenterol 2011; 35 : 446-454.
10. Gramenzi A, Gitto S, Caputo F et al. Liver transplantation for patients with alcoholic liver disease: An open question. Dig Liver Dis 2011; 43 : 843-849.
11. Patil TD, Yerian LM. Evolution of nonalcoholic fatty liver disease recurrence after liver transplantation. Liver Transpl 2012; 18 : 1147-1153.
12. El Atrache MM, Abouljoud MS, Divine G, et al. Recurrence of non-alcoholic steatohepatitis and cryptogenic cirrhosis following orthotopic liver transplantation in the context of the metabolic syndrome. Clin Transplant 2012; 26: E505-E512.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2015 Issue 4-
All articles in this issue
- Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
- Morfologie chirurgických komplikací v biopsiích jater časně po transplantaci
- Diagnostika rejekce v transplantovaných játrech
- Rekurence primárních chorob po transplantaci jater
- Transplantace plic v České republice – z pohledu patologa
- Chirurgické techniky orgánových transplantací
- Periostální osteosarkom - osobní zkušenost s pěti případy
- Biopsie renálních štěpů: průvodce spletitými detaily pro získání nejlepších výsledků
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Periostální osteosarkom - osobní zkušenost s pěti případy
- Transplantace plic v České republice – z pohledu patologa
- Diagnostika rejekce v transplantovaných játrech
- Chirurgické techniky orgánových transplantací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

