-
Medical journals
- Career
Gastrointestinální stromální tumor (GIST): pokroky do roku 2013
Authors: Ondřej Daum 1,2; Monika Šedivcová 2
Authors‘ workplace: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2
Published in: Čes.-slov. Patol., 50, 2014, No. 2, p. 76-80
Category: Reviews Article
Overview
Gastrointestinální stromální tumor (GIST) je v současné době vnímán jako skupina molekulárně geneticky-heterogenních nádorů, které spojuje obdobná morfologie, imunoexprese proteinu KIT a pravděpodobný původ z tkáňového prekurzoru intersticiálních Cajalových buněk. GISTy lze dělit podle imunoexprese beta podjednotky sukcinátdehydrogenázy (SDHB) na SDHB-pozitivní (zahrnující GISTy s mutací KIT, PDGFRA, NF1) a SDHB-deficientní (zahrnující syndrom Carneyho a Stratakisové, Carneyho trias a některé sporadické dětské i adultní GISTy). Jednotlivé molekulární podtypy se od sebe liší jak biologickým chováním, tak odezvou na terapii inhibitory tyrozinkináz, která je indikována v případě metastatického rozsevu nebo v případě nádoru s vysokým rizikem agresivního chování. I přes existenci několika prognostických systémů však dosud není algoritmus indikace pacienta k systémové terapii jednoznačně stanoven. Farmakogenomika slaví úspěchy ve vývoji látek účinných v terapii GISTů primárně rezistentních na imatinib (GISTy se substitucí Asp842Val v exonu 18 genu PDGFRA nebo SDHB-deficientní GISTy), ale i v překonávání sekundární rezistence způsobené sekundární mutací, která může postihovat jak geny kódující receptorové tyrozinkinázy, tak další molekuly v postižené signální kaskádě. Prospektivně se počítá s racionálním molekulárním cílením terapie na základě komplexního molekulárně-genetického vyšetření tumoru. Pro detekci sekundárních mutací, které mohou být přítomné pouze v některých buněčných klonech, lze využít analýzy DNA cirkulující v periferní krvi.
Klíčová slova:
GIST – KIT – PDGFRA – SDH – stromální tumorVzhledem k tomu, že vyčerpávající shrnutí nejdůležitějších poznatků o molekulární diagnostice GISTu bylo na stránkách tohoto časopisu publikováno před dvěma lety, klade si tento příspěvek za cíl pouze informovat o nových pohledech a objevech, které ovlivnily diagnostiku do konce roku 2013 (1).
Za zcela zásadní lze považovat objasnění role mitochondriálního enzymu sukcinátdehydrogenázy v kategorii GISTů bez mutací v genech kódujících receptorové tyrozinkinázy (RTK) KIT a PDGFRA (tzv. KIT/PDGFRA wt GISTů). Tento poznatek vedl ke změně klasifikace GISTů, které dnes již nejsou považovány za jeden typ nádoru, ale spíše za skupinu nádorů charakterizovaných podobnou morfologií, expresí proteinu KIT (ve většině případů) a pravděpodobným původem ze stejného buněčného prekurzoru.
Klasifikační změny se promítly i do vývoje nových terapeutických postupů umožňujících systémovou terapii i u tumorů neodpovídajích na dnes již běžnou terapii inhibitory RTK (TKI). I v kategorii „klasických“ GISTů se však dále na základech molekulární genetiky rozvíjejí farmakologické postupy pro překonání primární či sekundární rezistence vůči klasické terapii imatinibem.
Z národního hlediska má praktický význam také přijetí Doporučených postupů České onkologické společnosti pro prediktivní terapii a Doporučeného postupu pro histologické vyšetření gastrointestinálního stromálního tumoru (GIST) Společnosti českých patologů, které byly přijaty v roce 2013 a budou publikovány v tomto časopise.
SUKCINÁTDEHYDROGENÁZA A GIST
Sukcinátdehydrogenáza (SDH), jinak též sukcinát-koenzym Q reduktáza (SQR) nebo mitochondriální komplex II je enzymatický komplex lokalizovaný na vnitřní mitochondriální membráně, který je součástí citrátového cyklu i dýchacího řetězce. Jde o hetero-oligomer složený ze čtyř hlavních podjednotek A, B, C a D a několika vedlejších asociovaných molekul. Hlavní podjednotky jsou kódovány příslušnými jadernými geny SDHA, SDHB, SDHC a SDHD, kolektivně označované SDHx. Již delší dobu je známo, že inaktivační germinální mutace těchto genů vedou k syndromu familiárního paragangliomu (více typů) (2-4). Fakt, že nedávno byla popsána asociace familiárního paragangliomu s GISTem (5-7), nazvaná syndrom familiární paragangliom-GIST nebo syndrom Carney-Stratakis (syndrom Carneyho a Stratakisové), obrátil pozornost i k možnosti účasti těchto molekul v patogenezi GISTu. Kromě autozomálně dominantně dědičného syndromu Carneyho a Stratakisové podmíněného germinální mutací SDHx patří do skupiny SDHB-deficientních GISTů většina sporadických dětských GISTů, ale i některé sporadické adultní GISTy, které mohou být podmíněny jak germinálními, tak somatickými mutacemi SDHx. U Carneyho triády (plicní chondrom, žaludeční GIST, paragangliom) nebyl dosud přesný molekulární podklad SDHB-deficience odhalen.
Přesný mechanizmus onkogeneze způsobené deficiencí SDH není sice zcela poznán, předpokládá se však, že roli v něm hraje pseudohypoxie a akumulace sukcinátu. Ta vede jednak ke stabilizaci HIF1-α (hypoxia-inducible factor 1 - α), který ovlivňuje transkripci genů zúčastněných v angiogenezi, jednak k inhibici enzymů z rodiny TET, které katalyzují hydroxylaci 5-metylcytozinu na 5-hydroxymetylcytozin, v důsledku čehož dochází k abnormální metylaci DNA (8-11). Předpokládané metabolicko-onkogenní následky deficience SDH jsou zjednodušeně schematicky znázorněny na obr. 1.
Image 1. Mechanizmus onkogeneze SDHB-deficientních GISTů Funkční komplex SDH zakotvený ve vnitřní mitochondriální membráně katalyzuje přeměnu sukcinátu na fumarát. Akumulace sukcinátu, k níž dochází při deficienci katalytické aktivity enzymu, má za následek jednak stabilizaci transkripčního faktoru HIF1α v aktivním stavu, což vede k transkripci genů zúčastněných v angiogenezi (jako třeba VEGF), jednak k inhibici dioxygenáz z rodiny TET. Tím dochází k nedostatečné hydroxylaci 5-metylcytozinu na 5-hydroxymetylcytozin s následnou změnou struktury metylace DNA vedoucí k aberantní expresi genů. SDHA, SDHB, SDHC, SDHD: jednotlivé hlavní podjednotky sukcinátdehydrogenázy (SDH) HIF1-α: hypoxií inducibilní faktor 1α VHL: proteinový produkt genu VHL (von Hippel – Lindau) TET: rodina proteinů TET („Translocated in liposarcoma, Ewing‘s sarcoma and TATA-binding protein-associated factor 15“, tedy TLS/FUS, EWS, TAF15) 5-MC: 5-metylcytozin 5-HMC: 5-hydroxymetylcytozin 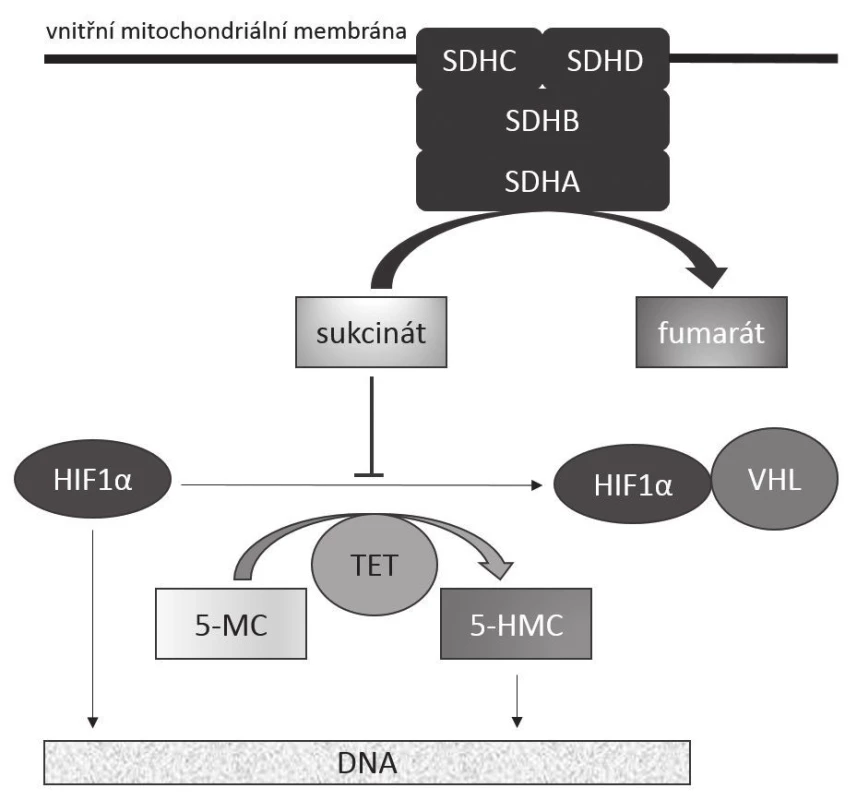
SOUČASNÁ MOLEKULÁRNĚ GENETICKÁ KLASIFIKACE GISTU
Základem současné klasifikace GISTů je imunohistochemické (IHC) vyhodnocení exprese beta podjednotky enzymu sukcinátdehydrogenázy (SDHB), na jehož základě lze rozlišit minoritní skupinu GISTů SDHB-deficientních a majoritní skupinu „klasických“ GISTů SDHB-pozitivních, jak je znázorněno v obr. 2. V rámci těchto hlavních skupin lze pak rozlišit několik dalších podkategorií na základě molekulárně genetických vlastností nádoru (tab. 1) (12).
Image 2. Klasifikace GISTů na základě SDHB imunohistochemie Imunohistochemické vyšetření exprese SDHB umožňuje rozdělit GISTy na „klasické“ GISTy SDHB-pozitivní (další dělení v tab. 1) a na imunohistochemicky negativní SDHB-deficientní. Z nich je asi jedna třetina podmíněna mutací genu SDHA, což se projeví ztrátou imunoexprese proteinu SDHA, čtvrtina mutací v některém ze zbývajících hlavních genů SDHB-D, u nichž je imunoexprese SDHA zachována, stejně jako u SDHB-deficientních tumorů bez detekovatelné mutace SDH genů. SDHA, SDHB, SDHC, SDHD: jednotlivé podjednotky enzymu sukcinátdehydrogenázy (SDH) SDHB IHC: imunohistochemické vyšetření exprese SDHB SDHA IHC: imunohistochemické vyšetření exprese SDHA SDHA mut, SDHB mut, SDHC mut, SDHD mut: mutace genu příslušné jednotky sukcinátdehydrogenázy SDHx wt: tumor bez detekovatelné mutace v jakékoli podjednotce SDH 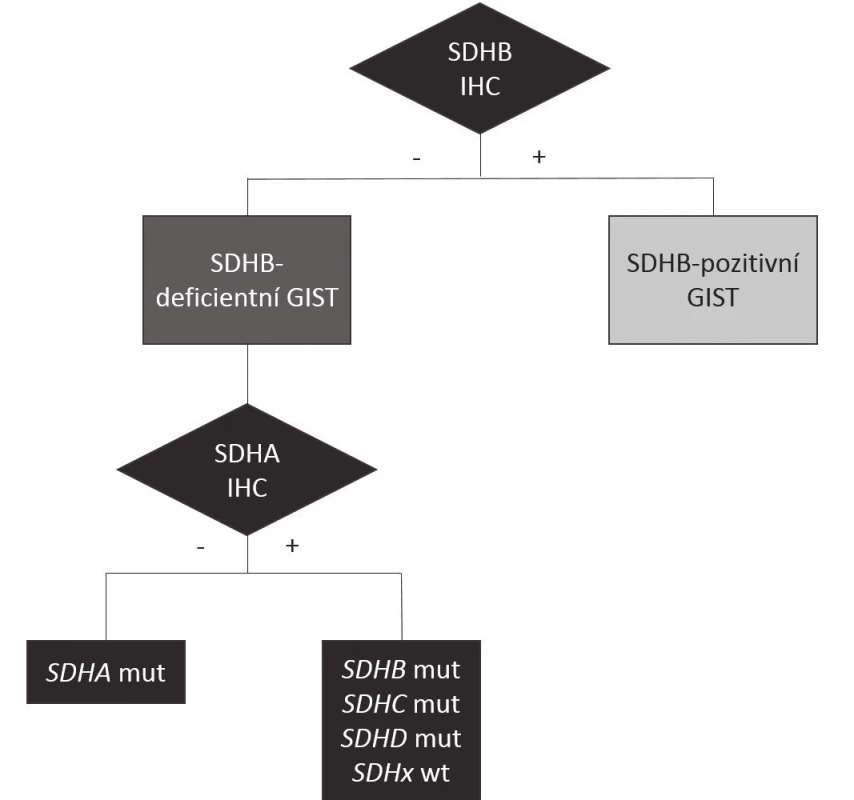
Table 1. Molekulárně genetická klasifikace GISTu 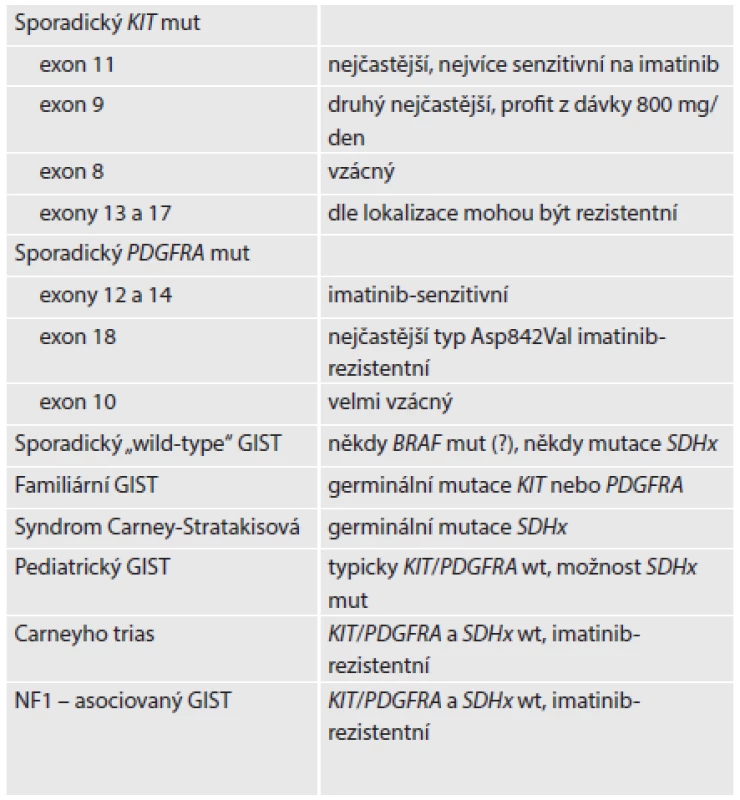
KIT mut: GIST s mutací v genu KIT PDGFRA mut: GIST s mutací v genu PDGFRA BRAF mut (?): mutace genu BRAF, její role v tumorigenezi GISTu zatím nebyla objasněna KIT/PDGFRA wt: divoké (nemutované) alely genů KIT a PDGFRA SDHx: souhrnné označení pro geny kódující jednotlivé podjednotky sukcinátdehydrogenázy (SDH), tedy konkrétně SDHA, SDHB, SDHC a SDHD Volně podle (12). Ačkoli je spektrum morfologických obrazů GISTu široké a mnohdy imitující i jiné nádory, lze ve značné části případů již na základě histologického obrazu odhadnout pravděpodobný molekulárně genetický profil. Zatímco většina GISTů s mutací genu KIT má typický vzhled vřetenobuněčného nádoru, mutace PDGFRA je často charakterizována epiteloidním tvarem nádorových buněk s příměsí buněk vícejaderných, pseudomyxoidním edematózním prosáknutím stromatu a přítomností žírných buněk. SDHB-deficientní GISTy mají většinou multinodulární až organoidní vzhled připomínající často neuroendokrinní tumor (vzhledem k molekulárně-genetickému zaměření tohoto článku odkazujeme na obrazovou dokumentaci Doporučeného postupu pro histologické vyšetření gastrointestinálního stromálního tumoru (GIST) Společnosti českých patologů přijatého v roce 2013). Tyto histologické rysy, spolu se znalostí endoskopického nálezu a klinických dat, umožňují s vysokou mírou jistoty odhadnout SDHB-deficienci u těchto tumorů (tab. 2) (13).
Table 2. Klinicko-patologické znaky SDHB-deficientních GISTů 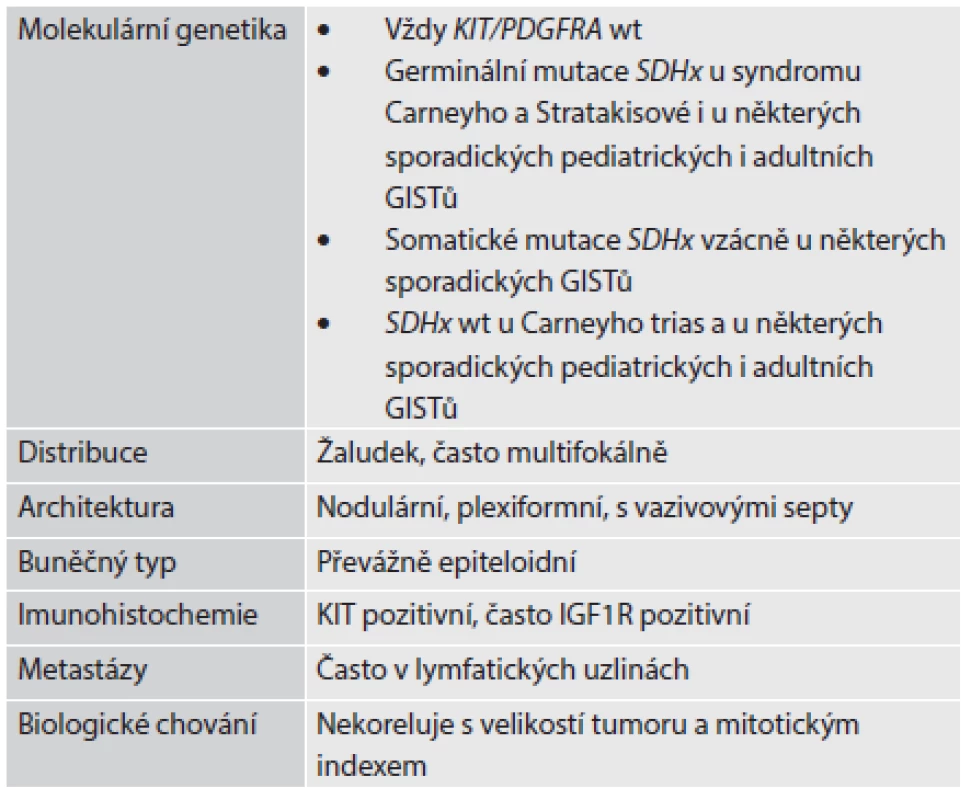
IGF1R: receptor pro růstový faktor podobný inzulinu - 1 KIT/PDGFRA wt: divoké (nemutované) alely genů KIT a PDGFRA SDHx: souhrnné označení pro geny kódující jednotlivé podjednotky sukcinátdehydrogenázy (SDH), tedy konkrétně SDHA, SDHB, SDHC a SDHD SDHx wt: divoké (nemutované) alely genů SDHA, SDHB, SDHC a SDHD Volně podle (13) Vzhledem k tomu, že prognóza a citlivost tumoru na terapii, případně i možnost nádorového postižení dalších členů rodiny, je do značné míry determinována genetickým profilem tumoru, může být vyžadováno molekulárně genetické vyšetření bioptického vzorku. Stále narůstající počet genů, které jsou pokládány za zodpovědné za vznik jednotlivých forem GISTu, spolu s finančními i časovými nároky molekulárně-genetické laboratoře, vyžadují efektivní cílení těchto metod. Na počátku managementu vyšetření GISTu by mělo stát rozdělení na hlavní kategorie podle exprese SDHB založené na zhodnocení znaků histologických, klinických, dle možností i imunoexprese SDHB. Vzhledem k finanční a technické náročnosti vyšetření genu SDHA je s výhodou před případnou genetickou analýzou vyloučit imunohistochemickým vyšetřením exprese SDHA možnost mutace v tomto genu (obr. 2) (14,15). Zvláštností SDHB-deficientních GISTů je, že i při sporadickém výskytu jsou často podmíněny germinální mutací, na rozdíl od germinálně podmíněných forem SDHB-pozitivních GISTů, které se často manifestují familiárním postižením, multifokálním výskytem a hyperplázií Cajalových interstitiálních buněk, v případě GISTu asociovaného s neurofibromatózou 1. typu navíc i s dalšími znaky neurofibromatózy.
POKROKY V CÍLENÉ TERAPII A PREDIKTIVNÍ DIAGNOSTICE
Systémová cílená terapie se v první řadě, jako terapie paliativní, týká GISTů generalizovaných. V případě lokalizovaného GISTu je primárním léčebným prostředkem samozřejmě chirurgický zákrok (16). U pacientů s významným rizikem relapsu je dále indikována terapie adjuvantní (17). Problémem však je, že ani Evropská společnost pro lékařskou onkologii (ESMO) ani Česká onkologická společnost nestanovují, který prognostický systém by se měl používat, natož prognostickou skupinu daného systému, od kterého by bylo riziko progrese onemocnění považováno za závažné (18).
Za rizikové faktory agresivního chování GISTu je všeobecně považován vysoký mitotický index, velikost nádoru, jeho extragastrická lokalizace, ruptura tumoru a dosahování nádoru do resekčního okraje (19). Na hodnocení mitotického indexu, velikosti a lokalizace tumoru je založena Miettinenova (AFIP) klasifikace, která byla po formálních modifikacích zahrnuta i do 4. vydání WHO klasifikace tumorů trávicího traktu (20). Novější prognostické systémy založené na nomogramech se snažily překonat diskontinuální prahový charakter Miettinenovy klasifikace, pro běžné použití jsou však poměrně komplikované (16), podobně jako nejnovější systém založený na nelineárním modelování obrysových map (21).
Před nasazením cílené terapie je doporučováno molekulárně genetické vyšetření nádoru, a to na základě rozhodnutí onkologa. Analýze by měly být podrobeny exony 9, 11, 13 a 17 genu KIT, a 12, 14 a 18 genu PDGFRA. Zohledněn dosud není ani fakt, že některé GISTy mohou být způsobeny mutací v exonu 8 genu KIT (22,23), ani heterogenita skupiny nádorů historicky označovaných jako wild-type GIST, přestože zahrnuje natolik odlišné jednotky jako třeba GIST s běžně nedetekovanou mutací v exonu 8 genu KIT, GIST asociovaný s neurofibromatózou nebo SDHB-deficientní GISTy, přičemž kupříkladu o posledně jmenovaných je již dobře známo, že jsou imatinib-rezistentní, ale i při metastatickém rozsevu umožňují dlouhodobé přežití (24,25).
„Klasické“ KIT/PDGFRA mut SDHB-pozitivní GISTy
Z klinického hlediska je hlavním účelem molekulárně genetického vyšetření GISTu predikce odpovědi na cílenou léčbu inhibitory receptorových tyrosinkináz (TKI). V tomto smyslu je cílem tohoto vyšetření jednak potvrdit diagnózu GISTu, jednak detekovat případné mutace asociované s rezistencí vůči cílené terapii imatinibem. Dosavadní poznatky o vztahu genetického profilu a terapeutické odpovědi GISTu lze shrnout do tří bodů:
- a. nejlépe odpovídají tumory s mutací v exonu 11 genu KIT
- b. tumory s mutací v exonu 9 genu KIT mají delší dobu přežití bez progrese nádoru při zvýšené denní dávce imatinibu, případně mohou profitovat z léčby sunitinibem
- c. tumory se substitucí Asp842Val v exonu 18 genu PDGFRA jsou imatinib-rezistentní
Největší význam má tedy detekce substituce Asp842Val exonu 18 genu PDGFRA, která je nejsilnějším negativním prediktivním faktorem. Slibně se v tomto ohledu jeví účinnost crenolanibu jako terapeutika cíleného na GISTy s touto mutací (26).
Stále větší pozornost je také věnována sekundární rezistenci. Dále probíhají studie s nízkomolekulárními TKI masitinibem, dovitinibem, pazopanibem, dasatinibem, ponatinibem. Jako lék 3. linie po selhání imatinibu a sunitinibu se jeví nadějně regorafenib (27). Pozornost se také soustřeďuje na ovlivnění dalších prvků signálních kaskád, které mohou být příčinou růstu GISTu. Jako možný lék 3. linie je tak studován inhibitor heat-shock proteinu 90 ganetespib, v kombinaci s imatinibem vykázal slibné výsledky inhibitor mTOR everolimus (28).
Hlavním problémem cílené terapie GISTu se sekundární rezistencí je detekce sekundárních mutací, které jsou většinou za tuto rezistenci zodpovědné. Mutace různých typů totiž mohou vznikat nezávisle na sobě v různých metastázách, ale i v jednotlivých nádorových klonech uvnitř jednoho nádorového ložiska. Kvůli tomu samozřejmě není běžnými prostředky možné spolehlivě a přesně zvolit cílenou terapii. Určitou naději představuje tzv. BEAMing (beads, emulsions, amplification, magnetics), metoda detekující sekundární mutace vyšetřením DNA v krevní plazmě, a to s větší senzitivitou než jakou umožňuje analýza samotných nádorových ložisek (29).
SDHB-deficientní GISTy
Z terapeutického hlediska je společným jmenovatelem SDHB-deficientních GISTů necitlivost na cílenou léčbu imatinibem, a to bez ohledu na to, zda jde o Carneyho trias, SDHx mut nebo SDHx wt tumor. Pozorování asociace absence imunoexprese SDHB s pozitivním imunohistochemickým průkazem IGF1R (insulin-like growth factor 1 receptor) podnítilo studie možností použití látky OSI-906 inhibující IGF1R jako specifického léku cíleného na SDHB-deficientní GISTy (30,31).
DALŠÍ PERSPEKTIVY
Již několik let je zřejmé, že efektivní paliativní nebo adjuvantní terapie (nejen) GISTu vyžaduje identifikaci molekulárních charakteristik jednotlivých prvků signálních kaskád účastnících se vzniku a/nebo progrese nádoru, a to na úrovni genetické i epigenetické. Tradiční molekulárně genetické postupy však neumožňovaly pro časovou a finanční náročnost komplexnější vyšetření. V současné době ale již do klinického provozu proniká metoda „next-generation DNA sequencing“ (sekvenování DNA další generace), které nabízí možnost použití rozsáhlých diagnostických kitů, v případě GISTu je navrhován například set vyšetření genů BRAF, CDKN2A, HRAS, KIT, KRAS, MAP2K1, NF1, NRAS, PDGFRA, PIK3CA, RB1, SDHA, SDHAF1, SDHAF2, SDHB, SDHC, SDHD, TP53. V kombinaci s již popsaným BEAMingem a vývojem nových specifických nízkomolekulárních inhibitorů signálních kaskád slibuje tato metoda účinnou léčbu reagující na genetické shifty nádory při minimu nežádoucích účinků.
Adresa pro korespondenci:
Doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13, 305 99 Plzeň
tel.: +420377402523
fax.: +420377402634
e-mail: DAUM@fnplzen.cz
Sources
1. Augustiňáková A, Kodet R. Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu. Cesk Patol 2011; 47(4): 148-152.
2. Amar L, Bertherat J, Baudin E, et al. Genetic testing in pheochromocytoma or functional paraganglioma. J Clin Oncol 2005; 23(34): 8812-8818.
3. Burnichon N, Rohmer V, Amar L, et al. The succinate dehydrogenase genetic testing in a large prospective series of patients with paragangliomas. J Clin Endocrinol Metab 2009; 94(8): 2817-2827.
4. Burnichon N, Briere JJ, Libe R, et al. SDHA is a tumor suppressor gene causing paraganglioma. Hum Mol Genet 2010; 19(15): 3011-3020.
5. Carney JA, Stratakis CA. Familial paraganglioma and gastric stromal sarcoma: a new syndrome distinct from the Carney triad. Am J Med Genet 2002; 108(2): 132-139.
6. Pasini B, McWhinney SR, Bei T, et al. Clinical and molecular genetics of patients with the Carney-Stratakis syndrome and germline mutations of the genes coding for the succinate dehydrogenase subunits SDHB, SDHC, and SDHD. Eur J Hum Genet 2008; 16(1): 79-88.
7. Stratakis CA, Carney JA. The triad of paragangliomas, gastric stromal tumours and pulmonary chondromas (Carney triad), and the dyad of paragangliomas and gastric stromal sarcomas (Carney-Stratakis syndrome): molecular genetics and clinical implications. J Intern Med 2009; 266(1): 43-52.
8. Killian JK, Kim SY, Miettinen M, et al. Succinate dehydrogenase mutation underlies global epigenomic divergence in gastrointestinal stromal tumor. Cancer Discovery 2013; 3(6): 648-657.
9. Mason EF, Hornick JL. Succinate dehydrogenase deficiency is associated with decreased 5-hydroxymethylcytosine production in gastrointestinal stromal tumors: implications for mechanisms of tumorigenesis. Mod Pathol 2013; 26(11): 1492-1497.
10. Ricketts CJ, Shuch B, Vocke CD, et al. Succinate dehydrogenase kidney cancer: an aggressive example of the Warburg effect in cancer. J Urol 2012; 188(6): 2063-2071.
11. Belinsky MG, Rink L, von Mehren M. Succinate dehydrogenase deficiency in pediatric and adult gastrointestinal stromal tumors. Frontiers in Oncology 2013; 3(3): 117.
12. Corless CL, Heinrich MC. Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 2008; 3(3): 557-586.
13. Gill AJ, Chou A, Vilain R, et al. Immunohistochemistry for SDHB divides gastrointestinal stromal tumors (GISTs) into 2 distinct types. Am J Surg Pathol 2010; 34(5): 636-644.
14. Miettinen M, Killian JK, Wang ZF, et al. Immunohistochemical loss of succinate dehydrogenase subunit A (SDHA) in gastrointestinal stromal tumors (GISTs) signals SDHA germline mutation. Am J Surg Pathol 2013; 37(2): 234-240.
15. Wagner AJ, Remillard SP, Zhang YX, et al. Loss of expression of SDHA predicts SDHA mutations in gastrointestinal stromal tumors. Mod Pathol 2013; 26(2): 289-294.
16. Gold JS, Gonen M, Gutierrez A, et al. Development and validation of a prognostic nomogram for recurrence-free survival after complete surgical resection of localised primary gastrointestinal stromal tumour: a retrospective analysis. Lancet Oncol 2009; 10(11): 1045-1052.
17. Dematteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 2009; 373(9669): 1097-1104.
18. ESMO group. Gastrointestinal stromal tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vii49-55.
19. Casali PG, Blay JY. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21 (Suppl 5): v98-102.
20. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23(2): 70-83.
21. Joensuu H, Vehtari A, Riihimaki J, et al. Risk of recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts. Lancet Oncol 2012; 13(3): 265-274.
22. Hartmann K, Wardelmann E, Ma Y, et al. Novel germline mutation of KIT associated with familial gastrointestinal stromal tumors and mastocytosis. Gastroenterology 2005; 129(3): 1042-1046.
23. Huss S, Kunstlinger H, Wardelmann E, et al. A subset of gastrointestinal stromal tumors previously regarded as wild-type tumors carries somatic activating mutations in KIT exon 8 (p.D419del). Mod Pathol 2013; 26(7): 1004-1012.
24. Pantaleo MA, Nannini M, Astolfi A, Biasco G. A distinct pediatric-type gastrointestinal stromal tumor in adults: potential role of succinate dehydrogenase subunit A mutations. Am J Surg Pathol 2011; 35(11): 1750-1752.
25. Miettinen M, Wang ZF, Sarlomo-Rikala M, et al. Succinate dehydrogenase-deficient GISTs: a clinicopathologic, immunohistochemical, and molecular genetic study of 66 gastric GISTs with predilection to young age. Am J Surg Pathol 2011; 35(11): 1712-1721.
26. Heinrich MC, Griffith D, McKinley A, et al. Crenolanib inhibits the drug-resistant PDGFRA D842V mutation associated with imatinib-resistant gastrointestinal stromal tumors. Clin Cancer Res 2012; 18(16): 4375-4384.
27. Demetri GD, Reichardt P, Kang YK, et al. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381(9863): 295-302.
28. Schoffski P, Reichardt P, Blay JY, et al. A phase I-II study of everolimus (RAD001) in combination with imatinib in patients with imatinib-resistant gastrointestinal stromal tumors. Ann Oncol 2010; 21(10): 1990-1998.
29. Richardson AL, Iglehart JD. BEAMing up personalized medicine: mutation detection in blood. Clin Cancer Res 2012; 18(12): 3209-3211.
30. Chou A, Chen J, Clarkson A, et al. Succinate dehydrogenase-deficient GISTs are characterized by IGF1R overexpression. Mod Pathol 2012; 25(9): 1307-1313.
31. Lasota J, Wang Z, Kim SY, Helman L, Miettinen M. Expression of the receptor for type 1 insulin-like growth factor (IGF1R) in gastrointestinal stromal tumors: an immunohistochemical study of 1078 cases with diagnostic and therapeutic implications. Am J Surg Pathol 2013; 37(1): 114-119.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2014 Issue 2-
All articles in this issue
- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Molekulární patologie plicních karcinomů
- Gastrointestinální stromální tumor (GIST): pokroky do roku 2013
- Hereditární karcinomy štítné žlázy a jejich molekulární diagnostika
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
- Využití archivovaných parafínových bločků s formalinem fixovanou tkání (FFPE) pro molekulárně genetickou analýzu u difuzního velkobuněčného lymfomu (DLBCL)
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

