-
Medical journals
- Career
Nové aspekty patobiologie nádorů
: M. Ludvíková 1; M. Pešta 2,3; L. Holubec jr. 3; D. Kalfeřt 4
: Ústav biologie LF UK Plzeň, Ústav patologie 1. LF UK a VFN Praha, Fakulta zdravotnických studií ZČU, Plzeň 1; II. interní klinika a Centrální laboratoř pro imunoanalýzu LF UK a FN, Plzeň 2; Onkologické a radioterapeutické oddělení LF UK a FN, Plzeň 3; Klinika ušní, nosní a krční LF UK a FN, Hradec Králové 4
: Čes.-slov. Patol., 45, 2009, No. 4, p. 94-99
: Reviews Article
V poslední době bylo popsáno několik biologických fenoménů, které se mohou vedle genetických změn významnou měrou též podílet na nádorové transformaci a/nebo progresi nádorů. Mezi tyto jevy řadíme epigenetické změny, RNA interferenci, epiteliálně mezenchymální tranzici a vznik nádorových kmenových buněk. Cílem tohoto článku je podat stručný přehled těchto „negenetických“ procesů ovlivňujících vznik, vzhled, chování, prognózu a léčbu nádorů a poukázat na jejich možné praktické využití především z hlediska diagnostického a terapeutického.
Klíčová slova:
nádorová patobiologie – epigenetické změny – RNA interference – epiteliálně mezenchymální tranzice – nádorové kmenové buňkyNádor je tradičně považován za genetické onemocnění, jehož vznik a progrese jsou způsobeny postupným hromaděním genetických změn ve formě mutací vedoucích k alteracím v genech, které jsou důležité pro regulaci buněčné proliferace a přežití buňky. V důsledku narušení signálních cest a deregulace exprese výše zmíněných genů tak získává nádorová buňka růstové výhody.
Na složitém procesu kancerogeneze a nádorové progrese se však podílí i řada dalších, se změnou sekvence DNA bezprostředně nesouvisejících procesů, jako jsou epigenetické změny, posttranskripční regulace, epiteliálně mezenchymální tranzice či vznik a perzistence nádorových kmenových buněk. Všechny uvedené fenomény mohou významně přispívat k nádorové transformaci a ovlivňovat tak fenotyp nádoru, jeho chování a progresi a mohou být východiskem pro nové, personalizované směry nádorové terapie. Ačkoli v nádorové diagnostice nadále zůstává zlatým standardem histologické vyšetření, další profilace nádorů z hlediska diagnostického, prognostického i prediktivního, založená nejen na genetické analýze DNA, ale i na bližším stanovení výše uvedených nádorových jevů, se zdá přínosná.
Cílem tohoto článku je ve stručném přehledu poukázat na základní „negenetické“ molekulárně biologické mechanismy kancerogeneze a na další faktory, které mohou ovlivňovat vzhled, chování, prognózu a léčbu nádorů.
Epigenetické změny
Jsou to chemické změny, které postihují molekulu DNA nebo chromatin, ale nemají na rozdíl od mutací bezprostřední vliv na sekvenci nukleotidů (19). Tyto změny však ovlivňují expresi genů, čímž mohou dosáhnou stejného účinku jako mutace v příslušných genech. Postihují-li tyto epigenetické změny „cancer-related“ geny, pak se může výsledný efekt rovněž podílet na procesu nádorové transformace nebo na změnách fenotypu nádorů. Epigenetické modifikace vznikají dvěma mechanismy – metylací DNA a/nebo chemicky podmíněnou změnou v uspořádání chromatinu (tzv. remodelací chromatinu).
DNA metylace
Proces, při němž se váže metylová skupina na vybrané nukleotidové baze, se označuje jako DNA metylace. Tímto procesem se vytváří v normálních tkáních relativně stabilní DNA metylační vzorec, který se ustanoví během embryonálního vývoje. Cílovou molekulou pro metylaci jsou cytosinové báze v CpG dinukleotidech. V somatických buňkách jsou metylována až 4 % cytosinových bází. Metylace jsou v genomu nerovnoměrně rozloženy. Nacházíme je jak v genech a jejich promotorech, tak v intergenových oblastech. Vznik DNA metylace je enzymatický proces, na němž se podílí DNA metyltransferázy (DNMT1-ustanovuje metylaci dle původního metylačního vzorce po replikaci na nově vytvořeném řetězci; DNMT3A a 3B-odpovídá za metylaci de novo). Metylace jako epigenetická informace se přenáší do dalších dceřinných buněk, a to prostřednictvím DNMT1, jak již bylo zmíněno (40).
DNA metylace má za následek umlčování genů v důsledku inhibované vazby transkripčních faktorů (Obr.1). DNA metylace se může uplatňovat v procesu nádorové transformace prostřednictvím několika mechanismů (15, 19):
1. DNA metylace má za následek umlčování genů v důsledku inhibované vazby transkripčních faktorů (A – nemetylovaný promotor, B – metylovaný promotor) 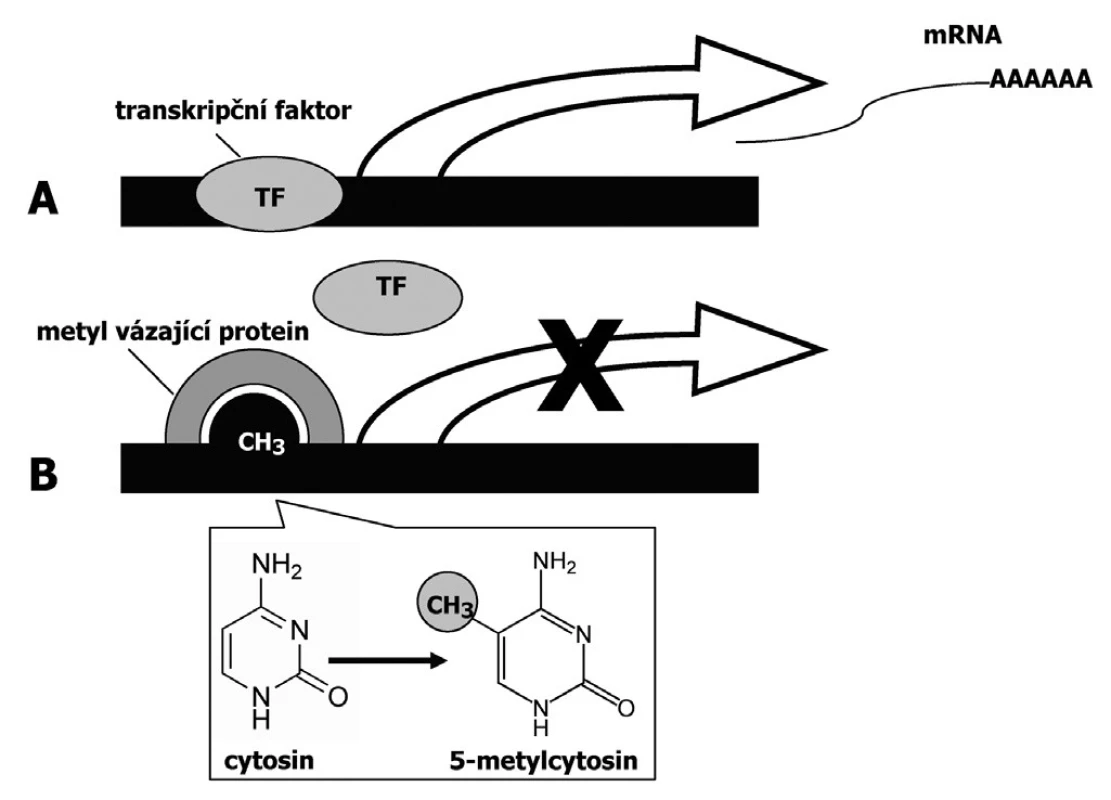
a) DNA metylace jako příčina bodových mutací
Metylovaný cytosin může podléhat spontánní deaminaci na tymin. Vyskytuje-li se tato C-T tranzice v kódující oblasti genů regulujících buněčný růst a přežití buňky, může změna funkce těchto genů přispět k nádorové transformaci buňky. Tyto mutace bývají časté zejména v genu TP53, jak bylo popsáno např. u kolorektálního karcinomu či u karcinomu prsu (41). Změna metylačního statutu rovněž usnadňuje mutagenní efekt exogenních kancerogenů.
b) DNA hypometylace
Globální genomická hypometylace je typická pro nádorové buňky. V mnoha nádorech je celková metylace snížena až na 70 % normálního stavu, což však zároveň nevylučuje zvýšenou metylaci některých genů. Jak přispívá globální hypometylace ke kancerogeneze? Může být evokována genomická nestabilita v důsledku aktivace dříve umlčovaných genů nebo zvýšená chromozomální nestabilita díky tomu, že pokles metylace v repetitivních a pericentrozomálních oblastech bývá příčinou zlomů nebo numerických chromozomálních aberací (16, 40).
c) DNA hypermetylace
Vyskytuje se ve formě fokální hypermetylace dříve aktivních genů, což vede k jejich umlčení. V nádorech mohou být hypermetylovány stovky genů. Na proces kancerogeneze má největší vliv inaktivace nádorově supresorových genů hypermetylací, přičemž výsledný efekt je srovnatelný s jejich mutacemi a delecemi. Na rozdíl od těchto genetických změn je však DNA hypermetylace proces reverzibilní. V kolorektálním karcinomu byla popsána hypermetylace promotorů DNA reparačních genů, což má za následek vznik mikrosatelitní instability (7, 10, 16, 40). Podobně se může metylace vyskytovat v promotorech microRNA, čímž se podílí na regulaci genové exprese na posttranskripční úrovni (19, 48).
Remodelace chromatinu
Jsou to epigenetické změny spočívající v chemické modifikaci (metylaci, acetylaci nebo fosforylaci) histonových proteinů, čímž ovlivňují kondenzaci chromatinu a následně i genovou expresi v důsledku změněné přístupnosti transkripčních enzymů k promotorům genů. Výsledný efekt uvedených chemických změn je ambivalentní. Acetylace histonů vede k transkripční aktivaci chromatinu, zatímco deacetylace histonů má za následek transkripční inaktivaci. Je to enzymaticky řízený proces prostřednictvím histonových deacetyláz. Metylace histonů (aminokyseliny lysinu) může mít transkripčně aktivační a deaktivační efekt v závislosti na tom, který lysin a na jakém histonovém proteinu je metylovaný. Tento proces je ovlivňován podobně jako při DNA metylaci metyltransferázami. Fosforylace se odehrává na histonu H3 (aminokyseliny serin 10, 28 a treonin 11) a vede ke kondenzaci chromatinu během mitózy a meiózy. Aktivaci enzymů sloužících k remodelaci chromatinu může též vyvolávat přítomnost metylovaného cytosinu v DNA příslušného chromozomu (40).
Klinické souvislosti epigenetických změn
Znalost epigenetického profilu nádoru se může uplatnit při jeho diagnostice, prognózování i terapii následujícím způsobem:
- aberantní DNA metylace v promotorech některých genů může být využita jako biomarker maligní transformace a prognózy nádoru (15),
- epigenetické změny slouží jako cíl nádorové terapie. Nové linie léčby vycházející z těchto epigenetických jevů jsou založeny na skutečnosti, že na rozdíl od genetických změn jsou epigenetické změny potenciálně reverzibilní. Otevírá se tedy možnost reaktivace epigeneticky umlčených nádorových genů užitím hypometylačních léků nebo inhibitorů deacetylace histonů (4, 16, 19, 35, 40).
Poslední studie prokázaly řadu epigenetických změn v mnoha nádorech, např. v karcinomech prsu, kde geny postižené epigenetickými modifikacemi zahrnují zejména p16, p21WAF , BRCA1, BRCA2, E-cadherin a receptory steroidních hormonů. Uvedené geny mohou být cílem speciální terapie (32).
RNA interference
RNA interference (RNAi) je další jev, který je významným regulátorem genové exprese a může se tak významně podílet na procesu kancerogeneze. Za objev tohoto převratného fenomenu v molekulární biologii obdrželi v roce 2006 Craig C. Mello a Andrew Fires Nobelovu cenu za fyziologii a medicínu. Ačkoliv byl tento jev pozorován už dříve u rostlin, oba zmínění vědci odhalili jeho mechanismus u hlístice Caenorhabditis elegans (háďátko obecné). Svoje výsledky v podobě efektu umlčení cílového genu po injekci dsRNA publikovali v r. 1998 v časopisu Nature, kde poprvé použili termín RNAi (17).
Mechanismus RNAi
Na podkladě RNA interference je možné v buňce kontrolovat aktivitu genů. Základem pro interferenci jsou malé RNA molekuly (siRNA a miRNA), které se mohou komplementárně vázat k mRNA a blokovat tvorbu proteinů (26). Zdrojem těchto malých, krátkých dvouřetězcových fragmentů RNA (tvořených 20–25 páry bází) je dlouhá dvouřetězcová RNA (dsRNA), která může být exogenního nebo endogenního původu:
- a/ exogenní dsRNA vstupuje do cytoplazmy buňky ze zevního prostředí v podobě RNA viru nebo je záměrně vpravována laboratorními mechanismy,
- b/ endogenní dsRNA je produktem vlastních, specifických genů buňky. Vzniká transkripcí v jádře ve formě pri-miRNA (primární transkript), která se vlivem enzymu Drosha a vazebného kofaktoru proteinu Pasha posttranskripčně modifikuje na pre-miRNA vlásenkovitého vzhledu. Tato prekurzorová RNA je pak transportována exportiny z jádra do cytoplazmy.
V cytoplazmě již další biogeneze malých RNA probíhá společně, bez ohledu na původ výchozí dvouřetězcové RNA. Enzym Dicer štěpí exogenní dsRNA a endogenní pre-miRNA do krátkých dvouřetězcových fragmentů zvaných siRNA a miRNA, které zahajují tvorbu RISC komplexu (RNA-induced silencing complex) (39). RISC komplex obsahuje především endonukleázy, které oddělí od sebe vlákna malých RNA (siRNA a miRNA) (obr. 2). Vedoucí vlákno malé RNA se pak naváže na komplementární sekvenci mRNA, kterou buď rozštěpí a degraduje (při neúplné komplementaritě) nebo zablokuje pro translaci (při úplné komplementaritě)(3, 26).
2. Mechanismus biogeneze miRNA 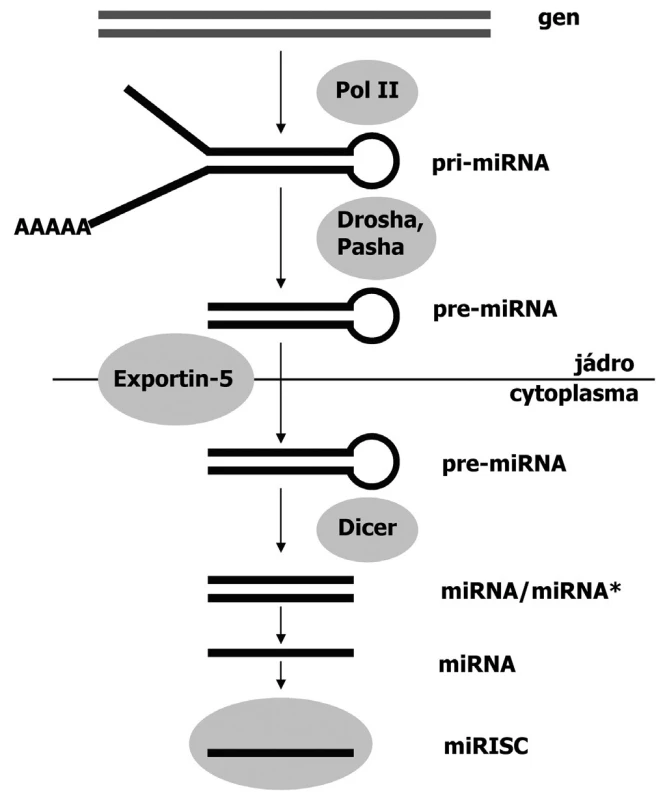
RNAi v nádorové transformaci a tumorigenezi
Je známo, že v nádorovém procesu dochází také k poruchám v expresi genů klíčových pro buněčný růst, diferenciaci a programovanou smrt. Vedle již dříve zmíněných epigenetických změn je RNAi prostřednictvím malých RNA dalším významným regulátorem genové exprese. MiRNA inhibují translaci mRNA mnoha cílových genů, které se podílejí na rozvoji nádorů (3). Tímto dochází ke změnám hladin příslušných proteinů, což může spolu s dalšími změnami vyústit v nádorovou transformaci. Geny kódující miRNAs jsou obvykle lokalizovány v těch oblastech genomu, které jsou často v nádorových buňkách ztraceny nebo amplifikovány (49).
Díky objevu miRNA a siRNA nalezl nádorový výzkum novou základnu. V posledních letech dochází k rozvoji poznatků o výskytu malých RNA v jednotlivých nádorech, což je příslibem pro novou terapeutickou strategii. Vzhledem k tomu, že zmíněné fenomény hrají roli v patogenezi, klasifikaci a prognózování nádorů, měli by být patologové o nich dobře informováni (53).
Malé RNA podílející se na tumorigenezi jsou tvořeny zejména vlastními buňkami (miRNA), v menší míře viry (siRNA) (tyto se uplatňují ve virové patogenezi nádorů).
MiRNA (též zvané microRNA) se řadí k posttranskripčním regulátorům. V lidském genomu bylo experimentálně identifikováno přes 500 miRNA (21). Tyto malé nekódující RNA plní různou úlohu v buněčných a vývojových procesech. Jejich aberantní exprese vede k různým onemocněním včetně vzniku nádorů. Příčinou této porušené exprese mohou být chromozomální abnormality či mutace genů pro miRNA nebo epigenetické změny postihující zmíněné geny, zejména hypermetylace promotorů. Bylo prokázáno, že v nádorech je povšechný pokles miRNA exprese. Pokles miRNA může přispívat k tvorbě a udržování nádorových buněk, včetně méně diferencovaných nádorových kmenových buněk (cancer stem cells; CSC)(37). Studium miRNA v různých typech nádorů a nádorových buněčných liniích ukázalo velkou různorodost v dysregulaci miRNA (6). Nicméně se zdá pravděpodobné, že určité typy nádorů mají charakteristický profil miRNA. Některé miRNA jsou specifické pro konkrétní tumor, jiné se vyskytují ve více nádorových typech (49).
V tumorigenezi mohou miRNA vykazovat funkci tumor supresorovou nebo onkogenní (21). Jak již bylo uvedeno, oblasti genomu obsahující geny, které kódují miRNA, jsou často v nádorových buňkách deletovány nebo amplifikovány. MiRNA fungují jako tumor supresorové v případě, kdy dojde k jejich redukci nebo chybění, ať již v důsledku genového defektu nebo jejich porušené biogeneze. Důsledkem těchto změn je zvýšená tvorba onkoproteinu, jehož mRNA je cílová pro příslušnou miRNA. Naopak miRNA plní funkci onkogenní za těch okolností, kdy je tvořena v nadbytku a utlumí tvorbu proteinu, který je kódován příslušným tumor supresorovým genem (tab. 1). Vybrané miRNA, jejich funkce, regulovaný cílový gen a nejčastější přidružený nádor(y) jsou uvedeny v tab. 2 (14, 29, 33, 39, 44, 53).
1. Přehled funkcí miRNA v tumorigenezi 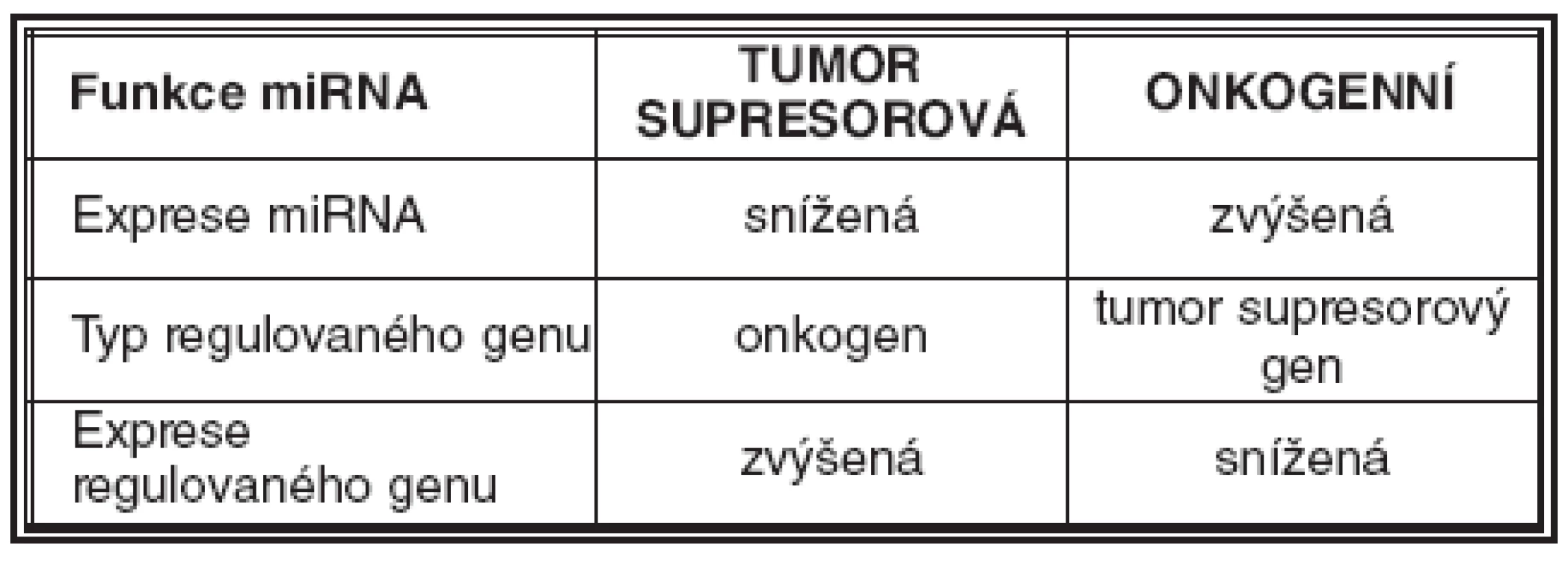
2. Vybrané typy miRNA v tumorigenezi 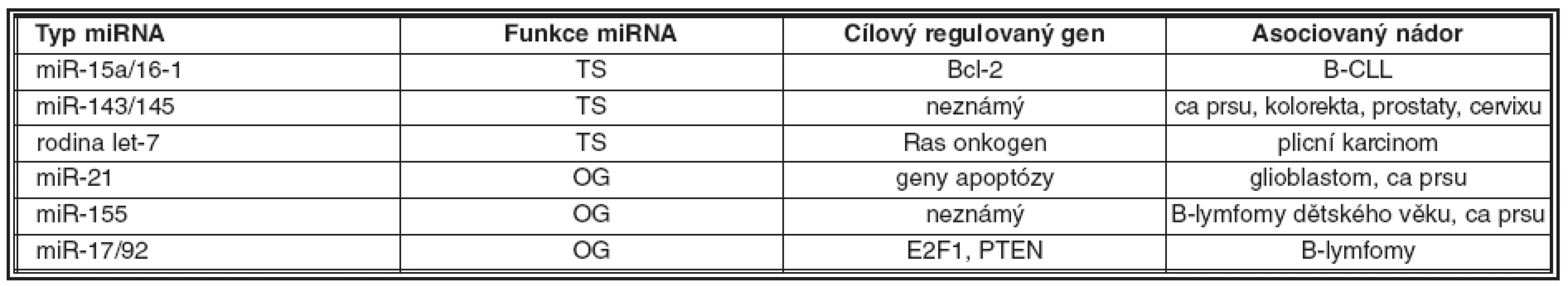
TS = tumor supresorová; OG = onkogenní Význam RNAi
RNAi se jako významný regulátor genové exprese vyskytuje u většiny eukaryotických organismů. Tento fenomén je také považován za formu vrozené imunity proti virům a hraje roli v regulaci rozvoje a v genomové stabilitě (39).
RNA interference se stala jednak významným nástrojem při studiu funkce genů (26), jednak umožnila detailnější objasnění mnoha chorobných procesů. Znalost a pochopení podstaty tohoto jevu jsou příslibem pro budoucí terapeutické využití.
RNAi jako důležitý mechanismus je v současné době využívána nebo intenzivně studována zejména v následujících oborech:
- a) Funkční genomika
RNA interference usnadnila studium genové exprese jak v buněčných kulturách, tak v živých organismech. Syntetická dsRNA zabudovaná do buněk způsobuje supresi specifických studovaných genů (tuto techniku nazývanou „knockdown“ je třeba odlišit od „knockout“ metody, při které musí být studované geny zcela eliminovány).
- b/ Biotechnologie
Předpokládá se uplatnění RNAi zejména v biotechnologii rostlinné stravy, kde její využití bude zaměřeno na snižování obsahu přirozených toxinů, redukci hladin alergenů apod.
- c) Medicína
RNA interference by mohla nalézt terapeutické využití při regulaci exprese klíčových genů u virových onemocnění, neurodegenerativních chorob (např. Huntingtonovy choroby) a nádorů (11).
Léčba nádorů na principu RNAi by měla být založena na dvou mechanismech(14, 21):
- použití syntetických anti-sense oligonukleotidů (anti-miRNA oligonukleotidy = AMOs), které mohou inaktivovat miRNAs v tumorech a blokovat tak jejich růst,
- aplikace siRNA do nádoru za účelem snížení patologicky zvýšené exprese onkoproteinů (např. represe aktivující mutace Ras genu prostřednictvím let-7).
Epiteliálně-mezenchymální tranzice (EMT)
EMT byla poprvé pozorována v roce 1980 a charakterizována jako dynamický proces transformace buněk epitelových do mezenchymových prostřednictvím speciálního transkripčního programu. Později byl popsán i opačný proces zvaný mezenchymálně-epiteliální tranzice (MET) (22). Aplikace EMT do nádorové problematiky umožňuje patologům lépe vysvětlit dobře známé a v různých nádorech běžně pozorované mikroskopické nálezy, jako je současný výskyt epiteliální a mezenchymální nádorové složky (20, 22), přítomnost sarkomatoidní diferenciace nebo anaplazie (12).
V průběhu EMT dochází k důležitým změnám ve fenotypu buněk, které spočívají v uvolnění mezibuněčných spojů, ztrátě buněčné apiko-bazální polarity a v reorganizaci cytoskeletu (poklesu exprese cytokeratinů a vzrůstající akumulace vimentinu). Spoje mezi buňkami a extracelulární matrix vymizí a transformované buňky nabývají protáhlého tvaru. Významně též vzrůstá buněčná motilita. Buňky mezenchymálního vzhledu rovněž přispívají k syntéze složek ECM a k tvorbě matrixových metaloproteináz a jsou též bohatým zdrojem signálních proteinů, které působí na epiteliální buňky jako růstové faktory. Ztráta kadherinové exprese a schopnost buněk přežívat v nepřítomnosti složek extracelulární matrix (podpora antiapoptotické aktivity) jsou též důležitým znakem EMT (7, 20, 23).
EMT je vysoce specifická pro určitý tkáňový a buněčný typ a je indukována faktory, které mohou mít odlišné projevy v různých tkáních. EMT hraje významnou roli v mnoha fyziologických a patologických procesech jako je embryogeneze, hojení ran, orgánová fibróza či nádorová progrese (43). Důležitý je rovněž objev, že v procesu EMT jsou tvořeny buňky s vlastnostmi kmenových buněk (30). V nádorovém procesu tak EMT generováním nádorových kmenových buněk umožňuje nejen rozsev buněk z primárního tumoru, ale rovněž zachování schopnosti sebeobnovy pro vznik metastáz (9).
V nádorech se uplatňuje EMT při invazi a metastazování, kdy se projeví základní vlastnosti transformovaných buněk mezenchymálního fenotypu, jako schopnost oddělovat se od okolních buněk, migrovat do hostitelské tkáně a penetrovat do cév. Na histologické úrovni jsou invadující buňky dobře patrny. Ačkoliv molekulární základ EMT není zcela vysvětlen, bylo již odhaleno několik signálních molekul a korespondujících signálních cest (Wnt, TGF-ß, Hedgehog, Notch a nukleární faktor-κB (NF-κB)), které se zdají být zásadní v zahájení EMT. Všechny tyto cesty se soustřeďují a způsobují prostřednictvím represivních transkripčních proteinů (Snail, Slug, Twist apod.) snížení produkce E-kadherinu. Nedávno byl též popsán silný regulační účinek microRNA v EMT (5, 51). Ke ztrátě exprese E-kadherinu může dojít rovněž vlivem promotorových hypermetylací a mutací v jeho genu. Tyto mutace jsou ve většině karcinomů vzácné, s výjimkou difuzních typů, jako je lobulární karcinom prsu a difuzní karcinom žaludku. Souvislost molekulárních a morfologických změn v procesu EMT je dobře patrna a byla detailněji studována zejména ve vřetenobuněčných dlaždicových karcinomech, v nichž byla prokázána snížená exprese E-kadherinu a kateninu, eventuelně zvýšená exprese Snail-1 (23, 25, 54). Molekuly, které se podílejí na procesu EMT, jsou potenciálním cílem pro působení farmak, čímž se otevírají nové cesty pro léčbu metastatických nádorů (20).
EMT je často následována opačným procesem nazývaným mezenchymálně-epiteliální tranzice (MET), která byla pozorována v mnoha mezenchymálních tumorech ve formě ložiskové epiteliální diferenciace. Předpokládá se, že je vyvolána derepresí promotoru genu pro E-kadherin, což vede k následné expresi E-kadherinu a k tranzici do epitelového fenotypu. MET se uplatňuje i v metastatických nádorových buňkách karcinomu, které tímto procesem nabývají opět vzhled primárního tumoru. Existuje tak značná buněčná plasticita, která umožňuje nádorovým buňkám podléhat EMT a následně MET v procesu mikrometastazování (51).
Nádorové kmenové buňky
Již v 19. století si Rudolf Virchow a Julius Cohnheim všimli, že některé nádory napodobují fetální vývoj. Předpokládali původ těchto nádorů z nezralých embryonálních buněk a embryonálních reziduí a vyslovili koncept buněčné hierarchie v nádorech (Virchowova hypotéza embryonálních reziduí) (18, 46). Jejich myšlenky a poznatky byly rozvinuty o 150 let později vyslovením hypotézy o vzniku nádorových kmenových buněk (cancer stem cell, CSC) a jejich úloze v řízení nádorů. Uvedená teorie přispěla k objasnění nádorové biologie, mnoha morfologických, klinických i terapeutických charakteristik zhoubných nádorů a k hledání nových léčebných strategií (18, 46).
Kmenové buňky jsou buňky charakterizované jednak schopností „nekonečné“ sebeobnovy, jednak schopností diferenciace. Pro kmenové buňky je typické asymetrické dělení, jehož výsledkem je vznik populace buněk kmenových, progenitorových a diferencovaných. Savčí kmenové buňky zahrnují dva typy: embryonální (mohou se diferenciovat do specializovaných embryonálních tkání) a adultní (diferenciace do tkáňově specifických buněk). Normální kmenové buňky se podílejí na embryonálním vývoji a na regeneračních procesech a účastní se též v procesu kancerogeneze transformací do nádorových kmenových buněk (28).
Nádorové kmenové buňky jsou definovány jako podskupina nádorových buněk, které mají schopnost řídit růst a šíření nádoru. Přítomnost CSC byla původně odhalena v hematologických malignitách a posléze i v řadě solidních nádorů, zejména v nádorech CNS, prsu, melanomu, kolorektálním karcinomu, ovariu a nádorech štítné žlázy (1, 8, 9, 24, 36, 42, 45, 46, 47). Teorie existence nádorových kmenových buněk poskytuje vhodnou základnu pro objasnění morfologické a funkční heterogenity nádorů (13) . Nádorová heterogenita je důsledkem asymetrického dělení CSC, čímž vzniká jednak nová populace nádorových kmenových buněk (jsou zodpovědné za tumorigenezi), jednak populace často aberantně diferencovaných nádorových buněk s žádnou nebo s omezenou schopností buněčného dělení (2, 31). Tradiční stochastický model tumorigeneze předpokládá, že každá nádorová buňka je schopná zahájit růst nádoru v důsledku mutací, epigenetických změn a klonální selekce buněk přizpůsobivých na nádorové mikroprostředí (46, 47). Oproti tomu model CSC vysvětluje, že nádorová aktivita a růst jsou řízeny pouze malou částí (méně než 1%) nádorových buněk.
Kmenové buňky normální a nádorové sdílejí řadu společných vlastností, jako jsou již zmíněná schopnost sebeobnovy a diferenciace, dále produkce antiapoptotických proteinů, sekrece cytokinů a angiogenních faktorů zásadních pro šíření nádoru a zvýšená schopnost provádět opravy DNA (31). Velký význam v procesu sebeobnovy a udržování kmenových buněk též hraje telomerázová aktivita a detoxikační schopnost kmenových buněk daná expresí ABC transportérů. Proces sebeobnovy normálních a nádorových kmenových buněk je řízen shodnými molekulárními mechanismy, které zahrnují různé signální cesty (Hedgehog, Notch, Wnt, PTEN aj.) více náchylné k hromadění mutací. Deregulací těchto signálů může dojít k expanzi kmenových buněk, což je klíčovou událostí kancerogeneze (9, 28).
Původ a vývoj CSC je složitý multifaktoriální proces. Výchozími buňkami pro vznik CSC mohou být nejen tkáňově příslušné nenádorové buňky kmenové, buňky progenitorové nebo buňky zralé, ale rovněž i diferencované buňky již existujícího nádoru. Mechanismy transformace výše uvedených buněk do CSC spočívají v sérii genetických a epigenetických změn, které vyústí v aktivaci signálních cest řídících proces sebeobnovy, dediferenciace a nádorové transformace (50). CSC nemusí být jen příčinou, nýbrž i důsledkem kancerogeneze. Na základě těchto pochodů je možné zdůvodnit některé fenomény, s nimiž se v nádorech setkáváme. Například je tímto možno objasnit histofenotyp nádorů jater, které mohou vykazovat hepatocelulární, cholangiocelulární nebo intermediární vzhled. Tato morfologická rozmanitost může být snadno vysvětlena odvozením nádorových buněk od jaterních tkáňově specifických kmenových buněk, které jsou bipotentní a mohou se diferencovat do hepatocytů i do žlučovodových buněk. Dále je možné na základě výskytu CSC vysvětlit nepříznivé biologické chování nádorů a terapeutické souvislosti.
Přítomnost CSC v nádoru má vliv na jeho diseminaci i na úspěšnost jeho terapie (27). Protože CSC jsou relativně odolné k běžné cytostatické léčbě, současná nádorová terapie vede pouze ke zmenšení nádoru a navození remise, ale není kurativní. Příčinou neúspěchu klasické chemoterapie je fakt, že CSC jsou často v klidovém stavu a že mají mechanismy pro eliminaci toxinů. Rezistence nádorů k radioterapii je zase vysvětlována aktivací DNA reparačních mechanismů. Důsledkem přetrvávající přítomnosti CSC je recidiva nádoru (24). Pouze terapie zacílená na CSC zabraňuje recidivě a je příslibem pro úplné odstranění nádoru (Obr.3). Nenádorové kmenové buňky by měly být účinků terapie ušetřeny (9). Proto se další výzkum zaměřuje na hledání biomarkerů a signálních cest typických pouze pro CSC, např. CD44+ CD24 - fenotyp u CSC prsu (8). Většina dosud popsaných markerů exprimovaných kmenovými buňkami, jako transmembránový glykoprotein CD133 (Prominin-1) vyskytující se převážně u neurálních a intestinálních kmenových buněk, či p63 ve štítné žláze, neumožňuje odlišení kmenových buněk nádorových a nenádorových (13, 34, 38, 42, 52).
3. Odpověď nádoru na použitou terapii dle teorie CSC 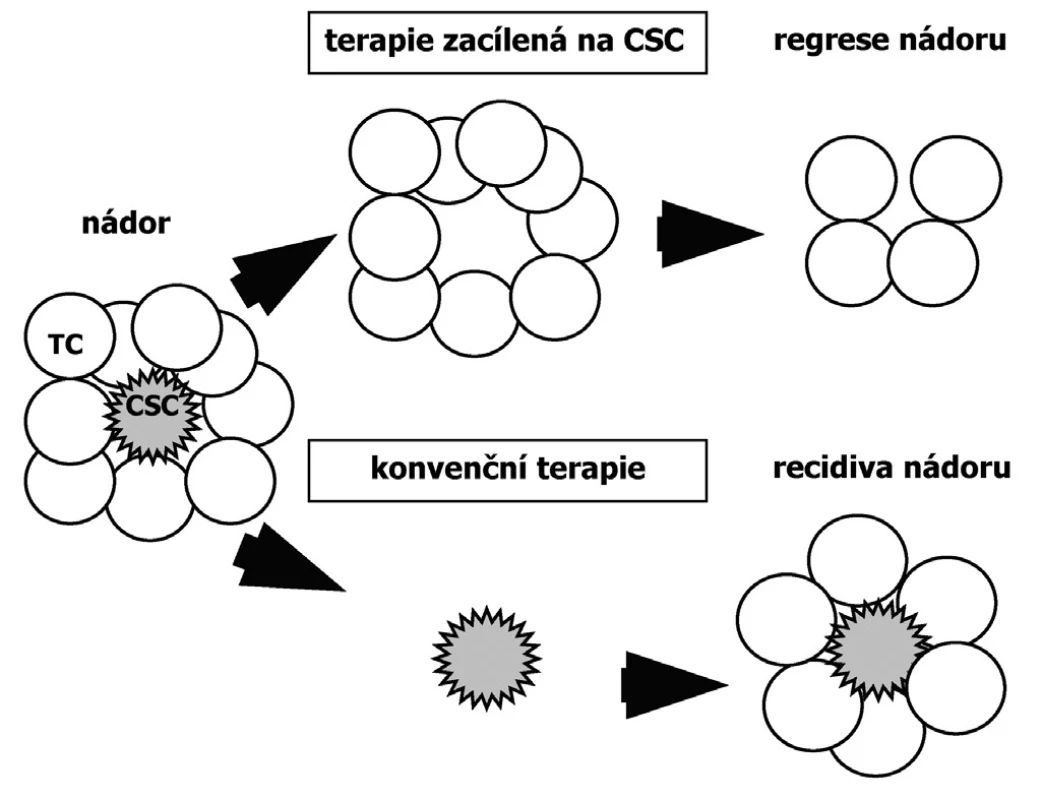
Závěr
Na základě všech výše uvedených fenoménů, které se mohou účastnit v procesu vzniku a rozvoje nádorů, je zjevné, že se nám jejich dokonalejším poznáním otevírají nové preventivní, diagnostické i terapeutické možnosti. Výběr správné léčebné strategie předpokládá co nejpodrobnější analýzu právě diagnostikovaného nádoru, díky úzké spolupráci řady specialistů – patologů, molekulárních genetiků a onkologů.
Práce byla podpořena výzkumným záměrem MSM 0021620819
Doc. MUDr. Marie Ludvíková, Ph.D.
Ústav biologie LF UK
Karlovarská 48
301 66 Plzeň,
tel: 377593260
e-mail: ludvikova.m@email.cz
Sources
1. Ailles, L.E., Weissman, I.L.: Cancer stem cells in solid tumors. Current Opinion in Biotechnology, 2007, 18 : 460–466.
2. Bapat, S.A.: Evolution of cancer stem cells. Seminars in Cancer Biology, 2007, 17 : 204–213.
3. Bhindi, R., Fahmy, R.G., Lowe, H.C. et al.: Brothers in arms. DNA enzymes, short interfering RNA, and the emerging wave of small molecule nucleic acid-based gene-silencing strategies. Am. J. Pathol., 2007, 171 : 1079–1088.
4. Brown, R., Strathdee, G.: Epigenomics and epigenetic therapy of cancer. Trends in Molecular Medicine, 2002, 8 (4supl.): 43–48.
5. Cano, A., Nieto, M.A.: Non-coding RNAs take centre stage in epithelial-to-mesenchymal transition. Trends in Cell Biology, 2008, 18 : 357–359.
6. Chan, J.A., Krichevski, A.M., Kosik, K.S.: MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells. Cancer Res., 2005, 65 : 6029–6033.
7. Chan, T.L., Yuen, S.T., Kong, C.K. et al.: Heritable germline epimutation of MSH2 in a family with hereditary nonpolyposis colorectal cancer. Nat. Genet., 2006, 38 : 1178–1183.
8. Charafe-Jauffret, E., Monville, F., Ginestier, C., Dontu, G., Birnbaum, D., Wicha, M.: Cancer stem cells in breast: current opinion and future challenges. Pathobiology, 2008, 75 : 79–84.
9. Croker, A.K., Allan, A.L.: Cancer stem cells: implications for the progression and treatment of metastatic disease. J. Cell. Mol. Med., 2008, 12 : 374–390.
10. Cunningham, J.M., Christensen, E.R., Tester, D.J. et al.: Hypermetylation of the bhMLH1 promotor in colon cancer with microsatellite instability. Cancer Res., 1998, 58 : 3455–3460.
11. Dalmay, T., Edwards, D.E.: MicroRNAs and the hallmarks of cancer. Oncogene, 2006, 25 : 6170–6175.
12. DeWever, O., Pauwels, P., CeCraene, B. et al.: Molecular and pathological signatures of epithelial-mesenchymal transitions at the cancer invasion front. Histochem. Cell. Biol., 2008, 130 : 481–494.
13. Dick, J.E.: Stem cell concepts renew cancer research. Blood, 2008, 112 : 4693-4708.
14. Esquela-Kerscher, A., Slack, F.J.: Oncomirs – microRNAs with a role in cancer. Nature Rew/Cancer, 2006, 6 : 259–269.
15. Esteller, M., Herman, J.G.: Cancer as an epigenetic disease: DNA methylation and chromatin alterations in human tumors. J. Pathol., 2002, 196 : 1–7.
16. Feinberg, A.P., Tycko, B.: The history of cancer epigenetics. Nature Rev. J. Cancer, 2004, 4 : 143–152.
17. Fire, A., Xu, S.Q., Montgomery, M. K., Kostas, S.A., Driver, S.E.; Mello, C.C.: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 1998, 391 : 806–811.
18. Gil, J., Stembalska, A., Pecs, K. A., Sasiadek, M. M.: Cancer stem cells: the theory and perspectives in cancer therapy. J.App. Genet., 2008, 49 : 193–199.
19. Gronbaek, K., Hother, C., Jones, P.A.: Epigenetic changes in cancer. APMIS, 2007, 115 : 1039–1059.
20. Guarino, M., Rubino, B., Ballabio, G.: The role of epithelial-mesenchymal transition in cancer pathology. Pathology, 2007, 39 : 305-318.
21. Hagan, J.P., Croce, C.M.: MicroRNAs in carcinogenesis. Cytogenet. Genome Res., 2007,118 : 252–259.
22. Hugo, H., Ackland, M.L., Blick, T. et al.: Epithelial-mesenchymal transition in carcinoma progression. J. Cell. Physiol., 2007, 213 : 374–383.
23. Iwata, H., Aoyama, Y., Kamiya, H., Ichiki, Y., Kitajima Y.: Spindle cell squamous cell carcinoma showing epithelial-mesenchymal transition. JEADV (Journal European Academy of Dermatology and Venerology ), 2008, 23 : 169–243.
24. Jordan, C.T., Guzman, M.L., Noble, M.: Cancer stem cells. N. Engl. J. Med., 2006, 355 : 1253–1261.
25. Koje, N., Volavšek, M., Cardes, A. et al.: Cadherin-catenin complex and transcription factor Snail-1 in spindle cell carcinoma of the head and neck. Virchows Arch., 2008, 453 : 267–274.
26. Kontrová, K., Škop, V., Sajdok, J., Zídková, J.: RNA interference a praktické aspekty jejího využití. Chem. Listy, 2009, 103 : 302–309.
27. Li, F., Tiede, B., Massague, J., Kang, Y.: Beyond tumorigenesis: cancer stem cells in metastasis. Cell Research, 2007, 17 : 3–14.
28. Lobo, N.A., Shimoto, Y., Qian, D., Clarke, M.F.: The biology of cancer stem cells. Annu. Rev.Cell. Dev Biol., 2007, 23 : 675–699.
29. Lu, J., Getz, G., Miska, E.A. et al.: MicroRNA expression profiles classify human cancers. Nature, 2005, 435 : 834–838.
30. Mani, S.A., Guo, W., Liao, M. et al.: The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell, 2008, 133 : 704–715.
31. Martinez-Climent, J.A., Andrea, E.J., Prosper, F.: Somatic stem cells and the origin of cancer. Clin.Transl. Oncol., 2006, 8; 547–663.
32. Mielnicki, L.M., Asch, H.L., Asch, B.B.: Genes, chromatin, and breast cancer: an epigenetic tale. Journal of Mammary Gland Biology and Neoplasia, 2001, 6 : 169-182.
33. Michael, M.Z., O’Conno, S.M., vanHolst Pellekan, N.G., Young, G.P., James, R.J.: Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol. Cancer Res., 2003, 1 : 882-891.
34. Mizrak, D., Brittan, M., Alison, M.R.: CD 133: molecule of the moment. J. Pathol., 2008, 214 : 3-9.
35. Ohlsson, R., Kanduri, C., Whitehead, J., Pfeifer, S., Lobanenkov, V., Feinberg, A.P.: Epigenetic variability and the evolution of human cancer. Adv. Cancer Res., 2003, 88 : 145–168.
36. Pan, Y., Huang, X.: Epithelial ovarian cancer stem cells-a review. Int. J. Clin. Exo. Med., 2008, 1 : 260–266.
37. Papagiannakopoulos, T., Kosik, K.S.: MicroRNAs: regulators of oncogenesis and stemness. BMC Medicine, 2008, 6; 1–4.
38. Ricci-Vitiani, L., Pagliuca, A., Palio, E., Zeuner, A., DeMaria, R.: Colon cancer stem cells. Gut, 2008, 57; 538–548.
39. Ross, J.S., Carlson, J.A., Brock, G.: miRNA. The new gene silencer. Am. J. Clin. Pathol., 2007, 128 : 830–836.
40. Shelton, B.P., Misso, N.L., Shaw, O.M., Arthaningtyas, E., Bhoola, K.D.: Epigenetic regulation of human epithelial cancer. Current Opinion in Molecular Therapeutics, 2008, 10 : 568–578.
41. Sjoblom, T., Jones, S., Wood, L.D. et al.: The consensus coding sequences of human breast and colorectal cancers. Science, 2006, 314 : 268–274.
42. Thomas, D., Friedman, S., Lin, R.Y.: Thyroid stem cells: lessons from normal development and thyroid cancer. Endocrine-Related Cancer, 2008, 15; 51–58.
43. Tsukamoto, H., Shibata, K., Kajiyama, H., Terauch, M., Nawa, A., Kikkawa, F.: Irradiation-induced epithelial-mesenchymal transition (EMT) related to invasive potential in endometrial carcinoma cell. Gynecologic Oncology, 2007, 107 : 500–504.
44. Volinia, G., Colin, G.A., Liu, C.G. et al.: A micro RNA expression signature of human solid tumors defines cancer gene targets. Proc. Natl. Acad.Sci. USA, 2006, 103 : 2257–2261.
45. Wang, J.C., Dick, J.E.: Cancer stem cells: lessons from leukemia. Trends Cell Biol., 2005, 15 : 494––501.
46. Wicha, M.S., Suling, L., Dontu, G.: Cancer stem cells: an old idea – a paradigm shift. Cancer Res., 2006, 66 : 1883–1890.
47. Willis, N.D., Przyborsk, S.A., Hutchison, C.J., Wilson, R.: Colonic and colorectal cancer stem cells: progress in the search for putative biomarkers. J. Anat., 2008, 213 : 59–65.
48. Wong, J.J.L., Hawkins, N.J., Ward, R.L.: Colorectal cancer: a model for epigenetic tumorigenesis. Gut, 2007, 56 : 140–8.
49. Wu, W., Sun, M., Zou, G.M., Chen, J.: MicroRNA and cancer: current status and prospective. Int. J. Cancer, 2006, 120 : 953–960.
50. Wu, X.Y.: Origin of cancer stem cells: The role of self-renewal and differentiation. Ann. Surg. Oncol., 2008, 15 : 407–414.
51. Wu, Y., Zhou, B.P.: New insights of epithelial-mesenchymal transition in cancer metastasis. Acta Biochim. Biophys. Sin., 2008, 40 : 643–650.
52. Zhang, P., Zuo, H., Ozaki, T., Nakagomi, N., Kakudo, K.: Cancer stem cell hypothesis in thyroid cancer. Pathology International, 2006, 56, 485–489.
53. Zhang, W., Dahlberg, J.E., Tam, W.: MicroRNAs in tumorigenesis. Am. J. Pathol., 2007, 171 : 728–738.
54. Zidar, N., Gale, N., Koje, N. et al.: Cadherin-catenin complex and transcription factor Snail-1 in spindle cell carcinoma of the head and neck. Virchow Arch., 2008, 453 : 267–274.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2009 Issue 4-
All articles in this issue
- Unusual Clinical Presentation of Hepatic Yolk Sac Tumour in Periappendical Region. A Case Report and Review of the Literature
- Congenital Granular Cell Epulis: a Case Report
- New Aspects of Tumor Pathobiology
- Detection of Regulatory Protein p16/INK4A in the Dysplastic Cervical Squamous Cell Epithelium is a Diagnostic Tool for Carcinoma Prevention
- Mammaglobin Immunostaining in the Differential Diagnosis Between Cutaneous Apocrine Carcinoma and Cutaneous Metastasis from Breast Carcinoma
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Detection of Regulatory Protein p16/INK4A in the Dysplastic Cervical Squamous Cell Epithelium is a Diagnostic Tool for Carcinoma Prevention
- Congenital Granular Cell Epulis: a Case Report
- New Aspects of Tumor Pathobiology
- Mammaglobin Immunostaining in the Differential Diagnosis Between Cutaneous Apocrine Carcinoma and Cutaneous Metastasis from Breast Carcinoma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

