Úvod do problematiky lidského močového mikrobiomu
Authors:
Jan Hrbáček 1; Vítězslav Hanáček 1; Pavel Čermák 2; Daniel Morais 3; Roman Zachoval 1
Authors‘ workplace:
Urologická klinika 3. LF UK a Thomayerovy nemocnice, Praha
1; Oddělení klinické mikrobiologie, Thomayerova nemocnice, Praha
2; Mikrobiologický ústav Akademie věd České republiky, Praha
3
Published in:
Ces Urol 2021; 25(1): 17-26
Category:
Review article
Overview
Hrbáček J, Hanáček V, Čermák P, Morais D, Zachoval R. Úvod do problematiky lidského močového mikrobiomu.
Předpoklad sterility zdravé moči byl v posledních letech vyvrácen průkazem existence močového mikrobiomu (MM). Rozšířená kvantitativní močová kultivace poskytuje inokulu delší čas k inkubaci za rozličných růstových podmínek a dokazuje přítomnost bakterií ve vzorcích hodnocených standardní kultivací jako negativní. Masivní paralelní sekvenování (NGS) s vysokou citlivostí detekuje bakteriální gen pro ribozomální 16S RNA a podle variabilních sekvencí tohoto genu lze daný mikroorganismus taxonomicky zařadit. Lidský MM tvoří převážně taxony spadající do kmenů Proteobacteria, Firmicutes, Bacteroidetes a Actinobacteria. U žen dominuje rod Lactobacillus, u mužů není rozdělení urotypů zatím zcela objasněno. Změny ve složení MM jsou dle dosavadních poznatků spojovány s funkčními poruchami urogenitálního traktu (symptomy dolních močových cest, urgentní inkontinence, neurogenní měchýř, chronická renální insuficience), syndromem chronické pánevní bolesti, intersticiální cystitidou a dokonce s nádory močového měchýře. MM může potenciálně plnit řadu úloh, které bude teprve třeba objasnit, a předpokládá se jeho diagnostické i terapeutické využití.
Klíčová slova:
Lidský mikrobiom – rozšířená kvantitativní močová kultivace – sekvenování příští generace – urogenitální systém
ÚVOD
Předpoklad absence jakýchkoli mikrooganismů ve zdravé moči je jedním z pilířů našeho oboru. Původ této myšlenky sahá do poloviny 19. století, kdy Louis Pasteur, John Lister a další výzkumníci v experimentech pozorovali zkalení moči vystavené okolnímu prostředí v důsledku pomnožení přítomných bakterií, zatímco moč v uzavřené zkumavce zůstala čirá (1). Koncentrace 105 mikroorganismů/ ml moči jako hranice klinicky významné infekce močových cest (IMC) byla stanovena v 50. letech 20. století harvardským infektologem Edwardem Kassem na základě srovnání pacientek s akutní pyelonefritidou (n = 74) a 444 zdravých kontrol (1, 2). I přes omezenou velikost jeho výzkumného souboru a nepopiratelný pokrok v diagnostice uroinfekcí se prahová hodnota 105 používá i 60 let po svém zavedení, přestože řada prací i klinická praxe poukázaly na její úskalí (2).
V posledním desetiletí se dogma o sterilitě zdravé moči otřáslo v základech díky objevu existence močového mikrobiomu (MM). Odhaduje se, že počet bakterií žijících v komensálním vztahu na povrchu i uvnitř našeho těla desetkrát převyšuje počet našich vlastních buněk (3). Teprve nedávno byl však v rámci Projektu lidského mikrobiomu (Human Microbiome Project, HMP) učiněn pokus o přesnější popis mikrobiálních populací žijících v lidském těle, konkrétně v ústní dutině, orofaryngu, na kůži, ve střevě a ve vagině (4). Následnými výzkumy bylo potvrzeno, že pro jednotlivé lokality našeho organismu existují typická složení bakteriálních populací a jejich změny (používá se termín eubióza a dysbióza) doprovázejí či mohou signalizovat různé patologické stavy včetně onkologických onemocnění (5). Pro soubor všech mikroorganismů (včetně virů a hub) přítomných v určité lokalizaci se v literatuře používá termínu mikrobiota, zatímco mikrobiom označuje soubor jejich genetické informace (bakteriální i virové DNA, plasmidů atd.) (6). Někdy se oba pojmy volně zaměňují; v dalším textu budeme výraz mikrobiom užívat v širším významu zahrnujícím spektrum mikroorganismů a jejich fenotypických rysů v dané anatomické lokalitě.
Z důvodů uvedených v prvním odstavci nebyl urogenitální systém zahrnut do projektu HMP. V poslední dekádě se však objevily překvapivé výzkumy dokazující, že moč asymptomatických jedinců, nadto s negativním závěrem standardní kultivace, obsahuje plejádu mikroorganismů, o jejichž přítomnosti jsme díky omezeným možnostem lidského poznání zatím neměli tušení. Cílem tohoto textu je přiblížit čtenářům–urologům dosavadní poznatky na poli výzkumu močového mikrobiomu (MM) a jejich potenciální aplikace v budoucnosti. Nejprve budou popsány metody studia MM, jejich výstupy a způsob hodnocení a na závěr shrneme poznatky o spojitosti MM s maligními, benigními i funkčními onemocněními urogenitálního traktu.
METODY
Základem tohoto narativního přehledového článku byla rešerše v databázi PubMed uskutečněná 25. 2. 2019 na počátku našeho vlastního výzkumného projektu s použitím vyhledávacích výrazů „urinary microbiome“ a „urinary microbiota“, bez časového omezení a s filtrováním výsledků na humánní studie. Po výběru relevantních publikací podle jejich názvů a abstrakt a pročtení celých prací jsme další zdroje vyhledali (a dle relevance zařadili do tohoto přehledu) v odkazech na literaturu u jednotlivých prací. Dále jsou zahrnuta odborná sdělení k tématu publikovaná v průběhu uplynulých dvou let.
VÝSLEDKY A DISKUZE
Metody výzkumu MM
Detailní zkoumání MM v poslední dekádě bylo umožněno významným zdokonalením a rozšířením platforem pro sekvenaci DNA, tzv. masivního paralelního sekvenování (next‑generation sequencing, NGS) a dále zavedením metodiky rozšířené močové kultivace (expanded quantitative urine culture, EQUC).
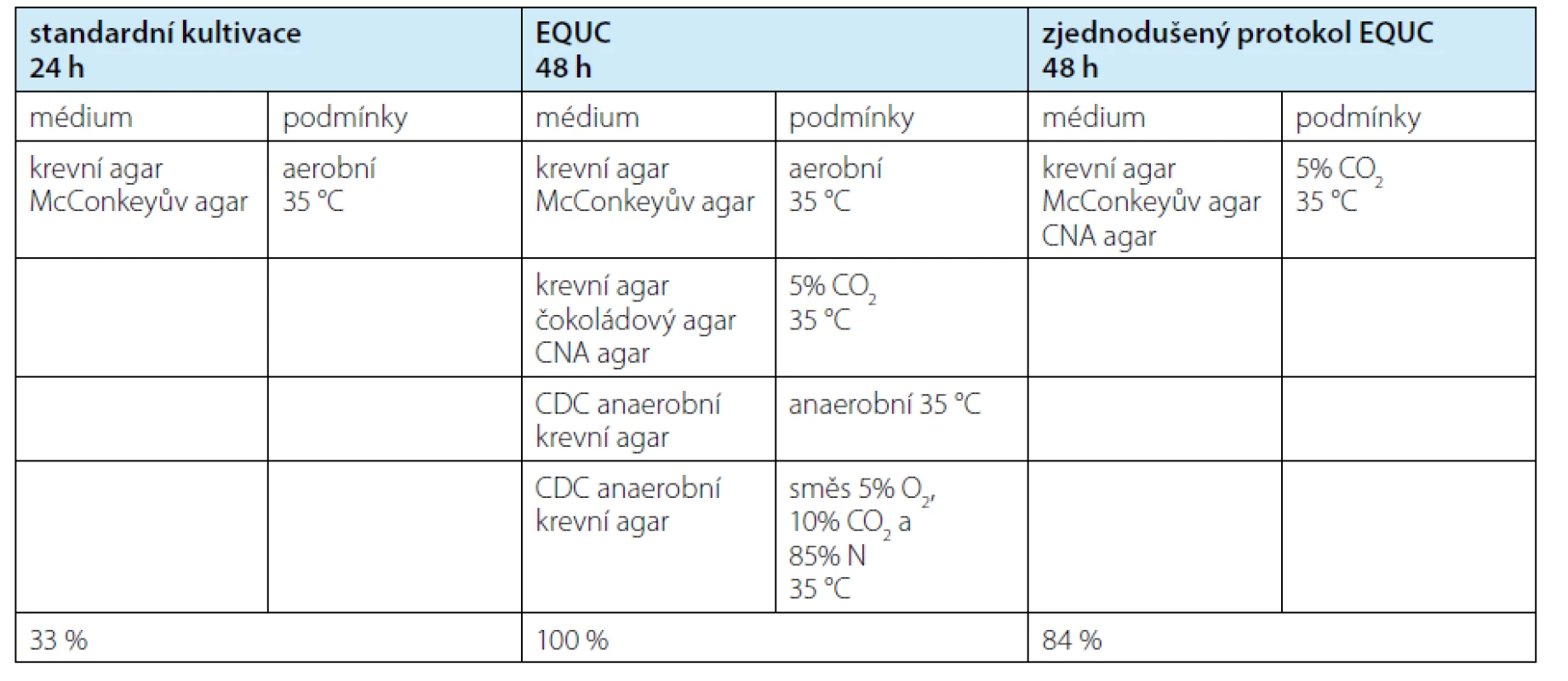
Technika standardní močové kultivace založená na inokulaci 1 μl moči sterilní kličkou na krevní a McConkeyho agar vede k preferenčnímu růstu G-bakterií. To je výhodné z hlediska detekce nejčastějších klinicky důležitých uropatogenů, avšak odvrácenou stranu mince představuje nízká senzitivita metody vůči G+ mikroorganismům, nemluvě o fastidiózních (obtížně kultivovatelných) mikrobech (7). Myšlenka EQUC (8) spočívá v inokulaci násobně většího množství materiálu na více různých půd a jejich inkubaci za různých růstových podmínek po delší dobu (tabulka 1). Výsledkem je výrazně vyšší záchyt mikroorganismů včetně méně typických (např. Alloscardovia spp., Moraxella spp., Veillonella spp., aj. [vlastní data autorů]), a to i ze vzorků moči s negativním výsledkem standardní kultivace. Existuje i zjednodušený protokol EQUC pro běžné laboratorní užití, který zachovává vysokou (84%) senzitivitu metody, ale vynecháním méně výtěžných kombinací půda – kultivační podmínky ji zjednodušuje a zlevňuje (9). Limitací EQUC zůstává, že organismy vyžadující ke svému růstu jiné podmínky nebo speciální živiny se ani touto robustní metodou vykultivovat nepodaří.
Tab. 1. Standard urine culture compared to EQUC (8) and modified EQUC (9). Last row shows detection rate
compared to EQUC. EQUC – extended quantitative urine culture
Druhý způsob zkoumání MM využívá jednu z přelomových technologií molekulární biologie: sekvenování nukleových kyselin. Protože většina z nás nesekvenuje nukleové kyseliny každý den, připomeneme si základní princip: DNA polymeráza syntetizuje nový řetězec komplementární DNA dle existujícího templátu a pořadí inkorporovaných deoxyribonukleotid‑fosfátů dešifruje konkrétní DNA sekvenci (10). Namísto jednoho si nyní představte miliony různých fragmentů DNA sekvenované paralelně v jednom okamžiku na čipu velikosti dvou sim‑karet v plně automatizovaném systému, který zkrátí dobu zpracování vzorku od odběru po kompletní přečtení genetické informace na řádově hodiny. V rámci jednoho pracovního cyklu (tzv. runu) přístroje Illumina MiSeq, který je v současnosti nejužívanější platformou NGS (11), lze takto zpracovat DNA z desítek vzorků různého původu a biologické povahy (12). Detekce bakterií technikou sekvenování je založena na existenci DNA, která se vyskytuje pouze u prokaryot a nemůže tedy být obsažena v žádné lidské buňce. Jde o vysoce konzervovaný gen pro 16S rRNA (r jako ribozomální), který však v sobě obsahuje hypervariabilní regiony V1 až V9. Unikátnost hypervariabilních regionů se využívá při NGS k taxonomickému zařazení mikroorganismů (13).
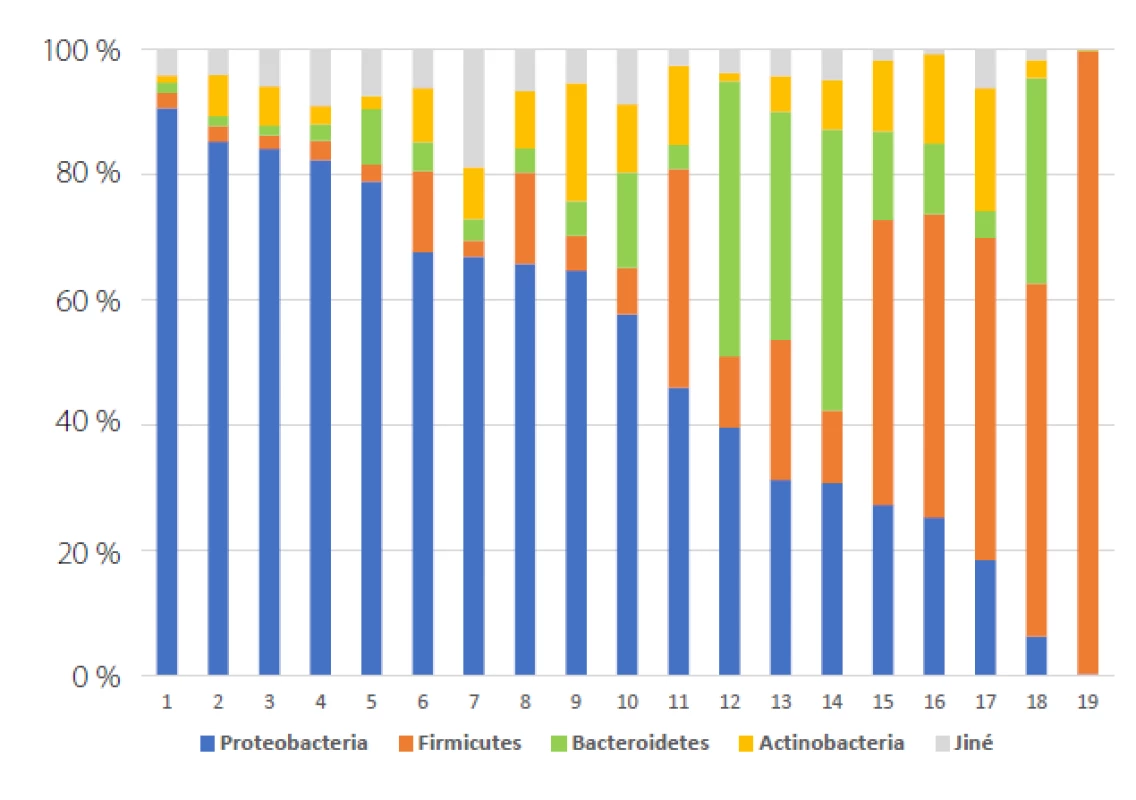
Nevýhodou NGS je, že metoda není kvantitativní (proto vždy hovoříme o „relativní abundanci“, tj. procentuálním zastoupení sekvencí náležejících určitému druhu, vztaženému k celkové kvantitě DNA ve vzorku – obr. 1) a krom toho nelze s jistotou říci, že detekované fragmenty DNA pocházejí z aktuálně živého mikroorganismu (14). NGS je dále zatížena řadou metodologických pastí a nejasností (11), jejichž rozbor leží mimo zaměření tohoto článku.
Fig. 1. Relativa abundance graph of
phyla represented in 19 urine samples
(original data)
Zpracování těžko představitelného objemu generovaných dat je vyhrazeno softwarovým algoritmům (15), s jejichž pomocí se vzniklé sekvence filtrují dle délky, odstraňují artefakty a prokazatelně reálné úseky DNA se nakonec porovnávají (opět automaticky a online) s mezinárodními databázemi DNA všech dosud známých mikroorganismů. To umožňuje taxonomické zařazení do tzv. operačních taxonomických jednotek (OTU). Dle kontextu může OTU představovat druh, rod, čeleď – podle toho, jak podrobně byla DNA ze vzorků sekvenována a jak jsou získané fragmenty specifické (pro konkrétní druh, rod či jen řád atp.).
I tak zůstává enormní množství informací, k jejichž zpracování byla vyvinuta řada biostatistických metod využívaných původně v mikrobiologii a ekologii, které jsou založeny na modelování a konstrukci hypotéz spíše než na tradičním statistickém posuzováním pravděpodobnosti neplatnosti nulové hypotézy. K popisu mikrobiomu potom používáme názvosloví opět převzaté z buněčné biologie a eko‑ logie, v němž zásadní roli hraje koncept diverzity (blíže viz tabulka 2).
Tab. 2. The notion of diversity and other selected terms explained (38). OTU – operational taxonomic unit, see
text for details

Lidský MM je dle dosavadních poznatků z drtivé většiny tvořen čtyřmi hlavními kmeny (z celkových devíti, které byly v moči popsány): Proteobacteria, Firmicutes, Bacteroidetes a Actinobacteria (8, 9, 10, 18) vlastní data autorů). V souvislosti s urogenitálním systémem bylo dosud popsáno 562 různých bakteriálních druhů náležejících do 210 rodů a představujících 21,4 % prokaryotické diverzity lidského organismu. Celkem 350 (62,3 %) z těchto 562 druhů se vyskytuje i jako součást střevního mikrobiomu (18).
MM se liší u obou pohlaví druhovou skladbou a zastoupením rodů z hlediska relativní abundance. Velmi často dominuje mikrobiomu pouze jeden rod, který představuje většinu detekovaných sekvencí; analogicky ke střevnímu mikrobiomu, kde se hovoří o enterotypech, se u MM používá výraz urotyp (1). U 60 % žen dominuje MM rod Lactobacillus, u 22 % rod Gardnerella a u ostatních se vyskytuje směs různých druhů bez zjevné dominance jednoho z nich (19, 20). Biologický význam ani potenciální klinický dopad tohoto fenoménu není zatím zřejmý (14). Další rody, které bývají v ženském MM běžně detekovatelné, jsou (metodikou EQUC prokázané) Corynebacterium, Streptococcus, Actinomyces a Staphylococcus (8). EQUC je schopna odhalit 66 % bakteriální abundance zdravého ženského MM. Zbylé mikroorganismy detekovatelné pomocí NGS představují anaerobní rody Propionimicrobium, Varibaculum, Atopobium z kmene Actinobacteria; Peptoniphilus, Megasphaera, Finegoldia z kmene Firmicutes; a Prevotella z kmene Bacteroidetes (21). Mužský mikrobiom je dosud méně podrobně popsán než ženský. Jako dominantní rod se zpravidla uvádí Staphylococcus, Streptococcus a případně Corynebacterium (20, 22), dle našich vlastních dat se kromě nich (a v našem souboru častěji) vyskytovala Pseudomonas a Prevotella.
Stabilita MM v čase je jednou z důležitých otázek, na které se bude muset zaměřit další výzkum. Data z HMP naznačují, že mikrobiomy jednotlivých lokalizací v organismu jsou v čase stabilní (4). Vzhledem k fyziologickým změnám (včetně hormonálních) v procesu stárnutí se však vývoj MM dá předpokládat, byť dosavadní poznatky se v tomto ohledu rozcházejí (23, 24). Dle jedné studie se např. rody Jonquetella, Parvimonas, Proteiniphilum a Saccharofermentans vyskytovaly u obou pohlaví výhradně ve věkové skupině 70+ (23), což ale např. naše vlastní data nepotvrzují.
Vůbec první studií, která nabourala postulát o sterilitě zdravé moči, byla práce Siddiqui et al., kteří v moči osmi žen s negativním výsledkem standardní kultivace detekovali a metodou pyrosekvenování (původní technika NGS před zavedením masivního paralelního sekvenování) dešifrovali bakteriální 16S rDNA. Nejvíce zastoupené kmeny byly kromě čtyř výše uvedených ještě Fusobacteria a nejčastějšími rody byly Lactobacillus, Prevotella a Gardnerella (3). Další prvenství, tentokrát pro detekci MM metodou EQUC, patří týmu Hilt et al., jež u 52 z 65 žen se symptomy hyperaktivního močového měchýře nalezli různé mikroorganismy, nejčastěji rody Lactobacillus, Corynebacterium, Streptococcus, Actinomyces a Staphylococcus. Z těcho 52 žen mělo 48 (92 %) negativní výsledek standardního kultivačního vyšetření (8).
Dosud neexistuje konsensus ohledně optimální metody sběru moči pro studium MM. Dosavadní práce poukázaly na odlišnou skladbu mikrobiomu spontánní moči ve srovnání s močí cévkovanou. Wolfe et al. prokázali rozdíl mezi vzorkem středního proudu moči ve srovnání s cévkovanou močí u žen; katetrizovaná byla naopak svým profilem podobná moči odebrané suprapubickou punkcí (25). Bajic et al. popisují odlišné výsledky při aplikaci NGS na vzorek spontánní versus cévkované moči; určitý vztah mezi diverzitou mikrobiomu a symptomy dolních močových cest byl prokazatelný pouze na katetrizovaných, avšak nikoli spontánně vymočených vzorcích (26). Naše vlastní data zatím poukazují na obdobné složení MM, avšak rozdílnou relativní abundanci jednotlivých OTU ve vzorcích první porce, středního proudu a katetrizované moči (rukopis v přípravě).
Vztah MM k uroonkologickým onemocněním
Vzhledem k prokázané souvislosti karcinogeneze s působením některých mikroorganismů nepřekvapí snaha o využití nových technologií při hledání spojitosti mezi MM a nádorovými onemocněními močového traktu. (Pokud není uvedeno jinak, byla ke studiu MM v citovaných studiích použita metoda NGS.) Wu et al. porovnávali charakteristiky MM mezi 31 pacienty s karcinomem močového měchýře a 18 zdravými kontrolami. Bohatost mikrobiomu (tj. počet detekovaných druhů) byla vyšší u pacientů s nádorem a tito měli také v moči vyšší relativní zastoupení rodů Acinetobacter, Anaerococcus, Rubrobacter, Sphingobacterium, Atopostipes a Geobacillus (16). Pederzoli et al. zajímavě srovnali triplety vzorků moči, nádorové a nenádorové tkáně u pacientů s karcinomem měchýře se závěrem, že 81 % bakteriálního osídlení se shodně vyskytovalo v moči i obou vzorcích tkáně (u žen dokonce 98 %). Pomocí lineární diskriminační analýzy autoři určili 26 taxonů u mužů a 48 taxonů u žen, které se statisticky významně vyskytovaly hojněji (či naopak méně hojně) u pacientů s nádorem, respektive u kontrol (17). Bučevičová‑Popovičová et al. na vzorku 12 pacientů a 11 kontrol zjistila vyšší zastoupení rodů Fusobacterium, Actinobaculum, Facklamia, Campylobacter a čeledi Ruminococcaceae u pacientů s karcinomem měchýře než u kontrol. Za zvláštní zmínku stojí Fusobacterium, které je nepřímo spojováno s některými lidskými malignitami (27).
Vztahem MM a karcinomu prostaty se zabývala studie 65 mužů s biopticky verifikovaným karcinomem prostaty a 65 kontrol, u kterých biopsie nádor neprokázala. Většině vzorků dominoval jeden určitý druh. Rozdíl mezi pacienty s nádorem a bez něj sice nalezen nebyl, avšak z analýzy vyvstala skupina bakterií spojovaných s IMC (včetně zánětů prostaty), které se častěji vyskytovaly u pacientů s nádorem než u benigních kontrol (22).
Vztah MM k benigním onemocněním
Benigním onemocněním urogenitálního traktu byla zatím ve vztahu k MM věnována menší pozornost. Shoskes et al. na souboru 25 pacientů se syndromem chronické pánevní bolesti (CPPS) pozorovali vyšší alfa‑diverzitu a vyšší relativní zastoupení anaerobních bakterií u mužů s CPPS než u kontrol (28). Ve studii pacientek s intesticiální cystitidou/syndromem bolestivého měchýře (IC/ PBS) měly ženy s IC/PBS nižší diverzitu MM, menší počet detekovaných druhů (45 vs. 31) a dominantní zastoupení rodu Lactobacillus (92 % relativní abundance rodu Lactobacillus u případů vs. 53 % u kontrol) (29). V jiné studii IC/PBS (n = 213) byly pak u žen s akutním vzplanutím symptomů častěji prokázány mykotické organismy Candida a Saccharomyces než u kontrol s IC/PBS a se stabilizovaným onemocněním (30).
Vztah MM k funkčním poruchám močového traktu
Zřejmě nejzajímavější dosavadní studie vztahu mužského MM a symptomů dolního močového traktu (LUTS) se týkala 28 mužů operovaných pro subvezikální obstrukci a 21 kontrol podstupujících jiný operační zákrok z nemaligní urologické indikace. Mikrobiální osídlení se prokázalo u 96 % vymočených a 29 % katetrizovaných vzorků moči pomocí EQUC a u 80 % vymočených a 27 % katetrizovaných vzorků pomocí NGS. Se vzrůstající závažností LUTS (měřeno Mezinárodním skóre prostatických symptomů IPSS) rostl i počet detekovaných bakteriálních druhů ve vzorku. Streptococcus a Candida byly zatoupeny ve skupině s těžkými LUTS častěji než u pacientů s mírnými a středně závažnými symptomy, avšak bez statistické význmnosti (26).
Že by složení MM mohlo mít vliv na jímací LUTS s urgentní inkontinencí (UUI), naznačuje práce kolektivu Kramerové et al., v níž pacienti s UUI měli vyšší diverzitu MM než kontroly bez symptomů UUI (24). Thomas‑White et al. referovali soubor pacientek s UUI (n = 57), jejichž MM vykazoval vyšší diverzitu – detekovanou EQUC – než zdravých kontrol (n = 60). Vyšší diverzita mikrobiomu byla také spojena s horší odpovědí na léčbu solifenacinem. Tyto závěry vyplynuly z EQUC, zatímco při použití NGS měly paradoxně obě skupiny žen stejnou míru alfa‑diverzity a dominantním rodem byl u pacientek i kontrol Lactobacillus (19). Naopak se symptomy stresové inkontinence (n = 197) složení MM nijak nesouviselo, což odpovídá zcela odlišným etiologiím obou situací (31). V této studii měly postmenopauzální ženy vyšší diverzitu a méně často jeden dominantní urotyp (Lactobacillus nebo Gardnerella) než ženy premenopauzální či na hormonální substituční léčbě. Diverzita MM se také zvyšovala s rostoucím BMI (31).
Khasriya et al. detekovali MM pomocí NGS a kultivačně na souboru žen s LUTS (n = 55) a bez nich (n = 26). Zatímco některé OTU byly společné pro obě skupiny, Proteus a Micrococcus se vyskytly pouze u žen s LUTS a Prevotella a Actinomyces pouze u kontrol (2).
MM se patrně mění i s funkčním stavem močového měchýře: u pacientů s transverzální lézí míšní vymizel po jednom roce od úrazu u obou pohlaví přítomný rod Lactobacillus a vzorkům moči začal dominovat Enterococcus faecalis a další známí původci IMC: E. coli, Pseudomonas aeruginosa a Streptococcus pneumoniae (20, 32). Že složení MM souvisí i s renální funkcí naznačují dvě následující studie. V analýze 77 pacientů s chronickým selháním ledvin byla diverzita mikrobiomu nepřímo úměrná hodnotě glomerulární filtrace. Čím vyšší byl u subjektů stupeň chronického onemocnění ledvin (CKD III – CKD V), tím nižší byla mikrobiomová diverzita (24). V další studii 67 pacientů po transplantaci ledviny byl popsán statisticky významný rozdíl v zastoupení 21 určitých OTU mezi pacienty s chronickou dysfunkcí transplantované ledviny v porovnání s kontrolami, kterým transplantát fungoval bezvadně (33).
Nové poznatky týkající se MM nepatří výhradně do sféry akademických debat, jak by se mohlo na první pohled zdát. Jestliže totiž močový trakt trvale osídlují komenzální bakterie v nízkých koncentracích 101–104 CFU/ml (21), je nadále neudržitelná představa IMC jako invaze jednoho virulentního mikroba do sterilního prostředí močového měchýře; přesnější bude hovořit o oscilaci mezi různými eu- a dysbiózami (14, 18). Do takového modelu pak hladce zapadá i existence asymptomatické bakteriurie, u které již dnes považujeme přítomnost určitých druhů (Enterococcus faecalis) za protektivní faktor vůči rozvoji manifestní uroinfekce (34). Genomickými studiemi bylo také zjištěno, že některé bakterie žijí jak ve vagině, tak v močovém měchýři a je tedy namístě hovořit o společném urogenitálním mikrobiomu – oproti současné představě zdravé vaginální flory s převahou Lactobacillus spp., která brání vzestupu E. coli do močového měchýře s následným rozvojem IMC (21).
Objevem existence MM se jako již mnohokrát v historii otevřelo nové pole poznání tam, kde se zdálo, že již není co vymyslet. Jakou roli přesně MM hraje v homeostáze našeho urogenitálního aparátu, bude teprve třeba zjistit, avšak potenciální úlohy MM zahrnují produkci antimikrobiálních látek namířených proti patogenům, funkci bariéry vůči přístupu patogenů k urotelu, posilování obranyschopnosti sliznice močových cest, udržování epiteliálních spojů, degradaci škodlivých látek, kompetici o zdroje s uropatogeny či dokonce produkci neurotransmiterů (7).
Naděje vkládané do medicínského využití mikrobiomu jsou značné. V našem oboru lze potenciálně uvažovat o využití MM jako diagnostického markeru urologických onemocnění; lze si představit syntetický MM transplantovaný v rámci léčby a prevence IMC či dokonce fekální transplantaci jako léčbu některých etiologií urolitiázy.
Kromě bakteriálního MM se výzkum orientuje i na detekci virových a fungálních nukleových kyselin z moči. Charakterizace močového viromu je obtížná z důvodu neexistence virové analogie bakteriální 16S rDNA (7). Dosud se však v lidské moči podařilo prokázat sekvence náležející polyomavirům (JCV a BKV), Torque teno viru (35), a množství bakteriofágů (virů infikujících bakterie) (36). Mezi úskalí zkoumání močového mykobiomu patří obtížnější izolace fungální DNA než v případě bakterií, její ještě nižší koncentrace než v případě 16S rDNA a nejasnosti ohledně stability i formy fungálního osídlení močového měchýře (37). Jestliže o MM toho nyní víme málo, pak o močovém viromu je známo ještě méně a o mykobiomu prakticky vůbec nic.
ZÁVĚR
Stejně jako jiné lokality lidského organismu má i urogenitální trakt svůj mikrobiom. MM se liší u mužů a u žen a jeho změny jsou spojeny s různými patologickými stavy močového systému. Výzkum vedoucí k odhalení příčinných souvislostí mezi MM a zdravím či nemocí je stále na svém počátku.
Poděkování
Petře Tláskalové (Mikrobiologický ústav Akademie věd ČR) za odbornou revizi a připomínky k textu.
Došlo: 12. 1. 2021
Přijato: 11. 2. 2021
Kontaktní adresa:
MUDr. Jan Hrbáček, Ph.D.
Urologická klinika 3. LF UK a Thomayerovy nemocnice Vídeňská 800, 140 59 Praha
e‑mail: jan.hrbacek@ftn.cz
Střet zájmů: Žádný.
Prohlášení o podpoře: Podpořeno MZ ČR – RVO (Fakultní Thomayerova nemocnice – FTN, 00064190).
Supported by MH CZ – DRO (Thomayer University Hospital – TUH, 00064190).
Hlavní stanovisko práce: Moč zdravých jedinců je oproti dosavadním předpokladům domovem pro řadu mikroorganismů.
Major statement: Against expectation, human urine is home to a plethora of microorganisms.
Sources
1. Thomas‑White K, Brady M, Wolfe AJ, Mueller ER. The Bladder Is Not Sterile: History and Current Discoveries on the Urinary Microbiome. Curr Bladder Dysfunct Rep 2016; 11(1): 18–24.
2. Khasriya R, Sathiananthamoorthy S, Ismail S, et al. Spectrum of Bacterial Colonization Associated with Urothelial Cells from Patients with Chronic Lower Urinary Tract Symptoms. J Clin Microbiol. 2013; 51(7): 2054–2062.
3. Siddiqui H, Nederbragt AJ, Lagesen K, Jeansson SL, Jakobsen KS. Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons. BMC Microbiol. 2011; (11): 1–12.
4. The Human Microbiome Project Consortium: Structure, function and diversity of the healthy human microbiome. Nature [Internet] 2012; 486: 207–214. Dostupné z: http://dx.doi.org/10.1038/nature11234, 13. 11. 2020.
5. Zwinsová B, Brychtová V, Hrivňáková M, et al. Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu. Klin Onkol 2019; 32(4): 261–269.
6. Wolfe AJ, Brubaker L. „Sterile Urine“ and the Presence of Bacteria. Eur Urol. 2015; 68(2): 173–174.
7. Whiteside SA, Razvi H, Dave S, Reid G, Burton JP. The microbiome of the urinary tract – a role beyond infection. Nat Rev Urol [Internet] 2015; 12(2): 81–90. Dostupné z: http://dx.doi.org/10.1038/nrurol.2014.361, 3. 5. 2019.
8. Hilt EE, McKinley K, Pearce MM, et al. Urine Is Not Sterile: Use of Enhanced Urine Culture Techniques To Detect Resident Bacterial Flora in the Adult Female Bladder. J Clin Microbiol 2014; 52(3): 871–876.
9. Price TK, Dune T, Hilt EE, et al. The Clinical Urine Culture: Enhanced Techniques Improve Detection of Clinically Relevant Microorganisms. J Clin Microbiol. 2016; 54(5): 1216–1222.
10. Alberts B, Bray D, Johnson A. DNA Technology. In: Essential Cell Biology 1998; 13–46.
11. Pollock J, Glendinning L, Wisedchanwet T, Watson M. The madness of microbiome: Attempting to find consensus „Best Practice“ for 16S microbiome studies. Appl Environ Microbiol. 2018; 84(7): e02627–17.
12. Illumina.com [Internet]. Dostupné z: https://www.illumina.com/systems/sequencing‑platforms/ miseq. html, 21. 11. 2020.
13. Fukuda K, Ogawa M, Taniguchi H, Saito M. Molecular Approaches to Studying Microbial Communities: Targeting the 16S Ribosomal RNA Gene. J UOEH 2016; 38(3): 223–232.
14. Mueller ER, Wolfe AJ, Brubaker L. Female urinary microbiota. Curr Opin Urol. 2017; 27(3): 282–286.
15. Vetrovsky T, Baldrian P, Morais D. SEED 2: a user‑friendly platform for amplicon high‑throughput sequencing data analyses. Bioinformatics 2018; 34(13): 2292–2294.
16. Wu P, Zhang G, Zhao J, et al. Profiling the Urinary Microbiota in Male Patients With Bladder Cancer in China. Front Cell Infect Microbiol 2018; 8: 167.
17. Pederzoli F, Ferrarese R, Amato V, et al. Sex‑specific Alterations in the Urinary and Tissue Microbiome in Therapy‑naïve Urothelial Bladder Cancer Patients. Eur Urol Oncol 2020; 3(6): 784–788.
18. Morand A, Cornu F, Dufour JC. Human Bacterial Repertoire of the Urinary Tract: a Potential Paradigm Shift. J Clin Microbiol 2019; 57(3): e00675–18.
19. Thomas‑White KJ, Hilt EE, Fok C. Incontinence Medication Response Relates to the Female Urinary Microbiota. Int Urogynecol J. 2016; 27(5): 723–733.
20. Groah SL, Pérez‑Losada M, Caldovic L, et al. Redefining Healthy Urine: A Cross‑Sectional Exploratory Metagenomic Study of People With and Without Bladder Dysfunction. J Urol 2016; 196(2): 579–587.
21. Thomas‑White K, Forster SC, Kumar N, et al. Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat Commun [Internet] 2018; (9): 1557. Dostupné z: http://dx.doi.org/10.1038/ s41467-018-03968-5, 13. 11. 2020.
22. Shrestha E, White JR, Yu S, et al. Profiling the Urinary Microbiome in Men with Positive versus Negative Biopsies for Prostate Cancer. J Urol 2018; 199: 161–171.
23. Lewis DA, Brown R, Williams J, et al. The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults. Front Cell Infect Microbiol [Internet] 2013; 3: 1–14. Dostupné z: http://journal. frontiersin.org/article/10.3389/fcimb.2013.00041/abstract, 3. 5. 2019.
24. Kramer H, Kuffel G, Thomas‑White K, et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. Int Urol Nephrol 2018; 50(6): 1123–1130.
25. Wolfe AJ, Toh E, Shibata N, et al. Evidence of Uncultivated Bacteria in the Adult Female Bladder. J Clin Microbiol. 2012; 1376–1383.
26. Bajic P, Kuiken ME van, Burge BK, et al. Male Bladder Microbiome Relates to Lower Urinary Tract Symptoms. Eur Urol Focus 2020; 15(6): 376–382.
27. Popović VB, Šitum M, Chow CT, Chan LS. The urinary microbiome associated with bladder cancer. Sci Rep. 2018; 8: 12157.
28. Shoskes DA, Altemus J, Polackwich AS, Tucky B, Wang H. The Urinary Microbiome Differs Significantly Between Patients With Chronic Prostatitis/Chronic Pelvic Pain Syndrome and Controls as Well as Between Patients With Different Clinical Phenotypes. Urology 2016; 92: 26–32.
29. Siddiqui H, Lagesen K, Nederbragt AJ, Jeansson SL, Jakobsen KS. Alterations of microbiota in urine from women with interstitial cystitis. BMC Microbiol [Internet] 2012; 12: 205. Dostupné z: http://www. biomedcentral.com/1471-2180/12/205, 3. 5. 2019.
30. Nickel JC, Stephens A, Landis JR, et al. Assessment of the Lower Urinary Tract Microbiota during Symptom Flare in Women with Urologic Chronic Pelvic Pain Syndrome: A MAPP Network Study. J Urol. 2016; 195(2): 356–362.
31. Thomas‑White KJ, Kliethermes S, Rickey L. Evaluation of the Urinary Microbiota of Women With Uncomplicated Stress Urinary Incontinence. Am J Obs Gynecol. 2017; 216(1).
32. Fouts D, Pieper R, Szpakowski S. Integrated next‑generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med. 2012; 10(174): 55.e1–55.e16.
33. Wu JF, Muthusamy A, Al‑Ghalith GA, Dan K. Urinary microbiome associated with chronic allograft dysfunction in kidney transplant recipients. Clin Transplant 2018; (32): e13436.
34. Cai T, Mazzoli S, Lanzafame P, et al. Asymptomatic Bacteriuria in Clinical Urological Practice: Preoperative Control of Bacteriuria and Management of Recurrent UTI. Pathogens [Internet] 2016; 5(1): 4. Dostupné z: http://www.mdpi.com/2076-0817/5/1/4, 20. 11. 2018
35. Rani A, Ranjan R, McGee HS, et al. A diverse virome in kidney transplant patients contains multiple viral subtypes with distinct polymorphisms. Sci Rep 2016; (6): 33327.
36. Garretto A, Thomas‑White K, Wolfe AJ, Putonti C. Detecting viral genomes in the female urinary microbiome. J Gen Virol. 2018; 99: 1141–1146.
37. Ackerman AL, Underhill DM. The mycobiome of the human urinary tract: Potential roles for fungi in urology. Ann Transl Med 2017; 5(2): 1–12.
38. Kim BR, Shin J, Guevarra RB, et al. Deciphering diversity indices for a better understanding of microbial communities. J Microbiol Biotechnol 2017; 27(12): 2089–2093.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2021 Issue 1
Most read in this issue
- Léčba následků strangulačního poranění penisu
- Úvod do problematiky lidského močového mikrobiomu
- Transperineálně prováděné fúzní US/MRI navigované biopsie prostaty
- Cizí těleso (visací zámek) na mužském zevním genitálu
