-
Medical journals
- Career
Gravidita u pacientek po augmentaci měchýře střevním segmentem – naše zkušenosti
Authors: Ivo Novák 1; Marian Kacerovský 2; Sylvie Dusilová-Sulková 3; Jan Malý 4
Authors‘ workplace: Urologická klinika, FN a LF UK, Hradec Králové 1; Porodnicko-gynekologická klinika, FN a LF UK, Hradec Králové 2; III. interní klinika, FN a LF UK, Hradec Králové 3; Dětská klinika, FN a LF UK, Hradec Králové 4
Published in: Ces Urol 2020; 24(1): 60-68
Category: Original Articles
Overview
U žen po rekonstrukcích dolních močových cest (DMC) augmentací pro závažné vrozené urogenitální anomálie není gravidita kontraindikována. Přirozená cesta otěhotnění je možná. Přestože těhotenství u takto operovaných žen přibývá, o problematice je jen málo publikovaných informací. V našem sdělení retrospektivně rozebíráme čtyři případy z pohledu urologa, nefrologa, gynekologa a neonatologa. Žena po rekonstrukci DMC vyžaduje trvalou následnou přechodovou péči. Pro úspěšný výsledek gravidity je nutná mezioborová spolupráce. Možné komplikace v graviditě (např. preeklampsii, infekce močových cest, obstrukci horních cest aj.) je nutno řešit ihned interdisciplinárně. Podle našich zkušeností těhotenství po rekonstrukcích DMC nemá zásadní vliv na trvalé zhoršení ledvinných funkcí a nevede k negativním funkčním změnám rekonstruovaných DMC. Vyšší výskyt vrozených vývojových vad (VVV) u dětí těchto gravidních oproti dětem jinak zdravých těhotných není vykazován.
Klíčová slova:
Augmentace měchýře – těhotenství – komplikace
ÚVOD
Těhotenství u žen po rekonstrukci měchýře augmentací střevním segmentem, obvykle spojené se založením suchého cévkovacího stomatu dle Mitrofanoffa nebo Montiho, mění anatomické poměry v oblasti dutiny břišní (Obr. 1). V 80.–90. letech 20. století vzrostl počet indikací k těmto operacím u dívek v raném dětství pro malokapacitní měchýř z různých příčin (primární komplexní vrozené vady DMC, nebo sekundární neurogenní měchýř). V současnosti je u takto operovaných stále častější událostí gravidita. Je to důsledek vyššího procenta úspěšně provedených rekonstrukcí u dívek narozených s komplexními urogenitálními anomáliemi. Ty se pak vyvíjejí v dobře sociálně a zdravotně přizpůsobené mladé dospělé ženy a dnes jsou ve fertilním věku (Obr. 2). O plodnosti těchto pacientek, funkčních a anatomických důsledcích těhotenství, nebo způsobu přístupu k vedení porodu je jen málo literárních informací, s malými soubory. Cílem našeho sdělení byl rozbor průběhugravidity u našeho souboru pacientek s augmentovaným měchýřem střevním segmentem z pohledů urologa, nefrologa, gynekologa, neonatologa. Naší snahou bylo zhodnotit u gravidních stav horních a dolních cest močových, možnost provádění čisté intermitentní katetrizace (ČIK) stomií, funkci ledvin, přítomnost IMC, hypertenze, anémie, nutnost intervence během/po graviditě; u plodů/novorozenců nutnost indikace indukce porodu, průběh porodu (spontánní/ sekcí), porodní komplikace, poporodní adaptace/stav novorozence, nálezy vrozeně vývojových vad.
Image 1. Operační pohled na augmentovaný močový měchýr se založenou apendikostomií: ileem augmentovaná vezika derivovaná epicystostomií, apendikostomie se zavedeným permanentním katétrem, ureterální cévky vyvedeny stěnou veziky jako derivace močovodů
Fig. 1. Operative view of the augmented bladder with appendicostomy having been created: ileal augmented bladder derived by epicystostomy; appendicostomy with an inserted indwelling catheter; ureteric catheters passed through the bladder wall as derivation of the ureters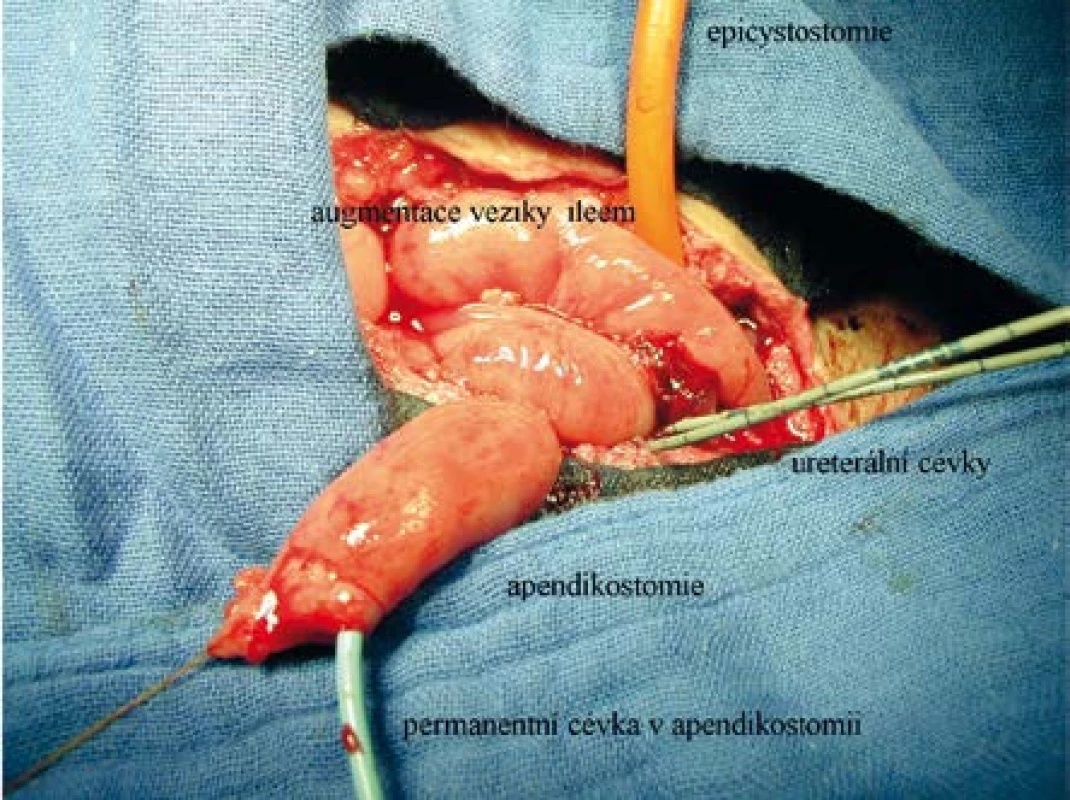
Image 2. Pohled na břišní stěnu nemocné po augmentaci měchýře: jizva po střední dolní laparotomii, založená apendikostomie v pupku se zavedenou cévkou
Fig. 2. View of the patient’s abdominal wall after bladder augmentation: a scar after an inferior median laparotomy; appendicostomy created at the umbilicus with a catheter in place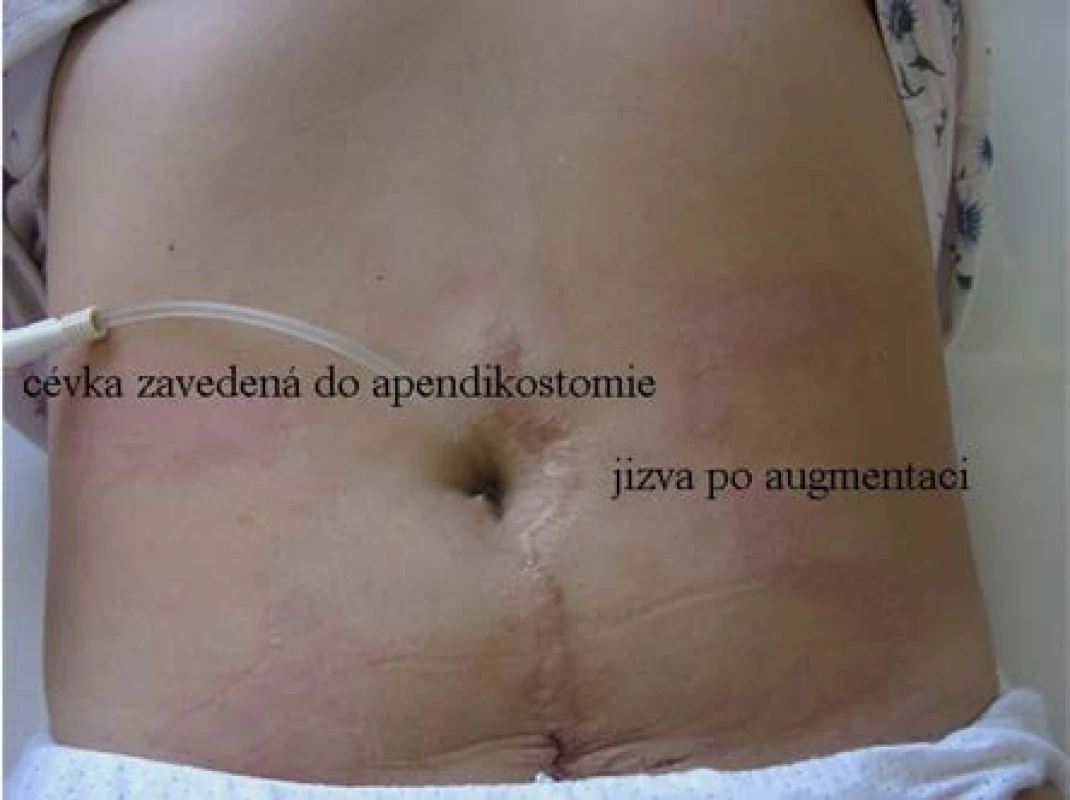
METODY A SOUBOR
Retrospektivně jsme vyhodnotili průběh čtyř gravidit u našich pacientek po augmentaci močového měchýřem střevním segmentem v dětství (jeden operatér):
- 1) 31letá sekundipara s neurogenním měchýřem (NMM) při meningomyelokéle (MMK), po augmentaci měchýře ileálním detubulizovaným střevním segmentem s apendikovezikostomií dle Mitrofanoffa do pupku v roce 1997. Před otěhotněním byla 3× endoskopicky řešena litiáza v augmentované vezice. Počátkem roku 2013 otěhotněla prvně, gravidita ale skončila spontánním abortem v prvém trimestru, nikoliv ale z příčiny IMC. Ultrasonografický (USG) nález před druhým otěhotněním koncem roku 2013 byl bez dilatace na horních močových cestách (HMC), laboratorně bez anémie (130 g Hb/l), bez poruchy funkce ledvin (kreatininemie 70 μmol/l, glomerulární filtrace (GF) 1,416 ml/s). Během druhé gravidity 2013–2014 se s růstem dělohy objevily problémy s ČIK cestou apendikovezikostomie. Nemocná byla ale schopna sama nekomplikovaně provádět ČIK přes uretru a neohrdlo. Z interních potíží se od 20. týdne gravidity objevily projevy gestační hypertenze a diabetes mellitus. Nebyly ale závažné a byly kompenzovány nasazením antihypertenziv (Dopegyt®), cukrovka dietou. Na kontrolní USG se objevila u matky oboustranně symetrická dilatace na HMC (pánvičky: 22…40 mm, kalichy: 16…20 mm, bez dilatace močovodů, bez redukce parenchymu). Měla chronický nehorečnatý nález leukocyturie DMC, s negativním kultivačním nálezem cévkované moči z augmentované veziky. Profylakticky byla porodníkem nasazena antibiotika (peniciliny/cefalosporiny). Těhotenství bylo ukončeno elektivním císařským řezem (SC) v gestačním stáří 37 týdnů + 2 dny, z horní střední laparotomie. Transfundálně byl vybaven živý, zdravý novorozenec, chlapec, Apgar 9/9/10, váha 2690 g. Po porodu byla matka bez komplikací. Novorozenec USG screeningem bez průkazu VVV, prospívající. Dimise obou pátý den po porodu. Na kontrolní USG matky plně regredovala dilatace na HMC, vymizela gestační hypertenze a cukrovka. Po porodu bylo nutno operačně odstranit fibroepiteliální membránu uzavírající vchod a znemožňující zavádění katétru do apendikovezikostomie. Po incidování membrány byla opět možná volná ČIK apendikovezikostomií. Zprůchodnění apendikovezikostomie jsme indikovali i přes schopnost nemocné cévkovat se cestou neohrdla a uretry. Pro nemocnou je zavedení cévky stomatem snadněji proveditelné, předchází možnému infikování neoveziky během zavádění cévky neouretrou z okolí poševního introitu a je bezpečnější stran možného poranění střevního segmentu neoveziky zaváděnou cévkou.
- 2) 25letá primipara s primárně exstrofií mě ‑ chýře, po augmentaci coekoileálním detubulizovaným střevním segmentem a apen ‑ dikovezikostomií dle Mitrofanoffa v pravém hypogastriu v roce 1994. Od provedené augmentace byla dispenzarizována s USG projevy chronické oboustranné dilatace kalicho ‑ pánvičkových systémů (KPS) (vpravo/vlevo: pánvička 17×12×10 mm/24×15×13 mm, kali ‑ chy 12 mm/10 mm, parenchym 4 mm/8 mm), oboustrannou nefropatií, nefrologem potvrzenou na statické scintigrafii ledvin 2015. Od roku 2004 postupný rozvoj chronického ledvinného selhání (CKD) (2015 kreatininemie 156 umol/l, GF 0,9 ml/s). V krevním obraze lehká sekundární hypochromní anémie (111 g Hb/l), v močovém sedimentu při ČIK s chronickým nálezem leukocyturie, klinicky asymptomatickým. V graviditě dochází postupně významně k USG progresi v oboustranné dilataci HMC (vpravo/vlevo: kalichy 27 mm/42 mm, ureter 7 mm/14 mm, parenchym 4,6 mm/4,2 mm), vlevo s klinickými projevy pyelonefritidy (bolestivá ledvina, elevace zánětlivých marke ‑ rů (CRP: 8,6…159,6 mg/l), pozitivita kultivace z cévkované moči augmentované veziky s nálezem Morganella morganii a Escherichia colli více 10/6 a rychlou progresí v CKD (kreatininemie 241…341 umol/l, GF: 0,391…0,257 ml/s). Zahájena antibiotická léčba (peniciliny), založena akutně derivace punkční nefrostomií (pND) vlevo a zavedena permanentní cévka (PK) apendikovezikostomií do augmentované veziky. Pro současné mírné zhoršení anémie (101…90 g Hb/l) nasazena perorálně substi ‑ tuce železem (Maltofer®), projevy sekundární hypertenze stabilizovány farmakoterapií (Tritace®). Klinický stav nemocné se po intervencích a při nasazených antibioticích rychle stabilizoval, poklesly zánětlivé markery (CRP: 52,6…5,3…0,7 mg/l), významně regredovala USG dilatace vlevo na pND a rovněž vpravo při zavedeném PK. Postupně pokles kreatininemie (336…277…246 μmol/l) a vzestup GF (0,257…0,376…0,446 ml/s). Gravidita byla elektivně ukončena v klinicky stabilizovaném, laboratorně trvale se lepšícím stavu SC v gestačním stáří 31 týdnů + 6 dnů, z horní střední laparotomie. Transfundálně byl vybaven živý, zdravý novorozenec, chlapec, Apgar 10/10/10, váha 1 440 g. Poporodně byl stav rodičky nekomplikován, zrušena pND, PK ze stomie a přechod zpět na ČIK přes apendikovezikostomii. Novorozenec na screening USG byl bez průkazu VVV, prospívající. Dimise matky a novorozence devátý pooperační den. U matky na kontrolách po propuštění stabilizace sekundární anémie (112 g Hb/l), postupná normalizace sekundární hypertenze bez nutnosti farmakoterapie, USG regrese dilatace KPS (vpravo/vlevo: kalichy 13 mm/20 mm, močovody bez dilatace, parenchym 5 mm/10 mm), přetrvávání CKD st. III (kreatininemie 215…248 umol/l, GF 0,448…0,376 ml/s).
- 3) 25letá primipara s primárně exstrofií měchýře, po augmentaci ileálním detubulizovaným střevním segmentem a apendikovezikostomií dle Mitrofanoffa v pravém hypogastriu v roce 2001. Od provedené augmentace byla dlouhodobě USG oboustranná dilatace IV. stupně, vlevo pro pyonefros s afunkcí byla provedena nefrektomie. Před otěhotněním stacionární funkce solitární ledviny (kreatininemie 87 umol/l, GF 1,34 ml/s.), lehce sekundární hypochromní ané ‑ mie (123 g Hb/l). Chronická bakteriurie (Escherichia colli a Enterococcus faecalis 10/6) pocházející z augmentované veziky byla klinicky němá. Na USG solitární ledviny vpravo chronicky hypotonie (pánvička 15 mm, kalichy 22 mm, ureter 7 mm). Již od počátku gravidity byly projevy CKD (kreatininemie: 152 uml/l, GF 0,681 ml/s), bez anemizace (132 g Hb/l). Podstatnou komplikací v prvním trimestru těhotenstvi byl rozvoj těžké formy časné preeklampsie matky a závažnou časnou formou fetální růstové restrikce plodu. Z těchto důvodů byla obligátně gravidita ukončena akutním SC v gestačním stáří 25 týdnů a 4 dny, z horní střední laparotomie. Transfundálně byl vybaven živý novorozenec, děvče, Apgar 5/6/8, váha 450 g. Peroperační projevy krvácení z dělohy si vynutily provedení hysterektomie. Stav rodičky stran preeklampsie se postupně stabilizoval, zlepšily se funkce ledvinné s přetrváváním CKD st. II–III (kreatininemie: 138 umol/l, GF 0,766 ml/s) a normalizoval se krevní tlak. Novorozenec i přes intenzivní neonatologickou péči umírá na novorozenecké JIP pro těžké poporodní komplikace kardio‑pulmonální s následky multiorgánového selhávání. Dle USG screeningu byl plod bez VVV. Dimise matky patý den po porodu. Časně po porodu bylo u matky nutno řešit cystolitiázu vzniklou v graviditě. Provedena cestou apendikovezikostomie endoskopická litotrypse. Pro recidivu v plánu další intervence. Dalším zdravotním problémem u matky byl USG nález cystické expanze na pravém ovariu rok od porodu. Bylo řešeno otevřenou revizí a adnexotomií postižené gonády. Histologicky byl potvrzen zralý cystický teratom.
◼ 4) 33letá primipara s NMM při MMK, po augmentaci ileálním detubulizovaným střevním segmentem a apendikovezikostomií dle Mitrofanoffa v pravém hypogastriu v roce 1997. USG nález byl dlouhodobě před graviditou se špatně zobrazitelnou levou ledvinou (hypoplastickou, bez dilatace KPS), vpravo ledvina kompenzatorně hypertrofická (120 mm v dlouhé ose, parenchym 17 mm, bez dilatace KPS), sekundární hypochromní anémie (95 g Hb/l), bez poruchy funkce ledvin (kreatininemie 52 umol/l, GF 2,009 ml/s). Potvrzená gravidita byla s nálezem gemini mo‑bi. Ve 20. gestačním týdnu v Ústavu pro péči o matku a dítě, Praha‑Podolí indikován a proveden porodníky selektivní fetoreduktivní intrauterinní potrat jednoho plodu. Na USG kontrolách porodníkem potvrzena prakticky plně regrese usmrceného plodu v děloze, živý plod byl s fyziologickým vývojem. Během gravidity byla diagnostikována na USG velká prokrvácená ovariální cysta vpravo. Ke konci těhotenství se objevily problémy s ČIK cestou apendikovezikostomie. Nemocná ale byla schopna trvale sama nekomplikovaně provádět ČIK přes uretru a neohrdlo. Průběh gravidity byl interně bez komplikací, kontroly USG bez dilatace solitárně funkční pravé ledviny. Cévkovaná moč z augmentované veziky kultivačně negativní. Těhotenství bylo ukončeno elektivním SC v gestačním stáří 38 týdnů + 3 dny, z horní střední laparoto ‑ mie. Transfundálně byl vybaven živý, zdravý novorozenec, děvče, Apgar 10/10/10, váha 2 880 g. Peroperačně při SC byla provedena marsupializace ovariální cysty. Histologicky potvrzena ovariální hemoragická cysta na podkladě endometriózy. Po porodu byla matka interně i chirurgicky bez komplikací. Po porodu byla opět volně možná ČIK přesstomii (doporučení cévkování touto cestou identicky viz nemocná 1). Novorozenec byl USG screeningem bez průkazu VVV, prospí ‑ vající. Dimise obou pátý den po porodu. V tabulce 1 jsou souhrnně uvedeny příčiny vedoucí k augmentaci měchýře, použitý střevní segment, USG stav močových cest (před/během/po graviditě), nutnost/typ intervence a stav stomatu v průběhu těhotenství, přítomnost infektu v moči DMC (leukocyturie)/HMC (pyelonefritida), projevy preeklampsie.
Table 1. Příčiny a typy augmentace, průběh těhotenství
Tab. 1. The causes and types of augmenlation, the course of pregnancy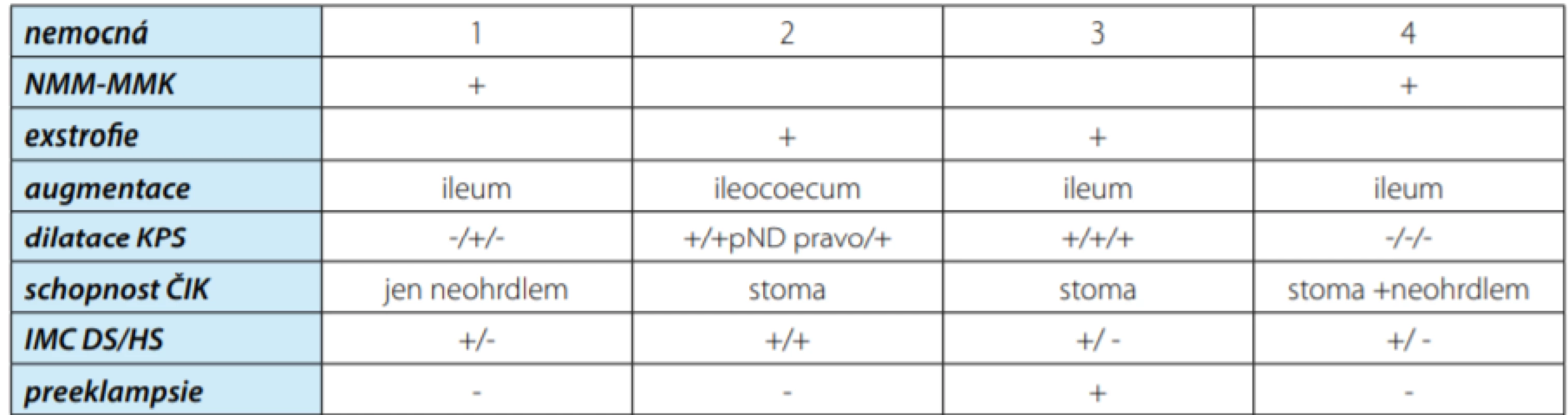
Legenda: NMM-MMK – neurogenní měchýř na podkladě meningomyelokély, KPS – kalichopánvičkový systém, ČIK – čistá intermitentní katetrizace, IMC DS/HS – infekce močových cest dolní cesty (leukocyturie)/horní cesty (pyelonefritida) VÝSLEDKY
Porod u všech našich gravidních byl indukován, veden SC, přístupem ze střední horní lapa ‑ rotomie (Obr. 3), plod byl vybaven transfundálně, u jedné nemocné bylo vynuceno provedení hysterektomie pro závažné chirurgicky neošetřitelné krvácení po vybavení plodu. U jedné nemocné ošetřena marsupializací prokrvácená cysta ovaria vpravo. Ve všech čtyřech případech šlo o živého novorozence, u tří byl poporodně nekomplikovaný průběh (Obr. 4), u jednoho těžce hypotrofického novorozence s patologickým Apgar skorem i přes intenzivní neonatologickou péči progredovalo multiorgánové selhávání s úmrtím po týdnu resuscitační neonatologické péče na kardiální selhání. V tabulce 2 je souhrnně uvedeno vedení porodu, týden gestace, typ kožní incize, incize dělohy, provedení vynucené peroperační hysterektomie, ošetření ovariální cysty, stav plodu.
Table 2. Průběh porodu
Tab. 2. The course of delivery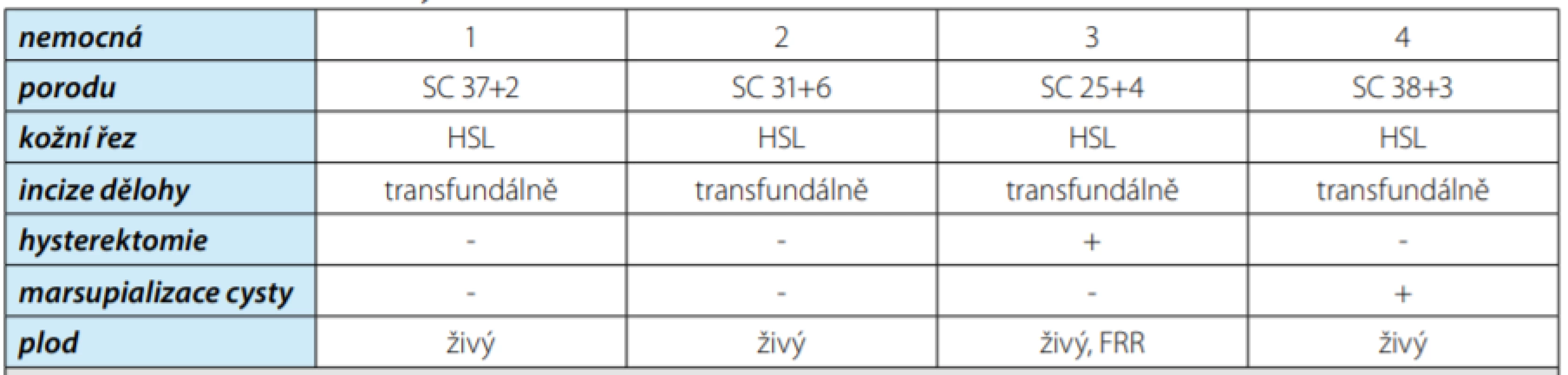
Legenda: SC – sectio caesarea, HSL – horní stření laparotomie, FRR – fetální růstová restrikce Image 3. Pohled na břišní stěnu identické nemocné po porodu: kraniálně od pupku je jizva po provedeném porodním řezu, pod pupkem původní jizva po augmentaci
Fig. 3. View of the same patient’s abdominal wall after delivery: a scar cranially from the umbilicus after obstetric incision; the original scar after augmentation below the umbilicus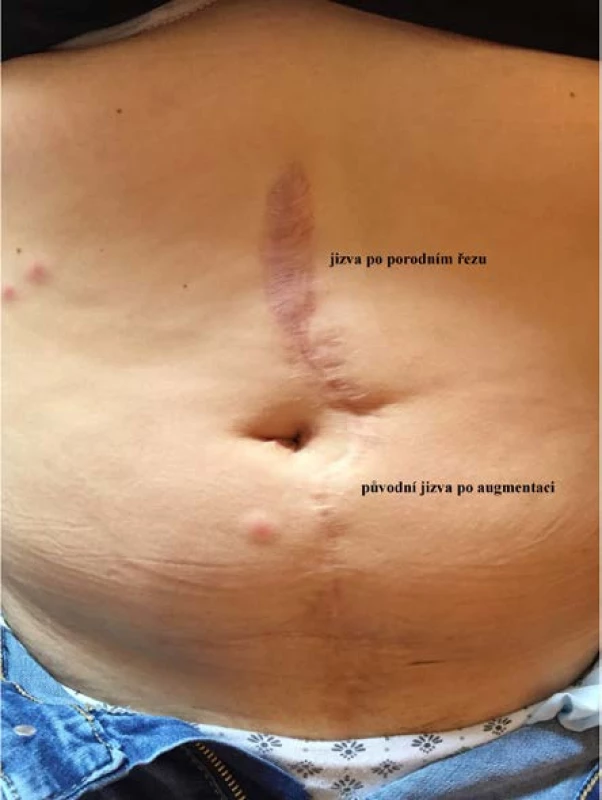
Image 4. Zdravý novorozenec matky s exstrofií měchýře po jeho střevní augmentaci
Fig. 4. A healthy newborn of the mother with bladder exstrophy after its intestinal augmentation (Fotografie novorozence uveřejněna se souhlasem matky.)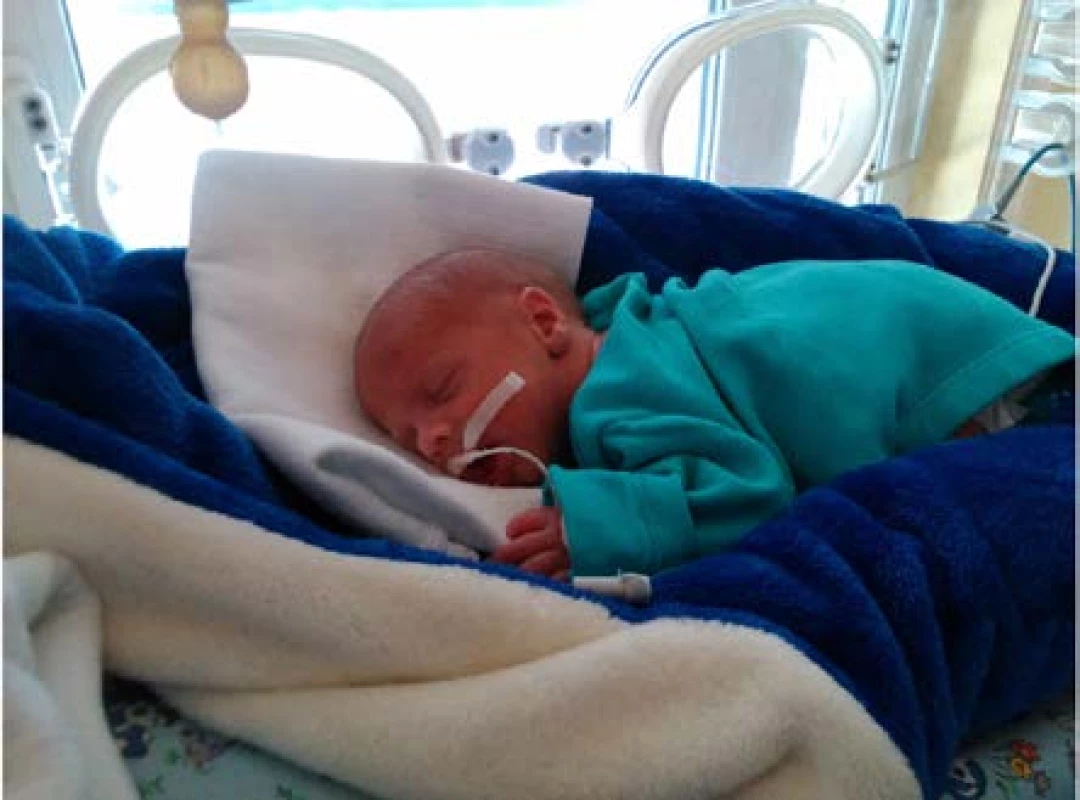
Poporodně u jedné pacientky s MMK byla nutná incize uzavřeného vchodu do apendikovezikostomie. U pacientky s exstrofií měchýře s těžkou formou preeklampsie byla řešena v krátkém odstupu po porodu litiáza zformována během těhotenství v neovezice. U téže pacientky po roce provedena pravostranná adnexotomie pro zralý cystický teratom. U dvou pacientek s exstrofií měchýře s progresí ledvinného selhávání v průběhu gravidity až na stupeň IV se po porodu CKD stabilizovala na stupeň III. V tabulce 3 je souhrnně uveden stav stomatu po graviditě, nález urolitiáza v neovezice po graviditě, CKD (před/během/po) graviditě, jiné nutné operace po porodu, stav novorozence, přítomnost VVV.
Table 3. Poporodní stav matek a novorozenců
Tab. 3. The postpartum status of mothers and newborns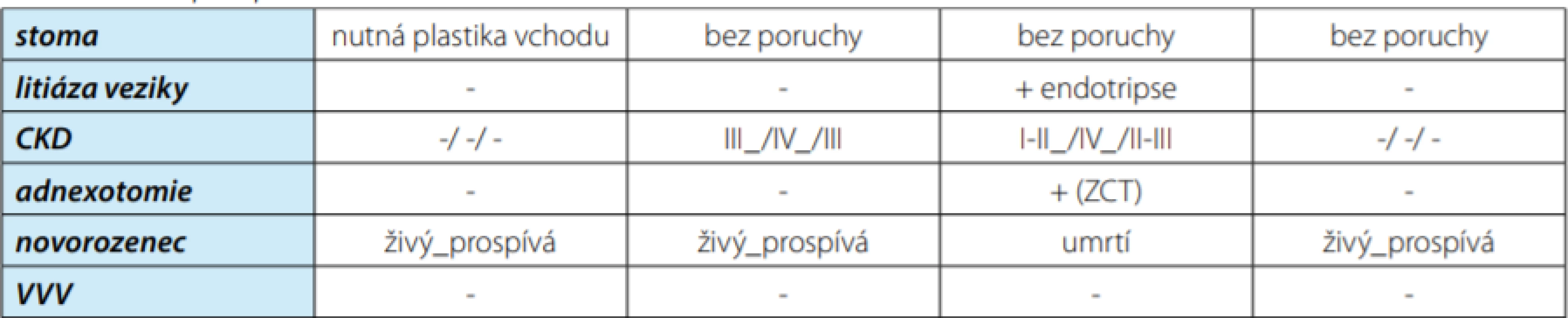
Legenda: CKD – chronická ledvinná insuficience, ZCT – zralý cystický teratom, VVV – vrozená vývojová vada DISKUZE
Vyvození obecných závěrů z našeho malého souboru není možné. Nicméně cílem péče o těhotné pacientky po korekční operaci DMC je jednak udržení stabilizovaného zdravotního stavu (zejména funkčnosti rekonstruovaného měchýře a ledvin), jednak porod zdravého novorozence. Naše pozorování a výsledky jsou v obecné korelaci s literárními údaji. Zdá se, že těhotenství u těchto pacientek po rekonstrukcích DMC nemá zásadní vliv na trvalé zhoršení ledvinných funkcí a nevede k negativním změnám stavu ve funkci rekonstruovaných DMC (1, 2). Problémy lze rozdělit dle charakteru potíží a nutnosti řešení na urologické, nefrologické, porodnické a neonatologické. Průkaz těhotenství u enterocystoplastik by měl být na podkladě serologickým vyšetřením hladiny hCG. Vyšetření z moči mohou být falešně pozitivní vlivem vysokého obsahu hlenu ve střevem augmentované vezice (3). Nejčastější urologickou komplikací, objevující se u gravidních pacientek po rekonstrukcích DMC, je přechodná obstrukce horních močových cest se sklonem k rozvoji infekcí dolních, ale i horních cest močových (viz dále). Pouhé nasazení antibiotické léčby nemusí být dostatečné. Tyto stavy mohou být indikací k akutní urologické intervenci, zajišťující dobrou derivaci močových cest (4, 5). V našem souboru tomu tak bylo u jedné těhotné pacientky s exstrofií měchýře, kde si progrese dilatace HMC v kombinaci s infekcí vynutila založení dočasné pND. Dle našeho pozorování u této pacientky i pouhé zavedení permanentní derivace augmentované veziky cévkou může stav derivace HMC významně vylepšit. Významně horší prognózu v našem souboru stran obstrukce a současné infekce HMC měly nemocné po rekonstrukci DMC na podkladě exstrofie měchýře. Toto koreluje s literárními údaji (6). Jinou urologickou problematiku gravidity u těchto nemocných představuje zhoršení až s nemožností provádění ČIK založeným stomatem (Mitrofanoff, Monti). Problémy s cévkováním se uvádí v literatuře spíše u vyústění v pravém hypogastriu, než do pupku (6). Stav jde obvykle na vrub fyziologicky se zvětšující děloze s růstem plodu. Tyto problémy jsme pozorovali u dvou našich nemocných. Cévkování přes stoma bylo s postupem gravidity jednou významně obtížné, jednou zcela nemožné. U obou šlo primárně o augmentaci sekundárně NMM u MMK ileálním segmentem s využitím apendixu jako cévkovací stoma technikou dle Mitrofanoffa. Obě nemocné byly schopny provádět ČIK cestou uretry a neohrdla. Nebylo nutno zavádět punkční derivaci do augmentované neoveziky. U jedné z těchto pacientek bylo nutno po graviditě provést incizi fibroepiteliální membrány. Stoma u této pacientky bylo umístěno do pupku. U druhé pacientky bylo stoma v pravém hypogastriu, po porodu se opět volně cévkovala cestou stomatu. U obou nemocných s exstrofií měchýře problém s ČIK nebyl. Stomata byla u obou vyvedena v pravém hypogastriu. Důvodem trvalé možnosti cévkování se stomatem mohla být významně nižší doba gravidity v době indukce porodu. Nefrologické problémy s progresí poruchy ledvinné funkce jsme pozorovali u dvou pacientek. Obě byly s primární diagnózou exstrofie měchýře. Jedna měla již delší dobu od provedené augmentace projevy CKD stupně III. Ledvinné selhávání se v graviditě vlivem progresivní obstrukce s následky infektu zhoršilo na stupeň IV a vyžádalo si založení derivace pND při současně zavedeném PK stomatem. Po ukončení gravidity se stupeň CKD snížil na hodnoty před otěhotněním. U druhé došlo k trvalé progresi i po ukončení gravidity na CKD stupně III (7, 8). Závažnost problematiky IMC v našem souboru podporují uváděné literární údaje. IMC jsou uváděny jako jedna z hlavních příčin abortu (9, 10, 8). Nálezy asymptomatické bakteriurie mluvící pro osídlení DMC augmentované veziky s ČIK byly v našem souboru ve 100 %. Nevedly ale ke klinicky manifestním problémům. Projevy infekce HMC (pyelonefritidy) jsme pozorovali pouze v jednom případě a byly spojeny s progresivní dilatací na HMC. Vyžádaly si časnou, intenzivní, cílenou léčbu antibiotiky a současné provedení derivace HMC a DMC (viz shora). Intenzivní profylaxe antibiotiky je často doporučována po dobu celé gravidity přes jejich možné vedlejší účinky na plod, zejména s ohledem na možný vezikoureterální reflux u nemocných po rekonstrukcích DMC (5). Sami jsme dlouhodobé antibiotické profylaxe v našem souboru nemocných využili pouze u jedné gravidní z indikace porodníka po předchozím spontánním abortu. Projevy IMC u této podruhé gravidní pacientky byly po celé těhotenství klinicky negativní (9, 10, 7). Lehké sekundární hypochromní anémie nebyly závažným problémem. Elektivní nasazení substituční terapie železem bylo plně terapeuticky dostačující (8). Projevy hypertenze jsme zaznamenali u tří pacientek. Závažná byla pouze v jednom případě s rychlým rozvojem preeklampsie, která vedla k indikaci ukončení gravidity v časném stadiu. V ostatních dvou případech byl vysoký krevní tlak nevýznamnou, přechodnou gestační komplikací. Naše pozorování podporuje literárně udávaný vyšší výskyt preeklamptických epizod u gravidních nemocných s augmentacemi (10 %) oproti jinak zdravým těhotným (3 %) (8, 11). Jednou jsme zaznamenali vznik gestačního diabetu. I zde šlo o nezávažnou, přechodnou komplikaci. S ukončením gravidity došlo k plné kompenzaci stavu (8). Z hlediska urologa a porodníka je diskutovanou otázkou vedení porodu. Všechny naše těhotné podstoupily porod sekcí (7, 12, 13). Jedním z důvodů indikace SC v našem souboru byly u všech našich pacientek současně s augmentační cystoplastikou provedené rekonstrukční plastiky na hrdle pro dosažení kontinence. V těchto případech lze urologicky doporučit porod SC jako prevence porodního traumatu plastiky hrdla během spontánního porodu. Ten může vlivem tlakové ischemie vést k poškození neohrdla a uretry s následky poruchy kontinence (14, 15). Literárně je ale i v těchto případech připouštěna možnost vedení spontánního porodu přirozenými porodními cestami při rozhodnutí matky (2). Jinou z urologického hlediska možnou komplikací SC je poranění cévní stopky nebo neoveziky. V případech spontánního porodu je nutno v prevenci traumatu vždy důkladně před porodem vyprázdnit augmentovaný měchýř (2, 16, 17). Z pohledu porodníka možné komplikace spontánního porodu v důsledku nefyziologických poměrů v rekonstruovaných porodních cestách a obvykle chronicky přítomné infekci v porodních cestách mohou ohrozit matku i novorozence. Spolu s předčasně indukovaným porodem to vede většinou k indikaci SC. Komplikované stavy vyžadují vždy přítomnost urologa, ale ani zde není vyloučena možnost poranění stopky nebo měchýře. U žádného z novorozenců nebyla zjištěna VVV. I toto plně koreluje s literárními údaji (6) (Obr. 4). Přesto pro bezpečné zajištění možných komplikací u novorozence je vhodná přítomnost zkušeného neonatologa u porodu, přestože ve shodě s literárními údaji většina novorozenců je bez nutnosti intenzivní neonatologické péče. V jednom z našich případů byla nutná neodkladná intenzivní neonatologické péče o novorozence s projevy závažné fetální restrikce. Ani tato vysoce kvalifikovaná péče neodvrátila u novorozence s enormně nízkou hmotností pod 500 g projevy multiorgánového selhání s následkem úmrtí.
ZÁVĚR
U žen po rekonstrukcích DMC pro závažné vrozené urogenitální anomálie není gravidita kontraindikována. Přirozená cesta otěhotnění je možná (12). Vyšší počet VVV oproti dětem jinak zdravých těhotných není vykazován. Pacientka po rekonstrukcích DMC augmentací vyžaduje trvalou následnou přechodovou péči (13). Možné komplikace v graviditě nutno řešit ihned. Jde zejména o preeklampsii, vyšší sklon k IMC dolního ale i horního segmentu, a obstrukci horních cest ve skupině jako celku, ke konci těhotenství pak hlavně ve skupině nemocných po rekonstrukčních operacích pro exstrofii, kde je větší počet porodnických, ale i urologických indikací k cí ‑ sařským řezům. Pro úspěšný výsledek je žádoucí interdisciplinární spolupráce (porodník, urolog, nefrolog, neonatolog).
Střet zájmů: Žádný.
Prohlášení o podpoře: Zpracování článku nebylo podpořeno žádnou společností.
Došlo: 10. 12. 2019
Přijato: 29. 2. 2020
Kontaktní adresa:
MUDr. Ivo Novák, Ph.D.
Urologická klinika FN a LF UK
Sokolská 581,
500 05 Hradec Králové
e‑mail: novakivo@fnhk.cz
Sources
1. Fontaine E, Leaver R, Woodhouse CR. The effect of intestinal reservoirs on renal function: a 10 year follow‑up. BJU Int 2000; 86 : 195–198.
2. Quenneville V, Beurton D, Thomas L, Fontaine E. Pregnancy and vaginal delivery after augmentation cystoplasty. BJU International 2003; 91 : 893–894.
3. Nethercliffe J, Trewick A, Samuell C, Leaver R, Woodhouse CRJ. False positive pregnancy tests in patients with enterocystoplasties. BJU Int 2001; 87 : 780–782.
4. Tomezsko JE, Sand PK. Pregnancy and intercurrent diseases of the urogenital tract. Clinics Perinatol 1997; 24 : 343–368.
5. Austenfeld MS, Snow BW. Complications of pregnancy in women after reimplantation for vesicoureteral reflux. J Urol 1988; 140 : 1103–1106.
6. Greenwell TJ, Venn SN, Creighton S, Leaver RB, Woodhouse CRJ. Pregnancy after lower urinary tract reconstruction for congenital abnormalities. BJU 2003; 92(7): 773–777.
7. Yamazaki Y, Yago R, Toma H, Onodera J, Nakabayashi M. Pregnancy after augmentation cystoplasty. A case report. Nihon Hinyokika Gakkai Zasshi 1997; 88(6): 632–635.
8. Wiles K, Chappell L, Clark K, et al. Clinical practice guideline on pregnancy and renal disease. BMC Nephrology 2019; 20 : 401. https://doi.org/10.1186/s12882-019-1560-2.
9. Loughlin KR. Management of urologic problems during pregnancy. Urology 1994; 44 : 159–169.
10. Barrett RJ, Peters WA. Pregnancy following urinary diversion. Obstet Gynecol 1983; 62 : 582–586.
11. Xiong X, Fraser WD, Demianczuk NN. History of abortion, preterm, term birth, and risk of preeclampsia: a population‑based study. Am J Obstet Gynecol 2002; 187 : 1013–1018.
12. Vilanova S, McCracken K, Halleran DR, et al. Obstetrical outcomes in adult patients born with complex anorectal malformations and cloacal anomalies. J Pediatr Adolesc Gynecol 2019; 32(1): 7–14.
13. Dy GW, Willihnganz‑Lawson KH, Shnorhavorian M, et al. Successful pregnancy in patients with exstrophy‑epispadias complex: A University of Washington experience. J Pediatr Urol 2015; 11(4): 213.e1–6. doi: 10,016/j.jpurol.2015.04.019.
14. Johnson R, Slade P. Does fear of childbirth during pregnancy predict emergency Caesarean section? BJOG 2002; 109 : 1213–1221.
15. Schumacher S, Fichtner J, Stein R, et al. Pregnancy after Mainz pouch urinary diversion. J Urol 1997; 158 : 136–144.
16. Creagh TA, McInerney PD, Thomas PJ, Mundy AR. Pregnancy after lower urinary tract reconstruction in women. J Urol 1995; 154 : 1323–1324.
17. Kameda M, Takahara E, Kobayashi M, et al. Pregnancy and delivery after myelomeningocele repair, ven ‑ triculoperitoneal shunt implantation, and augmentation cystoplasty. Childs Nerv Syst 2016; 33(6): 1015–1017.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2020 Issue 1-
All articles in this issue
- Editorial
- Roboticky asistovaná okluze vezikovaginální píštěle – krok za krokem
- Multirezistentní gram‑negativní bakterie v urologii
- Hereditární renální nádorové syndromy
- Incidence karcinomu prostaty v preparátech po radikální cystoprostatektomii. Histopatologická charakteristika nádorů a posouzení vlivu histologického zpracování preparátu na incidenci nádoru
- Naše zkušenosti s využitím MRI/TRUS softwarové fúze při cílené biopsii prostaty
- Gravidita u pacientek po augmentaci měchýře střevním segmentem – naše zkušenosti
- Kazuistika gigantického recidivujícího angiomyolipomu podkovovité ledviny
- Možnost řešení obstrukce dolního segmentu ledviny u zdvojené pánvičky pomocí roboticky asistované pyelo‑pyelo anastomózy systémem da Vinci XI®
- Vzpomínka na emeritního přednostu Urologické kliniky FN Hradec Králové pana docenta MUDr. Josefa Bašeho, CSc.
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Naše zkušenosti s využitím MRI/TRUS softwarové fúze při cílené biopsii prostaty
- Multirezistentní gram‑negativní bakterie v urologii
- Hereditární renální nádorové syndromy
- Kazuistika gigantického recidivujícího angiomyolipomu podkovovité ledviny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

