-
Medical journals
- Career
Multirezistentní gram‑negativní bakterie v urologii
Authors: Vanda Adamcová 1; Lucie Bartáková 1; Pavel Čermák 2; Roman Zachoval 1,3; Jan Hrbáček 1
Authors‘ workplace: Urologická klinika 3. LF UK a Thomayerovy nemocnice, Praha 1; Oddělení klinické mikrobiologie, Thomayerova nemocnice, Praha 2; Urologická klinika 1. LF UK, Praha 3
Published in: Ces Urol 2020; 24(1): 18-25
Category: Review article
Overview
Gram‑negativní bakterie jsou nejčastější pa ‑ togeny způsobující infekce močových cest. Celosvětově dochází k nárůstu incidence rezistentních bakterií. Prevence a léčba infekcí způsobených rezistentními bakteriemi se stává závažným medicínským, sociálním a finančním problémem. Jedním z největších problémů zůstávají nozokomiální infekce a infekce spojené s invazivními vstupy. Znalost mechanismu rezistence a lokální epidemiologické situace napomáhá ke správné volbě empirické antibiotické terapie v situaci, kdy nejsou k dispozici výsledky kultivačního vyšetření.
Klíčová slova:
Uroinfekce – gram‑negativní bakterie – antibiotikum – rezistence
ÚVOD
V posledních deseti letech je lékařská veřejnost stále častěji konfrontována s existencí a rychlým šířením patogenních mikroorganismů, rezistentních na velkou část dosud používaných antibiotik. Vedle známého meticilin‑rezistentního Staphylococcus aureus (MRSA) jde především o střevní gram‑negativní bakterie: Escherichia coli, Klebsiella spp., Proteus spp. a další (viz tabulka 1). Infekce vyvolané multirezistentními (multi‑drug resistant, MDR) bakteriemi jsou spojeny s vyšší mortalitou (1), delší dobou hospitalizace a vyššími náklady na léčbu. Většinou se jedná o nozokomiální kmeny a často jsou spojeny s močovými katétry a jinými invazivními vstupy. Podle mezinárodní studie GPIU (Global Prevalence of Infections in Urology) mezi pacienty hospitalizovanými na urologických odděleních se 9 % z nich nakazilo nozokomiální infekcí, často způsobenou MDR organizmy (2). Proto si zasluhují pozornost (nejen) nemocničních urologů. V tomto přehledovém článku přinášíme shrnutí základních poznatků o MDR patogenech v kontextu našeho oboru.
Table 1. Základní fakta v souvislostech
Tab. 1. Elementary facts in context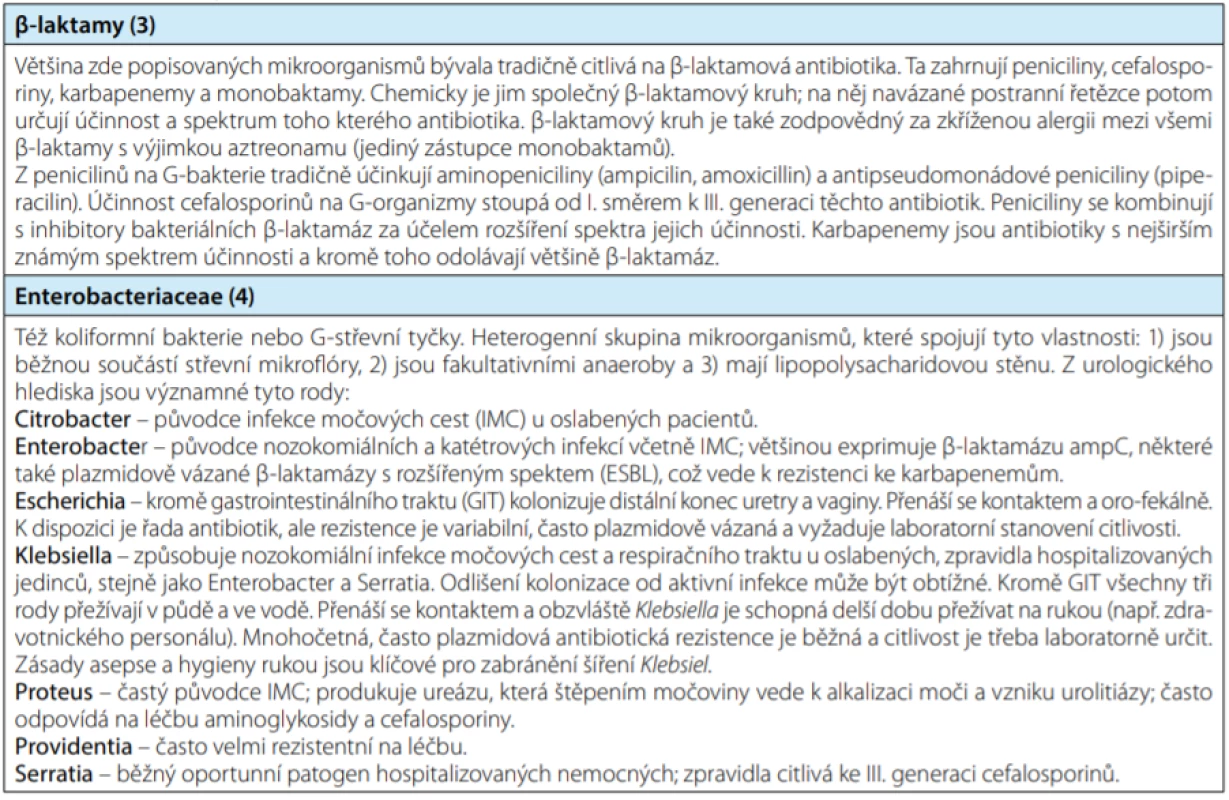
METODY
Relevantní publikace jsme vyhledali v databázi PubMed za použití vyhledávacích výrazů „extended beta lactamase“, „ESBL“, „carbapenemase“, „CPE“, „vancomycin resistant“, „VRE“, „methicillin resistant“, „MRSA“, společně s výrazem „urology ORsurgery“. Vyhledávání jsme omezili na humánní studie publikované v posledních deseti letech.
MECHANISMY REZISTENCE
Hlavní genetická informace bakterií je kódována v bakteriálním chromozomu. Některé bakterie však obsahují malé kruhové molekuly DNA, tzv. plazmidy, které kódují celou škálu informací včetně rezistence. Přenos genetické informace u bakterií probíhá nejen vertikálním způsobem, tedy z generace na generaci, ale i horizontálním způsobem, tedy v rámci jedné generace, a to i mezi různými bakteriálnimi kmeny. Horizontální přenos se může uskutečnit několika způsoby (5):
- transdukcí – přenosem pomocí bakteriálních virů (6)
- konjugací – výměnou genetické informace díky přímému spojení dvou bakterií
- transformací – příjmem genetické informace z prostředí Rezistence vůči antibiotikům je podmíněna širo ‑ kým spektrem mechanismů kódovaných jak chromozomálně, tak plazmidově. Následující zjednodušený přehled mechanismů rezistence má za cíl ukázat nejčastější způsoby rezistence vůči antibiotikům.
Modifikace antibiotika
- Chemická modifikace antibiotika: bakterie produkují enzymy schopné chemicky změnit molekulu antibiotika. Nejčastěji dochází k acetylaci, fosforylaci či adenylaci některé části molekuly antibiotika. Příkladem této rezistence může být enzym AME (Aminoglycoside Modifying Enzym), který kovalentní vazbou modifikuje hydroxylovou nebo amino‑skupinu aminoglykosidového antibiotika, a tím ho inaktivuje (5).
- Destrukce molekuly antibiotika: produkce enzymu schopného destruovat molekulu antibiotika. Příkladem této rezistence je enzym β‑laktamáza, která rozkládá amidový můstek β‑laktamového kruhu penicilinové řady antibiotik. Bylo popsáno více než 1 000 druhů β‑laktamáz. Pro lepší orientaci bylo vytvořeno několik klasifikací; pro klinickou praxi jsou významné následující skupiny:
- ESBL (Extended‑spectrum β‑lactamase): β‑laktamáza schopná inaktivovat peniciliny, cefalosporiny I.–III. řady a monobaktamy; naopak ESBL bakterie jsou citlivé ke karbapenemům a cefemycinovým antibiotikům (cefoxitin, cefotetan, cefmetazol); tento enzym je inhibován kyselinou klavulanovou (5),
- AmpC β‑laktamáza, někdy též nazývaná cefalosporináza je schopna inaktivovat všechny peniciliny i cefalosporiny; cefalosporiny IV. generace jsou horším substrátem a zachovávají si reziduální aktivitu; tento enzym není inhibován kyselinou klavulanovou (5),
- karbapenemázy: několik typů enzymů inaktivující všechna antibiotika penicilinové řady včetně karbapenemů; tyto enzymy dělíme na serinové karbapenemázy a metalokarbapenamázy; serinové karbapenemázy jsou na rozdíl od metalokarbapenemáz inhibovány kyselinou klavulanovou a tazobaktamem.
Snížení permeability nebo eflux molekuly antibiotika
- Snížení permeability: hydrofilní molekuly do buňky pronikají díky membránovým proteinům, takzvaným porinům. Změnou exprese porinů nebo jejich modifikací se změní permeabilita a tím i účinnost antibiotika. Tento typ rezistence se uplatňuje například u fluorochinolonů, betalaktamů a tetracyklinových antibiotik (5).
- Efluxní pumpa: bakterie mají v membránách integrované proteinové komplexy, které jsou schopny odstraňovat nepotřebné či škodlivé molekuly z cytoplazmy. Tyto membránové komplexy (efluxní pumpy) mohou také odstraňovat molekuly antibiotika. Efluxní pumpa může být molekulově specifická pro dané antibiotikum (například rezistence vůči tetracyklinu), nebo v případě multirezistentních bakterií může být schopna odstranit celou škálu antibiotik (fluorochinolony, beta‑laktamy, karbapenemy a polymyxiny) (5).
Změna cílového místa
- Ochrana cílového místa: bakterie jsou schopny produkce proteinu, který kompetuje o vazebné místo antibiotika. Většina těchto proteinů je kódovaná plazmidově. Příkladem je rezistence vůči fluorochinolonům, kdy dochází k produkci Qnr proteinu, který kompetuje o vazebné místo DNA gyrázy a topoizomerázy IV společně s molekulou antibiotika, a tím snižuje jeho účinnost (5).
- Modifikace cílového místa: tento mechanismus rezistence je jedním z nejběžnějších. Vyskytuje se téměř u každé skupiny antibiotik. Mechanismy jsou následující:
- mutace cílového místa: příkladem je rezistence vůči fluorochinolonům, které působí díky vazbě na DNA gyrázu a topoizomerázu IV; v případě mutací těchto proteinů dochází ke snížení vazebné aktivity antibiotika (5),
- enzymatická změna cílového místa: například produkce enzymu schopného metylovat ribosom; na takto metylovaný ribozom se nemůže navázat makrolidové antibiotikum (5),
- kompletní náhrada nebo bypass cílového místa: tento typ rezistence se uplatňuje například při vzniku rezistence na penicilinová antibiotika; účinek penicilinů spočívá ve vazbě na penicilin binding protein (PBP); PBP je enzym nezbytný k transpeptidaci a transglykosidaci peptidoglykanu; tyto vazby zabezpečují stabilitu bakteriální membrány; např. meticilin rezistentní Staphylococcus aureus produkuje PBP 2a, který má nízkou afinitu k penicilinovým antibiotikům a tím obchází cílové místo antibiotika (5).
EPIDEMIOLOGICKÁ SITUACE REZISTENTNÍCH BAKTERIÍ V EVROPĚ
Organizace European Centre for Disease Pre ‑ vention and Control (ECDC) pravidelně sleduje rezistence jednotlivých bakterií vůči vybraným skupinám antibiotik v evropských zemích (7). Poslední data vydaná v listopadu 2017 vycházejí ze situace v letech 2013–2016. Pravidelně sledovanými antibiotiky jsou: aminopeniciliny, fluorochinolony, III. generace cefalosporinů, ami ‑ noglykosidy a karbapenemy. Míru rezistence vybraných uropatogenů vůči sledovaným antibiotikům uvádí tabulka 2.
Table 2. Podíl rezistentních izolátů vybraných bakterií vůči sledovaným antibiotikům (%) (7)
Tab. 2. Resistance rates of selected bacteria to antibiotics (%) (7)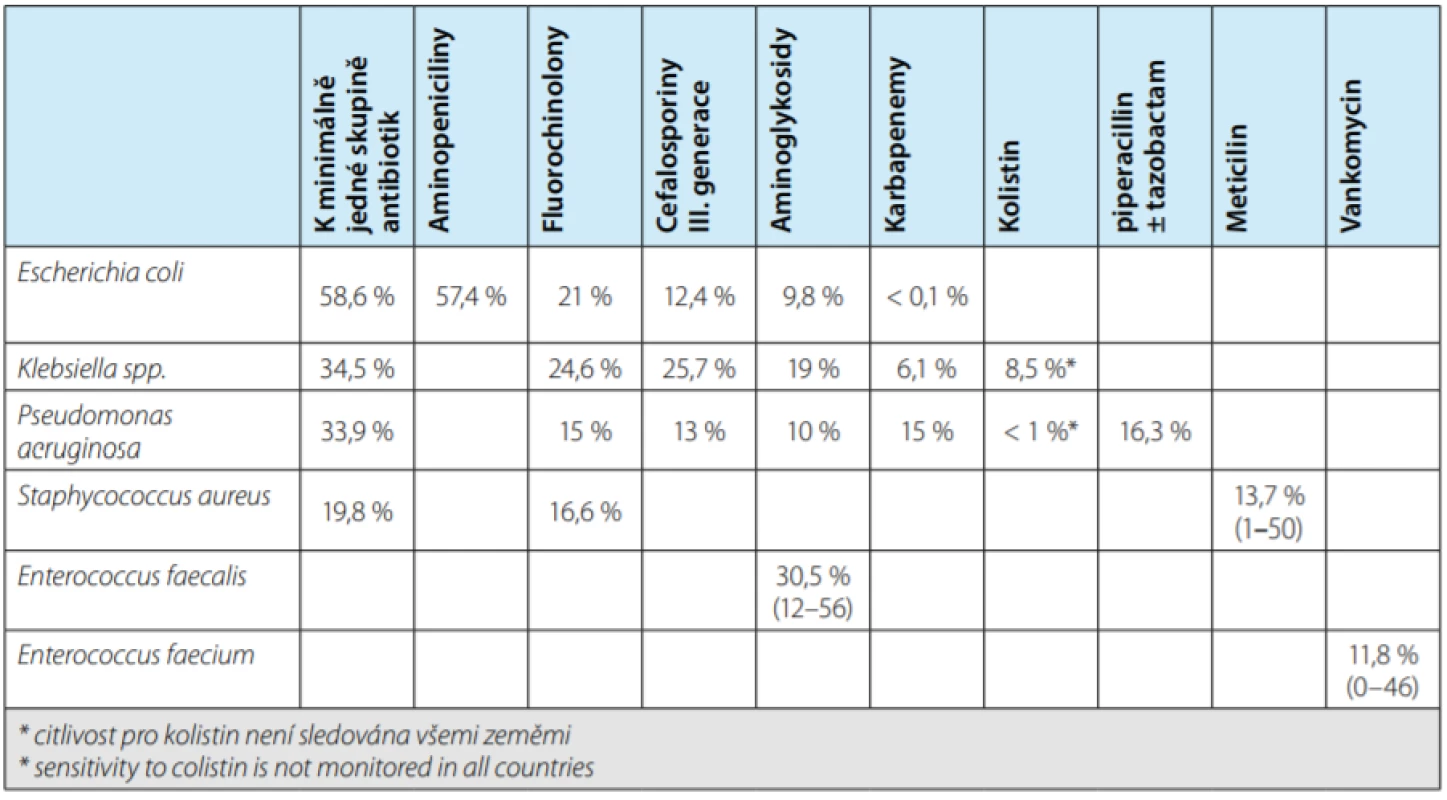
EPIDEMIOLOGIE A RIZIKOVÉ FAKTORY REZISTENCÍ UROPATOGENNÍCH BAKTERIÁLNÍCH KMENŮ NA UROLOGICKÝCH ODDĚLENÍCH
Znalost nejčastějších bakteriálních kmenů způsobujících infekce močových cest (IMC) u pacientů na urologických odděleních je klíčová pro efektivní nasazení empirické terapie, která se poté modifikuje dle výsledků bakteriální kultivace. Několik studií analyzovalo nejčastější patogeny přítomné u pacientů hospitalizovaných na urologických odděleních nemocnic. Na základě těchto výsledků byly identifikovány rizikové faktory pro infekci ESBL pozitivními bakteriemi (2, 8, 9). Retrospektivní analýza mikrobiálních nálezů hemokultur 1440 pacientů hospitalizovaných s podezřením na septikemii prokázala přítomnost bakterií u 9,2 % pacientů. U 58,3 % z nich byly prokázány gram‑pozitivní bakterie (Staphylococcus aureus – z toho více jak 70 % MRSA, koaguláza negativní Staphylococcus), zatímco u 40,2 % pacientů byly pokazány gram‑negativní bakterie (E. coli a Klebsiela spp. – s ESBL pozitivitou v 39,6 % případů). Gram‑pozitivní bakterie byly nejcitlivější na tetracyklin, teicoplanin, vankomycin, klindamycin, daptomycin a linezolid. Gram‑negativní bakterie byly nejci ‑ tlivější na karbapenemy, colistin, aminoglykosidy a tigecyklin (8). Jiná retrospektivní studie v maďarské univerzitní nemocnici analyzovala nejčastější bakteriální kmeny v močové kultivaci u pacientů se suspektní IMC a kultivační nálezy u asymptomatických pacientů před plánovanou operací. Studie analyzovala 2871 výsledků močových kultivací (2). Podobné pořadí četnosti uropatogenů bylo popsáno ve španělské prospektivní studii nozokomiálních infekcí zahrnující 6546 pacientů. Incidence nemocničních infekcí byla 6,3 % (z toho 70,6 % UTI, infekce v ráně 22,2 % a katétrová septikemie 6,3 %) (9). Tabulka 3 srovnává základní výsledky maďarské a španělské studie Klebsiella spp. byla nejčastějším patogenem u pacientů s diabetem, jaterním onemocněním, imunosupresí a u pacientů po prodělané uroinfekci. Enterococcus spp. byl nejčastějším patogen v ráně u pacientů po cystektomii (8). Jako rizikové faktory pro přítomnost ESBL pozitivních bakterií byly identifikovány vyšší věk, mužské pohlaví, diabetes mellitus, zavedený katétr či nazogastrická sonda, předchozí hospitalizace nebo pobyt v domově se zdravotně ošetřovatelskou péčí, imunosuprese, urolitiáza, předchozí užívání antibiotik, ASA status III–IV, doba od zavedení močového katétru a předchozí operace (8). Zkoumáním kultivačních výsledků 18 112 pacientů byly identifikovány podobné nezávislé rizikové faktory ESBL pozitivity u pacientů s nálezem E. coli a Klebsiella spp. Mužské pohlaví zvyšuje pravděpodobnost infekce ESBL bakterii o 50 %, zavedený katétr o 30 % a každých deset let věku přidává 10 % rizika infekce ESBL pozitivní bakterií (10).
Table 3. Porovnání etiologických agens nozokomiálních infekcí u pacientů hospitalizovaných na urologickém oddělení v retrospektivní maďarské (2) a prospektivní španělské (9) studii
Tab. 3. Causative agents of health care-associated infections in a urology department according to a retrospective Hungarian (2) and a prospective Spanish (9) study, respectively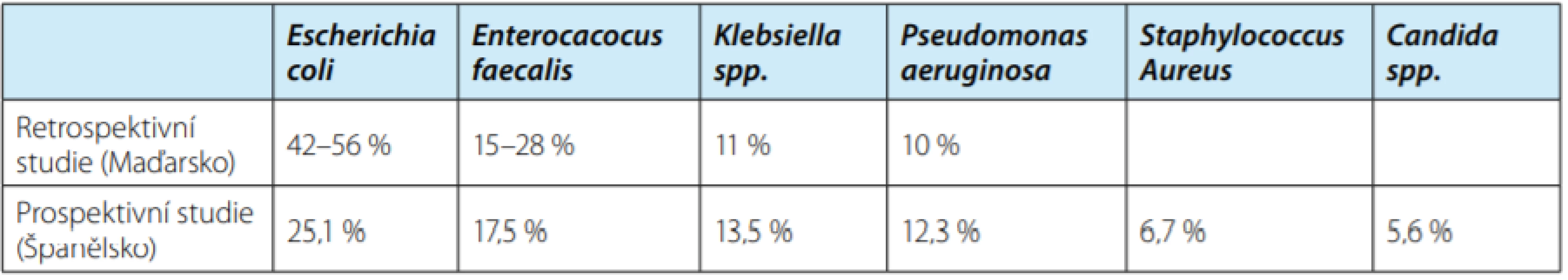
REZISTENCE BAKTERIÍ U PACIENTŮ S INVAZIVNÍMI UROLOGICKÝMI VSTUPY
Několik studií prokázalo vyšší incidenci kolonizace a asymptomatické bakteriurie u pacientůs derivací horních močových cest, především po operaci pro litiázu a po transplantaci ledviny. IMC spojená s derivací horních močových cest je zatížena vyšší incidencí rezistentních bakterií ve srovnání s komunitně získanými IMC (11, 12, 13). Prospektivní studie analyzovala 209 pacientů s derivací horních močových cest (JJ stentem, nefrostomií a kombinovaným nefrostomicko‑ureterálním stentem). Byly identifikovány nejčastější patogeny způsobující IMC u těchto pacientů a míra jejich rezistence (tabulka 4). Nejčastěji byly multirezistentní bakterie detekovány u pacientů s kombinovaným nefrostomicko‑ureterálním stentem (58,3 %), dále u pacientů s nefrostomií (47,1 %) a nejméně u pacientů se zavedeným JJ stentem (28,6 %) (14).
Table 4. Procentuální zastoupení rezisteních bakterií v závislosti na typu derivace horních močových cest
Tab. 4. Multi-drug resistant bacterial strain rates depending on the type of upper urinary tract diversion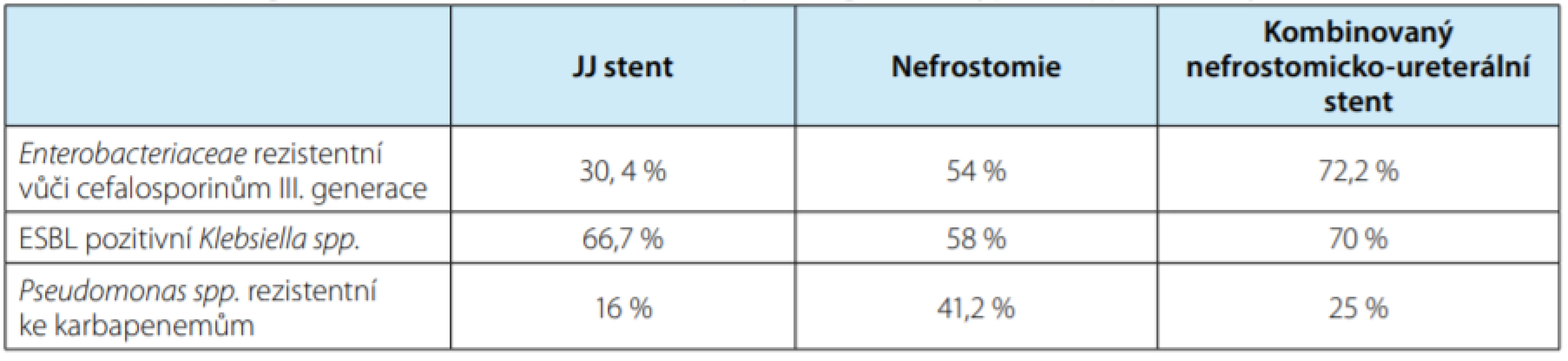
OBECNÁ DOPORUČENÍ PRO PREVENCI ŠÍŘENÍ A LÉČBU INFEKCÍ ZPŮSOBENÝCH REZISTENTNÍMI BAKTERIÁLNÍMI KMENY
Mnoho epidemiologických studií prokázalo zvyšující se incidenci multirezistentních kmenů bakterií způsobujících IMC (8, 10, 15, 16, 17). Mezi základní opatření ke snížení rezistence bakterií patří racionální užívání antibiotik dle aktuální epidemiologické situace. V případě empirické antibiotické terapie je následně nutná její úprava dle výsledků kultivačního vyšetření, které by mělo být odebráno před podáním první dávky antibiotika. Dodržení doporučené délky léčby je rovněž nezbytnou součástí prevence nárůstu incidence rezistentních kmenů. Zvláštní kapitolu představuje asymptomatická bakteriurie (ABU). Dle posledních výzkumů působí ABU preventivně proti symptomatickým epizodám IMC. Léčba ABU zvyšuje incidenci akutních symptomatických uroinfekcí a v populačním kontextu vede k selekci rezistentních bakteriálních kmenů (18). Jediné dvě výjimky z tohoto pravidla jsou pacienti před endourologickými výkony, během kterých dojde k porušení slizniční bariéry, a těhotné ženy. Bakteriurie během endoskopických urologických operací je rizikovým faktorem pro infekční komplikace včetně urosepse (22). U těhotných žen vyplývá z historických studií, že neléčená ABU přináší zvýšené riziko symptomatické uroinfekce, předčasného porodu a nižší porodní hmotnosti plodu. Avšak nedávná, kvalitativně lepší prospektivní kohortová studie zpochybnila i tyto závěry (23). Poněkud překvapivě se dnes nedoporučuje screening a léčba ABU ani před plánovanou ortopedickou operací s implantací kloubní náhrady, ani u pacientů po transplantaci ledviny (18, 19, 20). Součástí prevence nárůstu bakteriálních rezistencí je také racionální antibiotická perioperační profylaxe. Užívání antibiotické profylaxe před urologickými výkony je určeno doporučeními Evropské urologické společnosti. Volba profylaktického antibiotika závisí od aktuální lokální epidemiologické situace. Širokospektrá antibiotika jsou rezervována pro terapii, nikoliv pro profylaktické užití. K podání antibiotika by mělo dojít 30–60 minut (rozhodně ne déle než dvě hodiny) před operací, v jediné dávce. V případě dlouhého výkonu může být profylaxe rozšířena o další podání, maximálně však do 72 hodin po operaci (21).V případě výskytu rezistentních bakterií (MRSA, ESBL, AmpC, VRE, apod.) na odděleních se doporučují tato základní hygienicko‑epidemiologická opatření (21):
- samostatný pokoj pro pacienta s označením (izolace),
- ochranné prostředky personálu při kontaktu s pacientem (rukavice, igelitová zástěra),
- dezinfekce – rukou, stetoskopů, oblečení, nádobí,
- edukace návštěv pacienta,
- izolace odpadu. Tato opatření nejen snižují šíření rezistentních bakterií mezi pacienty, ale chrání i samotné zdra ‑ votnické pracovníky a jejich rodinné příslušníky před kolonizací těmito bakteriemi (24).
ZÁVĚR
Vzhledem ke zvyšující se incidenci rezistentních bakterií lze říci, že každý urolog se buď již setkal, anebo se setká s multirezistentním kmenem bakterií. Pro efektivní léčbu je třeba:
- znalost aktuální epidemiologické situace a výskytu rezistentních bakterií v populaci,
- zohlednění typu infekce – zda se jedná o komu ‑ nitně získanou, či nozokomiální infekci,
- zohlednění rizikových faktorů pacienta,
- dodržování pravidel antibiotické terapie,
- koordinace léčby s antibiotickým centrem,
- dodržování hygienických opatření u pacientů s prokázanou rezistentní bakterií.
Střet zájmů: Žádný.
Prohlášení o podpoře: Podpořeno MZ ČR – RVO (Thomayerova nemocnice – TN, 00064190).
Hlavní stanovisko práce: Infekce močových cest jsou nejčastěji způsobené gram‑negativními (G-) bakteriemi, jejichž spektrum rezistence se v posled ‑ ních letech rozšiřuje. Znalost základních mechanis ‑ mů rezistence a lokální epidemiologické situace pomáhá efektivnímu nasazení empirické antibiotické terapie v každodenní klinické praxi.
Major statement: Urinary tract infections are most commonly caused by gram‑negative bacteria. Their antimicrobial resistance has been increasing in recent years. Knowledge of basic resistance mechanisms and local epidemiological situation helps in the effective use of antibiotic therapy in daily clinical practice.
Došlo: 22. 4. 2019
Přijato: 8. 8. 2019
Kontaktní adresa:
MUDr. Jan Hrbáček, Ph.D.
Urologická klinika 3. LF UK a Thomayerovy nemocnice
Vídeňská 800, 140 00 Praha 4 – Krč
e‑mail: jan.hrbacek@ftn.cz
Sources
1. Rottier WC, Ammerlaan HSM, Bonten MJM. Effects of confounders and intermediates on the association of bacteraemia caused by extended‑spectrum β‑lactamase‑producing Enterobacteriaceae and patient outcome: a meta‑analysis. J Antimicrob Chemother. 2012; 67(6): 1311–1320. 2. Magyar A, Köves B, Nagy K, et al. Spectrum and antibiotic resistance of uropathogens between 2004 and 2015 in a tertiary care hospital in Hungary. J Med Microbiol. 2017; 66(6): 788–797. 3. Jawetz E, Brooks G, Melnick J, et al. Jawetz, Melnick, & Adelberg’s medical microbiology. 27th ed. New York: McGraw‑Hill Medical 2016 : 231–236. 4. Page C. Integrated pharmacology. 3rd ed. [Edinburgh]: Elsevier Mosby; 2006 : 113–118. 5. Munita JM, Arias CA. Mechanisms of Antibiotic Resistance. Microbiol Spectr [Internet]. duben 2016 [citován 31. říjen 2018]; 4(2). Dostupné z: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4888801/. 6. Varga M, Pantůček R, Růžičková V, Doškař J. Molecular characterization of a new efficiently trans ‑ ducing bacteriophage identified in meticillin‑resistant Staphylococcus aureus. J Gen Virol. 2016; 97(1): 258–268. 7. European Centre for Disease Prevention and Control. Surveillance of antimicrobial resistance in Europe 2016. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS‑Net). Stockholm: ECDC; 2017. 8. Gohel K, Jojera A, Soni S, et al. Bacteriological Profile and Drug Resistance Patterns of Blood Culture Isolates in a Tertiary Care Nephrourology Teaching Institute. BioMed Res Int. 2014; 2014 : 1–5. 9. Medina‑Polo J, Sopeña‑Sutil R, Benítez‑Sala R, et al. Prospective study analyzing risk factors and cha ‑ racteristics of healthcare‑associated infections in a Urology ward. Investig Clin Urol. 2017; 58(1): 61. 10. Toner L, Papa N, Aliyu SH, et al. Extended‑spectrum beta‑lactamase‑producing Enterobacteriaceae in hospital urinary tract infections: incidence and antibiotic susceptibility profile over 9 years. World J Urol. 2016; 34(7): 1031–1037. 11. Ozgur BC, Ekıcı M, Yuceturk CN, Bayrak O. Bacterial colonization of double J stents and bacteriuria frequency. Kaohsiung J Med Sci. 2013; 29(12): 658–661. 12. Kehinde EO, Rotimi VO, Al‑Hunayan A, et al. Bacteriology of urinary tract infection associated with indwelling J ureteral stents. J Endourol. 2004; 18(9): 891–896. 13. Lojanapiwat B. Colonization of internal ureteral stent and bacteriuria. World J Urol. 2006; 24(6): 681–683.
14. Lara‑Isla A, Medina‑Polo J, Alonso‑Isa M, et al. Urinary Infections in Patients with Catheters in the Upper Urinary Tract: Microbiological Study. Urol Int. 2017; 98(4): 442–448. 15. van der Donk CFM, Beisser PS, Hoogkamp‑Korstanje JAA, et al. A 12 year (1998-2009) antibiotic resistance surveillance of Klebsiella pneumoniae collected from intensive care and urology patients in 14 Dutch hospitals. J Antimicrob Chemother. 2011; 66(4): 855–858. 16. Stapleton PJ, Lundon DJ, McWade R, et al. Antibiotic resistance patterns of Escherichia coli urinary isolates and comparison with antibiotic consumption data over 10 years, 2005–2014. Ir J Med Sci. 2017; 186(3): 733–741. 17. Hanuš M, Matoušková M, Králová V, et al. Imunostimulace polybakteriálním lyzátem (Urivac®) v pre ‑ venci recidivujících infekcí dolních močových cest. Ces Urol 2015; 19(1): 33–43. 18. Cai T, Mazzoli S, Lanzafame P, et al. Asymptomatic Bacteriuria in Clinical Urological Practice: Preope ‑ rative Control of Bacteriuria and Management of Recurrent UTI. Pathogens. 2016; 5(1): 4. 19. EAU Guidelines. Edn. presented at the EAU Annual Congress Copenhagen 2018. ISBN 978-94-92671-01-1. 20. Sousa R, Muñoz‑Mahamud E, Quayle J, et al. Is Asymptomatic Bacteriuria a Risk Factor for Prosthetic Joint Infection? Clin Infect Dis Off Publ Infect Dis Soc Am. 2014; 59(1): 41–47. 21. Concia E, Azzini AM. Aetiology and antibiotic resistance issues regarding urological procedures. J Chemother. 2014; 26(Suppl 1): S14–23. 22. Wullt B, Sundén F, Grabe M. Asymptomatic Bacteriuria is Harmless and Even Protective: Don’t Treat if You Don’t Have a Very Specific Reason. Eur Urol Focus. 2019; 5(1): 15–16. 23. Köves B. Asymptomatic Bacteriuria: To Treat or Not To Treat. Pro Treatment. Eur Urol Focus 2019; 5(1): 13–14. 24. Holý O, Matoušková I, Zatloukalová S, et al. Prevalence of strains of Staphylococcus epidermidis and other coagulase‑negative staphylococci with biofilm‑forming ability at a department of hemato‑oncology. Klin Mikrobiol Infekcni Lek. 2018; 24(3): 68–72.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2020 Issue 1-
All articles in this issue
- Editorial
- Robotic‑assisted vesicovaginal fistula repair: step by step
- Multi-resistant gram negative bacteria in urology
- Hereditary renal cell carcinoma syndromes
- Incidence of prostate cancer in radical cystoprostatectomy specimen. Histopathological characteristics of tumor and the influence of the method of histological processing on the occurrence of incidental prostate cancer
- Our experience with MRI/TRUS software fusion for targeted prostate biopsies
- Pregnancy in patients post bowel segment bladder augmentation – our experience
- Case report of a gigantic recurrent angiomyolipoma in a horseshoe kidney
- Možnost řešení obstrukce dolního segmentu ledviny u zdvojené pánvičky pomocí roboticky asistované pyelo‑pyelo anastomózy systémem da Vinci XI®
- Vzpomínka na emeritního přednostu Urologické kliniky FN Hradec Králové pana docenta MUDr. Josefa Bašeho, CSc.
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Our experience with MRI/TRUS software fusion for targeted prostate biopsies
- Multi-resistant gram negative bacteria in urology
- Hereditary renal cell carcinoma syndromes
- Case report of a gigantic recurrent angiomyolipoma in a horseshoe kidney
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

