-
Medical journals
- Career
Význam stanovení survivinu v moči pro neinvazivní diagnostiku uroteliálních karcinomů močového měchýře
Authors: Michael Pešl 1; Marko Babjuk 1; Viktor Soukup 1; Monika Szakácsová 1; Pavel Dundr 2; Tomáš Hanuš 1
Authors‘ workplace: Urologická klinika 1. LF UK a VFN, Praha 1; Ústav patologie 1. LF UK a VFN, Praha 2
Published in: Ces Urol 2010; 14(2): 99-103
Category: Original article
Overview
Cíl:
Cílem této práce bylo zhodnotit význam stanovení survivinu v moči pro diagnostiku uroteliálních karcinomů močového měchýře.Soubor a metodika:
Do prospektivní studie jsme zařadili 151 pacientů (do skupiny s tumorem močového měchýře 84, do kontrolní skupiny 67). Sledování probíhalo od července 2004 do ledna 2006. Pacienti s nádory močového měchýře byli dále rozděleni do skupin dle stupně nádorové invaze, diferenciace, multiplicity, velikosti nádoru a dle toho, zda se jednalo o primozáchyt či recidivu onemocnění.Výsledky:
Průměrná hodnota survivinu v moči ve skupině s nádorem měchýře byla 32,4 pg/ml, v kontrolní skupině 22,4 pg/ml (p = 0,001). Statisticky významné rozdíly mezi jednotlivými skupinami vykazoval stupeň nádorové invaze, diferenciace a velikost tumorů. Hraniční hodnota hladiny survivinu tak, aby specificita testu byla 90%, byla vypočtena 33,9 pg/ml. Při této hodnotě byla senzitivita, pozitivní a negativní prediktivní hodnota 45 %, 86 % a 53 %. Senzitivita testu byla nejvyšší u špatně diferencovaných nádorů (68–100%), u invazivních nádorů (80%) a u nádorů větších než 5 cm (79%).Závěr:
Naše práce demonstruje signifikantní rozdíl mezi hladinou survivinu v moči u pacientů s tumorem močového měchýře oproti skupině pacientů s benigním urologickým onemocněním. Hladina survivinu v moči u pacientů s nádorem močového měchýře korelovala se stupněm nádorové invaze, diferenciace a velikostí nádoru. Stanovení hladiny survivinu v moči může být použito pro předpověď invazivní formy onemocnění a nízké diferenciace tumoru.Klíčová slova:
močový měchýř, survivin, uroteliální nádory.Úvod
Survivin je bílkovina, která hraje důležitou roli v onkogenezi. Jeho molekulová hmotnost je 16,5 kDa. Gen kódující survivin leží v regionu 17q25. Jedná se o protein ze skupiny inhibitorů apoptózy, které negativně regulují buněčný cyklus. Survivin je zvláštní tím, že je za fyziologických okolností exprimován pouze během embryonálního období. V normálních tkáních dospělých jedinců není detekovatelný. Jeho přítomnost je prokazována u pacientů s různými karcinomy, např. prostaty, ledviny, plic, tlustého střeva, jícnu a močového měchýře (1–3). Survivin může být vyšetřován v séru, moči nebo se míra jeho exprese stanoví ve tkáních imunohistochemicky.
Mnoho předchozích studií prokázalo pozitivní korelaci mezi mírou exprese survivinu ve tkáni karcinomu močového měchýře a pokročilostí onemocnění, jeho agresivitou, prognózou a rezistencí k protinádorové léčbě (4, 5).
Stanovením survivinu v moči se poprvé zabýval v roce 2001 Smith. V této studii byla jeho zvýšená hladina v moči přítomna u všech pacientů s prokázaným karcinomem močového měchýře, zatímco v kontrolní skupině nebyla jeho hladina v moči detekovatelná (6).
Provedli jsme studii s cílem zhodnotit přínos stanovení survivinu v moči pro neinvazivní detekci uroteliálních karcinomů močového měchýře.
Metoda
Do prospektivní studie jsme v období od července 2004 do ledna 2006 zařadili celkem 151 pacientů (102 mužů a 49 žen). Ve skupině pacientů s tumorem močového měchýře bylo celkem 84 pacientů, do kontrolní skupiny jsme zařadili 67 jedinců s různými benigními urologickými onemocněními (BPH, kongenitální hydronefróza, striktura uretry). Průměrný věk byl 66,2 let (21–87 let), v kontrolní skupině byl průměr 54 let, u pacientů s tumory měchýře 67.
Všichni pacienti s nádory močového měchýře podstoupili transuretrální resekci (TUR), nádory byly histologicky verifikovány. Random biopsie nebyly prováděny.
Pacienti s nádory močového měchýře byli dále rozděleni do skupin dle stupně nádorové invaze (svalovinu nefiltrující a infiltrující), dle stupně nádorové diferenciace (G1, G2, G3 a G4), dle plošného rozsahu (solitární a mnohočetné), dle velikosti nádoru (do 1,9 cm, 2–4,9 cm a větší než 5 cm) a dle toho, zda se jednalo o primozáchyt, či recidivu onemocnění. Výsledky byly v jednotlivých skupinách samostatně hodnoceny.
Charakteristiku skupiny pacientů s tumory močového měchýře shrnuje tabulka 1, kontrolní skupinu tabulka 2.
Table 1. Charakteristika souboru pacientů Table 1 Description of study group 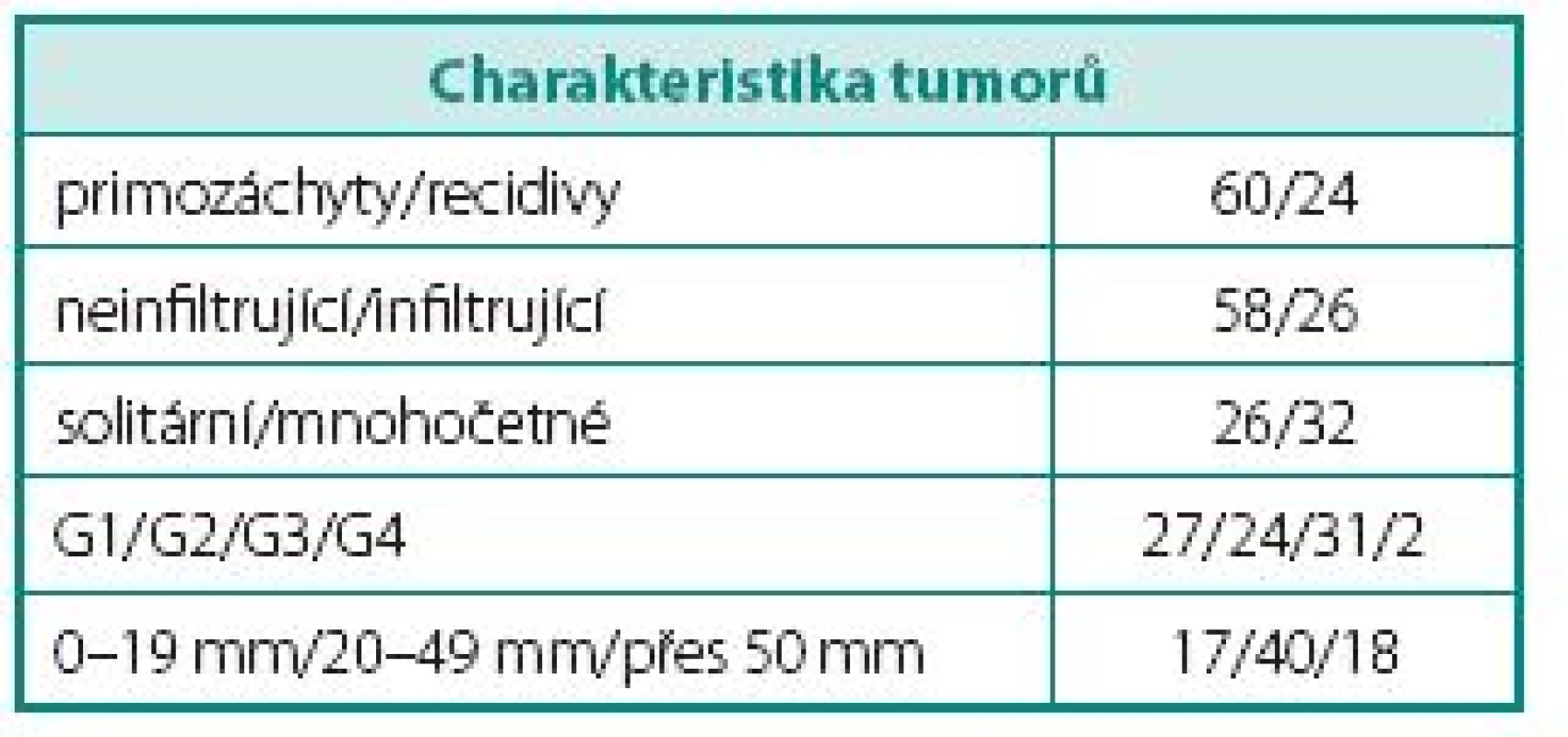
Table 2. Charakteristika kontrolní skupiny Table 2 Description of screenings 
Vzorky spontánně vymočené moči byly odebírány do 48 hodin před TUR a byly ihned po odběru zmraženy na -20oC.
K detekci survivinu ve vzorcích moči byla použita metoda TiterZyme EIA human Total Survivin Enzyme Immunometric Assay, Assay designs, Inc. (USA).
Všichni pacienti v kontrolní skupině měli negativní výsledek cytologického vyšetření moči (PAP I nebo PAP II) a při endoskopickém vyšetření nebyl nádor močového měchýře prokázán. U všech zařazených do studie byla vyloučena močová infekce aktuálním kultivačním vyšetřením moči.
Při statistickém hodnocení byl použit program S.A.S. software release 8.2 (SAS Inc., Cary, USA). Hladina statistické významnosti byla stanovena p = 0,05. Korelace mezi hladinou survivinu v moči a klinickopatologickými charakteristikami (nádorová invaze, diferenciace, mnohočetnost, velikost nádoru a recidiva onemocnění) byla zkoumána pomocí χ2 testu nebo Fischerova testu.
Výsledky
Průměrná hodnota survivinu v moči ve skupině s prokázaným karcinomem močového měchýře byla 32,4 pg/ml. Průměrná hodnota survivinu v moči v kontrolní skupině byla 22,4 pg/ml. Rozdíl mezi těmito hodnotami byl statisticky významný (p = 0,001).
Rozdílné hodnoty survivinu v moči dle klinickopatologických kritérií jsou uvedeny v tabulce 3. Statisticky významné rozdíly mezi jednotlivými skupinami vykazoval stupeň nádorové invaze, diferenciace a celková velikost tumorů.
Table 3. Výsledky – hladina survivinu v jednotlivých skupinách pacientů Table 3 Results – survivin level in different groups of patients 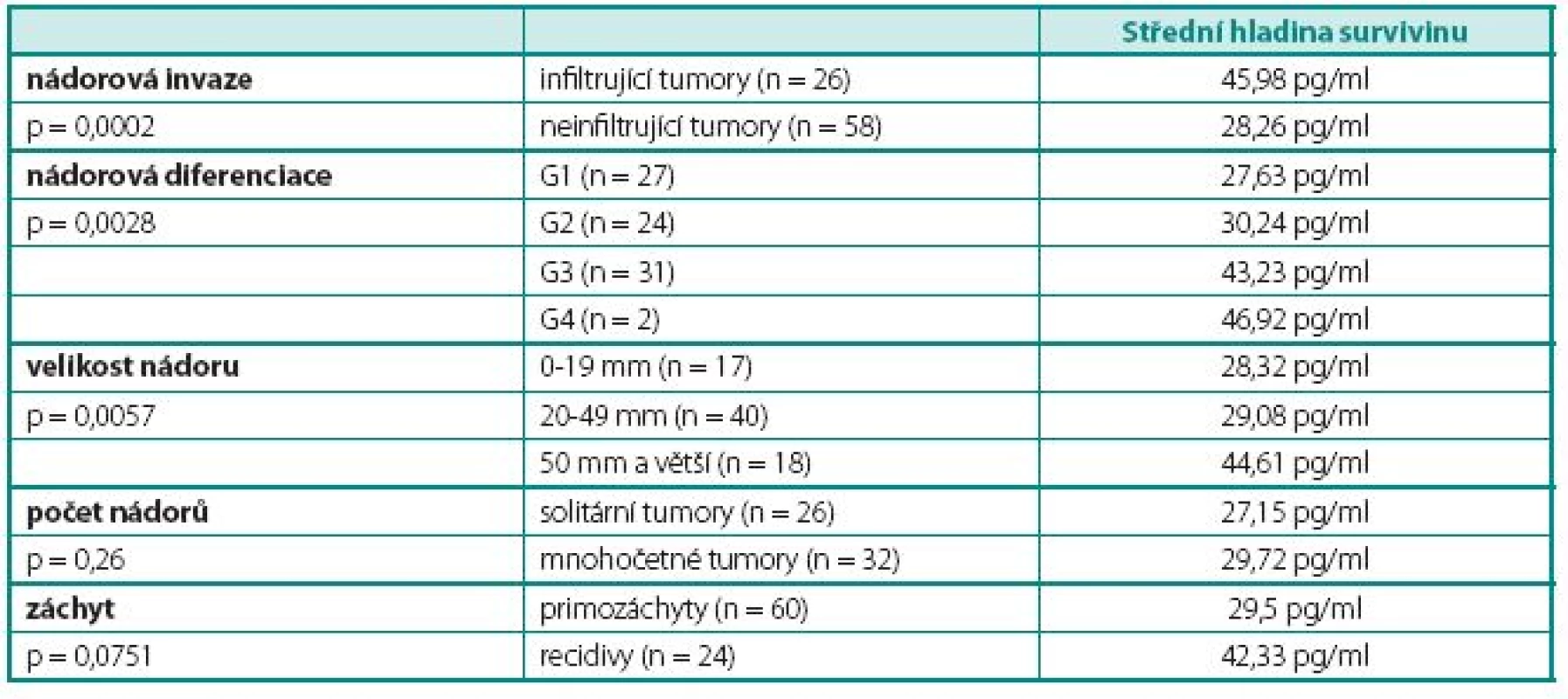
Hraniční hodnota (cut-off) hladiny survivinu v moči, tak aby specificita testu byla 90%, byla vypočtena 33,9 pg/ml. Senzitivitu testu při této specificitě uvádí tabulka 4. Při této hraniční hodnotě byla výsledná senzitivita, pozitivní a negativní prediktivní hodnota 45 %, 86 % a 53 %.
Table 4. Výsledky – senzitivita vyšetření survivinu v moči v jednotlivých hodnocených skupinách Table 4 Results – sensitivity of urine survivin in different study groups 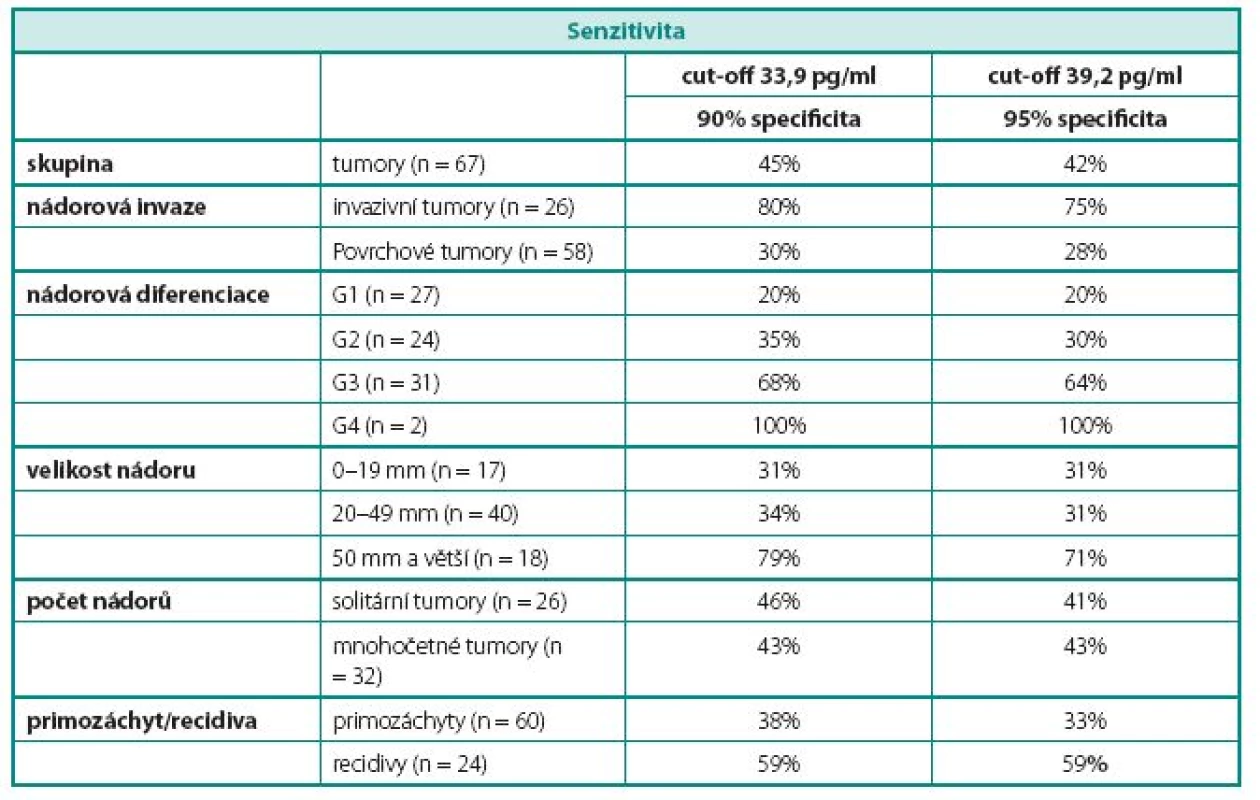
Senzitivita testu byla nejvyšší u špatně diferencovaných nádorů (68%, resp. 64), u infiltrujících nádorů (80%) a u nádorů větších než 5 cm (79%). Pro 95% specificitu byl cut-off stanoven na 39,2 pg/ml.
Diskuse
Většina studií zabývajících se vztahem survivinu k uroteliálním karcinomům močového měchýře využívá imunohistochemického vyšetření survivinu v nádorové tkáni (7–9). O stanovení survivinu v moči bylo publikováno podstatně méně informací. První zprávu o stanovení hladiny survivinu v moči publikoval Smith v roce 2001 (6). Rozdělil pacienty do skupin s benigním urologickým onemocněním, s urologickým maligním onemocněním kromě močového měchýře, s prokázaným karcinomem močového měchýře a s karcinomem močového měchýře v minulosti. Zvýšená hladina survivinu v moči byla přítomna u všech pacientů s prokázaným karcinomem močového měchýře, jen v minimu případů s anamnézou karcinomu močového měchýře, zatímco u pacientů s benigním urologickým onemocněním či maligním onemocněním nepostihujícím močový měchýř nebyla jeho hladina v moči detekovatelná. Senzitivita a specificita stanovení survivinu v moči byla 100%, resp. 95%. V této práci také pozitivně korelovala hladina močového survivinu se stupněm nádorové diferenciace, což je ve shodě s naším pozorováním. V naší studii byl test pozitivní u obou pacientů s G4 tumory. Také Shariat prokázal vysokou hladinu močového survivinu u pacientů s karcinomem močového měchýře, především s nízce diferencovanými karcinomy (10).
V roce 2006 publikoval své výsledky Ziaee. Prokázal 90% senzitivitu a 50% specificitu (11). V naší práci jsme při 90%, resp. 95% specificitě zjistili 45%, resp. 42% senzitivitu tohoto testu. V podskupině pacientů s invazivními tumory však byla senzitivita 80%, resp. 75%. I když jsme přímo neporovnávali senzitivitu stanovení močového survivinu a cytologického vyšetření moči, námi zjištěná senzitivita testu je vyšší než běžně uváděná senzitivita cytologického vyšetření moči. V roce 2006 byly publikovány výsledky českých autorů, kteří chtěli hodnotit močovou hladinu survivinu u pacientů s karcinomem močového měchýře. Projekt však byl ukončen proto, že ani u jednoho pacienta nezjistili měřitelnou hladinu survivinu (12).
Dle našich výsledků hladina močového survivinu nejvíce korelovala se stupněm nádorové invaze, diferenciace a s celkovou velikostí nádoru. Toto zjištění odpovídá i výsledkům prezentovaným ostatními autory (10, 11). Rozdíl mezi střední hladinou survivinu v moči u pacientů se solitárními tumory nebyl signifikantně rozdílný oproti pacientům s mnohočetným postižením (p = 0,26). Také rozdíl mezi skupinou s primozáchytem oproti recidivujícímu onemocnění nebyl statisticky významný (p = 0,0751).
Zatím mezi různými autory neexistuje shoda na ideální hraniční hodnotě močového survivinu. V naší studii byla hraniční hodnota (cut-off) při 90%, resp. 95% specificitě a 45%, resp. 42% senzitivitě vypočtena 33,9 pg/ml, resp. 39,2 pg/ml.
Vzhledem k relativně malému množství publikací o využití močového survivinu v diagnostice karcinomů močového měchýře a nesourodým výsledkům těchto studií bude v budoucnu nutné provést rozsáhlejší studie při jednotné metodice ke zjištění významu tohoto testu pro detekci uroteliálních karcinomů močového měchýře.
Závěr
Naše výsledky demonstrují signifikantní rozdíl mezi střední hodnotou survivinu v moči u pacientů s tumorem močového měchýře oproti skupině pacientů s benigním urologickým onemocněním. Hladina survivinu v moči u pacientů s nádorem močového měchýře korelovala se stupněm nádorové invaze a diferenciace, stejně tak jako s velikostí nádoru. Přestože celková senzitivita testu byla relativně nízká, stanovení hladiny survivinu v moči může být použito pro předpověď přítomnosti invazivní formy onemocnění a nízké diferenciace tumorů.
Došlo: 26. 10. 2009
Přijato: 28. 1. 2010
Kontaktní adresa
MUDr. Michael Pešl, FEBU
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6,
128 08 Praha 2
e-mail: pesl_m@hotmail.com
Práce byla podpořena granty IGA MZ NC 8095-3, VZ MSM 0021620808, IGA MZ č. 8934-3/2006 a IGA NR 8934-3.
Sources
1. Monzo M, Rosell R, Felip E, et al. A novel antiapoptotis gene: Re-expression of survivin messenger RNA as a prognosis marker in non-small-cell lung cancers. J Clin Oncol 1999; 17 : 2100–2104.
2. Tanaka K, Iwamoto S, Gon, G, Nohara T, Iwamoto M, Tanigawa N. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas. Clin Cancer Res 2000; 6 : 127–134.
3. Kato J, Kuwabara Y, Mitani M, et al. Expression of survivin in oesophageal cancer: corelation with the prognosis and response to chemotherapy. Int J Cancer 2001; 95 : 92–95.
4. Shariat SF, Ashfaq R, Karakiewicz PI, Saeedi O, Sagalowsky AI, Lotan Y. Survivin expression is associated with bladder cancer presence, stage, progression, and mortality. Cancer 2007; 109 : 1106–1013.
5. Karam JA, Lotan Y, Ashfaq R, Sagalowsky AI, Shariat SF. Survivin expression in patients with non-muscle-invasive urothelial cell carcinoma of the bladder. Urology 2007; 70 : 482–486.
6. Smith SD, Wheeler MA, Plescia J, Colberg JW, Weiss RM, Altieri DC. Urine detection of survivin and diagnosis of bladder cancer. JAMA 2001; 285 : 324–328.
7. Xiao ZJ, Zheng S, Chen W, Zhang HF, Li CL, Gao YN. Expression of Survivin in transitional cell carcinoma of urinary bladder and its clinical significance. Zhonghua Yi Xue Za Zhi 2004 84 : 1977–1979.
8. Ku JH, Kwak C, Lee HS, Park HK, Lee E, Lee SE. Expression of survivin, a novel inhibitor of apoptosis, in superficial transitional cell carcinoma of the bladder. J Urol 2004; 171 : 631–635.
9. Schultz IJ, Kiemeney LA, Witjes JA, Schalken JA, Willems JL, Swinkels DW, de Kok JB. Survivin mRNA expression is elevated in malignant urothelial cell carcinomas and predicts time to recurrence. Anticancer Res 2003; 23 : 3327–3331.
10. Shariat SF, Casella R, Khoddami SM, et al. Urine detection of survivin is a sensitive marker for the noninvasive diagnosis of bladder cancer. J Urol 2004; 171 : 626–630.
11. Ziaee SA, Moula SJ, Hosseini Moghaddam SM, Eskandar-Shiri D. Diagnosis of bladder cancer by urine survivin, an inhibitor of apoptosis: a preliminary report. Urol J 2006; 3 : 150–153.
12. Stejskal D, Fiala R. Stanovení koncentrace survivinu a livinu v séru či moči a efektivní diagnostika karcinomu močového měchýře. Klin Biochem Metabol 2006; 14 : 232–235.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2010 Issue 2-
All articles in this issue
- Fyzikální základy extrakorporální litotrypse
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
- Význam stanovení survivinu v moči pro neinvazivní diagnostiku uroteliálních karcinomů močového měchýře
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Méně časté příčiny dysurie u žen
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Méně časté příčiny dysurie u žen
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

