-
Medical journals
- Career
Ťažká kombinovaná imunodeficiencia v súbore pacientov liečených v Národnom ústave detských chorôb
Authors: V. Urdová 1; J. Horáková 1; P. Švec 1; I. Boďová 1; S. Šufliarska 1; M. Makohusová 1; D. Dóczyová 1; M. Pozdechová 1; A. Kolenova 1; M. Jeseňák 3; A. Šoltýsová 4; A. Ficek 4; Z. Tkáčová Tomečková 4; P. Čižnár 2
Authors‘ workplace: Transplantačná jednotka kostnej drene Kliniky detskej hematológie a onkológie, NÚDCH, Bratislava, Slovensko 1; Detská klinika NÚDCH a LF Univerzity Komenského, Bratislava, Slovensko 2; Centrum pre vrodené poruchy imunity, Klinika detí a dorastu, Jesseniova lekárska fakulty v Martine, Univerzita Komenského, v Bratislave, Univerzitná nemocnica Martin, Slovensko 3; Katedra molekulárnej biológie Prírodovedeckej fakulty UK, Bratislava, Slovensko 4
Published in: Čes-slov Pediat 2021; 76 (4): 184-193.
Category:
Overview
Ťažká kombinovaná imunodeficiencia (Severe combined immunodeficiency – SCID) je život ohrozujúce ochorenie, ktoré je charakterizované poruchou bunkovej a humorálnej imunity. Je jednou z najzávažnejších ochorení v skupine primárnych imunodeficiencií. V dôsledku závažnej infekcie môže viesť k úmrtiu už v skorom dojčenskom období.
Cieľ štúdie: Cieľom práce bolo analyzovanie jednotlivých charakteristík v skupine pacientov so SCID na Slovensku a vyhodnotenie výsledkov liečby transplantáciou krvotvorných buniek za účelom zmapovania celkového stavu diagnostiky, terapie a prognózy pacientov s diagnózou SCID.
Metódy: Retrospektívne bol hodnotený súbor pacientov s ťažkou kombinovanou imunodeficienciou. Za obdobie 15 rokov (2003–2017) bolo celkovo liečených v Národnom ústave detských chorôb (NÚDCH) 16 detí s diagnózou SCID. Z toho 11 podstúpilo alogénnu transplantáciu krvotvorných buniek (TKB) na Transplantačnej jednotke kostnej drene NÚDCH v Bratislave.
Výsledky: Pravdepodobnosť 2-ročného celkového prežívania bola v celom súbore pacientov SCID 68,8 %. V súbore 16 detí bol genetický defekt potvrdený u 13 pacientov s najčastejšou mutáciou v géne IL2RG. Medián veku stanovania diagnózy SCID bol 122 dní, s čím je asociovaný aj vyšší výskyt infekčných komplikácií. U 73 % pacientov bola potvrdená infekcia pred TKB. V súbore sme zaznamenali 4 úmrtia v dôsledku infekcie pred TKB. Analýza suchej kvapky krvi, získaná eluáciou skríningovej karty, potvrdila retrospektívne nízke hodnoty TREC u 100 % pacientov. Pravdepodobnosť 2-ročného celkového prežívania v skupine pacientov SCID po TKB bola 90,9 %.
Záver: Včasné stanovenie diagnózy SCID, pred objavením sa infekčných komplikácií, zvyšuje šance pripraviť pacienta bezpečne k transplantácii krvotvorných buniek. Diagnostika TREC v našom súbore potvrdila výbornú senzitivitu a špecificitu metodiky a jej implementácia do novorodeneckého skríningu podľa vzoru mnohých krajín vo svete by bola prínosom pre zlepšenie morbidity a mortality pacientov s diagnózou SCID. Do jej zavedenia je nevyhnutné zefektívnenie skorej diagnostiky na základe charakteristických klinických príznakov a následné centralizovanie pacientov do centier so skúsenosťami s liečbou SCID pacientov.
Klíčová slova:
ťažká kombinovaná imunodeficiencia – transplantácia krvotvorných buniek – TREC – skorá diagnostika – prežívanie
ÚVOD
Vrodené poruchy imunity predstavujú dynamicky sa rozvíjajúcu oblasť medicíny z pohľadu diagnostiky aj terapie. V ľudskom genóme je identifikovaných viac ako 22 000 génov, pričom doteraz bolo opísaných viac ako 400 génov podieľajúcich sa na vzniku PID [1]. Jednou z najzávažnejších foriem primárnej imunodeficiencie je ťažká kombinovaná imunodeficiencia (SCID). Syndróm ťažkej kombinovanej imunodeficiencie je heterogénna skupina ochorení charakterizovaná poruchou vývoja a funkcie imunitného systému. Bez ohľadu na charakter genetického defektu, u všetkých pacientov je prítomná porucha vývoja, maturácie alebo funkcie T lymfocytov. Populačný skríning potvrdil takmer dvojnásobne vyššiu incidenciu, ako sa pôvodne predpokladalo. Na základe štúdie, kde boli zhrnuté výsledky z 11 skríningových programov v Spojených štátoch, bola zistená incidencia 1 : 58 000. Do obdobia zavedenia skríningu bola predpokladaná incidiencia 1 : 100 000 [2].
Klasická forma SCID bez skorej intervencie končí fatálne v prvých rokoch života v dôsledku infekcií. Deti s týmito poruchami sa po narodení javia ako zdraví novorodenci. Priemerný vek stanovenia diagnózy u pacientov so SCID je 4. mesiac života.
Do typického klinického obrazu patrí chronická perzistujúca hnačka, neprospievanie, orálna kandidóza, dermatitída a komplikované respiračné recidivujúce infekcie (otitídy, pneumónie a i.). Etiologické agens infekčných komplikácií býva rôznorodé. Charakteristickou a závažnou komplikáciou je infekcia Pneumocystis jirovecii, jej potvrdenie je významným klinickým markerom. Najčastejšie sa vyskytujúcim typom SCID je X-viazaná forma, kde dochádza k mutácii v géne kódujúcom gamma reťazec receptora interleukínu 2 (IL2RG), ktorý tvorí asi 50–60 %. Všetky ostatné formy SCID majú autozómovo recesívnu dedičnosť. Medzi často identifikované genetické defekty patrí gén receptora alfa interleukínu 7 (IL7RA), Janus kinázy 3 (JAK3), Artemis (DCLRE1C), adenozín deaminázy (ADA), deficit rekombinázy aktivujúcej gény 1 (RAG1) a deficit rekombinázy aktivujúcej gény 2 (RAG2). V prospektívnej štúdií, kde bolo analyzovaných 100 pacientov so SCID liečených TKB, bol genetický defekt potvrdený v 87 % prípadov a identifikovalo sa 12 rôznych génov [3].
Novšiu skupinu SCID tvoria tzv. atypické formy. Hypomorfné mutácie vedú k parciálnej poruche T bunkového vývoja a spôsobujú tzv. leaky SCID, ktoré sú charakteristické oneskoreným nástupom závažných infekcií a autoimunitnými fenoménami. Príkladom špecifickej formy sú pacienti s Omennovým syndrómom, ktorí laboratórne spĺňajú kritériá leaky SCID [4]. Omennov syndróm je autozómovo recesívne ochorenie, vo väčšine prípadov spôsobené mutáciou v génoch RAG1 alebo RAG2. Počet lymfocytov v krvnom obraze tu môže byť znížený, normálny alebo aj zvýšený, počet B lymfocytov je variabilný, najčastejšie nízky, prítomná je oligoklonálna expanzia autoreaktívnych T lymfocytov. V klinickom obraze je prítomná erytrodermia, hepatosplenomegália a lymfadenopatia či hypertrofia sekundárnych lymfatických tkanív (ktorá pri iných formách SCID naopak absentuje) [5].
Celkovým problémom u pacientov s diagnózou SCID je asymptomatické obdobie v prvých mesiacoch po narodení, pacienti sú najčastejšie diagnostikovaní až na základe oportúnnej infekcie. Zároveň u viac ako 80 % SCID prípadov chýba pozitívna rodinná anamnéza. Toto ochorenie je vhodným kandidátom na vyšetrovanie v rámci novorodeneckého skríningu. V roku 2005 Kee Chan a Jennifer Puck prvýkrát preukázali, že absencia epizómov receptora T lymfocytov TREC izolovaných zo suchej kvapky krvi novorodencov umožňuje identifikáciu SCID pacientov. TREC (T cell receptor excision circles) sú stabilné, nereplikujúce sa DNA krúžky vznikajúce počas procesu rekombinácie alfa reťazca T bunkového receptora v týmuse. Konkrétne δRec-φJα TREC vzniká v neskorej fáze maturácie u 70 % vyvíjajúcich sa TCRαβ T buniek [6]. Zvláštnosťou rekombinácie alfa reťazca TCR je excízia D kódujúceho segmentu, ktorý je umiestnený v rámci TCA lokusu medzi génmi TRAV a TRAJ (obr. 1). Vystrihnuté epizomálne DNA segmenty sa cirkularizujú ligáciou ich signálnych koncov, čím dochádza k tvorbe excíznych krúžkov TCR (TREC) [7]. Na diagnostiku TREC sa využíva buď plná krv v EDTA alebo suchá kvapka krvi nanesená na filtračný papier Guthrieho kartičky, ktorá sa štandardne využíva v rámci novorodeneckého skríningu.
Image 1. TREC vznikajú počas procesu V(D)J rekombinácie génu pre alfa reťazec T bunkového receptora (upravené podľa Somech & Etzioni, 2014).
Fig. 1. TRECs are formed during the V(D)J recombination process of the T cell receptor alpha chain gene (adjusted from Somech & Etzioni, 2014).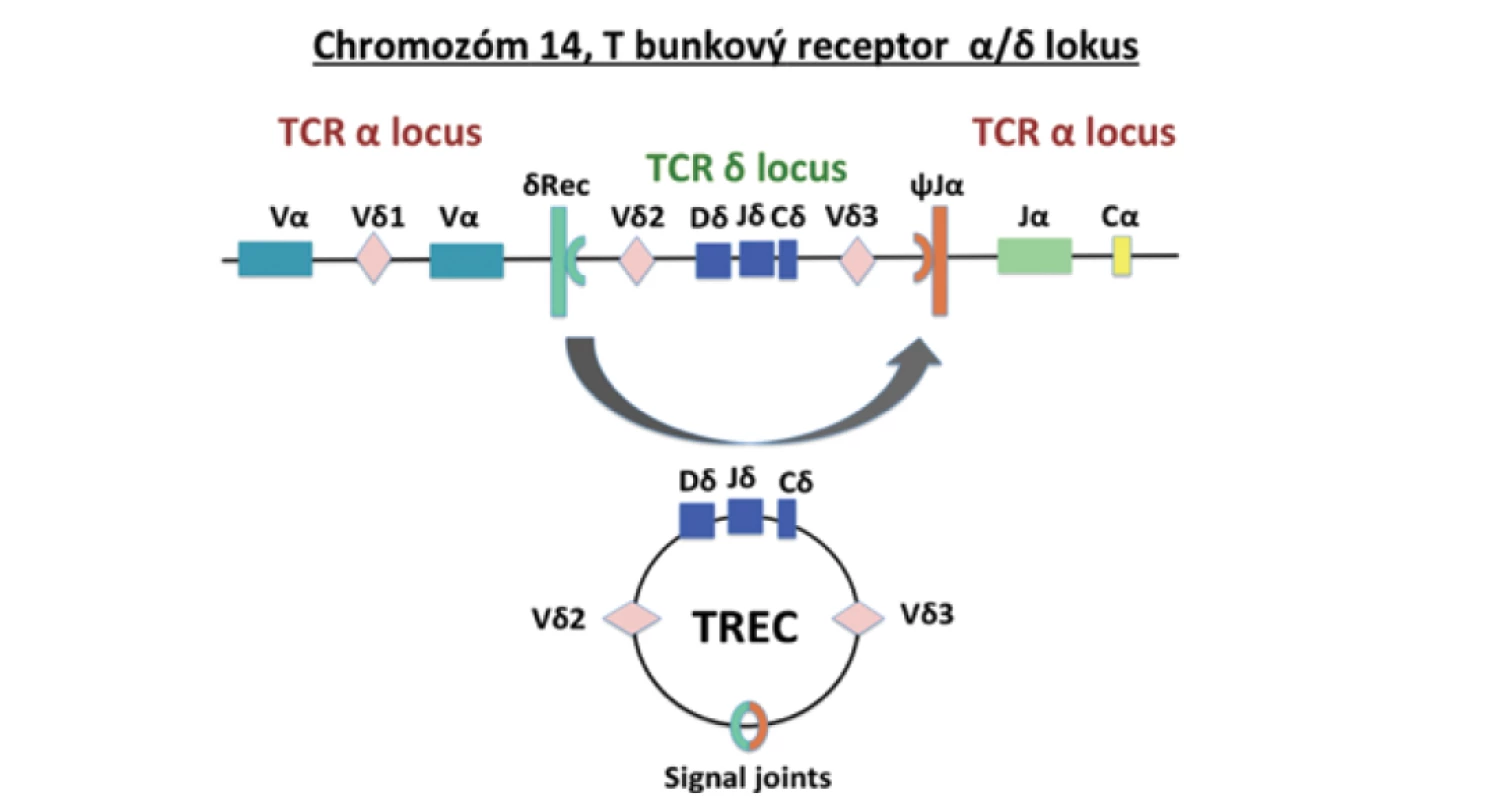
Toto vyšetrenie bolo implementované do novorodeneckého skríningu vo všetkých štátoch USA, pričom 100 % amerických novorodencov je skrínovaných. Dosiaľ zaviedli celoplošný skríning SCID tiež Nórsko, Dánsko, Nemecko, Island, Holandsko, Švédsko, Švajčiarsko, Katalánsko v Španielsku, Taiwan, Singapur, Brazília, Izrael, Libanon, Nový Zéland, v ďalších krajinách prebiehajú pilotné programy a/alebo skríning vo vybraných oblastiach [8]. Pri zavedenom screeningu je výsledok nízkeho počtu kópií TREC nasledovaný vyšetrením prietokovou cytometriou a definitívna diagnóza je stanovená pomocou genetických vyšetrení s identifikovaním kauzálneho variantu mutácie. Implementácia tohto ochorenia do slovenského skríningového programu zatiaľ nebola realizovaná, preto je nevyhnutná edukácia pediatrov prvého kontaktu o tejto diagnóze, aby bolo možné čo najskôr zabezpečiť adekvátne preventívne a liečebné procesy.
Hlavnou liečebnou modalitou SCID je transplantácia krvotvorných buniek, ktorá za posledné dekády zaznamenala významné pokroky a stala sa bezpečnejšou kuratívnou metódou. Bez TKB končí toto ochorenie infaustne. Potvrdilo sa, že pacienti transplantovaní pred dovŕšením 3,5 mesiaca života mali štatisticky menej infekcií (66 %) v porovnaní s pacientami transplantovanými po 3,5 mesiaci života (46 %, p < 0,001) [9]. V otázke výberu darcu je prvou voľbou vo väčšine centier zhodný rodinný darca, najčastejšie súrodenec (matched sibling donor – MSD). HLA identického súrodeneckého darcu má len 25–30 % pacientov [10]. Väčšinou je potrebné vyhľadať alternatívneho nepríbuzného darcu (matched unrelated donor – MUD), prípadne je možné použiť haploidentického darca (mismatched related donor – MMRD) alebo nepríbuznú pupočníkovú krv (umbilical cord blood – UCB).
V posledných rokoch sa v skupine vrodených ochorení dostáva stále viac do popredia génová terapia. Génová terapia je molekulárna terapeutická metóda, ktorej hlavným princípom je úprava defektného génu a následné vloženie opravenej kópie génu do somatických buniek jedinca za účelom vyliečenia alebo zmiernenia ochorenia [11]. V prípade diagnózy SCID je registrovaná génová terapia u podtypu ADA SCID. U X SCID a Artemis SCID prebiehajú klinické štúdie. V pláne je klinická štúdia u RAG1 SCID (informácia z konferencie IEWP EBMT 2019).
Cieľom našej práce bolo zmapovanie súčasného stavu diagnostiky a liečby SCID na Slovensku za účelom identifikovania možností na eventuálne zlepšenie v budúcnosti. Zároveň sme porovnávali náš súbor pacientov s publikovaným dátami. Považujeme za nevyhnutné vyzdvihnúť raritnosť týchto ochorení, preto komunikácia a koordinácia pri ceste pacienta zdravotným systémom má veľmi podstatnú úlohu. V prípade podozrenia na diagnózu SCID je potrebné informovať existujúce Centrá pre primárne imunodeficiencie (Bratislava, Martin, Košice), ktoré indikujú včasné a správne intervencie a preberajú komunikáciu s jediným transplantačným centrom krvotvorných buniek na Slovensku (TJKD NÚDCH Bratislava) v otázke iniciácie procesu organizácie TKB.
SÚBOR PACIENTOV A METÓDY
Hodnotili sme súbor 16 pacientov, ktorí boli diagnostikovaní a liečení v NÚDCH v Bratislave alebo iniciálne diagnostikovaní v mieste bydliska či PID centre a následne preložení do NÚDCH za účelom ďalšej diagnostiky a liečby od 1. 1. 2003 do 31. 12. 2017.
Prvý pacient s diagnózou SCID bol na Slovensku diagnostikovaný v roku 2003. Alogénnu TKB na Transplantačnej jednotke kostnej drene (TJKD) NÚDCH v Bratislave podstúpilo 11 pacientov. Medián engrafmentu neutrofilov sme hodnotili ako prvý deň po TKB v troch na seba nadväzujúcich dňoch, kde hodnota ANC bola viac ako 0,5 x 109/l . Klinické údaje sme získali zo zdravotnej dokumentácie pacientov.
Štatistická analýza pozostávala z deskriptívnej charakteristiky súboru a samotnej štatistickej analýze predchádzala prieskumová analýza dát. Analýzou prežívania (Kaplanova-Maierova analýza) sme hodnotli celkové prežívanie pacientov [12]. Rozdiely medzi prežívaniami v dvoch porovnávaných skupinách boli hodnotené Log-Rankovým testom [13]. Jednotlivé analýzy boli vykonané softvérovým balíkom IBM SPSS Statistics 19.0 [14].
VÝSLEDKY
Celý sledovaný súbor pozostával zo 16 detí – 5 dievčat (31 %) a 11 chlapcov (69 %). Za jeden kalendárny rok sa narodili 1–3 pacienti s diagnózou SCID (graf 1). V súbore boli 3 páry súrodencov. Jedenásť pacientov (69 %) podstúpilo transplantáciu krvotvorných buniek. V súbore exitovalo celkovo 5 pacientov (31 %), pričom 4 pacienti zomreli pred TKB v dôsledku infekcie, jedna pacientka v dôsledku komplikácií TKB.
Graph 1. Frekvencia prípadov diagnózy SCID na Slovensku za obdobie 15 rokov. 
Najviac zastúpenou skupinou v súbore pacientov bol X viazaný SCID s mutáciou v géne IL2RG, ktorý bol molekulárnou genetikou potvrdený u 5 pacientov (31 %), z toho boli 2 páry súrodencov – chlapcov. Zo 16 pacientov 4 (25 %) mali diagnostikovanú mutáciu génu ADA. Do tejto skupiny patrí 1 pár súrodencov – dievčat. Mutáciu génu RAG1 mali v pozorovanej skupine 2 pacienti (13 %). U 3 pacientov (19 %) nebola zistená konkrétna genetická mutácia, diagnóza bola stanovená na základe klinických a laboratórnych nálezov. U jedného pacienta bola v neskoršom veku potvrdená zriedkavá mutácia FOXN1, kde na základe patogenézy ochorenia je preferovaná transplantácia týmusu pred transplantáciou krvotvorných buniek (ktorá bola následne realizovaná v nemocnici GOSH v Londýne v roku 2019). Do súboru bol zaradený aj pacient s kompletným DiGeorgovým syndrómom, kde v dôsledku poruchy vývoja týmusu dochádza k rozvoju imunodeficitu (tab. 1). Kompletná forma tohto syndrómu má charakter ťažkej kombinovanej imunodeficiencie (SCID). Vo februári 2019 podstúpila na oddelení TJKD transplantáciu kostnej drene ešte jedna pacientka s Omennovým syndrómom, ktorá ale vzhľadom na dátumové vymedzenie súboru do analýzy už nebola zaradená.
Práve počiatočné asymptomatické obdobie je jedným z dôvodov neskorej diagnostiky u detí postihnutých ťažkým imunodeficitom. Diagnóza bola v našom súbore stanovená na základe rodinnej anamnézy len u 3 pacientov (19 %). V sledovanom súbore bol medián veku stanovenia diagnózy SCID 122 dní (rozsah 3–336 dní). U pacientov s pozitívnou rodinnou anamnézou (potvrdené ochorenie SCID u staršieho súrodenca) bola diagnóza stanovená už v prvom týždni života. Jeden pacient bol diagnostikovaný až vo veku 8 rokov po liečbe Burkittovho lymfómu a manifestácii autoimunitných fenoménov (pacient č. 16 – mutácia FOXN1). Medián obdobia od stanovenia diagnózy po začatie liečby (deň TKB) bol v súbore pacientov 74 dní (rozsah 51–1534 dní).
Hodnotili sme charakter klinických prejavov, na základe ktorých bola stanovená diagnóza SCID. Medzi najčastejšie klinické prejavy patrili neprospievanie (44 %), hnačky (44 %) a recidivujúce respiračné infekcie (31 %). Jedným z dominantných príznakov bola pneumónia (44 %), ktorá zásadne ovplyvnila klinický priebeh ochorenia detí. V skupine s prekonanou pneumóniou sme potvrdili horšie celkové prežívanie (OS 42,9 %), v skupine bez potvrdenej pneumónie to bolo 88,5 % (p = 0,033).
Do 31. 12. 2011 sa v rámci celoplošného vakcinačného programu aplikovala všetkým novorodencom živá BCG vakcína, čo významne ovplyvnilo klinický priebeh u pacientov pre komplikácie spojené s BCG-itídou. V krajinách, kde sa vykonáva BCG vakcinácia novorodencov, je závažná BCG-itída často prvou infekciou, ktorou sa SCID manifestuje. Najzávažnejšia komplikácia BCG vakcinácie – diseminovaná BCG-itída, ktorá postihuje najmä deti s vrodenou imunodeficienciou, nie je častá, má však vysokú, až 80% mortalitu [15]. Prejavy diseminovanej BCG infekcie sa v našej skupine objavili celkovo u 19 % detí (obr. 2). Porovnávali sme dĺžku hospitalizácie u pacientov, u ktorých stav ovplyvnila BCG infekcia, so skupinou bez spomenutej komplikácie. U pacientov s BCG infekciou bol medián počtu dní hospitalizácie významne vyšší (99 dní vs 43 dní; p = 0,03) (graf 2).
Image 2. Prejavy BCG-itídy u pacienta so SCID s nepotvrdenou mutáciou (pacient č. 4).
Fig. 2. Manifestations of BCG in SCID patient with an unconfirmed mutation (patient 4).
Graph 2. Porovnanie počtu dní hospitalizácie v skupinách BCG+/BCG 
V rámci imunodysregulácie pri potvrdenom imunodeficite sa autoimunitné fenomény objavili u 13 % pacientov (pacienti s ADA-SCID a FOXN1-SCID). Bola potvrdená celiakia, autoimunitná cytopénia a tyreoiditída. Dermatitída sa vyskytla u dvoch pacientov, z toho 1 pacient mal potvrdený Omennov syndróm, kde práve dermatitída je jedným z charakteristických klinických prejavov (obr. 3).
Image 3. Erytrodermia u pacienta s Omennovým syndrómom (pacient č. 12).
Fig. 3. Erythroderma in patient with Omenn syndrome (patient 12).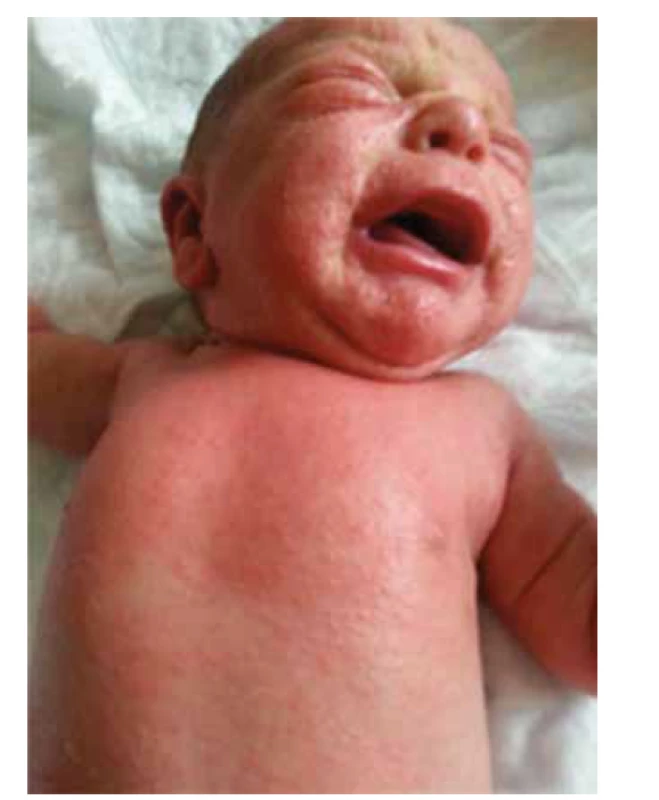
V analýze laboratórnych výsledkov iniciálneho vyšetrenia pacientov bola leukopénia prítomná len u 27 % pacientov. Spracovaním výsledkov laboratórnych vyšetrení sme zistili, že z počtu 15 hodnotených pacientov malo 73 % pacientov znížené absolútne hodnoty lymfocytov (pre chýbanie údajov sme do hodnotenia nezahrnuli jedného pacienta). Diferenciálny leukogram preto nie je považovaný za adekvátnu a dostatočne senzitívnu skríningovú a diagnostickú metódu.
Na Slovensku nie je ochorenie SCID zaradené do novorodeneckého skríningového programu, preto sme vyšetrenie TREC u pacientov realizovali buď retrospektívne, alebo v prípade pozitívnej rodinnej anamnézy ihneď po narodení, alebo prospektívne v prípade podozrenia na diagnózu SCID nám metóda TREC uľahčila diagnostický proces do obdržania genetických výsledkov. V prípade analýzy TREC sme spolupracovali so zahraničnými pracoviskami a s Prírodovedeckou fakultou Univerzity Komenského v Bratislave. Analýza bola vykonaná u 11 pacientov retrospektívne, po genetickom stanovení diagnózy. U 5 pacientov bol test vykonaný ešte pred realizáciou genetického vyšetrenia. Analýza potvrdila nízke až nedetekovateľné hladiny epizómov TREC u 100 % pacientov so SCID (tab. 1). U všetkých pacientov sme zároveň vyžiadali Guthrieho kartu zo Skríningového centra novorodencov v Banskej Bystrici a následne analyzovali počty kópií TREC. Rovnako sme potvrdili nízke až nedetekovateľné hladiny epizómov TREC u 100 % pacientov. Pravdepodobnosť 2-ročného prežívania pacientov v celom súbore SCID bola 68,8 % (graf 3).
Table 1. Charakteristika pacientov so SCID. 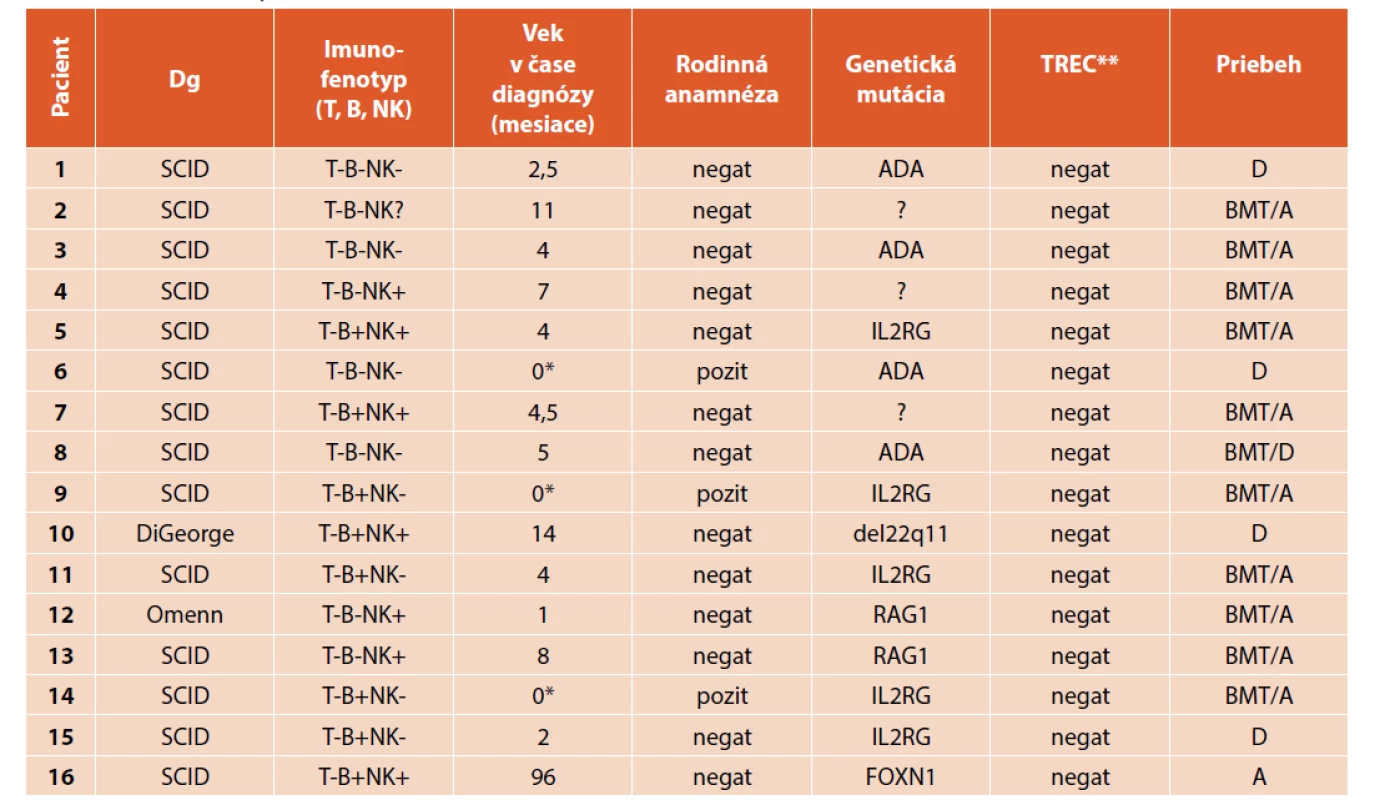
Poznámky: Dg – diagnóza, negat -, pozit + BMT bone marrow transplantation (pacient po TKB), A alive (pacient žije), D died (pacient zomrel); * pacienti diagnostikovaní v 1. týždni života na základe rodinnej anamnézy, t.j. vek < 1 mesiac, ** v prípade hodnoty TREC negatívna hodnota znamená nízke až nedetekovateľné hodnoty TREC kópií Graph 3. Kaplanova-Maierova krivka celkového prežívania v celom súbore pacientov so SCID na Slovensku. 
SE – štandardná odchýlka (z angl. standard error), OS – celkové prežívanie TRANSPLANTÁCIA KRVOTVORNÝCH BUNIEK
Z celkového súboru 16 pacientov podstúpilo TKB 11 pacientov (69 %). Všetci pacienti, ktorí neboli liečení TKB, exitovali v dôsledku infekcie. Jedinou výnimkou bol pacient s atypickou formou SCID (s mutáciou FOXN1), ktorému bola indikovaná transplantácia týmusu.
Pravdepodobnosť celkového 2-ročného prežívania pacientov v našom súbore pacientov SCID s TKB bola 90,9 % (graf 4) s mediánom sledovania pacientov 59,9 mesiaca. Medián veku v čase TKB bol 217 dní (rozsah 69–1870). Vyšší vek v čase TKB bol ovplyvnený hlavne neskorším vekom diagnózy. Infekcia pred TKB sa v našom súbore vyskytla v 73 % prípadoch. 45 % pacientov vstupovalo do procesu TKB s aktívnou infekciou, ktorá sa považuje za nepriaznivý prognostický faktor.
Graph 4. Kaplanova-Maierova krivka pravdepodobosti celkového prežívania v skupine pacientov so SCID s TKB na Slovensku. 
SE – štandardná odchýlka (z angl. standard error), OS – celkové prežívanie Súrodeneckého darcu (MSD) malo v súbore 5 pacientov (45 %). Zo skupiny pacientov s nepríbuzenským darcom (MUD) bola prítomná HLA zhoda 9–10/10 u 5 pacientov (45 %), 1 pacient mal nepríbuzenského darcu s HLA zhodou 8/10. U tohto pacienta sa po TKB rozvinula extenzívna chronická GvHD (kožná a črevná forma). Ako profylaxia GvHD bol použitý cyklosporín A (CS-A) v 9 prípadoch (82 %) od dňa D-1 pred TKB, v 2 prípadoch v kombinácii s mykofenolát mofetilom (MMF) (18 %). V prípade nepríbuzenských transplantácií bol pridaný nízkodávkovaný metotrexát na D +1, +3, +6. Pre zníženie rizika GvHD bola pred TKB pridaná séroterapia, v 4 prípadoch (36 %) antitymocytárny globulín (ATG), alemtuzumab (monoklonálna anti-CD52 protilátka) v 3 prípadoch (27 %).
Vzhľadom na exitus u jedného pacienta sme GvHD hodnotili v skupine 10 pacientov. Akútna GvHD sa rozvinula u 5 pacientov (45 %), pričom u všetkých týchto pacientov išlo o nezávažné formy akútnej GvHD stupňa I–II s dobrou odpoveďou na kortikoidnú terapiu. Ako zdroj krvotvorných buniek pre TKB dominovala v súbore kostná dreň (n = 7, 64 %) a periférne krvotvorné bunky boli použité u 4 pacientov (36 %). Pupočníková krv v prípade diagnózy SCID na Slovensku nebola použitá.
Najčastejším prípravným režimom bol redukovaný prípravný režim (RIC) (treosulfan a fludarabin u 7 pacientov, melfalan a fludarabin u 1 pacienta), použitý u 73 % pacientov. Do popredia v liečbe SCID sa dostávajú aj TKB bez použitia prípravného režimu. Je avšak dôležité prehodnotenie, ktorá konkrétna forma SCID by z tejto možnosti mohla profitovať. Najlepšie výsledky boli popísané v prípade TKB bez prípravného režimu u príbuzenských TKB, najmä v prípade ADA-SCID. U T-B+ imunofenotypoch (konkrétne IL2RG, JAK3 a IL-7) bol popísaný vyhovujúci T bunkový engrafment, avšak s variabilnou obnovou humorálnej imunity. V prípade porúch VDJ rekombinácie vrátanie mutácie RAG1/2 bolo prihojenie aj u MSD TKB bez prípravného režimu suboptimálne a zatiaľ nie je odporúčané [16]. Medián engrafmentu neutrofilov bol v sledovanom súbore 12,5 dňa (rozsah 12–21dní). Vírusové infekcie po TKB sa vyskytli u 2 pacientov (18 %), u oboch týchto pacientov sa jednalo o EBV reaktiváciu. Pokles EBV kopií bol dosiahnutý redukovaním imunosupresívnej liečby, ani v jednom prípade nebola indikovaná biologická liečba rituximabom.
DISKUSIA
SCID je heterogénnou skupinou genetických ochorení charakterizovaná vážnym poškodením vývoja a funkcie imunitného systému. Bez intervencie klasické formy SCID končia fatálne najčastejšie už v priebehu 1. roku života. Liečebnými možnosťami u týchto pacientov sú transplantácia krvotvorných buniek (TKB), enzýmová a génová terapia. Enzýmová terapia v prípade ADA – SCID je tzv. premosťujúcou liečbou do obdobia TKB alebo génovej terapie. Génová terapia je zatiaľ indikovaná len v prípade nedostupnosti TKB. TKB ostáva hlavnou kauzálnou liečebnou modalitou pre pacientov so SCID. Jediným centrom pre TKB u detských pacientov na Slovensku je Transplantačná jednotka kostnej drene NÚDCH v Bratislave. Pravdepodobnosť dvojročného celkového prežívania v súbore TKB pacientov bola 90,9 %, čo pri porovnaní s medzinárodnými centrami poukazuje na veľmi dobré výsledky (tab. 2).
Table 2. Medzinárodná skúsenosť – porovnanie našich výsledkov s publikovanými údajmi. 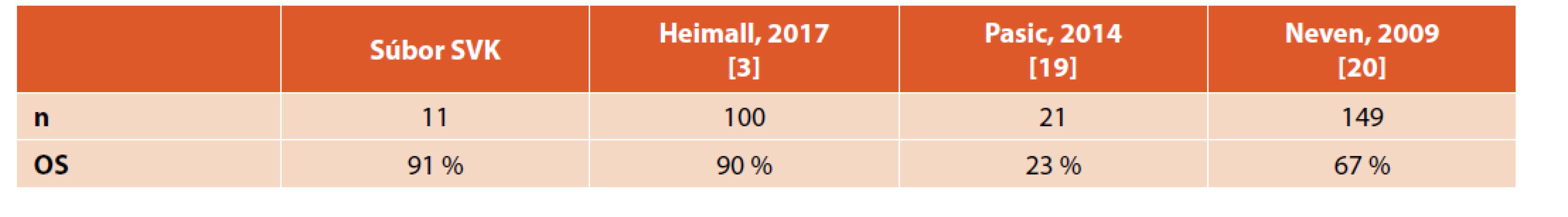
V slovenskom súbore pacientov bola zistená aj zriedkavá mutácia génu FOXN1, ktorá bola podľa publikácie Rota a kol. z roku 2017 potvrdená na svete len u 9 pacientov [17]. Veľmi dôležitým laboratórnym výsledkom v našom súbore boli nízke až nedetekovateľné hodnoty TREC kópií u 100 % pacientov nie len v čase stanovenia diagnózy, ale aj zo vzorky z novorodeneckého skríningu. Dostupnosť tohto vyšetrenia na Slovensku je významným krokom v diagnostike pacientov SCID. Implementovanie tohto vyšetrenia do slovenského novorodeneckého skríningového programu je veľkou výzvou do budúcnosti.
Zvyšovanie povedomia o diagnóze SCID a charaktere klinických príznakov by aj v našej krajine mohlo zabezpečiť skorší záchyt diagnózy. V sledovanom súbore bol medián veku stanovenia diagnózy SCID 122 dní (rozsah 3–336 dní) a medián obdobia od stanovenia diagnózy po začatie liečby (deň TKB) bol 74 dní (rozsah 51–1534 dní). V porovnaní so štúdiou PIDTC 6901, v ktorej analyzovali po zavedení novorodeneckého skríningu (NBS) 100 liečených detí so SCID v 25 centrách v Spojených štátoch, bol medián veku stanovenia diagnózy v skupine klasických SCID pacientov 27 dní (z toho 59 % pacientov diagnostikovaných na základe NBS alebo rodinnej anamnézy). Výsledky poukazujú na vyšší vek pacientov v čase stanovenia diagnózy v súbore, ktorý súvisí aj s chýbaním novorodeneckého skríningu v našej krajine, ale i pravdepodobne s menšími skúsenosťami s touto diagnózou u pediatrov. Pri incidencii 1 prípadu na 30–50 tisíc živonarodených detí a malej početnosti rodinných príslušníkov, ako je tomu vo väčšine vyspelých štátov, je pravdepodobnosť predvídania poruchy na základe rodinnej anamnézy veľmi nízka, a to napriek tomu, že takmer polovica prípadov sa dedí spôsobom viazaným na chromozóm X [18].
Významným problémom ostáva výskyt infekcií u SCID pred TKB. V našom súbore 73 % pacientov prekonalo infekciu pred TKB. V porovnaní so štúdiou autorov Heimall et al. bol výskyt infekcie v skupine pacientov diagnostikovaných na základe NBS/RA 42 %, avšak u skupiny diagnostikovanej na základe klinických príznakov bol výskyt infekcie tiež vysoký (92 %) [3].
V otázke celkovej morbidity a mortality hrajú významnú úlohu opatrenia obmedzujúce mikróbnu expozíciu bakteriálneho, vírusového a fungálneho pôvodu od včasného obdobia veku, podľa zavedených štandardných postupov. Zavedené štandardy sa odlišujú v jednotlivých krajinách so zavedeným skríningovým programom. Pre naliehavosť a zachovanie jednotlivých diagnostických a terapeutických postupov v prípade podozrenia na SCID preto odporúčame urgentne kontaktovať jedno z troch existujúcich PID centier (Bratislava, Martin, Košice).
ZÁVER
V prípade diagnózy SCID hrá čas významnú úlohu, preto sa táto diagnóza v literatúre zaraďuje medzi pediatrickú emergenciu. Pre zlepšenie prežívania týchto pacientov považujeme za potrebné zvyšovanie povedomia o tejto diagnóze, aby sa zabezpečil správny diagnostický a terapeutický postup s promptnou organizáciou TKB u všetkých pacientov so SCID.
Korespondující autorka:
MUDr. Veronika Urdová Dobšinská
Transplantačná jednotka kostnej drene
Klinika detskej hematológie a onkológie
Národný ústav detských chorôb,
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: nikaurdova@gmail.com
Sources
1. Tangye SG, Al-Herz W, Bousfiha A. Human inborn errors of immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol 2020; 40 (1): 24–64.
2. Kwan A. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA 2014; 312 (7): 729–738.
3. Heimall J. Immune reconstitution and survival of 100 SCID patients post-hematopoietic cell transplant: a PIDTC natural history study. Blood 2017; 130 (25): 2718–2727.
4. Fischer A, Notarangelo LD, Neven B, et al. Severe combined immunodeficiencies and related disorders. Nat Rev Dis Prim 2015; 1 : 15061.
5. Gennery AR. Omenn’s syndrome occurring in patients without mutations in recombination activating genes. Clin Immunol 2005; 116 (3): 246–256.
6. Chan K, Puck JM. Development of population-based newborn screening for severe combined immunodeficiency. J Allergy Clin Immunol 2005; 115 (2): 391–398.
7. Douek DC. Changes in thymic function with age and during the treatment of HIV infection. Nature 1998; 396 (6712): 690–695.
8. http://www.info4pi.org/town-hall/newborn-screening. Jeffrey Model Foundation.
9. Heimall J, Cowan MJ. Long term outcomes of severe combined immunodeficiency: therapy implications. Expert Rev Clin Immunol 2017; 13 (11): 1029–1040.
10. Šufliarska S, Horáková J, Boďová I. Transplantácia krvotvorných buniek v pediatrickej onkológii. Onkológia 2006; 1 (2): 93–97.
11. Cavazzana M, Six E, Lagresle-Peyrou C, André-Schmutz I. Gene therapy for X-linked severe combined immunodeficiency: Where do we stand? Hum Gene Ther 2016; 27 (2): 108–116.
12. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
13. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966 Mar; 50 (3): 163–170.
14. IBM Corp. Released, IBM SPSS Statistics for Windows, Version 20.0, 2011.
15. Šufliarska S, Horáková J, Boďová I. Závažná BCG-itída u detí s vrodenou imunodeficienciou. Pediatr pre prax 2012; 13 (6): 268–270.
16. Gaspar HB. Long-term persistence of a polyclonal T cell repertoire after gene therapy for X-linked severe combined immunodeficiency. Sci Transl Med 2011 Aug; 3 (97).
17. Rota IA, Dhalla F. FOXN1 deficient nude severe combined immunodeficiency. Orphanet J Rare Dis 2017; 12 (1): 6.
18. Čižnár P, Horáková J. Novorodenecký skríning primárnych imunodeficiencií. Pediatr pre prax 2014; 15 (2): 52–56.
19. Pasic S, Vujic D, Veljković D. Severe combined immunodeficiency in Serbia and Montenegro between years 1986 and 2010: a single-center experience. J Clin Immunol 2014; 34 (3): 304–308.
20. Neven B, Leroy S, Decaluwe H, et al. Long-term outcome after hematopoietic stem cell transplantation of a single-center cohort of 90 patients with severe combined immunodeficiency. Blood 2009; 113 (17): 4114–4124.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 4-
All articles in this issue
- EDITORIAL Vrodené poruchy imunity – najväčší učitelia modernej imunológie
- Ťažká kombinovaná imunodeficiencia v súbore pacientov liečených v Národnom ústave detských chorôb
- Kombinované imunodeficience spojené se syndromickými příznaky
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
- Vrozené poruchy komplementu II. – hereditární angioedém
- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- Ako hľadali názov choroby. Münchhausenov syndróm
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

