-
Medical journals
- Career
Kdy pomýšlet na řasinkové dysfunkce?
Authors: V. Martinů 1; P. Dvořáková 1,2; J. Uhlík 2; Ž. Varényiová 1; L. Bořek-Dohalská 1; P. Pohunek 1
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN Motol, Praha 1; Ústav histologie a embryologie 2. LF UK, Praha 2
Published in: Čes-slov Pediat 2020; 75 (7): 401-409.
Category:
Overview
Primární ciliární dyskineze (PCD) je vzácné geneticky podmíněné onemocnění s pestrou symptomatologií. Na tuto diagnózu je potřeba vždy myslet u dětí i dospělých s rekurentní nebo chronickou nemocností v oblasti horních a dolních dýchacích cest, často ve spojitosti s poruchami sluchu.
Onemocnění se obvykle projeví již krátce po narození jako dechová tíseň novorozence nebo novorozenecká rýma. Pacienti pak po celý život trpí chronickým vlhkým kašlem a opakovanými záněty dýchacích cest a plic, jež mohou vyústit až v bronchiektázie. Na možnou ciliopatii je nutné pomýšlet při situs viscerum inversus nebo jiných poruchách laterality, častější jsou také poruchy plodnosti. Včasné stanovení diagnózy a zahájení komplexní péče jsou klíčové pro prognózu nemocných, jelikož k regresi plicních funkcí a devastaci plicní tkáně dochází u některých fenotypů již v časném věku pacienta.
Klíčová slova:
primární ciliární dyskineze – situs viscerum inversus – diagnostika – symptomatologie – léčba
ÚVOD
Primární ciliární dyskineze (PCD) patří mezi vzácná onemocnění. Jedná se o geneticky podmíněnou poruchu, jejíž dědičnost je v naprosté většině případů autosomálně recesivní. Prevalence tohoto onemocnění je udávána 1 : 10 000 až 1 : 40 000, v Evropě je odhad prevalence 1 : 10 000 až 1 : 15 000, výskyt je častější v některých populacích [1–4]. Onemocnění bylo poprvé popsáno Kartagenerem v roce 1936 jako trias chronické sinusitidy, situs viscerum inversus a bronchiektázií prozatím bez podrobné znalosti patogenetického mechanismu. Až v sedmdesátých letech 20. století byl syndrom Afzeliem spojen s dysfunkcí motilních řasinek. PCD je velmi heterogenním onemocněním, jedná se o komplexní poruchu s pestrou, zejména respirační symptomatologií. Příčinou této symptomatologie u pacientů s PCD je porušená mukociliární clearance v důsledku poruchy pohyblivosti řasinek na apikálním povrchu buněk respiračního epitelu. Řasinky díky svému typickému charakteru pohybu zajišťují transport sekretu dýchacími cestami orálním směrem, tak je zajištěno potřebné očišťování dýchacích cest od sekretu a vdechnutých částic.
K typickým příznakům onemocnění projevujícím se již od dětského věku patří chronická rýma, chronický vlhký kašel, opakované záněty středouší, chronická sekretorická otitida, poruchy sluchu, chronická sinusitida, opakované pneumonie a bronchitidy, chronická bronchitida a bronchiektázie, také poruchy laterality orgánů a poruchy plodnosti (tab. 1). V současné době je známo již 50 genů, jejichž defekt souvisí s PCD. Fenotyp nemoci může být velmi variabilní, u některých pacientů dochází k rychlé progresi nemoci se zhoršováním plicních funkcí a kvality života [5–8].
Table 1. Příznaky typické pro PCD. 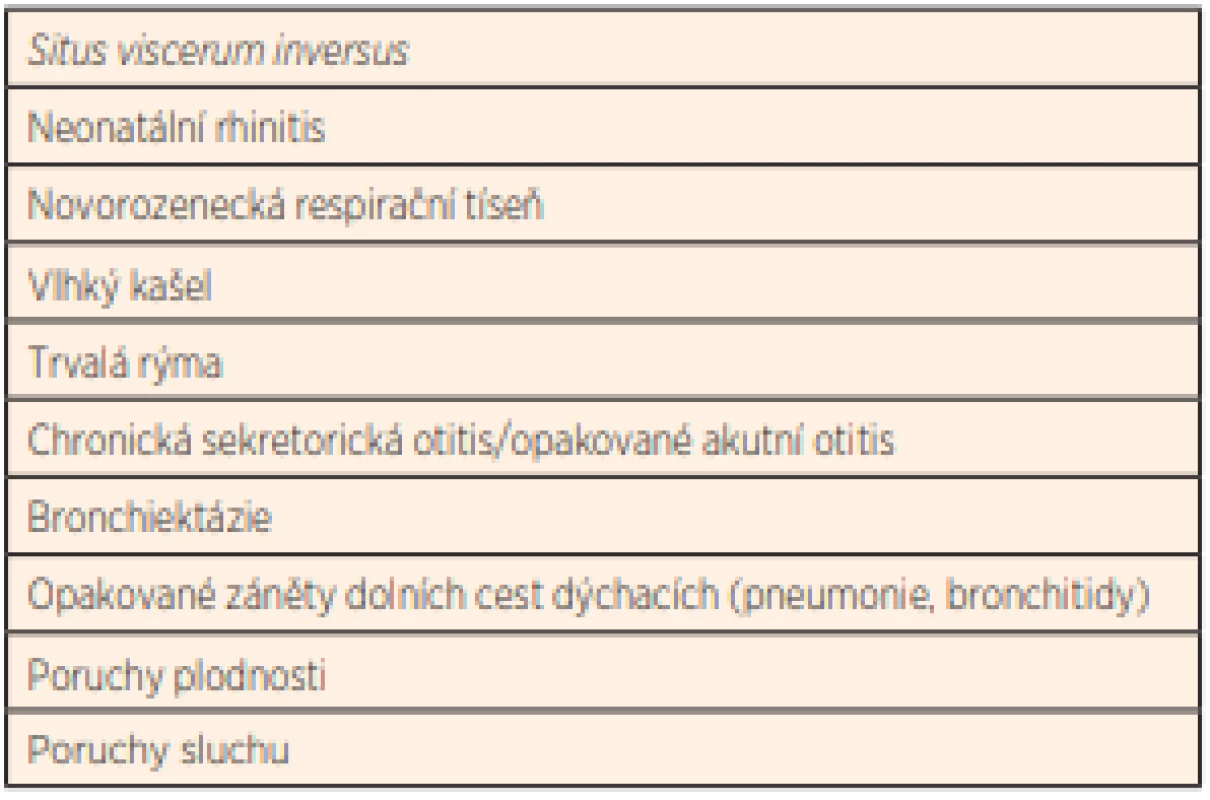
PCD – primární ciliární dyskineze Diagnostický proces je náročný, jelikož se skládá z řady vyšetření vyžadujících specializované přístroje a specificky vyškolené pracovníky. Stanovení diagnózy je proto mnohdy obtížné a nemoc je poddiagnostikována. Často je diagnóza stanovena až ve školním věku nebo v dospělosti, kdy již bývají rozvinuty chronické ireverzibilní změny, bronchiektázie a porucha sluchu. Projevy nemoci souvisí s konkrétním typem řasinkové poruchy, významný je jistě i vliv řady dalších faktorů, např. bakteriální kolonizace, přístup ke kvalitní léčbě a včasnost jejího zahájení. U pozdně diagnostikovaných pacientů dochází k zavedení soustavné péče až v době plně rozvinuté nemoci. Porucha pohyblivosti řasinek může být také sekundární. Vzniká často po virových infekcích horních cest dýchacích, či při chronickém zánětu nebo dráždění sliznice (např. alergie, EER, imunodeficience, tabákový kouř, nazální dekongestiva). Odlišení této poruchy motility od PCD je někdy obtížné, jelikož se vyskytuje velice často a může zakrývat či imitovat charakteristické nálezy při primární poruše.
PATOGENEZE ONEMOCNĚNÍ
Podstatou respiračních symptomů onemocnění je porucha pohyblivosti řasinek (kinocilií) na apikálním povrchu řasinkových buněk ve víceřadém cylindrickém epitelu dýchacích cest. Počet řasinek na buněčném povrchu je přibližně 250. Řasinky u nemocných s PCD mohou být akinetické, nebo je charakter jejich pohybu abnormální a tudíž nefunkční. Tyto řasinky pak nemohou zajistit transport sekretu a v něm přítomných částic (bakterií, virů, nečistot, odumřelých buněk) orálním směrem. Nefunkční a neefektivní mukociliární clearance vede ke stagnaci hlenu v oblasti horních i dolních dýchacích cest, z toho vyplývá typická respirační symptomatologie PCD. Struktura řasinek je velmi komplexní, axonema volné části řasinky je složeno z centrálního páru mikrotubulů, centrální pochvy, devíti periferních dubletů mikrotubulů, které nesou vnější (ODA) a vnitřní (IDA) dyneinová raménka, a radiálních a nexinových spojek (obr. 1).
Image 1. Struktura cilie – axomema (schematický příčný řez řasinkou). Popis: ODA – vnější dyneinová raménka, IDA – vnitřní dyneinová raménka, CP – centrální pár, PD – periferní dublety, RS – radiální spojky, NS – nexinové spojky; použito se svolením MUDr. Petry Dvořákové
Fig. 1. Structure of cilia – axoneme (crossectional figure of cilia). Description: ODA – outer dynein arms, IDA – inner dynein arms, CP – central pair, PD – peripheral doublets, RS – radial spokes, NS – nexin links; figures were used with a consent of Dr. Petra Dvorakova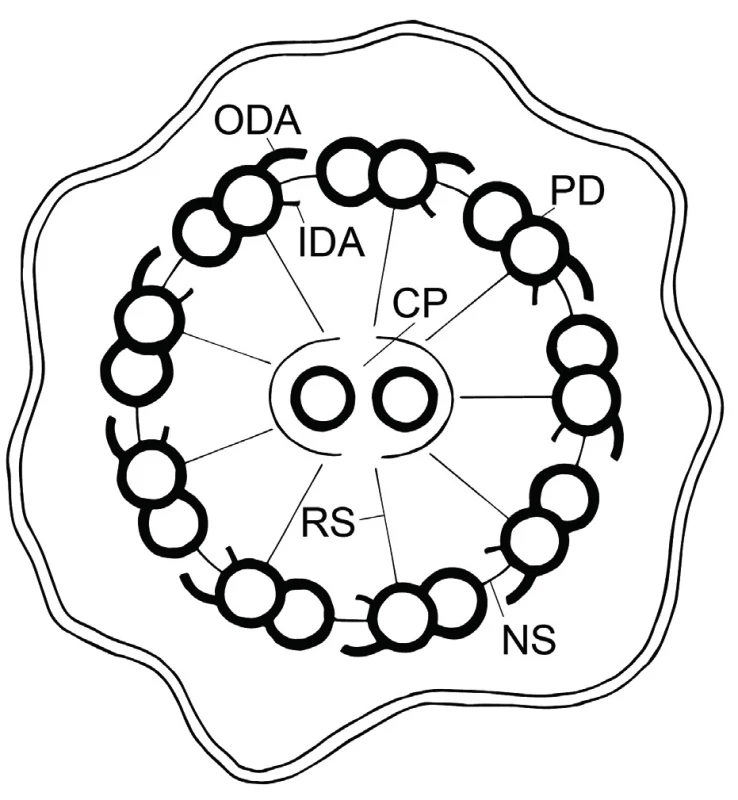
Podkladem onemocnění je genetická vada způsobující strukturální nebo funkční poruchu v proteinech důležitých pro výstavbu a funkci řasinek. Kinocilie se nevyskytují pouze v respiračním systému, ale také v systému pohlavním. U žen se nacházejí kinocilie ve vejcovodech, kde pomáhají transportu oplodněného vajíčka do dělohy. Dysfunkce těchto cilií může vést k problémům s plodností, popisován je častější výskyt extrauterinních gravidit. Axonema bičíku spermií má také podobnou strukturu a může proto docházet k poruše hybnosti spermií, která vede k neplodnosti u mužů (přibližně u poloviny mužských pacientů s PCD) [9]. Další lokalizací pohyblivých řasinek je ependym vystýlající komorový systém CNS. Proto může být PCD spojena i s hydrocefalem. Vedle kinocilií jsou u PCD významné i nodální řasinky mající důležitou roli v určení pravolevé osy zárodku. Jejich porucha vede k nahodilému uspořádání, což vysvětluje přítomnost situs viscerum inversus a jiných poruch laterality u pacientů s PCD. Vedle toho stojí primární cilie se senzorickou funkcí, jejichž dysfunkce není u typické PCD přítomna.
SYMPTOMATOLOGIE
Symptomatologie PCD je velmi heterogenní. Vzhledem k tomu, že pohyblivé cilie se vyskytují v celém dýchacím traktu až po respirační bronchioly, je potřeba pomýšlet na možnou poruchu jejich pohyblivosti zejména u pacientů s větší nemocností v oblasti horních i dolních dýchacích cest současně. Podezření na toto onemocnění může vzniknout již prenatálně nebo perinatálně. U pacientů s PCD je častější výskyt situs viscerum inversus, dextrokardie nebo jiných poruch laterality (poruchy laterality se vyskytují až u 50 %, situs ambiguus až u 12 % pacientů s PCD) [10, 11]. PCD je spojena i s vyšším výskytem vrozených srdečních vad [10, 12], v embryonálním období totiž hrají řasinky roli také při formování srdce.
Již krátce po narození se mohou u pacientů objevit typické respirační příznaky. Přechodná respirační insuficience novorozence s potřebou oxygenoterapie se vyskytuje u více než 80 % dětí s PCD narozených v termínu, nastupuje typicky 12–24 hodin po porodu po předchozí normální poporodní adaptaci [13]. Předpokládá se podíl řasinek na odstranění amniové tekutiny z plic. Hyposaturace s potřebou oxygenoterapie u novorozenců s PCD mohou přetrvávat i několik dnů až týdnů. Dítě je často léčeno antibiotiky pro suspektní pneumonii, na skiagramu hrudníku může být patrný lobární kolaps. Již v novorozeneckém věku je také možné pozorovat rýmu nebo nosní obstrukci, někdy již v porodnici. Sekrece z nosu přetrvává a přechází do chronicity, může přecházet ze serózní do purulentní. Trvalá rýma se vyskytuje až u 97 % pacientů. Po přeléčení obvykle mění charakter, ale neustává. Chronická rinosinusitida vede u 15–30 % pacientů k rozvoji polypů. Polypy se vyskytují spíše až v dospělosti nebo u větších dětí, vyskytují se v menší míře než např. u nemocných s cystickou fibrózou.
V dětském věku jsou typické příznaky v oblasti středouší. Při nefunkčnosti řasinek vázne odtok tekutiny přes Eustachovu trubici. Až 88 % pacientů má proto v časném věku záněty středouší. Často bývá diagnostikována chronická sekretorická otitida. Následným problémem může být nedoslýchavost, která může také vést k opoždění vývoje řeči. Diagnostika chronické sekretorické otitidy vyžaduje otomikroskopické vyšetření. Porucha sluchu bývá v 66 % bilaterální a většinou je převodní [14]. Počet otitid se s věkem snižuje, u pacientů s PCD se obvykle vyskytují delší dobu než u běžné populace (do 18 let vs. do 8 let). Při časté antibiotické léčbě zánětů horních dýchacích cest a ORL oblasti může být symptomatologie z dolních dýchacích cest méně nápadná a exacerbace málo časté. To může také přispět k opoždění diagnózy.
Typickým příznakem u PCD je chronický každodenní vlhký kašel (až u 97 % pacientů). Někdy je tento příznak opomíjen a podceňován. Je potřeba se aktivně ptát po příznacích zahlenění v dolních dýchacích cestách. Řada pacientů může být mylně vedena pod diagnózou obtížně léčitelného astmatu. Vyšetření funkce plic u pacientů s PCD prokáže obvykle obstrukční ventilační poruchu. Efekt protiastmatické léčby je samozřejmě omezený, měla by být nasazena pouze u pacientů se současnou bronchiální hyperreaktivitou, tato léčba nezmírní příznaky zahlenění. Stagnace hlenu v bronchiálním stromu vede k chronické bronchitidě a pneumoniím.
Důsledkem chronického postižení dolních dýchacích cest je časný rozvoj bronchiektázií. V 8 letech věku má již přibližně polovina dětských pacientů s PCD rozvinuté bronchiektázie [15]. Nález bronchiektázií by měl být jednoznačnou indikací ke screeningovému vyšetření ciliární aktivity u všech pacientů, není-li jasná jiná etiologie jejich vzniku (např. cystická fibróza). Stejně tak by měl být ke screeningu indikován každý pacient s výraznější a nevysvětlenou nemocností v oblasti horních i dolních dýchacích cest.
V dospělém věku se u některých pacientů setkáváme také s poruchami plodnosti. Pomoci s tímto problémem mohou u obou pohlaví centra reprodukční medicíny. U pacientů s poruchou plodnosti je také potřeba aktivně pátrat po respirační symptomatologii. I porucha plodnosti může být někdy hlavním příznakem, který přivede pacienta k vyšetření řasinek.
Fenotyp nemoci může být velmi variabilní, zejména u pacientů se zcela typickou symptomatologií by ale měla být diagnóza velmi časně stanovena. Nemělo by se stávat, že je až v dospělosti nebo ve školním věku diagnostikován pacient se zcela typickými příznaky, vč. rizikové perinatální anamnézy, vlhkého kašle nebo situs viscerum inversus. U pacientů s poruchami laterality bývá někdy diagnóza stanovena časněji ve srovnání s ostatními. Vzhledem k široké symptomatologii onemocnění je jasné, že důležitou úlohu v indikaci vyšetření řasinek může hrát řada specialistů, vč. kardiologa, ORL lékaře, alergologa, neonatologa nebo gynekologa. Zásadní je samozřejmě role pneumologů pro dětské i dospělé pacienty a samozřejmě také úloha PLDD a nemocničních pediatrů. Velmi vzácně může být s PCD asociováno také polycystické onemocnění ledvin nebo jater, biliární atrézie, hydrocefalus, retinitis pigmentosa či hluchota.
DIAGNOSTIKA
Diagnostický algoritmus začíná podezřením na PCD, to je naprosto zásadní pro včasnou diagnózu nemoci. V současné době neexistuje žádný jednotlivý test, který by byl zlatým standardem pro diagnózu u všech pacientů. Zásadní je kombinace anamnézy, klinických příznaků a výsledků více vyšetřovacích metod. Vždy je nutné hodnotit komplexně všechny výsledky provedených vyšetření v kontextu klinického stavu pacienta. Nejnovějším doporučeným postupem pro diagnostiku PCD je diagnostický algoritmus Evropské respirační společnosti z roku 2017 [16].
Ke zhodnocení rizika a pravděpodobnosti onemocnění a snadnější orientaci v příznacích byly vytvořeny škálovací (skórovací) dotazníky, které usnadňují indikaci dalšího vyšetřování. Nejznámější je PICADAR (PrImary CiliAry DyskinesiA Rule) [17] (tab. 2), tento dotazník je koncipován pro pacienty trpící vlhkým kašlem. Výsledkem je zjištění pravděpodobnosti onemocnění. Při použití cut-off hranice 5 bodů získáme 90% senzitivitu a 75% specificitu. Tento dotazník však nelze použít jako definitivní nástroj k diagnóze, je samozřejmě nutná kombinace s ostatními testy. V ČR byl ještě před zveřejněním PICADAR zaveden klinický index rizika [18], který se skládá ze 7 otázek a zohledňuje příznaky typické pro PCD. Na základě počtu bodů určuje tento index riziko onemocnění. Při podezření na diagnózu PCD je vhodné provést vyšetření k vyloučení jiných onemocnění, která mohou mít podobné příznaky, řada z nich je častější než PCD a jsou také často mnohem snadněji diagnostikovaná. Je vhodné doplnit potní test, základní imunologické vyšetření, ORL vyšetření včetně posouzení adenoidní vegetace a ev. také vyšetření k posouzení gastroezofageálního refluxu.
Table 2. PICADAR (PrImary CiliAry DyskinesiA Rule). 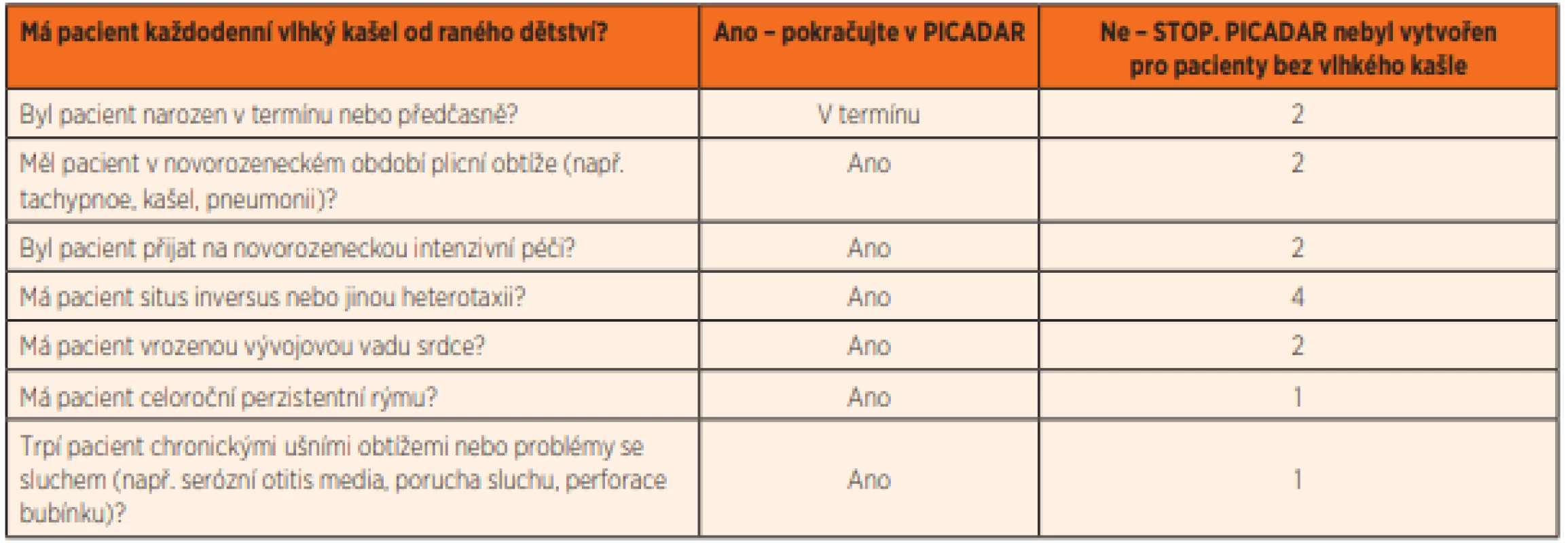
Při použití hodnoty 5 a více bodů jako hraniční hodnoty pro hodnocení pozitivity je dosaženo 90% senzitivity. Základními a zásadními screeningovými metodami vyšetření jsou vysokorychlostní videomikroskopie a vyšetření koncentrace nazálního oxidu dusnatého ve vzduchu odsátém z nosní dutiny. V případě podezření na vrozenou poruchu řasinek je vždy nutné pacienta odeslat na screeningové vyšetření PCD, to je v ČR možné v Praze v Motole nebo v Olomouci. Některá další pneumologická pracoviště jsou vybavena přístrojem k měření nazálního NO a mohou také částečně pomoci v rámci screeningu onemocnění a výběru pacientů indikovaných k vysokorychlostní videomikroskopii (high-speed-videomicroscopy, HSVM). Podle nálezů při HSVM je pak indikováno další podrobné vyšetření.
Měření nazálního oxidu dusnatého (NO) je velmi výhodnou metodou, která je pro pacienta zcela nezatěžující a neinvazivní. Jedná se o analýzu nazální koncentrace NO, která odráží produkci tohoto plynu v paranazálních dutinách. U pacientů s PCD byla zjištěna nízká produkce NO, patofyziologický mechanismus však není zcela vyjasněn [19, 20]. Měření lze provádět různými technikami (dýchání ústy, vydechování proti odporu, zadržení dechu), analýza se provádí metodou chemoluminiscenční nebo elektrochemickou. Za patologicky nízkou je obvykle považována hodnota 77 nL/min a méně (některé přístroje hodnotí v ppb, nutno tedy hodnoty podle použitého režimu převést). V žádném případě není možné potvrdit či vyloučit diagnózu PCD pouze na základě tohoto testu. Ve výjimečných případech může být hodnota NO i u PCD normální, jen část pacientů s nízkou hodnotou NO má skutečně diagnózu PCD. Snížená produkce NO může být i důsledkem jiných onemocnění (aplazie sinů, cystická fibróza atd.), výsledek vyšetření je nutné dát do souvislosti s výsledky ostatních testů. Vyšetření je možné provádět obvykle u dětí od 3–5 let věku, podle možnosti spolupráce, podobně jako například u spirometrie. Zajímavá je také otázka vyšetření u nejmenších dětí, kde je ale také komplikované hodnocení nálezů, paranazální dutiny se postupně vyvíjejí v prvních letech života.
HSVM je funkčním vyšetřením, při kterém sledujeme a hodnotíme pohyb řasinek. Hraje v diagnostice naprosto zásadní roli. Vzorek k vyšetření získáme rychlým odběrem z nosu pomocí cytologického kartáčku, nutný je speciální živný roztok, ve kterém jsou řasinky schopné pohybu ještě několik hodin. Vzorek prohlížíme pod mikroskopem, připojená vysokorychlostní kamera umožňuje pořízení videozáznamu a prohlížení zpomaleného pohybu. Pozorujeme lemy epitelových cylindrických buněk s řasinkami, u nichž analyzujeme frekvenci a charakter pohybu, jeho amplitudu, koordinaci a linearitu. Pohyb řasinek sledujeme při pohledu z boku a shora. Pohyb řasinek je složitý děj, frekvence je závislá na teplotě. Dopředná fáze (forward stroke) je rychlejší, efektivní složka pohybu, kdy řasinka aktivně posune sekret pomocí své apikální části. Zpětný pohyb (recovery stroke, backward sweep) je pomalejší, řasinka se při něm ohýbá ve své spodní části, nedotýká se hlenu a dostává se do své původní pozice (obr. 2) [21]. Vyšetření musí provádět zkušený pracovník. V nálezech často pozorujeme sekundární změny, které znesnadňují diagnózu. Vyšetření je v některých případech nutno s odstupem opakovat pro nejasný nález. Odstup vyšetření musí být nejméně 4–6 týdnů, aby se po odeznění nepříznivých vlivů využilo vývoje nové, nepoškozené generace řasinkových buněk. K odlišení sekundární dyskineze je možné použít také techniku buněčných kultur. Z bazálních buněk nosního epitelu jsou v ideálních laboratorních podmínkách pěstovány ciliární buňky, metoda je technicky poměrně náročná. Řasinkové buňky získané touto metodou by měly být prosty vnějších vlivů a případná porucha jejich hybnosti je s největší pravděpodobností dána vrozenou vadou.
Image 2. HSVM – foto z kamery.
Fig. 2. HSVM – photo taken by a camera.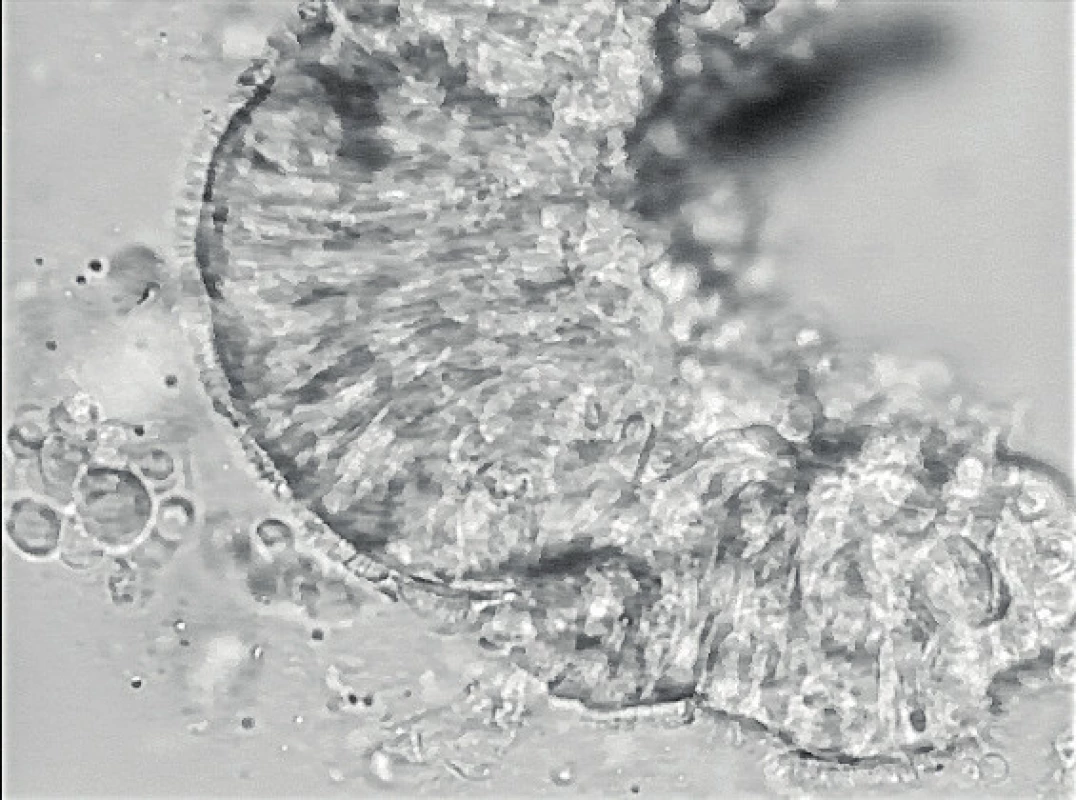
Dalším krokem k potvrzení diagnózy PCD je vyšetření ultrastruktury řasinek pomocí transmisní elektronové mikroskopie (TEM). Vzorek k vyšetření lze získat při bronchoskopii nebo z nosního odběru [22]. Výhodou nosního odběru je časová a technická nenáročnost a nízká invazivita. Bronchoskopický odběr pomocí endobronchiální biopsie je většinou kvalitnější, poskytuje mimo informace o ultrastruktuře jednotlivých řasinek i možnost zhodnocení vzájemné orientace řasinek a přítomnosti zánětlivých změn sliznice. Je-li u pacienta indikována bronchoskopie k ozřejmění stavu dolních cest dýchacích (makroskopické posouzení zánětlivých změn, přítomnost hlenu, hlenové zátky, malacie, vyloučení anatomických odchylek bronchiálního stromu a kultivační vyšetření), je výhodné získat vzorek samozřejmě pomocí biopsie. Při bronchoskopickém vyšetření je někdy možné pozorovat mukociliární transport in vivo, a to i v anestezii, kdy je za fyziologického stavu transportován hlen s bublinami vzduchu po stěně trachey. Vyhodnocení vzorků pomocí TEM (obr. 3) vyžaduje velkou zkušenost a erudici. Ke spolehlivému odečtení je zapotřebí prohlédnout velké množství transverzálních řezů axonematy. Na řezech je hodnocena nejen přítomnost ODA, IDA a centrálního páru, ale i pravidelná organizace axonematu svědčící pro prezenci radiálních spojek. Tyto změny svědčí pro PCD, pozorovat však můžeme i nálezy charakteristické pro sekundární poškození (swollen cilia – oteklé řasinky, compound cilia – sdružené řasinky). Výsledek TEM poskytuje údaj o strukturální vadě spojené s PCD. U velké části pacientů umožňuje jednoznačně potvrdit diagnózu, v diagnostice PCD má své zásadní místo, jedná se o velmi senzitivní metodu [16]. Negativní nález však nevylučuje diagnózu, přibližně 30 % pacientů nemá strukturální vadu zobrazitelnou na TEM, nebo je porucha čistě funkční [23]. Velmi užitečné může být také vyšetření pomocí imuno-fluorescence (IF) za použití protilátek proti strukturálním proteinům řasinek (obr. 4) a také jeho kombinace s TEM. Prozatím není k dispozici dostatek studií zabývajících se diagnostikou pomocí IF. Vyšetření pomocí IF může pomoci ozřejmit povahu řasinkové poruchy a pomoci tak k cílenému genetickému testování, vyšetření suspektních kandidátních genů.
Image 3. a, b. TEM – a) cilie norma, b) cilie s deficitem vnějších i vnitřních dyneinových ramének (ODA + IDA).
Fig. 3a, b. TEM – a) normal cilia, b) outer and inner dynein arms defect of cilia (ODA + IDA).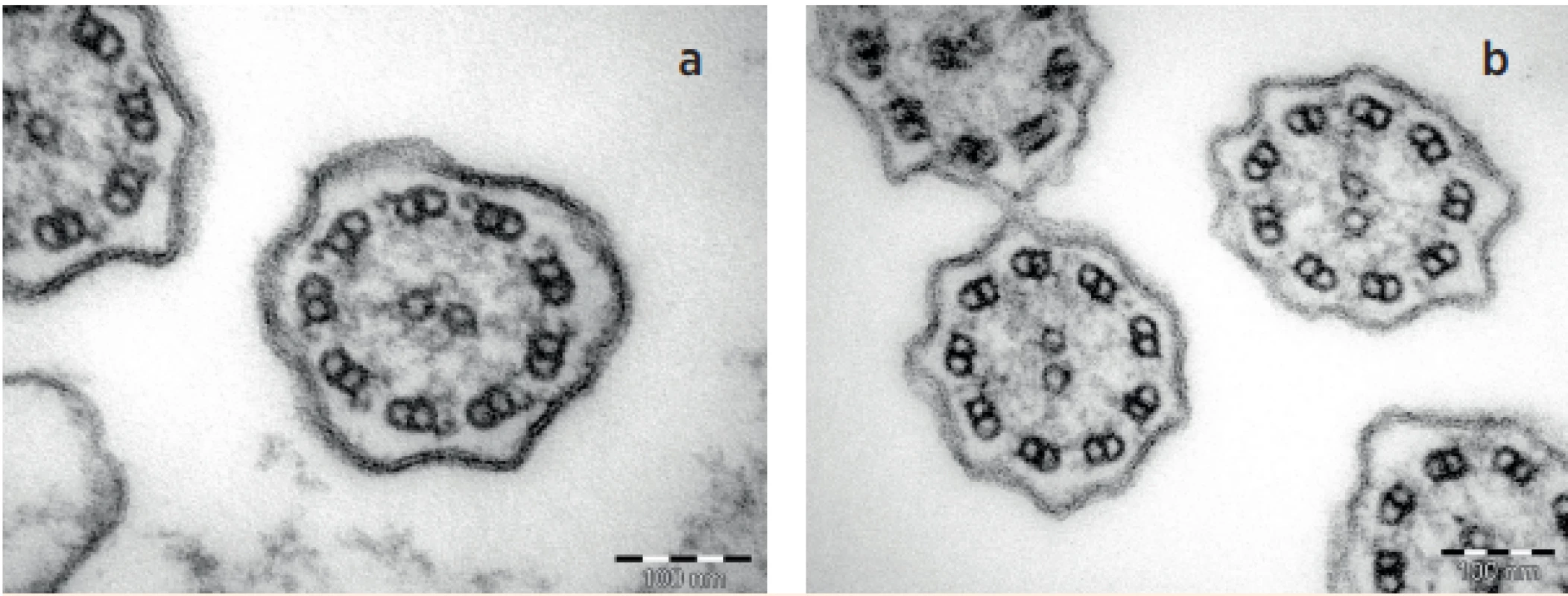
Image 4. Imunofluorescence – průkaz deficitu zevních dyneinových ramének (ODA) (DNAH5 – marker zevních dyneinových ramének).
Fig. 4. Immunofluorescence – outer dynein arms defect (ODA) (DNAH5 – marker of outer dynein arms).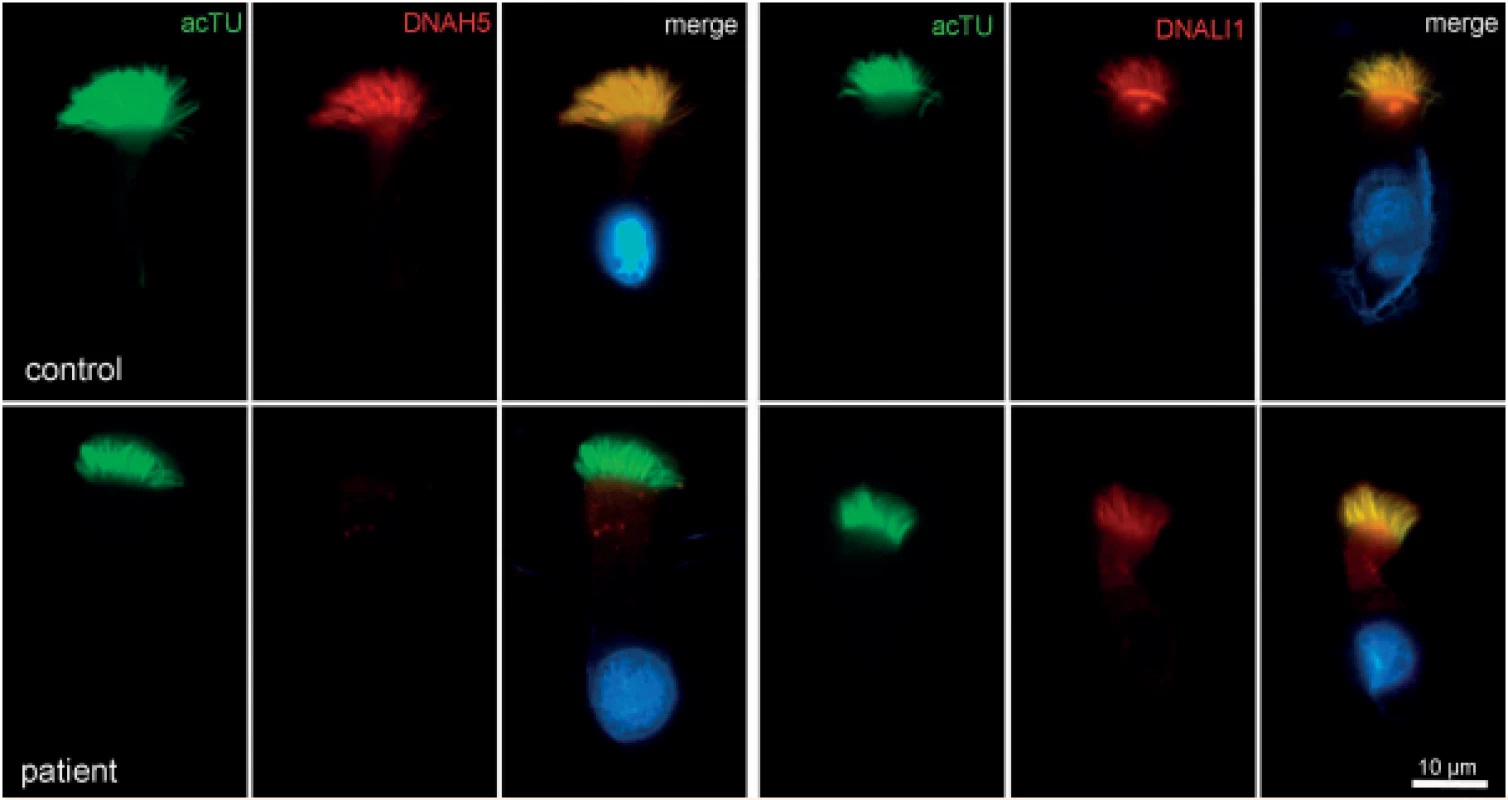
Genetické vyšetření je další součástí diagnostického algoritmu. Počet známých genů, jejichž defekt je asociován s PCD, se neustále zvyšuje. V současné době je známo již 50 genů, jejichž defekt způsobí PCD. Hlavním problémem u tohoto vyšetření je jeho ekonomická náročnost, dostupnost se ale celkově zvyšuje. Genetická diagnostika poskytuje cenné informace, které lze využít při plánované koncepci. Podobně jako u ostatních metod, genetickým testováním také není možné potvrdit diagnózu u všech pacientů. Při použití všech dostupných poznatků bychom byli t.č. schopni potvrdit diagnózu přibližně u 75 % pacientů s PCD [2]. Genetické vyšetření není nezbytné v diagnostickém procesu, ukazuje se ale stále více, že souvislost mezi genotypem a fenotypem onemocnění je klíčová. Co nejpřesnější ozřejmění řasinkové poruchy včetně genetického podkladu nemoci a poznání souvislosti s klinickými projevy jsou důležité pro co nejkvalitnější a dostatečně intenzivní léčbu jednotlivých pacientů. Některé souvislosti jsou již nyní známé, u některých mutací se setkáváme s vážnějšími projevy nemoci (například mutace CCDC39 a CCDC40 jsou asociovány s horšími plicními funkcemi, naopak mutace DNAH9 se spíše mírnějšími projevy) [24–26]. Je ale zapotřebí velkých mezinárodních studií k lepšímu porozumění projevů této vzácné nemoci u různých genotypů. Některé již v současné době probíhají.
LÉČBA NEMOCI, PÉČE O PACIENTY
Péče o pacienty s PCD musí být multidisciplinární a měla by probíhat ve specializovaném centru. Důležité jsou pravidelné klinické kontroly sledující stav nemocného, včetně plicních funkcí, mikrobiální kolonizace, compliance a jiných faktorů ovlivňujících progresi onemocnění a kvalitu života nemocného. Kontroly jsou časovány podle závažnosti průběhu v rozptylu 2–4x ročně [27]. Kauzální léčba není v současné době možná [2]. Podstatou terapie PCD je kombinace technik zlepšujících porušenou mukociliární clearance s antibiotickou léčbou. Cílem je očištění dýchacích cest od stagnujícího sekretu, léčba zánětu a prevence progrese nemoci s rozvojem nevratných komplikací.
Léčebné postupy u PCD vycházejí často ze zkušeností s léčbou jiných onemocnění, která také souvisí s poruchou evakuace sekretu z bronchiálního stromu či z ORL oblasti. Na základě dostupných publikací a zkušeností lze shrnout současný stav nejběžněji používané terapie. Důležitou součástí léčby jsou pravidelné každodenní inhalace roztoku s mukolytickým efektem, na které navazuje intenzivní dechová fyzioterapie s cílem evakuace sekretu z dýchacích cest. Pacienti obvykle inhalují 2–3x denně hypertonický 3–6% solný roztok (podle tolerance), který snižuje viskozitu hlenu, fyzioterapie musí ihned navazovat po inhalaci. U některých pacientů je před inhalací solného roztoku nutná premedikace inhalačním salbutamolem pro snížení dráždivosti inhalací a rizika bronchospazmu. Kvalitní edukace v dechové rehabilitaci je klíčovým momentem léčby a je u každého pacienta individuální v kontextu jeho plicního postižení. Vhodné jsou kombinace airway-clearance technik, autogenní drenáže a usilovného výdechu za použití výdechových trenažérů (zejména oscilační PEP – positive expiratory pressure), u nejmenších dětí je možné použít PEP masku. U nemocných s PCD se nedoporučuje užívat rekombinantní DNázy. Výsledky studií u PCD byly sporné, efekt těchto přípravků byl prokázán pouze u cystické fibrózy [2, 28].
Image 5. Skiagram hrudníku, 9letá pacientka s PCD a dextrokardií – zvýrazněná plicní kresba, chronické atelektaticko-infiltrativní změny mediobazálně bilaterálně.
Fig. 5. X-ray of the chest, 9-year-old patient with dextrocardia – enhanced density of the pulmonary tissue, chronic atelectatic and infiltrative changes in medio-basal region bilaterally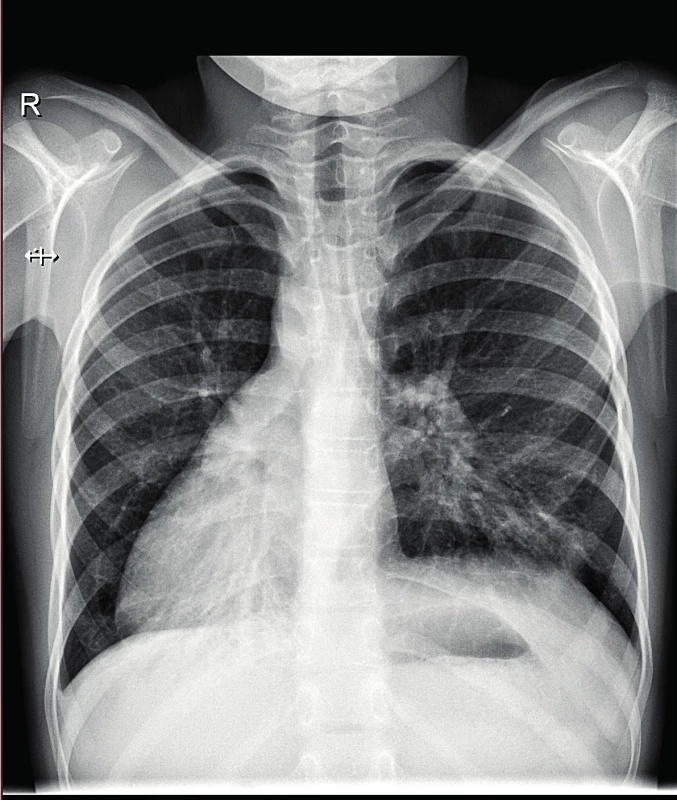
Antibiotická léčba je u PCD podávána akutně nebo v preventivním režimu. Exacerbace je nutno vždy léčit razantně a také dostatečně dlouho. Terapii zahajujeme podle posledních dostupných kultivačních nálezů a také podle závažnosti klinického stavu. U pacientů je nutné pravidelně provádět kultivace sekretu z dolních cest dýchacích, minimálně 4x ročně. Nutnost ozřejmění mikrobiálního osídlení dolních dýchacích cest může být někdy indikací k provedení bronchoskopie, zejména u dítěte, které nevykašlává sputum. Nejčastějšími zachycenými patogeny jsou Haemophilus influenzae, Staphylococcus aureus a Streptococcus pneumoniae, možný je také výskyt Pseudomonas aeruginosa, Stenotrophomonas maltophilia nebo netuberkulózních mykobakterií (spíše ve vyšším věku). Léčba by měla trvat 2–3 týdny podle závažnosti exacerbace. Nemocní s častými exacerbacemi, špatným celkovým stavem nebo rozvinutými bronchiektáziemi obvykle profitují z dlouhodobé antibiotické léčby. Nejvíce pozitivních zkušeností je s dlouhodobým podáváním azithromycinu v režimu 3x, event. 2x týdně. Předpokládá se, že efekt dlouhodobého podávání makrolidových antibiotik u pacientů s PCD je zprostředkován antiinfekčním a imunomodulačním působením [29]. Nevýhodou je ale vysoké riziko rozvoje rezistence. Randomizovanou studií bylo prokázáno snížení frekvence exacerbací u PCD pacientů léčených 6 týdnů azithromycinem o polovinu ve srovnání s placebem [30]. Lze podávat i sulfamethoxazol/trimethoprim nebo betalaktamová antibiotika podle kultivačních nálezů. Délka podávání je od 3 do 12 měsíců. Nejčastěji plánujeme přestávku na letní období, kdy je riziko exacerbace většinou nižší. U některých pacientů je výhodné použití inhalačních antibiotik v preventivním režimu, zejména při prokázané kolonizaci Pseudomonas aeruginosa (v ČR je schválen colimycin u pacientů s prokázanou kolonizací, u tobramycinu je zatím nutné žádat o schválení revizním lékařem). Inhalační ciprofloxacin a aztreonam nejsou běžně používány. Spirometrické vyšetření se doporučuje provádět pravidelně vždy po 3 až 6 měsících nebo při zhoršení stavu. V případě prokázaného souběhu astmatu nebo bronchiální hyperreaktivity bez typických příznaků astmatu lze podávat inhalační kortikosteroidy, případně v kombinaci s dlouhodobě působícími beta-2-agonisty. V jiných případech není použití antiastmatik u PCD podloženo studiemi [27, 31].
Velmi důležitá je také péče o horní cesty dýchací. Spočívá ve výplachu paranazálních dutin solným roztokem s pomocí speciálních konviček (například s mořskou solí). Kontrola na pracovišti ORL by měla probíhat pravidelně každých 6–12 měsíců (1x ročně tympanometrie a audiometrie), v případě komplikací samozřejmě častěji. Indikováno je také odstranění hypertrofické adenoidní tkáně. V terapii akutních otitid je důležitá antibiotická léčba. Názory na léčbu chronické sekretorické otitidy nejsou zcela jednotné. Některé zdroje uvádějí, že tympanostomie z dlouhodobého hlediska zlepšuje kvalitu sluchu, jiné zdroje tuto metodu nedoporučují kvůli možným komplikacím v podobě otorhey, trvalé perforace bubínku či nutnosti opakovaných zákroků [27, 31]. Při pokročilé převodní poruše sluchu je indikováno zavedení naslouchadel [28]. Doporučuje se upřednostnění naslouchadel u přechodné sluchové poruchy před rutinním zaváděním stipul. Přístup ale musí být individuální. Efekt medikamentózní léčby pomocí antihistaminik, dekongestiv či kortikosteroidů nebyl potvrzen. Při progresi nosních polypů je někdy indikováno chirurgické řešení. Pacienti s PCD by měli být očkováni proti pneumokokům, hemofilovým infekcím, tuberkulóze, každoročně proti chřipce a v prvním roce věku také proti RSV [27]. Důležité je také bezprašné a čisté domácí prostředí bez expozice cigaretovému kouři. I při volbě školy a povolání je potřeba zohlednit tyto faktory. Systematická péče musí pokračovat i v dospělosti, klíčové je předání pacienta do péče pneumologického pracoviště pro dospělé s dostatečným zázemím a možností včasného řešení všech komplikací.
U některých pacientů, zejména s diagnózou stanovenou v pozdějším věku, může onemocnění progredovat do závažného stavu s těžkým plicním postižením. V případě závažného plicního postižení, které vede k respirační insuficienci, je součástí léčby také oxygenoterapie, případně neinvazivní ventilační podpora a indikace k transplantaci plic. Indikace k resekčnímu plicnímu výkonu je velmi specifická a vhodná jen ve výjimečných případech lokalizovaného postižení, je potřeba mít na mysli také možnou limitaci v případě zvažované transplantace plic v budoucnu při těžkém plicním postižení.
SITUACE V ČESKÉ REPUBLICE V ROCE 2020
V České republice se nyní díky systematickému komplexnímu přístupu daří zlepšovat poddiagnostikovanost této vzácné nemoci a péči o nemocné. Komplexním centrem pro diagnostiku nemoci a péči o pacienty s PCD v ČR je pracoviště Pediatrické kliniky FN Motol v Praze (pracoviště zajišťuje jako jediné v ČR kompletní diagnostický servis pro děti i dospělé). V současné době je celkový počet pacientů s potvrzenou diagnózou PCD v ČR 99, z toho 83 v mezinárodních registrech (40 žen, 43 mužů, 41 dětí, 42 dospělých). V roce 2019 se podařilo stanovit nově diagnózu u 13 pacientů (z toho 5 v dospělém věku), což je výrazný nárůst oproti letům předchozím, kdy byl tento počet výrazně nižší, v rozmezí 1–6 pacientů za rok. Několik dalších pacientů s potvrzenou diagnózou PCD máme i v letošním roce, řada dalších velmi suspektních pacientů je nyní vyšetřována. V poslední době vzrostl počet starších pacientů, jejichž správná diagnóza byla doposud opomenuta, zároveň se také podařilo odhalit onemocnění u několika kojenců.
Průměrný věk při stanovení diagnózy je t.č. v ČR 12 let, medián 9 let (ve skupině dětských pacientů je průměrný věk i medián přibližně 5 let). Cílem je samozřejmě co nejčasnější záchyt onemocnění, aby mohla být co nejdříve zahájena kvalitní péče a prognóza nemocných byla co nejpříznivější. Díky zlepšování a zpřesňování diagnostických metod a lepší informovanosti o nemoci (www.rasinky.cz) očekáváme v budoucnu další nárůst počtu nově diagnostikovaných případů.
Image 6. a, b. CT plic, 13letá pacientka s rozsáhlým plicním postižením a respirační insuficiencí, atelektázy s bronchiektáziemi postihující téměř kompletně oba dolní laloky, pravý střední lalok a lingulu.
Fig. 6a, b. CT of the lungs, 13-year-old patient with a severe pulmonary impairment and respiratory insufficiency, atelectasis together with bronchiectasis localised in basal lobes bilaterally, right medial lobe and the lingula.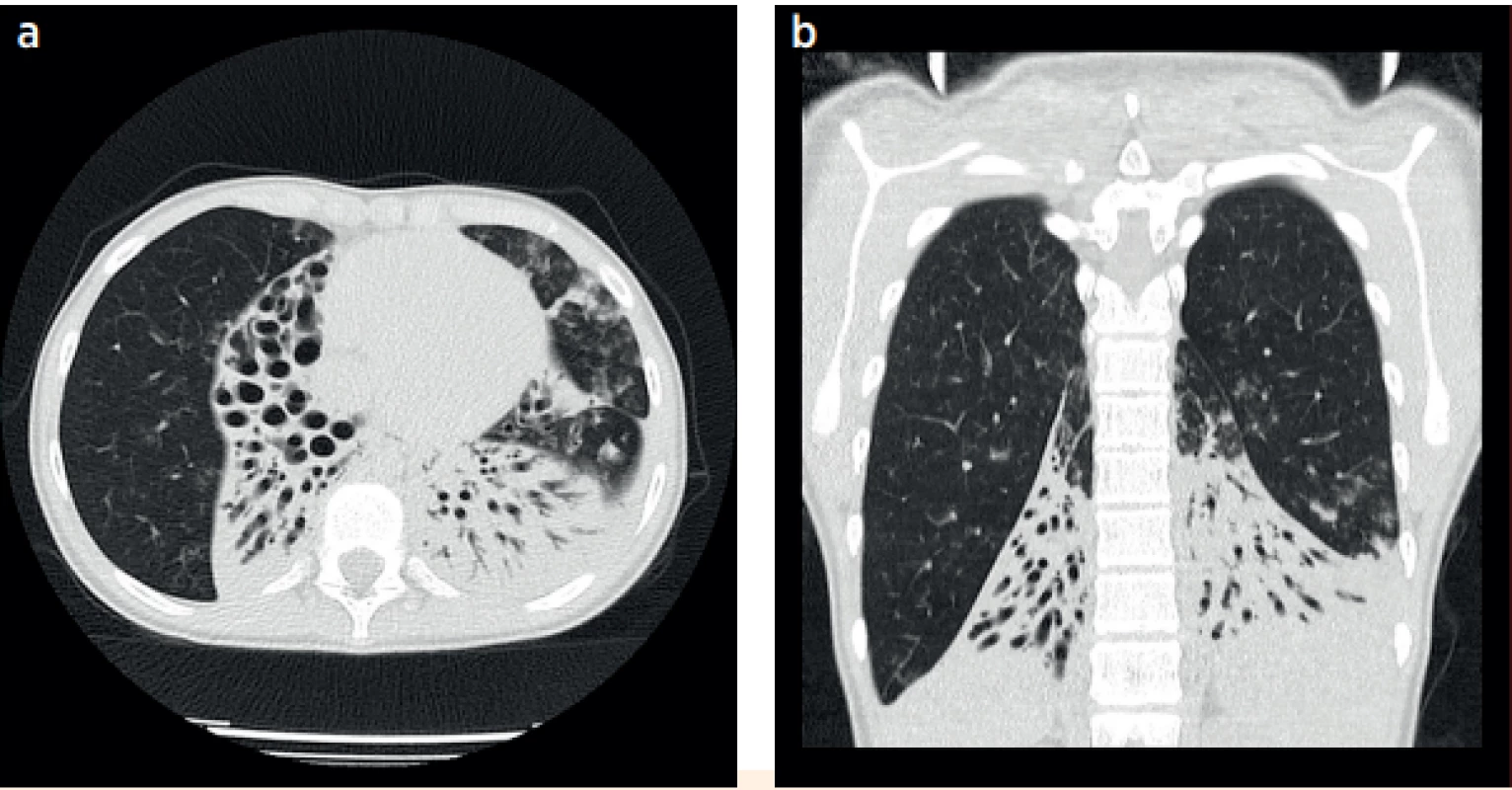
ZÁVĚR
PCD je vzácnou komplexní poruchou. Vzhledem k heterogenitě tohoto onemocnění může být diagnostika někdy velmi složitá. Onemocnění je u nás i celosvětově významně poddiagnostikováno, diagnóza je často opožděná. Včasné stanovení diagnózy a zavedení léčby jsou klíčové pro prognózu nemocných. Kritická je spolupráce s praktickými lékaři a dalšími specialisty při záchytu onemocnění. Na onemocnění je třeba myslet i u dospělých s chronickými respiračními příznaky.
Diagnostika onemocnění by měla probíhat ve specializovaném centru s řádným vybavením a zkušeností, obvykle se tak děje na pediatrických pracovištích, dospělí pacienti jsou pak předáváni do péče pneumologů pro dospělé pacienty. Léčba a dlouhodobé sledování by měly i nadále probíhat pod dohledem specializovaného centra s možnostmi komplexní multidisciplinární péče.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR (projekt NV19-07-00210) a Grantovou agenturou Univerzity Karlovy (projekt 670119P).
Práce byla podpořena Ministerstvem zdravotnictví České republiky (koncepční rozvoj výzkumné organizace, Fakultní nemocnice v Motole; grant 00064203).
MUDr. Vendula Martinů
Pediatrická klinika 2. LF UK a FN Motol
Oddělení dětské pneumologie
V Úvalu 84
150 06 Praha 5
e-mail: Vendula.Martinu@fnmotol.cz
Sources
1. Lucas JS, Burgess A, Mitchison HM, et al. National PCD Service, UK, 2014. Diagnosis and management of primary ciliary dyskinesia. Arch Dis Child 2014; 99 : 850–856. https://doi.org/10.1136/archdischild-2013-304831.
2. Lucas JS, Davis SD, Omran H, Shoemark A. Primary ciliary dyskinesia in the genomics age. Lancet Respir Med 2020; 8 : 202–216. https://doi.org/10.1016/S2213-2600(19)30374-1.
3. Kuehni CE, Frischer T, Strippoli M-PF, et al., ERS Task Force on Primary Ciliary Dyskinesia in Children. Factors influencing age at diagnosis of primary ciliary dyskinesia in European children. Eur Respir J 2010; 36 : 1248–1258. https://doi.org/10.1183/09031936.00001010
4. O’Callaghan C, Chetcuti P, Moya E. High prevalence of primary ciliary dyskinesia in a British Asian population. Arch Dis Child 2010; 95 : 51–52. https://doi.org/10.1136/adc.2009.158493.
5. Halbeisen FS, Goutaki M, Spycher BD, et al. Lung function in patients with primary ciliary dyskinesia: an iPCD Cohort study. Eur Respir J 2018 Aug; 52 (2). https://doi.org/10.1183/13993003.01040-2018.
6. Lucas JS, Behan L, Dunn Galvin A, et al. A quality-of-life measure for adults with primary ciliary dyskinesia: QOL-PCD. Eur Respir J 2015; 46 : 375–383. https://doi.org/10.1183/09031936.00216214.
7. Behan L, Leigh MW, Dell SD, et al. Validation of a health-related quality of life instrument for primary ciliary dyskinesia (QOL-PCD). Thorax 2017; 72 : 832–839. https://doi.org/10.1136/thoraxjnl-2016-209356.
8. Marthin JK, Petersen N, Skovgaard LT, Nielsen KG. Lung function in patients with primary ciliary dyskinesia: a cross-sectional and 3-decade longitudinal study. Am J Respir Crit Care Med 2010; 181 : 1262–1268. https://doi.org/10.1164/rccm.200811-1731OC.
9. Conraads VM, Galdermans DI, Kockx MM, et al. Ultrastructurally normal and motile spermatozoa in a fertile man with Kartagener’s syndrome. Chest 1992; 102 : 1616–1618. https://doi.org/10.1378/chest.102.5.1616.
10. Kennedy MP, Omran H, Leigh MW, et al. Congenital heart disease and other heterotaxic defects in a large cohort of patients with primary ciliary dyskinesia. Circulation 2007; 115 : 2814–2821. https://doi.org/10.1161/CIRCULATIONAHA.2007; 106.649038.
11. Shapiro AJ, Davis SD, Ferkol T, et al., Genetic Disorders of Mucociliary Clearance Consortium. Laterality defects other than situs inversus totalis in primary ciliary dyskinesia: insights into situs ambiguus and heterotaxy. Chest 2014; 146 : 1176–1186. https://doi.org/10.1378/chest.13-1704.
12. Goutaki M, Meier AB, Halbeisen FS, et al. Clinical manifestations in primary ciliary dyskinesia: systematic review and meta-analysis. Eur Respir J 2016; 48 : 1081–1095. https://doi.org/10.1183/13993003.00736-2016.
13. Mullowney T, Manson D, Kim R, et al. Primary ciliary dyskinesia and neonatal respiratory distress. Pediatrics 2014; 134 : 1160–1166. https://doi.org/10.1542/peds.2014-0808.
14. Kreicher KL, Schopper HK, Naik AN, et al. Hearing loss in children with primary ciliary dyskinesia. Int J Pediatr Otorhinolaryngol 2018; 104 : 161–165. https://doi.org/10.1016/j.ijporl.2017.11.005.
15. Knowles MR, Daniels LA, Davis SD, et al. Primary ciliary dyskinesia. Recent advances in diagnostics, genetics, and characterization of clinical disease. Am J Respir Crit Care Med 2013; 188 : 913–922. https://doi.org/10.1164/rccm.201301-0059CI.
16. Lucas JS, Barbato A, Collins SA, et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. Eur Respir J 2017 Jan 4; 49 (1). https://doi.org/10.1183/13993003.01090-2016.
17. Behan L, Dimitrov BD, Kuehni CE, et al. PICADAR: a diagnostic predictive tool for primary ciliary dyskinesia. Eur Respir J 2016; 47 : 1103–1112. https://doi.org/10.1183/13993003.01551-2015.
18. Djakow J, Svobodová T, Pohunek P. Primární ciliární dyskineze. Pediatr praxi 2013; 14 (6): 368–371.
19. Walker WT, Jackson CL, Lackie PM, et al. Nitric oxide in primary ciliary dyskinesia. Eur Respir J 2012; 40 : 1024–1032. https://doi.org/10.1183/09031936.00176111.
20. ATS/ERS Recommendations for Standardized Procedures for the Online and Offline Measurement of Exhaled Lower Respiratory Nitric Oxide and Nasal Nitric Oxide, 2005. Am J Respir Crit Care Med 2005; 171 : 912–930. https://doi.org/10.1164/rccm.200406-710ST.
21. Chilvers MA, Rutman A, O’Callaghan C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax 2003; 58 : 333–338. https://doi.org/10.1136/thorax.58.4.333.
22. Dvořáková P, Uhlík J, Svobodová T, et al. Diagnostika primární ciliární dyskineze. Čes-slov Pediat 2016; 71 : 104–110.
23. Fitzgerald DA, Shapiro AJ. When to suspect primary ciliary dyskinesia in children. Paediatr Respir Rev 2016; 18 : 3–7. https://doi.org/10.1016/j.prrv.2015.11.006.
24. Davis SD, Ferkol TW, Rosenfeld M, et al. Clinical features of childhood primary ciliary dyskinesia by genotype and ultrastructural phenotype. Am J Respir Crit Care Med 2015; 191 : 316–324. https://doi.org/10.1164//rccm.201409-1672OC.
25. Davis SD, Rosenfeld M, Lee H-S, et al. Primary ciliary dyskinesia: Longitudinal study of lung disease by ultrastructure defect and genotype. Am J Respir Crit Care Med 2019; 199 : 190–198. https://doi.org/10.1164/rccm.201803-0548OC.
26. Fassad MR, Shoemark A, Legendre M, et al. Mutations in outer dynein arm heavy Chain DNAH9 cause motile cilia defects and situs inversus. Am J Hum Genet 2018; 103 (6): 984–994. https://doi.org/10.1016/j.ajhg.2018.10.016.
27. Shapiro AJ, Zariwala MA, Ferkol T, et al., Genetic Disorders of Mucociliary Clearance Consortium. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatr Pulmonol 2016; 51 : 115–132. https://doi.org/10.1002/ppul.23304.
28. Rubbo B, Lucas JS. Clinical care for primary ciliary dyskinesia: current challenges and future directions. Eur Respir Rev 2017; 26. https://doi.org/10.1183/16000617.0023-2017.
29. Kobbernagel HE, Buchvald FF, Haarman EG, et al. Study protocol, rationale and recruitment in a European multi-centre randomized controlled trial to determine the efficacy and safety of azithromycin maintenance therapy for 6 months in primary ciliary dyskinesia. BMC Pulm Med 2016 Jul; 16. https://doi.org/10.1186/s12890-016-0261-x.
30. Kobbernagel HE, Buchvald FF, Haarman EG, et al. Efficacy and safety of azithromycin maintenance therapy in primary ciliary dyskinesia (BESTCILIA): a multicentre, double-blind, randomised, placebo-controlled phase 3 trial. Lancet Respir Med 2020; 8 : 493–505. https://doi.org/10.1016/S2213-2600(20)30058-8.
31. Knowles M, Zariwala M, Leigh M. Primary ciliary dyskinesia. Clin Chest Med 2016; 37 : 449–461. https://doi.org/10.1016/j.ccm.2016.04.008.
32. Řasinky.cz [www document], n.d. URL. https://rasinky.cz/ (accessed 6.22.20).
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 7-
All articles in this issue
- Dětská pneumologie v Česku a na Slovensku
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- C-reaktívny proteín vo vzťahu k fenotypom obštrukčného spánkového apnoe u detských pacientov
- Děti závislé na technické podpoře dýchání
- Transplantace kmenových buněk krvetvorby u dětí s Fanconiho anémií po selhání krvetvorby v České republice a na Slovensku (2005–2016)
- Úsmevné príhody z Martinskej nemocnice – obytná budova
- Vplyv chorioamnionitídy na morbiditu predčasne narodených novorodencov a možné terapeutické intervencie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Dětská pneumologie v Česku a na Slovensku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

