-
Medical journals
- Career
Opakovaná spontánní remise atypického hemolyticko-uremického syndromu vyvolaného chřipkou – kazuistika
Authors: H. Flögelová 1; J. Volejníková 1; I. Hrachovinová 2; Z. Prohászka 3; M. Šeda 1; J. Gumulec 4
Authors‘ workplace: Dětská klinika LF Univerzity Palackého a Fakultní nemocnice Olomouc, Česká republika 1; Ústav hematologie a krevní transfuze Praha (ÚHKT), Česká republika 2; Research Laboratory, Semmelweis University, 3rd Department of Internal Medicine, Budapest, Hungary 3; Klinika hematoonkologie, Fakultní nemocnice Ostrava, Česká republika 4
Published in: Čes-slov Pediat 2020; 75 (2): 98-102.
Category: Case Report
Overview
Popisujeme spontánní úpravu dvou epizod atypického hemolyticko-uremického syndromu (aHUS) u 17letého chlapce. Vyvolávajícím faktorem byla v obou případech sezonní chřipka (poprvé chřipka A/H3, podruhé s odstupem 1 roku chřipka B). Již při první manifestaci aHUS jsme prokázali sníženou expresi CD46 (membránový proteinový kofaktor, MCP) na granulocytech, což vedlo k podezření na komplementem zprostředkovaný HUS. Protože klinický stav pacienta byl stabilizovaný a od 3. dne se začaly lepšit i laboratorní nálezy, nepodávali jsme eculizumab, který je u dětí doporučeno podat do 48 hodin, ale léčili jsme pouze symptomaticky. Eculizumab jsme měli k dispozici pro případ zhoršení klinického stavu. V obou epizodách došlo k úplné spontánní úpravě HUS. Vzhledem k předpokládanému riziku relapsu aHUS jsme po první epizodě doplnili genetické vyšetření. Byla potvrzena mutace v MCP (CD46) genu (heterozygot pro mutaci p.C35Y) a současně rizikový MCPggaac haplotyp téhož genu. Předpokládáme, že kombinace uvedených genetických lézí měla patogenní roli při vzniku komplementem zprostředkovaného aHUS a chřipka byla spouštěčem onemocnění. Molekulárně geneticky byli vyšetřeni i rodiče pacienta, z nichž každý nese 1 vlohu – otec je heterozygot pro mutaci p.C35Y a matka heterozygot pro MCPggaac haplotyp genu MCP (CD46).
V této kazuistice jsme potvrdili, že u jedince s mutací v MCP může být sezonní chřipka vyvolávajícím faktorem aHUS a že je možná spontánní remise.
Klíčová slova:
atypický hemolyticko-uremický syndrom (HUS) – chřipka – membránový proteinový kofaktor (MCP) – remise
ÚVOD
Hemolyticko-uremický syndrom (HUS) patří mezi trombotické mikroangiopatie (TMA) a je charakterizován neimunní hemolytickou anémií, přítomností schistocytů, trombocytopenií a akutním poškozením ledvin (případně dalších orgánů jako myokardu, trávicího traktu a centrální nervové soustavy). V posledních letech došlo k prudkému rozvoji diagnostiky HUS, rozlišení jednotlivých podtypů (obr. 1) a jejich přirozeného průběhu. Průlom v léčbě atypického HUS (aHUS) znamenalo použití eculizumabu, nové léčebné možnosti především pro aHUS zprostředkovaný komplementem.
Image 1. Etiologie trombotické mikroangiopatie.
(Upraveno podle Loirat Ch, et al. An international consensus approach to the mana- gement of atypical hemolytic uremic syndrome in children. Pediatr Nephrol 2016 Jan; 31 (1): 17)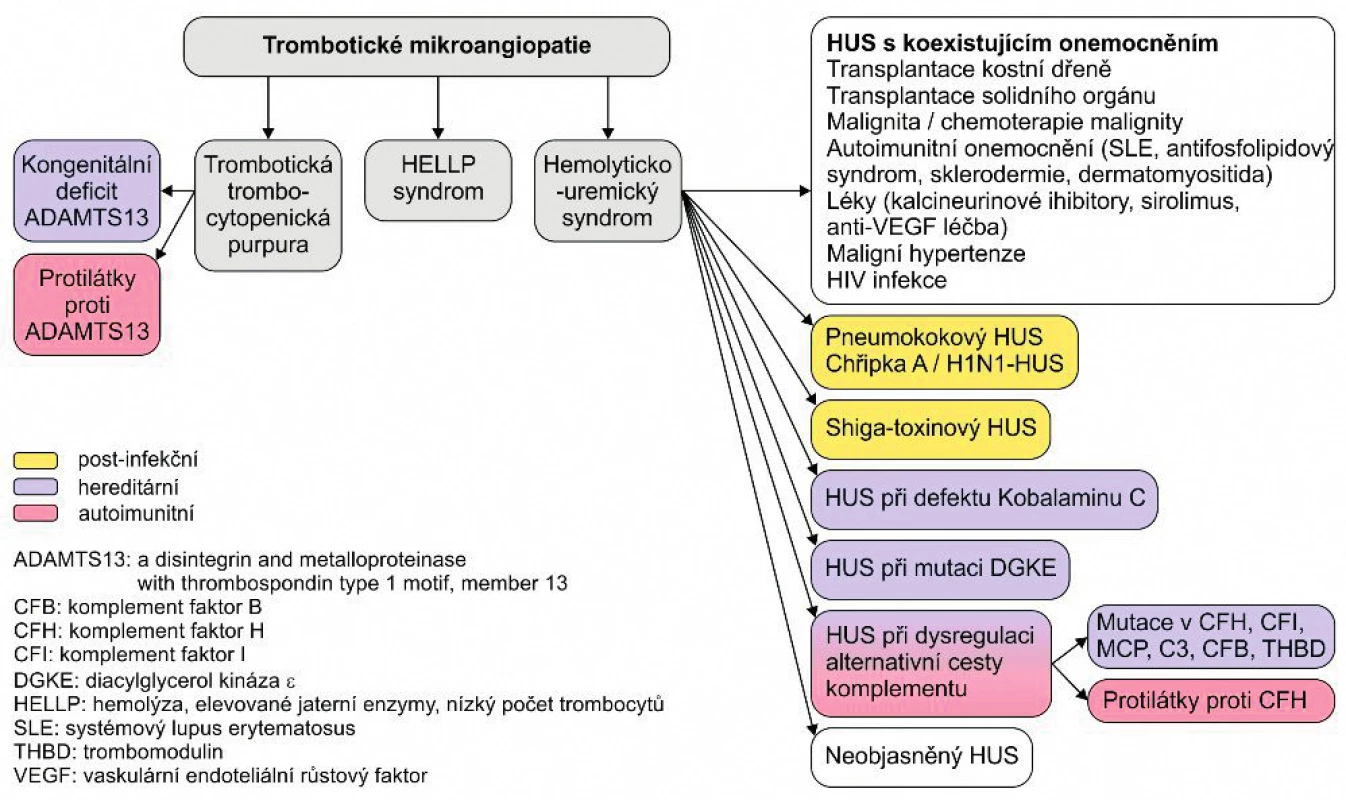
Přehledový článek o TMA vyšel v časopise Česko-slovenská pediatrie v roce 2017 [1]. V praxi je důležité TMA včas diagnostikovat a podle etiologie a klinického průběhu indikovat správnou léčbu.
<hr>
Toto sdělení bylo prezentováno jako poster na mezinárodním kongresu 51st Anniversary Meeting of the European Society for Paediatric Nephrology v Antalyi v Turecku 3.–6. 10. 2018 a jako přednáška na pediatrické konferenci 14. Festival kazuistik, 20.–22. 4. 2018.
<hr>
KLINICKÝ PŘÍPAD
Sedmnáctiletý chlapec byl přeložen ze spádové nemocnice na JIP Dětské kliniky Fakultní nemocnice pro trombocytopenii a akutní poškození ledvin (hemoglobinurii, elevaci urey a kreatininu). Čtyři dny před překladem měl známky respirační infekce, horečky do 40 °C, serózní sekreci z nosu a epistaxi. Den před překladem se objevila hematurie („moč barvy coca-coly“), proto byl hospitalizován na dětském oddělení spádové nemocnice. Při laboratorním vyšetření byla zjištěna trombocytopenie 25 x 103/µl, z koagulačních vyšetření lehce nižší Quick 66 %, zvýšený sérový kreatinin 134 µmmol/l, zvýšené CRP 60 mg/l. Kardiální markery byly negativní, nebyly známky rhabdomyolýzy. V moči chemicky krev 4+, erytrocyty 20. Při ultrazvukovém vyšetření břicha byla zjištěna splenomegalie a volná tekutina v ileocékální oblasti. Pro suspektní TMA byl chlapec k dalšímu vyšetření a léčbě přeložen na naši kliniku.
Z anamnézy
Chlapec se narodil nepříbuzným rodičům, z 1. gravidity, v termínu, porodní hmotnost byla 4350 g. Poporodní anamnéza i psychomotorický vývoj byly normální. Do 10 let věku měl častější respirační infekty, ve 3 letech věku podstoupil adenotomii.
V předchorobí neměl onemocnění ledvin. Studuje střední odborné učiliště (elektrikář). Žije v úplné rodině, nemá sourozence. Rodinná anamnéza je po stránce hematologických a renálních onemocnění nevýznamná.
Průběh onemocnění
Při přijetí na naši kliniku byl chlapec ve stabilizovaném stavu, spolupracoval, Glasgow coma scale bylo 15. Byl afebrilní, bez otoků, měl lehce zpomalený kapilární návrat, hematomy po krevních odběrech a ojediněle petechie na pažích, jinak byl bez kožních a slizničních krvácivých projevů. Měl serózní sekreci z nosu, prosáklý nosohltan a suše kašlal. Nález na hrudníku a břichu byl normální. Močil tmavou moč. Průjem neměl, nezvracel. Hodnota krevního tlaku byla na 95. percentilu.
V laboratoři trvala trombocytopenie 20 x 103/µl, objevila se lehká anémie (Hb 121 g/l), retikulocyty 0,007, schistocyty 8 %. Vysoká LD (nad 30 µkat/l) odpovídala diagnóze TMA. Byly přítomny známky akutního poškození ledvin, urea v séru 8 mmol/l, kreatinin 142 µmol/l. Vypočtená glomerulární filtrace (GFR) dle Schwartze byla 46 ml/min/1,73 m2. V moči dominovala hemoglobinurie při normální erytrocyturii a mírná proteinurie. Pro středně zvýšené CRP (35 mg/l), vyšší prokalcitonin (0,77 µg/l) a respirační infekt byl zajištěn antibiotikem (amoxicilin + kyselina klavulanová). Močil dostatečně, jen krátce potřeboval podporu diuretikem.
V rámci diferenciální diagnostiky TMA jsme vyšetřili Coombsův test (negativní), C3 a C4 v séru, ANA, lupus antikoagulans (LA) a antikardiolipinové protilátky (ACLA), vše s normálními hodnotami. Vyloučili jsme trombotickou trombocytopenickou purpuru (TTP), aktivita ADAMTS13 byla v normě. Dále byla vyloučena paroxysmální noční hemoglobinurie (PNH), vyšetření průtokovou cytometrií bylo negativní.
Na základě uvedených výsledků jsme stanovili pracovní diagnózu HUS. Vzhledem k dobrému klinickému stavu jsme chlapce dále léčili na našem pracovišti, v případě výrazného zhoršení bychom měli možnost podání eculizumabu nebo provedení plazmaferézy na dialyzačním pracovišti naší nemocnice. K vyloučení klasického (typického) STEC-HUS byla odeslána stolice na vyšetření shiga toxinu do Státního zdravotního ústavu Praha. Provedli jsme stěr z nosu, nosohltanu a rekta, průkaz antigenu Streptococcus pneumoniae v moči, ASLO, vyšetření PCR z nosohltanu na chřipku. K průkazu aHUS jsme odeslali krev na protilátky proti faktoru H a CD46 (membránový proteinový kofaktor, MCP) – obojí v Ústavu hematologie a krevní transfúze (ÚHKT) v Praze.
Klinický stav chlapce byl dobrý, byl afebrilní s dostatečnou diurézou a bez krvácivých projevů. Postupně se začaly upravovat laboratorní nálezy. Třetí den hospitalizace se začal zvyšovat počet trombocytů (48 x 103/µl), hodnota hemoglobinu byla jen lehce nižší (121 g/l) a leukocyty v normě (6,4 x103/µl). Začala klesat LD (24 µkat/l), upravovala se také renální funkce (urea 7 mmol/l, vypočtená GFR dle Schwartze 51 ml/min/1,73 m2).
Výsledek shiga toxinu ve stolici byl negativní, nejednalo se tedy o typický HUS. Kultivační mikrobiologická vyšetření i průkaz antigenu Streptococcus pneumoniae v moči byly negativní. ASLO bylo nízké (< 200 IU/ml). U pacienta byla prokázána chřipka A/H3, která mohla být buď nezávislá na HUS, nebo spouštěčem aHUS. Protilátky proti faktoru H byly negativní, ale byla opakovaně prokázána snížená exprese CD46 (MCP) na granulocytech (3,69 MFI, norma 7–16 MFI), což vedlo k podezření na komplementem zprostředkovaný HUS, jehož spouštěčem byla chřipka A. Do Zdravotního ústavu v Ostravě jsme odeslali krev k vyšetření na klasickou (CH50), alternativní (AH50) a lektinovou cestu komplementu (MBL). Výsledky byly v normálním rozmezí, což bylo zřejmě ovlivněno tím, že v době odeslání (7. den hospitalizace) byl již chlapec v částečné remisi HUS. Pacient byl nadále v dobrém klinickém stavu, upravovaly se laboratorní hodnoty (tab. 1). Pro hypertenzi kolem 95. percentilu byl ordinován ACE inhibitor – ramipril. Chlapec byl propuštěn do ambulantní léčby.
Pro podezření na komplementem zprostředkovaný HUS a riziko opakování aHUS byla indikována kompletní genetická analýza (membránový proteinový kofaktor – MCP, komplementární faktor H – CFH, komplementární faktor I – CFI, C3 složka komplementu, komplementární faktor B – CFB, trombomodulin – THBD). Toto vyšetření se v současnosti v ČR neprovádí, proto bylo po domluvě s revizním lékařem zdravotní pojišťovny realizováno v certifikované laboratoři v Budapešti. Výsledek vyšetření jsme obdrželi za necelé 3 měsíce. Bylo potvrzeno, že se jednalo o HUS zprostředkovaný komplementem. Pacient je heterozygot pro mutaci p.C35Y v genu MCP (CD46) a zároveň heterozygot pro rizikový MCPggaac haplotyp téhož genu. Předpokládáme, že uvedené genetické léze měly patogenní roli při vzniku aHUS a chřipka A byla spouštěčem onemocnění. Díky laskavosti prof. Prohászky byli v Research Laboratory v Budapešti geneticky vyšetření také rodiče pacienta, z nichž každý nese 1 vlohu – otec je heterozygot pro mutaci p.C35Y a matka heterozygot pro MCPggaac haplotyp genu MCP (CD46).
Remise trvala přibližně rok od první manifestace aHUS, při ambulantních kontrolách byly opakovaně normální laboratorní hodnoty (tab. 1) a při léčbě malou dávkou ACE inhibitoru normální krevní tlak. Za rok po první epizodě byl pacient přijat na naši kliniku pro relaps aHUS, který se projevil makroskopickou hematurií při respiračním infektu. Hoch byl ve stabilizovaném klinickém stavu, laboratoř (tab. 1). Léčili jsme jej opět symptomaticky. Tentokrát byla triggerem chřipka B (pozitivní PCR z nosohltanu). Od čtvrtého dne se pacient začal klinicky i laboratorně lepšit a dosáhl úplné remise onemocnění.
Table 1. Laboratorní hodnoty při epizodách aHUS a v remisi onemocnění. 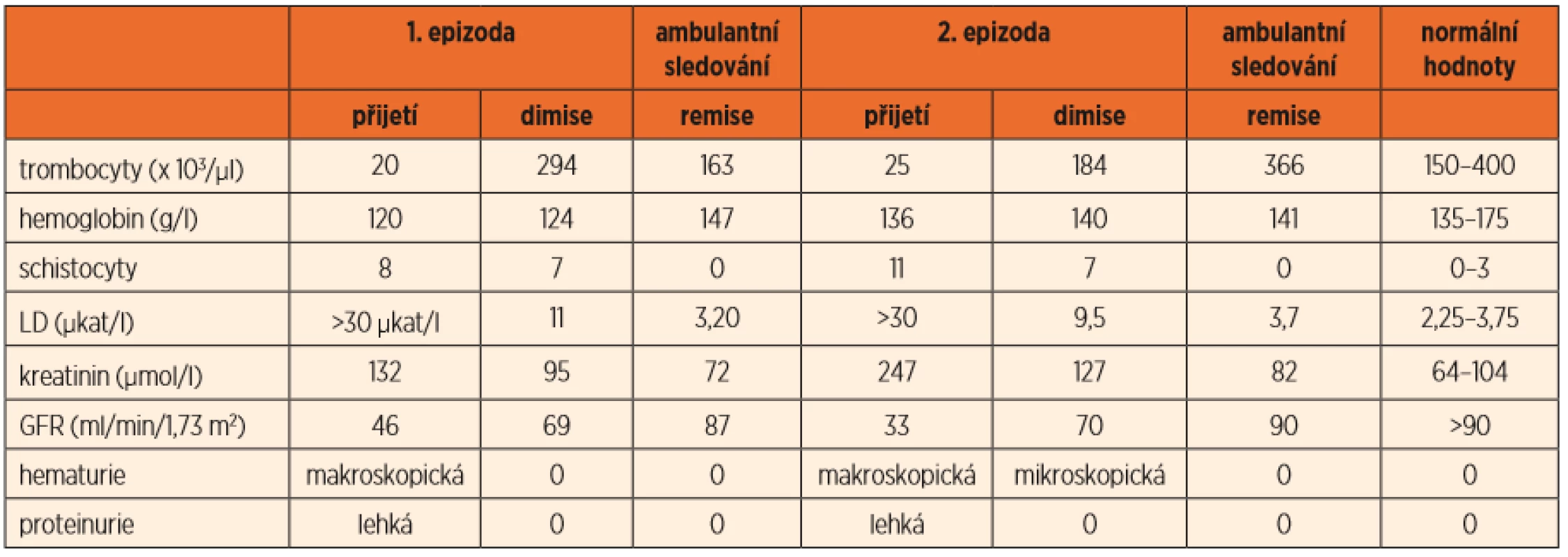
U chlapce nelze do budoucna vyloučit relaps aHUS, který může mít horší průběh než při první atace s potřebou plazmaferéz nebo eculizumabu. Proto byl pacient v 19 letech předán do specializovaného centra pro TMA (C4TMO, Klinika hematoonkologie, Fakultní nemocnice Ostrava) a bylo mu doporučeno preventivní očkování proti sezónní chřipce. Pacient u sebe nosí zdravotní bezpečnostní kartičku s informací o onemocnění v českém a anglickém jazyce (obr. 2).
Image 2. Zdravotní bezpečnostní kartička. 
DISKUSE
Atypický HUS tvoří asi 10 % všech případů HUS. Dochází k němu z důvodu nerovnováhy mezi aktivátory a regulátory alternativní cesty aktivace komplementu, kdy aktivátory převáží. K aktivátorům patří C3 složka komplementu a komplementární faktor B. Naopak regulátory jsou komplementární faktor H, komplementární faktor I, membránový proteinový kofaktor MCP/CD46 a trombomodulin. Při obraně organismu před vnějším útokem, např. bakteriemi, dochází k aktivaci komplementu a C3 složka se mění na aktivní C3b. Následuje opsonizace – C3b se váže na povrch mikrobů, dále tvorba C5b-9 komplexu, který způsobuje rozpad bakterií a uvolňují se anafylatoxiny C3a a C5a. Aby aktivace komplementu nebyla trvalá a nepoškozovala vlastní tkáně, regulují ji faktory cirkulující v plazmě CFH a CFI. Ochrannými faktory jsou také proteiny prezentované na povrchu endotelu, MCP a trombomodulin [2]. MCP je kofaktor faktoru I, který je zodpovědný za inaktivaci složek komplementu C3b a C4b, čímž chrání hostitelské buňky před poškozením komplementem [3]. Při poruše regulace komplementu dochází k jeho trvalé aktivaci a TMA.
Eculizumab je rekombinantní humanizovaná monoklonální IgG2/4K protilátka proti C5 složce komplementu. Je tvořena lidskou oblastí IgG2 a IgG4 a myší částí lehkých a těžkých řetezců. Eculizumab se váže na C5 složku komplementu, znemožňuje její štěpení na C5a a C5b a tím brání vzniku komplexu C5b-9, čili blokuje terminální cestu aktivace komplementu [2]. Mechanismus účinku eculizumabu ukazuje obrázek 3.
Image 3. Schéma efektu eculizumabu. Zablokováním C5 složky komplementu zabrání eculizumab vzniku terminálního komplexu a přeruší tak patologickou nekontrolovanou aktivaci komplementu. 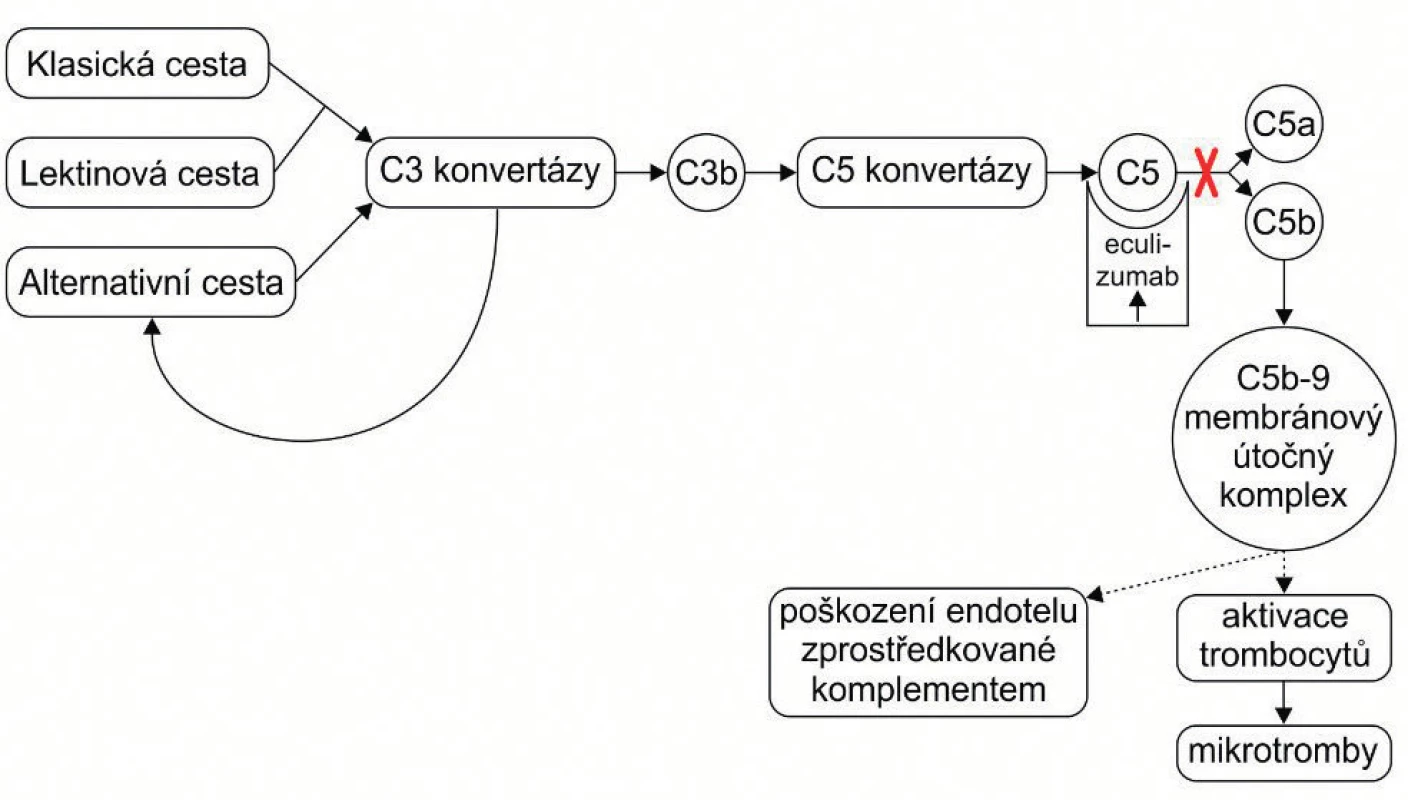
První úspěšná léčba aHUS eculizumabem byla popsána v roce 2009 [4]. Racionální je léčba eculizumabem u aHUS zprostředkovaného komplementem. Protože laboratorní a především genetické vyšetření vyžaduje určitý čas, a aHUS je akutní a často závažný stav, není pro zahájení léčby eculizumabem požadován průkaz genetické mutace. U dětí je doporučováno zahájení léčby do 48 hodin od začátku onemocnění, protože tato léčba je spojena s významným vzestupem počtu trombocytů a zlepšením funkce ledvin [5]. V ČR je k úhradě léčby eculizumabem potřebný souhlas revizního lékaře, takže zvlášť u dospělých nemocných je někdy nutné zahájit léčbu infuzemi plazmy nebo plazmaferézami při nedostupnosti eculizumabu (většina lékáren nemá eculizumab k dispozici ihned). Pokud je pacient ve vážném klinickém stavu, je léčba eculizumabem jednoznačně indikována. Nemocné ve stabilizovaném stavu lze léčit symptomaticky a s léčbou eculizumabem vyčkat. V rámci diferenciální diagnostiky je nezbytné vyloučit během 48 hodin TTP (vyšetření aktivity ADAMTS13), STEC-HUS (kultivace stolice, PCR ze stolice k detekci genů kódujících produkci shiga toxinů 1 a 2), koexistující autoimunitu, malignitu a infekci (obr. 1), což vyžaduje poměrně velké organizační úsilí. Je výhodné mít dopředu stanoven postup, v jakém sledu a kam rozeslat jednotlivá vyšetření podle možností dané lokality. Na našem pracovišti posíláme hned po vyloučení TTP vyšetření na protilátky proti faktoru H a expresi CD46 (MCP) na granulocytech, protože výsledek těchto vyšetření máme k dispozici rychle a tvorba protilátek proti faktoru H a mutace v MCP jsou relativně častými příčinami aHUS.
Je třeba mít na zřeteli, že infekce může být nezávislá na HUS, ale také vyvolávajícím faktorem epizody HUS u pacienta s poruchou regulace komplementu, u dětí se většinou jedná o mutaci v MCP [6]. Toto je i případ našeho pacienta, který byl na přelomu mezi dětským a dospělým věkem.
Dosud bylo publikováno více než 50 mutací v MCP asociovaných s aHUS, včetně mutace C35Y, zjištěné u našeho pacienta [7]. Publikovaná byla také kohorta českých pacientů s aHUS a mutací v MCP [8]. U nemocných s aHUS na podkladu mutace v MCP je sice popisována lepší prognóza např. oproti mutacím v CFH, jsou však časté relapsy a v časovém odstupu je selhání ledvin přítomno až u 10 % pacientů.
V literatuře jsou rovněž popsány případy asociace aHUS a chřipky A, většinou A/H1N1. Bud se jednalo o HUS asociovaný s infekcí Streptococcus pneumoniae, který následoval po infekci chřipkou A/H1N1, nebo o pacienty s genetickou poruchou komplementu, kdy chřipka A/H1N1 byla vyvolávajícím faktorem. HUS spojený se sezónní chřipkou A nebo B je podstatně vzácnější, ale také tito pacienti byli publikováni [9, 10], někteří z nich měli mutaci v MCP a byli úspěšně léčeni eculizumabem [10].
U našeho pacienta jsme léčbu eculizumabem zvažovali, ale nezahájili, protože byl v dobrém klinickém stavu. Než jsme stihli vyloučit TTP a STEC-HUS, začaly se zlepšovat laboratorní parametry (trombocyty, kreatinin), což nasvědčovalo incipientní remisi, ke které následně skutečně spontánně došlo. Také průkaz chřipky A nás vedl k tomu, že symptomatická léčba by mohla být dostačující. Až výsledek snížené exprese CD46 (MCP) na granulocytech vyvolal podezření, že by mohlo jít o komplementem zprostředkovaný aHUS. V té době však již byla jednoznačná tendence ke spontánní remisi aHUS.
ZÁVĚR
Eculizumab znamená nové období v léčbě aHUS, protože četným pacientům zachrání funkci ledvin a některým i život. Nicméně rozhodnutí, který pacient eculizumab potřebuje a který ne, se postupně optimalizuje na základě klinických zkušeností. U všech pacientů s aHUS má význam provedení genetického vyšetření ke zjištění mutací ovlivňujících komplement, protože to zlepší naše chápání patogeneze aHUS.
V této kazuistice jsme potvrdili, že u jedince s mutací v MCP může být sezónní chřipka vyvolávajícím faktorem aHUS a že je možná spontánní remise.
Došlo: 19. 3. 2019
Přijato: 27. 3. 2019
MUDr. Hana Flögelová, Ph.D.
Dětská klinika LF Univerzity Palackého
a Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: Hana.Flogelova@seznam.cz
Sources
1. Seeman T, Podracká L, Štolbová Š, et al. Trombotické mikroangiopatie – hemolyticko-uremické syndromy a trombotická trombocytopenická purpura. Čes-slov Pediat 2017; 72 (2): 99–108.
2. Ryšavá R. Atypický hemolyticko-uremický syndrom a nové možnosti léčby. Interní Med 2014; 16 (1): 22–25.
3. Noris M, Remuzzi G. Atypical hemolytic-uremic syndrome. N Engl J Med 2009; 361 (17): 1676–1687.
4. Schmidtko J, Peine S, El-Housseinin Y, et al. Treatment of atypical hemolytic uremic syndrome and thrombotic microangiopathies: a focus on eculizumab. Am J Kidney Dis 2013 Feb; 61 (2): 289–299.
5. Loirat Ch, Fakhouri F, Ariceta G, et al. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol 2016 Jan; 31 (1): 15–39.
6. Fremeaux BV, Fakhouri F, Garnier A, et al. Genetics and outcome of atypical hemolytic uremic syndrome: A nationwide French series comparing children and adults. Clin J Am Soc Nephrol 2013; 8 : 554–562.
7. Liszewski MK, Atkinson JP. Complement regulator CD46: genetic variants and disease associations. Hum Genomics 2015 Jun 10; 9 : 7.
8. Provaznikova D, Rittich S, Malina M, et al. Manifestation of atypical hemolytic uremic syndrome caused by novel mutations in MCP. Pediatr Nephrol 2012 Jan; 27 (1): 73–81.
9. Bitzan M, Zieg J. Influenza associated thrombotic microangiopathies. Pediatr Nephrol 2018 Nov; 33 (11): 2009–2025.
10. Kobbe R, Schild R, Christner M, et al. Case report-atypical hemolytic uremic syndrome triggered by influenza B. BMC Nephrology 2017 Mar 20; 18 (1): 96.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 2-
All articles in this issue
- Editorial: Když si děti hrají, někdy z toho problém mají
- Cizí tělesa v polykacích cestách u dětí
- Pevné exogénne cudzie telesá v dolných dýchacích cestách u detí
- Aspirovaná cizí tělesa u dětí – kazuistiky
- Hračka – bezpečný předmět na dětských odděleních?
- Stravovací a pohybové zvyklosti v rodině – ověření reliability dotazníku
- Léčba trombotických příhod u novorozenců a kojenců
- Stanovenie hladín sukcinylacetónu u časti zdravej detskej populácie na Slovensku
- Opakovaná spontánní remise atypického hemolyticko-uremického syndromu vyvolaného chřipkou – kazuistika
- Hyponatriémia – vzácna komplikácia nefrotického syndrómu
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Moje úsmevné spomienky na Olomouc
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cizí tělesa v polykacích cestách u dětí
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Léčba trombotických příhod u novorozenců a kojenců
- Aspirovaná cizí tělesa u dětí – kazuistiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

