-
Medical journals
- Career
Prenatální detekce srdečních vad a její důsledky
: V. Tomek 1; J. Gilík 1; H. Jičínská 2,5; J. Pavlíček 3; J. Navrátil 2; D. Čutka 4; P. Vlašín 5; M. Lacinová 4; J. Marek 1; J. Škovránek 1
: Dětské kardiocentrum FN Motol a 2. LF UK, Praha 1; Dětská kardiologie Pediatrické kliniky FN Brno a LF Masarykovy univerzity, Brno 2; Oddělení dětské a prenatální kardiologie, Klinika dětského lékařství FN Ostrava 3; Centrum lékařské genetiky s. r. o., České Budějovice 4; Centrum prenatální diagnostiky, Brno 5
: Čes-slov Pediat 2018; 73 (5): 284-290.
:
Cíl studie:
Posoudit úspěšnost prenatální diagnostiky vrozených srdečních vad a zjistit, jaký je důsledek ukončování těhotenství na změnu postnatálního spektra srdečních vad.
Metody:
Počet prenatálně detekovaných srdečních vad jsme porovnávali se známou incidencí srdečních vad u dětí (studie M. Šamánka – BOSS). Obdobným způsobem jsme posuzovali úspěšnost záchytu jednotlivých srdečních vad v letech 2006–2015 a určili významnost změn v jejich počtu při ukončování gravidity.
Výsledky:
Záchytnost srdečních vad se v posledních 5 letech v ČR pohybuje mezi 39–49 %. Z celkového počtu zjištěných 2358 srdečních vad se pro ukončení gravidity rozhodlo 1093 (46,3 %) těhotných, u nichž extrakardiální vadu mělo 526 (48,1 %) plodů. Fetálně jsme zachytili všechny plody se společnou komorou, atrioventrikulárním defektem a hypoplazií levého srdce. Celoplošně se zvyšuje i záchytnost kritických vad – transpozicí velkých tepen (48 %) a koarktací (35 %). Vzhledem k vysokému počtu ukončených těhotenství se signifikantně snižuje počet většiny VSV postnatálně: kompletního atrioventrikulárního defektu, syndromu hypoplazie levého srdce, dvojvýtokové pravé komory, Fallotovy tetralogie, aortální stenózy, atrézie plicnice, arteriálního trunku, společné komory a Ebsteinovy anomálie.
Závěr:
Prenatální detekce srdečních vad v České republice je díky vybudovanému propojení screeningu a specializovaného echokardiografického vyšetření vysoká. Ukončování těhotenství z důvodu diagnózy srdečního postižení vede ke změně spektra většiny srdečních vad u dětí. Signifikantně se snižují postnatální diagnózy závažnějších a/nebo komplexních vad s častými extrakardiálními defekty.
Klíčová slova:
vrozená srdeční vada, prenatální diagnóza, echokardiografie, plod
ÚVOD
Hlavním smyslem prenatální detekce vrozených srdečních vad (VSV) je odhalení kritických vad ohrožujících zdraví nebo i život novorozenců a diagnostika komplexních onemocnění srdce, která mohou významně ovlivnit dlouhodobou morbiditu a mortalitu pacientů. Intrauterinní vyšetření tak díky včasné a přesné diagnóze zlepšuje přežívání dětí s VSV. Na druhé straně je ale příčinou jejich výrazné redukce díky častému ukončování těhotenství, což mění spektrum narozených dětí se srdečními vadami.
Organizace fetální kardiologie
Záchyt a diagnostika srdečních vad spočívá v návaznosti screeningového a specializovaného echokardiografického vyšetření. Screeningové vyšetření srdce je součástí prenatálního ultrazvukového vyšetření ve druhém a limitovaně i v prvém trimestru. Jeho cílem je odlišení fyziologického nálezu od patologie určením základní srdeční anatomie a funkce. Screeningové vyšetření je prováděno především gynekology, ale podílí se na něm i genetici, dětští kardiologové nebo také neonatologové. Pro posouzení základní srdeční anatomie je důležité zejména zobrazení symetrických srdečních oddílů (4-dutinová projekce) a správné odstupy velkých tepen. Není-li srdeční anatomie normální, má být těhotná odeslána na podrobné vyšetření ke specialistovi v prenatální kardiologii. Logickou indikací specializovaného vyšetření tak je nejen přímo nález srdeční vady, ale i podezření na ni, nebo jen nejistota ohledně správné anatomie a funkce srdce.
Screeningový program, který je založený na multidisciplinární spolupráci, nyní existuje ve většině rozvinutých zemí. Z doporučení ISUOG (The International Society of Ultrasound in Obstetrics and Gynecology) pro ultrazvukové vyšetření plodu vyplývá, že k efektivnosti takového systému výrazně napomáhá nízký práh při doporučení k echokardiografickému vyšetření u specialisty na prenatální kardiologii [1]. Obdobný doporučující přístup zastává i AIUM (The American Institute of Ultrasound in Medicine) a AEPC (Association for European Paediatric Cardiology) [2].
Etiologii vrozených srdečních vad přesně neznáme. Protože ani identifikace rizikových faktorů nevyloučí možnost přítomné srdeční vady u plodu, je screeningové vyšetření všech těhotných v prenatální diagnostice klíčové. Nález nebo podezření na vadu při screeningovém vyšetření je nejsilnějším „rizikovým faktorem“ přítomnosti srdeční vady. Existuje ale celá řada vlivů, které riziko nálezu VSV u plodu dále zvyšují [3]. Rizikové faktory zahrnují vlivy ze strany matky, rodiny a plodu. Tato rizika, spadající do kategorie I a IIa (level of evidence) a zvyšující riziko VSV o ≥3 %, jsou logicky indikacemi ke spe-cializovanému prenatálnímu kardiologickému vyšetření tak, jak vycházejí z doporučení ISUOG, AIUM a AEPC.
A. Riziko ze strany matky a rodiny
metabolické vady matky (diabetes mellitus, fenylketonurie), užívání léků v graviditě (např. antiepileptika, antidepresiva, nesteroidní kyselina retinová), in vitro fertilizace, vícečetné těhotenství, prodělané infekce v graviditě (dětské virové choroby, cytomegalovirus, parvovirus, toxoplazmóza, event. další), autoimunní onemocnění matky s přítomností autoprotilátek třídy SSA/antiRo a SSB/antiLa, přítomnost vrozených srdečních vad nebo kardiomyopatie u matky, otce, sourozenců a prarodičů, chromosomální aberace, syndromy a jiná genetická postižení, jako např. myopatie, Marfanův syndrom.
B. Rizikové faktory ze strany plodu
abnormální nález při screeningu srdce (přítomná srdeční vada, podezření na srdeční vadu nebo nejasný nález na srdci), srdeční arytmie nebo abnormální srdeční frekvence (<100/min, >180/min), extrakardiální vrozená vývojová vada, chromosomální vada, hydrops, zvýšená antiflogistika), teratogeny v graviditě (lithium, nuchální translucence, absence ductus venosus, vícečetné těhotenství, nevysvětlitelný polyhydramnion, trikuspidální regurgitace v 1. trimestru, syndrom feto-fetální transfuze, absence nosní kůstky.
Cílem specializovaného vyšetření, prováděného erudovaným dětským kardiologem, je přesné určení srdeční vady. Její klíčovou součástí je adekvátní informování rodičů o povaze, léčebných možnostech a prognóze onemocnění s návrhem a zajištěním správné léčby včetně organizace porodu a následné postnatální léčby.
Specializované vyšetření dětským kardiologem a „counseling“
Za absolutní indikací ke specializovanému echokardiografickému vyšetření dětským kardiologem je nález srdeční vady nebo i podezření na ni. Falešná pozitivita srdeční vady rozhodně není při screeningovém vyšetření chybou. Je vždy lepší odeslat těhotnou ke specializovanému vyšetření „zbytečně“ než vadu přehlédnout. Ještě větší hrubou chybou je ale vytvářet mylné nebo dokonce neexistující diagnózy srdečních vad a z nich plynoucí závěry, na jejichž chybném základě těhotné ženy mohou unáhleně volit možnost ukončení těhotenství.
Správná diagnóza srdeční vady je pouze nezbytným předpokladem pro stanovení prognózy a následnou konzultaci s rodiči o dalším osudu těhotenství. Proto má být prováděna dětským kardiologem s adekvátními zkušenostmi v prenatální diagnostice a léčbě dětí se srdečními vadami. Rozhodnutí o dalším osudu plodu včetně eventuální úvahy o ukončení gravidity má být plně v kompetenci rodičů, kteří jsou zodpovědní za své dosud nenarozené dítě. Finální diagnostika a s ní související informování o možnostech léčby a prognóze srdeční vady má tedy zcela zásadní význam pro další osud těhotenství.
Diagnóza srdeční vady plodu je pro rodiče (zejména matku) velmi traumatizující a stresující záležitost. Je proto nutné při pohovoru s rodiči jednat citlivě a být připraven na to, že takový „counseling“ vyžaduje dostatek času, mnohdy opakované návštěvy a konzultace s dalšími lékaři a jinými zdravotnickými specialisty (kontaktní sestra, psycholog).
VÝSLEDKY PRENATÁLNÍ DIAGNOSTIKY SRDEČNÍCH VAD
Metodika posouzení úspěšnosti detekce srdečních vad a jejich vlivu na postnatální incidenci VSV
Pro posouzení úspěšnosti prenatálního záchytu VSV používáme srovnání se známou prospektivní studií o postnatální incidenci vad v ČR – BOSS (BOhemia Survival Study) prof. Šamánka [4]. V rámci této studie bylo vyšetřeno všech 815 569 živě narozených dětí v Čechách v období 1980–1990 a stanovena prevalence jednotlivých srdečních vad. Studie probíhala v době, kdy prenatální selekce ještě neměla podstatnější vliv na spektrum dětí se srdeční vadou. Prevalence všech srdečních vad byla stanovena 6,16 VSV na 1000 živě narozených dětí. Za kritické VSV (celkem 35 % všech srdečních vad, 2,36/1000 živě narozených dětí) považujeme ty, které ohrožují dítě po narození významnou hypoxémií, těžkým srdečním selháním nebo kombinací obou příznaků.
Statistická analýza
Pro analýzu jsme používali SigmaStat 3.5, Systat Software Inc. (San Jose, Kalifornie, USA). Soubory byly testovány na normalitu rozložení. Pro posouzení rozdílu v prenatálním a postnatálním spektru vad byl použit párový t-test nebo Mannův-Whitneyho sum test. Za statisticky významné rozdíly byly považovány parametry s p <0,05.
Celkové výsledky prenatální detekce srdečních vad v České republice
V letech 1986–2015 se v ČR živě narodilo 3 280 604 dětí a intrauterinně byl dokumentován nález srdeční vady u celkem 3812 plodů v gestačním stáří od 13. do 41. týdne (medián 20. týden). Pro srovnání prenatálního záchytu s postnatální prevalencí nebyly pro posouzení úspěšnosti detekce započítávány diagnózy, které je z povahy fetální cirkulace nemožné intrauterinně odhalit, a to tepenná dučej a sekundum defekt septa síní. Úspěšnost fetální detekce se průběžně zvyšovala a v posledních 5 letech se prenatální záchyt všech VSV pohyboval v rozmezí 39–49 % (graf 1). Detekce kritických vad (postnatální prevalence 2,36/1000 živě narozených dětí) se pohybuje mezi 80–90 % z očekávaných srdečních vad v daném roce.
1. Vývoj prenatální detekce vrozených srdečních vad (VSV) v letech 1986–2015. 
Úspěšnost prenatální detekce VSV (2006–2015)
Porovnali jsme počty prenatálně detekovaných jednotlivých typů vad s předpokládaným počtem těchto vad u dětí narozených v daném roce v posledním analyzovaném 10letém období 2006–2015. Fetálně jsme zachytili >100 % plodů se společnou komorou a atrio-ventrikulárním septálním defektem, 100 % plodů s hypoplazií levého srdce, 86 % arteriálních trunků, 73 % Ebsteinových anomálií, 65 % Fallotových tetralogií, 59 % plodů s dvojvýtokovou pravou komorou, 48 % plodů s transpozicí velkých arterií a 35 % s koarktací (tab. 1). V uvedeném období 2006–2015 byl prenatálně nejčastěji detekovanou vadou defekt komorového septa (302 plo-dů/12,8 %), atrioventrikulární defekt (288/12,2 %), syndrom hypoplazie levého srdce (234 plodů/8,9 %), transpozice velkých tepen (178/7,5 %, dvojvýtoková pravá komora (164/7,0 %), Fallotova tetralogie (153/6,5 %) a aortální stenóza (163/5,7 %) (tab. 1). Nejméně často fetálně odhalenou vadou byl izolovaný totální anomální návrat plicních žil (3 případy).
1. Úspěšnost prenatální detekce nejčastějších srdečních vad 2006–2015. 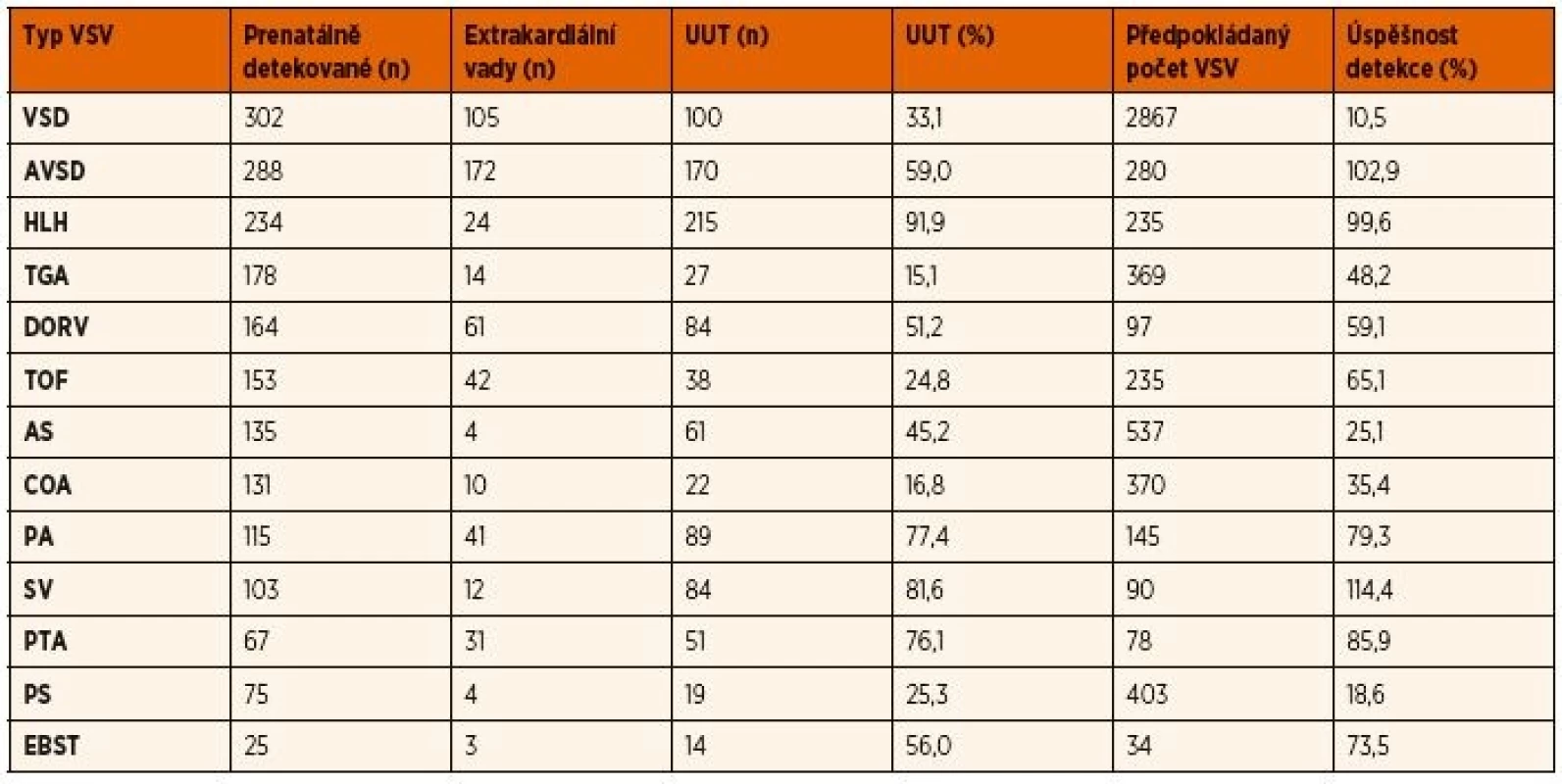
Srdeční vady jsou řazeny podle frekvence jejich prenatálního výskytu. Předpokládaný počet VSV je vypočten podle jejich postnatální incidence (studie M. Šamánka – BOSS).
UUT – umělé ukončení těhotenství, VSD – defekt komorového septa, AVSD - atrioventrikulární defekt, HLH – syndrom hypoplazie levého srdce, TGA – transpozice velkých arterií, DORV – dvojvýtoková pravá komora, TOF – Fallotova tetralogie, AS – aortální stenóza, COA – koarktace aorty, PA – atrézie plicnice, SV – společná komora, PTA – arteriální trunkus, PS – stenóza plicnice, EBST – Ebsteinova anomálieZ celkového počtu 2358 srdečních vad byla u 576 (24,4 %) nalezena extrakardiální vada (genetická anomálie a/nebo orgánová vada). Pro ukončení gravidity se rozhodlo 1093 (46,3 %) těhotných, u 526 (48,1 %) z nich měl plod extrakardiální vadu. Z pokračujících těhotenství došlo k intrauterinnímu úmrtí u 67 plodů (2,8 %).
Vysoký počet uměle ukončených těhotenství (UUT) se srdeční vadou má významný dopad na jejich postnatální prevalenci (graf 2). V letech 2006–2015 tak došlo ke statisticky signifikantně významnému snížení výskytu většiny typů srdečních vad: kompletního atrioventrikulárního defektu, syndromu hypoplazie levého srdce, dvojvýtokové pravé komory, Fallotovy tetralogie, aortální stenózy, atrézie plicnice, arteriálního trunku, společné komory a Ebsteinovy anomálie. Vliv ukončení těhotenství u defektu komorového septa, koarktace aorty, transpozice velkých tepen a stenózy plicnice neovlivnil významně jejich počet po narození. U těchto vad se jedná o dobře léčitelná onemocnění s obvykle dobrou prognózou.
2. Změna v postnatálním spektru vrozených srdečních vad v letech 2006–2015. Statistická významnost (p) mezi předpokládaným počtem VSV a předpokládaným počtem novorozenců po odečtení ukončených těhotenství. AVSD (p <0,001) – atrioventrikulární defekt, HLH (p <0,001) – syndrom hypoplazie levého srdce, TGA (ns) – transpozice velkých arterií, DORV (p <0,001) – dvojvýtoková pravá komora, TOF (p = 0,02) – Fallotova tetralogie, AS (p <0,001) – aortální stenóza, COA (ns) – koarktace aorty, PA (p <0,001) – atrézie plicnice, SV (p <0,001) – společná komora, PTA (p <0,001) – arteriální trunkus, PS (ns) – stenóza plicnice, EBST (p <0,001) – Ebsteinova anomálie 
Všechny případy ukončení těhotenství u defektu komorového septa byly z důvodů závažné extrakardiální vady a srdeční vada nebyla jejich primární příčinou. Nejčastěji byla těhotenství ukončována s vadou: syndrom hypoplastického levého srdce (UUT v 91,9 % případů), společná komora (81,6 %), atrézie plicnice (77,4 %), arteriální trunkus (76 %), atrioventrikulární defekt (59 %) a Ebsteinova anomálie (56 %).
DISKUSE
Jaký je důsledek prenatální detekce srdečních vad?
Česká republika patří mezi první země, kde byl zahájen celoplošný prenatální screening srdečních vad [5]. Centralizace péče, velmi dobrá kvalita primárního screeningu prováděného gynekology a spolupráce s dětskými kardiology, specializujícími se na prenatální echokardiografii, vede k vysoké záchytnosti VSV, která patří mezi nejvyšší v rámci celé Evropy [6, 7]. Proto vnímáme snahu části odborné gynekologické veřejnosti o absolutní autonomii při vyšetřování těhotných jako přímo ohrožující skvěle vybudovaný systém prenatální detekce VSV. I když je pojmenována řada známých rizikových faktorů pro vznik srdeční vady, jejich absence možnost vzniku VSV u plodu vůbec nevylučuje. Např. různé metody in vitro fertilizace ale zvyšují, i přes prováděnou preimplantační diagnostiku, riziko srdeční vady 2–3násobně [8]. Při porovnání s postnatální frekvencí jednotlivých vad jsou fetálně častěji zachyceny komplexní vady (syndrom hypoplazie levého srdce, atrézie plicnice, společná komora) a VSV, které jsou spojeny se závažnými extrakardálními vadami včetně chromosomálních, typicky se jedná o atrioventri-kulární defekt nebo dvojvýtokovou pravou komoru [9].
Hlavním přínosem a smyslem prenatální kardiologie je detekce kritické vady plodu s následným porodem dítěte s VSV ve specializovaném centru („transport in utero“). Tím je umožněna okamžitá péče o nemocného novorozence a odpadá prodlení vznikající oddálenou postnatální diagnostikou a transportem dítěte, které by mohlo být až v bezprostředním ohrožení života. Řada studií včasný přínos fetální diagnózy na prognózu dítěte potvrdila [10, 11], zhruba obdobné množství studií takový prenatální vliv popírá [12, 13] a argumentuje současnou dostupností kvalitní péče o novorozence. Druhou možností při prenatální diagnóze VSV je právo rodičů rozhodnout se pro ukončení gravidity z důvodu závažné diagnózy se špatnou nebo nejistou prognózou dítěte. V našem souboru se pro ukončení gravidity rozhodlo 46 % rodičů.
Ukončování gravidity v ČR z důvodu srdeční vady plodu patří mezi nejvyšší v Evropě [14] a v procentech zůstává i v posledních letech stejně vysoké. Důvody pro vysoké ukončování gravidity jsou spekulativní: může jím být celkové naladění společnosti s nízkým prahem pro ukončení gravidity obecně, domnělá či skutečně chybějící zdravotnická a sociální podpora rodin s „postiženými“ dětmi, jejich nepřijetí společností a strach zejména matek z rozpadu manželského/partnerského vztahu. Často se i setkáváme s tím, že těhotné při screeningovém vyšetření dostávají nesprávné informace o povaze srdeční vady a je jim vyšetřujícími lékaři doporučeno ukončení těhotenství, buď na základě chybné diagnózy nebo nesprávné interpretaci závažnosti vady. A to i v případě léčitelné vady (kterých je naprostá většina) s dobrou prognózou. Nehledě na to, že oprávnění lékaře doporučit ukončení těhotenství je přinejmenším velmi diskutabilní. Prvotní informace o povaze srdeční vady je často klíčová pro rozhodování rodičů a dalším osudu těhotenství [15]. Je nesmírně složité následně vyvracet buď chybnou diagnózu VSV, nebo sice správně stanovenou diagnózu, ale prezentovanou s mylnou prognózou odvozenou četbou z mnoha let starých učebnic. Správná diagnóza srdeční vady je pouze nezbytným předpokladem pro stanovení prognózy a konzultaci s rodiči o dalším osudu těhotenství. Diagnóza srdeční vady musí být vždy potvrzena dětským kardiologem, který je plně erudován v prenatální péči. Z našich zkušeností víme, že přesnost prenatální diagnostiky je vysoká, ale určit přesný způsob postnatální léčby a prognózu je mnohdy obtížné [16].
Ukončování těhotenství z důvodu diagnózy závažné VSV vede ke změně spektra dětí se srdečními vadami, kde se signifikantně snižují postnatální počty závažnějších a/nebo komplexních vad (syndrom hypoplazie levého srdce, atrézie plicnice, společný arteriální trunkus a další). K ukončení gravidity při srdeční vadě nepochybně přispívá časté extrakardiální postižení plodu [17]. V naší studii mělo 48 % ukončených těhotenství s VSV další vrozenou vývojovou vadu včetně chromosomální. Riziko genetického postižení je poměrně vysoké, u jednotlivých srdečních vad se liší. Některé vady riziko chromosomálních aberací nepředstavují (transpozice velkých arterií) a jiných je vysoké [18]: atrioventrikulární defekt (46–73 %), arteriální trunkus (19–78 %), dvojvýtoková pravá komora (6–43 %).
V posledních letech zaznamenáváme zvýšený počet VSV detekovaných v prvním trimestru [19]. Známým faktem je, že prevalence VSV v nízkém gestačním stáří je vyšší a přítomnost srdeční vady je i častou příčinou intrauterinního úmrtí [20]. Úspěšnou detekcí vad v 1. trimestru se však může falešně zvyšovat záchytnost vad u plodů, se kterými bychom se již při druhotrimestrálním vyšetření nesetkali. Typickým příkladem v našem souboru je „více než stoprocentní“ záchyt společné komory a atrioventrikulárního defektu v porovnání s jejich známou postnatální incidencí. Na druhé straně se v 1. trimestru odhalí řada plodů s chromosomálními anomáliemi, na jejichž podkladě se gravidita ukončí [21]. U nich předpokládáme zvýšený výskyt VSV, které nejsou vždy detekovány buď pro nemožnost nálezu vady v nízkém gestačním týdnu, nebo pro absenci důvodu po VSV dále pátrat [22]. Ve 13.–14. týdnu je možné vcelku spolehlivě diagnostikovat některé typy vad, jako např. syndrom hypoplastického levého srdce, společnou komoru nebo atrioventrikulární defekt [23].
U řady vad ale přesnou diagnózu stanovit v 1. trimestru nelze a je nutná kontrola v další fázi těhotenství. Tím se ale zároveň dostáváme pod tlak ze strany rodičů, kteří naléhají na určení jasné diagnózy a prognózy, aby mohli co nejdříve rozhodnout o dalším osudu svého těhotenství [24]. Tlak na brzké stanovení diagnózy může vést ke snaze nutit se do závěrů za každou cenu s rizikem závažných chyb.
Fetální intervence u srdečních vad – budoucnost nebo slepá cesta?
Úvahy o fetálních intervencích se týkají srdečních vad, jejichž přirozený vývoj vede k hypoplazii nebo ireverzibilní poruše srdeční komory, hypoplazii tepny a/nebo chlopně. Typicky se jedná o kritickou aortální stenózu, která může vést až k hypoplazii levého srdce (na principu „kde není adekvátní krevní průtok, není správný růst dané části srdce“) [25], nebo k dilataci dysfunkční levé komory s ischemickým postižením (endokardiální fibro-elastóza). Smysl intrauterinní katetrizační balonkové valvuloplastiky aortální chlopně je v zachování růstu levé komory s možností biventrikulární postnatální korekce a zábraně nezvratných změn levé komory vedoucích k její systolické a diastolické dysfunkci. Výsledky této fetální katetrizační intervence nejsou jednoznačné a jsou zatíženy vysokou mortalitou a morbiditou plodů i narozených dětí [26]. Zřejmě i proto, že kritická aortální stenóza s fibroelastózou dysfunkční a často malé komory je velmi závažné srdeční postižení, jejíž léčebné výsledky nejsou ani postnatálně povzbudivé. Fetální balonkové valvuloplastiky aortální stenózy se v ČR neprovádí. Od roku 2017 indikované případy referujeme na pracoviště v Linci, dosud se jedná o 4 těhotné. Intrauterinní katetrizační intervence vyžaduje další studie pro prokázání dlouhodobého efektu. Je ale příslibem toho, že existuje varianta ovlivnění nepříznivého vývoje srdeční vady již před narozením a není nutné čekat na porod dítěte s již hypoplastickou nebo dysfunkční dilatovanou komorou [27].
ZÁVĚR
Prenatální detekce srdečních vad v České republice je díky vybudovanému propojení screeningu a specializovaného echokardiografického vyšetření vysoká a patří mezi nejvyšší na světě vůbec. Ukončování těhotenství z důvodu diagnózy srdečního postižení vede ke změně spektra většiny srdečních vad u dětí. Signifikantně se snižují postnatální diagnózy závažnějších a/nebo komplexních vad s častými extrakardiálními defekty.
Podpořeno MZ ČR – RVO, FN Motol 00064203.
MUDr. Viktor Tomek, Ph.D.
Dětské kardiocentrum FN Motol
a 2. LF UK
V Úvalu 84
150 06 Praha 5
e-mail: viktor.tomek@fnmotol.cz
Sources
1. Carvalho JS, Allan LD, Chaoui R, et al. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart International Society of Ultrasound in Obstetrics and Gynecology, Ultrasound Obstet Gynecol 2013 Mar; 41 (3): 348–359.
2. Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014 May 27; 129 (21): 2183–2242.
3. Pavlicek J, Klaskova E, Prochazka M, et al. Congenital heart defects according to the types of the risk factors–a single center experience. J Matern-Fetal Neo M 2018, doi: 10.1080/14767058.2018.1468883.
4. Šamánek M, Břešťák M, Škovránek J. Prenatální kardiologie. Čs Pediat 1986; 41 : 478–480.
5. Šamánek M, Voříšková M. Congenital heart disease among 815,569 children born between 1980 and 1990 and their 15-year survival: A prospective Bohemia survival study. Pediatr Cardiol 1999; 20 (6): 411–417.
6. Levy DJ, Pretorius DH, et al. Improved prenatal detection of congenital heart disease in an Integrated Health Care System. Pediatr Cardiol 2013; 34 : 670–679.
7. Marek J, Tomek V, Škovránek J, et al. Prenatal ultrasound screening of congenital heart disease in an unselected population: A 21-year experience. Heart 2011 Jan; 97 (2): 124–130.
8. Tararbit K, Houyel L, Bonnet D, et al. Risk of congenital heart defects associated with assisted reproductive technologies: a population-based evaluation. Eur Heart J 2011; 32, 500–508.
9. Pavlíček J, Klásková E, Doležálková E, et al. Vývoj prenatální diagnostiky vrozených srdečních vad, zisk z jednotlivých ultrazvukových projekcí. Čes Gynek 2018; 83 (1): 17–23.
10. Bonnet D, Coltri A, Butera G, et al. Detection of transposition of the great arteries in fetuses reduces neonatal morbidity and mortality. Circulation 1999; 99 : 916–918.
11. Calderon J, Angeard N, Moutier S, et al. Impact of prenatal diagnosis on neurocognitive outcomes in children with transposition of great arteries. J Pediatr 2012 Jul; 161 (1): 94–98.
12. Landis BJ, Levey A, Levasseur SM, et al. Prenatal diagnosis of congenital heart disease and birth outcomes. Pediatr Cardiol 2013 Mar; 34 (3): 597–605.
13. Khoshnood B, Lelong N, Houyel L, et al. Impact of prenatal diagnosis on survival of newborns with four congenital heart defects: a prospective, population-based cohort study in France (the EPICARD Study). BMJ Open 2017 Nov 8; 7 (11): e018285.
14. Tararbit K, Bui TT, Lelong N, et al. Clinical and socioeconomic predictors of pregnancy termination for fetuses with congenital heart defects: a population-based evaluation. Prenat Diagn 2013; 33 (2): 179–186.
15. Carlsson T, Bergman G, Wadensten B, et al. Experiences of infmational needs and received information following a prenatal diagnosis of congenital heart defect. Prenat Diagn 2016 Jun; 36 (6): 515–522.
16. Bensemlali M, Stirnemann J, Le Bidois J, et al. Discordancies between pre-natal a post-natal diagnosis of congenital heart diseaseas and impact on care strategies. J Am Coll Cardiol 2016 Aug 30; 68 (9): 921–930.
17. Ge Groote K, Vanhie E, Roets E, et al. Outcome after prenatal and postnatal diagnosis of complex congenital heart defects and the infulence of genetic aomalies. Prenat Diagn 2017 Oct; 37 (10): 983–991.
18. Song MS, Hu A, Dyamenahalli U, et al. Extracardiac lesions and chromosomal abnormalities associated with major fetal heart defects: comparison of intrauterine, postnatal and postmortem diagnoses. Ultrasound Obstet Gynecol 2009 May; 33 (5): 552–559.
19. Carvalho JS. Screening for heart defects in the first trimester of pregnancy: food for thought. Ultrasound Obstet Gynecol 2010; 36 : 658–660.
20. Gerlis LM. Cardiac malformations in spontaneous abortions. Int J Cardiol 1985; 7 : 29–43.
21. Engelbrechtsen L, Brøndum-Nielsen K, Ekelund C, et al. Detection of triploidy at 11-14 weeks‘ gestation: a cohort study of 198 000 pregnant women. Ultrasound Obstet Gynecol 2013; 42 (5): 530–535.
22. Wright D, Spencer K, Kagan K, et al. First-trimester combined screening for trisomy 21 at 7–14 weeks‘ gestation. Ultrasound Obstet Gynecol 2010; 36 : 404–411.
23. Jicinska H, Vlasin P, Jicinsky M, et al. Does first trimester screening modify the natural history of congenital heart disease? Analysis of outcome of regional cardiac screening at 2 different time periods. Circulation 2017 Mar 14; 135 (11): 1045–1055.
24. Larsson AK, Svalenius EC, Marsal K, et al. Parents’ worried state of mind when fetal ultrasound shows an unexpected finding: a comparative study. J Ultrasound Med 2009; 28 : 1663–1670.
25. Sedmera D, Pexieder T, Rychterova V, et al. Remodeling of chick embryonic ventricular myoarchitecture under experimentally changed loading conditions. Anat Rec 1999; 254 : 238–252.
26. Freud LR, McElhinney DB, Marshall AC, et al. Fetal aortic valvuloplasty for evolving hypoplastic left heart syndrome: postnatal outcomes of the first 100 patients. Circulation 2014 Aug 19; 130 (8): 638–645.
27. Gardiner HM, Kovacevic A, Tulzer G, et al. Natural history of 107 cases of fetal aortic stenosis from a European multicenter retrospective study. Ultrasound Obstet Gynecol 2016 Sep; 48 (3): 373–381.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2018 Issue 5-
All articles in this issue
- Prenatal detection of congenital heart defects and its consequences
- Screening for sudden cardiac death in children: Useful tool or wishful thinking?
- Management of sudden cardiac death in the young patients
- The incidence of congenital heart defects – the impact of prenatal diagnosis
- Body dissatisfaction in the third trimester of pregnancy
- Early onset anorexia nervosa, diagnostics and treatment
- Turner syndrome and anomalies of the aortic arch in four different ways
- Local reactions after snakebite – clinical experience
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Early onset anorexia nervosa, diagnostics and treatment
- The incidence of congenital heart defects – the impact of prenatal diagnosis
- Prenatal detection of congenital heart defects and its consequences
- Local reactions after snakebite – clinical experience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

