-
Medical journals
- Career
Identifikace prediktivních faktorů časného relapsu onemocnění u dětských pacientů s Crohnovou chorobou léčených thiopuriny
Authors: T. Dršková; O. Hradský; J. Bronský
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN Motol, Praha
Published in: Čes-slov Pediat 2017; 72 (5): 282-289.
Category:
Overview
Crohnova choroba (CD) je společně s ulcerózní kolitidou řazena mezi zánětlivá střevní onemocnění (IBD). IBD je skupina chronicky probíhajících onemocnění s významně narůstající incidencí, vedoucí k omezení běžné životní aktivity a možnou nutností opakovaných hospitalizací.
Léčba CD v dětském věku probíhá nejčastěji ve dvou základních krocích. Jako první je zahájena tzv. indukce remise, která je téměř okamžitě následována dlouhodobou udržovací imunosupresivní léčbou. Tou jsou na základě aktuálních doporučení převážně thiopuriny. Podle publikovaných dat přibližně 50 % pacientů dospěje do relapsu onemocnění do dvou let od zahájení této léčby. Na základě dostupných studií, provedených mezi dospělými pacienty, má správná volba terapeutického postupu a tím zamezení progrese zánětu již na začátku onemocnění významný vliv na další progresi a dlouhodobý průběh nemoci. Možnost správně vybrat vhodné pacienty, kteří by z léčby thiopuriny profitovali, nebo naopak včasně zahájit anti-TNF léčbu u těch, kteří jsou v riziku, časného relapsu či komplikace onemocnění, je v současné době u dětských i dospělých pacientů omezená.KLÍČOVÁ SLOVA:
zánětlivá střevní onemocnění, IBD, Crohnova choroba, thiopuriny, relaps, komplikace, predikce, prediktor1. ÚVOD
Zánětlivá střevní onemocnění (IBD) tvoří skupinu několika onemocnění s ne zcela jasnou etiologií, jejichž incidence, zvláště mezi dětskými pacienty, významně narůstá [1]. Počet všech nemocných je v evropské populaci v současné době odhadován na více než 3 000 000 [2, 3]. Chronicky probíhající střevní zánět, s typickými relapsy onemocnění, významně snižuje kvalitu života nemocného a může vést k nutnosti opakovaných hospitalizací. Roční terapie IBD v Evropě stojí více než 5 miliard eur [3, 4].
Dominantní příznaky onemocnění obvykle vyplývají z postižení gastrointestinálního traktu. Nejčastěji se jedná o časté řídké stolice s možnou příměsí hlenu a krve, tenesmy, bolesti břicha a nadýmání [5]. U dětí dochází k poruchám růstu, výživy a puberty [6]. Vedle postižení gastrointestinálního traktu se IBD může manifestovat i v jiných orgánových systémech, mezi častější patří např. onemocnění kůže, kloubů, zrakového aparátu nebo jater [7, 8]. Klinická manifestace a průběh nemoci je do značné míry ovlivněn včasnou diagnostikou a zahájením správného terapeutického postupu [9, 10].
2. ZÁKLADNÍ PŘÍSTUP K LÉČBĚ CROHNOVY NEMOCI (CD) U DĚTÍ
Podle aktuálního doporučení [11] ECCO (European Crohns and Colitis Organisation) a ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) je po diagnóze [12] zvolen jeden ze tří základních terapeutických scénářů. Podle čeho volit konkrétní terapeutický postup, není v současné době jasně definované. V běžné klinické praxi se řídíme spíše celkovým obrazem a závažností onemocnění v době diagnózy (obr. 1). Ta je hodnocena na základě kombinace klinického stavu, antropometrických údajů, laboratorních parametrů a především nálezů z endoskopických, zobrazovacích a histologických vyšetření. Z doporučení vyplývá, že většina pacientů spadá do druhé kategorie a je tedy indikována k dlouhodobé imunosupresivní léčbě thiopuriny. V tomto případě je současně s dlouhodobou udržovací léčbou zahájena i tzv. indukce remise. Metodou volby indukční léčby je podle aktuálních doporučení výlučná enterální výživa (EEN), nebo v případě její intolerance kortikosteroidy (CS) [11]. Za předpokladu, že dlouhodobá udržovací terapie byla zahájena při diagnóze, nemá ve chvíli dosažení remise zvolený způsob indukční terapie (EEN či CS) pravděpodobně vliv na dobu jejího udržení [13, 14].
Image 1. Možnosti udržovací léčby u dětských pacientů s Crohnovou chorobou. 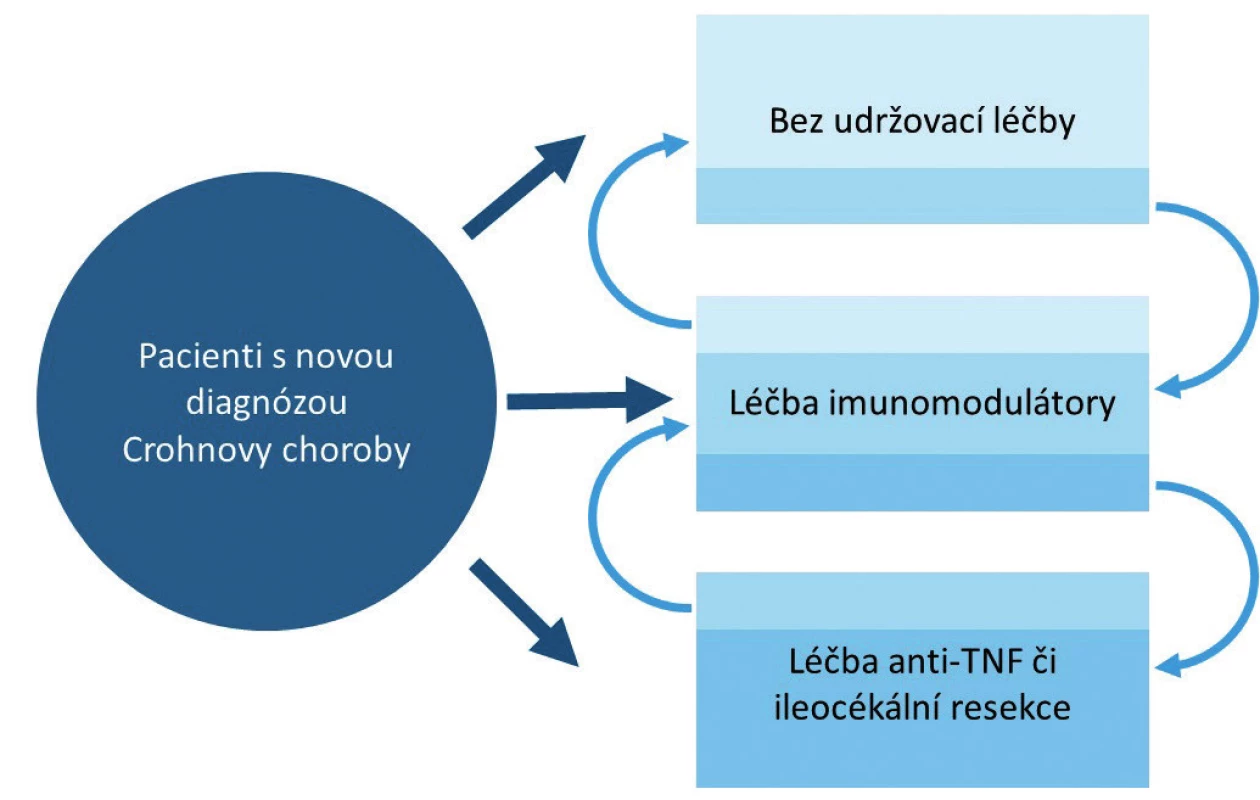
Další, méně početná skupina pacientů, je tvořena těmi, kteří na základě intenzity a rozsahu svého onemocnění vyžadují maximálně intenzifikovaný terapeutický postup již v době diagnózy. Tímto postupem může být zahájení léčby anti-TNF preparáty, popř. indikace k chirurgickému výkonu. V současné době je jedinou poměrně rozšířenou indikací k podávání anti-TNF preparátů v době diagnózy perianální fistulující onemocnění. Poslední, v pediatrické populaci téměř neexistující skupina sestává z pacientů s natolik mírným postižením, že v době diagnózy nevyžadují žádnou dlouhodobou imunosupresivní léčbu [11].
Největší část dětských pacientů s nově diagnostikovanou CD je tedy indikována k léčbě azathioprinem (AZA) nebo jeho metabolitem 6-merkaptopurinem (6-MP). Na podkladě jediné kontrolované zaslepené randomizované studie, která byla v pediatrické populaci provedena, udrželo remisi po 2 letech trvání léčby 6-MP přibližně 90 % pacientů [15]. Výsledky dalších recentně provedených studií, většinou v retrospektivním designu, se ve svém pozorování liší. Podle těchto studií došlo k relapsu onemocnění do 2 let od zahájení léčby AZA/6-MP přibližně u 50 % dětských pacientů [13, 14, 16, 17].
3. VÝZNAM MOŽNÉ PREDIKCE ČASNÉHO RELAPSU NA LÉČBĚ AZA/6-MP
Podle recentně provedených studií u dospělých pacientů má míra progrese zánětu bezprostředně v době po stanovení diagnózy významný vliv na dlouhodobou prognózu nemoci. Časný a správně zvolený terapeutický postup tak může zásadně ovlivnit další průběh nemoci [10].
Maximálně intenzivní terapeutický přístup – včetně podávání anti-TNF preparátů – je způsob, jakým lze v indikovaných případech zásadně přispět k prevenci progrese onemocnění a rozvoji komplikací [18, 19]. Na druhé straně, užívání anti-TNF preparátů má i svá omezení a rizika. Mezi hlavní nevýhody patří vysoká cena léčiv a omezená doba účinku. Podle dat získaných ze studií, které byly provedeny na dospělé populaci, téměř polovina (43 %) pacientů léčených anti-TNF preparáty ztratí odpověď na léčbu do 2 let od jejího zahájení [20]. Mezi dětskými pacienty byla tato ztráta odpovědi zaznamenána u 39 % v 60. týdnu léčby [21]. Riziko rozvoje nežádoucích účinků u anti-TNF léčby a léčby thiopuriny se liší. Zatímco v případě podávání thiopurinů bylo zaznamenáno především mírně zvýšené riziko výskytu některých malignit, nejčastější nežádoucí účinky, které se mohou objevit u pacientů léčených anti-TNF preparáty, jsou běžné i oportunní infekce [22, 23]. Souvislost mezi užíváním anti-TNF preparátů a zvýšením rizika rozvoje maligního onemocnění nebo velmi vážného průběhu infekce nebyla v recentním systematickém přehledu nalezena [22]. Oproti tomu léčba AZA/6-MP s sebou nese dále zvýšené riziko rozvoje intolerance a reakcí alergického typu (až 25 %), abnormálních jaterních testů (34 %), suprese maturace buněk v kostní dření (7 %), akutní pankreatitidy (7 %) a zvracení (6 %) [24, 25]. Imunosupresivní léčba stejně jako chronicky probíhající zánět mají velmi pravděpodobně podíl také na rozvoji lymfoproliferativních onemocnění. Ačkoliv je komplikované odlišit, která ze dvou složek se na vzniku lymfoproliferace podílí více, podle dostupných dat se zdá riziko rozvoje lymfoproliferativního onemocnění v asociaci s thiopruriny tři až pětkrát pravděpodobnější [26–28].
Table 1. Prediktory komplikovaného průběhu CD. 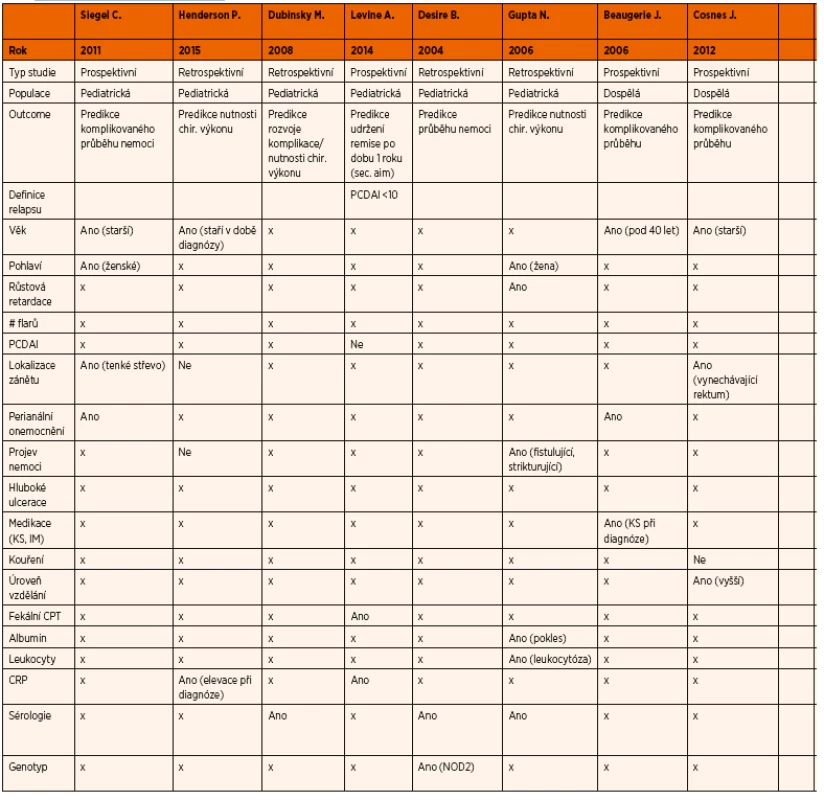
Vzhledem k možným, výše zmíněným nežádoucím účinkům, ceně preparátů a riziku ztráty odpovědi na podávané léčivo je tedy nutné indikovat anti-TNF preparáty velmi uvážlivě. Zásadním úkolem je správně identifikovat jedince, kteří budou z časného nasazení anti-TNF preparátů maximálně profitovat. Léčba by měla být cílená, co nejefektivnější a přitom bezpečná.
4. JIŽ ZNÁMÉ PREDIKTIVNÍ FAKTORY KOMPLIKOVANÉHO PRŮBĚHU ONEMOCNĚNÍ/ČASNÉHO RELAPSU PŘI LÉČBĚ AZA/6-MP
A) Prediktory komplikovaného průběhu CD
Prediktivní faktory obecně komplikovaného průběhu onemocnění nejsou v dětské populaci dosud spolehlivě definované. Podstatně lépe jsou popsány u pacientů s CD dospělého věku. Proto vycházíme z dat získaných u dospělých pacientů i při predikci průběhu onemocnění u dětí [11]. Mezi uvažované prediktivní faktory patří: mladý věk v době diagnózy, extenzivní forma nemoci, postižení horní části gastrointestinálního traktu, loklalizace zánětu v ileu, perianální postižení, strikturující nebo penetrující forma CD, záchyt hlubokých ulcerací při endoskopickém vyšetření, kouření, nutnost užívání systémových kortikosteroidů v době diagnózy, specifická sérologická odpověď, varianty genu NOD2 [9, 29–38]. Jako možné parametry predikující komplikovaný průběh nemoci u dětských pacientů byly zatím zkoumány následující: věk v době diagnózy, pohlaví, růstová retardace, PCDAI (Paediatric Crohn’s Disease Activity Index), specifické chování nemoci, lokalizace onemocnění, perianální postižení, hladina CRP a fekálního kalprotektinu v době diagnózy, míra imunitní reakce, určité formy genotypu.
Table 2. Prediktory selhání léčby thiopuriny. 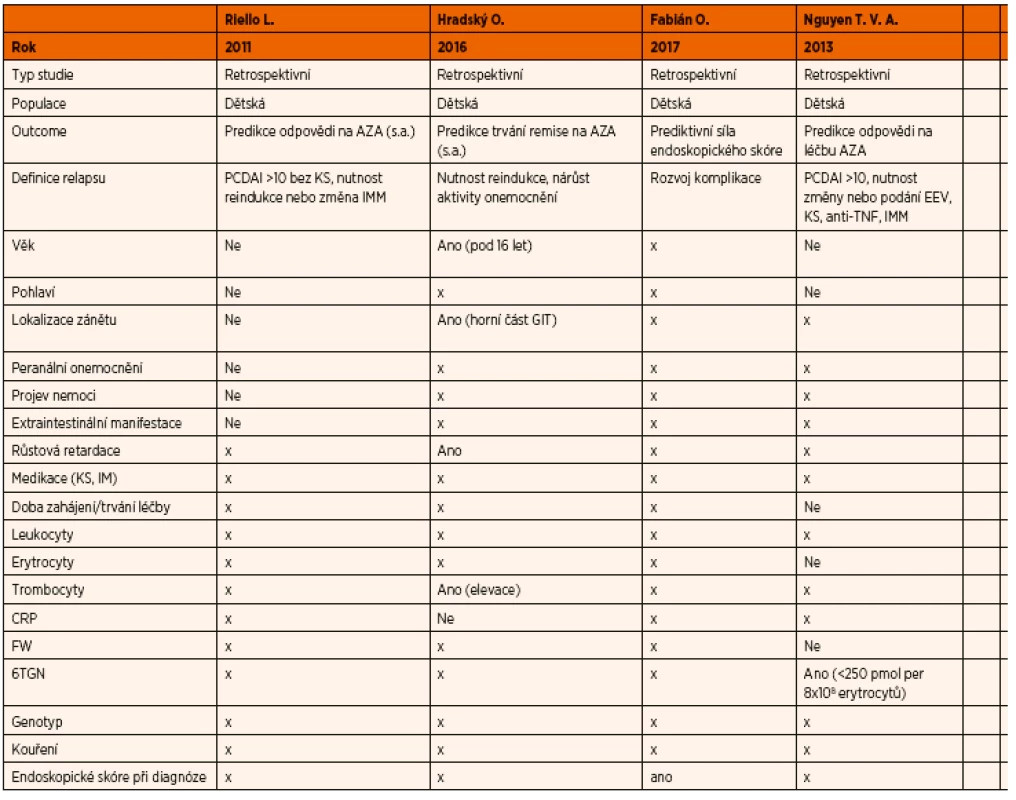
Studie zabývající se tímto tématem nejsou ve svých výsledcích jednotné a parametry, které by spolehlivě predikovaly komplikovaný průběh dětského IBD, nejsou stále jasně vymezené. Podle některých studií byly vyšší věk v době diagnózy, ženské pohlaví, růstová retardace v době diagnózy, lokalizace onemocnění v tenkém střevě, SES-CD, perianální postižení, zvýšená hladina CRP a fekálního kalprotektinu v době diagnózy, zvýšená imunitní reakce a varianty genu NOD2 hodnoceny jako parametry s možnou prediktivní silou vzhledem k dalšímu průběhu nemoci [39–45].
Ačkoliv jsou obecné prediktory důležité, vždy se jedná o data získaná u již léčených pacientů, jejichž léčba je upravována právě podle tíže onemocnění, a neumožňují tak hodnotit přirozený průběh nemoci. Z toho důvodu je přesnějsí hledat prediktory ve spojení vždy s kontrétním terapeutickým postupem.
B) Prediktory selhání léčby AZA/6-MP
Klinických, endoskopických, laboratorních nebo genetických parametrů, které byly systematicky zkoumány v souvislosti s nedostatečnou odpovědí dětských pacientů na léčbu AZA/6-MP, není mnoho. Mezi tyto faktory patří: věk v době diagnózy, lokalizace postižení gastrointestinálního traktu při diagnóze, hladina trombocytů v době remise, růsová retardace v době diagnózy a endoskopické skóre v době diagnózy.
Studie, které se těmito faktory zabývaly, obě provedené v retrospektivním designu, se ve svých výsledcích liší. Věk pod 16 let v době diagnózy byl podle jedné z nich prokázán jako faktor s prediktivní hodnotou časného relapsu při léčbě AZA/6-MP, stejně tak růstová retardace a lokalizace zánětu v horní části gastrointestinálního systému v době diagnózy byly prediktivní k časnému relapsu při užívání AZA/6-MP, trombocytóza (>440x109/l) v době remise byla podle stejné studie asociována s vyšší pravděpodobností špatné odpovědi na léčbu AZA/6-MP [14]. Podle jiné studie neměl žádný z těchto parametrů dostatečnou prediktivní hodnotu [13]. V jiné recentní práci [45], která se primárně zabývala prediktivní hodnotou histologického skóre, se jako prediktivní jevilo endoscopické skóre (simple endoscopic score) v době diagnózy.
Mezi pravděpodobné faktory určující časný relaps nemoci na léčbě AZA/6-MP u dospělých pacientů patří: starší věk, lokalizace onemocnění v kolon, penetrující půběh nemoci, neutropenie v krevním obraze, určité formy genotypu [5, 46, 47].
5. DALŠÍ RECENTNĚ PUBLIKOVANÉ PARAMETRY S MOŽNOU PREDIKČNÍ HODNOTOU
Současné možnosti predikce průběhu onemocnění a především odpovědi na konkrétní terapeutický režim jsou v dětské i dospělé populaci omezené. Spektrum parametrů, které by tímto způsobem mohly být využity, není zdaleka vyčerpáno a stále je pátráno po nových faktorech. V poslední době je uvažováno např. o sérovém kalprotektinu (SC) [4], střevním mikrobiomu [48], nebo asociaci některých parametrů se specifickými variantami genotypu [49].
SC byl s možnou predikcí dalšího průběhu onemocnění v minulosti již několikrát spojován. Ve dvou případech šlo o souvislost s jiným chronickým onemocněním – v prvním případě s revmatoidní artritidou a ve druhém s cystickou fibrózou. V případě revmatoidní artritidy byl SC hodnocen jako nezávislý faktor korelující s radiologicky sledovanou progresí nemoci [50]. U pacientů léčených pro cystickou fibrózu predikovalo sledování změn hladin SC rozvoj exacerbace onemocnění a zhoršení plicních funkcí [51, 52]. I v rámci IBD se podle recentně provedené studie SC projevil jako faktor korelující s celou řadou dalších běžně sledovaných parametrů, které odpovídají aktivitě onemocnění. Pozitivní asociace byla popsána mezi SC a CRP a počtem neutrofilů v krevním obraze. Naopak negativně byl SC asociován s hladinou albuminu a hemoglobinu. Signifikantní asociace byla prokázána také mezi SC a fekálním kalprotektinem (FC). Hlavní výhodou SC oproti FC je předpoklad snazšího rutinního zpracování v běžné praxi a lepší adherence pacientů k odběru vzorku [4]. Podle stejné studie kombinace zvýšené hladiny CRP nad 24 mg/l, pokles albuminu pod 26 g/l a elevace SC nad 991 ng/ml signifikantně predikovala nutnost eskalace léčby [4]. V těchto případech se však nejedená o predikci v pravém slova smyslu, neboť zvýšení těchto parametrů již vyjadřuje aktivitu onemocnění na určité léčbě a k relapsu již došlo, jen zatím nemá klinickou odezvu.
Střevní mikrobiom ve spojení s běžně dostupnými klinickými parametry významně přispívá k přesnosti predikce obecného průběhu onemocnění. Podle recentně provedené studie byla predikční síla běžně sledovaných faktorů – CRP a léčba podávaná od stanovení diagnózy – nižší, pokud nebyla do modelu přidána informace o stavu střevního mikrobiomu [48].
Z genetických faktorů se zdají nejsilnějšími prediktory varianty genu NOD2. Nicméně podle recentně provedené studie je hlavním faktorem asociace mezi komplikovaným průběhem nemoci a genetickými variantami NOD2 jejich vazba na věk pacienta a lokalizaci onemocnění v době diagnózy. Tyto parametry samy o sobě naznačují komplikovaný průběh onemocnění [49]. Vyjádření rizika rozvoje komplikovaného průběhu nemoci se na základě genetických faktorů podle stejné studie zdá být nejsilněji asociováno právě s lokalizací CD [49].
6. ZÁVĚR
Možnost predikovat průběh nemoci a především odpovědi na konkrétní terapeutický režim je v době stanovení diagnózy CD v současné době nedostatečná jak u dětských, tak dospělých pacientů. Jak vyplývá z dostupných dat, správná volba terapeutického postupu a tím včasné zamezení progrese zánětu může mít významný vliv na další průběh nemoci a případný rozvoj komplikací, a to zvláště u pacientů dětského věku.
Identifikování parametrů, které by mohly buď samostatně, nebo v kombinaci umožnit výše zmiňovanou predikci, je třeba dále věnovat pozornost. Zdá se že, žádný z již sledovaných prediktorů není sám o sobě dostatečně silný, aby podle něj bylo možno rozhodnout o strategii léčby. Bude tedy třeba nejprve tyto slabší prediktory identifikovat a poté se pokusit vytvořit vhodnou kombinací těchto faktorů predikční model. K tvorbě takového modelu je však zapotřebí velké množství pacientů a tak lze předpokládat, že podobná studie je realizovatelná pouze jako mezinárodní multicentrická.
Podpořeno MZ ČR – RVO, FN Motol 00064203 a GA UK 364617, 136215 a 246216.
MUDr. Tereza Dršková
Pediatrická klinika 2. LF UK
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: tereza.drskova@fnmotol.cz
Sources
1. Benchimol EI, Fortinsky KJ, Gozdyra P, et al. Epidemiology of pediatric inflammatory bowel disease: a systematic review of international trends. Inflamm Bowel Dis 2011; 17 : 423–439.
2. Burisch J. Crohn‘s disease and ulcerative colitis. Occurrence, course and prognosis during the first year of disease in a European population-based inception cohort. Dan Med J 2014; 61: B4778.
3. Burisch J, Jess T, Martinato M, et al. The burden of inflammatory bowel disease in Europe. J Crohns Colitis 2013; 7 : 322–337.
4. Kalla R, Kennedy NA, Ventham NT, et al. Serum Calprotectin: A novel diagnostic and prognostic marker in inflammatory bowel diseases. Am J Gastroenterol 2016; 111 : 1796–1805.
5. Lund JL, Cook SF, Allen JK, et al. Patterns of 6-mercaptopurine and azathioprine maintenance therapy among a cohort of commercially insured individuals diagnosed with Crohn‘s disease in the United States. Clinical Epidemiology 2013; 5 : 501–512.
6. Mason A, Malik S, McMillan M, et al. A Prospective longitudinal study of growth and pubertal progress in adolescents with inflammatory bowel disease. Horm Res Paediatr 2014; 83 : 45–54.
7. Cardile S, Alterio T, Candusso M, et al. Autoimmune liver diseases and inflammatory bowel diseases in children: current issues and future perspectives. Scand J Gastroenterol 2017; 52 : 662–667.
8. Greuter T, Bertoldo F, Rechner R, et al. Extraintestinal manifestations of pediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2017 Aug: 65 (2): 200–206.
9. Torres J, Caprioli F, Katsanos KH, et al. Predicting outcomes to optimize disease management in inflammatory bowel diseases. J Crohns Colitis 2016; 371 : 660–667.
10. Pariente B, Cosnes J, Danese S, et al. Development of the Crohn‘s disease digestive damage score, the Lémann score. Inflamm Bowel Dis 2011; 17 : 1415–1422.
11. Ruemmele FM, Veres G, Kolho KL, et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn‘s disease. J Crohns Colitis 2014; 8 : 1179–1207.
12. Levine A, Koletzko S, Turner D, et al. The ESPGHAN revised Porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2013; 58 : 1.
13. Riello L, Talbotec C, Garnier-Lengliné H, et al. Tolerance and efficacy of azathioprine in pediatric Crohn‘s disease. Inflamm Bowel Dis 2011; 17 : 2138–2143.
14. Hradsky O, Copova I, Zarubova K, et al. Time to relapse in children with Crohn‘s disease treated with Azathioprine and nutritional therapy or corticosteroids. Dig Dis Sci 2016 : 61 (7): 2041–2050.
15. Markowitz J, Grancher K, Kohn N, et al. Alimentary tract. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn‘s disease. Materials and methods. Gastroenterology 2000; 119 : 895–902.
16. Punati J, Markowitz J, Lerer T, et al. Effect of early immunomodulator use in moderate to severe pediatric Crohn disease. Inflamm Bowel Dis 2008; 14 : 949–954.
17. Jaspers GJ, Verkade HJ, Escher JC, et al. Azathioprine maintains first remission in newly diagnosed pediatric Crohn‘s disease. Inflamm Bowel Dis 2006; 12 : 831–836.
18. D‘Haens G, Baert F, van Assche G, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn‘s disease: an open randomised trial. Lancet 2008; 371 : 660–667.
19. Peyrin-Biroulet L, Bigard MA, Malesci A, et al. Step-up and top-down approaches to the treatment of Crohn‘s disease: early may already be too late. Gastroenterology 2008; 135 : 1420–1422.
20. Chaparro M, Panes J, García V, et al. Long-term durability of infliximab treatment in Crohn‘s disease and efficacy of dose „escalation“ in patients losing response. J Clin Gastroenterol 2011; 45 : 113–118.
21. Ruemmele FM, Lachaux A, Cézard J-P, et al. Efficacy of infliximab in pediatric Crohn‘s disease: a randomized multicenter open-label trial comparing scheduled to on demand maintenance therapy. Inflamm Bowel Dis 2009; 15 : 388–394.
22. Bonovas S, Fiorino G, Allocca M, et al. Biologic therapies and risk of infection and malignancy in patients with inflammatory bowel disease: A systematic review and network meta-analysis. Clin Gastroenterol Hepatol 2016; 14 : 1385–1397.
23. de Bie CI, Escher JC, de Ridder L. Antitumor necrosis factor treatment for pediatric inflammatory bowel disease. Inflamm Bowel Dis 2012; 18 : 985–1002.
24. Hindorf U, Lindqvist M, Hildebrand H, et al. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006; 24 : 331–342.
25. Gearry RB, Barclay ML, Burt MJ, et al. Thiopurine drug adverse effects in a population of New Zealand patients with inflammatory bowel disease. Pharmacoepidemiol Drug Saf 2004; 13 : 563–567.
26. Beaugerie L, Brousse N, Bouvier AM, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet (London, England) 2009; 374 : 1617–1625.
27. Kandiel A, Fraser AG, Korelitz BI, et al. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut 2005; 54 : 1121–1125.
28. Magro F, Peyrin-Biroulet L, Sokol H, et al. Extra-intestinal malignancies in inflammatory bowel disease: Results of the 3rd ECCO Pathogenesis Scientific Workshop (III). J Crohns Colitis 2014; 8 : 31–44.
29. Beaugerie L, Seksik P, Nion-Larmurier I, et al. Predictors of Crohn‘s disease. Gastroenterology 2006; 130 : 650–656.
30. Cosnes J, Bourrier A, Nion-Larmurier I, et al. Factors affecting outcomes in Crohn‘s disease over 15 years. Gut 2012; 61 : 1140–1145.
31. Romberg-Camps MJL, Dagnelie PC, Kester ADM, et al. Influence of phenotype at diagnosis and of other potential prognostic factors on the course of inflammatory bowel disease. Am J Gastroenterol 2009; 104 : 371–383.
32. Thia KT, Sandborn WJ, Harmsen WS, et al. Risk factors associated with progression to intestinal complications of Crohn‘s disease in a population-based cohort. Gastroenterology 2010; 139 : 1147–1155.
33. Targan SR, Landers CJ, Yang H, et al. Antibodies to CBir1 flagellin define a unique response that is associated independently with complicated Crohn‘s disease. Gastroenterology 2005; 128 : 2020–2028.
34. Abreu MT, Taylor KD, Lin Y-C, et al. Mutations in NOD2 are associated with fibrostenosing disease in patients with Crohn‘s disease. Gastroenterology 2002; 123 : 679–688.
35. Louis E, Michel V, Hugot JP, et al. Early development of stricturing or penetrating pattern in Crohn‘s disease is influenced by disease location, number of flares, and smoking but not by NOD2/CARD15 genotype. Gut 2003; 52 : 552–557.
36. Alvarez-Lobos M, Arostegui JI, Sans M, et al. Crohn‘s disease patients carrying Nod2/CARD15 gene variants have an increased and early need for first surgery due to stricturing disease and higher rate of surgical recurrence. Ann Surg 2005; 242 : 693–700.
37. Tarrant KM, Barclay ML, Frampton CMA, et al. Perianal disease predicts changes in Crohn‘s disease phenotype-results of a population-based study of inflammatory bowel disease phenotype. Am J Gastroenterol 2008; 103 : 3082–3093.
38. Lakatos PL, Czegledi Z, Szamosi T, et al. Perianal disease, small bowel disease, smoking, prior steroid or early azathioprine/biological therapy are predictors of disease behavior change in patients with Crohn‘s disease. World J Gastroenterol 2009; 15 : 3504–3510.
39. Siegel CA, Siegel LS, Hyams JS, et al. Real-time tool to display the predicted disease course and treatment response for children with Crohn‘s disease. Inflamm Bowel Dis 2011; 17 : 30–38.
40. Henderson P, Kennedy NA, Van Limbergen JE, et al. Serum C-reactive protein and CRP genotype in pediatric inflammatory bowel disease: influence on phenotype, natural history, and response to therapy. Inflamm Bowel Dis 2015; 21 : 596–605.
41. Levine A, Turner D, Pfeffer Gik T, et al. Comparison of outcomes parameters for induction of remission in new onset pediatric Crohn‘s disease: evaluation of the porto IBD group "growth relapse and outcomes with therapy" (GROWTH CD) study. Inflamm Bowel Dis 2014; 20 : 278–285.
42. Dubinsky MC, Kugathasan S, Mei L, et al. Increased immune reactivity predicts aggressive complicating Crohn‘s disease in children. Clin Gastroenterol Hepatol 2008; 6 : 1105–1111.
43. Desir B, Amre DK, Lu S-E, et al. Utility of serum antibodies in determining clinical course in pediatric Crohn‘s disease. Clin Gastroenterol Hepatol 2004; 2 : 139–146.
44. Gupta N, Cohen SA, Bostrom AG, et al. Risk factors for initial surgery in pediatric patients with Crohn’s disease. Gastroenterology 2006; 130 : 1069–1077.
45. Fabian O, Hradsky O, Potuznikova K, et al. Low predictive value of histopathological scoring system for complications development in children with Crohn‘s disease. Pathol Res Pract 2017; 213 : 353–358.
46. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review. Gut 2002; 50 : 485–489.
47. Koifman E, Karban A, Mazor Y, et al. Thiopurine effectiveness in patients with Crohn‘s disease: a study of genetic and clinical predictive factors. Inflamm Bowel Dis 2013; 19 : 1639–1644.
48. Gevers D, Kugathasan S, Denson Lee A, et al. The treatment-naive microbiome in new-onset Crohn’s disease. Cell Host & Microbe 2014; 15 : 382–392.
49. Cleynen I, Boucher G, Jostins L, et al. Inherited determinants of Crohn‘s disease and ulcerative colitis phenotypes: a genetic association study. Lancet 2016; 387 : 156–167.
50. Hammer HB, Odegard S, Syversen SW, et al. Calprotectin (a major S100 leucocyte protein) predicts 10-year radiographic progression in patients with rheumatoid arthritis. Ann Rheum Dis 2010; 69 : 150–154.
51. Reid PA, McAllister DA, Boyd AC, et al. Measurement of serum calprotectin in stable patients predicts exacerbation and lung function decline in cystic fibrosis. Am J Respir Crit Care Med 2015; 191 : 233–236.
52. Gray RD, Imrie M, Boyd AC, et al. Sputum and serum calprotectin are useful biomarkers during CF exacerbation. J Cyst Fibros 2010; 9 : 193–198.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 5-
All articles in this issue
- Enterální výživa v léčbě idiopatických střevních zánětů
- Identifikace prediktivních faktorů časného relapsu onemocnění u dětských pacientů s Crohnovou chorobou léčených thiopuriny
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
- Monogénová obezita u detí na Slovensku
- Uzlinový syndrom u nemoci z kočičího škrábnutí u dětí ošetřených na Klinice infekčního lékařství v Ostravě
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Fatální meningokoková sepse způsobená Neisseria meningitidis séroskupiny W
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Enterální výživa v léčbě idiopatických střevních zánětů
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



