-
Medical journals
- Career
Pepsín v sekrétoch horných dýchacích ciest u detí ako marker extraezofágového refluxu
: T. Strachan 1,2; J. Melter 2; A. Barabasová 2; M. Miškovská 2; P. Ferenc 2; J. Fábry 2; Peter Bánovčin 1
: Klinika detí a dorastu Jesseniovej lekárskej fakulty Univerzity Komenského v Bratislave a Univerzitnej nemocnice, Martin 1; Šrobárov ústav detskej tuberkulózy a respiračných chorôb, n. o., a Klinika detskej TBC a respiračných chorôb JLF UK, Dolný Smokovec 2
: Čes-slov Pediat 2017; 72 (3): 176-181.
: Original Papers
Účel štúdie:
Extraezofágové prejavy gastroezofágovej refluxovej choroby (GERD) predstavujú rôznorodú skupinu symptómov a ochorení, u ktorých sa predpokladá podiel refluxu na ich vzniku, udržiavaní alebo zhoršovaní. Naším cieľom bolo poukázať na problematiku extraezofágového refluxu (EER) u detí a predstaviť naše skúsenosti s vyšetrovaním pepsínu v slinách pomocou imunochromatografickej metódy – PeptestTM.Metódy:
Výskum sme realizovali prostredníctvom 2 rôznych súborov pacientov. V prvom súbore 39 detských pacientov s podozrením na GERD sme korelovali výsledky Peptestu s 24-hodinovou pH metriou pažeráka. V druhom 62-člennom súbore detí so suspektnými prejavmi EER bolo u každého jednotlivca realizované ORL vyšetrenie a kvantitatívne vyšetrenie pepsínu z dvoch vzoriek slín. Jednotlivé výstupy realizovaných vyšetrení boli korelované s klinickými ťažkosťami detských pacientov.Výsledky:
V prvej vyšetrovanej skupine malo 17 z 39 pacientov abnormálny pH záznam, na základe čoho im bola stanovená diagnóza GERD. 82,4 % z nich malo pozitívnu aspoň jednu vzorku slín na prítomnosť pepsínu. Naopak, až 90,9 % pacientov s fyziologickým pH záznamom malo pozitívnu aspoň jednu vzorku slín na prítomnosť pepsínu.
V druhej vyšetrovanej skupine bol pepsín v slinách potvrdený u všetkých 62 detí s podozrením na EER. 50 % všetkých vzoriek slín vykazovalo vysokú koncentráciu pepsínu (>500 ng/ml). Vyššie koncentrácie pepsínu v slinách boli zaznamenané u pacientov s pridruženým ORL nálezom (zadná laryngitída, chronická faryngitída). Nezaznamenali sme významnú koreláciu medzi koncentráciou pepsínu v slinách a výskytom jednotlivých symptómov. Najčastejším príznakom u našich EER-pozitívnych detských pacientov bola nadmerná tvorba hlienov v hrdle a potreba odkašlať si.Závery:
Nezistili sme priamu koreláciu medzi 24-h pH metriou pažeráka a záchytom pepsínu v slinách u detí. Senzitivita Peptestu vzhľadom k pH metrii bola 82,4 %. Špecificita vyšetrenia vzhľadom na absenciu kontrolnej skupiny nebola stanovená. Avšak, až 90,9 % pacientov s fyziologickým pH záznamom malo pozitívny výsledok Peptestu. Oveľa užší vzťah sa javí medzi klinickými prejavmi EER a výsledkom Peptestu (v našom súbore 100% senzitivita). Preto pri podozrení na mimopažerákové prejavy GERD u detí uprednostňujeme vyšetrenie slín/spúta na prítomnosť pepsínu pred klasickou 24-hodinovou pH metriou.KĽÚČOVÉ SLOVÁ:
extraezofágový reflux, pepsín v slináchDEFINÍCIA A ETIOPATOGENÉZA EER
Gastroezofágový reflux (GER) predstavuje spontánny návrat žalúdočného obsahu do pažeráka, ktorý môže a nemusí byť sprevádzaný regurgitáciou a vracaním [1]. Ak dochádza k preniknutiu refluxátu nad úroveň horného pažerákového zvierača, stav označujeme ako laryngofaryngový (LPR) alebo extraezofágový reflux (EER) [2]. Niektorí autori považujú EER za súčasť GER, iní za samostatnú klinickú jednotku. Kým hlavným mechanizmom vzniku GER sú tranzientné relaxácie dolného pažerákového zvierača (TLESR), pri vzniku EER zohrávajú dôležitú úlohu aj relaxácie horného pažerákového zvierača [3, 4]. Etiológia extraezofágového refluxu však nie je doposiaľ úplne známa.
Reflux je do určitej miery fyziologický a refluxné epizody sú vo väčšine prípadov asymptomatické. Ku vzniku klinických ťažkostí a ev. komplikácií dochádza až po prekonaní protektívnych mechanizmov [5]. Pažerák, na rozdiel od laryngu, disponuje viacerými obrannými bariérami, ktoré chránia pažerákovú sliznicu pred agresívnym pôsobením prevažne kyslého žalúdočného obsahu (za normu sa považuje cca 50 gastroezofágových refluxných epizód za 1 deň). Naproti tomu, prítomnosť už jednej extraezofágovej refluxnej epizódy za 1 deň, resp. troch epizód za 1 týždeň môže byť patologická [6]. Okrem zistenia, že sliznica hypofaryngu, hrtana a ďalších častí dýchacích ciest je viac citlivá na zložky refluxátu v porovnaní so sliznicou pažeráka, bol tiež dokázaný škodlivý vplyv pepsínu na sliznicu horných dýchacích ciest, kde spôsobuje disrupciu buniek [5]. Pepsín je proteolytický enzým, ktorý pozostáva z viacerých izoenzýmov, pričom najväčšie zastúpenie tvorí pepsín 3 komplex (až 80 %). Svoju najvyššiu aktivitu dosahuje v kyslom žalúdočnom prostredí (pH 1,5–2). Tráviaca schopnosť pepsínu je však čiastočne zachovaná aj v slabokyslom a slabozásaditom prostredí. To vysvetľuje, prečo môžu byť nepriaznivé aj slabokyslé a nekyslé refluxné epizódy, ktoré sú typické pre EER [7]. Pepsín je tvorený výlučne v žalúdku, preto jeho prítomnosť v sekrétoch a tkanivách dutiny ústnej alebo dýchacích ciest svedčí o mimopažerákovom refluxe (EER) [8].
KLINICKÁ MANIFESTÁCIA EER
Prítomnosť pepsínu už bola dokázaná vo viacerých klinických vzorkách – sliny, spútum, bronchoalveolová lavážna tekutina, sekrét zo stredoušia a iné. Na základe toho možno usudzovať na súvis EER s jednotlivými symptómami alebo ochoreniami – laryngitída, kašeľ, pľúcna fibróza, otitída a podobne. Mimopažeráková symptomatológia gastroezofágovej refluxovej choroby (GERD) môže byť v detskom veku veľmi rozmanitá (tab. 1). Keďže klinické prejavy EER sú v detskom veku nešpecifické, nie je jednoduché určiť podiel refluxu na vzniku, udržovaní alebo zhoršovaní jednotlivých ťažkostí.
1. Mimopažerákové prejavy gastroezofágovej refluxovej choroby 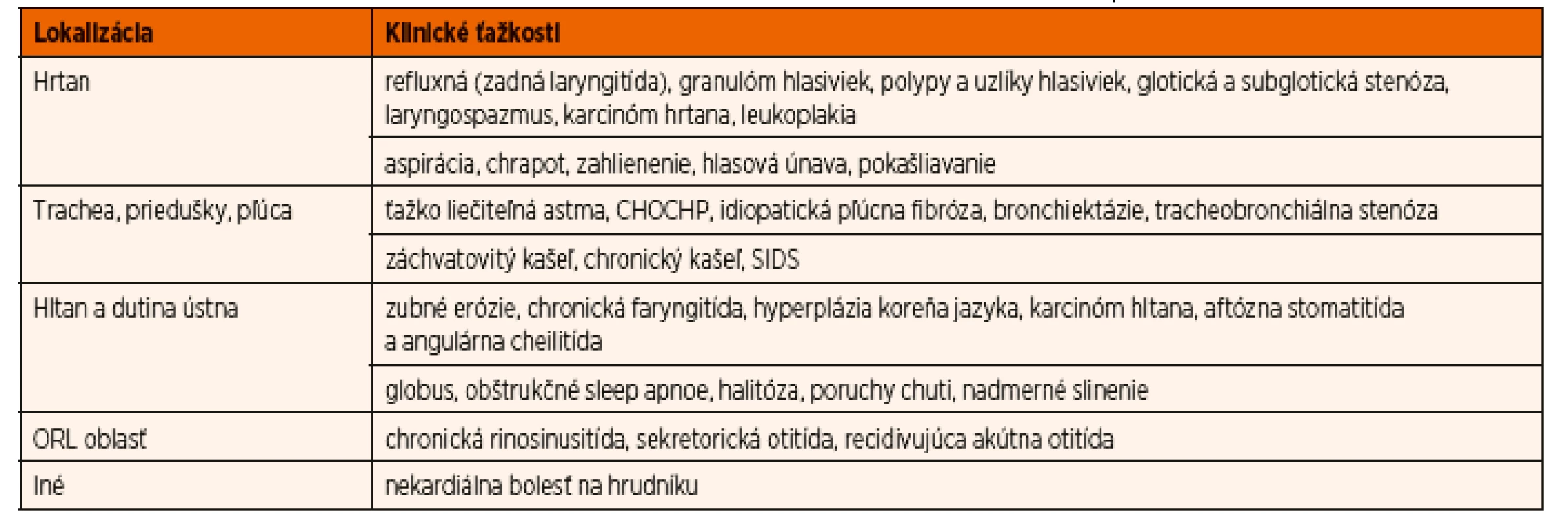
(upravené podľa Zeleníka, 2013). DIAGNOSTIKA EER
Zložitosť extraezofágového refluxu spočíva aj v jeho verifikácii. Štandardná 24-hodinová pH metria pažeráka má v prípade diagnostiky EER výrazné limitácie. Posun v diagnostike EER znamenalo zavedenie multikanálovej impedancie s 2-kanálovou pH metriou s umiestnením príslušných senzorov nad horný pažerákový zvierač [5]. Avšak doposiaľ neexistuje konsenzus o tom, koľko epizód už treba považovať za patológiu. Vzhľadom na význam pepsínu při extraezofágových prejavoch refluxu boli v poslednej dobe vyvinuté viaceré metódy zamerané na jeho detekciu. Za jednoduchú a zároveň spoľahlivú metódu sa považuje imunochromatografia (nepriama sendvičová ELISA so značenými monoklonálnymi protilátkami proti ľudskému pepsínu – PeptestTM). Vyšetrením je možné detekovať už 16 ng pepsínu v 1 ml klinickej vzorky (napr. spútum, sliny...) [9]. Senzitivita a špecificita vyšetrenia sa udáva na 88 %, resp. 87 % [10]. Stanovenie pepsínu z tekutín a tkanív má jednu potenciálnu výhodu oproti pH metrii. Dáva totiž predstavu o výskyte refluxu z dlhodobého hľadiska, pretože pepsín sa v sekrétoch alebo tkanivách hromadí dlhodobo pri opakovaných refluxných epizódach [5].
Podľa viacerých vedeckých prác v dospelej populácii, nie je korelácia medzi záchytom pepsínu v slinách/spúte a výsledkom 24-hodinovej pH metrie. V prípade GERD pozitívnych pacientov (potvrdených štandardnou 24-hodinovou pH metriou) je senzitivita Peptestu len 22 %, resp. 33 % [11, 12]. V literatúre chýbajú podobné údaje u detských pacientov. Taktiež nie je jednoznačne určená hranica koncentrácie pepsínu v slinách/spúte, ktorá sa považuje za patologickú. Detekčný limit Peptestu je 16 ng/ml a vyšetrenie je len semikvantitatívne. Zariadenie (lateral flow reader) používané na stanovenie presnej koncentrácie pepsínu v klinickej vzorke je schopné detekcie od 25 ng/ml, pričom výrobca udáva hodnotu nad 200 ng//ml ako vysoko pozitívnu. Naopak, profesor Daniel Sifrim z Londýna považuje hladinu pepsínu v slinách do 200 ng//ml za nesignifikantnú [13]. Cut-off hodnoty koncentrácie pepsínu v slinách nie sú doposiaľ pre detský vek určené.
LIEČBA EER
Liečba patologického EER by mala byť komplexná a dostatočne dlhá. Nevyhnutnou súčasťou liečby sú režimové opatrenia, fyzioterapia a diétne obmedzenia, ktorých výhodou je, že okrem zvýšenia pH majú význam v prevencii samotného refluxu (zvýšenie tonusu dolného a horného pažerákového zvierača) [5]. Základný kameň farmakologickej liečby predstavujú medikamenty potláčajúce kyslosť žalúdočných štiav (najmä inhibítory protónovej pumpy). Prokinetiká nie sú u detí odporúčané pre riziko vedľajších účinkov (napr. extrapyramídové príznaky). Vzhľadom na negatívny význam pepsínu v patogenéze EER je snaha vytvoriť liek, ktorý by znížil, alebo eliminoval jeho škodlivé pôsobenie [8]. Dovtedy je vhodným doplnením liečby suspenzia alginátu [10].
Naším cieľom bolo poukázať na problematiku extraezofágového refluxu u detí a predstaviť naše skúsenosti s vyšetrovaním pepsínu v slinách pomocou imunochromatografickej metódy – PeptestTM. Výskum sme realizovali v Šrobárovom ústave detskej tuberkulózy a respiračných chorôb v Dolnom Smokovci prostredníctvom 2 rôznych súborov pacientov. Práca bola schválená etickou komisiou Šrobárovho ústavu.
SÚBOR 1
- Materiál a metodika
Súbor pacientov tvorilo 39 detí (26 chlapcov a 13 dievčat; medián 9 rokov) so suspektnými prejavmi GERD (pažerákové aj mimopažerákové). Kontrolná skupina zdravých asymptomatických detí nebola zostavená. Všetci pacienti podstúpili vyšetrenie dvojkanálovou 24-hodinovou pH metriou a vyšetrenie dvoch vzoriek slín po odkašlaní. Prvá vzorka slín sa odoberala ráno pred jedením a umytím zubov, druhá vzorka slín 1 hodinu po obede. Po spracovaní boli obe vzorky vyšetrované na prítomnosť pepsínu in vitro pomocou diagnostického zariadenia s dvomi monoklonálnymi protilátkami na ľudský pepsín (PeptestTM – lateral flow test). Hodnotenie vyšetrenia bolo semikvantitívne, na základe viditeľnej intenzity zafarbenia testovacej línie. Realizácia ako aj hodnotenie 24-h pH metrie bolo na základe štandardných doporučených postupov (pozitívny výsledok pri reflux index RI >3 %). Obe vyšetrenia (pH metria a Peptest) boli realizované v priebehu jednej hospitalizácie, pričom vyšetrenia neboli realizované súčasne v jeden deň.
- Výsledky
U 17 (43,6 %) pacientov bol zachytený signifikantný gastroezofágový reflux na základe 24-hodinovej pH metrie. Z nich malo pozitívnu aspoň jednu vzorku slín na prítomnosť pepsínu 14 pacientov (82,4 %), pričom obe vzorky slín boli pozitívne v 7 prípadoch (41,2 %). Žiaden pacient z tejto skupiny prekvapivo nemal silnopozitívnu vzorku. U zvyšných 22 (56,4 %) pacientov bol záznam na 24-hodinovej pH metrii hodnotený ako fyziologický. Z nich až 20 (90,9 %) malo pozitívnu aspoň jednu vzorku slín na prítomnosť pepsínu, pričom obe vzorky slín boli pozitívne v 14 prípadoch (63,6 %). U 4 pacientov s fyziologickým pH záznamom sme zaznamenali aj silnopozitívne vzorky.
U 12 z celkovo vyšetrených 39 pacientov sme zaznamenali zvýšené pôsobenie refluxovaného obsahu v proximálnych častiach pažeráka v polohe v ľahu (acid exposure index pre proximálny kanál >0,9 %). Z nich len 5 pacientov (41,7 %) malo pozitívnu rannú vzorku slín na prítomnosť pepsínu. Naopak, až 7 z 10 pacientov (70 %), u ktorých sa nočný kyslý reflux v proximálnom pažeráku vôbec nevyskytoval, malo pozitívnu rannú vzorku slín.
Zo všetkých 78 vzoriek slín bolo 55 vzoriek (70,5 %) pozitívnych na prítomnosť pepsínu, pričom ráno bolo pozitívnych 56,4 % vzoriek, po obede bolo pozitívnych 84,6 % vzoriek.
- Diskusia
Častejší záchyt pepsínu v slinách u našich pacientov bol podľa očakávania zaznamenaný v poobedných vzorkách, čo je v súlade s výsledkami doteraz publikovaných prác. Vyplýva to zo skutočnosti, že refluxné epizódy sa prirodzene najčastejšie vyskytujú postprandiálne a pri potrebe odgrgnutia môže zmiešaný alebo plynný (aerosolový) reflux preniknúť nad horný pažerákový zvierač. Našim ďalším pozorovaním bolo, že pepsín v rannej vzorke slín bol dokázaný aj u pacientov, u ktorých sa kyslé proximálne refluxné epizódy počas noci vôbec nevyskytovali. Tento fakt podporuje predpoklad, že pepsín sa v sekrétoch alebo tkanivách hromadí dlhodobo pri opakovaných refluxných epizódach a dá sa detekovať, aj keď predtým neprebehla kyslá refluxná epizóda, respektíve mohlo dôjsť ku slabokyslej refluxnej epizóde, ktorú klasická 24-hodinová pH metria nie je schopná detekovať. Nepochybne vhodnejšie by bolo pH metriu kombinovať s impedanciou, ktorá dokáže zachytiť aj slabokyslé (pH >4) a nekyslé (pH >7) refluxné epizódy a presnejšie určiť propagáciu refluxu.
Taktiež sme nezaznamenali pozitívnu koreláciu medzi výsledkom Peptestu a 24-hodinovou pH metriou (podobne ako Yuksel, 2012 a Ocak, 2015). Naopak, častejší záchyt pepsínu v slinách mali pacienti s fyziologickým pH záznamom. Treba pripomenúť, že títo pacienti boli symptomatickí (v zmysle mimopažerákových prejavov GERD). Príčinou tejto diskrepancie môžu byť určité odlišnosti v patofyziológii GER a EER a už spomenutá limitácia klasickej 24-hodinovej pH metrie. Oveľa užší vzťah sa teda zdá byť medzi klinickými prejavmi a výsledkom Peptestu, čo bolo predmetom výskumu druhého súboru detských pacientov.
- Záver
Nezistili sme priamu koreláciu medzi 24-hodinovou pH metriou pažeráka a záchytom pepsínu v slinách/spúte u detských pacientov. Senzitivita Peptestu u pacientov s abnormálnym pH záznamom a prejavmi GERD bola 82,4 %. Špecificita vyšetrenia vzhľadom na absenciu kontrolnej skupiny nebola stanovená. Avšak až 90,9 % pacientov s fyziologickým pH záznamom malo pozitívny výsledok Peptestu. Preto u detských pacientov s podozrením na mimopažerákové prejavy GERD neodporúčame realizovať vyšetrenie klasickou 24-hodinovou pH metriou.
SÚBOR 2
- Materiál a metodika
Súbor pacientov tvorilo 62 detí (medián 5 rokov) s podozrením na patologický extraezofágový reflux. Chlapcov bolo 29 (46,8 %), dievčat 33 (53,2 %). Pacienti, resp. ich rodičia vyplnili nami zostavený dotazník zameraný na možné klinické prejavy GER a EER. Vzhľadom na vek našich pacientov nebolo možné stanoviť refluxný symptómový index (RSI). Všetci pacienti podstúpili ORL vyšetrenie s fibrolaryngoskopiou a odber dvoch vzoriek slín po odkašlaní (ráno a po obede), ktoré boli vyšetrované kvantitatívne na prítomnosť pepsínu (pomocou lateral flow test a lateral flow reader). Na základe výsledkov Peptestu sme rozdelili pacientov do dvoch skupín (A a B). Skupinu A (n = 18) tvorili tzv. „silnopozitívni“ pacienti, u ktorých boli zaznamenané vysoké koncentrácie pepsínu v oboch klinických vzorkách (>500 ng/ml). Do skupiny B (n = 14) sme naopak zaradili pacientov s negatívnym alebo slabopozitívnym výsledkom Peptestu v oboch vzorkách (0–250 ng/ml). Podľa ORL vyšetrenia boli pacienti tiež rozdelení do dvoch skupín (I a II). Skupinu I (n = 10) tvorili pacienti s pozitívnym ORL nálezom (napr. zadná laryngitída, chronická faryngitída). Skupinu II (n = 52) naopak pacienti bez objektívnych známok extraezofágového refluxu.
- Výsledky
Všetkých 62 detí (100 %) malo aspoň jednu vzorku slín pozitívnu na prítomnosť pepsínu, pričom u 57 z nich (91,9 %) boli obe vzorky pozitívne. Ráno bolo pozitívnych 93,5 % vzoriek, po obede bolo pozitívnych 98,4 % vzoriek. Poobedné vzorky slín vykazovali priemerne vyššie hladiny pepsínu ako ranné vzorky.
Pacientov s objektívnymi známkami EER (skupina I) bolo 10 (16,1 %), pričom všetci mali obe vzorky slín pozitívne na pepsín. Až 9 z nich (90 %) patrilo do skupiny A („silnopozitívni“) a iba jeden pacient (10 %) bol zo skupiny B („slabopozitívni“). Pacientov bez patologického ORL nálezu (skupina II) bolo až 52 (83,9 %), pričom až 73,1 % z nich patrilo do skupiny A („silnopozitívni“).
Nezaznamenali sme výraznejší rozdiel v chorobnosti ani vo výskyte symptómov medzi skupinami A, B, I a II (viď grafy 1 a 2). Výnimku tvorila pyróza, ktorá sa častejšie vyskytovala u pacientov „silnopozitívnych“, alebo s patologickým ORL nálezom (teda v skupine Aa I). Naopak u pacientov zo skupiny B („slabopozitívni“) sa pyróza vôbec nevyskytovala. Všeobecne najčastejšie sa vyskytujúcim symptómom u našich pacientov bola nadmerná tvorba hlienov v hrdle a potreba odkašlať si (až 88,9 % pacientov). Rozdiely vo výskyte jednotlivých symptómov medzi sledovanými skupinami boli vzhľadom na malý počet pacientov štatisticky nevýznamné (p >0,05).
1. Výskyt jednotlivých symptómov GERD podľa výsledku Peptestu a ORL vyšetrenia. 
2. Výskyt opakovaných pridružených ochorení v závislosti od výsledku Peptestu a ORL vyšetrenia u detských pacientov s extraezofágovým refluxom. 
- Diskusia
Každý náš pacient s podozrením na patologický extraezofágový reflux (EER) mal aspoň v jednej vzorke slín dokázanú prítomnosť pepsínu. Častejšie a silnejšie pozitívne boli postprandiálne vzorky slín v porovnaní s rannými vzorkami odoberanými nalačno. Presne 50 % vzoriek vykazovalo vysokú koncentráciu pepsínu (>500 ng/ml). V dospelej populácii sa koncentrácia pepsínu v slinách nad 200 ng/ml považuje za patognomickú pre patologický EER [13]. V prípade detských pacientov nie je cut-off hodnota jednoznačne určená a podľa našich zistení môže byť vyššia, nakoľko až 58,1 % našich pacientov malo koncentráciu pepsínu aspoň v jednej vzorke nad 500 ng/ml a pritom nemali objektívne ORL známky extraezofágového refluxu. To zrejme svedčí o dobrých obranných slizničných mechanizmoch horných dýchacích ciest v detskom veku. Môžeme tiež predpokladať, že extraezofágový reflux je do určitej miery u detí fyziologický. Veľkú úlohu určite zohráva aj individuálna vnímavosť jednotlivca. V našom súbore žiaľ chýbali zdraví, bezpríznakoví pacienti, ktorí by tvorili kontrolnú skupinu. Ďalšou limitáciou súboru detských pacientov bol práve ich vek a nespoľahlivosť interpretácie subjektívnych ťažkostí.
Mimopažeráková symptomatológia našich EER-pozitívnych detských pacientov bola rozmanitá, najčastejšie charakterizovaná nadmernou tvorbou hlienov v hrdle a potrebou odkašlať si. Týmto príznakom trpelo až 88,9 % našich pacientov, čo je v súlade s Koufmanom a spol., ktorí vo svojej štúdií na 899 pacientoch zistili, že odkašliavanie bolo prítomné u 87 % pacientov s EER a len u 3 % pacientov s GERD. V našom súbore bol výskyt nadmerného zahlieňovania a odkašliavania prekvapivo menej častý u pacientov s inhalačnou alergiou alebo zväčšenými adenoidnými vegetáciami, ako u pacientov bez týchto pridružených ochorení. Preto tento príznak, aj keď je nešpecifický, považujeme v prípade podozrenia na EER za významný.
- Záver
U každého pacienta s podozrením na patologický extraezofágový reflux (EER) sme dokázali prítomnosť pepsínu v sekrétoch horných dýchacích ciest (v slinách/spúte). Vyššie koncentrácie pepsínu boli pozorované u pacientov s pridruženým ORL nálezom (zadná laryngitída, resp. chronická faryngitída). Najčastejším príznakom u našich EER-pozitívnych detských pacientov bola nadmerná tvorba hlienov v hrdle a potreba odkašlať si. Vo všeobecnosti sú mimopažerákove prejavy GERD u detí nešpecifické, preto odporúčame objektivizovať EER. Za vhodnú, neinvazívnu metódu považujeme detekciu pepsínu v slinách/spúte pomocou lateral flow test. V prípade podozrenia na mimopažerákové prejavy GERD u detí odporúčame toto vyšetrenie uprednostniť pred klasickou 24-hodinovou pH metriou.
Poďakovanie
Ďakujeme spolupracovníkom a pacientom Šrobárovho ústavu detskej tuberkulózy a respiračných chorôb v Dolnom Smokovci ako aj firme IMEDEX, s.r.o., za poskytnutie Peptestov.
Táto publikácia vznikla vďaka podpore v rámci operačného programu Výskum a vývoj pre projekt: Centrum experimentálnej a klinickej respirológie, ITMS kód projektu: 26220120004, který bol spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
Došlo: 7. 6. 2016
Přijato: 7. 3. 2017
Korešpondujúci autor:
MUDr. Jaroslav Fábry, PhD.
Klinika detskej TBC a respiračných chorôb
JLF UK a ŠÚDTaRCH, n. o.
059 81 Dolný Smokovec
Slovenská republika
email: fabry@sudtarch.sk
Sources
1. North American Society for Pediatric Gastroenterology, Hepatology and Nutrition and European Society For Pediatric Gastroenterology, Hepatology and Nutrition. Pediatric gastroesophageal reflux clinical practice guidelines. J Pediatr Gastroenterol Nutr 2009; 49 : 501. ISSN0277-2116.
2. Toohill RJ. History of extra-esophageal reflux. In: Effects, Diagnosis and Management of Extra-Esophageal Reflux. New York: Nova Science Publisher, 2011 : 1–10.
3. Banovcin P Jr, Halicka J, Halickova M, et al. M. Studies on the regulation of transient lower esophageal sphincter relaxations (TLESRs) by acid in the esophagus and stomach. Dis Esophagus 2015; Apr 15. doi: 10.1111/dote.12357. [Epub ahead of print].
4. Halicka J, Banovcin P Jr, Halickova M, et al. Acid infusion into the esophagus increases the number of meal-induced transient lower esophageal sphincter relaxations (TLESRs) in healthy volunteers. Neurogastroenterol Motil 2014 Oct; 26 (10): 1469–1476. doi: 10.1111//nmo.12409. Epub 2014 Aug 22.
5. Zeleník K, Čáp P, Chlumský J, a kol. Mimojícnové projevy refluxní choroby. 1. vyd. Havlíčkův Brod: Tobiáš, Medicína hlavy a krku, 2013 : 23–285. ISBN 978-80-7311-138-0.
6. Koufman JA. The otolaryngologic manifestations of gastroesophageal reflux disease (GERD): a clinical investigation of 225 patients using ambulatory 24-hour pH monitoring and an experimental investigation of the role of acid and pepsin in the development of laryngeal injury. Laryngoscope 1991; 101 (53): 1–78.
7. Johnston N, Knight J, Dettmar PW, et al. Pepsin and carbonic anhydrase isoenzyme III as diagnostic markers for laryngopharyngeal reflux disease. Laryngoscope 2004; 114 (12): 2129–2134.
8. Johnston N, Wells CW, Samuels TL, Blumin JH. Pepsin in nonacidic refluxate can damage hypopharyngeal epithelial cells. Ann Otol Rhinol Laryngol 2009; 118 (9): 677–685.
9. Hayat JO, Gabieta-Somnez S, Yazaki E, et al. Pepsin in saliva for the diagnosis of gastro-esophageal reflux disease. Gut 2015; 64 (3): 373–380.
10. Strugala V, Avis J, Jolliffe IG, et al. The role of an alginate suspension on pepsin and bile acids - key aggressors in the gastric refluxate. Does this have implications for the treatment of gastro-oesophageal reflux disease? J Pharm Pharmacol 2009; 61 (8): 1021–1028.
11. Yuksel ES, Hong S-KS, Strugala V, et al. Rapid salivary pepsin test: blinded assessment of test performance in gastroesophageal reflux disease. Laryngoscope 2012; 122 (6): 1312–1316.
12. Ocak E, Kubat G, Yorulmaz İ. Immunoserologic pepsin detection in the saliva as a noninvasive rapid diagnostic test for laryngopharyngeal reflux. Balkan Med J 2015; 32 : 46–50.
13. Sifrim D. The role of salivary pepsin in the diagnosis of reflux. Gastroenterology & Hepatology 2015; 11 (6): 417.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 3-
All articles in this issue
- Pepsin in secretion from the upper respiratory tract as a marker of extraesophageal reflux in children
- Cri du chat syndrome in the newborn diabetic mother
- Patello-femoral disorders in children
- Legg-Calve-Perthes disease
- RSV infection in late preterm infants
- Febrile seizures – information for parents
- Care for children with haemophilia in the Czech Republic
- Quality of life of pediatric patients with haemophilia in the Czech Republic – experiences of one centre
- Risks of late haemophilia diagnosis
- The correlation between grade of adenoid hypertrophy verified by nasofiberendoscopy and grade of nasal obstruction objectivised by rhinomanometry
- The effect of adenoids and endoscopic adenoidectomy on nasal patency in children
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Patello-femoral disorders in children
- Legg-Calve-Perthes disease
- Pepsin in secretion from the upper respiratory tract as a marker of extraesophageal reflux in children
- RSV infection in late preterm infants
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

