-
Medical journals
- Career
Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
Authors: D. Neumann 1; K. Krylová 1; E. Al Taji 2; Z. Límanová 3; P. Dejmek 2; J. Horáček 4
Authors‘ workplace: Dětská klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Klinika dětí dorostu UK 3. LF a Fakultní nemocnice Královské Vinohrady, Praha přednosta doc. MUDr. F. Votava, CSc. 2; III. interní klinika UK 1. LF a Všeobecné fakultní nemocnice, Praha přednosta prof. MUDr. Š. Svačina, DrSc. 3; IV. interní klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta doc. MUDr. P. Žák, Ph. D. 4
Published in: Čes-slov Pediat 2013; 68 (5): 331-341.
Category: Review
Overview
Článek dává do vztahu fyziologii anatomického a funkčního vývoje štítné žlázy (spolu s vlivem genů v tyreoidální morfogenezi a hormonogenezi) s péčí o novorozence. Poruchy anatomického a funkčního vývoje štítné žlázy mohou být příčinou kongenitální hypotyreózy, která, pokud není včas léčena, nevratně poškozuje vývoj dítěte, především neurokognitivní funkce. Fungující novorozenecký screening má včasnou diagnózou poškození zabránit a umožnit zahájení přiměřené léčby novorozenců L-tyroxinem. Mírné, při narození ještě funkčně asymptomatické formy dysgeneze i dyshormonogeneze mohou zůstat novorozeneckým screeningem nezachycené. Později se z nich stávají případy hypotyreóz, které nejsou na imunitním podkladě, nebo se vyskytují v rodinách dětí s kongenitální hypotyreózou. V případě novorozenecké hypertyreotropinemie je potřeba léčby určována podle hodnot TSH ve 2. týdnu po porodu. Terapie tranzientní hypotyroxinemie nedonošených není zatím jednoznačně doporučována. U novorozenců s protrahovaným závažným průběhem základního onemocnění a prokázaným sick euthyroid syndromem by měla být podávána substituce ve formě trijodtyroninu. Pokud léčba není indikována, vyžadují tyto děti dlouhodobé sledování.
Klíčová slova:
novorozenec, hormony štítné žlázy, kongenitální hypotyreóza, dysgeneze, dyshormonogeneze, geny, hypotyroxinemie nedonošených, novorozenecká hypertyreotropinemieÚvod
Ovlivnění vývoje štítné žlázy a její funkce u plodu a novorozence zásobením jodem matky a mateřskými tyreopatiemi se věnoval předchozí článek [1]. Předložený souhrn přináší informace o kongenitální hypotyreóze, tranzientní hypertyreotropinemii a vlivu předčasného porodu a perinatální patologie na funkci štítné žlázy novorozence. Časnou detekci uvedených poruch umožňují screeningové programy se včasnou intervencí zaměřené na novorozence.
Anatomický a funkční vývoj štítné žlázy
Ve třetím gestačním týdnu (g. t.) se objevují disperzně folikulární buňky, které postupně vytvářejí pupen štítné žlázy. Ve 4. g. t. sestupuje formovaný pupen štítné žlázy podél ductus thyreoglossus, který v 5. g. t. zaniká. Jeho přetrvávající zbytky však mohou později vytvořit tyreoglosální cysty. Migrace je dokončena v 6. týdnu. Anatomické formování na dva laloky probíhá v 10.–12. g. t., kdy zároveň štítná žláza splývá s ventrálními částmi čtvrtého žaberního oblouku (C-buňky ultimobranchiálních tělísek). Organogeneze je pod kontrolou homeodoménových (HOX) genů a transkripčních faktorů TTF-1, TTF-2, PAX8 a řady dalších [2, 3]. Porucha anatomického vývoje štítné žlázy je označována jako dysgeneze. Nejčastější je porucha její kaudální migrace, obvykle v první fázi sestupu. Linguální ektopie štítné žlázy proto tvoří přibližně 2/3 stavů dysgeneze štítné žlázy [4] (obr. 1).
Image 1. Poruchy migrace a morfologického vývoje štítné žlázy. 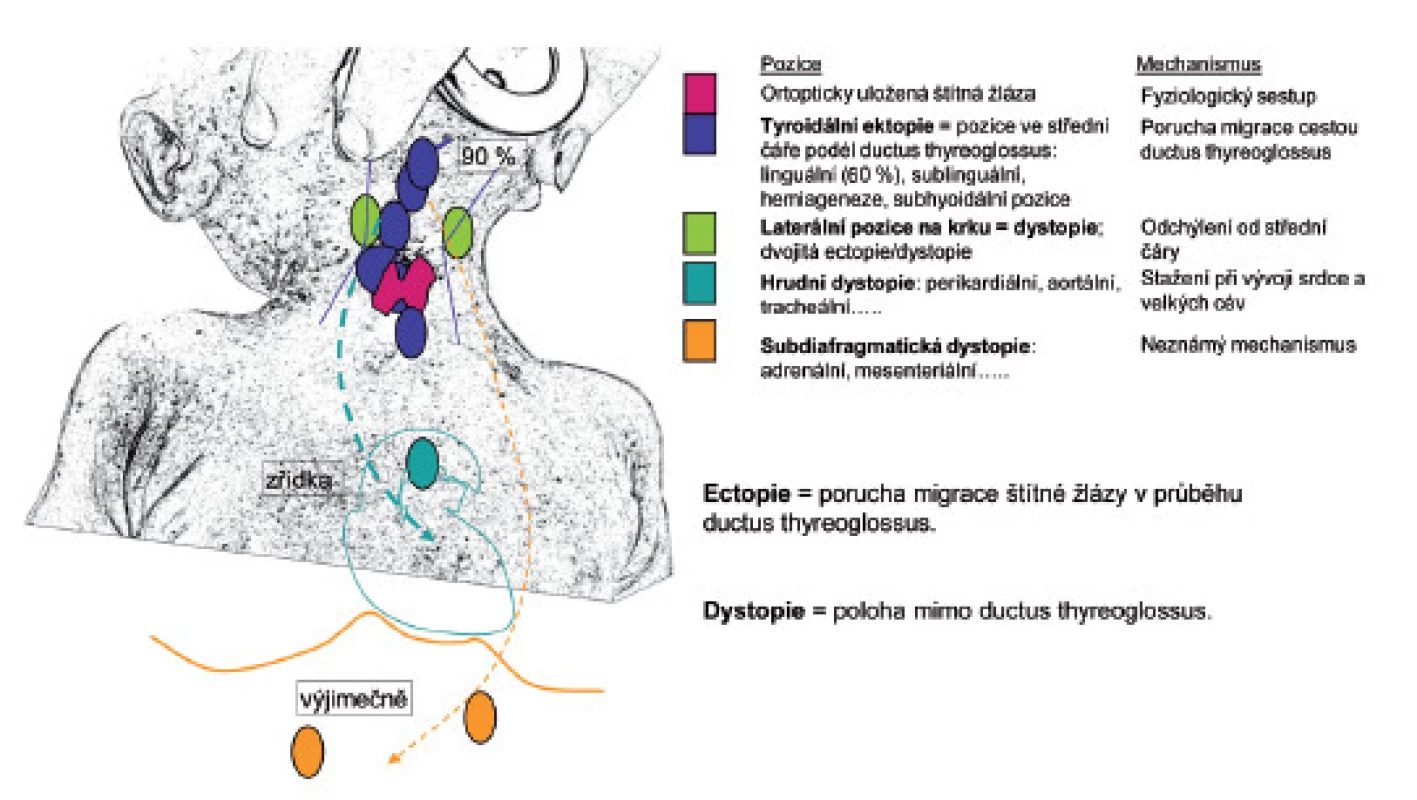
Funkčně je plod v první třetině těhotenství plně závislý na hormonech štítné žlázy matky. Placenta je volně prostupná pro jod a mateřský TRH, v menším množství pro T3 a T4. TSH přes ni nepřechází. V 10.–12. g. t. jsou u plodu detekovatelné folikuly obsahující fetální tyreoglobulin [5], T3 a T4, současně je prokazatelný TSH plodu. Hladiny TSH a TBG stoupají od 20. do 36. gestačního týdne. Hladina tyreo-globulinu odpovídá množství funkční tkáně štítné žlázy. Stoupá i hladina T4, plazmatické hodnoty T4 a T3 plodu jsou však ve srovnání s postnatálními nízké. Tkáňové koncentrace T4 kontroluje zvýšená aktivita dejodáz tak, že plod predisponuje k inaktivaci hormonů štítné žlázy. Proto jsou hladiny rT3 vysoké [6, 7]. Tvorba hormonů štítné žlázy plodu a její regulace je plně funkční v době termínu porodu. Hypotyroxinemie přetrvává u předčasně narozených novorozenců.
U donošených novorozenců jsou maximální hodnoty TSH 30 minut po porodu. Tento vrchol neodrážejí hladiny v pupečníkové krvi, ale perinatální komplikace pupečníkové TSH zvyšují. Přestože pupečníkové TSH reflektuje hlavně prenatální rovnováhu [8], je dostatečné pro identifikaci kongenitální hypotyreózy [9]. Screeningové programy založené na vyšetření pupečníkové krve, kde je stanovení TSH doplněno o vyšetření fT4, mají vysokou senzitivitu a specificitu bez falešně pozitivních i falešně negativních záchytů [10]. Císařský řez ani typ anestezie při porodu nevedou ke změnám v hladinách TSH v 1.–7. dni po porodu [11]. TSH klesá a stabilizuje se po 48 hodinách. V té době začíná stoupat hladina volného T4 na hodnoty 15–35 pmol/l, které přesahují obvyklé referenční meze 10–25 pmol/l (navíc je potřebné počítat se změnami podle metody stanovení). Přes pokles hladiny fT4 během prvních 4–6 týdnů mohou přetrvávat vyšší hodnoty než u dospělých až do 6 měsíců po narození [6, 12].
Poruchy vývoje a funkce štítné žlázy u novorozenců
Ve druhé polovině 20. století byly diagnostikovány příčiny kongenitální hypotyreózy a zavedeny pojmy dysgeneze a dyshormonogeneze. Novorozenecký screening začal v 70. letech 20. století. Po roce 1995 narůstají znalosti molekulárních příčin kongenitální hypotyreózy [3, 13, 14]. Díky tomu se také mezi příbuznými dětí s kongenitální hypotyreózou diagnostikují mírné poruchy vývoje štítné žlázy, které jsou asymptomatické [15], nebo mají projevy až po novorozeneckém věku nebo až v dospělosti [16]. Některé jsou podmíněné okolnostmi, např. mírným jodovým deficitem [17], jiné – mírné formy tyreoidální dyshormonogeneze – mohou být příčinou tranzientní novorozenecké hypertyreotropinemie [18].
Kongenitální hypotyreóza
Kongenitální hypotyreóza (KH) je stav hypofunkce štítné žlázy po narození a je nejčastější vrozenou endokrinní poruchou. Bez ohledu na etiologii se vyskutuje u 1 : 2500–4000 novorozenců. Většina případů KH je sporadických, dívky jsou postiženy dvakrát častěji. V případě postižení vlastní štítné žlázy tvoří morfologická dysgeneze 85 % případů a pouze 2 % případů dysgeneze mají familiární výskyt. Převažují poruchy kaudální migrace v mediální rovině do fossa thyroidea, hlavně linguální ektopie (>60 %), ageneze štítné žlázy a její hypoplazie [4] (obr. 1). U symetrické i asymetrické hypoplazie i ageneze je potřeba myslet na auto-zomálně dominantní mutaci receptoru pro TSH [19]. Přibližně 10–15 % příčin KH tvoří poruchy syntézy tyreoidálních hormonů – dys-hormonogeneze [20]. Jsou obvykle dědičné autozomálně recesivně [14]. V této skupině se vyskytují poruchy organifikace jodu (mutace genů pro tyreoperoxidázu, dejodázy, dehalogenázy, oxidázy – THOX) přibližně ve 37 % případů, poruchy genu pro tyreoglobulin ve 30 %, natrium-jodidového symportéru (NIS) ve 4 % a pendrinu ve 4 % případů [21] (obr. 1). Klinický obraz odpovídá postiženému mechanismu. U mutací genu pro tyreoglobulin bývá objemná kongenitální nebo prenatálně zjištěná struma [22], u poruch TPO a THOX genů mohou být objemy štítné žlázy i klinický obraz variabilní. U Pendredova syndromu (mutace genu pro pendrin) je KH se strumou a senzorineurální hluchotou po narození nebo může být porucha zjištěna v pozdějším věku. Pendrin je chloridový-jodidový výměnný transportér společný pro štítnou žlázu a řasinkový epitel labyrintu vnitřního ucha [23].
Centrální KH je vzácná. Je izolovaná, nebo s deficitem TRH/TSH nebo ve spojení s kongenitálním panhypopituitarismem. Nejčastější příčinou centrální KH je septooptická dysplazie [24].
KH v rámci malformačních syndromů je samostatnou skupinou, vyskytuje se v 5–16 % případů KH. Obvykle je spojena s dysgenezí štítné žlázy (geny pro transkripční faktory TTF-1,TTF-2, PAX8). Další malformace postihují nejčastěji srdce, urogenitální systém a patro. KH způsobená nejasným mechanismem a charakterizovaná hlavně vzestupem TSH se vyskytuje u Downova syndromu [25], následovaná patologií funkce štítné žlázy až u 50 % postižených v průběhu života [26].
Pro vyjádření závažnosti stavu se používají termíny nekompenzovaná a kompenzovaná KH. Nekompenzovaná KH znamená stav významného zvýšení TSH a současně nízké hladiny fT4 (pod 15 pmol/l). Kompenzovaná hypotyreóza je stav mírného až středního zvýšení TSH s hladinou fT4 v referenčním rozmezí. Do skupiny kompenzované hypotyreózy patří i stav tzv. novorozenecké hypertyreotropinemie.
KH je obvykle diagnostikována v novorozeneckém screeningu před rozvojem klinických příznaků. V případě klinického podezření (tab. 1) je indikované laboratorní vyšetření i přes negativní/nehlášený screening. Popsány jsou případy kongenitálních strum s eufunkcí nezachycených screeningem [27].
Table 1. Klinické příznaky kongenitální hypotyreózy (podle [7]). ![Klinické příznaky kongenitální hypotyreózy (podle [7]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/03dc93e65aa3562bd7cba76ee1c44f95.png)
Novorozenecká hypertyreotropinemie
Novorozenecká hypertyreotropinemie (NHT) je stav mírného zvýšení TSH s fyziologickou hladinou fT4 [28]. Tyreoglobulin není snížený a UZ vyšetření obvykle zobrazuje správně umístěnou štítnou žlázu přiměřené velikosti. Naopak radioizotopové vyšetření (99mTc) může prokázat patologický nález – snížené až nulové vychytávání radioizotopu štítnou žlázou. NHT může být tranzientní nebo perzistentní. Mezi novorozenci zachycenými screeningem KH tvoří přibližně třetinu případů [29]. Příčinami NHT mohou být mírné formy dyshormonogeneze (mutace genu pro TSH receptor, TPO), poruchy G-proteinů (pseudohypoparatyreóza Ia; Albrightova hereditární osteodystrofie), přítomnost přenesených protilátek, prematurita, polutanty, jodový deficit a jodový exces. Výjimečně může laboratorní obraz NHT vyvolat linguální ektopie žlázy nebo hemityroidea.
Tranzientní hypertyreotropinemie má čtyři příčiny: mateřské přenesené protilátky proti TSH receptoru, tyreostatika užívaná pro léčbu matky, jodový deficit a nadměrnou expozici jodu. Kromě toho ji může způsobit opožděné vyzrávání osy hypotalamus - hypofýza - štítná žláza. Podle definice AAP (American Academy of Pediatrics) by se hladina TSH měla normalizovat do 1–2 měsíců po narození [30]. Hodnota TSH >10 mIU/l po 2 týdnech života u předčasně narozených i donošených novorozenců znamená s velkou pravděpodobností trvalou poruchu [31].
Názory na zahájení léčby NHT nejsou jednotné ani pokud jde o její načasování, ani při jaké hladině TSH s ní začít (5–10 nebo více než 10 mIU/l). Pokud je ale léčba podána, je substituce L-tyroxinem stejná jako u KH. Po druhém, ale spíše třetím roce života dítěte [32] je prováděn pokus o její ukončení. Pro tranzientní NHT svědčí normalizace hladin TSH i fT4. Má být doplněno UZ a podle zvyklostí pracoviště také scintigrafické vyšetření štítné žlázy [30]. Přetrvávající zvýšené hladiny TSH do dospělosti (odpovídající užívaný termín je subklinická hypotyreóza) způsobují předčasnou aterosklerózu, dyslipidemii, dysfunkci myokardu a kognitivní poruchy.
Screeningem zachycení novorozenci matek s autoimunitní tyreoiditidou, kteří mají laboratorní nález svědčící pro KH i NHT, by měli projít kompletním vyšetřením včetně UZ a při nejasném nálezu i scintigrafickým vyšetřením. Jinak nelze vyloučit skutečnou kongenitální hypotyreózu (obr. 2).
Image 2. <sup>99m</sup>Tc scanem prokázaná ektopie štítné žlázy u děvčátka s kompenzovanou kongenitální hypotyreózou (TSH 43,48 mIU/l, fT4 23,3 pmol/l, tyreoglobulin před léčbou 77,89 mcg/l). Vyšetření bylo provedeno 10. den po zahájení substituce. Podle UZ reziduum nehomogenního hypoechogenního parenchymu s centrálními cystami v obou lalocích 2–4 mm. Matka dítěte má léčenou autoimunitní tyreoiditidu. 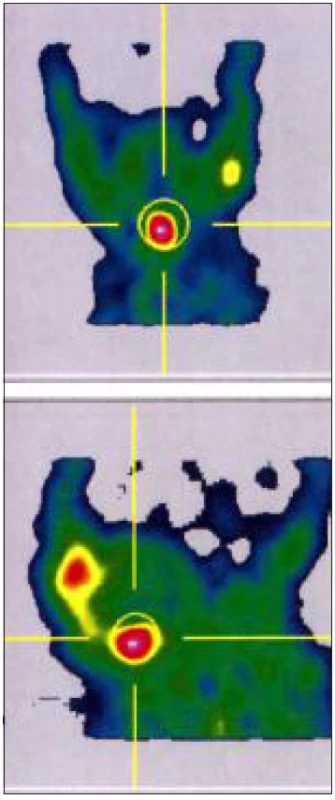
Principy screeningu kongenitální hypotyreózy, jeho pozitivita
Kongenitální hypotyreóza (KH) je jednoznačným důvodem pro celoplošný screening novorozenců. Je možné ji jednoduše detekovat a včasnou terapií předejít jejím následkům – neurokognitivní dysfunkci a mentální retardaci. Screening se provádí nejčastěji odběrem vzorku kapilární krve z patičky metodou tzv. suché kapky, obvykle 2.–5. den po narození. Je standardizován s ohledem na dynamiku TSH po porodu a logistické možnosti systémů scree-ningu jednotlivých zemí. U nedonošených a nemocných dětí se provádí rescreening za 14 dní [20]. Venózní odběr není doporučován, ale neznamená zkreslení výsledků. Ve světě existují i screeningové programy založené na vyšetření pupečníkové krve [9]. V certifikovaných laboratořích novorozeneckého screeningu je pak vyšetřena hladina TSH, T4 nebo fT4. Screening TSH nezachytí centrální hypotyreózu [33], vyšetření tyroxinu nediagnostikuje kompenzovanou hypotyreózu (normální hladina T4 nebo fT4 a zvýšené TSH) [34]. Klinický obraz proto zůstává indikací k vyšetření i při negativním výsledku novorozeneckého scree-ningu.
Kromě kongenitální hypotyreózy může být screening pozitivní i bez morfologického postižení štítné žlázy nebo bez geneticky dané poruchy hormonogeneze. Stává se tak u předčasně narozených novorozenců (převážně pod 34. gestační týden) a novorozenců léčených infuzí dopaminu nebo vysokými dávkami kortikoidů [35]. V těchto případech se mění schéma vyšetření v novorozeneckém screeningu [36]! Příčinou pozitivního scree-ningu KH je také blokáda funkce novorozenecké štítné žlázy přenesenými protilátkami při autoimunitní tyreoiditidě matky (rodinná anamnéza) a při léčbě tyreostatiky při Gravesově-Basedowově nemoci matky. Po vystavení matky nebo novorozence vysokému množství jodu v době screeningu (např. vyšetření s použitím jodového kontrastu, jodová dezinfekce při operativním porodu [33]) blokuje nadbytek jodu funkci štítné žlázy (Wolffův--Chaikoffův efekt). Bývá výraznější u předčasně narozených novorozenců [37]. Pozitivní výsledek screeningu KH je možný i u zá-važného jodového deficitu matky [20, 38].
Screening kongenitální hypotyreózy v ČR a systém péče o postižené novorozence
V České republice byl po pilotním projektu mezi lety 1975–1985 zaveden screening celoplošně [39]. V letech 2002–2006 bylo zachyceno celkem 125 dětí s kongenitální hypotyreózou, tedy 1 případ na 3937 porodů [40]. V ČR se stanoví imunometricky TSH v suché kapce krve, od roku 2009 mezi 48. a 72. hodinou po narození. Hodnoty TSH pod 10 mIU/l jsou negativní, mezi 10–15 mIU/l probíhá vnitřní kontrola ze stejné kartičky a při překročení cut-off hodnot 15 mIU/l je aktivován systém následné péče. Pokud je výsledek TSH do 20 mIU/l, dostávají rodiče dopis s doporučením kontrolního vyšetření u praktického dětského lékaře (PLDD), při hodnotách TSH mezi 20 a 30 mIU/l jsou kontaktováni rodiče novorozence i PLDD („recall“) k neodkladnému vyšetření funkčních testů štítné žlázy (žilní TSH a fT4). Hodnoty TSH nad 30 mIU/l jsou označovány jako „pravděpodobné“ a je aktivovaný celý systém PLDD – rodiče – nejbližší centrum pro léčbu KH. Centra stanoví metodický návod MZ ČR [36]. Novorozenec musí být odeslán do centra bezodkladně. Kontrolní žilní odběr fT4 a TSH nesmí být odložen a výsledek by měl být znám v den vyšetření. Substituční léčba je zahajována neodkladně, v ČR při hospitalizaci. Vývoj dítěte a laboratorní výsledky sleduje specializovaný endokrinolog. Do tří měsíců je doplněno vyšetření sluchu metodou otoakustických emisí. Klíčovými body funkčního systému screeningu jsou pravidelně prováděné a do screeningové laboratoře pravidelně (každý pracovní den) odesílané vzorky kapilární krve novorozenců z porodnic a komunikace uvnitř systému screeningu. Laboratoře novorozeneckého screeningu informují jedenkrát ročně MZ ČR, systém má zpětnou vazbu ke každému zachycenému případu.
Diagnostika příčiny kongenitální hypotyreózy
Diagnostika příčiny je v současnosti považována za součást diagnostiky KH, nesmí ale vést k oddálení léčby. Kombinuje stanovení tyreoglobulinu, protilátek proti TPO a proti receptoru pro TSH, ultrazvukové a scintigrafické vyšetření 99mTc pertechnetátem nebo 123I. 123I je používán jen výjimečně, hlavně vzhledem k obtížnější dosažitelnosti a stabilitě radioizotopu. Jednotlivá zobrazení se provádí podle zvyklostí země a pracoviště. Informace z UZ vyšetření a scintigrafie se navzájem doplňují. Ultrazvuk poskytuje morfologický, zatímco scintigrafie funkční nález. UZ vyšetření je ovlivněno zkušeností vyšetřujícího [41]. Patologicky perzistující tkáň ductus thyreoglossus může zkreslit hodnocení UZ vyšetření u pacientů s linguální ektopií, když imponuje jako abnormální tkáň štítné žlázy. Při scintigrafickém vyšetření však tkáň zobrazená UZ radioizotop nekumuluje [41, 42] (obr. 2). Scintigrafie, pokud je využita, by měla být provedena před 5. dnem léčby před poklesem TSH [43]. V novorozeneckém věku je snadno proveditelná a je minimální zátěží. Scintigrafie není schopná rozlišit některé typy postižení (viz novorozenecká hypertyreotropinemie), nezobrazí funkční parenchym štítné žlázy při defektu receptoru pro TSH. Někdy je používáno RTG vyšetření levého kolene k posouzení závažnosti hypotyreózy.
Třetí oblastí je diagnostika přidružených stavů. Základním souborem vyšetření je UZ ledvin, srdce a vyšetření otoakustických emisí [36], v indikovaných případech pak genetické a širší endokrinologické vyšetření (parathormon).
Terapie kongenitální hypotyreózy
Léčba je zahajována 10–15 mcg L-tyroxinu/kg/den v jedné denní dávce [44] v den diagnózy. Některá zahraniční pracoviště používají alternativně pro novorozence nad 2500 g iniciální dávku 50 mcg/den s následnou redukcí po 10–14 dnech na 37,5 mcg/den a poté podle laboratorních výsledků k udržení hladin fT4 >15 pmol/l a TSH <5 mIU/l. Postup vede k rychlejší normalizaci fT4 i TSH [43]. Jiná doporučení jsou opatrnější a používají iniciální dávku 10 mcg/kg/den s tím, že další neurologický vývoj těchto dětí není odlišný od dětí iniciálně léčených vyšší dávkou [45].
Při dlouhodobé léčbě KH by se mělo předcházet výkyvům hladin TSH [46]. Kazuistiky upozorňují na výskyt papilárních a folikulárních karcinomů štítné žlázy u nemocných s dyshormonogenezí (defekt TPO a TG, Pendredův syndrom), pokud není léčba přiměřená, u nemocných se vyvine struma. Nejvíce případů je známých u mutace genu pro tyreoglobulin [47]. Situaci komplikuje histologická podobnost žlázy s poruchou hormonogeneze s karcinomy štítné žlázy, včetně pseudoinvaze do cév [48]. Jinak je riziko karcinomu u ektopických a dysgenetických strum shodné s výskytem malignit v nezměněné štítné žláze umístěné fyziologicky [49].
Mírné poruchy morfogeneze a hormonogeneze s projevy v dospělosti
Mírné poruchy vývoje nebo funkce štítné žlázy nemusí být screeningem zachyceny. Cílená anamnéza by měla odhalit potenciální výskyt v rodině a vyšetření funkce štítné žlázy by mělo být provedeno i u příbuzných, u kterých porucha funkce štítné žlázy dosud není známá.
Vliv patologických stavů novorozenců na funkci štítné žlázy
Prematurita a intrauterinní růstová restrikce
U předčasně narozených novorozenců je odpověď štítné žlázy na působení TSH snížená nezralostí hypotalamo-hypofyzární osy. Hladina TSH po porodu nestoupá, své minimum má v 72. hodině života současně s minimální hladinou fT4. Hladiny následně pomalu stoupají v prvních dvou týdnech života. Hladina T4 je po narození nižší než u donošených novorozenců a koreluje s gestačním věkem a porodní hmotností [50]. U nedonošených lze stav považovat za „fyziologický“. Chybí vliv mateřských hormonů a je nezralá autoregulace a enzymatická dejodace v periferních tkáních. Zároveň přetrvává tendence k inaktivaci T3, proto je substituce tyroxinem u velmi nezralých novorozenců s tranzientní hypotyroxinemií neúčinná. Novorozenecký screening je prováděn u předčasně narozených novorozenců ve stáří 48–72 hodin po narození s následným rescreeningem za 14 dní [7].
Při znalosti vlivu hormonů štítné žlázy na vývoj CNS byl opakovaně studován vliv tranzientní hypotyroxinemie nedonošených na jejich neurologický vývoj. Turecká studie u dětí s porodní hmotností pod 1500 g a gestačním věkem pod 32. týden neprokázala vztah mezi tranzientní hypotyroxinemií a neurologickým vývojem v 18–24 měsících života [51]. Skotská studie [52] rovněž nepotvrdila vliv tranzientní hypotyroxinemie u nedonošených novorozenců narozených před 34. gestačním týdnem na psychomotorický vývoj v 5,5 letech věku. Naopak španělská studie [53] prokázala vliv nízkých novorozeneckých hladin fT4 na poruchy neurologického vývoje ve 4 letech věku. Japonská a americká studie u dětí s gestačním věkem pod 28. týden prokázaly snížení incidence dětské mozkové obrny u dětí suplementovaných tyroxinem. Sami autoři ale doporučují provedení větší randomizované studie před zavedením suplementace do běžné praxe [54, 55]. Toto téma je stále revokováno, ale metaanalýza (Cochrane review) nepotvrdila přínos suplementace na zlepšení mortality, morbidity a neurologického vývoje nedonošených [2].
Na nízkých hladinách hormonů štítné žlázy se může spolupodílet i nedostatečný příjem jodu u nezralých novorozenců. Totální parenterální výživa neobsahuje téměř žádný jod a ani při enterální výživě nedonošeneckými fomulemi nebo fortifikovaným mateřským mlékem nedosáhneme doporučených 30 mcg/den [56]. Při podávání totální parenterální výživy je u malých dětí doporučována substituce jodu, jeho podávání u nedonošených novorozenců ale zatím nebylo ověřeno více studiemi [57]. Je známý vztah mezi závažností respiratory distress syndromu (RDS), hypotenzí a hladinou fT4 při narození [58, 59]. Rovněž při těchto stavech nebyl dosud prokázán přínos podávání tyroxinu.
Při porušené funkci fetoplacentární jednotky u intrauterinní růstové restrikce má plod a novorozenec snížené hodnoty volných T3 a T4 a pouze mírně zvýšené hodnoty TSH. Substituční podávání L-tyroxinu není v tomto případě nutné [6, 60].
Nonthyroidal illness syndrom
Předčasně narození novorozenci se závažným onemocněním (sepse, závažné trauma, operace apod.) mohou reagovat podobně jako jiné osoby v intenzivní péči adaptivní změnou funkce štítné žlázy – nonthyroidal illness syndromem (sick euthyroid syndromem). Mírná onemocnění vedou ke zvýšení hladin T4 a volného T4, se vzrůstající závažností stavu pak stoupá reverzní T3 a klesají hladiny T4 a T3 a jejich volných frakcí. Stav může vyústit až do sekundární centrální hypotyreózy. Přetrvávající nízké hladiny TSH, fT4 a fT3 jsou nepříznivým prognostickým znamením u závažně nemocných. Nejsou jednoznačné důkazy pro nebo proti substituční terapii. Substituovány by měly být nejspíše děti s dlouhotrvajícím závažným základním onemocněním s prokázaným sick euthyroid syndromem [61]. Součástí syndromu je snížení aktivity dejodázy DII, takže by substituce měla být podávána ve formě trijodtyroninu.
Závěr
Hormony štítné žlázy jsou nezbytné pro normální vývoj plodu a novorozence. Screening kongenitální hypotyreózy odhaluje pět hlavních skupin novorozenců – novorozence s kongenitální hypotyreózou, děti s novorozeneckou hypertyreotropinemií, děti se syndromickým postižením, předčasně narozené a závažně nemocné novorozence. Každá ze skupin má svá diagnostická a terapeutická specifika. V případě kongenitální hypotyreózy je zahajována terapie L-tyroxinem v den diagnózy, tranzientní hypertyreotropinemie je indikována k léčbě podle hodnot TSH po druhém týdnu života. U předčasně narozených novorozenců je vzhledem k nezralosti funkce štítné žlázy prováděn rescreening ve 14 dnech věku, terapie tranzientní hypotyroxinemie nedonošených není zatím jednoznačně doporučována. U novorozenců s dlouhodobým závažným průběhem základního onemocnění a prokázaným sick euthyroid syndromem by měla být podávána substituce ve formě trijodtyroninu. Pokud léčba není indikovaná, vyžadují tyto děti sledování stavu. V indikovaných případech zabraňuje časně zahájená substituční terapie nevratnému poškození dalšího vývoje těchto dětí.
Použité zkratky:
g. t. – gestační týden, HOX – homeodoménové geny, KH – kongenitální hypotyreóza,
NHT – novorozenecká hypertyreotropinemie,
NIS – natrium-jodidový symportér,
PLDD – praktický lékař pro děti a dorost,
RDS – respiratory distress syndrom , rT3 – reverzní trijodtyronin, T3 – trijodtyronin, T4 – tyroxin,
TBG – tyroxin vážící globulin, Tg – tyreoglobulin, THOX – tyreoidální oxidáza,
TPO – tyreoidální peroxidáza, TRH – tyreoliberin, TSH – tyreostimulační hormon,
TSH-R – receptor pro tyreostimulační hormon, TTF1 a 2 – tyreoidální transkripční faktory 1 a 2
Autoři jsou vděční za revizi textu profesoru MUDr. Václavu Zamrazilovi, DrSc.
Obrazová dokumentace je publikována se souhlasem rodičů.
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Došlo: 2. 12. 2012
Přijato: 1. 5. 2013
MUDr. David Neumann, Ph.D.
Dětská klinika FN
Sokolská tř. 581
500 05 Hradec Králové
e-mail: david.neumann@fnhk.cz
Sources
1. Krylová K, Neumann D, Al Taji E, et al. Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence. Čes-slov Pediat 2013; 68 (4): 260–265.
2. Bursell JDH, Warner JT. Interpretation of thyroid function in chidren. Ped Child Health 2007; 17 : 361–366.
3. De Felice M, Di Lauro R. Thyroid development and its disorders: genetics and molecular mechanisms. Endocr Rev 2004; 25 : 722–746.
4. Deladoëy J, Ruel J, Giguère Y, Van Vliet G. Is the incidence of congenital hypothyroidism really increasing? A 20-year retrospective population-based study in Québec. J Clin Endocrinol Metab 2011; 96 : 2422–2429.
5. Brown RS, Shalhoub V, Coulter S, et al. Developmental regulation of thyrotropin receptor gene expression in the fetal and neonatal rat thyroid: relation to thyroid morphology and to thyroid-specific gene expression. Endocrinology 2000; 141 : 340–345.
6. Ogilvy-Stuart A, Midgley P. Practical Neonatal Endocrinology. Cambridge: Cambridge University Press, 2006 : 1–218. ISBN 978-0-521-83849-8.
7. Raine JE, Donaldson MDC, Gregory JW, et al. Practical Endocrinology and Diabetes in Children. John Wiley & Sons, 2006 : 1–256. ISBN-13 : 978-1-4051-2233-7. ISBN-10 : 1-4051-2233-1.
8. Mutlu M, Karagüzel G, Aliyazicioglu Y, et al. Reference intervals for thyrotropin and thyroid hormones and ultrasonographic thyroid volume during neonatal period. J Mat Fet Neonat Med 2012; 25 (2): 120–124.
9. Freire C, Ramos R, Amaya E, et al. Newborn TSH concentration and its association with cognitive development in healthy boys. Eur J Endocrinol 2010; 163 : 901–909.
10. Abduljabbar M, Al Shahri A, Afifi A. Is umbilical cord blood total thyroxin measurement effective in newborn screening for hypotyhroidism? J Med Screen 2009; 16 : 119–123.
11. Turan S, Bereket A, Angaji M, et al. The effect of the mode of delivery on neonatal thyroid function. J Matern-Fetal Neonatal Med 2007; 20 : 473–476.
12. Djemli A, van Vliet G, Delvin EE. Congenital hypothyroidism: from Paracelsus to molecular diagnosis. Clin Biochem 2006; 36 : 511–518.
13. Al Taji E, Biebermann H, Limanova Z, et al. Screening for mutations in transcription factors in a Czech cohort of 170 patients with congenital and early-onset hypothyroidism: identification of a novel PAX8 mutation in dominantly inherited early-onset non-autoimmune hypothyroidism. Eur J Endocrinol 2007; 156 : 521–529.
14. Park SM, Chatterjee VKK. Genetics of congenital hypothyroidism. J Med Genet 2005; 42 : 379–389.
15. Léger J, Marinovic D, Garel C, et al. Thyroid develop-mental anomalies in first degree relatives of children with congenital hypothyroidism. J Clin Endocrinol Metab 2002; 87 : 575–580.
16. Moreno JC, Klootwijk W, van Toor H, et al. Mutations in the iodotyrosine deiodinase gene and hypothyroidism. N Engl J Med 2008; 358 : 1811–1818.
17. Pohlenz J, Madeiros-Neto G, Gross JL, et al. Hypothyroidism in a brazilian kindred due to iodide trapping defect caused by a homozygous mutation in the sodium/iodide symporter gene. Biochem Biophys Res Comm 1997; 240 : 488–491.
18. Niu HM, Lin CY, Hwang B, et al. Contribution of genetic factors to neonatal transient hypothyroidism. Arch Dis Child Fetal Neonatal Ed 2005; 90: F69–F72.
19. Jeziorowska A, Pniewska-Siark B, Brzeziańska E, et al. A novel mutation in the thyrotropin (thyroid-stimulating hormone) receptor gene in a case of congenital hypothyroidism. Thyroid 2006; 16 : 1303–1309.
20. AAP, ATA. Update of newborn screening and therapy for congenital hypothyroidism. Pediatrics 2006; 117 : 2290–2303.
21. Gaudino R, Garel C, Czernichow P, Léger J. Proportions of various types of thyroid disorders among newborns with congenital hypothyroidism and normally located gland: a regional cohort study. Clin Endocrinol 2005; 62 : 444–448.
22. Reynolds BC, Simpson JH, Macara L, et al. Goitrous congenital hypothyroidism in a twin pregnancy causing respiratory obstruction at birth: Implications for management. Acta Paediatrica 2006; 95 : 1345–1348.
23. Banghova K, Al Taji E, Cinek O, et al. Pendred syndrome among patients with congenital hypothyroidism detected by neonatal screening: identification of two novel PDS/SLC26A4 mutations. Eur J Pediatr 2008; 167 : 777–783.
24. Nebesio TD, McKenna MP, Michael P, et al. Newborn screening results in children with central hypothyroidism. J Pediatr 2010; 156 : 990–993.
25. McGovan S, Jones JH, Brown A, et al. Capillary TSH screening programme for Down’s syndrome in Scotland, 1997–2009. Arch Dis Child 2011; 96 : 1113–1117.
26. O’Grady MJ, Cody D. Subclinical hypothyroidism in childhood. Arch Dis Child 2011; 96 : 280–284.
27. Medeiros-Neto G, Gil-Da-Costa MJ, Santos CLS, et al. Metastatic thyroid carcinoma arising from congenital goiter due to mutation in the thyroperoxidase gene. J Clin Endocrinol Metab 1998; 83 : 4162–4166.
28. Wit JM, Ranke MB, Kelnar CJH (eds). ESPE classification of paediatric endocrine diagnosis. 7. Thyroid disorders. Horm Res 2007; 68 (Suppl 2): 44–47.
29. Zung A, Tenenbaum-Rakover Y, Barkan S, et al. Neonatal hyperthyrotropinemia: population characteristics, diagnosis, management and outcome after cessation of therapy. Clin Endocrinol 2010; 72 : 264–271.
30. Parks JS, Lin M, Grosse SD, et al. The impact of transient hypothyroidism on the increasing rate of congenital hypothyroidism in the United States. Pediatrics 2010; 125: S54–S63.
31. Niwa F, Kawai M, Kanazawa H, et al. Hyperthyrotropinemia at 2 weeks of age indicates thyroid dysfunction and predicts the occurrence of delayed elevation of thyrotropin in very low birth weight infants. Clin Endocrinol 2012; 77 : 255–261.
32. Bhatia V. Congenital hypothyroidism is not always permanent: caveats to newborn thyroid screen interpretation. Ind Pediatr 2010; 17 : 753–754.
33. Li M, Eastman CJ. Neonatal TSH screening: is it a sensitive and reliable tool for monitoring iodine status in populations? Best Pract Res Clin Endocrinol Metab 2010; 24 : 63–75.
34. Kempers MJE, Lanting CI, van Heijst AFJ, et al. Neonatal screening for congenital hypothyroidism based on thyroxine, thyrotropin, and thyroxine-binding globulin measurement: potentials and pitfalls. J Clin Endocrinol Metab 2006; 91 : 3370–3376.
35. Sperling MA. Pediatric Endocrinology. 2nd ed. Saunders, 2002 : 1–816. ISBN 0-7216-9539-6.
36. Metodický návod k zajištění celoplošného novorozeneckého laboratorního screeningu a následné péče. Věstník Ministerstva zdravotnictví České republiky 2009; částka 6 : 7–14.
37. Weber G, Vigone MC, Rapa A, et al. Neonatal transient hypothyroidism: aetiological study. Arch Dis Child Fetal Neonat Ed 1998; 79: F70–72.
38. Rovelli R, Vigone MC, Giovanettoni C, et al. Newborn of mothers affected by autoimmune thyroiditis: the importance of thyroid function monitoring in the first months of life. Ital J Pediatr 2010; 36 : 24–29.
39. Hnikova O, Kracmar P, Zelenka Z, et al. Screening of congenital hypothyroidism in newborns in Bohemia and Moravia. Endocrinol Exp 1989; 23 : 117–123.
40. Votava F, Strnadová K. Novorozenecký screening v České republice a v Evropě. Čes-slov Pediat 2008; 63 : 96–105.
41. Jones JJ, Attaie M, Maroo S, et al. Heterogeneous tissue in the thyroid fossa on ultrasound in infants with proven thyroid ectopia on isotope scan – a diagnostic trap. Pediatr Radiol 2010; 40 : 725–731.
42. Ahuja AT, King AD, King W, Metreweli C. Thyroglossal duct cysts: sonographic appearances in adults. Am J Neuroradiol 1999; 20 : 579–582.
43. Donaldson MCD, Jones JH, Brown A (SPEG group). Guideline for the management of congenital hypothyroidism in Scotland Review 05/10/2012, 16 s. http://www.clinicalguidelines.scot.nhs.uk.
44. Fisher DA. The importance of early management in optimizing IQ in infants with congenital hypothyroidism. J Pediatr 2000; 136 : 273–274.
45. APEG Guidelines for Management of Congenital Hypothyroidism. 8 s. http://www.apeg.org.au.
46. Haymart MR, Repplinger DJ, Leverson GE, et al. Higher serum thyroid stimulating hormone level in thyroid nodule patients is associated with greater risk of differentiated thyroid cancer and advanced tumor stage. J Clin Endocrinol Metab 2008; 93 : 809–814.
47. Hishinuma A, Fukata S, Kakudo K, et al. High incidence of thyroid cancer in long-standing goiters with thyroglobulin mutations. Thyroid 2005; 15 : 1079–1084.
48. Desphande AH, Bobhate SK. Cytological features of dyshormonogenetic goitre: case report and review of the literature. Diagn Cytopathol 2005; 33 : 252–254.
49. Altay C, Erdogan N, Karasu S, et al. CT and MRI findings of developmental abnormalities and ectopia varieties of the thyroid gland. Diagn Interv Radiol 2012; 18 : 335–343.
50. Biswas S, Buffery J, Enoch H, et al. A longitudinal assessment of thyroid hormone concentrations in preterm infants younger than 30 weeks gestation during the first two weeks of life. Pediatrics 2002; 109 : 222–227.
51. Dilli D, Eras Z, Andiran N, et al. Neurodevelopmental evaluation of very low birth weight infants with transient hypothyroxinemia at corrected age of 18–24 months. Indian Pediatr 2012, pii: S097475591100706-1.
52. Delahunty C, Falconer S, Hume R, et al. Levels of neonatal thyroid hormone in preterm infants and neurodevelopmental outcome at 5 ½ years: millenium cohort study. J Clin Endocrinol Metab 2010; 95 : 4898–4908.
53. Ares S, Quero J, Diez J, Morreale de Escobar G. Neurodevelopment of preterm infants born at 28 to 36 weeks of gestation age: the role of hypothyroxinemia and long-term outcome at 4 years. J Pediatr Endocrinol Metab 2011; 24 : 897–902.
54. Suzumura H, Nitta A, Tsuboi Y, et al. Thyroxine for transient hypothyroxinemia and cerebral palsy in extremely preterm infants. Pediatr Int 2011; 53 : 463–467.
55. La Gamma EF, Paneth N. Clinical importance of hypothyroxinemia in the preterm infant and a discussion of treatment concerns. Curr Opin Pediatr 2012; 24 : 172–180.
56. Belfort MB, Pearce EN, Braveman LE, He X, Brown RS. Low iodine content in the diets of hospitalized preterm infants. J Clin Endocrinol Metab 2012; 97 : 632–636.
57. Zimmermann MB. Iodine: it´s important in patients that require parenteral nutrition. Gastroenterology 2009; 137 : 36–46.
58. Paul DA, Mackley A, Yencha EM. Thyroid function in term and late preterm infants with respiratory distress and relation to severity of illness. Thyroid 2010; 20 : 189–194.
59. Goissen C, Fontaine C, Braun K, et al. Prospective study at 1 week of thyroid function in 97 consecutive preterm newborns under 32 weeks of gestation. Arch Pediatr 2011; 18 : 253–260.
60. Chan S, Kilby MD. Thyroid hormone and central nervous system development. J Endocrinol 2000; 16 : 1–8.
61. Golombek SG. Nonthyroidal illness syndrome and euthyroid sick syndrome in intensive care patiens. Semin Perinatol 2008; 32 : 413–418.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2013 Issue 5-
All articles in this issue
- Vliv perikoncepční expozice kouření na mužskou reprodukci: poměr pohlaví a nástup puberty
- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
- Je prostredie detských pieskovísk pre zdravie detí bezpečné?
- Rozdiely v duševnom zdraví žiakov v meste a na vidieku
- Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
- Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
- Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
- Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
- Je prostredie detských pieskovísk pre zdravie detí bezpečné?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

