-
Medical journals
- Career
Nekrotizujúca enterokolitída donosených novorodencov – kazuistika a prehľad literatúry
Authors: K. Maťašová 1; D. Murgaš 2; M. Zibolen 1
Authors‘ workplace: Neonatologická klinika JLF UK a UNM, Martin prednosta prof. MUDr. M. Zibolen, CSc. 1; Klinika detskej chirurgie JLF UK a UNM, Martin prednosta doc. MUDr. M. Dragula, PhD, mim. prof. 2
Published in: Čes-slov Pediat 2011; 66 (6): 372-379.
Category: Case Report
Overview
Nekrotizujúca enterokolitída (NEC) sa môže zriedkavo vyvinúť aj u donosených novorodencov. Pre NEC u donosených je typická manifestácia ochorenia vo veku 2–4 dní, prednostné postihnutie hrubého čreva a prítomnosť iného primárneho ochorenia, ktoré negatívne ovplyvňuje prekrvenie čreva. Etiopatogenéza je nejasná, dôležitá je prítomnosť iného rizikového faktora, kolonizácie čreva patogénnou mikroflórou a perorálna výživa. Pre včasnú diagnostiku je prínosné sonografické vyšetrenie, ktoré ukáže prítomnosť plynu v črevnej stene už v začiatočnom štádiu ochorenia.
Kazuistika uvádza prípad dieťaťa narodeného v 36. gestačnom týždni s pôrodnou hmotnosťou 1950 g, Apgar 10/10, ktoré bolo od druhého dňa liečené antibiotikami pre perinatálnu infekciu narodení, leukopénia, trombocytopénia), s negatívnou hemokultúrou, bezhemodynamickej instability. Vo veku 4 dní dieťa zvracia krv, na RTG bruchaviditeľná pneumatóza čreva – nález charakteristický pre NEC. Napriek liečbeo 24 hodín neskôr diagnostikované pneumoperitoneum, chirurgický výkon jepre neliečiteľnú koagulopatiu kontraindikovaný. Dieťa zomrelo vo veku 6 dní.Patologicko-anatomický nález potvrdil prítomnosť rozsiahlej nekrotizujúcejenterokolitídy s perforáciou a difúznou peritonitídou.Kľúčové slová:
nekrotizujúca enterokolitída, donosený novorodenec, pneumoperitoneum, pneumatóza črevaÚVOD
Nekrotizujúca enterokolitída (NEC) je najčastejšou náhlou brušnou príhodou v novorodeneckom veku, ktorá často vyžaduje chirurgickú intervenciu. Charakterizuje ju poškodenie slizničnej bariéry v čreve, zápal vyvolaný prítomnými patogénnymi mikroorganizmami a nekróza črevnej steny. Možnou komplikáciou je perforácia čreva, peritonitída, sepsa a ochorenie môže končiť úmrtím.
NEC je ochorením, ktoré v typickom prípade postihuje extrémne nezrelých novorodencov. Zriedkavo sa však môže vyvinúť aj u novorodencov narodených v termíne, u ktorých sa pri diferenciálnej diagnostike enterorágie na túto diagnózu zvyčajne nemyslí. NEC u donosených má niektoré špecifické znaky. Spravidla sa vyvinie u novorodenca liečeného primárne na iné ochorenie. Druhou charakteristikou je včasná manifestácia – väčšinou vo veku 2–4 dní po narodení, kým u nedonosených sa prvé príznaky objavujú priemerne vo veku 20 dní. Tretím typickým znakom je prednostné postihnutie hrubého čreva, u nedonosených sú zápalové zmeny lokalizované najmä v terminálnom ileu a v jejune. Literatúra uvádza, že NEC sa diagnostikuje u približne 2–4 % všetkých novorodencov vyžadujúcich intenzívnu starostlivosť [1, 2]. Zatiaľ nie je známe, či NEC u donosených je odlišným ochorením ako u nedonosených, ale viacerí autori túto možnosť pripúšťajú [3, 4, 5, 6]. Keďže NEC sa u donosených novorodencov vyskytuje oveľa skôr po narodení, je možné predpokladať, že patogenéza ochorenia je u nich v porovnaní s predčasne narodenými odlišná.
INCIDENCIA
Literárne údaje týkajúce sa incidencie NEC u novorodencov narodených v termíne sa rôznia, najčastejšie sa uvádza 0,05–0,06 na 1000 živonarodených detí [2, 5, 6]. Maayan-Metzger a kol. popisujú vo svojom súbore vyššiu incidenciu NEC – 0,71 na 1000 živonarodených, čo predstavuje 58 % všetkých prípadov NEC [5]. Naproti tomu iní autori uvádzajú, že deti narodené v termíne predstavujú približne 7–25 % všetkých prípadov NEC [1, 6].
Podobne ako incidencia, ani prevalencia NEC u donosených novorodencov nie je presne známa. Bolisetty a kol. [6] vo svojej práci odhadujú, že v Austrálii sa vyskytuje približne u 1 z 20 000 donosených novorodencov. Vo výskyte NEC neboli popísané sezónne rozdiely a obidve pohlavia bývajú postihnuté v rovnakej miere. Hoci je priemerný vek manifestácie ochorenia u donosených novorodencov 2–4 dni, približne v 40 % sa prvé príznaky objavujú už v priebehu prvého dňa po narodení [5, 7].
ETIOLÓGIA A RIZIKOVÉ FAKTORY
Etiológia NEC zostáva nepoznaná u všetkých detí bez ohľadu na ich gestačný vek a zvlášť u novorodencov narodených v termíne. Jediným známym faktorom predisponujúcim k jej vzniku je nezrelosť. Okrem toho nie je známy žiadny činiteľ alebo ich kombinácia, ktoré by jednoznačne zvyšovali riziko rozvoja NEC. Napriek tomu sa vo všeobecnosti za rizikové považujú tie ochorenia, ktoré vedú k zníženiu prietoku krvi v čreve alebo zvyšujú jeho metabolickú aktivitu, čo môže spôsobiť ischémiu čreva. Významná je aj včasná kolonizácia tráviaceho traktu patogénnou mikroflórou. Včasná manifestácia ochorenia môže byť pravdepodobne dôsledkom prenatálneho ischemického inzultu, aj keď po narodení dieťa nejaví známky perinatálnej asfyxie. Jeho následkom je obmedzenie perfúzie čreva, ktoré môže byť asymptomatické a nemusí byť diagnostikovateľné pred začatím perorálnej výživy [5].
NEC je u donosených zvyčajne komplikáciou iného primárneho ochorenia, ktoré bolo dokumentované u 50–66 % detí s NEC [3, 5, 6]. Stout a kol. [8] uvádzajú v skupine 49 donosených novorodencov s NEC, že až 48 z nich vyžadovalo primárne intenzívnu starostlivosť pre iné ochorenie, ktoré je pravdepodobne príčinou porušenej perfúzie čreva. Najčastejšie sa NEC vyskytuje v súvislosti s kritickými vrodenými vývojovými chybami srdca (VCC), včasnou sepsou, hypotenziou alebo polycytémiou. Nedostatočné prekrvenie čreva môže byť aj krátkodobé, napríklad v dôsledku požitia drog. Popísané boli prípady donosených novorodencov s NEC, u ktorých boli v mekóniu zistené opiáty, kokaín a kanabinoidy [8]. Podobné výsledky uvádzajú aj Lambert a kol. [3]. Zo skupiny 30 donosených detí, u ktorých sa rozvinula choroba, bolo 28 hospitalizovaných na JIS pre inú príčinu, u zvyšných 2 sa rozvinula NEC 2 dni po prepustení z JIS. Z uvedeného súboru 28 detí bolo 9 % primárne liečených pre perinatálnu asfyxiu, u 50 % boli dôvodom na intenzívnu starostlivosť sepsa alebo šok a v 13 % bola diagnostikovaná polycytémia.
Sledovaný bol aj vplyv spôsobu výživy na rozvoj NEC. Zistilo sa, že približne 90 % donosených detí bolo pred rozvojom ochorenia kŕmených, pričom u väčšiny z nich bola podávaná buď formula alebo kombinácia formuly a materského mlieka. Žiadne z nich nebolo výlučne dojčené. Či dojčenie môže ochrániť choré dieťa pred rozvojom NEC nie je známe, ale na základe uvádzaných výsledkov je táto možnosť pravdepodobná. Predpokladá sa, že neúplne strávená potrava je substrátom pre rast baktérií. Kŕmenie zároveň zvyšuje požiadavky na dodávku kyslíka počas vstrebávania živín, čím zvyšuje riziko hypoxie čreva, ktorá môže spôsobiť poškodenie sliznice, a tak umožní bakteriálnu inváziu [3, 5, 8]. Okrem druhu bolo v súvislosti s rozvojom NEC sledované aj množstvo podávaného mlieka. U približne polovice z nich boli zaznamenané vyššie podávané objemy pri kŕmení z fľaše ako u porovnateľnej skupiny dojčených [8]. Autori uvažujú, či pomalé a opatrné kŕmenie nie je nápomocné v prevencii rozvoja ochorenia a naopak, či rýchle zvyšovanie objemu podávaného mlieka rizikovým a chorým novorodencom nezvyšuje pravdepodobnosť rozvoja NEC. Na základe výsledkov získaných retrospektívnou analýzou údajov predpokladajú, že kombinácia zníženej perfúzie čreva a kŕmenie formulou sú predisponujúce faktory rozvoja NEC u donosených novorodencov [3]. Uvedený predpoklad potvrdzuje aj kazuistika dvoch novorodencov s polycytémiou (hematokrit viac ako 0,7), u ktorých sa vyvinula choroba v priebehu prvého týždňa života. Obidve deti boli kŕmené výlučne formulou a dosiahli plný príjem (160 ml/kg/deň) do 72 hodín po narodení. Pri laparotómii bolo zistené nekrotické postihnutie celého čreva [9].
Za rizikový faktor rozvoja ochorenia je považovaná, podobne ako u predčasne narodených, aj významná intrauterinná rastová retardácia [10]. Okrem toho bola NEC popísaná u novorodencov narodených v termíne v súvislosti s výmennou transfúziou, katetrizáciou umbilikálnych ciev, predčasným odtokom plodovej vody s - alebo bez chorioamnionitídy, gestačným diabetes mellitus matky a preeklampsiou [5, 6]. Zaujímavý je aj údaj o vyššej incidencii u donosených novorodencov liečených pre ťažkú hemolytickú chorobu podaním vysokých dávok imunoglobulínov (500 mg/kg/deň) [11]. V literatúre sa tiež objavujú zmienky o možnej súvislosti medzi NEC a Hirschsprungovou chorobou. Raboei [13] uvádza nález aganglionózy v rekte u 4 zo 7 donosených detí s NEC. Ochorenie sa môže vyskytovať aj v súvislosti s gastroschízou a meningomyelokélou [6].
Pre rozvoj choroby je nevyhnutná bakteriálna kolonizácia čreva. Literatúra uvádza prípad donoseného dieťaťa, u ktorého sa rozvinula agresívna forma ochorenia a v kultivácii zo stolice i v hemokultúre bol zaznamenaný pozitívny nález Escherichia coli O157:H7. Napriek liečbe sa u dieťaťa vyvinula letálna nekróza celého čreva [12].
Súvislosť medzi vznikom NEC a pôrodom cisárskym rezom nie je jednoznačne vysvetlená a v súčasnosti sa pôrod sekciou nepovažuje za rizikový faktor [5]. Avšak v literatúre sa objavuje diskusia o možnom mechanizme, keď celková anestéza pri elektívnom cisárskom reze môže spôsobiť prechodný pokles krvného tlaku a mohla by tak obmedziť placentárnu a fetálnu cirkuláciu. Okrem toho poloha matky na chrbte pred a počas operácie môže ďalej redukovať fetálnu cirkuláciu a negatívne ovplyvniť prekrvenie čreva plodu [14]. Ďalšie objasnenie súvislosti medzi rozvojom choroby a spôsobom pôrodu vyžaduje ďalšie sledovanie.
Bolisetty a kol. [6] popisujú u 17 % detí s NEC pridruženú endokrinnú poruchu – panhypopituitarizmus, hypotyreózu, hypoparatyreózu a kongenitálnu adrenálnu hyperpláziu. Na druhej strane je ťažké povedať, akou veľkou mierou sa tieto endokrinopatie podieľajú na jej rozvoji – napríklad Di Georgov syndróm bol spojený s VCC, hypopituitarizmus môže byť dôvodom nevysvetliteľnej pôrodnej asfyxie. Zdá sa pravdepodobné, že hormonálny deficit s abnormálnou odpoveďou na stres môže byť čiastočne zodpovedný za zvýšenú vnímavosť týchto detí na hypoxické poškodenie a rozvoj NEC. Pri hypotyreóze je možnou patofyziologickou súvislosťou znížená motilita gastrointestinálneho traktu v dôsledku periférnej neuropatie čreva pri deficite hormónov štítnej žľazy. Pri kŕmení môže dôjsť k nadmernému pomnoženiu baktérií, nadmernej tvorbe plynu a distenzii brucha. Druhým príčinným faktorom je hemodynamický efekt deficitu hormónov štítnej žľazy. Vo fetálnom a perinatálnom období sú potrebné tyroidálne hormóny na normálne zvýšenie srdcového výdaja ako odpovede na katecholamíny. Nedostatočný vzostup srdcového výdaja v súvislosti so stresom môže viesť k zníženiu prietoku v mezenteriálnej cirkulácii a ischémii čreva [5, 15].
Významným predisponujúcim faktorom pre rozvoj NEC je VCC. Jej incidencia v skupine 643 novorodencov s VCC bola 3,3 %, čo je približne 10–100-násobne viac v porovnaní s celkovou populáciou novorodencov. Najväčším rizikom je hypoplastický ľavokomorový syndróm a truncus arteriosus. V skupine detí s hypopláziou ľavého srdca je uvádzaný výskyt NEC 7,6 %, pri ostatných VCC 2,1 %. Ďalšie rizikové faktory u detí s VCC pre rozvoj ochorenia sú vysoké dávky prostaglandínov – viac ako 0,05 μg/kg/min, epizódy zníženého kardiálneho výdaja a klinický šok. V tejto skupine nebol preukázaný vplyv výživy na výskyt ochorenia. Súvislosť medzi VCC a NEC u donosených detí je potrebné hľadať v negatívnom ovplyvnení mezenteriálnej cirkulácie. Pri VCC spojených s ľavo-pravým skratom na úrovni veľkých artérií môže byť v aorta descendens počas diastoly retrográdny tok krvi, čo môže byť potenciálnou príčinou ischémie mezenteriálnej oblasti. U pacientov s obmedzením výtoku z ľavej komory (pri koarktácii aorty, hypoplázii ľavého srdca) môže pri uzatvorení ductus arteriosus dôjsť k zlyhaniu cirkulácie s následnou ischémiou čreva. Okrem toho u mnohých z týchto pacientov bola potrebná katetrizácia umbilikálnej artérie i katetrizácia srdca, čo sú pravdepodobne ďalšie rizikové faktory [4].
PATOGENÉZA
Hoci je NEC významnou príčinou neonatálnej morbidity a mortality, jej patogenéza nie je úplne objasnená. Predstavuje najpravdepodobnejšie komplex interakcií faktorov predisponujúcich k poškodeniu sliznice a následnej odpovede dieťaťa. Pri NEC dochádza jednoznačne k ischémii čreva, ktorú v histopatologickom obraze dokazuje prítomnosť koagulačnej nekrózy. Nie je však jasné, či ischémia je primárnym činiteľom, alebo je následkom poškodenia čreva z iných príčin. Je pravdepodobné, že ischémia zohráva sekundárnu, ale kľúčovú úlohu v progresii ochorenia [16].
Významným činiteľom v patogenéze NEC sú baktérie. Fermentácia cukrov v lúmene čreva činnosťou baktérií vedie k tvorbe vodíka (ide o plyn, ktorý bol nájdený v stene čreva pri pneumatóze). Okrem toho pri porušenej celistvosti sliznice baktérie prechádzajú translokáciou do regionálnych lymfatických uzlín a aktivujú makrofágy. Bakteriálnou translokáciou alebo absorpciou bakteriálnych toxínov dochádza k tvorbe zápalových mediátorov, čo je kľúčovým bodom v patogenéze. Zvieracie štúdie ukázali, že zvýšený TNF a doštičkový aktivujúci faktor (PAF) vedú k ďalšiemu poškodeniu sliznice čreva [7]. Poškodenie endotelu v dôsledku pôsobenia zápalových mediátorov je príčinou poruchy regulácie perfúzie čreva. Odpor v cievach vyživujúcich črevo je v princípe určený rovnováhou medzi tvorbou vazokonstrikčne pôsobiaceho peptidu endotelínu 1 (ET-1) a oxidu dusnatého (NO), ktorý pôsobí vazodilatačne. Obidva sú produkované endotelovými bunkami a za fyziologických okolností prevažuje vazodilatácia sprostredkovaná NO, čo sa prejaví nízkym cievnym odporom a súčasne vysokým prietokom krvi. Pri poškodení endotelových buniek sa uvedená rovnováha naruší a prevládajúcou sa stane vazokonstrikcia. Výsledkom je ischémia, ktorá môže postihnúť veľký úsek čreva [16].
DIAGNOSTIKA
Klinické prejavy NEC u novorodencov narodených v termíne sú podobné ako príznaky popisované pri NEC u nezrelých. Zvyčajne ide o distenziu brucha, zvracanie, prímes krvi v stolici a celkové príznaky sepsy. Pre diagnostiku sa používajú kritériá navrhnuté Bellom [17], ktoré boli následne modifikované Walshom a Kliegmanom [18] a prijaté sieťou Vermont Oxford Network [8].
Táto definícia vyžaduje prítomnosť jedného alebo viacerých z nasledujúcich 3 klinických príznakov: 1. žalúdočné reziduum s obsahom žlče alebo zvracanie žlčou sfarbeného obsahu, 2. distenzia brucha, 3. okultné krvácanie alebo masívna prímes krvi v stolici (bez fisury) a prítomnosť jedného alebo viacerých z 3 nasledujúcich RTG zmien: 1. pneumatóza čreva, 2. plyn v portálnom riečisku, 3. pneumoperitoneum.
V diferenciálnej diagnostike pneumoperitonea prichádza do úvahy aj spontánna fokálna perforácia čreva bez prítomnosti zápalu a nekrózy. Ich rozlíšenie umožní len vizuálne zhodnotenie čreva počas laparotómie a histologické vyšetrenie [8]. Modifikované kritériá podľa Bella [7] definujúce jednotlivé štádiá NEC sú uvedené v tabuľke 1.
Table 1. Modifikovaná klasifikácia NEC podľa Bella [7]. ![Modifikovaná klasifikácia NEC podľa Bella [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2173c65c25c741268798a8b56bd80948.png)
Klinická manifestácia ochorenia, ako aj výsledky laboratórnych vyšetrení sú vo včasných štádiách nešpecifické. Trombocytopénia a zmeny počtu leukocytov sú neskorými príznakmi, a preto nepomôžu pri rozhodovaní vo včasnej fáze ochorenia. V III. štádiu je v porovnaní s II. štádiom významnejšia leukopénia, ktorá tiež súvisí s vyššou mortalitou. Uvádza sa aj nižšie prežívanie tých detí, u ktorých bola zistená trombocytopénia. Horšia prognóza bola zaznamenaná pri trombocytopénii menej ako 100x109/l [19].
CRP je zvýšené v II. a III. štádiu. Dá sa predpokladať, že trvalo zvýšené CRP poukazuje na pridružené komplikácie a môže byť indikáciou na chirurgickú intervenciu [19, 20]. V I. štádiu podľa Bella dosahuje CRP významne nižšie hodnoty ako v III. štádiu. Význam CRP pre rozhodovanie o liečbe alebo odhade prognózy zostáva nejasný [19]. U dieťaťa s podozrením na NEC je možné na základe normálnych hodnôt CRP pri opakovaných denných vyšetreniach skôr ukončiť antibiotickú liečbu a včas začať perorálnu výživu [20].
Pri NEC boli sledované aj ďalšie parametre, ako sú prokalcitonín, interleukíny a PAF, ale ich klinický význam pre včasnú diagnostiku zatiaľ nebol stanovený. Ďalší parameter, ktorý by mohol byť nápomocný v diagnostike, je laktát. Zistilo sa, že vyššia koncentrácia laktátu koreluje so závažnosťou ochorenia [19]. Koncentrácia laktátu v sére sa bežne používa ako indikátor infarktu v mezenteriálnej oblasti alebo peritonitídy v chirurgii u dospelých. V experimentálnych prácach bolo zistené, že pri ischémii čreva sa koncentrácia laktátu v sére rýchlo zvýši. Zvýšené vylučovanie D-laktátu v moči u novorodencov s NEC môže byť pravdepodobne následkom ischémie čreva. Kessler a kol. uvádzajú významnú koreláciu medzi koncentráciou laktátu pred operáciou a mortalitou (2,6 ± 0,25 mg/dl u prežívajúcich a 7,0 ± 3,7 mg/dl u zomretých) [19].
Vzhľadom na nejednoznačnosť výsledkov klinického i laboratórneho vyšetrenia sa javí optimálnym použitie viacerých parametrov a vytvorenie skórovacieho systému. Na základe retrospektívnej analýzy údajov od 128 novorodencov liečených pre NEC bolo stanovené tzv. „NEC skóre“, ktoré je možné použiť orientačne na odhad prognózy vzhľadom na prežitie. „NEC skóre“ berie do úvahy gestačný vek dieťaťa, klinický stupeň ochorenia podľa Bella a výsledky niektorých laboratórnych vyšetrení. Skórovací systém je uvedený v tabuľke 2. Senzitivita predpovede prežívania u tohto skóre je 0,71 a špecificita 0,72. Optimálna hodnota skóre by mala dosiahnuť maximum 4–5 bodov z 8 možných. Zhodnotenie účinnosti uvedeného skórovacieho systému vyžaduje ďalšie, prospektívne sledovanie [19].
RTG vyšetrenie
Jednoznačným RTG nálezom, ktorý je charakteristický pre NEC, je pneumatóza čreva. Popisuje sa u 70–89 % postihnutých detí [6]. RTG obraz bubliniek v črevnej stene je podmienený akumuláciou plynu, vytvoreného činnosťou črevných baktérií, v submukóze a subseróze čreva.
Iné príznaky gangrény čreva alebo hroziacej perforácie sú plyn vo vena portae (PVG), fixovaná dilatovaná črevná kľučka, voľná tekutina v peritoneálnej dutine alebo pneumoperitoneum. PVG vzniká preniknutím plynu z čreva do portálneho systému prostredníctvom mezenteriálnych vén [7].
Sonografia
Sonografické vyšetrenie, hoci je zatiaľ v diagnostike NEC málo používané, poskytuje užitočné informácie hlavne v situácii, ak je klinický i RTG nález nešpecifický. Tradične sa voľný vzduch v peritoneálnej dutine diagnostikuje na základe RTG vyšetrenia. Ukazuje sa, že sonografia môže byť v tejto situácii dokonca citlivejšou metódou. Malé množstvo voľného vzduchu nemusí byť dobre viditeľné na RTG a môže sa prehliadnuť, rovnako ako nie je možné podľa RTG zistiť malú ohraničenú kolekciu tekutiny, ktorá vznikne ako následok zrastov pri krytej perforácii čreva [21, 22]. Vzhľadom na jeho neinvazívnosť je možné použiť ho na bed-side monitorovanie dieťaťa. Sonograficky je možné hodnotiť viaceré parametre: echogenitu a hrúbku črevnej steny, perfúziu čreva, prítomnosť plynu v črevnej stene, prítomnosť plynu v portálnom riečisku, voľný vzduch v peritoneálnej dutine, voľnú tekutinu v peritoneálnej dutine, prítomnosť hyperechogénnych reflexov vo voľnej tekutine alebo ohraničenú kolekciu tekutiny [21]. Zvýšená echogenita i hrúbka črevnej steny (viac ako 2,7 mm) sú dôsledkom edému, zápalu alebo krvácania do črevnej steny. Za stenčenie črevnej steny sa považuje jej hrúbka menej ako 1 mm. Intramurálny plyn je ekvivalentom pneumatózy čreva na RTG snímke a viditeľný je vo forme drobných okrúhlych hyperechogénnych bodiek v črevnej stene. Plyn v portálnom riečisku je viditeľný v podobe podobných, pohyblivých, hyperechogénnych reflexov, pripomínajúcich koráliky, ktoré sú viditeľné vo vena portae alebo jej intrahepatálnych vetvách.
Z prognostického hľadiska je najnepriaznivejší nález voľného vzduchu a izolovanej kolekcie tekutiny, pretože sú nepriamym dokladom perforácie čreva [21]. Hyperechogénne bodkovité alebo granulárne reflexy sú viditeľné v črevnej stene už v začiatočnom štádiu NEC, preto sonografia môže byť nápomocnou pri včasnej diagnostike a monitorovaní pacienta [23].
LIEČBA
Hlavným cieľom liečby je stabilizácia pacienta. Základom je zrušenie perorálnej výživy, zabezpečenie dekompresie žalúdka, systémová liečba širokospektrálnymi antibiotikami a parenterálna výživa. Perorálna antibiotická liečba sa neodporúča vzhľadom na riziko nárastu rezistencie mikroorganizmov. Nevyhnutná je korekcia minerálovej poruchy, pretrvávajúcej metabolickej acidózy a poruchy hemokoagulácie. V prípadoch pretrvávania nepriaznivého klinického stavu, vysokých koncentrácií CRP a pri príznakoch gangrény alebo hroziacej ruptúry čreva by mala byť zvážená chirurgická liečba. Jedinou absolútnou indikáciou na laparotómiu je v súčasnosti perforácia čreva.
V literatúre sa nedávno objavili informácie o perorálnej liečbe laktoferínom s cieľom zlepšiť imunitnú odpoveď a modulovať zápal. Kombinácia laktoferínu a antibiotík by mohla zlepšiť prognózu pacientov s NEC. Ako vyplýva z prehľadu Cochrane-databázy z roku 2009, v súčasnosti nie sú dôkazy, na základe ktorých by bolo možné túto liečbu odporučiť alebo zamietnuť. V budúcnosti bude potrebné uskutočniť ďalšie štúdie na posúdenie bezpečnosti a účinnosti rôznych preparátov laktoferínu a jeho dávkovania, ako aj vplyv uvedenej liečby na celkovú prognózu pacienta [24].
PROGNÓZA
Mortalita v súvislosti s NEC sa u donosených v porovnaní s predčasne narodenými deťmi nelíši [1, 3]. V literatúre sú uvedené rôzne údaje, najčastejšie v rozmedzí 5–13 %, niektorí autori uvádzajú mortalitu až do 35 % [2, 3, 4, 8, 25].
PREVENCIA
Hlavným dôvodom, prečo preventívne stratégie nie sú dostatočne účinné, je skutočnosť, že NEC je multifaktoriálne podmieneným ochorením [5].
Zvýšenú pozornosť je potrebné venovať novorodencom s takými rizikovými faktormi alebo ochorením, pri ktorých je negatívne ovplyvnené prekrvenie čreva. V tomto prípade je vhodné zabezpečiť dieťaťu výživu výlučne materským mliekom s dodržaním optimálnej dávkovacej schémy a pomalým zvyšovaním objemu podanej výživy [3, 8].
KAZUISTIKA
Kazuistika uvádza prípad chlapca narodeného v 36. týždni tehotenstva spontánne záhlavím s pôrodnou hmotnosťou 1950 g a dĺžkou 44 cm. Počas gravidity bola indikovaná hospitalizácia v 30. týždni z dôvodu rastovej retardácie plodu a vzhľadom na hroziaci predčasný pôrod bola v 31. týždni podaná kortikoidná liečba s cieľom indukcie maturácie pľúc plodu. Bezprostredná popôrodná adaptácia dieťaťa bola primeraná, Apgarovej skóre 10/10.
Vzhľadom na hypoglykémiu (1,8 mmol/l) a nízku pôrodnú hmotnosť indikovaná infúzia glukózy a perorálna výživa formulou pre nedonosené deti (do 80 ml/kg/deň), hodnoty glykémie opakovane vo fyziologickom rozmedzí. Vo veku 24 hodín zaznamenaná leukopénia (leukocyty 5,5x109/l, pri opakovanom odbere 2,8x109/l), ostatné výsledky laboratórnych vyšetrení v norme, CRP negatívne. Celkový stav dieťaťa bol uspokojivý, bez príznakov infekcie pri klinickom vyšetrení. Napriek tomu, vzhľadom na leukopéniu, predpokladaná včasná sepsa, indikovaná antibiotická liečba kombináciou ampicilin a gentamicin. Perorálna výživa pokračovala odstriekaným natívnym materským mliekom v dávke do 120 ml/kg/deň. Vo veku 96 hodín zaznamenaná mierna distenzia brucha, dieťa vracalo obsah s prímesou čerstvej krvi, iné prejavy krvácania nepozorované. Vzhľadom na pozitívny kultivačný nález E. coli v plodovej vode (aspiráte zo žalúdka po narodení ) bol pridaný do liečby cefotaxim. Opakované podanie vitamínu K, v krvnom obraze zvýraznená leukopénia (1,4 až 0,7x109/l), zaznamenaná trombocytopénia (76 až 47x109/l). Vo vnútornom prostredí metabolická acidóza (kapilárne pH 7,179, BE –10 mmol/l), CRP 23–50 mg/dl. Po doplnení cirkulujúceho objemu fyziologickým roztokom dieťa obehovo stabilné, normotenzia. Pri natívnom RTG vyšetrení viditeľná pneumatóza v celom rozsahu čreva (obr. 1), vzduch v črevnej stene i v portálnom riečisku dokumentovaný sonografickým vyšetrením (obr. 3, 4).
Image 1. Pneumatóza čreva – drobné „bublinkové“ prejasnenia v črevnej stene. Obraz patognomický pre NEC. Fig. 1. Pneumatosis of intestine – minute “bubble” clearing in the intestinal wall: The picture is pathognomic for NEC. 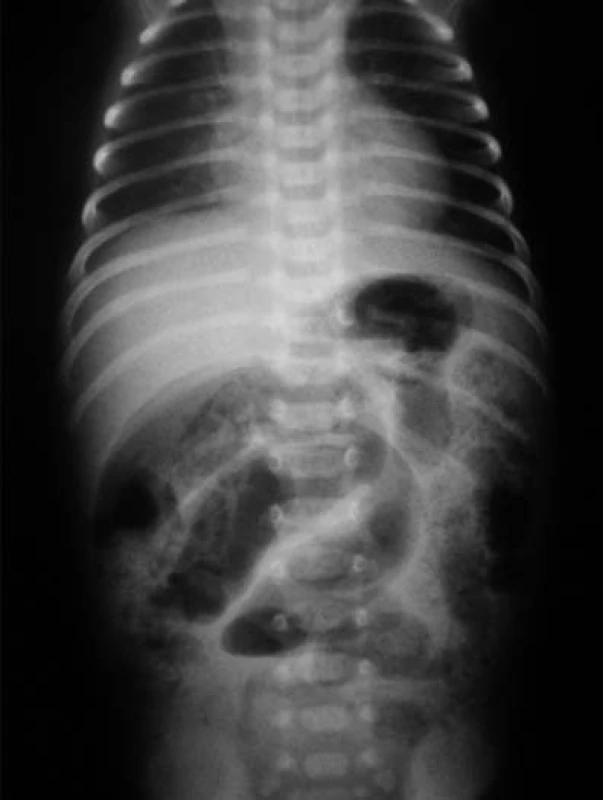
S cieľom vylúčiť volvulus ako príčinu ischémie čreva a nekrotizujúcej enterokolitídy realizované kontrastné RTG vyšetrenie izoosmolárnou kontrastnou látkou. V priebehu nasledujúcich 6 hodín došlo k zhoršeniu celkového stavu, respiračná insuficiencia vyžadovala liečbu umelou pľúcnou ventiláciou. Patologickú hemokoaguláciu (protrombínový čas – nezráža sa do 3 minút, APTT nezráža sa do 3 minút, trombínový čas – nezráža sa do 3 minút) nebolo možné upraviť transfúziami čerstvej mrazenej plazmy, vzhľadom na rozvoj diseminovanej intravaskulárnej koagulopatie hematológom indikovaná liečba faktorom VII. Anémia substituovaná opakovane transfúziou erytrocytov. Počas nasledujúcich 20 hodín zaznamenaná zmena lokálneho nálezu na bruchu so stuhnutím a zmenou farby brušnej steny. Sonograficky v brušnej dutine diagnostikovaná voľná tekutina s hyperechogénnymi reflexami, na základe toho predpokladaná perforácia čreva, RTG vyšetrením verifikované pneumoperitoneum (obr. 2).
Image 2. Pneumoperitoneum – voľný vzduch viditeľný ako prejasnenie okrúhleho tvaru nad tieňom pečene. Fig. 2. Pneumoperitoneum – free air is visible as clearing of round shape above the shadow of liver. 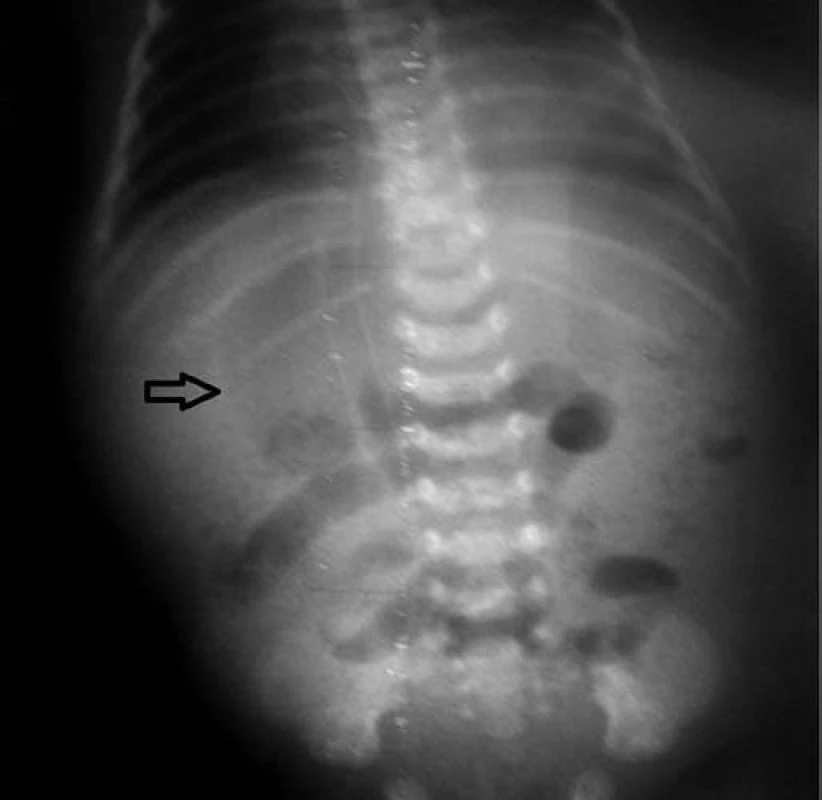
Image 3. Sonografické vyšetrenie – vzduch v portálnom riečisku. Fig. 3. Sonographic examination – air in periportal vascular bed. 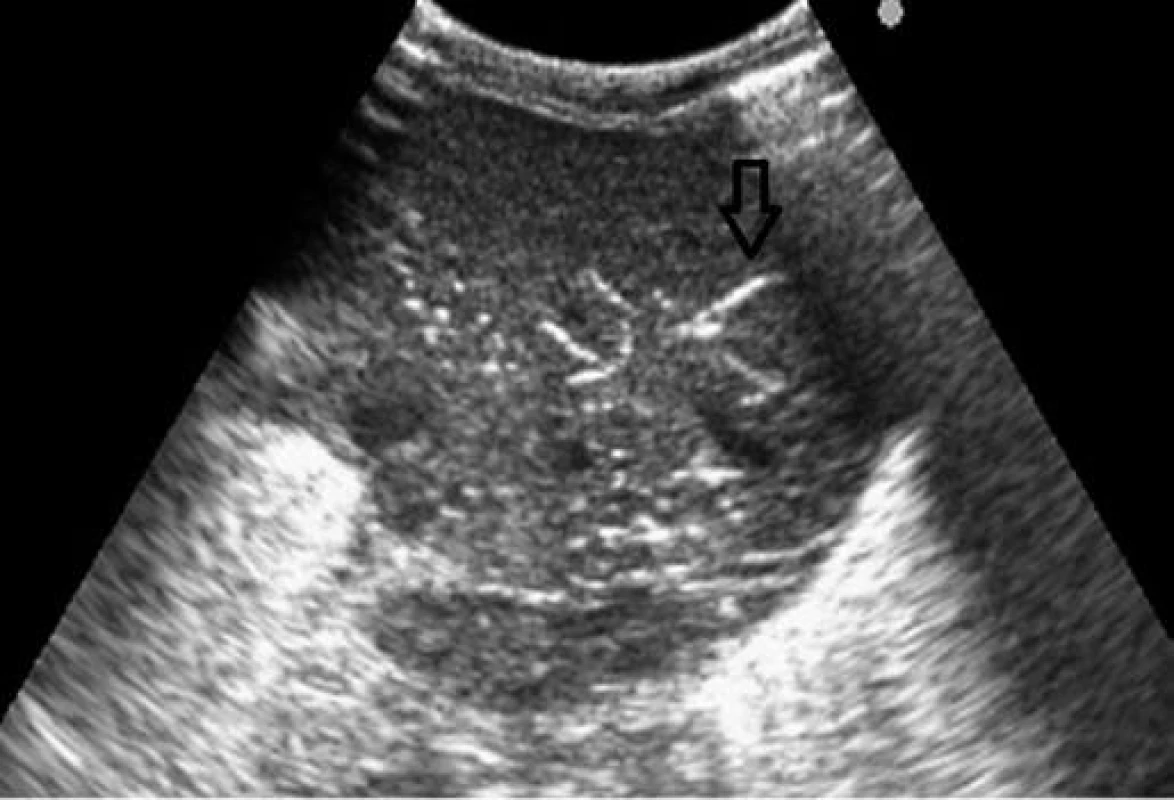
Image 4. Sonografické vyšetrenie – vzduch v črevnej stene. Fig. 4. Sonographic examination – air in the intestinal wall. 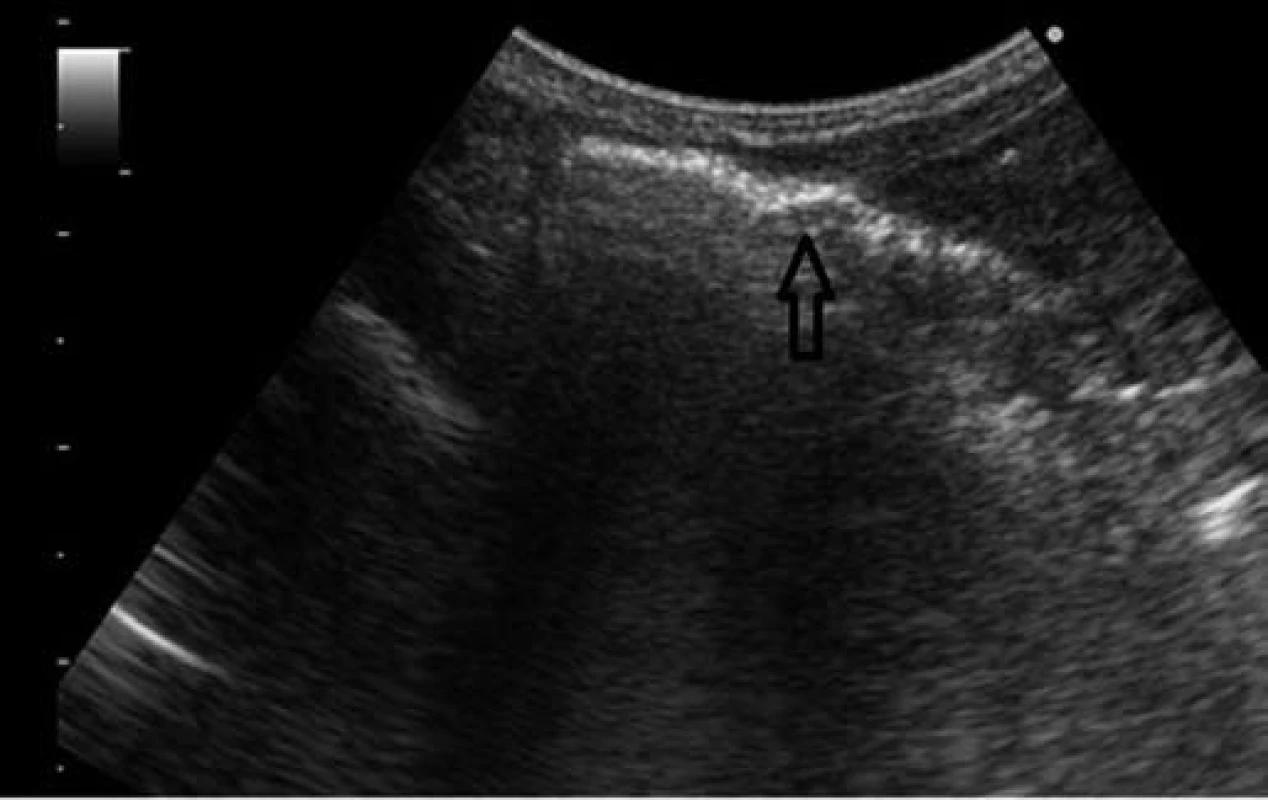
S cieľom potlačiť infekciu anaeróbnymi kmeňmi mikroorganizmov antibiotická liečba doplnená o metronidazol. Indikovaná bola chirurgická liečba, avšak vzhľadom na závažnú, neliečiteľnú poruchu hemokoagulácie bol hematológom operačný výkon kontraindikovaný. Pokračovala konzervatívna liečba substitúciou hemokoagulačných faktorov, pri inotropnej liečbe kombináciou dopamínu s dobutamínom krvný tlak stabilný, diuréza viac ako 1 ml/kg/h, koncentrácia laktátu opakovane v rozmedzí 4,8–6 mmol/l. Z mikrobiologických vyšetrení pozitívna kultivácia stolice na E. coli, hemokultúra sterilná; vyšetrením stolice nepotvrdené okultné krvácanie. Napriek intenzívnej resuscitačnej liečbe na 6. deň náhle vzniknutá asystólia bez reakcie na resuscitáciu. Patologicko-anatomický nález potvrdil prítomnosť rozsiahlej nekrotizujúcej enterokolitídy s perforáciou a difúznou peritonitídou.
V súlade s literárnymi údajmi, v uvedenom prípade sa vyvinula NEC u dieťaťa s rizikovými faktormi – intrauterinnou rastovou retardáciou a perinatálnou infekciou, ktorá bola dokumentovaná kolonizáciou dieťaťa E. coli pri narodení. Na možnú infekciu upozorňovala leukopénia, preto bola včas začatá antibiotická liečba. Rovnako s literatúrou súhlasí, že NEC sa zvyčajne vyvinie po predchádzajúcej perorálnej výžive – zvlášť formulou [3, 5, 8].
U nášho pacienta bola začatá výživa formulou, avšak dávkovanie zodpovedalo všeobecne odporúčaným schémam (so zvýšením o 20 ml/kg/deň). Manifestácia ochorenia vo veku 4 dní zodpovedá literárnym údajom. Uvádza sa tiež, že leukopénia a trombocytopénia sú spojené s nepriaznivou prognózou, čo sa v našom prípade potvrdilo. NEC skóre bolo vyhodnotené na 6 bodov, čo je rovnako spojené s vyšším rizikom úmrtia. Pri diagnostike bolo nápomocné ultrazvukové vyšetrenie, ktoré bolo viackrát opakované bez toho, aby bol narušený komfort pacienta. Na základe nálezu nehomogénnej voľnej tekutiny bolo aktuálne indikované RTG vyšetrenie. Diskutovateľnou je možnosť drenáže peritoneálnej dutiny v prípade perforácie čreva, keď je vzhľadom na celkový stav pacienta kontraindikovaná laparotómia. V našom prípade vzhľadom na diseminovanú intravaskulárnu koagulopatiu s rizikom nezvládnuteľného krvácania nebola drenáž indikovaná.
ZÁVER
Vzhľadom na vysokú mortalitu v súvislosti s NEC je nevyhnutné na toto ochorenie myslieť aj u donosených novorodencov, hoci nie je pre nich typické. Pre včasnú diagnostiku je vhodné použiť sonografické vyšetrenie a s liečbou začať čo najskôr.
V rámci prevencie je u donosených novorodencov so známymi rizikovými faktormi vhodné začať s výživou materským mliekom v malých objemoch.
Práca bola podporená projektom „Dobudovanie Centra excelentnosti pre perinatologický výskum (CEPV II)“, ITMS kód: 26220120036, ktorý je splufinancovaný zo zdrojov EU-ERDF.
Došlo: 24. 1. 2011
Přijato: 10. 7. 2011
MUDr. Katarína Maťašová, Ph.D.
Neonatologická klinika JLF UK a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: matasova.katarina@gmail.com
Sources
1. Ng S. Necrotizing enterocolitis in the full-term neonate. J Pediatr Child Health 2001; 37 : 1–4.
2. Neu J. Neonatal necrotizing enterocolitis: an update. Acta Paediatr 2005; 94(Suppl): 100–105.
3. Lambert DK, Christensen RD, Henry E, et al. Necrotizing enterocolitis in term neonates: data from a multihospital health-care system. J. Perinatol 2007; 27 : 437–443.
4. McElhinney DB, Hedrick HL, Bush DM, et al. Necrotizing enterocolitis in neonates with congenital heart disease: risk factors and outcomes. Pediatrics 2000; 106 : 1080–1087.
5. Maayan-Metzger A, Itzchak A, Mazkereth R, et al. Necrotizing enterocolitis in full-term infants: case-control study and review of the literature. J Perinatol 2004; 24 : 494–499.
6. Bolisetty S, Lui K, Oei J, et al. A regional study of underlying congenital diseases in term neonates with necrotizing enterocolitis. Acta Paediatr 2000; 89 : 1226–1230.
7. Lee JS, Polin RA. Treatment and prevention of necrotizing enterocolitis. Sem Neonatol 2003; 8 : 449–459.
8. Stout G, Lambert DK, Baer VL, et al. Necrotizing enterocolitis during the first week of life: a multicentered case-control and cohort comoarison study. J Perinatol 2008; 28 : 556–560.
9. Christensen RD, Lambert DK, Schmutz N, et al. Fatal bowel necrosis in two polycytemic term neonates. Fetal Pediatr Pathol 2008; 27 : 41–44.
10. Fedorová M, Zlatohlávková B, Kytnarová J, Malošková G, Kršek M, Plavka R. Intrauterinní růstová retardace a její vliv na další vývoj extrémně nezralých novorozenců. Čes-slov Pediat 2009; 64 : 359–364.
11. Figueras-Aloy J, Rodríguez-Miguélez JM, Iriondo-Sanz M, et al. Intravenous immunoglobulin and necrotizing enterocolitis in newborns with hemolytic disease. Pediatrics 2010; 125 : 139–144.
12. Guner YS, Malhotra A, Ford HR, et al. Association of Escherichia coli O157:H7 with necrotizing enterocolitis in a full-term infant. Pediatr Surg Int 2009; 25 : 459–463.
13. Raboei EH. Necrotizing enterocolitis in full-term neonates: is it aganglionosis? Eur J Pediatr Surg 2009; 19 : 101–104.
14. Minkoff H, Chervenak FA. Elective primary ceaserean delivery. N Engl J Med 2003; 348 : 946–950.
15. Amer T, David R, Oberfield SE. Necrotizing enterocolitis and hypothyroidism in a newborn infant: treatment with intravenous L-thyroxin. Am J Perinatol 1994; 11 : 30–32.
16. Nowicki PT. Ischemia and necrotizing enterocolitis: where, when and how. Sem Pediatr Surg 2005; 14 : 152–158.
17. Bell MJ, Shackelford P, Feigin RD, et al. Epidemiologic and bacteriologic evaluation of neonatal necrotizing enterocolitis. J Pediat Surg 1997; 14 : 1–4.
18. Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatr Clin North Am 1986; 33 : 179–202.
19. Kessler U, Mungnirandr A, Nelle M, et al. A simple presurgical necrotizing enterocolitis-mortality scoring system. J Perinatol 2006; 26 : 764–768.
20. Pourcyrous M, Korones SB, Yang W, et al. C-reactive protein in the diagnosis, management, and prognosis of neonatal necrotizing enterocolitis. Pediatrics 2005; 116 : 1064–1069.
21. Silva CT, Daneman A, Navarro OM, et al. Correlation of sonographic findings and outcome in necrotizing enterocolitis. Pediatr Radiol 2007; 37 : 274–282.
22. Dilli D, Suna Oğuz S, Erol R, et al. Does abdominal sonography provide additional information over abdominal plain radiography for diagnosis of necrotizing enterocolitis in neonates? Pediat Surg Int 2010; 1–7. Article in press.
23. Kim WY, Kim WS, Kim IO, et al. Sonographic evaluation of neonates with early-stage necrotizing enterocolitis. Pediatr Radiol 2005 : 1056–1061.
24. Mohan P, Abrams SA. Oral lactoferrin for the treatment of sepsis and necrotizing enterocolitis in neonates. Cochrane Database Syst. Rev. 2009;21:CD007138.
25. Ostlie DJ, Spilde TL, St Peter SD, et al. Necrotizing enterocolitis in full-term infants. J Pediatr Surg 2003; 38 : 1039–1042.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2011 Issue 6-
All articles in this issue
- Vývoj neonatální péče a zhodnocení zkušeností prvních pěti let operací rozštěpu rtu v neonatálním období
- Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů
- Nekrotizujúca enterokolitída donosených novorodencov – kazuistika a prehľad literatúry
- Používání léků mimo schválené indikace v pediatrii
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nekrotizujúca enterokolitída donosených novorodencov – kazuistika a prehľad literatúry
- Používání léků mimo schválené indikace v pediatrii
- Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů
- Vývoj neonatální péče a zhodnocení zkušeností prvních pěti let operací rozštěpu rtu v neonatálním období
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


![NEC skóre [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/804f65148ddb6fdc03a1c16c3bd875ca.png)