-
Medical journals
- Career
Používání léků mimo schválené indikace v pediatrii
: P. Langerová; K. Urbánek
: Ústav farmakologie LF UP a FN, Olomouc přednosta prof. RNDr. P. Anzenbacher, DrSc.
: Čes-slov Pediat 2011; 66 (6): 380-386.
: Review
V každodenní léčebné praxi je obtížné najít léčiva registrovaná pro použití u pediatrické populace. Až 70 % léků je proto předepisováno k podání, které není schváleno regulační autoritou a pro které používáme termíny off-label a unlicensed. Je však důležité zdůraznit, že takové podávání není synonymem „nesprávného“ a že kvalita terapie nesouvisí nutně s tím, zda je lék pro danou věkovou populaci schválen. Na druhou stranu při výzkumu incidence nežádoucích účinků léků v dětském věku bylo zjištěno, že riziko nežádoucího účinku při použití mimo schválené indikace je 3,6krát vyšší za hospitalizace a 2krát vyšší v ambulantní péči. Výsledky publikovaných studií ukazují i závislost výskytu neregistrovaného použití léků na věku dítěte. Čím je dítě mladší, tím častěji jsou u něj používány léky mimo schválené indikace. Tento závěr zřejmě platí především pro nemocniční péči, zatímco v ambulantní je navíc pozorován vysoký počet neregistrovaných předpisů pro adolescenty. Mezi jednotlivými zeměmi sledovanými ve studiích se sice určité odlišnosti vyskytují, nicméně nejsou příliš významné.
Pokud jde o jednotlivé skupiny léčiv, nejčastěji jsou zřejmě mimo schválené indikace u dětí používána léčiva kardiovaskulárního systému. Abychom zabránili vystavování dětí zbytečným rizikům a zároveň se vyhnuli ochuzení dětí o potenciálně efektivní farmakoterapii, je nutné doplnit legislativu k usnadnění provádění klinických hodnocení léků v pediatrii.Klíčová slova:
off-label, unlicensed, léčiva, děti, pediatrie, klinické studie, předpisy, nemocniceÚVOD
Mnoho léčiv, podávaných dnes běžně v klinické praxi dětem a dospívajícím, nebylo adekvátně testováno pro použití v pediatrických indikacích. Důvodem je skutečnost, že provádění klinických studií u dětské populace je mnohem náročnější než u dospělých. Počty subjektů vhodných pro zařazení do klinického hodnocení jsou často velmi malé a také získání informovaného souhlasu bývá obtížnější. O tom, zda se dítě klinického hodnocení zúčastní, rozhodují jeho rodiče nebo zákonní zástupci, a ti jsou z pochopitelných důvodů velmi opatrní.
Rodiče i pediatři mnohdy raději volí standardní terapii nebo jinou intervenci na úkor účasti dítěte v klinických studiích, i když jejich provádění podstatně zlepšuje kvalitu zdravotní péče. Příkladem může být farmakoterapie dětské akutní lymfoblastické leukémie, u které díky výsledkům multicentrických studií stouplo už počátkem 90. let 20. století pětileté přežívání z 25 % až na více než 70 % [1]. Bohužel však takových případů podstatného zlepšení výsledků léčby zatím není mnoho a většina z nich se týká terapie nádorových onemocnění. Řada jiných užitečných léčiv je proto do pediatrické praxe zaváděna se zpožděním nebo vůbec ne. Na druhou stranu díky tomu někdy dochází i k situacím, kdy neefektivní nebo dokonce nedoporučené intervence jsou u dětí používány ještě před tím, než jsou k dispozici dostatečně kvalitní výsledky jejich klinického hodnocení podle zásad správné klinické praxe [2].
Vzhledem k nedostatečnému množství validních dat pro dětský věk jsou pediatři běžně nuceni vycházet z výsledků klinických studií u dospělých. Tato interpolace je však často nevhodná, protože u dětí mohou být spektrum nemocí i jejich průběh odlišné oproti dospělým. Také léčiva samotná mohou mít u dětského organismu poněkud odlišnou farmakokinetiku nebo farmakodynamiku, což může vést k neočekávané odpovědi. Známými příklady jsou specifické nežádoucí účinky thalidomidu, tetracyklinů, chloramfenikolu nebo aspirinu v dětském věku [3].
OFF-LABEL A UNLICENSED LÉKY
V anglicky psané odborné literatuře jsou pro výše zmíněná léčiva nejčastěji používány termíny „unlicensed“ a „off-label“ léky. Obvyklé definice těchto pojmů v pediatrii vycházejí z práce Turnera a kol. [4]. U nás neexistuje jednotná terminologie, často se uplatňuje termín off-label pro oba druhy neschváleného použití léků.
Pokud jsou dětem podávána léčiva, která pro použití u nich nejsou vůbec registrována, zažitý anglický termín je „unlicensed“. Český termín se v dostupné literatuře nevyskytuje, výraz „neregistrované léčivo“ je obvykle užívá pro situaci úplného chybění registrace v dané zemi, nejpřesněji odpovídající překlad – „léky neregistrované pro použití u dětí“ – je příliš složitý, proto bude anglický termín používán dále i v tomto sdělení. Unlicensed léky tedy nemají doporučené dávkování pro dětský věk a specifika farmakodynamiky, farmakokinetiky nebo nežádoucích účinků v dětském věku u nich obvykle nejsou dostatečně známa. Navíc nejsou většinou ani dostupné v lékových formách a dávkách vhodných pro děti a k dosažení vhodné dávky nebo k usnadnění polknutí musí být někdy upravovány.
„Off-label“ léky jsou v tomto kontextu takové, které se u dětí používají jinak než schváleným způsobem (outside the terms of their license). Jsou tudíž předepisovány dětem v jiné dávce nebo pro jiné indikace, než jaké jsou uvedeny v registrační dokumentaci. Může se jednat i o odlišnou cestu podání nebo o podávání jiné věkové skupině dětí, než pro jakou je lék schválen.
Používání unlicensed nebo off-label léků v pediatrii je relativně běžné [4]. Všechna individuálně připravovaná léčiva (tzv. magistraliter) jsou samozřejmě unlicensed už ze své definice. Ze všech léčiv schválených EMEA (European Medicines Evaluation Agency, nyní European Medicines Agency, EMA) mezi říjnem 1995 a zářím 2005 bylo pouze 33 % schváleno pro užití u dětí, 23 % u kojenců a 9 % u novorozenců. Terapie neschválenými léčivy přináší vyšší riziko výskytu nežádoucích účinků, ale také možnost předávkování nebo poddávkování. Proto bylo v lednu 2007 vydáno Nařízení Evropského parlamentu a Rady, aby klinické studie byly pokud možno prováděny i na dětské populaci, a to zejména tehdy, pokud lze předpokládat, že děti mohou z nového léku profitovat [5].
V rámci Evropské lékové agentury byly legislativní základy zabývající se pediatrickou tematikou položeny v roce 1997, kdy Evropská komise organizovala kulatý stůl expertů k problematice pediatrické farmakoterapie. V roce 2002 pak Evropská komise uveřejnila konzultační materiál „Better medicines for children – proposed regulatory actions in paediatric medicinal products“, který se stal prvním důležitým krokem v této problematice. V roce 2006 byla schválena směrnice o léčivech pro pediatrické použití. Výbor pro humánní léčiva vytvořil expertní skupinu pro pediatrii (Expert Group on Paediatrics – PEG), složenou ze 14 expertů v nejdůležitějších oblastech, jako je farmakokinetika, pediatrické lékové formy, metodologie klinických studií, neonatologie a jiné. Ve svých aktivitách spolupracuje s dalšími pracovními skupinami, jako je výbor pro orphan léčiva (Committee for Orphan Medicinal Products – COMP). V roce 2007 byla expertní skupina transformována do pediatrického výboru (Paediatric Committee) v rámci EMA [6].
PŘEHLED PUBLIKOVANÝCH STUDIÍ
V posledních deseti letech bylo publikováno množství studií věnovaných výše uvedené problematice. Pro potřeby tohoto přehledu jsme vyhledali práce v databázi MEDLINE zabývající se problematikou podávání léků off-label a unlicensed v dětské populaci. V české literatuře práce na toto téma pomocí vyhledávání v národní databázi Bibliographia Medica Čechoslovaca nebyla nalezena. Dvě nejvýznamnější shrnutí dosud známých poznatků obsahují práce Pandolfiniho [5] a Lindell-Osuagwu [7].
1. Přehled nejvýznamnějších studií publikovaných od roku 2005 k tématu, v chronologickém pořadí. 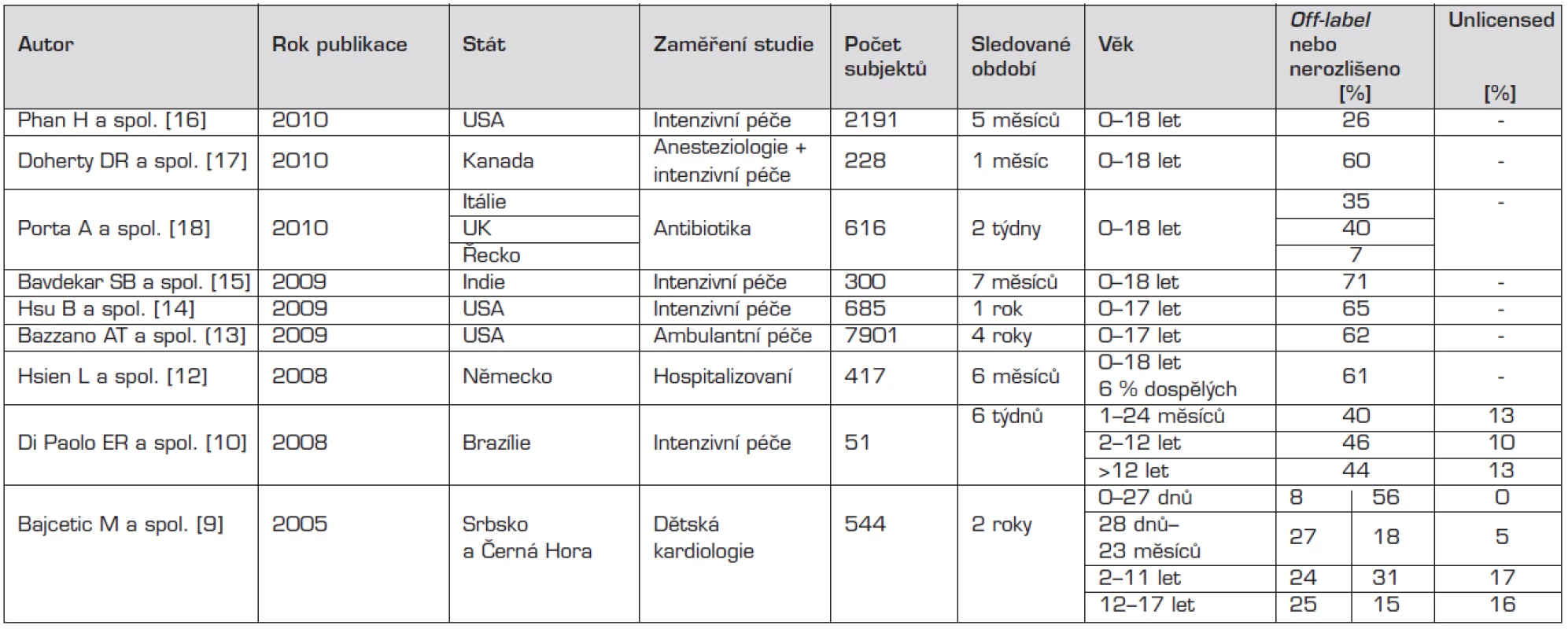
Poznámka: Bajcetic a spol. dělí off-label: první sloupec vzhledem k dávce, druhý sloupec vzhledem k věku [9]. Pandolfini a spolupracovníci se ve své práci zabývali podáváním léků, u kterých chybí dostatečné množství specifických informací vztažených na pediatrickou populaci. Shrnuli výsledky celkem 30 studií, publikovaných mezi lety 1985–2004, z toho 11 provedených na nemocničních pediatrických odděleních, 7 na novorozeneckých odděleních a 12 v ambulantní péči. Počet zahrnutých dětských pacientů se v nich pohyboval od pouhých 40 až do 455 661 a většina studií byla prospektivních. Podíl off–label nebo unlicensed použití léčiv v nich se pohyboval mezi 11–80 % a tento podíl byl nepřímo úměrný věku dětí; z pochopitelných důvodů byl vyšší v nemocniční péči. Na pediatrických odděleních se procento takového použití léků pohybovalo mezi 16–62 % a nejčastěji se jednalo o paracetamol, cisaprid, chloralhydrát a salbutamol. Na novorozeneckých odděleních to bylo 55–80 % a nejvíce byl takto podáván kofein. V ambulantní péči bylo zastoupení 11–37 % a nejčastěji šlo o amoxicilin. Hlavním způsobem unlicensed nebo off-label aplikace či předpisu bylo použití léčiva u jiné věkové kategorie (27 studií), na druhém místě neregistrované dávkování (23 studií) nebo podání mimo registrované indikace (22 studií), dále jiná než registrovaná cesta podání (21 studií), léková forma (7 studií), vzácně i použití kontraindikovaných léčiv (5 studií). V závěru autoři uvádějí, že častěji se s off-label nebo unlicensed použitím léků setkáváme na novorozeneckých odděleních než na pediatrických a dále pak v nemocniční péči oproti ambulantní. Taktéž zdůrazňují, že off-label není synonymem pro „nesprávné“ [5].
Přehled studií publikovaných v letech 1997–2007 zpracovali ve své práci Lindell-Osuagwu a spol. [7]. Předepisováním off-label a unlicensed léčiv se v posledních letech zabývají studie ze Severní i Jižní Ameriky, Austrálie, Středního východu a Evropy. Ukazují, že situace se v různých zemích značně liší. Ve sledovaném období jich bylo publikováno 24, a to z 12 různých států (USA, Velká Británie, Austrálie, Švédsko, Itálie, Německo, Nizozemí, Izrael, Brazílie, Francie, Srbsko a Černá Hora, Švýcarsko). Nejčastěji se jednalo o státy evropské (n = 8), délka sledování se pohybovala mezi 4 týdny a 2 lety. Většina z nich byla prospektivních (n = 19) a více než polovina z nich zahrnovala minimálně 100 dětí. Počet pacientů zahrnutých do studií se pohyboval od 34 (Itálie) do 355 409 (USA) a jejich věk od méně než 1 dne do 18 let. Použité definice off-label a unlicensed léčiv se lišily, ale nejčastěji byly používány výše uvedené definice podle Turnera [4]. Z celkového počtu 24 studií v pěti z nich nebylo vyhodnoceno procento pacientů, kteří obdrželi off-label nebo unlicensed lék. Podíl dětí užívajících minimálně jeden lék z těchto skupin se ve zbylých 19 studiích pohyboval mezi 36 a 100 %. Z nich 4 studie hodnotily pouze procento dětí s off-label podávanými léky, a to s výsledky od 43 do 93 %.
Podíl použití off-label léků se v těchto 24 sledovaných studiích pohyboval mezi 18 a 60 %. Nejčastějším důvodem k takovému použití byl odklon od doporučeného dávkování, na druhém místě pak od doporučeného věkového rozmezí. Ve 13 studiích bylo zjištěno, že věková skupina, u které byly nejčastěji použity léky off-label, byli adolescenti. Nejhojněji takto užívanou účinnou látkou byl salbutamol (v 7 studiích). Použití unlicensed léčiv bylo v jednotlivých hodnocených studiích zjištěno v rozsahu 0 až 48 % (19 studií). Spektrum takových účinných látek bylo velmi široké. Ve 3 studiích byl mezi nejčastějšími zmíněn kofein. Věkové skupiny, které je dostávaly nejčastěji, byli novorozenci, kojenci a děti do 2 let [7].
Ve své vlastní prospektivní studii Lindell-Osuagwu a spolupracovníci hodnotili používání těchto léčiv na 3 pediatrických odděleních ve Finsku. Během dvoutýdenního časového období vyhodnocovali farmakoterapii u všech pacientů mladších 18 let na dětském všeobecném a chirurgickém oddělení a na novorozenecké jednotce intenzivní péče. Z celkového počtu 141 dětí byla 108 z nich podávána léčiva, celkem 629krát. Z těchto 108 dětí byl 82 (76 %) předepsán minimálně jeden off-label nebo unlicensed lék, a to: na novorozenecké jednotce 79 %, na všeobecném pediatrickém oddělení 63 % a na chirurgickém oddělení 91 %. Z již zmíněných 108 dětí byl 26 (24 %) podán schválený (licensed) lék, 71 (66 %) off-label lék a 36 (33 %) unlicensed lék. Z celkového počtu 629 ordinací léčiv bylo 321 (tedy 51 %) na léky schválené, 226 (36 %) na off-label a 82 (13 %) unlicensed [7].
Z jednotlivých publikovaných studií zabývajících se tímto tématem vyplynuly některé další zajímavé skutečnosti. V roce 2001 ´t Jong a spol. publikovali zjištění, že u novorozenců a kojenců je velké procento (41 %) předpisu individuálně připravovaných (magistraliter) léčivých přípravků [8]. O rok později pak dokládají, že počet pacientů, kteří obdrželi jeden nebo více unlicensed nebo off-label předpisů na léky, byl nejvyšší u novorozenců a malých kojenců (98 %, v porovnání s 88 % u starších dětí) [9]. Bajcetic a spol. potvrdili, že na oddělení pediatrické kardiologie dostávají nejvíce off-label léčiv právě novorozenci [10]. Di Paolo a spol. prokázali, že kojenci a batolata ve věku od 1 do 23 měsíců obdrželi více unlicensed léků než jiné věkové skupiny [11].
Ve studiích provedených na jednotkách intenzivní péče (n = 9) je procento dětí, kterým byl předepsán takovýto lék, obzvláště vysoké (80–100 %). Podobně všem dětem s malignitami a 76 % dětských kardiologických pacientů byl předepsán minimálně jeden lék k užití mimo schválené indikace nebo lék neregistrovaný pro dětský věk [10, 12].
Hsien a spol. v roce 2008 publikovali prospektivní observační studii zahrnující 417 pacientů na pediatrickém oddělení v Düsseldorfu v období mezi lednem a červnem 2006. Analyzovali dohromady 1812 ordinací na 211 různých léčiv. Celkem 253 pacientů (61 %) obdrželo minimálně jeden off-label lék, přičemž pojem unlicensed nebyl autory vůbec používán. Ze všech posuzovaných ordinací léčiv bylo 553 (31 %) použito off-label. Autoři taktéž hodnotili podíl jednotlivých lékových skupin: V 60 % se jednalo o indikaci k léčbě kardiovaskulárního systému (129 z 216), ve 42 % o antiinfektivum (190 z 449), ve 30 % o léčivo dýchacího systému (100 z 335), ve 25 % o léčivo trávicího traktu a metabolismu (67 z 269) a ve 3 % o analgetika a antipyretika. Ve 34 % se jednalo o off-label ordinaci z důvodu věku. Nevýhodou studie však bylo, že zahrnovala i 6 % dospělých pacientů, a proto by celkový počet off-label ordinací u dětí mohl být podhodnocen. Autoři rovněž sestavili seznam 21 takto ordinovaných léčiv, který porovnávali se seznamem pediatrických potřeb a priorit vytvořeným Evropskou lékovou agenturou (EMA). Ze zmíněných 21 léčiv bylo 15 na seznamu EMA (karvedilol, metoprolol, propranolol, spironolakton, furosemid, hydrochlorothiazid, nifedipin, amlodipin, amiodaron, sotalol, sildenafil, aspirin, fenprokumon, enoxaparin a urokináza). Indikacemi byly hypertenze, srdeční selhání s otoky a arytmie. Dalších 6 léků ordinovaných off-label v Univerzitní nemocnici v Düsseldorfu byly bisoprolol, nebivolol, kanreonát draselný, isosorbid dinitrát, glycerol trinitrát a fenoxybenzamin, které na seznamu EMA uvedeny nejsou. Z těchto 21 kardiovaskulárních léků bylo 8 ordinováno minimálně 3 různým pacientům. Na prvním místě v počtu jednotlivých ordinací byl spironolakton, následoval aspirin a na třetí pozici furosemid. V závěru této práce se konstatuje, že farmakoterapie kardiovaskulárních onemocnění je nezbytnou součástí jejich léčby, a že potřeba klinických studií u pediatrické populace je skutečně zásadní. V Německu není pro použití u dětí doposud registrován žádný beta-blokátor ani kalciový blokátor s vazodilatačními účinky. Studie poukazuje na 21 off-label ordinovaných kardiovaskulárních léků používaných k terapii potenciálně život ohrožujících stavů u dětí. Takovými stavy mohou být srdeční selhání, arytmie a trombózy. Proto by právě kardiovaskulární léčiva měla být prioritně testována pro použití v pediatrické populaci [13].
Od roku 2008 bylo publikováno několik zajímavých studií. Alicia T. F. Bazzano a spol. v roce 2009 uveřejnili práci, zabývající se off-label preskripcí u ambulantních dětských pacientů v USA. Během let 2001–2004 se jednalo celkem o 312 milionů návštěv, při kterých byl pacientovi předepsán minimálně jeden medikament. Děti byly rozděleny podle pohlaví, rasy, věku, přítomnosti chronického onemocnění, typu zdravotního pojištění, počtu předepsaných léků a odbornosti ordinujícího lékaře. Z celkového počtu všech ambulantních návštěv v 62 % dítě obdrželo jeden nebo více off-label předpisů. 96 % z těchto preskripcí tvořila léčiva kardiovaskulárních a renálních onemocnění, 86 % terapie bolesti, 80 % léčba gastrointestinálních chorob a 67 % léčiva plicních a kožních onemocnění. Potvrzena byla také závislost na věku. Čím bylo dítě mladší, tím častěji obdrželo off-label předpis. U dětí mladších 1 rok to bylo v 74 %, od 1 do 2 let v 67 %, od 2 do 6 let v 65 % a od 6 do 12 let v 59 %. Častější byl také tento typ předpisu u ambulantních specialistů v porovnání s praktickými lékaři. V závěru autoři mimo jiné zdůrazňují, že vytvoření guidelines, jak správně předepisovat off-label, by pomohlo zlepšit informovanost ambulantních lékařů [14].
Několik studií se zabývalo podáváním léčiv off-label v intenzivní pediatrické péči. Za zmínku stojí práce Hsu a Brazeltona z roku 2009, která zahrnuje celkem 677 pacientů hospitalizovaných na pediatrické jednotce intenzivní péče od ledna 2005 do prosince 2005. Nejčastěji ordinovanými léky byl paracetamol, ranitidin, morfin, fentanyl a propofol. Z nich však pouze paracetamol je FDA (Food and Drug Administration) schválen k předpisu u všech věkových skupin. Z lékových skupin se na prvním místě umístila analgetika, dále anestetika a antiemetika [14]. Další publikované práce k tomuto tématu jsou studie Bavdekara a spol. [16], Phana a spol. [17] a Doherta a spol. [18].
Používáním antibiotik off-label se zabývá práce Alessandra Porta a jeho spolupracovníků, ve které bylo sledováno 616 dětí přijatých na standardní oddělení (506) nebo jednotku intenzivní péče (110) ve Velké Británii, Itálii a Řecku. U těchto pacientů bylo provedeno 1244 ordinací antibiotik. Studie zohledňuje věk pacientů, celkovou denní dávku a její rozdělení, ale také indikace terapie. Výsledky ukazují, že off-label použití je velmi časté a že mezi sledovanými zeměmi jsou určité rozdíly, z nichž jen některé jsou významné. Jedinými antibiotiky použitými off-label z důvodu nesplnění věkových kritérií byly meropenem (který není registrován pro děti mladší 3 měsíců), chinolony a linezolid (které nejsou registrovány do 18 let věku). Ze studie také vyplývá, že podávání ciprofloxacinu a levofloxacinu dětem má dobré výsledky a minimum nežádoucích účinků. I přesto by jejich podávání mělo být vyhrazeno k terapii infekcí vyvolaných patogeny rezistentními ke všem antibiotikům schváleným pro podání dětem. Nejčastější off-label indikací na jednotkách intenzivní péče byla prokázaná nebo suspektní sepse (ve Velké Británii) a antibiotická profylaxe (v Itálii a Řecku). Některá antibiotika, zejména aminoglykosidy, byla ordinována v nižších než doporučených dávkách, a to hlavně ve Velké Británii a Itálii. Toto zjištění může odrážet obavy neonatologů ze známých nežádoucích účinků a snaha snížit jejich riziko pomocí nižšího dávkování. Oproti tomu v Řecku bylo zaznamenáno podávání vyšších dávek aminoglykosidů, než jaké jsou doporučeny. Autoři tímto upozorňují na nutnost vytvoření uceleného doporučení pro dávkování potenciálně toxických antibiotik [19].
ZÁVĚR
V každodenní praxi je mnohdy obtížné najít vhodné léčivo, které by bylo registrováno pro pediatrickou populaci. Asi 70 % dostupných léčiv vůbec nebylo v klinických studiích na dětech hodnoceno [20]. Používání off-label a unlicensed léků je však u dětských pacientů velmi časté jak v ambulantní, tak v nemocniční péči. Je důležité zdůraznit, že off-label užití neznamená nesprávné užití a že velká většina lékařů se ve své denní praxi bez něj neobejde. Vždy záleží na poměru přínosu a rizika v konkrétní situaci. Je všeobecně známo, že někdy pacienti profitují z použití dokonce i kontraindikovaného léku, protože žádná registrační dokumentace ani úřední rozhodnutí nemohou postihnout všechny situace, nastávající v klinické praxi. Příkladem může být používání fluorochinolonů u cystické fibrózy [21].
Výsledky jednotlivých studií, zabývajících se touto problematikou, je dosti obtížné porovnat, neboť používané definice podání či předpisu léčiv mimo schválené indikace nejsou zcela jednotné. Navíc je při hodnocení jejich výsledků nutné brát v potaz, zda studie hodnotí pouze samotné použití léků neregistrovaných pro děti nebo posuzuje také použité dávkování, detailní indikace apod.
Výsledky publikovaných studií ukazují závislost výskytu neregistrovaného použití léků na věku dítěte. Nejvyšší výskyt je obvykle zjišťován u novorozenců a kojenců. Čím je dítě mladší, tím častěji jsou u něj použity léky mimo schválené indikace. Tento závěr zřejmě platí především pro nemocniční péči, zatímco v ambulantní je navíc pozorován vysoký počet neregistrovaných předpisů pro adolescenty. Mezi jednotlivými zeměmi sledovanými ve studiích se sice určité odlišnosti vyskytují, nicméně nejsou příliš významné, což je pravděpodobně důsledkem postupné harmonizace registračních procedur. Pokud jde o jednotlivé skupiny léčiv, nejčastěji jsou zřejmě mimo schválené indikace u dětí používána léčiva kardiovaskulárního systému. Při výzkumu incidence nežádoucích účinků léků v dětském věku bylo zároveň zjištěno, že riziko nežádoucího účinku při použití léku mimo schválené indikace u dětí je 3,6krát vyšší za hospitalizace a 2krát vyšší v ambulantní péči než při použití léků ve schválených indikacích [22].
Abychom omezili vystavování nemocných dětí zbytečným rizikům, ale zároveň je neochudili o potenciálně efektivní farmakoterapii, bude nezbytné častěji provádět klinické studie i na pediatrické populaci. Je to důležité, zejména pokud předpokládáme, že by z nového léku děti mohly profitovat. Zřejmě bude také nutné upravit legislativu a stanovit si další cíle v provádění klinických studií na dětské populaci, a to od těch nejrizikovějších, nezralých novorozenců až po adolescenty. Mimo jiné by také výrobci léčiv měli být více motivováni vyvíjet u registrovaných léčiv lékové formy určené pro děti [23].
Příkladem pokroku v této problematice je použití antipsychotika 2. generace ziprasidonu (Zeldox®) k léčbě bipolární afektivní poruchy dětí a dospívajících ve věku 10–17 let, které bylo schváleno v září roku 2010. Všechna ostatní atypická antipsychotika (aripiprazol, risperidon, olanzapin, quetiapin) se zatím v pediatrické psychiatrii používají v off-label indikaci.
Protože není možné se zcela vyhnout použití léčiv tímto způsobem, bylo by vhodné pokusit se minimalizovat jeho rizika. K tomu by mohly sloužit farmakovigilanční metody zaměřené na tuto problematiku.
Téma off-label a unlicensed předpisu léčiv je poměrně obsáhlé a je obtížné je stručně shrnout. Pochopení této problematiky by nám mělo pomoci používat účelnou farmakoterapii, ale také předcházet závažným nežádoucím účinkům. S touto tematikou úzce souvisí i otázka provádění klinických studií u dětí. Řada léčiv není na dětech testována, a přesto se v běžné praxi používají. Pokud lékař nemá k dispozici léčivo pro dítě registrované, nezbývá mu, než se řídit zkušenostmi a dostupnými odbornými doporučeními.
Zpracováno s podporou grantu IGA UPOL LF-2011-005.
Došlo: 3. 5. 2011
Přijato: 10. 8. 2011
MUDr. Petra Langerová
Ústav farmakologie LF UP a FN
Hněvotínská 3
775 15 Olomouc
e-mail: petra.langerova@fnol.cz
Sources
1. Chessels JM. Treatment of childhood acute lymphoblastic leukaemia: present issues and future prospects. Blood Rev 1992; 6 : 193–203.
2. Roberts R, Rodriguez W, Murphy D, Crescenzi T. Pediatric drug labeling: improving the safety and efficacy of pediatric therapies. JAMA 2003; 290(7): 905–911.
3. Caldwell PH, Murphy SB, Butow PN, Craig JC. Clinical trials in children. Lancet 2004; 364(9436): 803–811.
4. Turner S, Longworth A, Nunn AJ, Choonara I. Unlicensed and off label drug use in paediatric wards: prospective study. BMJ 1998; 316(7128): 343–345.
5. Pandolfini C, Bonati M. A literature review on off-label drug use in children. Eur J Pediatr 2005; 164(9): 552–558.
6. European Medicines Agency. The European paediatric initiative: History of the Paediatric Regulation. Doc. Ref: EMEA/17967/04 Rev 1, London 2007.
7. Lindell-Osuagwu L, Korhonen MJ, Saano S, Helin-Tanninen M, et al. Off-label and unlicensed drug prescribing in three paediatric wards in Finland and review of the international literature. J Clin Pharm Ther 2009; 34(3): 277–287.
8. ‘t Jong GW, Vulto AG, de Hoog M, Schimmel KJ, et al. A survey of the use of off-label and unlicensed drugs in a Dutch children’s hospital. Pediatrics 2001; 108 : 1089–1093.
9. ‘t Jong GW, van der Linden PD, Bakker EM, van der Lely N, et al. Unlicensed and off-label drug use in a paediatric ward of a general hospital in the Netherlands. European Journal of Clinical Pharmacology 2002; 58 : 293–297.
10. Bajcetic M, Jelisavcic M, Mitrovic J, Divac N, et al. Off label and unlicensed drug use in paediatric kardiology. European Journal of Clinical Pharmacology 2005; 61 : 775–779.
11. Di Paolo ER, Stoetter H, Cotting J, et al. Unlicensed and off-label drug use in Weiss paediatric university hospital. Swiss Medical Weekly 2006; 136 : 218–222.
12. Conroy S, Newman C, Gudka S. Unlicensed and off label drug use in acute lymphoblastic leukaemia and other malignancies in children. Ann Oncol 2003; 14 : 42–47.
13. Hsien L, Breddemann A, Frobel AK, Heusch A, et al. Off-label drug use among hospitalised children: identifying areas with the highest need for research. Pharm World Sci 2008; 30(5): 497–502.
14. Bazzano AT, Mangione-Smith R, Schonlau M, Suttorp MJ, Brook RH. Off-label prescribing to children in the United States outpatient setting. Acad Pediatr 2009; 9(2): 81–88.
15. Hsu B, Brazelton T. Off-label medication use in an academic hospital pediatric critical care unit. Department of Pediatrics, University of Wisconsin School of Medicine and Public Health, Madison, WI 53792-4108, USA. MJ 2009; 108(7): 343–348.
16. Bavdekar SB, Sadawarte PA, Gogtay NJ, Jain SS, Jadhav S. Off-label drug use in a Pediatric Intensive Care Unit. Indian J Pediatr 2009; 76(11): 1113–1118.
17. Phan H, Leder M, Fishley M, Moeller M, Nahata M. Off-label and unlicensed medication use and associated adverse drug events in a pediatric emergency department. Pediatr Emerg Care 2010; 26(6): 424–430.
18. Doherty DR, Pascuet E, Ni A, Stewart P, Splinter W, Vaillancourt R. Off-label drug use in pediatric anesthesia and intensive care according to official and pediatric reference formularies. Can J Anaesth 2010; 57(12): 1078–1088.
19. Porta A, Esposito S, Menson E, Spyridis N, Tsolia M, et al. Off-label antibiotic use in children in three European countries. Eur J Clin Pharmacol 2010; 66(9): 919–927.
20. Kemper EM, Merkus M, Wierenga PC, Van Rijn PC, Van der Werff D, et al. Towards evidence-based pharmacotherapy in children. Paediatr Anaesth 2011 Mar; 21(3): 183–189. doi: 10.1111/j.1460-9592.2010.03493.
21. Hanulík V, Sedláková MH, Petrželová J, Kolář M. Možnosti fluorochinolonů v současné klinické praxi. Klin Farmakol Farm 2010; 24(4): 184–186.
22. Clavenna A, Bonati M. Adverse drug reactions in childhood: a review of prospective studies and safety alerts. Arch Dis Child 2009; 94(9): 724–728.
23. European Medicines Agency. The European paediatric initiative: History of the Paediatric Regulation. Doc. Ref: EMEA/17967/04 Rev 1, London 2007.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2011 Issue 6-
All articles in this issue
- The development of neonatal care and evaluation of the first five years experience in surgery of cleft lip in the neonatal period
- Changes in electrical conductivity of the skin due to painful stimuli in newborns of different gestational categories and comparison with changes in selected physiological parameters
- Necrotizing enterocolitis in full-term neonates. Case report and review of the literature
- Off-label prescribing in pediatrics
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Necrotizing enterocolitis in full-term neonates. Case report and review of the literature
- Off-label prescribing in pediatrics
- Changes in electrical conductivity of the skin due to painful stimuli in newborns of different gestational categories and comparison with changes in selected physiological parameters
- The development of neonatal care and evaluation of the first five years experience in surgery of cleft lip in the neonatal period
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

