-
Medical journals
- Career
Revidovaný doporučený postup při diagnostice, léčbě a prevenci alergie na bílkovinu kravského mléka
: P. Frühauf
: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Praha přednosta prof. MUDr. J. Zeman, DrSc.
: Čes-slov Pediat 2010; 65 (7-8): 466-471.
: Opinion of expert / working groups
Jsou doporučeny zvláštní algoritmy pro kojené a uměle živené kojence. Doporučení zdůrazňují důležitost podrobné anamnézy a pečlivého fyzikálního vyšetření. Pacienti s těžkými symptomy by měli být odesláni ke specialistovi. Eliminace bílkovin kravského mléka z diety dítěte nebo matky a expozice jsou zlatým standardem pro diagnózu.
Klíčová slova:
alergie na bílkovinu kravského mléka, extenzivní hydrolyzáty, aminokyselinové formuleVzhledem k tomu, že se v oblasti diagnostiky, terapie a prevence alergie na bílkovinu kravského mléka (ABKM) objevily nové poznatky – poruchy motility jako projev ABKM, pojem tzv. těžké ABKM, nový postoj k zavádění komplementární výživy ve smyslu prevence ABKM, byl přepracován doporučený postup uveřejněný v roce 2001 Českou lékařskou společností Jana Evangelisty Purkyně, reg. číslo: o/035/073 (www.cls.cz/dokumenty2/postupy/r073.rtf).
Pojem ABKM je chápán jako imunologicky podmíněná reakce na některou z bílkovin kravského mléka. Vzhledem k tomu, že užší pojetí alergie je chápáno ve smyslu reakce mediované pouze IgE, je někdy místo ABKM používán pojem hypersenzitivita na bílkovinu kravského mléka k vyjádření všech možných typů alergických reakcí na bílkovinu kravského mléka, zvláště tehdy, když chybí laboratorní průkaz alergie.
Incidence ABKM je podle prospektivních studií s provedeným reexpozičním testem 2,2–2,8 % u dětí mladších tří let. ABKM u plně kojených dětí má incidenci 0,5 %.
Podle prospektivní studie provedené v Praze v letech 2004–2006 byla ABKM diagnostikována u 2,2 % kojenců [1].
Patofyziologicky se kromě IgE zprostředkovaných reakcí uplatňují i další typy alergických reakcí. Je udáváno, že u 50 % kojenců a starších dětí s klinicky prokázanou alergií neexistují žádné známky IgE mediované reakce.
Rizikovým faktorem rozvoje ABKM je rodinná alergická zátěž, přičemž je-li anamnestická zátěž alergií u obou rodičů nebo u jednoho rodiče a u sourozence je manifestovaná ABKM, je to považováno za důvod k preventivní dietní intervenci. Anamnestický údaj o tzv. první lahvi (senzibilizující), tj. podání umělého kojeneckého mléka před rozvojem laktace, je závažný. Klinické příznaky ABKM jsou uvedeny v tabulce 1.
Vztah času rozvoje ABKM a množství vypitého mléka a obvyklých klinických manifestací ukazuje tabulka 2.
2. Vztah času rozvoje ABKM a množství vypitého mléka a obvyklých klinických manifestací. 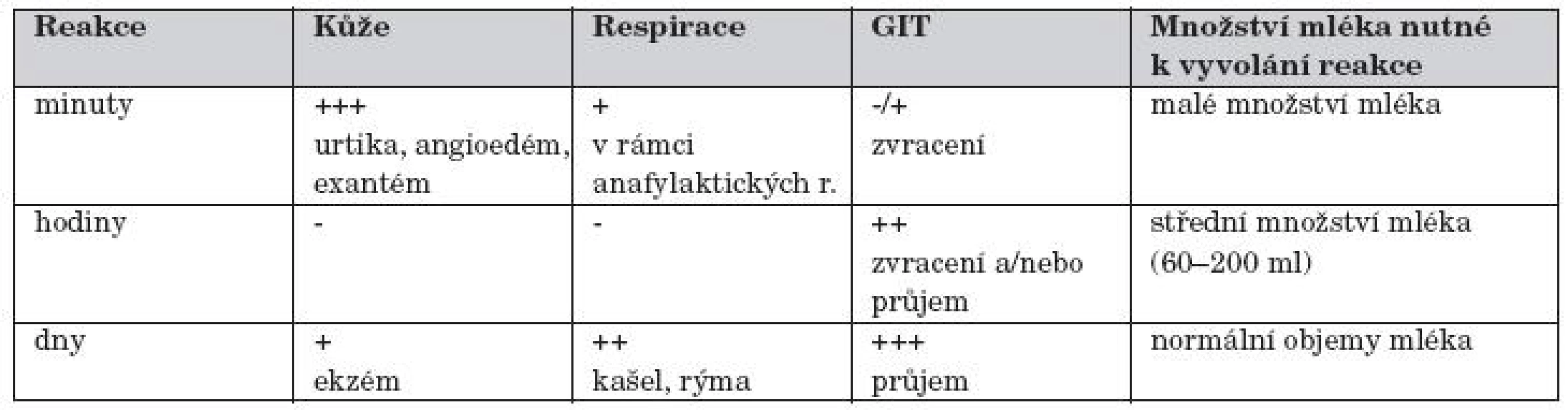
ABKM se zpravidla projevuje v kojeneckém věku a udává se, že gastrointestinální příznaky má asi 60 % postižených, kožní projevy 50–60 % nemocných a respirační projevy jsou asi u jedné třetiny kojenců s ABKM, přičemž příznaky se často kombinují. Soudí se, že asi 10 % kojenců s abdominálními kolikami lze úspěšně ovlivnit eliminací kravského mléka (KM). V poslední době jsou publikovány práce, které upozorňují na spojení ABKM s poruchami motility. Charakteristickými rysy těchto projevů jsou: začátek v prvních týdnech života, selhávání obvyklé terapie, zlepšení po eliminaci KM, relaps po zavedení KM, koexistence více obtíží: GER + koliky + obstipace.
Anafylaktická reakce (její projevy s poklesem TK jsou literárně uváděny u 9 % dětí s ABKM). Anafylaktický šok jako projev ABKM lze očekávat asi u 2 % dětí. Na 50 % případů ABKM se manifestuje do jednoho týdne po kontaktu s KM, je však uváděno, že první reakce se může manifestovat až za 2 měsíce. ABKM je nepravděpodobná, jestliže dítě toleruje plné porce KM déle než 3 měsíce.
Diagnosticky neexistuje jednoznačný laboratorní test, kterým by bylo možno celý komplex ABKM postihnout. Vyšetřování různých protilátek proti KM proto nemusí přinést jednoznačnou odpověď a jejich pozitivita je pouze pomocným diagnostickým faktorem a může být i falešně pozitivní – vyšetřování IgA a IgG protilátek je zcela zbytečné a zavádějící, což vede k mylným diagnózám a zcela zbytečným dietám. Pozitivní protilátky ve třídě IgE nejsou důkazem alergie na KM. Pouze 20–30 % dětí s IgE protilátkami na KM má pozitivní expoziční test [4]. Lepší je negativní prediktivní hodnota testu – negativní protilátky ve třídě IgE vylučují anafylaktickou reakci. Rozhodnutí o změně výživy je stejně nutno přijmout před zhodnocením vyšetření protilátek. V současné době jsou ceněny nejvýše prick testy, ale ani jejich senzitivita a specificita není stoprocentní. Náplasťové testy nejsou obecně doporučovány (časová náročnost, subjektivita, omezený informační přínos).
Zlatým diagnostickým standardem proto zůstává zhodnocení eliminace KM z výživy a následná reexpozice k potvrzení alergické povahy reakce. KM se zavádí znovu do výživy obvykle po 1–4 týdnech předchozí eliminace. Při takto prováděné diagnostice se původní hypotéza o ABKM potvrzuje podle různých pramenů pouze u 30–60 % původních suspekcí na ABKM. Podstatou reexpozičního testu je podávání zvyšujícího se množství KM pod lékařskou supervizí v prvních hodinách podávání, kdy by měly být zachyceny nejzávažnější reakce vyžadující akutně kromě přerušení podávání KM i event. medikaci při anafylaktické reakci (adrenalin 0,01 mg/kg/dávku s.c., event. dále kortikoidy). Metodika podávání KM při reexpozici je uvedena v tabulce 3. Je vhodné používat mléko se sníženým obsahem laktózy nebo bez ní, aby bylo vyloučeno současné posuzování tolerance bílkoviny a laktózy.
3. Metodika expozičního testu. 
Metodologicky je nejkorektnější eliminační test s aminokyselinovým preparátem (AAF), protože určité množství kojenců s ABKM (až 10 %) netoleruje ani extenzivní hydrolyzát (eHF). Neústup obtíží po eHF může být interpretován jako neúspěch eliminace a tudíž je diagnóza ABKM – jako příčiny klinických obtíží – zpochybněna. Eliminace v případě eozinofilních a non-IgE reakcí musí trvat alespoň 2 týdny, u atopické dermatitidy a alergické kolitidy 4 týdny.
V případě, že se jedná o posouzení některých reakcí, které je obtížné správně interpretovat (iritabilita kojence, koliky, ekzém a jeho změny), je vhodné test provést jako dvojitou slepou studii, tj. rodiče neví, zda dítě dostane skutečný testační pokrm nebo placebo, tj. proteinový hydrolyzát, který dítě dostávalo jako terapeutický. Teprve po vyhodnocení záznamového listu (tab. 4) po provedení zátěže s KM a placebem je definitivně zhodnocen reexpoziční test (příprava placeba a testačního pokrmu je uvedena v tabulce 5 – navážený prášek je rodičům vydáván v neoznačené konzervě).
4. Záznamový list pro rodiče dítěte při expozičním testu. 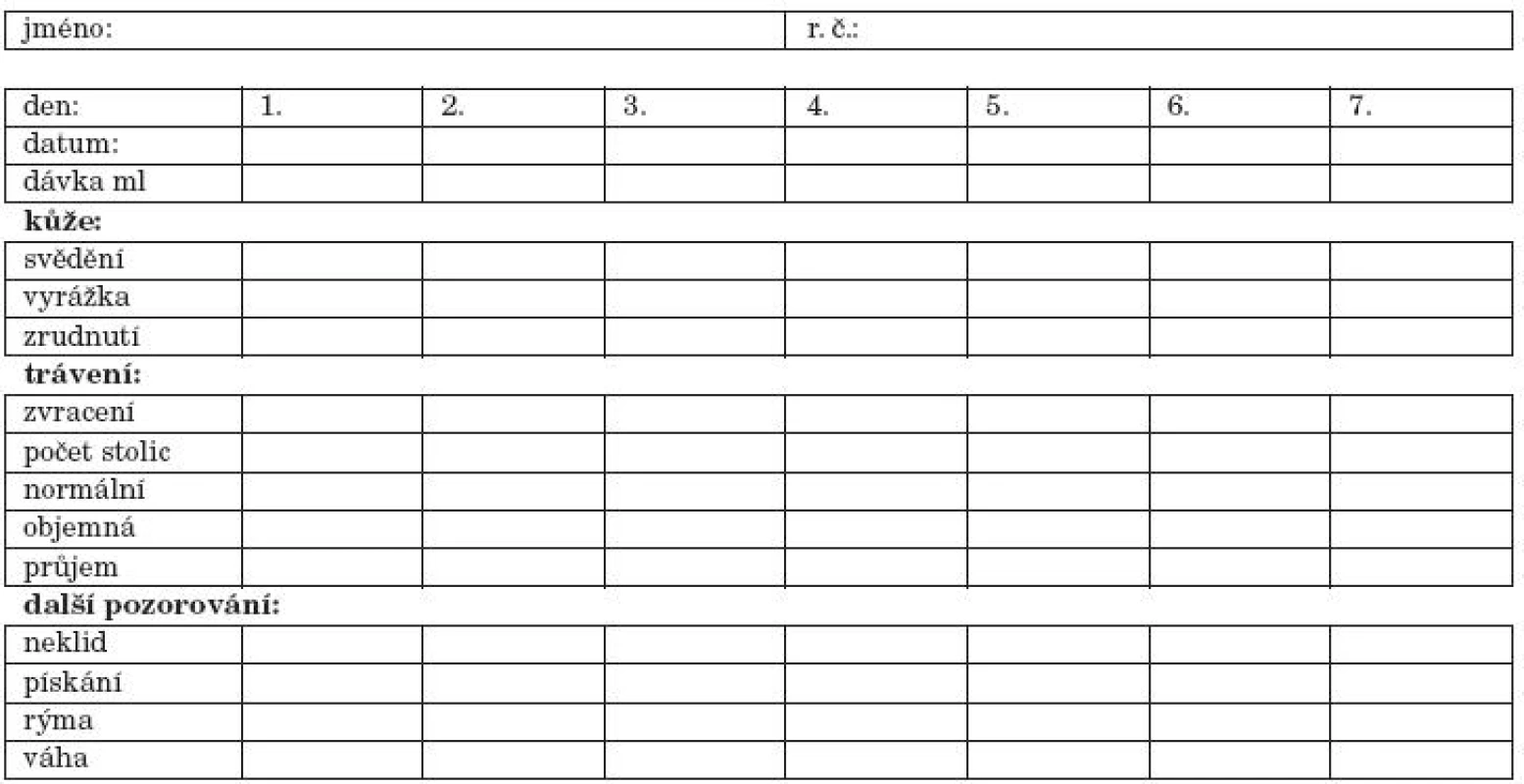
Diferenciálně diagnosticky je třeba vzít v úvahu intoleranci laktózy (vzácná primární se projevuje již po porodu, častější sekundární obvykle po gastrointestinálních infektech, celiakii), podobnou symptomatologii může mít gastroezofageální reflux, imunodefekty nebo intolerance mléka v důsledku metabolických vad. V některých případech vyžaduje diferenciální diagnostika i provedení enterobiopsie.
Terapeutickým opatřením je kompletní eliminace preparátů s kravským mlékem z výživy dítěte. U ABKM není vhodné používat jako náhradu kozí a ovčí mléko, protože existuje podobná antigenicita a alergenicita jako u mléka kravského. Je třeba rovněž zdůraznit, že v rámci existence multiproteinových alergií je uváděna alergie na sójové preparáty u 17–47 % kojenců s ABKM, a proto je užití sójových preparátů v léčbě ABKM nevhodné. Tepelné zpracování mléka (pasterizace, sušení, kondenzace) sice snižuje antigenicitu mléka, ale není považováno za dostatečnou úpravu mléka u ABKM (terapeutický preparát by mělo tolerovat 90 % postižených s ABKM). Z výše uvedeného vyplývá, že pro malou skupinu kojenců s ABKM je i extenzivní proteinová hydrolýza bílkoviny nedostatečné opatření a je třeba podávat preparát, jehož bílkovinná složka je tvořena pouze směsí aminokyselin. Základním technologickým postupem při výrobě proteinových hydrolyzátů je hydrolýza bílkoviny (syrovátky, kaseinu, bovinního kolagenu, sójové bílkoviny). Z hlediska hloubky zásahu do struktury bílkovin potom dělíme preparáty na hypoalergenní – extenzivně hydrolyzované, tj. terapeutické, a hypoantigenní – parciálně hydrolyzované, tj. preventivní. U prokázané ABKM jsou nevhodné i tzv. hypoantigenní formule (označované výrobci HA). Mateřské mléko lze považovat z hlediska ABKM za hypoalergenní.
Byl definován pojem tzv. těžké ABKM, kdy je primárně indikováno podání aminokyselinových preparátů (tab. 6). Od tohoto členění a způsobu výživy (kojení, umělá výživa) se odvíjí diagnostický algoritmus – schéma 1 a 2.
Schéma 1. Kojené dítě s ABKM [6]. ![Schéma 1. Kojené dítě s ABKM [6].](https://pl-master.mdcdn.cz/media/image/da33314503dd2b9cb3114256c8b42114.jpg?version=1537797180)
Schéma 2. Uměle živené dítě s ABKM [6]. ![Schéma 2. Uměle živené dítě s ABKM [6].](https://pl-master.mdcdn.cz/media/image/e45e193c1c9c6733c76a72ee00845d95.jpg?version=1537797349)
Preparáty k léčbě a prevenci ABKM a jejich indikace (tab. 7)
7. Preparáty k léčbě a prevenci ABKM a jejich indikace. 
Medikamentózní terapie má menší význam než dietoterapie a terapeutický efekt ve vztahu k ABKM, event. multiproteinovým alergiím byl prokázán v některých kontrolovaných klinických studiích pouze u kromglykátu, u ostatních antialergik chybí u dětí kontrolované klinické studie.
Prognosticky se ukazuje, že pouze asi polovina pacientů s ABKM toleruje KM ve věku dvou let. Počet dětí, které tolerují KM, se postupně zvyšuje tak, že ve školním věku lze očekávat toleranci asi u 80 % původních pacientů s ABKM. Rozvoj dalších alergických projevů je ve skupině dětí s ABKM častější než ve zbytku populace, nejen ve smyslu multiproteinových potravinových reakcí (nejčastěji vejce, sója, burské ořechy i další), ale i respiračních alergóz.
Kojení do 4 měsíců – u dětí s vyšším rizikem alergie – redukuje riziko atopické dermatitidy. Kojení rovněž snižuje riziko „wheezingu“ u kojenců a batolat. Nezdá se, že má význam ve vztahu k rozvoji astmatu. Rovněž není jasné, zda kojení snižuje výskyt potravinových alergií.
Dietní opatření u kojících matek je považováno za sporné. Dietní opatření u těhotných žen k prevenci nebo oddálení časného rozvoje atopického ekzému je neúčinné (tab. 8).
8. Preventivní opatření ke snížení rizika ABKM [2, 5]. ![Preventivní opatření ke snížení rizika ABKM [2, 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/203e4efc4c7eba76bfc7d8ac2ece4853.jpg)
Užívání hydrolyzovaných formulí u nekojených dětí s vyšším rizikem rozvoje alergie má protektivní efekt a snižuje riziko atopické dermatitidy. Dietní opatření u kojící matky k prevenci nebo oddálení časného rozvoje atopického ekzému jsou považována za neúčinná.
Nejsou žádné důkazy pro to, že by oddalování zavedení jakýchkoliv potravin po 4.–6. měsíci snižovalo výskyt alergických onemocnění.
Preskripce terapeutických preparátů – jsou částečně hrazeny zdravotními pojišťovnami – je usměrněna u eHF na praktického lékaře pro děti a dorost, dětského lékaře, alergologa a dětského gastroenterologa. Aminokyselinové preparáty může předepisovat v indikaci ABKM dětský lékař, dětský gastroenterolog a alergolog.
Tento doporučený postup byl projednán a schválen Pracovní skupinou pro dětskou gastroenterologii a výživu České pediatrické společnosti ČLS JEP, závěrečnou recenzi provedl prof. MUDr. Jiří Nevoral, CSc.
Práce je podporována MZO VFN 2005.
MUDr. Pavel Frühauf, CSc.
Klinika dětského a dorostového
lékařství UK 1. LF a VFN
Ke Karlovu 2
129 01 Praha 2
e-mail: fruhauf.pavel@vfn.cz
Sources
1. Fabianová J, Frühauf P. Epidemiologická studie intolerance kravského mléka. 18.pracovní dny dětské gastroenterologie a výživy, Hrubá Skála, 4. 10.–6. 10. 2007. Čes.-slov. Pediat. 2008; 63 : 49.
2. Greer FR, et al. Effects of early nutritional interventions on the development of atopic disease in infants and children: The role of maternal dietary restriction, breastfeeding, timing of introduction of complementary foods, and hydrolyzed formulas. Pediatrics 2008; 121 : 183–191.
3. Heine RG. Allergic gastrointestinal motility disorders in infancy and early childhood. Pediatr. Allergy Immunol. 2008; 19 : 383–391.
4. Majamaa H, et al. Cow’s milk allergy: Diagnostic accuracy of skin prick and patch tests and specific IgE. Eur. J. Allergy Clin. Immunol. 1999; 54 : 346–351.
5. Saarinen KM, et al. Suplementary feeding in maternity hospitals and the risk of cow’s milk allergy: A prospective study of 6209 infants. J. Alergy Clin. Imunol. 1999; 104 : 457–461.
6. Vandenplas Y, et al. Guidelines for the diagnosis and management of cow´s milk protein allergy in infants. Arch. Dis. Child. 2007; 92 : 902–908.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2010 Issue 7-8-
All articles in this issue
- Brdlík’s Price Awarded
- Clinical Symptoms and Laboratory Data in 75 Children with Neonatal Manifestation of Mitochondrial Disease: Proposed Diagnostic Algorithms
- The Significance of the Dynamics of Serological and PCR Diagnostic Data for the Likelihood of Congenital Toxoplasmosis in Children Born to Toxoplasma Seropositive Mothers
- Results of Molecular Genetic Examinations in Patients of the Child Lipid Advisory Center at the Faculty Hospital at Olomouc within the Framework of the MedPed Project
- Analysis of Vaccination in Children Population against Tick-borne Encephalitis in the Slovak Republic from 1997 to 2009
- Present Opportunities for Treatment of Hyperphenylalaninemia
- Assessment of Arterial Wall Stiffness by Measurement of Pulse Wave Velocity in Children
- Revised Guidelines for Diagnosis, Therapy and Prevention Cow Milk Protein Allergy
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Present Opportunities for Treatment of Hyperphenylalaninemia
- Revised Guidelines for Diagnosis, Therapy and Prevention Cow Milk Protein Allergy
- Assessment of Arterial Wall Stiffness by Measurement of Pulse Wave Velocity in Children
- Clinical Symptoms and Laboratory Data in 75 Children with Neonatal Manifestation of Mitochondrial Disease: Proposed Diagnostic Algorithms
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


![Klinické příznaky [3, 6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a6e5962a740c87e06f6490c63ad688bd.jpg)

