-
Medical journals
- Career
Poškodenie srdca po rádioterapii v detskom veku
Authors: K. Hudecová; B. Mladosievičová
Authors‘ workplace: Ústav patologickej fyziológie, Lekárska fakulta Univerzity Komenského, Bratislava prednosta doc. MUDr. M. Bernadič, CSc., mim. prof.
Published in: Čes-slov Pediat 2008; 63 (4): 194-200.
Category: Review
Overview
Liečba detského onkologického pacienta prináša viaceré riziká do budúcnosti. Rádioterapia (RT) na oblasť hrudníka, ale aj na kraniálnu a abdominálnu oblasť môže vyústiť do neskorých kardiovaskulárnych komplikácií. Mediastinálna RT môže indukovať poškodenie perikardu, myokardu, koronárnej vaskulatúry a môže zapríčiniť endoteliálnu dysfunkciu a fibrózu. Rádioterapia môže významne prispievať k vzniku perikardiálneho výpotku, konstriktívnej perikarditídy, ischemickej choroby srdca, infarktu myokardu, chlopňových chýb, arytmií a ďalších komplikácií. Vzájomná súvislosť jednotlivých orgánových systémov môže spôsobiť vznik neskorých účinkov, ktoré sa navzájom potencujú a ovplyvňujú. Metabolický syndróm ako rizikový faktor aterogenézy a kardiovaskulárnych ochorení je v súčasnosti často diskutovaný neskorý účinok protinádorovej liečby – najmä kraniálnej rádioterapie.
Rozpoznanie patofyziologických mechanizmov radiačného poškodenia a používanie nových diagnostických kardiologických metód v klinickej praxi umožňuje včasnú detekciu subklinických abnormalít. Očakáva sa, že vhodnými preventívnymi a terapeutickými postupmi (ACE-inhibítory, antikoagulanciá, profylaxia bakteriálnej endokarditídy) bude možné predchádzať vzniku kardiovaskulárnych ochorení aj u asymptomatických pacientov.Kľúčové slová:
rádioterapia, Hodgkinova choroba, metabolický syndróm, kardiotoxicita, prevenciaÚvod
Kardiovaskulárne (KVS) komplikácie protinádorovej liečby môžu významne prispievať k zníženej kvalite života u bývalých detských onkologických pacientov. Poškodenie srdca po rádioterapii sa môže manifestovať aj s odstupom viacerých rokov po ukončení liečby. U niektorých pacientov môže byť toto poškodenie život ohrozujúce.
Kardiovaskulárne ochorenia súvisia s rádioterapiou na oblasť:
- hrudníka a mediastína,
- kránia,
- miechy (v hrudníkovej oblasti),
- ľavej axily,
- brucha (celého alebo horných kvadrantov).
Kraniocerebrálna oblasť
Patofyziológia poškodenia kardiovaskulárneho systému po ožiarení kraniocerebrálnej oblasti v detskom veku je komplexná. Podieľa sa na nej aj dysfunkcia hypotalamo-hypofýzovej osi (abnormality gonadotropínov, rastového hormónu, tyroideálnych hormónov, adrenálna insuficiencia, diabetes insipidus, inzulínorezistencia, ovariálna dysfunkcia, obezita a ďalšie zmeny) [1, 2]. Hormonálnou dysbalanciou sa zvyšuje riziko vzniku metabolického syndrómu a predčasnej aterosklerózy. Metabolický syndróm predstavuje súhrn potenciálnych rizikových faktorov pre kardiovaskulárny systém [3]. V etiopatogenéze metabolického syndrómu má kľúčový význam inzulínorezistencia. Hyperinzulinizmus je kompenzačný fenomén, ktorým sa organizmus snaží prekonať znížený biologický účinok inzulínu, t.j. primárnu inzulínorezistenciu. Hyperinzulínizmus per se však inzulínorezistenciu ďalej prehlbuje. Hyperglykémia a DM 2. typu reprezentujú dekompenzovanú fázu IR [4] (obr. 1).
Image 1. Patogenéza inzulínorezistencie a jej metabolických a klinických dôsledkov (voľne podľa [4]). ![Patogenéza inzulínorezistencie a jej metabolických a klinických dôsledkov (voľne podľa [4]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f71530b6e279230ff4c44d15d841f3cb.jpeg)
V ostatných rokoch boli publikované viaceré štúdie týkajúce sa rizika vzniku metabolického syndrómu po protinádorovej liečbe. Osobitná pozornosť sa zameriava na rádioterapiu v detskom veku a s tým súvisiace riziko metabolického syndrómu [2, 3].
Gurney a spol. hodnotili prevalenciu metabolického syndrómu, deficit rastového hormónu a kardiovaskulárne rizikové faktory u 75 dospelých pacientov, ktorí v detstve prekonali akútnu lymfoblastickú leukémiu (ALL) a boli liečení ožiarením na oblasť kránia alebo boli bez rádioterapie (RT). Prevalencia metabolického syndrómu nebola výrazne rozdielna medzi pacientmi a kontrolnou skupinou (rovnakého veku a pohlavia). Avšak 60 % pacientov liečených kraniálnym ožiarením malo 2 alebo viac komponentov metabolického syndrómu v porovnaní s 20 % pacientov bez RT. Neliečená abnormálne nízka hladina rastového hormónu bola prítomná u 64 % všetkých pacientov a u 85 % pacientov, ktorí boli liečení kraniálnou rádioterapiou. Existuje teda silný kauzálny vzťah medzi kraniálnym ožiarením a deficitom rastového hormónu, nižšou hladinou IGF-1 (insuline-like growth factor 1), vyššou hladinou skorej fázy vyplavovania inzulínu, abdominálnou obezitou a dyslipidémiou (a to najmä u žien) [5]. Vznikom metabolického syndrómu a/alebo non-inzulín-dependentného diabetu sú ohrození aj pacienti liečení celotelovým ožiarením alebo chemoterapiou pre ALL [3, 6]. Tahrani a spol. dokumentujú prípad 6-ročného pacienta, ktorý dostal celotelové ožiarenie a transplantáciu kostnej drene pre relaps ALL. O deväť rokov neskôr sa u neho vyvinul diabetes mellitus [6].
Viaceré štúdie dokazujú, že po rádioterapii na oblasť kránia sa zvyšuje aj riziko vzniku obezity, najmä u mladých dievčat [7, 8]. Ross a spol. skúmali výskyt nadváhy a obezity po liečbe ALL. Ožiarenie v mladom veku pôsobí na štruktúry hypotalamu a môže zapríčiniť leptínovú rezistenciu – necitlivosť leptínového receptora na leptín. Polymorfizmy v géne pre leptínový receptor – Gln223Arg – môžu ovplyvniť u detských pacientov náchylnosť na vznik obezity. V tejto štúdii autori zistili, že pacientky s BMI (body mass index) >25 boli väčšinou Arg homozygoti. Pacientky – homozygotky Arg/Arg s kraniálnym ožiarením v celkovej dávke ≥20 Gy mali 6x väčšie riziko mať BMI >25 ako tie s Gln alelou (štúdia nezahŕňala mužov). Polymorfizmus v géne pre leptínový receptor tak môže ovplyvniť vznik obezity u dievčat, ktoré boli liečené kraniálnym ožiarením pre ALL v mladom veku [7]. Kraniálna RT v celkovej dávke ≥20 Gy súvisí so zvýšenou prevalenciou obezity, najmä u dievčat liečených vo veku mladšom ako 4 roky [8].
Najčastejšou komplikáciou poškodenia hypotalamo-hypofýzovej osi po rádioterapii je porucha vyplavovania rastového hormónu [2]. Birkholz a spol. vo svojej štúdii porovnávali rast a pubertálny vývoj detí po liečbe mozgového nádoru, ktoré boli resp. neboli liečené rekombinantným rastovým hormónom (rGH). Potreba suplementácie rastovým hormónom bola posúdená podľa zaostávania v raste a nízkej sekrécie hormónu po stimulačných testoch. Prvá skupina detí mala totálnu resekciu nádoru bez ožiarenia a nebola liečená rastovým hormónom. U niektorých pacientov sa vyvinula sekundárna hypotyreóza, sekundárna adrenálna insuficiencia, diabetes insipidus a hypogonadotropný hypogonadizmus s potrebou substitučnej terapie. V tejto skupine bola výška detí –1,24 SD a signifikantne sa nezmenila počas sledovania. BMI týchto detí bol 18,09 a postupne sa zvýšil na 23,73. Druhá skupina detí mala subtotálnu resekciu a kraniálne ožiarenie do celkovej dávky 46,5 Gy. U všetkých detí sa vyvinula multihormonálna insuficiencia podmozgovej žľazy. Výška detí bola –3,84 SD a po terapii rGH v priebehu 1,5-ročného sledovania bola výška –2,6 SD. BMI tejto skupiny sa zvýšil z 18,06 pred liečbou na 22,41 v čase sledovania a po liečbe rGH sa znížil na 18,5. Zvýšené riziko vzniku závažného multihormonálneho deficitu s potrebou suplementácie rastového hormónu majú teda pacienti liečení operáciou aj rádioterapiou. Riziko sa ďalej zvyšuje použitím adjuvantnej chemoterapie. Pacienti, ktorí podstúpili len operáciu, majú menšie riziko vzniku neskorej toxicity [1, 9].
Nedostatok rastového hormónu môže mať vážne následky na vývoj kardiovaskulárneho systému. Deficit rastového hormónu sa prejaví aj na zvýšení BMI pacienta, čo môže znamenať zvýšenú záťaž na kardiovaskulárny systém. Samotný rastový hormón je v čase rastu a pubertálneho zrenia nevyhnutný pre správny vývoj a maturáciu tkanív a orgánov. Nedostatok rastového hormónu preto spôsobuje nedostatočný vývoj srdca, najmä stenčenie ľavej komory (obr. 2).
Image 2. Dôsledky porúch vyplavovania rastového hormónu po rádioterapii na kránium. 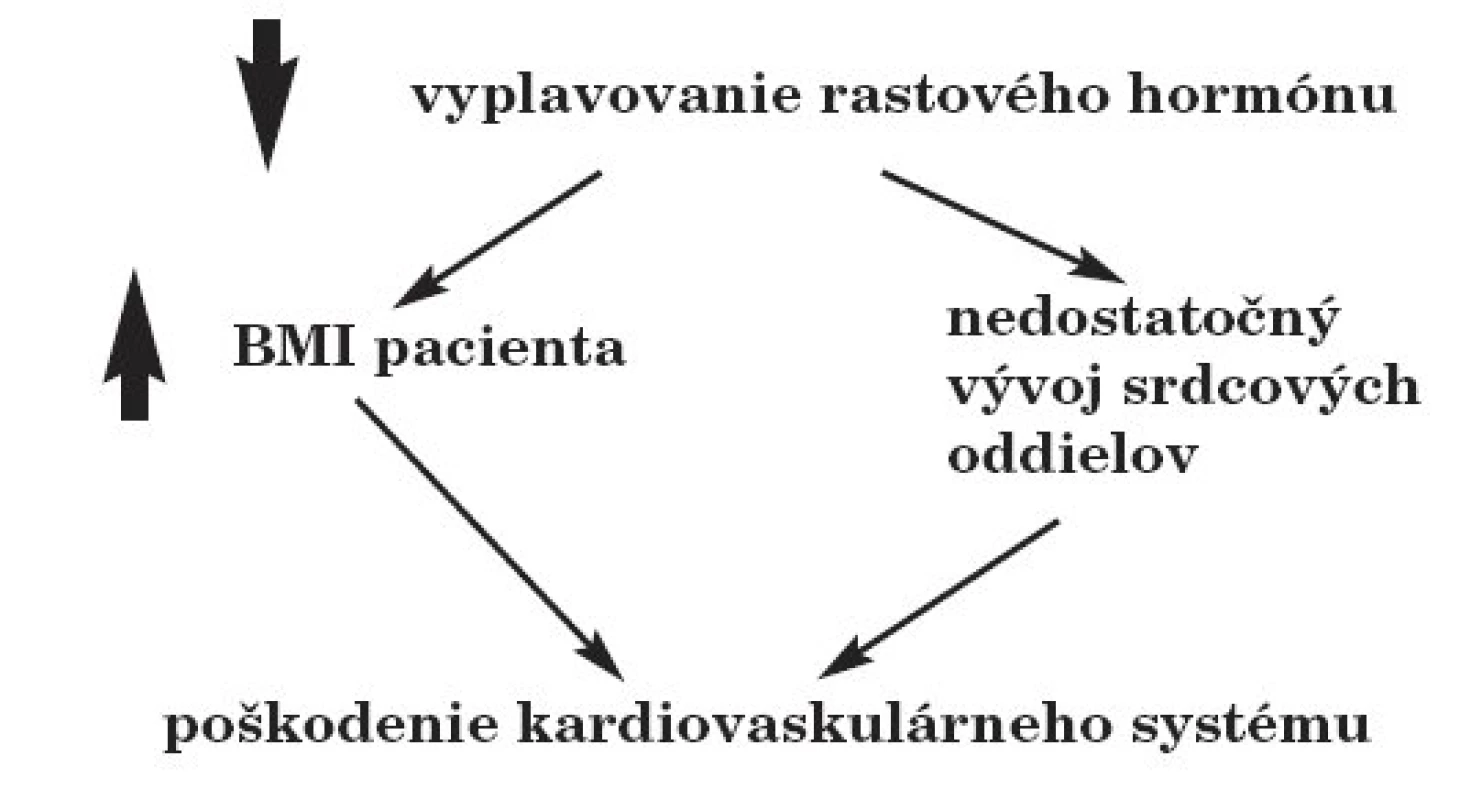
V rámci starostlivosti o pacientov po liečbe hematologických malignít a nádorov mozgu kraniálnou RT je nevyhnutné myslieť v súvislosti s deficitom rastového hormónu aj na riziko kardiovaskulárnych ochorení, diabetu a obezity. Identifikácia zvýšeného rizika umožňuje skorú intervenciu a prevenciu neskorých kardiovaskulárnych komplikácií. U detí po kraniálnom ožiarení je potrebné sledovať hormonálny stav a biochemický profil dlhodobo po ukončení terapie [3, 5, 8].
Rádioterapia na oblasť hrudníka a mediastína
Z hľadiska predchádzania neskorých kardiovaskulárnych následkov rádioliečby sa najväčšia pozornosť sústreďuje na rádioterapiu zasahujúcu oblasť srdca. V čase rastu a pubertálneho vývinu je organizmus vnímavejší na RT. Rádioterapia na oblasť mediastína môže súvisieť s poškodením:
- perikardu,
- myokardu,
- koronárnych artérií.
Riziko kardiotoxicity sa zvyšuje, ak je ožiarených viac ako 65 % objemu srdca [10]. Rozsah a charakter poškodenia RIHD (radiation induced heart disease) závisí od:
- veku pacienta,
- pohlavia pacienta,
- dávky RT,
- techniky RT,
- druhu adjuvantnej terapie,
- dĺžky sledovania,
- predchádzajúceho poškodenia srdca,
- ďalších rizikových faktorov.
Dôležitý vplyv má najmä dávka RT a vek pacienta v čase liečby. Zistilo sa, že používané dávky spôsobujú poškodenie kardiovaskulárneho aj muskuloskeletálneho systému [11, 12]. Trendy protinádorovej liečby sa zameriavajú na zníženie toxicity RT použitím kombinovaných modalít liečby. Redukcia ožiareného objemu u pacientov s Hodgkinovou chorobou z tzv. extended na involved-field radiotherapy (IFRT) kombinovaná s chemoterapiou sa ukazuje byť rovnako efektívna ako extended-field radiotherapy [13]. V súčasnosti sa do popredia dostáva použitie modernej techniky – tzv. INRT (involved-node radiotherapy) najmä u pacientov vo včasnom štádiu Hodgkinovej choroby. Táto technika redukuje veľkosť ožiareného poľa v porovnaní s IFRT. Pri použití INRT sú ožiarené iba postihnuté lymfatické uzliny, čím sa znižuje nežiaduce ožiarenie zdravých tkanív a orgánov v okolí [14]. Okrem redukcie ožiareného objemu je v modernej protinádorovej liečbe snaha aj o redukciu celkovej dávky RT. Viaceré štúdie dokumentujú efektívnu liečbu pacientov v skorom štádiu Hodgkinovej choroby použitím kombinácie chemoterapie a dávok RT <30 Gy [15, 16] (tab. 1).
Table 1. Kardiotoxicita po rádioterapii (voľne podľa [12]). ![Kardiotoxicita po rádioterapii (voľne podľa [12]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a37a207005cfbf53992243e6bb20fcc8.png)
Rozličné kardiálne komplikácie rádioterapie môžu vznikať následne. Charniot a spol. dokumentujú prípad pacienta, u ktorého sa po 28 rokoch od liečby Hodgkinovej choroby rádioterapiou vyvinuli viaceré abnormality srdca – poruchy vedenia a chronická perikarditída: najprv exsudatívna, potom konstriktívna [17]. Ichinose a spol. dokumentujú prípad 28-ročného pacienta s non-Hodgkinovým lymfómom. S odstupom 24 rokov po mediastinálnej rádioterapii (celková dávka 40 Gy) sa u neho vyvinula závažná infundibulárna stenóza pulmonálnej artérie, stenóza koronárnej artérie a ventrikulárna tachykardia. U pacienta bola nevyhnutná rekonštrukčná operácia výtokového traktu pravej komory a koronárny by-pass [18]. Incidencia ischemickej choroby srdca stúpa v druhej dekáde po ukončení terapie, menej počas prvých desiatich rokov od ukončenia liečby [10]. Komplikácie sa teda začnú objavovať v čase, kedy je už pacient vyliečený a vyradený zo sledovania. Preto je potrebné dlhodobé sledovanie detských onkologických pacientov aj v dospelom veku.
V patofyziológii poškodenia kardiovaskulárneho systému majú kľúčovú úlohu endotelové bunky kapilár. Ich ožiarenie rezultuje do obštrukcie kapilárneho lúmenu a formovania fibrínových hmôt a trombocytov. Tieto procesy vedú k ischémii, k smrti myokardiálnych buniek a k fibróze. Poškodenie myokardu je charakterizované nešpecifickou, difúznou intersticiálnou fibrózou, ktorá zriedka postihuje celý myokard. Závažnosť fibrotického postihnutia môže byť v jednotlivých oblastiach myokardu značne rozdielna. Fibróza poškodzuje kompliance srdca a vyúsťuje do reštrikčnej kardiomyopatie, ktorá je príčinou diastolickej dysfunkcie. Naproti tomu u pacientov liečených chemoterapiou sa vyvinie skôr systolická dysfunkcia. Zjazvené tkanivo a neprítomnosť dostatočného počtu myocytov negatívne ovplyvňujú normálny vývoj a rast srdca. Bunky vodivého systému, endotelové bunky koronárnych artérií a perikard sú taktiež citlivé na rádioterapiou indukovanú fibrózu [11].
Zjednodušený patofyziologický mechanizmus vzniku kardiomyopatie a srdcového zlyhania po RT uvádza schéma 1.
Image 3. Schéma 1. Zjednodušený patofyziologický mechanizmus vzniku kardiomyopatie a srdcového zlyhania po rádioterapii. 
Nedávno uverejnená štúdia Alemana a spol. hodnotí 1474 pacientov s Hodgkinovou chorobou (pacienti boli v čase liečby mladší ako 41 rokov a sledovaní 5 rokov po ukončení liečby). V priebehu 18,7-ročného sledovania autori zistili, že mediastinálna rádioterapia zvyšuje 2–7-násobne riziko vzniku infarktu myokardu, kongestívneho zlyhania srdca, anginy pectoris a chlopňových chýb. Autori uvádzajú, že antracyklíny v kombinácii s rádioterapiou môžu výrazne prispievať k zvýšenému riziku vzniku infarktu myokardu a chlopňových chýb [19].
Adams a spol. sledovali 48 pacientov po liečbe Hodgkinovej choroby plášťovou ožarovacou technikou (medián dávky bol 40 Gy a medián sledovania pacientov 14,3 rokov). Štyria pacienti (8,3 %) dostali antracyklíny. 12 % pacientov malo patologické parametre systolickej funkcie (avšak traja z týchto piatich pacientov dostali antracyklíny). 37,2 % pacientov malo znížené hodnoty masy ľavej komory a/alebo diastolickú dysfunkciu. 54 % pacientov malo pravdepodobne patologický pomer E/A – 1,5–2 a 22 % pacientov malo patologickú hodnotu E/A ≥2. Na základe daných parametrov sa u týchto pacientov môže vyvinúť reštrikčná kardiomyopatia. Kardiomyopatia môže teda byť potenciálny nežiaduci účinok rádioterapie. Autori zistili, že výskyt chlopňových chýb je u pacientov oveľa častejší, ako by sa očakávalo u populácie daného veku. 42,6 % pacientov malo najmenej jednu chlopňovú chybu. Chlopňové chyby môžu viesť ku vzniku bakteriálnej endokarditídy, preto sa uvažuje o nutnosti profylaxie [11]. Pacienti po liečbe Hodgkinovej choroby majú 8-násobne vyššie riziko chlopňových operácií v porovnaní s normálnou populáciou [20].
Diagnostika kardiovaskulárnych zmien po rádioterapii
Záťažové testovanie KVS a elektrokardiografia detekujú ischemickú chorobu srdca, 24-hodinové monitorovanie podľa Holtera demaskuje suspektné poruchy vedenia. V súčasnosti najčastejšie používanú metódu detekcie poškodenia KVS reprezentuje Dopplerova echokardiografia, ktorá identifikuje hlavné formy kardiálnych komplikácií (dysfunkcia ľavej komory, chlopňové chyby, perikarditída, perikardiálny výpotok, lézie koronárnych artérií).
Heindreich a spol. vo svojej štúdii zisťovali, či záťažové testovanie KVS môže identifikovať závažné, neočakávané stenózy koronárnych artérií u asymptomatických pacientov. Štúdia zahŕňala 294 pacientov, ktorí mali ožiarené mediastínum pre Hodgkinovu chorobu dávkou >35 Gy. V čase liečby nemali známu ischemickú chorobu srdca. Pacienti sa podrobili záťažovej echokardiografii, rádionuklidovému vyšetreniu a koronárnej angiografii. Abnormálne komorové parametre v pokoji malo 63 pacientov. Počas záťažových vyšetrení sa u 42 pacientov zistili perfúzne defekty a/alebo poškodená kinetika steny komory. Koronárna angiografia detekovala >50% stenózu u 22 pacientov, <50% stenózu u 9 pacientov a u 9 pacientov sa stenóza koronárneho riečiska nedokázala. Počas 6,5-ročného sledovania sa u 23 pacientov vyvinula koronárna príhoda (10 mali infarkt myokardu, 2 prípady boli fatálne). Záťažové testy tak identifikovali asymptomatických pacientov so zvýšeným rizikom vzniku akútneho infarktu myokardu a náhlej kardiálnej smrti [21]. Chemoterapia antracyklínmi môže taktiež viesť k dysfunkcii ľavej komory. Autori Elbl a spol. hodnotili 137 asymptomatických pacientov, ktorí boli liečení v detstve alebo adolescencii antracyklínmi. Autori zistili pokles EF (ejekčnej frakcie) na 40 % a FS (frakcionovaného skrátenia) na 20 % so zachovanou toleranciou záťaže a kontrakčnou rezervou ľavej komory u asymptomatických pacientov. Pokojová echokardiografia by mala byť robená aj u pacientov liečených chemoterapiou v pravidelných intervaloch po ukončení liečby. V prípade zistenia patologických hodnôt by sa pacienti mali podrobiť záťažovej echokardiografii [22].
Apter a spol. vo svojej štúdii zistili, že skoré kalcifikáty kardiovaskulárneho systému súvisia s rádioterapiou. Štúdia zahŕňala 15 pacientov vo veku 55 rokov a menej, ktorým boli počítačovou tomografiou detegované kalcifikáty. Pacienti boli liečení rádioterapiou pre Hodgkinovu chorobu a sledovaní 10 rokov. Akcelerované kalcifikáty boli detegované v koronárnych artériách, v aorte, v aortálnej a mitrálnej chlopni. Ich rozsah bol väčší, ak boli pacienti liečení v mladom veku. Počas sledovania sa u 3 pacientov vyvinula koronárna príhoda, 2 mali chlopňovú dysfunkciu, 2 perikarditídu a u jedného sa vyvinul kompletný AV blok. Kalcifikáty kardiovaskulárneho systému reprezentujú radiáciou indukovanú aterosklerózu. Môžu byť neinvazívne detegované pomocou špirálového CT vyšetrenia u asymptomatických pacientov, ktorí sú vo zvýšenom riziku. Preventívnou terapiou by sa u týchto pacientov mohlo predísť rozvoju kardiovaskulárneho ochorenia [23] (tab. 2).
Table 2. Skríningové vyšetrenia KVS systému u pacientov s poškodením srdca po RT (voľne podľa [12]). ![Skríningové vyšetrenia KVS systému u pacientov s poškodením srdca po RT (voľne podľa [12]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cbe24f07524a26ae685bd25794070b6d.png)
Poškodeniu srdca po rádioterapii sa venuje pozornosť najmä u pacientov s hematologickými malignitami. Prevalencia a súvis kardiovaskulárnych ochorení s rádioterapiou na oblasť brucha nie je doteraz dostatočne popísaná. Kardiovaskulárne komplikácie po RT v detskom veku môžu súvisieť aj s ožiarením obličiek a horných kvadrantov brucha. Paulino a spol. vo svojej štúdii hodnotili frekvenciu a typy nežiaducich účinkov u 42 detí, ktoré boli liečené rádioterapiou pre Wilmsov tumor. Rádioterapia bola u 36 pacientov zameraná na polovicu abdomenu a u 6 pacientov na celé brucho (všetci pacienti dostali chemoterapiu). Radiačná dávka bola v rozmedzí 1000–4000 cGy. Žiadne nežiadúce účinky nemalo 31 % pacientov. Čo sa týka možného vplyvu na kardiovaskulárny systém – u 3 pacientov sa vyvinula hypertenzia s normálnymi hodnotami sérového kreatinínu a močoviny. U jedného pacienta sa vyvinula chronická renálna insuficiencia neožiarenej obličky [24]. Rádioterapia na oblasť brucha môže spôsobiť vznik hypertenzie.
Záver
Poškodenie kardiovaskulárneho systému je závažný neskorý účinok rádioterapie v detskom veku. Zmeny kardiovaskulárneho systému mávajú progresívnejší charakter. Vývoj patofyziologických zmien na srdci je dlhodobý. Symptómy sa začnú objavovať až v pokročilejších štádiách kardiovaskulárneho ochorenia.
Poškodenie srdca u asymptomatických pacientov sa môže manifestovať náhle vplyvom zmien v rastúcom organizme, ktoré znamenajú stres – akcelerácia rastu rastovým hormónom, tehotenstvo, pôrod, akútna vírusová infekcia a iné [11]. Na poškodené srdce sa v takýchto situáciách kladú väčšie nároky, ako môže byť schopné zabezpečiť. Vyliečenie závažného onkologického ochorenia v týchto prípadoch môže skomplikovať následné poškodenie KVS. Vhodnými preventívnymi a terapeutickými postupmi sa poškodeniu srdca dá predchádzať [25]. Všetci pacienti liečení rádioterapiou zasahujúcou oblasť srdca, kraniocerebrálnu oblasť a oblasť brucha by mali byť pravidelne kardiologicky vyšetrovaní, a to aj dlhodobo po ukončení protinádorovej liečby.
Práca bola podporená grantom Univerzity Komenského č. UK/107/2007.
Došlo: 2. 5. 2007
Přijato: 26. 10. 2007
MUDr. Kristína Hudecová
Ústav patologickej fyziológie LFUK
Sasinkova 4
811 08 Bratislava
Slovenská republika
e-mail: kristina.hudecova@fmed.uniba.sk
Sources
1. Birkholz D, Korpal-Szczyrska M, Kaminska H, et al. Influence of surgery and radiotherapy on growth and pubertal development in children treated for brain tumour. Med. Wieku Rozwoj 2005;9(3 Pt 2): 463–469.
2. Couto-Silva AC, Brauner R, Adan LF. Endocrine sequelae after radiotherapy in childhood and adolescence. Arq. Bras. Endocrinol. Metanol. 2005;49(5): 825–832.
3. Kourti M, Tragiannidis A, Makedou A, et al. Metabolic syndrome in children and adolescent with acute lymphoblastic leukemia after the completion of chemotherapy. J. Pediatr. Hematom. Oncol. 2005;27(9): 499–501.
4. Klimeš I. Účinok inzulínu, inzulínová rezistencia a syndróm inzulínovej rezistencie. In Hulín I, et al. Patofyziológia. 6.vyd. Bratislava: SAP, 2002 : 1119–1135.
5. Gurney JG, Ness KK, Sibley SD, et al. Metabolic syndrome and growth hormone deficiency in adult survivors of childhood acute lymphoblastic leukemia. Cancer 2006;107(6): 1303–1312.
6. Tahrani AA, Cramp C, Moulik P. The development of non-insulin-dependent diabetes after total body irradiation and bone marrow transplantation in adolescence: a case report and literature review. Pediatr. Diabetes 2006;7(3): 173–175.
7. Oeffinger KC, Mertens AC, Sklar CA, et al. Obesity in adult survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study. J. Clin. Oncol. 2003;21(7): 1359–1365.
8. Ross JA, Oeffinger KC, Davies SM, et al. Genetic variation in the leptin receptor and obesity in survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study. J. Clin. Oncol. 2004;22(17): 3558–3562.
9. Gurney JG, Kadan-Lottick NS, Packer RJ, et al. Endocrine and cardiovascular late effects among adult survivors of childhood brain tumors: Childhood Cancer Survivor Study. Cancer 2003;97(3): 663–673.
10. Gaya AM, Ashford RF. Cardiac complications of radiation therapy. Clin. Oncol. 2005;17(3): 153–159.
11. Adams MJ, Lipshultz SE. Pathophysiology of antracycline - and radiation-associated cardiomyophaties: Implications for sreening and prevention. Pediatr. Blood Cancer 2005;44 : 600–606.
12. Guldner L, Haddy N, Pein F, et al. Radiation dose and long term risk of cardiac pathology following radiotherapy and anthracyclin for a childhood cancer. Radiother. Oncol. 2006;81(1): 47–56.
13. Dabaja B, Cox JD, Buchholz TA. Radiation therapy can still be used safely in combined modality approaches in patients with Hodgkin´s lymphoma. J. Clin. Oncol. 2007;25(1): 3–5.
14. Girinsky T, van der Maazen R, Specht L, et al. Involved-node radiotherapy (INRT) in patients with early Hodgkin lymphoma: concepts and guidelines. Radiother. Oncol. 2006;79(3): 270–277.
15. Koontz BF, Kirkpatrick JP, Clough RW, et al. Combined-modality therapy versus radiotherapy alone for treatment of early-stage Hodgkin’s disease: Cure balanced against complications. J. Clin. Oncol. 2006;24(4): 605–611.
16. Diehl V, Brillant C, Engert A, et al. Investigating reduction of combined modality treatment intensity in early stage Hodgkin’s lymphoma: Interim analysis of a randomized trial of the German Hodgkin’s Study Group (GHSG). J. Clin. Oncol. 2005;23 : 56.
17. Charniot JC, Zerhouni K, Kidouche R, et al. Late cardiac complications of radiation therapy. Presse Med. 2006;35(2 Pt 1): 239–242.
18. Ichinose T, Nakazato Y, Miyano H, et al. Severe infundibular pulmonary stenosis and coronary artery stenosis with ventricular tachycardia 24 years after mediastinal irradiation. Intern. Med. 2005;44(9): 963–966.
19. Aleman BMP, van den Belt-Duseboud AW, De Bruin ML, et al. Late cardiac toxicity after treatment for Hodgkin´s lymphoma. Blood 2006;109 : 1878–1886.
20. Hull MC, Morris CG, Pepine CJ, et al. Valvular dysfunction and carodit, subclavian, and coronary artery disease in survivors of Hodgkin lymphoma treated with radiation therapy. JAMA 2003;290 : 2831–2837.
21. Heindreich PA, Schnittger I, Strauss HW, et al. Screening for coronary artery disease after mediastinal irradiation for Hodgkin´s disease. J. Clin. Oncol. 2007;25(1): 43–49.
22. Elbl L, Hrstkova H, Chaloupka V, et al. Dynamic stress echocardiography in asymptomatic patients treated for malignant diseases in childhood. Vnitř. Lék. 2003;49(4): 273–279.
23. Apter S, Shemesh J, Raanani P, et al. Cardiovascular calcifications after radiation therapy for Hodgkin lymphoma: computed tomography detection and clinical correlation. Coron. Artery Dis. 2006;17(2): 145–151.
24. Paulino AC, Wen BC, Brown CK, et al. Late effects in children treated with radiation therapy for Wilms´tumor. Int. J. Radiat. Oncol. Biol. Phys. 2000;46(5): 1239–1246.
25. Mladosievičová B, Kaiserová E, Foltínová A (Eds). Možné neskoré následky protinádorovej liečby v detstve. Bratislava: SAP, 2007. 212 s.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2008 Issue 4-
All articles in this issue
- Hrozí zneužití a diskreditace lékařské genetiky
- Vliv některých faktorů na počet kojených dětí při propuštění z porodnice v letech 2000 až 2004 v ČR
- Pertuse a GER – dvě příčiny dlouhodobého kašle
- Poškodenie srdca po rádioterapii v detskom veku
- Morfologický pohľad na ontogenézu týmusu človeka
- Faktory ovplyvňujúce veľkosť a involúciu týmusu detí
- Historie dětské nefrologie v bývalém Československu a později v ČR
- Očkování proti pneumokokovým nákazám
- Nežádoucí účinky po podání BCG vakcíny v ČR v letech 2001–2006
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pertuse a GER – dvě příčiny dlouhodobého kašle
- Morfologický pohľad na ontogenézu týmusu človeka
- Faktory ovplyvňujúce veľkosť a involúciu týmusu detí
- Nežádoucí účinky po podání BCG vakcíny v ČR v letech 2001–2006
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

