-
Medical journals
- Career
Tularémie: vzácná příčina horečky a lymfadenopatie v kojeneckém věku
: A. Janda 1; F. Fencl 2; Z. Kabelka 3; J. Hobstová 4; M. Kroča 7; J. Kayserová 1; K. Bláhová 2; Z. Hříbal 5; T. Lázničková 6
: Ústav imunologie UK 2. LF a FN Motol, Praha přednostka prof. MUDr. J. Bartůňková, DrSc., MBA 1; Pediatrická klinika UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Lebl, CSc. 2; Klinika ušní, nosní, krční UK 2. LF a FN Motol, Praha přednosta doc. MUDr. Z. Kabelka 3; Infekční oddělení UK 1. LF a FN Motol, Praha přednostka MUDr. J. Hobstová, CSc. 4; Klinika zobrazovacích metod UK 2. LF a FN Motol, Praha přednosta doc. MUDr. M. Roček, CSc. 5; Ústav lékařské mikrobiologie UK 2. LF a FN Motol, Praha přednosta MUDr. O. Nyč 6; Ústřední vojenský zdravotní ústav Praha, Centrum biologické ochrany, Těchonín náčelník J. Navrátil 7
: Čes-slov Pediat 2008; 63 (3): 137-147.
: Case Report
Febrilní stavy spojené s lymfadenopatiemi jsou v dětském věku relativně časté. Nejobvyklejšími příčinami jsou běžné infekty virového či bakteriálního původu, po jejichž úspěšné léčbě dochází k uzdravení a regresi lymfadenopatie. Jednou z méně obvyklých a komplikovanějších příčin těchto příznaků je tularémie. Jedná se o onemocnění spíše dospělého věku, v pediatrické praxi je tato infekce vídána méně, u kojenců pak zcela raritně. V dostupné české literatuře nebyla tularémie u kojence dosud popsána; ve světě bylo zaznamenáno pouze několik ojedinělých případů.
V následujícím textu autoři předkládají své zkušenosti s léčbou tularémie u kojence hospitalizovaného v roce 2006 ve Fakultní nemocnici v Praze-Motole, doplněné stručným souhrnem poznatků o tomto onemocnění.Klíčová slova:
tularémie, lymfadenopatie, febrilie, kojenecký věkÚvod
Tularémie, jinak také nazývána zaječí nemoc nebo zaječí mor, je zoonóza způsobená bakterií Francisella tularensis. Poprvé bylo toto onemocnění popsáno v roce 1837 Sokenem, a to jako febrilní stav spojený s generalizovanou lymfadenopatií způsobený požitím králičího masa. Infekční agens označené jako Bacterium tularense detekoval McCoy v roce 1911 u nakažených veverek a jiných hlodavců v blízkosti jezera Tulare v Kalifornii. Odtud pochází název nemoci a druhové jméno bakterie. Její izolace u lidského onemocnění se zdařila až v roce 1920 Edwardu Francisovi, který nemoc poprvé nazval tularémie a na jehož počest byl mikrob následně přejmenován [1–3].
Francisella tularensis je striktně aerobní, drobný (délka 0,2–0,7 μm), nepohyblivý, nesporulující, opouzdřený, gramnegativní kokobacil. Mikrob je fakultativně intracelulární, přežívá a množí se především v cytoplazmě neaktivovaných makrofágů (obr. 1), kde dokáže zabránit splynutí fagozomu s lyzozomem. Popisují se čtyři sérologicky nerozlišitelné sérovary, a to Francisella tularensis sérovar tularensis (typ A), holartica (typ B), mediasiatica a novicida. Typ A je nejvíce virulentní, infekce tímto sérovarem může vést k úmrtí, naopak infekce typem B, stejně jako sérovarem novicida je mírnější, v příznivém případě dochází ke spontánní úzdravě. Typ A je nejčastějším sérovarem v Severní Americe, typ B v Evropě a Asii [1, 4–6].
1. Monocyto-makrofágová buňka infikovaná Francisella tularensis (poskytla RNDr. Z. Kročová, Ústav molekulární patologie, FVZ UO, Hradec Králové). Fig. 1. Monocyto-macrophage cell infected with Francisella tularensis (courtesy of Dr. Z. Kročová, Institute of molecular pathology, FVZ UO, Hradec Králové). 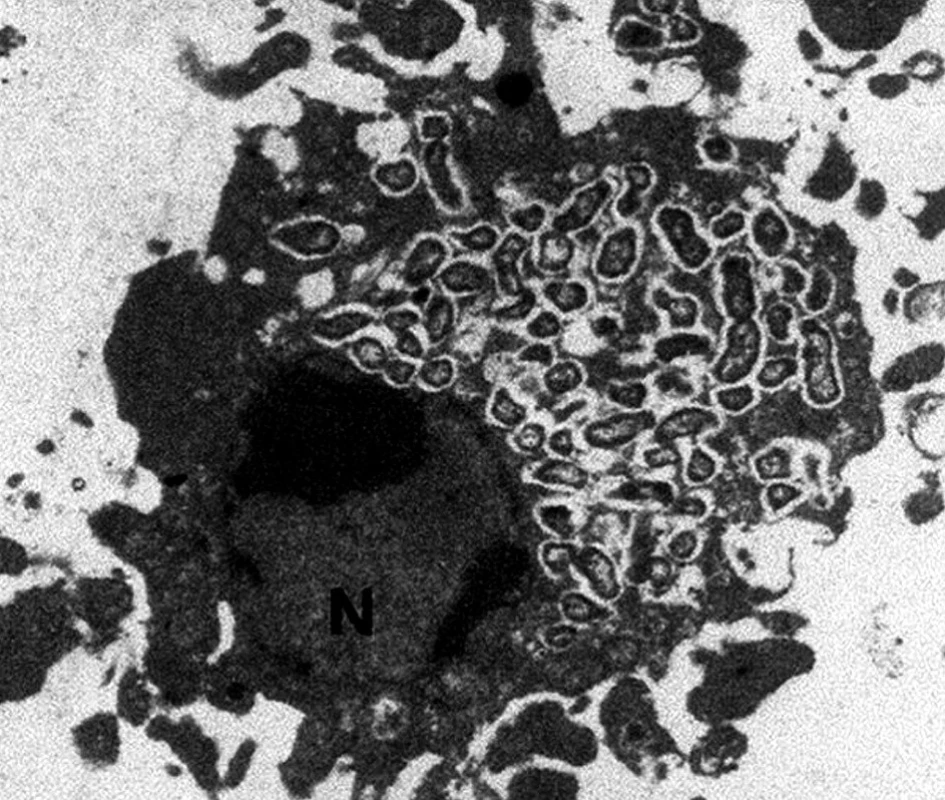
Francisella tularensis patří mezi bakterie s extrémně vysokou infekciozitou. Tato skutečnost vedla k zařazení bakterie mezi potencionální biologické zbraně [7].
Přírodním rezervoárem onemocnění jsou drobní hlodavci, od nichž se nákaza šíří na větší hlodavce a jiná volně žijící nebo domácí zvířata. Bakterie byla izolována z více než 250 zvířecích druhů. Kromě zajíce mohou nemoc přenášet králíci, bažanti, bobři, vysoká zvěř, někteří ptáci, obojživelníci, ryby, vzácněji kočky a psi. K přenosu na člověka dochází nejčastěji při manipulaci s infikovaným zvířetem. Některá zvířata infekci zvládají bez větších komplikací a slouží jako skutečný rezervoár infekce, u jiných, např. u myší a hrabošů, vyvolává Francisella tularensis akutní infekci, která může vést k úmrtí zvířete. Další cesty přenosu představují členovci sající krev, např. klíšťata a komáři (toto je například nejčastější způsob přenosu popisovaný ve Skandinávii [8]), pití kontaminované vody, konzumace kontaminovaného ovoce nebo inhalace kontaminovaného prachu či aerosolu. Byla popsána epidemie oroglandulární formy u důchodců, kteří pili tepelně neupravený jablečný mošt z padaných jablek. Zaznamenána je také nákaza inhalační cestou při sekání trávníku, ve kterém se pohybovala nakažená zvířata, nebo při práci se senem potřísněným výměšky infikovaných hlodavců. Dále jsou známé malé epidemie při sklizni cukrové řepy. Tento způsob přenosu infekce často vede k těžkým plicním formám. Vzácně může k nakažení dojít kousnutím nebo škrábnutím infikovaným zvířetem. Popisuje se také průnik bakterie nepoškozenou pokožkou. U čtvrtiny až poloviny pacientů není zdroj infekce odhalen. Přenos z člověka na člověka není znám, ale jsou popsány laboratorní nákazy. Přenos z matky na dítě dosud nebyl prokázán. Bakterie velice dobře odolává vnějším vlivům, při nízké teplotě může přežít v půdě, vodě nebo v těle mrtvých zvířat i několik týdnů, v případě zmrzlého masa zvířat se jedná až o roky [2, 3, 9–13].
Francisella tularensis se vyskytuje především na severní polokouli, onemocnění jsou hlášena z Evropy, Severní Ameriky, zemí bývalého Sovětského svazu, Blízkého východu, Japonska a Číny. První epidemie tularémie jsou ve světě dokumentovány ve 30. a 40. letech 20. století. Kromě České republiky proběhly v Evropě během posledních desetiletí epidemie na území několika států, například ve Finsku, Švédsku, Španělsku, Itálii, Kosovu a v Bulharsku [12, 14–17]. Ročně jsou v ČR zaznamenány desítky onemocnění (graf 1), v roce 2006 bylo hlášeno 87 případů. Od roku 1965, kdy bylo zahájeno sledování výskytu tularémie na našem území, byl zvýšený výskyt tularémie zaznamenán v letech 1967 (1021 případů), 1969 (279 případů) a v roce 1999 (225 případů), kdy byla evidována nejvyšší incidence v 90. letech. Nejčastěji onemocní lidé ve věkové skupině 45–54 let (graf 2) [18–20]. Pro srovnání, v celých Spojených státech amerických bylo v posledních třiceti letech dokumentováno méně než 200 případů ročně, v Japonsku a v Norsku je to kolem deseti onemocnění každý rok [21]. Naopak, poměrně vysoká incidence tularémie je ve Švédsku, kde při poslední epidemii v roce 2003 bylo hlášeno téměř 700 případů [22]. Rozdíly ve výskytu onemocnění mezi jednotlivými roky jsou zřejmě způsobeny variabilitou zvířecího rezervoáru; incidenci zvyšuje například přemnožení myšovitých hlodavců (tzv. myší roky) nebo záplavy.
1. Výskyt tularémie v ČR v absolutních počtech v letech 1993 až 2006 [18, 19]. ![Výskyt tularémie v ČR v absolutních počtech v letech 1993 až 2006 [18, 19].](https://pl-master.mdcdn.cz/media/image/37b82539ef07a976a95dca57c4acbb77.png?version=1537790198)
2. Výskyt tularémie v ČR podle věku v letech 1993 až 2006 [18, 19]. ![Výskyt tularémie v ČR podle věku v letech 1993 až 2006 [18, 19].](https://pl-master.mdcdn.cz/media/image/4adfb185d3f56f78d7ae4e93364953d1.png?version=1537790198)
Nejvíce případů na našem území bylo dosud zaznamenáno na jižní Moravě a v Polabí [21]. V české literatuře je dokumentováno několik lokálních epidemií [10, 20, 21, 23]. Při poslední významnější epidemii, která proběhla v zimě na přelomu let 2000 a 2001, onemocnělo 48 lidí; příčinou byla kontaminovaná voda z přírodního vrtu [9, 24]. Pro zajímavost uveďme, že v roce 2001 došlo k poměrně kuriózní situaci, když se nakazili tularémií čeští chovatelé psounů prériových (Cynomys ludovicianus), oblíbených domácích mazlíčků. K zavlečení infekce došlo díky dovozu stovky infikovaných mláďat z farmy ležící v americkém Texasu [25].
Sezonnost výskytu tularémie vykazuje dva vrcholy. Na jaře a v létě dochází k onemocnění spíše díky infikovaným klíšťatům, v podzimních měsících je vektorem častěji nemocné zvíře. Běžněji onemocní dospělí, pokud dojde k infekci u dětí, je to většinou v jarních a letních měsících nebo při epidemiích způsobených alimentární cestou. Onemocněním jsou postiženi více muži, a to díky profesní expozici [3].
Pokud se týká výskytu tularémie v dětském věku, bylo v české literatuře dosud popsáno přibližně 40 případů. Postiženi byli většinou chlapci, nejmladší pacienti byli čtyřletí [2]. Děti se většinou nakazily při kontaktu s domácími zvířaty, při stahování zajíce, přisátím klíštěte, při práci ve vlhkém skleníku, alimentární cestou atd. V některých případech byla cesta přenosu nejasná, případně se spekulovalo o infekci neporušenou kůží.
Nejčastější formy onemocnění v České republice jsou formy glandulární a ulceroglandulární, generalizované formy jsou velmi vzácné [21]. Také u popsaných dětských onemocnění se ve většině případů jednalo o glandulární, resp. ulcero - nebo oroglandulární formu, plicní forma onemocnění se manifestovala ojediněle u několika starších dětí, abdominální forma byla popsána jen u několika málo případů. Téměř vždy byla přítomna výrazná lymfadenopatie doprovázená vysokými horečkami, spolu s nespecifickými příznaky. U několika dětí došlo ke kolikvaci postižených uzlin [2, 3, 9, 10, 21, 24, 26]. Popsán byl případ oroglandulární formy tularémie spojený s kultivačním nálezem nokardií v kolikvované uzlině [26]. V zahraniční literatuře popisované případy onemocnění dětí se od případů v České republice zásadně neliší [13, 17, 27–31].
Klinický obraz
Průběh onemocnění bývá variabilní a závisí na virulenci bakterie, místě vstupu a stavu imunitního systému. Infekce může být zcela asymptomatická nebo může probíhat až pod obrazem těžké akutní sepse.
Inkubační doba je 3–10 dnů, za hraniční je považováno rozmezí 1–25 dní. Jsou však popisovány případy manifestace onemocnění i po více než třiceti dnech po infekci [2, 10]. Onemocnění dominují nespecifické příznaky, mezi které patří náhlý vzestup tělesné teploty, zimnice, nevolnost, nechutenství, únava, bolesti hlavy, dále kašel, myalgie, dechové obtíže, bolesti břicha, bolesti v krku, průjmy a sekundární kožní erupce, např. erythema multiforme, erythema nodosum, nebo generalizovaný makulopapulózní exantém [1, 2].
Podle brány vstupu infekčního agens rozlišujeme sedm klasických forem klinického obrazu, a to formu ulceroglandulární, glandulární, oroglandulární (orofaryngeální, faryngeální, anginózní), okuloglandulární, plicní (pneumonickou), střevní (abdominální) a tyfoidní. Rozdělení je však spíše orientační, jednotlivé formy se mohou překrývat nebo v sebe navzájem přecházet [1, 2].
Nejčastějším typem klinického obrazu je ulceroglandulární forma (75–90 % pacientů), kdy je branou vstupu oděrka na kůži. V místě poranění se nejprve utváří papulka, která se později mění ve svědivou pustulku, ta následně praská a objevuje se špatně se hojící vřídek.
Při přenosu od savců, např. při manipulaci s infikovaným masem, je afekce většinou na horních končetinách, v případě, že je vektorem klíště nebo jiný členovec, je místo postižení spíše na končetinách dolních. Po lokálním vstupu infekce kůží následuje zduření regionálních uzlin, tj. epitrochanterických, axilárních, popliteálních či inguinálních, později však může dojít i k systémové lymfadenopatii. Při průniku bakterie nepoškozenou pokožkou, kdy se objevuje horečka a regionální lymfadenopatie bez zjevného narušení kůže, hovoříme o glandulární formě (5–10 % pacientů).
Oroglandulární forma (až 20 % pacientů) je způsobena požitím syrových infikovaných pokrmů, kontaminované tekutiny nebo zanesením infekce do úst rukama či kapénkovou infekcí. Projevuje se jako jednostranná tonzilitida s lokalizovaným vředem, faryngitida nebo stomatitida doprovázené lymfadenopatií podčelistních a krčních uzlin; nebezpečí představuje možný vznik retrofaryngeálního abscesu. Lokální příznaky bývají spojeny s bolestí břicha, nauzeou, zvracením, průjmem, případně vzácněji krvácením do gastrointestinálního traktu. V případě epidemií je tato forma vídána nejčastěji.
Po vzácném průniku infekce sliznicí oční spojivky (kapénkovou infekcí, autoinokulací, při práci s infikovaným masem) následuje okuloglandulární forma tularémie (1–2 % pacientů). Manifestuje se unilaterální konjunktivitidou, světloplachostí, zvýšeným slzením, periorbitálním edémem a zduřením preaurikulárních a krčních uzlin; v nepříznivých případech dochází k ulceraci rohovky.
Těžkou bakteriální pneumonii, tuberkulózu, mykotickou infekci plic či malignitu může připomínat průběh plicní formy onemocnění vyvolané inhalací kontaminovaného prachu či aerosolu; v případě sekundární pneumonie je příčinou hematogenní rozsev z místa primární infekce. Pacienti si stěžují na kašel, bolest na hrudi, pleuritickou bolest a dušnost. V rentgenovém obraze plic bývá přítomna peribronchitida nebo pneumonie a výrazná hilová lymfadenopatie někdy doprovázená pleurálním výpotkem. Vzácně může dojít k rozvoji akutního respiračního selhání a následně k úmrtí. Pacienty s tularemickou pneumonií není třeba izolovat.
Další formou tularémie je forma střevní projevující se jako horečnaté průjmové onemocnění připomínající dyzentérii, které bývá doprovázeno výraznější ztrátou hmotnosti, splenomegalií a mezenteriální lymfadenopatií.
Jako tyfoidní forma tularémie je označováno horečnaté onemocnění s nespecifickými chřipkovými příznaky, bez lokálního nálezu a s neurčenou vstupní bránou infekce.
Nejzávažnějším, ale naštěstí poměrně vzácným stavem spojeným s infekcí bakterií Francisella tularensis je generalizace infekce, která může nastat při jakékoli z výše uvedených forem. Hovoříme o tzv. septické formě manifestující se v extrémním případě diseminovanou intravaskulární koagulopatií a multiorgánovým selháním.
Relativně častou komplikací tularémie je kolikvace infikovaných lymfatických uzlin, provalení obsahu uzliny na povrch kůže a vznik píštěle, která se velice špatně hojí nehezkou vtaženou jizvou. Naopak velmi vzácně dochází (především v endemických oblastech) k rozvoji meningitidy, encefalitidy, endokarditidy, perikarditidy, tromboflebitidy, apendicitidy, peritonitidy nebo osteomyelitidy. U dětí je průběh podobný jako u dospělých, nespecifické celkové příznaky však bývají výraznější, např. velmi vysoké horečky, a častěji se u nich manifestuje faryngitida a hepatosplenomegalie. I při adekvátní a včasné terapii ustupuje lymfadenopatie pomalu (může přetrvávat až 3 roky) [1, 3, 10, 11, 26, 32].
Smrtnost neléčeného onemocnění je u typu A 8 % (rozsah 1–15 %), 4 % u ulceroglandulární formy, 30–50 % u formy plicní, abdominální nebo septické. Při adekvátní terapii je počet úmrtí velmi nízký, udává se méně než 1 %. Infekce typem B je zřídka fatální [11, 33]. V České republice nebylo úmrtí na tularémii dosud zaznamenáno.
Diagnóza
Stanovení diagnózy pouze z klinických příznaků je u sporadických případů obtížné, a to především pro nespecifičnost počátečních obtíží. Diferenciální diagnostika je široká (tab. 1). Průměrná doba od manifestace prvních příznaků k určení diagnózy je 3–4 týdny [21].
1. Diferenciální diagnostika různých forem tularémie [1, 34, 35]. ![Diferenciální diagnostika různých forem tularémie [1, 34, 35].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b81ccf950745835ebfb21c34cb137091.png)
Kromě klinického stavu pacienta a pozitivní nebo suspektní epidemiologické anamnézy jsou zásadní laboratorní vyšetření, z nichž je na prvním místě sérologické stanovení protilátek proti bakterii Francisella tularensis. Nejběžněji je používán nepřímý průkaz, a to zkumavkovou aglutinací. Nevýhodou této metody je pomalý nástup detekovatelných aglutininů. Protilátky se objevují až koncem 2. týdne choroby, k jejich nárůstu dochází za 4–5 týdnů od okamžiku nákazy. To znamená, že při prvních známkách manifestace choroby bývají sérologické výsledky negativní a je tedy nutno vyšetření opakovat po 2–3 týdnech. Pro zkřížené reakce např. s brucelami nemusí být nízké titry aglutinačních protilátek průkazné. Za diagnostický, tzn. svědčící pro čerstvou infekci, se považuje čtyřnásobný vzestup titru během choroby, popř. jediný titr 1 : 160 a více. Protilátky stanovované metodou ELISA (Enzyme-Linked ImmunoSorbent Assay) jsou prokazatelné dříve než protilátky aglutinační, lze zde rozlišit i jednotlivé třídy protilátek – IgM, IgA, IgG, ale vzhledem k tomu, že požadavky na sérologický průkaz tularémie nebývají příliš časté, je použití této metody pro rutinní mikrobiologickou laboratoř ekonomicky nevýhodné a je prováděno pouze specializovanými laboratořemi [24, 34, 35].
Přímý průkaz antigenuFrancisella tularensis je možné provést ze vzorku moči. V České republice se však v současnosti toto vyšetření neprovádí.
Kultivace bakterie z materiálu odebraného z postiženého místa, tj. kožního vřídku, kolikvované uzliny, stěru z tonzil, sputa, pleurální tekutiny nebo krve, se nyní běžně neprovádí. Kultivace je technicky náročná a zdlouhavá a takto stanovená diagnóza je značně pozdní. Další překážkou je vysoká virulence bakterie a nebezpečí infikování laboratorního personálu. Kultivace se tedy provádí jen ve specializovaných laboratořích, a to v případech, kdy je nutno stanovit citlivost bakterie na jednotlivá antibiotika, například při rozsáhlých epidemiích [10, 36].
Probatorní punkce kolikvované uzliny není vhodná, a to pro obtížné hojení rány po výkonu. Pokud je indikován chirurgický výkon, je třeba přistoupit k exstirpaci [2].
V histologickém obraze exstirpovaných uzlin je zřejmý granulomatózní proces z epiteloidních buněk, přítomny bývají obrovské buňky Langhansova typu s následnou kolikvací až nekrózou postižených tkání. Histologické vyšetření není specifické a většinou významně nepřispěje ke stanovení diagnózy. Provádí se k vyloučení mykobakteriózy či lymfoproliferace [3, 24]. Odebraný materiál lze vyšetřit také imunohistochemicky a pokusit se tak o přímý důkaz přítomnosti bakterie.
Vyšetřením s relativně vysokou senzitivitou i specificitou je detekce části DNA bakterie pomocí metody PCR (Polymerase Chain Reaction). Tento způsob potvrzení přítomnosti patogenu má nespornou výhodu v tom, že je poměrně rychlý, nevyžaduje velké množství materiálu a je proveditelný i v případě, kdy byl pacient přeléčen antibiotiky a kultivace by byla nemožná. Vyšší záchyt je v případě použití materiálu přímo z tkáně než ze séra. Toto vyšetření se za účelem diagnostiky v České republice rutinně neprovádí. Pro účely výzkumu, resp. detekce onemocnění u zvířat, je PCR Francisella tularensis prováděno v Ústředním vojenském zdravotním ústavu v Praze, na pracovišti v Těchoníně (tel. 973 273 507), ve Státním ústavu jaderné, chemické a biologické ochrany Příbram – Kamenná (tel. 318 600 200), ve Výzkumném ústavu veterinárního lékařství Brno (tel. 533 331 111) a ve Státním veterinárním ústavu v Praze – Suchdole (tel. 251 031 111) [5, 36, 37].
Imunitní reakce organismu na infekci Francisella tularensis je komplexní, nejdůležitější roli v eliminace bakterie hraje buněčná imunita. Pro diagnostické účely se však vyšetření této složky imunitního systému z technických důvodů využívá pouze okrajově. Příkladem vyšetření, které může být částečně diagnosticky přínosné, je detekce T lymfocytůnesoucích takzvaný γ/δ receptor. V těchto lymfocytech neprobíhá klasická rekombinace imunoglobulinových genů kódující povrchový T receptor, jejich variabilita je tak mnohem menší a jsou řazeny na pomezí vrozené a získané imunity. U infikovaných jedinců dochází k signifikantnímu vzestupu jejich počtu, receptory jsou v tomto případě namířeny proti fosforylovaným nepeptidickým ligandům na povrchu mikrobů, zřejmě alkylaminům. Počet těchto lymfocytů překračuje v rozmezí 8–40 dnů desetiprocentní hranici (normální počet je do 5 % ze všech lymfocytů); zvýšení může přetrvávat i více než rok po infekci. Podobnou odpověď imunitního systému je možno vidět například u tuberkulózy, toxoplazmózy, malárie, viscerální leishmanie nebo histoplazmózy [38].
Pro úplnost zmiňme dnes již historické testy, mezi které počítáme kožní test [23] a test in vitro stimulace lymfocytů tularemickými antigeny [39].
Léčba
Tularémie v našich podmínkách, tj. za předpokladu infekce euroasijským sérovarem holartica (typ B), a při dostatečné imunokompetenci pacienta, není onemocněním ohrožujícím život. Při správně stanovené diagnóze a po včas nasazené adekvátní antibiotické léčbě je úspěšnost vyléčení ad integrum velmi vysoká. Latence onemocnění se nevyskytuje, většinou dochází ke kompletní eradikaci mikroorganismu. Reinfekce jsou dokumentovány jen výjimečně [40].
Léčebná schémata uváděná v literatuře se liší. V českém prostředí je většinou volena terapie poměrně intenzivní, založená na delším podávání antibiotik a častější nutnosti hospitalizace. Zahraniční doporučené postupy – jako příklad uveďme nejnovější doporučení zpracované v roce 2003 komisí Evropské unie zabývající se biologickými a chemickými zbraněmi (BICHAT, European Commission’s Task Force on Biological and Chemical Agent Threats) – pro změnu nediferencují přístup podle formy onemocnění a klinického stavu pacienta [11]. Optimální, i když dosud v široké odborné veřejnosti dostatečně nediskutovaný přístup představuje léčebný protokol navržený Benešem (tab. 2) [41].
2. Doporučená terapie tularémie u dětí a dospělých podle formy a stadia nemoci (adaptováno se svolením autora [41]). ![Doporučená terapie tularémie u dětí a dospělých podle formy a stadia nemoci (adaptováno se svolením autora [41]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/02172865cbad675ee398d5eec9a7654e.png)
ATB – antibiotika, AZI – Azitromycin, CIP – Ciprofloxacin, DOX – Doxycyklin, GEN – Gentamicin * U dětí do 18 let není podávání fluorochinolonů obecně doporučováno, jejich toxicita však nebyla prokázána. Za léky první volby jsou tradičně považována aminoglykosidová antibiotika. Nejpoužívanější je gentamycin; dříve byl doporučován také spiramycin, na který však vznikla rezistence a nyní je zcela mimo hru; nejúčinnějším preparátem z této skupiny, který je rezervován pro těžké infekce (např. tularemickou meningitidu), je streptomycin [3]. Léčba aminoglykosidy by měla probíhat minimálně 10–14 dní, jejich nevýhodou je nutnost intravenózního podání, potřeba průběžné monitorace sérové hladiny a v neposlední řadě ototoxicita [10, 29]. Při těžkých stavech jsou aminoglykosidy kombinovány s tetracykliny. V monoterapii je použití tetracyklinových antibiotik možné pouze při aplikaci vysokých dávek (někteří autoři doporučují až dvojnásobné proti standardním) a prodlouženém podávání (nejlépe 21 dní). Jsou kontraindikovány u dětí mladších osmi let [10].
Méně toxickou a podle všech informací efektivní léčebnou alternativou je použití chinolonů. Patří k velice perspektivním lékům pro výborný průnik do tkání a buněk, baktericidní efekt, nízkou minimální inhibiční koncentraci in vitro (nejnižší je u ciprofloxacinu) odrážející se ve výborném klinickém efektu [27, 42, 43]; jejich selhání bylo dokumentováno pouze v případě pozdního nasazení léčby [33]. Jejich další výhodou je možnost perorální aplikace, a tedy ambulantní péče a relativně nízká cena. Tyto přednosti vedou některé autory k přesvědčení, že chinolony jsou optimální léčebnou variantou a prosazují je jako lék první volby u nekomplikovaného průběhu tularémie [12, 27, 32, 33, 44]. Terapie musí trvat minimálně 14 dní, v těžších případech je možno je podávat v kombinaci s aminoglykosidy. Výsledky jednotlivých nekontrolovaných studií jsou slibné a bez vedlejších nežádoucích účinků, a to i v případě použití v dětském věku [8, 13, 27]. Nedostatek spolehlivých dat hodnotících riziko podání chinolonů u dětí však nutí k opatrnosti, především při použití těchto preparátů ve velmi raném věku [13, 27, 45].
Další terapeutickou možností je aplikace azitromycinu, jehož velkou předností je dobrý průnik do tkání, příznivá farmakokinetika, nízká toxicita a tedy bezproblémová možnost podání u dětí. S azalidy spřízněná skupina antibiotik, makrolidy, není pro svou nízkou spolehlivost doporučována, stejně jako dříve používaný chloramfenikol. Beta-laktamová antibiotika jsou považována za zcela neúčinná. V rámci post-expoziční profylaxe (při kapénkové či alimentární expozici) se doporučuje podávat doxycyklin nebo ciprofloxacin, samostatně nebo v kombinaci, a to nejméně 14 dní [1]. Kombinované podání těchto perorálních preparátů by mělo být uplatněno také v případě velkých epidemií, kdy není možná hospitalizace postižených [33].
Obávanou a při pozdní diagnóze či nesprávné volbě antibiotik velice častou komplikací je kolikvace postižených uzlin vyžadující urychlenou chirurgickou léčbu [10, 23, 24]. Pro ilustraci uveďme, že na Klinice dětské ORL v Praze-Motole bylo v období od roku 1980 do roku 1994 operováno 12 dětí pro zvětšené uzliny na krku, kdy bylo histologické podezření na tularémii potvrzeno také sérologicky; za devítileté období (1998–2006) bylo na téže klinice operováno 5 dětí s oroglandulární či ulceroglandulární formou tularémie, přičemž spádové území nemůže být přesně vymezeno. Některé z nich byly odeslány k dořešení s prvotním podezřením na nádorové onemocnění, některé po pokusu o probatorní exstirpaci. Všechny děti byly léčeny ve spolupráci s infekčními odděleními (FN v Motole a FN Na Bulovce). Přesnější data jsou k dispozici u druhého jmenovaného souboru – děti byly ve věku 11 měsíců (níže popisovaný pacient) a 3, 7, 10 a 12 let (2 chlapci a 3 děvčata), u dvou byla provedena exstirpace celých paketů uzlin, u tří exstirpace parciální se současnou exkochleací dutiny v projizvené tkáni. K recidivě obtíží a vzniku chronických píštělí nedošlo; výsledné jizvení nezpůsobilo žádné významnější zatuhnutí, tortikolis či deformitu.
Je-li možné odstranění všech zjevně postižených uzlin, lze očekávat poměrně rychlé zhojení a tento způsob ošetření by měl být preferován. U parciálních výkonů je nutno pečlivě odstranit nekrotickou tkáň rozpadové dutiny, děti zajistit antibiotickým krytím do uzavření incize na krku a dlouhodobě sledovat.
V současnosti existuje možnost očkování proti tularémii živou atenuovanou vakcínou odvozenou od méně virulentního sérovaru holartica (typ B). Vakcína však není licencována, což znamená nemožnost použití pro širokou veřejnost. Očkování se provádí skarifikací, a to jen u vybraného laboratorního personálu nebo vojáků v případě epidemie nebo event. napadení biologickou zbraní. Vakcína má chránit proti ulceroglandulární a plicní formě tularémie, její účinnost je však sporná, navíc je vakcína velmi reaktogenní. Podání se zásadně nedoporučuje při post-expoziční profylaxi. Na vývoji jiných vakcín se intenzivně pracuje [12].
Kazuistika
U jedenáctiměsíčního chlapce se dne 13. 5. 2006 objevily febrilní teploty doprovázené mírným kašlem, současně u ostatních členů rodiny probíhal virový infekt. Chlapec byl opakovaně vyšetřován u praktického pediatra, zánětlivé parametry byly nízké, na nativním rentgenovém snímku plic byl popsán normální nález. Antibiotická perorální terapie (Augmentin) byla zahájena 15. 5., jednorázově byl aplikován Rectodelt. Pro přetrvávající febrilie nejasné etiologie odeslal ošetřující lékař dítě 17. května k hospitalizaci na dětské oddělení spádové nemocnice.
Perinatální anamnéza byla bez komplikací, chlapec prospíval, v předchorobí nestonal. Matka trpí hypertyreózou (stejně tak její matka), rodinná anamnéza je jinak bez pozoruhodností.
První hospitalizace
(Dětské oddělení okresní nemocnice)
Chlapec byl febrilní, po antipyreticích byl zaznamenán vždy jen dočasný pokles teploty, přechodně se objevil mírný exantém a průjmovitá stolice, jiné klinické obtíže neměl. Zánětlivé parametry byly na počátku hospitalizace v normě, později vzrostly. Postupně byly vyloučeny infekční fokusy v oblasti ORL, močového a respiračního traktu; hemokultura byla opakovaně negativní, sérologické vyšetření rovněž nevedlo ke stanovení diagnózy (testováno EBV, CMV, HSV, HHV6, Aspergillus spp., Candida spp., leptospiry, respirační viry, borelie), mozkomíšní mok byl bez abnormalit, v neurologickém vyšetření popsán normální EEG nález.
Chlapec byl zajištěn intravenózním penicilinem a herpesinem, intenzita febrilních špiček (s maximem 40 °C) se však nesnižovala. Opakovaně bylo provedeno ultrazvukové (UZ) vyšetření břicha, při posledním byla zjištěna výrazná mezenteriální lymfadenitida (uzliny velikosti až 17 mm), ztluštění stěny terminálního ilea v posledních 4–5 cm na 6–7 mm a v dutině břišní malé množství volné tekutiny. Došlo k mírnému vzestupu jaterních enzymů. Herpesin i penicilin byly po pěti dnech vysazeny. V denním odstupu (23. 5. a 24. 5.) byly podány dvě vysoké dávky intravenózních imunoglobulinů (IVIG, 2 g/kg/den). Následovalo několik epizod prošednutí a tachykardie. Chlapec byl stále intermitentně febrilní. Pro nejasnost etiologie potíží byl 25. 5. přeložen k dalšímu vyšetření na Pediatrickou kliniku motolské nemocnice.
Druhá hospitalizace
(Pediatrická klinika UK 2. LF a FN Motol)
Při přijetí byl chlapec febrilní, v krevním obraze byla leukocytóza (16,5 x 109/l) s převahou neutrofilů (47 %) a monocytózou (12 %), anémií (hemoglobin 89 g/l), trombocytózou (493 x 109/l), v koagulacích mírně prodloužený čas podle Quicka (INR 1,22), snížená hladina antitrombinu III (73 %), více D-dimerů (500–1000 ng/ml), byl pozitivní etanolový test, CRP 55 mg/l, sedimentace erytrocytů (FW) 120 mm/hod, v biochemii hraniční ALT (1,02 ∝kat/l). Fyzikální nález byl bez pozoruhodností.
V průběhu hospitalizace byly zachyceny hraničně pozitivní autoprotilátky proti kardiolipinu, extrahovatelným jaderným antigenům (ENA), endotelu (AECA), výrazněji zvýšené pak byly proti tyreoperoxidáze (TPO, 303 kU/l, norma do 60), ostatní laboratorní nálezy včetně buněčné imunity byly v normě. Zopakovali jsme extenzivní sérologii, kde byla zřejmá pozitivita většiny vyšetřovaných agens ve třídě IgG a slabá pozitivita aglutinačních protilátek proti tularémii v titru 1 : 80. Mikrobiologická kultivační vyšetření i vyšetření na parazity byla negativní.
Ultrazvukové vyšetření břicha potvrdilo předchozí nález mezenteriální lymfadenitidy a ztluštění terminálního ilea. Byla zahájena léčba dvojkombinací antibiotik – metronidazol s co-trimoxazolem v běžném dávkování. Vzhledem k pozitivitě některých autoprotilátek a sonografickému nálezu v břišní dutině bylo vysloveno podezření na autoimunitně podmíněný střevní zánět a ve dnech 25. 5. a 26. 5. byly intravenózně aplikovány 2 dávky Solu-medrolu (2 x 250 mg). Po infuzích teploty ustoupily. Podle kontrolního UZ břicha jsme zjistili regresi zánětlivé infiltrace, tloušťka střevní stěny se normalizovala, došlo také ke zmenšení mezenteriálních lymfatických uzlin (do 10 mm), CRP po přechodném vzestupu v průběhu hospitalizace kleslo k normálním hodnotám, FW zůstávala mírně zvýšena (40 mm/hod), krevní obraz se postupně normalizoval. Průběh hospitalizace se zkomplikoval rotavirovou gastroenteritidou. Do domácího ošetřování byl chlapec propuštěn 5. června v dobrém klinickém stavu, afebrilní, pouze na symptomatické terapii.
Za 14 dní po propuštění byla při ambulantní kontrole zjištěna zvětšená a palpačně mírně citlivá submandibulární lymfatická uzlina vpravo (cca 2 x 2 cm), kůže byla proti povrchu uzliny pohyblivá, kůže bez zarudnutí, chlapec zůstával afebrilní, čilý, zdánlivě zcela v pořádku. Byly provedeny sérologické odběry. V následujícím týdnu došlo k progresi velikosti uzliny (vel. cca 2 x 4 cm), ultrazvukové vyšetření ukázalo incipientní kolikvaci (obr. 2). V té době již byly k dispozici výsledky sérologických vyšetření, kde byl patrný čtyřnásobný vzestup titru aglutinačních protilátek proti bakterii Francisella tularensis (v titru 1 : 320), hladiny protilátek ve třídě IgG proti ostatním agens měly podle očekávání klesající tendenci.
2. Ultrazvukové vyšetření před chirurgickým zákrokem. Krční lymfadenitida, paket lymfatických uzlin, podélně cca 40 mm, s anechogenním kulovitým podílem v průměru 19 mm (kolikvace). Fig. 2. Sonographic investigation before surgical intervention. Neck lymphadenitis, group of lymphnodes, 40 mm in length, with anechogenic spherical structure 19 mm in diameter (suppuration). 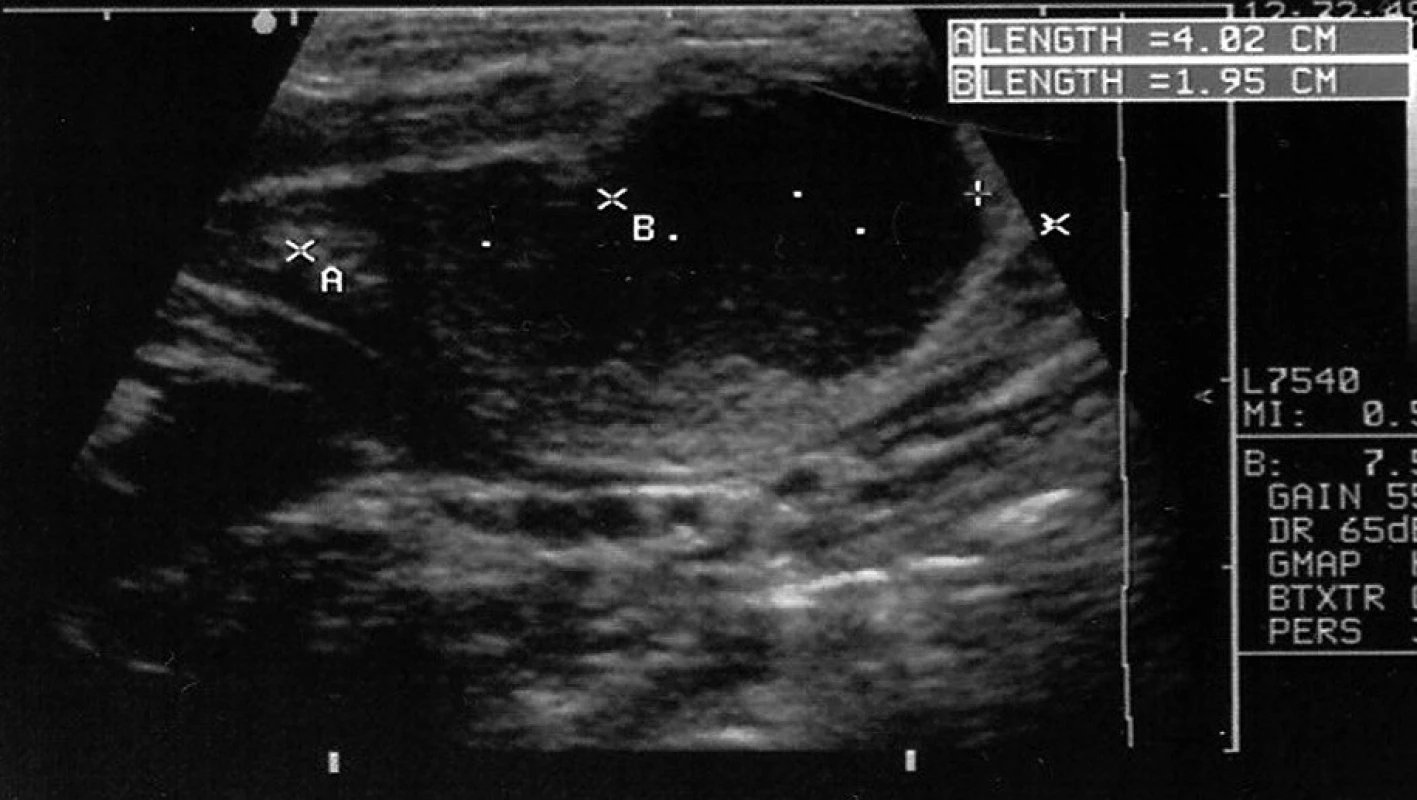
Třetí hospitalizace
(Klinika ušní, nosní a krční UK 2. LF a FN Motol)
Po zhodnocení vyšetření byl chlapec předán na ORL kliniku k operačnímu zákroku. Kolikvovaná uzlina byla dne 30. 6. spolu s paketem sousední lymfatické tkáně exstirpována. Zákrok byl velmi náročný, což bylo způsobeno rozšířením zánětu kolem lymfatické uzliny s výraznou reakcí v měkkých tkáních celého okolí a vytvořením paketu uzlin přijizveného zespoda ke kývači, m. platysma a podkoží. Orientace v operačním poli a vlastní exstirpace byly tak značně ztíženy. Opatrnost byla nutná především při uvolňování velkých krčních cév. Rána se zhojila per primam, v místě exstirpace zůstala po několika měsících po operaci klidná jizva, podkoží bylo tužší a nebolestivé. Operace byla provedena pod antibiotickým krytím gentamycinem (5 mg i.v./kg/den, celkem 14 dní), poté následovala zajišťovací třídenní kúra azithromycinem (8 mg/kg/den).
Kolikvovaný obsah uzliny byl odeslán k detekci bakterie Francisella tularensis pomocí metody PCR do laboratoře Ústředního vojenského zdravotního ústavu v Těchoníně. Vyšetření jednoznačně potvrdilo infekci tímto agens.
Následné sledování
Dva měsíce po propuštění z kliniky ORL byla zřejmá klesající tendence titru aglutinačních protilátek proti bakterii Francisella tularensis (slabě pozitivní v titru 1 : 80), klesl i titr anti-TPO protilátek (92 kU/l). Bylo zachyceno vyšší procento γ/δpozitivních T-lymfocytů (16 % ze všech lymfocytů), ultrazvukové vyšetření submandibulárních i krčních uzlin, stejně tak štítné žlázy bylo v normě.
Onemocnění je tedy hodnoceno jako kombinovaná oroglandulární a abdominální forma tularémie. Zpětně zjišťujeme, že se chlapec nakazil nejspíše při pobytu ve staré chalupě u Hlinska, kde byl týden před manifestací onemocnění v kontaktu s prachem obsahujícím výměšky drobných hlodavců.
Komentář ke kazuistice
Na příkladu našeho pacienta můžeme vidět důležitost epidemiologické anamnézy. Možnost infekce při styku s kontaminovaným prachem na staré chalupě zpočátku zcela unikla naší pozornosti. Průběh onemocnění byl typický pro alimentární cestu infekce. Diagnostika byla ztížena podáním intravenózních imunoglobulinů, které následně ovlivnilo sérologická vyšetření. V době, kdy byl zachycen stoupající titr aglutinačních protilátek, byla infekce již s velkou pravděpodobností překonána a zjištěná kolikvace submandibulární lymfatické uzliny byla pozdním následkem proběhlého onemocnění. Jednalo se pravděpodobně o infekci méně virulentním a v Česku častějším sérovarem typu B.
K prvotnímu zlepšení stavu došlo nejspíše spontánně, jelikož ani jedno z prvotně podávaných antibiotik (beta-laktamy, sulfonamidy, imidazoly) není v případě tularémie účinné. Pokračování infekce lokálně by však probíhalo dlouhodobě, pravděpodobně by bez exstirpace došlo k perforaci a nepříznivému průběhu hojení s rozsáhlým jizvením, a to i přes podávání adekvátních antibiotik. Prospěšnost vysokých dávek intravenózních imunoglobulinů a bolusu steroidů je sporná. Antibiotické krytí gentamycinem v průběhu chirurgického výkonu bylo plně na místě. Otevřena diskusi zůstává délka jeho podávání, která zřejmě mohla být vzhledem k velice dobrému klinickému stavu chlapce kratší, a event. možnost použití chinolonů, jak je navrhují někteří autoři [27]. Detekce bakteriálního genomu Francisella tularensis metodou PCR nemělo vliv na další terapeutický postup, přispělo však k potvrzení proběhlé infekce a správnosti zvoleného přístupu a umožnilo nám po úspěšném odstranění ložiska na krku s jistotou vyslovit příznivou prognózu.
Závěr
Před rokem 1994 byla až na výjimky tularémie na našem území poměrně vzácná a na onemocnění se přestalo myslet [10]. Nyní je nutno tularémii řadit mezi relativně běžnější příčiny horečnatých stavů a lymfadenopatií, a to i v dětském věku. Při rozhovoru s rodiči je třeba věnovat náležitou pozornost epidemiologické anamnéze a zvláště možnému kontaktu se zvířaty a jejich výměšky. To se týká i domácích a exotických zvířat chovaných v zajetí.
Díky větší mobilitě obyvatelstva a častějšímu zahraničnímu cestování i v raném dětství je také nutné myslet na možnost importu z endemických oblastí.
Při nejednoznačném výsledku sérologického vyšetření je na místě zvážit diagnostiku metodou PCR a cílenou antibiotickou léčbou se snažit zabránit kolikvaci postižených uzlin. Základní přehled o tomto onemocnění je nutný také vzhledem k hypotetickému, ale přesto reálnému, zneužití bakterie Francisella tularensis teroristy.
Poděkování
Autoři děkují Mgr. Daniele Rožkové, PhD., prof. MUDr. Anně Šedivé, CSc., a prof. MUDr. Jiřině Bartůňkové, DrSc., MBA, za podnětné připomínky.
Práce byla podpořena VZ FNM 64203 MZ ČR, VZ 21620812 MŠMT ČR.
Došlo: 28. 8. 2007
Přijato: 1. 1. 2008
MUDr. Aleš Janda, MSc.
Ústav imunologie UK 2. LF
FN Motol
V Úvalu 84
150 06 Praha 5-Motol
e-mail: ales.janda@lfmotol.cuni.cz
Sources
1. Migala FA. Tularemia [online]. 2006, poslední revize 16. 5. 2006 [cit. 2007-03-17]. Dostupné z: <http://www. emedicine.com/ped/topic2327.htm>
2. Pellantová V. Příspěvek k diagnostice a léčbě tularémie. Čes.-slov. Pediat. 2000; 55(3): 173–175.
3. Křepela K, Pohl J, Augustinová A, et al. Tularémie – jedna z méně obvyklých příčin uzlinového syndromu a plicního postižení v dětském věku. Čes.-slov. Pediat. 1999;54(9): 463–469.
4. Forsman M, Sandstrom G, Jaurin B. Identification of Francisella species and discrimination of type A and type B strains of F. tularensis by 16S rRNA analysis. Appl. Environ. Microbiol. 1990; 56(4): 949–955.
5. Johansson A, Ibrahim A, Goransson I, et al. Evaluation of PCR-based methods for discrimination of Francisella species and subspecies and development of a specific PCR that distinguishes the two major subspecies of Francisella tularensis. J. Clin. Microbiol. 2000;38(11): 4180–4185.
6. Hornick R. Tularemia revisited. N. Engl. J. Med. 2001;345(22): 1637–1639.
7. Health Aspects of Chemical and Biological Weapons. Geneva: World Health Organization, 1970 : 105–107.
8. Karhukorpi EK, Karhukorpi J. Rapid laboratory diagnosis of ulceroglandular tularemia with polymerase chain reaction. Scand. J. Infect. Dis. 2001;33(5): 383–385.
9. Pazdiora P, Moravkova I, Nocarova D, et al. A water-borne epidemic of tularemia in Chlumcany. Epidemiol. Mikrobiol. Imunol. 2002;51(1): 23–25.
10. Černý Z. Tularemie na jižní Moravě opět aktivnější. Klin. Mikrobiol. Inf. Lék. 2000;3 : 66–72.
11. Bossi P, Tegnell A, Baka A, et al. Bichat guidelines for the clinical management of tularaemia and bioterrorism-related tularaemia. Euro Surveill. 2004;9(12): E9–10.
12. Oyston PC, Sjostedt A, Titball RW. Tularaemia: bioterrorism defence renews interest in Francisella tularensis. Nat. Rev. Microbiol. 2004;2(12): 967–978.
13. Arav-Boger R. Cat-bite tularemia in a seventeen-year-old girl treated with ciprofloxacin. Pediatr. Infect. Dis. J. 2000;19(6): 583–584.
14. Reintjes R, Dedushaj I, Gjini A, et al. Tularemia outbreak investigation in Kosovo: case control and environmental studies. Emerg. Infect. Dis. 2002;8(1): 69–73.
15. Eliasson H, Lindback J, Nuorti JP, et al. The 2000 tularemia outbreak: a case-control study of risk factors in disease-endemic and emergent areas, Sweden. Emerg. Infect. Dis. 2002;8(9): 956–960.
16. Christova I, Velinov T, Kantardjiev T, et al. Tularaemia outbreak in Bulgaria. Scand. J. Infect. Dis. 2004;36(11–12): 785–789.
17. Mignani E, Palmieri F, Fontana M, et al. Italian epidemic of waterborne tularaemia. Lancet 1988;2(8625): 1423.
18. Beneš Č. Výskyt vybraných hlášených infekcí v České republice v letech 1996–2005 [online]. 2006, poslední revize 3. 1. 2006 [cit. 2006-17. 12.]. Dostupné z: <http://www.szu.cz/cem/epidat/epiabs-95-05.htm>
19. Beneš Č. Výskyt vybraných hlášených infekcí v České republice v letech 1996–2005 (nemocnost) [online]. 2006, poslední revize 3. 1. 2006 [cit. 2006-17. 12.]. Dostupné z: <http://www.szu.cz/cem/epidat/epirel-95-05.htm>
20. Ludvíková M, Beneš Č, Petráš P. Výskyt tularemie v České republice v roce 1998. Zprávy CEM 1999;8(3): 89–95.
21. Lobovská A, Havlíčková I, Aster V. Tularemie – stále aktuální zoonóza. Klin. Mikrobiol. Inf. Lék. 2000;3 : 73–76.
22. Payne L, Arneborn M, Tegnell A, et al. Endemic tularemia, Sweden, 2003. Emerg. Infect. Dis. 2005;11(9): 1440–1442.
23. Brejchová H, Táborská J, Špindlerová A. Zvýšený výskyt tularemie v západočeském regionu. Prakt. Lék. 2000;80(6): 322–325.
24. Virtová S, Táborská J, Kydlíčková J, et al. Epidemie tularemie v západočeském regionu: klinický obraz nemoci. Prakt. Lék. 2002;82(3): 130–133.
25. Avashia SB, Petersen JM, Lindley CM, et al. First reported prairie dog-to-human tularemia transmission, Texas, 2002. Emerg. Infect. Dis. 2004;10(3): 483–486.
26. Vágnerová I, Mikušková E, Kohnová I, et al. Kazuistika oroglandulární formy tularémie s překvapivým kultivačním záchytem Nokardií ve zkolikvované uzlině. Pediatrie pro Praxi 2005;(2): 95–97.
27. Johansson A, Berglund L, Gothefors L, et al. Ciprofloxacin for treatment of tularemia in children. Pediatr. Infect. Dis. J. 2000;19(5): 449–453.
28. Fisher RG. Index of suspicion. Case 2. Diagnosis: ulceroglandular tularemia. Pediatr. Rev. 1996;17(6): 221–223.
29. Cross JT, Jr., Schutze GE, Jacobs RF. Treatment of tularemia with gentamicin in pediatric patients. Pediatr. Infect. Dis. J. 1995;14(2): 151–152.
30. Plourde PJ, Embree J, Friesen F, et al. Glandular tularemia with typhoidal features in a Manitoba child. CMAJ 1992;146(11): 1953–1955.
31. Umlas SL, Jaramillo D. Massive adenopathy in oropharyngeal tularemia; C.T. demonstration. Pediatr. Radiol. 1990;20(6): 483–484.
32. Tarnvik A, Berglund L. Tularaemia. Eur. Respir. J. 2003;21(2): 361–373.
33. Dennis DT, Inglesby TV, Henderson DA, et al. Tularemia as a biological weapon: medical and public health management. JAMA 2001;285(21): 2763–2773.
34. Koskela P, Salminen A. Humoral immunity against Francisella tularensis after natural infection. J. Clin. Microbiol. 1985;22(6): 973–979.
35. Votava M. Lékařská mikrobiologie II. Přehled vyšetřovacích metod v lékařské mikrobiologii. Brno: Masarykova univerzita, Lékařská fakulta, 2002.
36. Johansson A, Berglund L, Eriksson U, et al. Comparative analysis of PCR versus culture for diagnosis of ulceroglandular tularemia. J. Clin. Microbiol. 2000;38(1): 22–26.
37. Long GW, Oprandy JJ, Narayanan RB, et al. Detection of Francisella tularensis in blood by polymerase chain reaction. J. Clin. Microbiol. 1993;31(1): 152–154.
38. Kroca M, Tarnvik A, Sjostedt A. The proportion of circulating gammadelta T cells increases after the first week of onset of tularaemia and remains elevated for more than a year. Clin. Exp. Immunol. 2000;120(2): 280–284.
39. Syrjala H, Herva E, Ilonen J, et al. A whole-blood lymphocyte stimulation test for the diagnosis of human tularemia. J. Infect. Dis. 1984;150(6): 912–915.
40. Burke DS. Immunization against tularemia: analysis of the effectiveness of live Francisella tularensis vaccine in prevention of laboratory-acquired tularemia. J. Infect. Dis. 1977;135(1): 55–60.
41. Beneš J. Léčba tularemie v závislosti na formě a stadiu nemoci. Klin. Mikrobiol. Inf. Lék. 2000;3 : 79–83.
42. Perez-Castrillon JL, Bachiller-Luque P, Martin-Luquero M, et al. Tularemia epidemic in northwestern Spain: clinical description and therapeutic response. Clin. Infect. Dis. 2001;33(4): 573–576.
43. Syrjala H, Schildt R, Raisainen S. In vitro susceptibility of Francisella tularensis to fluoroquinolones and treatment of tularemia with norfloxacin and ciprofloxacin. Eur. J. Clin. Microbiol. Infect. Dis. 1991;10(2): 68–70..
44. Johansson A, Urich SK, Chu MC, et al. In vitro susceptibility to quinolones of Francisella tularensis subspecies tularensis. Scand. J. Infect. Dis. 2002;34(5): 327–330.
45. Limaye AP, Hooper CJ. Treatment of tularemia with fluoroquinolones: two cases and review. Clin. Infect. Dis. 1999;29(4): 922–924.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2008 Issue 3-
All articles in this issue
- Sauna and Children
- To the Contribution of J. Gut, M.D. – Kawasaki Disease
- Occurrence of Overweight and Obesity in 7,427 Czech Children Examined in 2006
- Associations between Parental and Children’s Injuries
- Tularaemia: Rare Cause of Fever and Lymphadenopathy in an Infant
- Plasmapheresis and Immunoadsorption in Pediatrics
- Kawasaki Disease (40th Anniversary of the First Publication)
- Czech Atherosclerosis Society Guidelines for the Diagnosis and Treatment of Dyslipidemias in Children
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tularaemia: Rare Cause of Fever and Lymphadenopathy in an Infant
- Plasmapheresis and Immunoadsorption in Pediatrics
- Czech Atherosclerosis Society Guidelines for the Diagnosis and Treatment of Dyslipidemias in Children
- Kawasaki Disease (40th Anniversary of the First Publication)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

