-
Medical journals
- Career
Současné metodické postupy a přehled preimplantační, prenatální a postnatální DNA diagnostiky cystické fibrózy v České republice
: M. Balaščaková 1*; T. Piskáčková 1*; A. Holubová 1; E. Raušová 1; V. Kazárová 1; A. Krebsová 1; M. Koudová 1; A. Štambergová 1; J. Čamajová 1; P. Norambuena 1; P. Křenková 1; F. Votava 2; V. Skalická 3; V. Vávrová 3; M. Macek st. 1; M. Macek ml. 1
: Ústav biologie a lékařské genetiky UK 2. LF a FN Motol, Praha přednosta prof. MUDr. M. Macek ml., DrSc. 1; Klinika dětí a dorostu UK 3. LF a FN Královské Vinohrady, Praha přednosta doc. MUDr. F. Votava, PhD. 2; Pediatrická klinika UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Lebl, CSc. 3
: Čes-slov Pediat 2008; 63 (2): 62-75.
Cystická fibróza (CF) je nejčastějším autozomálně recesivně dědičným onemocněním se závažnou prognózou. Je způsobena přítomností mutací v genu CFTR. Incidence CF se v České republice odhaduje na 1 : 2700–3800 novorozenců a každý 26.–33. jedinec je zdravým nosičem mutace v genu CFTR. Včasná diagnostika do dvou měsíců života významně ovlivňuje průběh a prognózu tohoto onemocnění. Proto je důležité mít k dispozici spolehlivé molekulárně genetické vyšetření, které stanoví genotyp probanda. Následně je třeba zajistit specializované genetické poradenství. Cílem genetického poradenství u CF je poskytnout rodičům přístupnou a pochopitelnou formou maximum informací o dědičnosti tohoto onemocnění a nabídnout rodině a dalším pokrevním příbuzným genetické vyšetření. V rámci prekoncepční péče informujeme páry o možnostech prenatální diagnostiky tohoto onemocnění. Smyslem je umožnit rodině narození zdravého dítěte.
Klíčová slova:
cystická fibróza (OMIM 219700), gen CFTR, prenatální diagnostika, postnatální diagnostika, novorozenecký screening, mutace, varianty, genetické modifikátory, preimplantační genetická diagnostikaÚvod
Cystická fibróza (CF; OMIM 219700) [1] je jedním z nejčastějších autozomálně recesivně dědičných onemocnění v bělošské populaci s incidencí cca 1 : 2000–4000 novorozenců [2, 3, 4]. Poslední údaje o incidenci CF v různých populacích lze nalézt ve zprávě „The Molecular Genetic Epidemiology of Cystic Fibrosis“ na internetové stránce Světové zdravotnické organizace (WHO; http://www.who.int/genomics/publications/en/) [5]. V České republice byla incidence CF epidemiologickými studiemi v padesátých a šedesátých letech 20. století stanovena na 1 : 2700 novorozenců [6], přičemž naše nedávná pilotní studie novorozeneckého screeningu prokázala incidenci přibližně dvojnásobně nižší (1 : 6400) [7]. Po započtení vlivu prenatální diagnostiky CF v období novorozeneckého screeningu jsme získali hodnotu 1 : 3800 novorozenců, což odpovídá nálezům z ostatních evropských screeningových programů [8]. Celosvětově nebyl dosud rozdíl mezi vyšší epidemiologickou incidencí CF a incidencí onemocnění vyplývající z novorozeneckého screeningu uspokojivě vysvětlen. Z praktického hlediska je stanovení co možná nejpřesnější incidence CF důležité pro určení reziduálního rizika CF u vyšetřovaných po vyloučení co možná největšího počtu populačně specifických mutací v genu CFTR [9, 10, 11].
Gen pro CF, nazývaný Cystic Fibrosis Transmembrane Conductance Regulator gene (gen CFTR), je lokalizován na dlouhém raménku 7. chromozomu (7q31.2) a skládá se z 27 exonů [2]. Genomická sekvence genu CFTR zahrnuje cca 230 kb [12, 13, 14, 15], CFTR-mRNA je dlouhá cca 6,5 kb a výsledný CFTR protein má 1430 aminokyselin. Celosvětově bylo dosud popsáno více než 1500 mutací v genu CFTR, z toho přes 1200 patogenních mutací (viz aktuální stav v Cystic Fibrosis Genetic Analysis Consortium Dabatase – CFGAC; http://www.genet.sick-kids.on.ca/cftr/) [16]. Molekulárně genetická diagnostika CF je bohužel komplikována skutečností, že naprostá většina mutací je privátních a pouze 30 mutací (1717-1G>A, 1898+1G>A, 2184delA, 2789+5G>A, 3120+1G>A, 3659delC, 3849+10kbC>T, 621+1G>T, 711+1G>T, A455E, F508del, I507del, G542X, G551D, G85E, N1303K, R1162X, 1161delC, S549N, R117H, R334W, R347P, R553X, R560T, W1282X, 1078delT, 394delTT, CFTRdele2,3(21kb), 3272-26A>G a D1152H) se vyskytuje s četností více než 0,1 %. Mnohé mutace jsou populačně specifické a/nebo se nacházejí ve vyšší prevalenci v populačních či náboženských izolátech [16]. V Evropě v zásadě narůstá heterogenita mutací od severu na jihovýchod [16, 17, 18].
V této souvislosti je nutno rovněž uvést, že objektivně byl patogenetický potenciál vyšetřen expresními studiemi pouze u necelého 1 % mutací a tak „kauzální vztah“ většiny mutací k rozvoji CF byl stanoven pouze jejich asociací s fenotypem choroby u pacienta, u něhož byly původně identifikovány [19, 20]. Z hlediska typu mutací se nejčastěji vyskytují mutace vedoucí k záměně aminokyseliny (tzv. „missense“ mutace). Kromě nich jsou diagnostikovány nukleotidové substituce vedoucí k zavedení předčasného stop/terminačního kodónu („stop/nonsense“ mutace), posuny čtecího rámce jsou dány „výpadkem“ či „vnesením“ takového počtu nukleotidů DNA, který není dělitelný třemi („frameshift“ mutace) a sestřihové mutace („splicing“ mutace) [21], včetně delecí/inzercí jednotlivých kodonů, které nevedou k posunu čtecího rámce (viz aktuálně CFGAC) [16]. Větší delece nebo inzerce zahrnující celé exony a přilehlé intronové sekvence se vyskytují v 1–2 % všech případů a nejsou zachytitelné standardními PCR metodikami, které neumožňují kvantifikaci amplifikace obou alel (paternálních a maternálních) genů CFTR [22, 23]. V naprosté většině případů se jedná o mutace germinální, zpravidla s ancestrální povahou [24], tj. vyskytují se v dané populaci dlouhodobě, a jsou důsledkem dávných historických selekčních procesů [25]. Dosud bylo popsáno pouze několik málo „de novo“ mutací, v současné době však nejsou k dispozici žádné spolehlivé údaje o jejich skutečné četnosti. Konečně somatické mutace se v genu CFTR dosud nenašly [2, 16].
Z hlediska molekulárně genetické diagnostiky je podstatné, že efekt mutací na jednotlivé složky „fenotypu“ CF je tkáňově specifický [26], přičemž nejcitlivější je mužský reprodukční trakt (vas deferens/chámovod), pankreas, potní žláza a vedlejší nosní dutiny [105]. Bronchiální postižení je na vlivu genu CFTR závislé nepřímo, díky výraznému vlivu prostředí (tj. infekcí) [27] a dalších genetických modifikátorů jako například genu pro TGFbeta1 [3, 19, 20].
V současné době se molekulárně genetická diagnostika provádí ve dvaceti laboratořích v České republice, které se podrobují externí kontrole kvality (http://www.uhkt.cz/nrl/db). Vzhledem k širokému vyšetřování mutací v genu CFTR jak na klasických genetických pracovištích (soukromých i státních), tak v poslední době i v centrech asistované reprodukce, vyvstala potřeba poskytnout aktuální doporučení pro laboratorní a klinicko-genetické postupy pro molekulárně genetickou diagnostiku CF.
Dále tedy uvádíme nejčastější diagnostické situace a doporučené postupy pro jejich řešení.
Postnatální molekulárně genetická diagnostika CF
Smyslem postnatálního molekulárně genetického vyšetření genu CFTR u pacienta s CF je především potvrzení klinické diagnózy onemocnění. Nesporným přínosem je také možnost prenatální diagnostiky v dalších graviditách rodičů probanda a genetické vyšetření pokrevních příbuzných ke stanovení možnosti přenašečství daných mutací (viz dále). Spolupracující klinické pracoviště by mělo být poučeno o tom, že pacient nebo u nezletilých jeho zákonní zástupci by měli podepsat informovaný souhlas s vyšetřením (viz například pravidla stanovená Švýcarskou společností lékařské genetiky – http://www.ssgm.ch/sections/ pdf/2001/meetings/GE01/informed_consent.pdf nebo OECD – www.oecd.orgstibiotechnology).
Vzhledem k populačně specifickému zastoupení jednotlivých mutací je při molekulárně genetickém vyšetření genu CFTR klíčové znát etnický původ probanda a distribuci i četnost mutací v příslušné populaci. Důležitá je i znalost populačně specifické incidence CF pro stanovení reziduálního rizika CF (viz výše). U českých pacientů bylo zatím nalezeno 70 různých mutací (viz tab. 1) [16, 17]. Osmnáct mutací se vyskytlo více než třikrát, což je statistický limit chyby malých čísel při tomto počtu mutací.
Vzhledem k autozomálně recesivnímu charakteru CF spočívá strategie tzv. kaskádového molekulárně genetického vyšetření genu CFTR u pacienta s CF v postupném vylučování nejčastějších mutací v dané populaci [28]. Tento postup je účelný z praktického i ekonomického hlediska. Nález dvou patogenních mutací v pozici trans, tj. ve dvou homologních genech na chromozomech paternálního a maternálního původu, znamená ukončení molekulárně genetického vyšetření a tím finální stanovení genotypu u vyšetřovaného. V některých případech nález dvou závažných mutací v pozici trans nekoreluje s atypicky mírnými průběhem onemocnění (vzhledem k věku pacienta a kvalitě jeho léčby). Pak je třeba pokračovat ve vyšetření celé kódující sekvence genu CFTR, která může odhalit další varianty či dokonce mutace v pozici cis (například F508del-V1212I), které mitigují klinický dopad „hlavní“ mutace a zásadně zlepšují prognózu quoad vitam u vyšetřovaného. Spolupráce s referenčním pracovištěm je v tomto ohledu potřebná [10].
Pokud je kaskádové vyšetření neúspěšné a pacient vykazuje jasné klinické a laboratorní známky onemocnění (a hladina chloridů v potu je vyšší než 30 mmol/l), je indikováno vyšetření méně častých nebo neznámých mutací genu CFTR tzv. mutačně ,,skenovacími“ metodami [29]. Jedná se například o denaturační gradientovou elektroforézu – DGGE nebo analýzu křivek tání DNA – HRMCA (viz také doporučení a databáze projektu EuroGentest – www.eurogentest.org nebo CF Thematic Network – www.cfbnetwork.be), nebo o přímé sekvenování kódující sekvence genu CFTR a přilehlých intronových oblastí. Při sekvenci genu CFTR (Lucarelli 2006) je vhodné zahrnout alespoň +/ - 50 pb v přilehlých intronech [21], kde se mohou nacházet klinicky relevantní intronové mutace rozrušující konsensuální místa sestřihu exonů genu CFTR.
V této souvislosti je třeba zdůraznit, že „primární“ využití sekvenace pro diagnostické účely je nevhodné vzhledem k tomu, že často jsou nalezeny varianty sekvence genu CFTR, jejichž patogenetický dopad není jasný [30]. Jejich nesprávná interpretace může vést k chybné diagnóze a iatrogenizaci vyšetřovaných. Konečně, pokud laboratoř nemůže s jistotou určit, zda je nalezená varianta patogenní či nikoli, měla by do výsledkového protokolu („zprávy“) tuto skutečnost jednoznačně uvést. Zpráva o výsledku by měla splňovat minimální kritéria kvality, tak jak je doporučeno Švýcarskou společností lékařské genetiky – http://www.ssgm.ch/sections/pdf/current/publications/SSGM%20reporting%20guidelines%20dna%20v1.pdf nebo „OECD guidelines for quality assurance in molecular genetic testing“ (viz výše) [9, 11, 31].
V případě, kdy sekvenace kódující sekvence není úspěšná a mutaci se nedaří nalézt, je s výhodou stanovit genotypy varianty M470V (1540A/G), kde alela „V (G)“ je signifikantně asociována s přítomností non-F508del mutací v genu CFTR [32]. Podobně nález jedné patogenní mutace (např. F508del) a koncentrace chloridů v potu nad 30 mmol/l výrazně zvyšují šanci, že se podaří najít dosud neznámou mutaci v genu CFTR [33].
1. Prevalence mutací genu CFTR, které byly nalezeny v posledních deseti letech u pacientů vyšetřených v pražském CF centru ve FN v Motole. 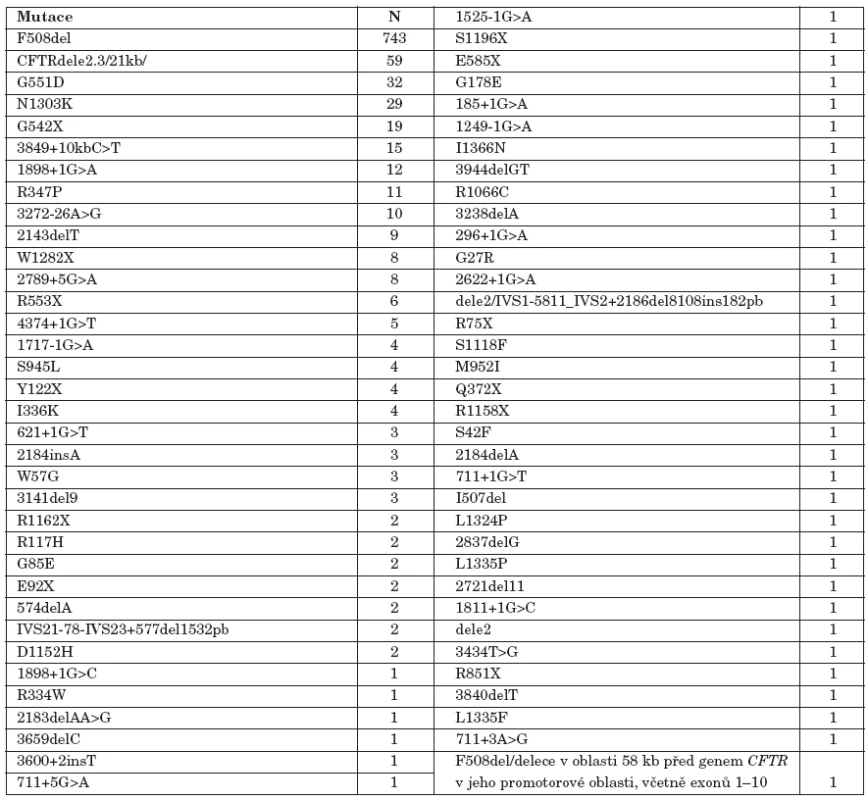
N – počet nalezených mutací Molekulárně genetická diagnostika u pacientů s CF by měla v každém případě zahrnovat všechny mutace, které se v příslušné populaci vyskytují s četností vyšší než 0,5 % nebo optimálně více než 0,1 % [9, 10]. V tabulce 1 jsou uvedeny nejčastější mutace v genu CFTR, které byly naším centrem v posledních deseti letech zachyceny. Současně by měly být vyšetřeny časté intragenové přestavby (1–2 % všech mutací), které nejsou běžnými metodami založenými na podkladě PCR zachytitelné, a to pomocí moderních kvantitativních technik, jakou jsou MLPA/QPMSF [22, 23]. Nálézáme především přestavby v oblasti exonů 2–3 a 17A–17B. Ostatně druhou nejčastější mutací v naší populaci je rozsáhlá „slovanská“ delece CFTRdele2,3/21kb/ [34].
Pokud nemáme k dispozici informace o distribuci mutací u konkrétní etnické skupiny, je vhodné u těchto pacientů vyšetřit celosvětově nejčastější mutace [16, 17]. To platí rovněž pro pacienty, jejichž etnická příslušnost není známa nebo kteří byli počati na podkladě dárcovství gamet.
Ne všechny mutace genu CFTR, zvláště pak vzácné (či dokonce privátní) záměny aminokyselin, jsou jednoznačně spojeny z rozvojem klasické formy onemocnění [19, 20]. Je proto vždy nezbytné potvrdit jejich přítomnost u obou rodičů vyšetřovaného segregační analýzou (k ozřejmění jejich lokalizace v obou homologních alelách), protože se mohou nacházet i v pozici cis, tj. v rámci jednoho genu CFTR. Současně je vhodné si ověřit jejich patogenetický potenciál v internetové databázi PolyPhenTm (http://genetics.bwh.harvard.edu/pph/) nebo přímo dotazem u autora, který tuto změnu nalezl. Některé mutace jsou spojeny i s mužskou fertilitou (3849+10kbC>T) [35, 36], mírným sino-pulmonálním onemocněním (A455E) [19, 37], v různých populacích s různou mírou pankreatické dysfunkce (R347P) nebo s populačně specifickým rizikem mekoniového ileu (G542X nebo CFTRdele2,3/21kb/) [34]. Variabilita CF i u stejné mutace je u jednotlivých pacientů značná [39] a dokonce i rasově specifická [38]. Konečně jednoznačně platí, že negativní nález mutací v genu CFTR neznamená vyloučení diagnózy onemocnění v případě, že jsou splněna ostatní laboratorní a klinická kritéria CF [4, 40].
Rodiče pacienta s CF
Pokud to okolnosti umožňují, je vždy důležité vyšetřit rodiče pacienta s CF a potvrdit tak nosičství nalezených mutací u každého z nich. Tímto vyšetřením vyloučíme záměnu vzorků nebo eventuální non-paternitu, zvláště při prenatální diagnostice. Odhalení mutací u rodičů pacienta umožní také cílené vyšetření jejich pokrevních příbuzných.
V případě další gravidity s 25% rizikem narození dítěte s CF můžeme rodičům nabídnout možnost invazivní prenatální diagnostiky (tj. odběr buněk plodu buďto v I. trimestru těhotenství pomocí choriové biopsie – CVS, nebo ve II. trimestru – amniocentézou) k vyšetření genotypu plodu [41].
Příbuzní pacientů s CF
U sourozenců pacientů s CF se známými mutacemi je dostačující prokázat nebo vyloučit familiární mutace v genu CFTR. Pokud nezletilý sourozenec pacienta nevykazuje žádné příznaky CF, doporučujeme v současné době molekulárně genetické vyšetření odložit do doby plnoletosti nebo alespoň do doby, kdy může poskytnout informovaný souhlas a pochopit reprodukční dopady tohoto vyšetření (minimálně do 12 let věku). Pokud není genotyp probanda s jistotou zcela objasněn, lze pomocí nepřímého molekulárně genetického vyšetření určit pravděpodobnost nosičství u dalších pokrevních příbuzných, event. u plodu při prenatální diagnostice. V tomto případě je však nutné mít k dispozici genetický materiál probanda, u něhož však byla diagnóza CF jednoznačně stanovena. Je potřeba mít DNA od probandových rodičů a rodina musí být dostatečně informativní pro kombinaci neznámé mutace s intragenovými a extragenovými markery (tj. diagnosticky relevantních benigních polymorfismů) [11, 42, 43, 44].
K zamezení rizika rekombinace markerů asociovaných s mutovaným genem je vhodné zvolit jejich lokalizaci z obou stran genu CFTR (tj. ze strany 5´a 3´) [106]. Navíc vzhledem k rozsáhlé oblasti vazebné nerovnováhy v oblasti CFTR lokusu, která začíná 200 kb před promotorem genu CFTR a končí přibližně okolo exonu 14B, poskytují diagnostické markery v této oblasti stejnou míru „informativity“ [44].
Na základě podrobné rodokmenové analýzy je důležité vytipovat pokrevní příbuzné vhodné k molekulárně genetickému vyšetření. Cílem je opět vyloučit nebo potvrdit nosičství familiární mutace. V případě rizika přenašečství neznámé mutace doporučujeme provést nepřímé molekulárně genetické vyšetření. Pokud toto vyšetření provést nelze, je indikováno vyšetření populačně specifických mutací u partnera tohoto příbuzného s dostatečně vysokou populačně specifickou „záchytností“, převyšující optimálně 90 % etnicky specifických alel. Takto výrazně snížíme riziko narození dítěte s CF v jejich rodině, tj. minimálně pod základní populační riziko dané incidencí CF v České republice [9, 10, 11].
Vyšetření genu CFTR u onemocnění příbuzných CF
Kromě suspektní klasické formy CF je postnatální molekulárně genetické vyšetření genu CFTR indikováno i u onemocnění příbuzných CF – tj. u mužů s kongenitální bilaterální agenezí vas deferens (CBAVD), neobstrukční formou těžké oligospermie a azoospermie [45, 46], chronické idiopatické [47, 48] pankreatitidy [49, 50, 51], roztroušených bronchiektázií [52, 53], izolované nosní polypózy [54], chronické rhinosinusitidy [55] nebo alergické bronchopulmonální aspergilózy [56]. Zde je však velice důležité správně interpretovat získané výsledky a pacienta psychicky netraumatizovat diagnózou klasické formy CF, pokud nemá další klinické obtíže a laboratorní známky svědčící pro CF [3, 4, 40]. Ve většině případů se spíše jedná o atypické formy CF s výrazně lepší prognózou quoad vitam než u klasické formy nemoci [40]. V každém případě je vhodné tyto pacienty dlouhodobě klinicky dispenzarizovat ve specializovaných CF centrech.
V případě kongenitální bilaterální absence vas deferens (CBAVD) byla prokázána nezvykle vysoká četnost složeně heterozygotního genotypu mutací F508del a R117H na intragenovém pozadí varianty IVS8 “5T” (pozici cis, tj. v témže genu CFTR; kdygenotypový zápis laboratorního výsledku je „F508del/R117H-5T“). Vzhledem k tomu, že u pacientů s CBAVD a ostatními onemocněními příbuznými CF je záchytnost mutací používaných k diagnostice klasické formy CF nízká, nelze vyloučit přítomnost dalších „mírných“ alel. Vyšetření je třeba také rozšířit o mutaci D1152H nebo provést mutační skenování celé kódující sekvence [57] podobně jako u chronické idiopatické pankreatitidy. Nicméně názor na analýzu celé kódující sekvence u onemocnění příbuzných CF není sjednocený vzhledem ke zvýšenému riziku nálezu variant s neznámým či neurčitelným patogenetickým potenciálem – klinickou interpretací (viz výše). Význam molekulárně genetického vyšetření spočívá především v objasnění patogeneze mužské neplodnosti a v primární prevenci CF v širší rodině probanda. Konečně intragenové přestavby v genu CFTR byly nalezeny i u CBAVD [64].
Vyšetření a klinická relevance intragenových variant IVS8 T(n)/IVS-8 TG(n) a polyvariantní haplotypy
Geny CFTR, které mají minimálně dvě funkčně relevantní varianty či mutace v pozici cis (tj. v témže genu a na témže chromozomu 7), jsou nazývány „komplexní alely”. V současné době byly nejpodrobněji charakterizovány komplexní alely intronu 8 (IVS-8) v podobě asociace variant TG13-T5, TG12-T5 a TG11-T5 nebo R117H-T5/R117H-T7 [58], včetně „dyády“ varianty I148T s mutací 3199del6.
Před exonem 9 v intronu 8 genu CFTR se nalézají dvě polymorfní repetice nukleotidových bází v přímé souslednosti (ve směru 5´–3´ DNA transkripce): TG(n) a T(n). Se vzrůstajícím počtem repetice TG(n) a naopak se snižujícím se počtem repetice T(n) se snižuje i podíl správně sestřižených exonů 8 a 9 v průběhu sestřihu pre-mRNA genu CFTR [59]. Transkripty CFTR m-RNA, které nemají exon 9, nejsou dále zpracovány v endoplazmatickém retikulu a transportovány z jádra k povrchu buňky [67]. Z tohoto důvodu je na povrchu epiteliálních buněk jen menší množství funkčních proteinů CFTR. V rámci lokusu T(n) se vyskytují tři časté alely T5, T7 a T9, vzácně i T3 [60]. Efekt repetice IVS-8 T(n) na správný sestřih exonu 9 je potencován její asociací s IVS-8 TG(n) v pozici cis (viz výše). Proto alela T5 může být asociována s TG11 v pozici cis (tj. 11x dinukleotid TG), TG12, TG13 a vzácně i TG15 [61].
Přibližně 5 % genů CFTR v náhodné evropské kontrolní populaci obsahuje variantuIVS-8 T5 [62]. V případě alely T5 počet TG repetic (v pozici cis) určuje výsledné množství plně funkčních proteinů – chloridových kanálů CFTR, které zajišťují normální transport iontů na povrchu epiteliálních buňek. Pokud jejich množství klesne pod kritickou hranici 5–10 % normy [63], kdy se kvantitativní defekt změní v kvalitativní, dojde k rozvoji patogenetické kaskády vedoucí k rozvoji atypických či dokonce vzácně i typických forem CF [59, 65]. Asociace TG12-T5 nebo TG13-T5 (obojí v pozici cis) v homozygotním stavu (tj. obě komplexní alely v pozici trans vzájemně vůči sobě) nebo ve složeně heterozygotní podobě s další patogenní mutací v genu CFTR v pozici trans obvykle vede k rozvoji onemocnění příbuzného CF, jako je například CBAVD nebo chronická idiopatická pankreatitida (viz výše). Je zajímavé, že ve vyšším věku se u některých pacientů s CBAVD rozvinou i mírné příznaky sino-pulmonálního onemocnění jako u klasické formy CF. Zcela výjimečně „extrémní“ kombinace TG13-T5 může vést k rozvoji CF, pokud je v pozici trans patogenní mutace [66, 59].
Je tedy potřeba nález „izolované“ alely 5T, tak jak je zavzata do většiny současných komerčních diagnostických souprav, vždy doplnit vyšetřením alel poly-TG traktu, protože jinak není možno se vyjádřit k jejímu patogenetickému potenciálu. Naopak kombinace TG11-T5 je velmi nepravděpodobně spojena s rozvojem CF. V případě CBAVD je většina variant T5 asociována v pozici cis s TG12/TG13 (v 90 % všech případů), přičemž pouze 10 % alel je spojeno s TG11 [59, 65, 68]. Podobné asociace platí i u chronické idiopatické pankreatitidy nebo roztroušených bronchiektázií [52].
Na závěr je potřeba uvést, že dosud není dořešena z diagnostického hlediska problematika tzv. polyvariantních haplotypů (tj. přítomnost několika benigních variant v pozici cis), které mohou i při nepřítomnosti kauzální mutace svým additivním či dokonce multiplikativním efektem natolik změnit (negativním „loss of function mutation“ i pozitivním směrem „gain of function mutation“) funkci CFTR proteinu, že vlastně nahrazují přítomnost patogenní alely genu CFTR [59]. Na tuto skutečnost je nutno pomýšlet i v situacích, kdy se sekvenční analýzou nedaří nalézt patogenní mutaci. Výzkum v této oblasti pokračuje a v této souvislosti byly charakterizovány i tzv. subpolymorfní varianty, které se vyskytují v obecné populaci více než v 1 % a méně než ve 3 % a jsou potenciálně patogenní [42, 43]. Z tohoto důvodu je rovněž nezbytné při nálezu vzácné mutace sekvenční analýzou ověřit, zda je v pozici cis (velmi pravděpodobně nepatogenní) nebo trans (velmi pravděpodobně patogenní) vůči „hlavní“ nebo časté patogenní mutaci v genu CFTR [69].
Molekulární patogeneze u mutace R117H v asociaci s intragenovou variantou IVS8 T(n)
Zajímavá je i asociace „mírné mutace“ R117H v pozici cis s IVS-8 T5 nebo T7 [70]. Asociace R117H-T5 vede k méně funkčnímu proteinu CFTR než asociace R117H-T7. Z tohoto důvodu kombinace R117H-T5 vede k mírné formě CF, zatímco kombinace R117H-T7 vede u mužů převázně k obstruktivní azoospermii až CBAVD nebo dokonce je spojena i s asymptomatickým průběhem z hlediska CF, převážně u žen. Proto se doporučuje v případě nálezu mutace R117H doplnit genotyp varianty IVS-8 5T nebo 7T (tj. pomocí “reflexního vyšetření”) [70].
Stanovení počtu thymidinů u varianty IVS-8 T(n) je obzvláště důležité při novorozeneckém screeningu CF, protože více než 5 % novorozenců se zvýšenými koncentracemi imunoreaktivního trypsinogenu (IRT) má mutaci R117H v pozicitrans s další závažnou mutací v genu CFTR [71]. Z uvedeného vyplývá, že počet pacientů s mutací R117H je vyšší v populaci jedinců zachycených laboratorním testem (tj. novorozeneckým screeningem na podkladě zvýšeného IRT) než zachycených na podkladě klinické diagnózy (tj. symptomaticky). Pacienti s mutací R117H zachycení při novorozeneckém screeningu jsou dosud v průběhu dosavadního sledování (max. 15 let od začátku screeningových programů) asymptomatičtí. Nicméně podobně jako u CBAVD (viz výše) není možno vyloučit, že se u nich v dospělosti nerozvinou mírné příznaky sino-pulmonálního onemocnění, tak jako u klasické formy CF [72]. Na druhé straně mutace R117H je celosvětově relativně velmi častá [16, 17]. Z porovnání výskytu této mutace v náhodné kontrolní populaci a u pacientů s CF se prokázalo, že pouze přibližně 1 % složených heterozygotů s touto mutací a další závažnou alelou v genu CFTR rozvine nějakou z forem CF. Rozhodující je v této souvislosti posouzení asociace R117H s variantou IVS-8 7T v pozici cis. V případě, že je komplexní alela R117H-7T nalezena ve složeně heterozygotní podobě s další mutací v genu CFTR, bude množství plně funkční CFTR-mRNA menší (viz výše), což vysvětluje rozvoj onemocnění u klinicky diagnostikovaných pacientů. Pokud bude komplexní alela R117H-7T zachycena na podkladě novorozeneckého screeningu u novorozence/kojence bez klinických příznaků CF, tato genotypová kombinace pravděpodobně nepovede k rozvoji onemocnění v dětství a rané dospělosti. Nicméně tito pacienti by měli být dlouhodobě sledováni ve specializovaných CF centrech. Tato skutečnost ještě vyžaduje další výzkum a dlouhodobé sledování takto diagnostikovaných pacientů [71].
Komplexní alela I148T-3199del6
Varianta I148T byla omylem na začátku devadesátých let charakterizována jako častá patogenní mutace. Z tohoto důvodu American College of Medical Genetics (ACMG) zahrnula tuto variantu do panelu 25 základních mutací, které by měly být vyšetřovány při populačním screeningu nosičů CF v USA [69]. Nicméně v roce 2004 bylo stanoveno, že I148T není patogenní a že se jedná o neutrální polymorfismus s populační četností 7 % [73]. Při další analýze se prokázalo, že mutace 3199del6 je v pozici cis zodpovědná za rozvoj onemocnění u pacientů s I148T [74]. Vzhledem k tomu, že pouze 1 % všech genů s variantou I148T rovněž nese mutaci 3199del6, varianta I148T byla vyřazena z rutinního panelu ACMG v roce 2004 [75].
Tento příklad je uváděn především z toho důvodu, že řada výrobců komerčních diagnostických souprav nezareagovala s dostatečnou flexibilitou a varianta I148T se stále nachází v panelech komerčních diagnostických souprav, bez možnosti reflexního testování pro patogenní mutaci 3199del6.
Novorozenecký screening CF: nová perspektiva
Včasná diagnostika a systematická specifická terapie u pacientů s CF je jednoznačně považována za prognosticky příznivý faktor a zároveň za průkaz dobře fungující zdravotní péče. Pozdě diagnostikovaná choroba má často komplikovaný průběh a je problémem terapeutickým, psychologickým i sociálně ekonomickým [7, 107].
Přestože CF dosud není kauzálně léčitelná, délka a kvalita života pacientů s CF se v posledních desetiletích ve vyspělých zemích významně zlepšila (viz například data Americké nadace pro CF – www.cff.org) a je přímo úměrná celkové úrovni zdravotní péče v daném státě. Nedávná studie dokazuje, že pacienti s CF diagnostikovaní do 2 měsíců věku jsou dlouhodobě v lepším klinickém stavu a mají příznivější průběh choroby [76]. Rozpoznání nemoci v prvních měsících života je však často obtížné – mimo případy mekoniového ileu, vyskytujícího se pouze u 13 % novorozenců s CF. V posledním desetiletí však došlo bohužel v České republice ke zhoršení včasné diagnostiky CF. Tyto údaje nás vedly k vytvoření pilotní studie novorozeneckého screeningu CF, která probíhala v letech 2005–2006, s cílem zjistit, zda je novorozenecký screening CF efektivní z hlediska včasné diagnostiky tohoto onemocnění. CF jsme diagnostikovali u 12 novorozenců, medián věku při stanovení diagnózy byl 37 dní. Současně jsme odhalili tuto diagnózu i u jejich 3 starších sourozenců, kteří měli klinické příznaky CF, ale byli vedeni pod jinými diagnózami [7]. Náš projekt tedy splnil všechna objektivní kritéria stanovená WHO pro jeho celoplošné zavedení.
Novorozenecký screening CF je v současnosti významným trendem v řadě evropských zemí i USA [8]. Nabývá na významu v rámci pomoci dětem s CF v celoplošném měřítku k zajištění uniformní a časné diagnózy, včetně následné péče ve specializovaných CF centrech. Jsme proto přesvědčeni, že uvedené skutečnosti jsou pádným důvodem k tomu, aby se celoplošný novorozenecký screening začal provádět i v České republice v rámci státem garantované preventivní péče, tak jak je tomu u kongenitální hypotyreózy, kongenitální adrenální hyperplazie a fenylketonurie.
Prenatální molekulárně genetická diagnostika CF
Prenatální diagnostika CF je v současné době neodmyslitelnou součástí genetického poradenství a měla by být dostupná pro všechny páry se zvýšeným rizikem tohoto onemocnění u jejich potomků. Úlohou klinického genetika je zvolit správný vyšetřovací postup. Z hlediska etického je potřeba zvážit nelehkou otázku stále se prodlužujícího mediánu přežívání a zvyšující se kvality života nemocných s CF, oproti možnosti selektivního přerušení těhotenství. Tato „delikátní rovnováha“ se vždy odvíjí od specifické situace konkrétní rodiny a od její zkušenosti s CF ve vlastní či širší rodině.
Následující řádky nabízejí stručný přehled současných vyšetřovacích algoritmů:
Partneři s 25% nebo 50% rizikem CF u plodu
Pokud jsou oba rodiče zdraví nosiči, nebo pokud je partnerem nosiče sám pacient s CF, je riziko postižení plodu vysoké – 25 % a 50 %. V těchto případech je partnerům doporučeno invazivní prenatální vyšetření, tzn. biopsie choria (CVS), ve 12.–13. týdnu gravidity a stanovení genotypu, genu CFTR u plodu. Rodinu je nutné informovat o možnosti tohoto vyšetření již prekoncepčně, abychom mohli výkon včas naplánovat. Výhodou tohoto vyšetření je časné stáří gravidity v době odběru, což v případě potvrzení diagnózy CF u plodu umožňuje umělé přerušení gravidity (UPT) na počátku II. trimestru. Tím snížíme riziko komplikací při tomto výkonu u matky a současně zkrátíme období stresu při čekání na výsledek vyšetření. V případě záchytu plodu s CF jsou doporučení klinického genetika přísně nedirektivní povahy a konečné rozhodnutí ohledně zachování těhotenství je pouze na rodičích. UPT lze provést do 24. týdne gravidity. Úlohou klinického genetika je poskytnout rodině komplexní a přitom srozumitelné informace o CF, a to včetně eventuální konzultace s dalšími odborníky – pediatrem, psychologem atd. Součástí prenatální diagnostiky CF je i vyšetření klinicko-genetické, tj. například u rodin s vyšším věkem matky (nad 35 let) nebo otce (nad 45 let) zaměřené na nejčastější chromozomální aneuploidie.
Hyperechogenita střev u plodu nebo nízká hladina GGT v plodové vodě
Další skupinu se zvýšeným rizikem CF tvoří těhotné s negativní rodinnou anamnézou, ale se záchytem hyperechogenity dutiny břišní u plodu při rutinním ultrazvukovém vyšetření ve II. trimestru gravidity (vzhledem k subjektivnosti nálezu hyperechogenita dutiny břišní musí být minimálně tak intenzivní jako u okolní kostní tkáně) nebo se signifikantně sníženou hladinou gama-glutamyltransferázy (GGT, dříve „GMT“) v plodové vodě pod 3. percentilem populačně specifických hodnot [41]. Obojí nález odpovídá prenatálnímu postižení pankreatu a následné malabsorpci u plodu v důsledku ucpání terminálního ilea nenatrávenými zbytky spolykaných epitelií a/nebo chloupků z plodové vody. Při záchytu zvýšené echogenity střevní u plodu je diferenciálně diagnosticky nutné zvážit vrozenou vývojovou vadu GIT, chromozomální aberaci u plodu (a to i v mozaikové podobě), intrauterinně probíhající infekci a prenatální formu CF. Obecně je hyperechogenita střev u plodu způsobená CF maximálně v 10 % všech případů [78]. V této situaci je na místě nabídnout rodině vyšetření nejčastějších mutací v genu CFTR společně s vyšetřením karyotypu a prenatálních infekcí ze skupiny TORCH [41]. Pokud těhotná odmítne odběr a vyšetření plodové vody, je možné vyšetřit nejčastější mutace genu CFTR u obou partnerů. Pokud se těhotná rozhodne pro amniocentézu, vyšetřujeme gen CFTR přímo u plodu. Abychom snížili riziko kontaminace mateřským materiálem, což by mohlo ovlivnit výsledek molekulárně genetického vyšetření, doporučujeme použít kultivované amniocyty nebo buňky trofoblastu (z vypreparované CVS). Po vyloučení 38 nejčastějších populačně specifických mutací (zahrnujících přibližně 92 % všech populačně specifických mutací) u plodu nebo u obou partnerů je reziduální riziko postižení plodu CF menší než 0,1 %. Přínosem je v případě amniocentézy i biochemické vyšetření plodové vody, jehož součástí je koncentrace GGT [77].
Tento algoritmus funguje i obráceně: pokud je zachycena nízká hladina GGT v plodové vodě, indikujeme vyšetření nejčastějších mutací genu CFTR u plodu a zároveň doporučujeme ultrazvukové vyšetření v 18.–20. týdnu těhotenství se zaměřením na hyperechogenitu dutiny břišní u plodu. Konečně, i v případě těhotenství s hyperechogenitou dutiny břišní, kdy byla CF vyloučena, se doporučuje specializovaná perinatální péče s ohledem na zvýšené riziko časného postnatálního ileu [78].
Preimplantační genetická diagnostika CF
V současné době se rychle rozvíjí tzv. preimplantační genetická diagnostika (PGD) CF, která je spojena s hormonální stimulací ženy, invazivním odběrem oocytů a metodami asistované reprodukce [79]. Toto vyšetření umožňuje implantovat nepostižené embryo, u kterého pro molekulárně genetické vyšetření mutací v genu CFTR a/nebo vázaných markerů byla biopticky odebrána polární tělíska, jedna až dvě blastoméry či extraembryonální buňky trofoektodermu. Tento postup umožňuje implantovat „zdravé“ embryo (bez mutací nebo pouze nosiče jedné mutace v genu CFTR) a tak předejít selektivnímu přerušení těhotenství jako u standardní prenatální diagnostiky. Přestože se neustále zlepšují molekulárně genetické techniky pro vyšetření mutací genu CFTR nebo intragenových/extragenových markerů, stále je přítomno nezanedbatelné riziko technického selhání metody (falešné pozitivity či negativity) nebo tzv. fenoménu „allele dropout“ [80] při použití několika buněk pro izolaci DNA. Z tohoto důvodu by se měla PGD CF provádět na pracovišti s kvalitním molekulárně genetickým zázemím, laboratorní akreditací podle ISO 15198 (http://www.iso 15189.com/) [9, 81] a zařazeném v mezinárodních kontrolách kvality molekulárně genetické diagnostiky CF. Nezanedbatelné je i riziko ovariálního hyperstimulačního syndromu při hormonální stimulaci [82], komplikace spojené s invazivními metodami odběru oocytů, včetně zvýšeného rizika vzniku poruch tzv. imprintingu při intracytoplazmatické injekci spermií (ICSI) [83].
Z těchto důvodů by PGD měla být metodou volby oproti klasické prenatální diagnostice především v případech, kde pár přerušení těhotenství odmítá z náboženských či závažných sociálních důvodů, nebo tehdy, když předchozí standardní prenatální diagnostika vedla k opakovaným přerušením těhotenství z genetické indikace [79]. PGD CF je „sekundárně“ vhodná tam, kde pár podstupuje asistovanou reprodukci z jiných příčin než primárně z důvodu zvýšeného rizika CF (viz výše). Konečně je rovněž dobrou praxí doporučit po PGD standardní „kontrolní“ prenatální diagnostiku v I.–II. trimestru těhotenství, včetně ultrazvukového vyšetření hyperechogenity dutiny břišní a koncentrací GGT v plodové vodě [85].
Vyšetření mutací CF u poruch reprodukce a při asistované reprodukci
Samostatnou kapitolu představují dárci spermií a oocytů. Podle doporučení CF Thematic Network (www.cfnetwork.be) [10] by u nich měly být vyšetřeny nejčastější mutace genu CFTR. V případě záchytu některé z mutací vyřazujeme tohoto dárce/dárkyni ze seznamu, protože se tím výrazně sníží riziko narození dítěte s CF. (Cave: každý 26.–33. jedinec v české populaci je nosičem jedné mutace v genu CFTR).
Vyšetření genu CFTR je indikováno také u pacientů s poruchou spermiogeneze, zejména s obstrukční azoospermií nebo těžkou oligospermií [85]. Pokud je u pacienta mutace zachycena, pokračujeme dále v kaskádovém vyšetření genu CFTR. Pacient by měl zároveň absolvovat potní test a v případě pozitivního výsledku (tj. nad 60 mmol/l) je vhodné doplnit klinické vyšetření, včetně eventuální dlouhodobé dispenzarizace pacienta. Tento postup platí pro všechny pacienty s obstrukční azoospermií, případně jinou těžkou poruchou spermiogeneze, kde byly vyloučeny časté chromozomální aberace a mikrodelece chromozomu Y (DAZ lokus) [84]. V případě záchytu mutace je vždy indikováno vyšetření pokrevních příbuzných pacienta a prenatální diagnostika CF je aktivně nabízena. Vzhledem k tomu, že „mužský faktor“ se podílí na infertilitě z 50 %, a vzhledem k vysoké populační četnosti nosičů mutací v genu CFTR (1 : 26 v české populaci), CF Thematic Network doporučuje vyšetření genotypu nejčastějších mutací v genu CFTR i u všech párů podstupujících asistovanou reprodukci, a to bez ohledu na základní diagnózu a negativní rodinnou anamnézu, ale po vyloučení nejčastějších cytogenetických abnormalit [10].
Partner nosiče mutace genu CFTR
V rámci prekoncepční péče je indikováno vyšetření nejčastějších mutací genu CFTR (optimálně DNA diagnostickým testem se záchytností vyšší než 90 %) také u partnerky či partnera zdravého nosiče mutace v genu CFTR. Při negativitě tohoto vyšetření je reziduální riziko postižení plodu CF pod 0,1 %. Takový pár by měl mít specializovanou péči během gravidity, tzn. podrobné ultrazvukové vyšetření plodu v 18.–20. týdnu těhotenství se zaměřením na hyperechogenitu dutiny břišní u plodu, přičemž po porodu doporučujeme u dítěte provedení potního testu. Pokud by takový pár trval na invazivním vyšetření během gravidity, je možné jim v tomto případě nabídnout odběr a vyšetření plodové vody v 16.–18. týdnu těhotenství. Přínosné je zde vyšetření koncentrace GGT v plodové vodě. Riziko komplikací u tohoto výkonu (tj. 0,5 až max. 1 %) však převyšuje riziko postižení plodu CF [10]. Definitivní rozhodnutí je tedy na rodičích. Molekulárně genetickým vyšetřením je pak možné vyšetřit přítomnost nebo nepřítomnost konkrétní rodičovské mutace u plodu. Při odběru plodové vody je vždy vyšetřen také karyotyp plodu [41]. V diagnosticky komplikovaných situacích lze využít i Bayesova teorému (zhodnocující matematicky míru apriori a aposteriori rizik) pro přesný výpočet reziduálních rizik CF v širší rodině probanda. Tuto relativně komplikovanou problematiku nebudeme v této publikaci podrobně rozebírat a odkazujeme na nedávné instruktivní publikace [86].
Rodič s CF
Pokud je jedním z rodičů pacient s CF, provádíme na našem pracovišti vyšetření 42 mutací genu CFTR u jeho partnera k dosažení co nejvyšší populačně specifické záchytnosti mutací (více než 92 %). V případě, že jsou tyto mutace u partnera vyloučeny, má takto vyšetřený pár riziko narození dítěte s CF cca 1 : 625, což je však stále přibližně čtyřnásobně vyšší riziko než riziko populační, dané incidencí CF [86]. Zde opět doporučujeme podrobné ultrazvukové vyšetření plodu se zaměřením na hyperechogenitu jeho dutiny břišní v 18.–20. týdnu těhotenství. Partnerům nabízíme fakultativně i výkon invazivní prenatální diagnostiky, tedy odběr plodové vody s vyšetřením karyotypu plodu, molekulárně genetickým vyšetřením plodu a biochemickým vyšetřením plodové vody [41]. Molekulárně genetické vyšetření prokáže jednu z rodičovských mutací a plod bude vždy minimálně přenašečem mutace v genu CFTR. Po narození dítěte je opět indikováno provedení potního testu na pracovišti, které má podle mezinárodních doporučení CF Thematic Network zkušenost s více než 250 potními testy provedenými metodou Gibson-Cooke [87] ročně k dosažení spolehlivých výsledků [10, 11].
Příbuzenské sňatky
V rámci prekoncepční péče u příbuzenských sňatků je vhodné vyšetřit nejčastější mutace v genu CFTR. Toto doporučení vychází z principu autozomálně recesivního typu dědičnosti CF, kde konsangvinita rodičů zvyšuje riziko onemocnění dítěte CF nad riziko populační [10].
Prenatální screening mutací v genu CFTR u rodin bez rodinné anamnézy CF
V roce 1997 poradní sbor expertů N.I.H. – USA doporučil, aby se s molekulárně genetickým screeningem nosičů mutací v CFTR genu nezačínalo dříve, než bude populační záchytnost mutací alespoň 95 % (106th Genetic Testing for Cystic Fibrosis, NIH Consensus Statement, Online 1997; 14–16/IV,15(4): 1–37, odp.od.nih.gov/consensus/ cons/106/106_statement.htm) [75]. Doporučení pro populační screening nosičů CF byla rovněž publikována American Society of Human Genetics (www.faseb.org/genetics/ashg/ ashgmenu.htm/) a Světovou zdravotnickou organizací (www.who. int) nebo Německou společností lékařské genetiky (http://www.forum-humangenetik.de/en/documents/gfh.htm?Submit2=show+list).
V případě současného stavu v České republice s 96% záchytností všech mutací (tab. 1) by se riziko nosičství CF screeningem snížilo z 1 : 26–30 na 1 : 189–260. Přibližně sedmkrát snížené riziko nosičství mutací u CF se může zdát jako dostatečně nízké, aby ospravedlnilo populační screening CF molekulárně genetickým vyšetřením [86]. Matematické modely však prokázaly, že v populaci by bylo takto zachyceno velké množství „izolovaných“ nosičů [10]. Navíc u většiny z těchto zachycených nosičů by byl jejich partner „negativní“ a tak by míra „záchytnosti“ CF byla snížena. Přesto by tak bylo možno celkově zvýšit efektivitu prenatálně genetické prevence CF. Při ~90% záchytnosti vyšetření mutací genu CFTR je reziduální riziko CF u párů, kde jeden z rodičů by byl „pozitivní“ a druhý „negativní“, přibližně 2,7krát (1 : 1000) zvýšeno nad obecné populační riziko dané incidencí CF (1 : 2700) v České republice [86].
V současné době se proto doporučuje screening asymptomatických nosičů CF: 1. u jedinců s pozitivní rodinnou anamnézou CF, tj. u příbuzných probanda, 2. v případech nejasné diagnózy CF, 3. u „vysoce uvědomělých a motivovaných“ jedinců i bez rodinné anamnézy CF.
V posledním případě se jedná o psychologické indikace u profesí, které přijdou dlouhodobě do styku s pacienty s klasickou formou CF, jako jsou například zdravotníci nebo studenti medicíny, kteří z pochopitelných důvodů chtějí znát, zda jsou nosiči mutací genu CFTR. Všechna tato vyšetření musí být provedena po podrobné a nedirektivní genetické konzultaci [10, 86, 104].
Nicméně i při více než 95% záchytnosti mutací genu CFTR zůstává problematika populačního screeningu CF stále kontroverzní, především z psychologického hlediska. Navíc poslední rozsáhlé sociologické průzkumy prokazují velmi nízké povědomí obecné populace o genetických onemocněních, strachu z nich a z případné stigmatizace celé rodiny [2]. Je nutné vzít v úvahu i případné náboženské a kulturní vlivy, především u neevropských populací. Psychologické a sociologické studie N.I.H. prokázaly, že největší zájem o screening nosičů CF je pouze před plánovaným těhotenstvím nebo v I.–II. trimestru těhotenství (106th Genetic Testing for Cystic Fibrosis, NIH Consensus Statement, Online 1997) [69].
Z těchto důvodů by před započetím populačního screeningu měla být obecná populace podrobně seznámena s povahou CF, podstatou testu a jeho dopady, protože jinak hrozí riziko plošné iatrogenní psychické traumatizace velkého množství lidí. Navíc úroveň a rozsah genetických služeb je prozatím celosvětově (včetně České republiky) nedostačující pro genetické konzultace před a/nebo po screeningovém vyšetření CF.
Hlavní technický problém populačního screeningu nosičů s CF je podobný jako u screeningu nemocných s CF. Spočívá v tom, že není dosud možné paralelně vyšetřit všechny dosud známé mutace v genu CFTR v etnicky heterogenních populacích. Dosud je rovněž nevyřešena i reálná doba laboratorního vyšetření a náklady spojené s touto formou screeningu CF. Záchytnost příslušného screeningového testu by omezila i etnicita vyšetřovaných vzhledem k tomu, že spektrum vyšetřovaných mutací genu CFTR v rámci takto prováděného screeningu by bylo optimalizováno na „většinovou“ populaci [11].
Vyšetření modifikujících genů a použití tzv. tříd mutací genu CFTR pro klinickou prognózu u CF
V současné době se výzkumně studují genetické modifikátory u CF, například mutace v genech TGFbeta1 [88], MBL2 [89] nebo A1AT [19, 90, 91], které ovlivňují nejrůznější aspekty či komplikace u klasické formy CF – jaterní onemocnění (CFLD) [92, 93] či diabetes mellitus (CFRDM) [94]. I přes určité úspěchy při nálezu statisticky signifikantních asociací je jejich využití při „klinické prognostice“ dosud neopodstatněné. Ukazuje se, že asociace nalezené pro celé soubory nemocných (kohorty) nelze jednoznačně aplikovat pro jednotlivé (konkrétní) pacienty [95]. Podobné závěry platí i pro použití patogenetických tříd mutací [2] pro předpovězení průběhu CF u nově diagnostikovaných forem CF. U kojenců může však být rozdělení mutací na „závažné“ (Třídy I–III) a „mírné“ (Třídy IV–V) z hlediska jejich dopadu na pankreatickou dysfunkci u CF prognosticky významné [96, 97] a může být společně s vyšetřením koncentrací elastázy I ve stolici podkladem pro indikaci pankreatické substituční terapie. Konečně, využití typizace mutací v subjednotkách epitelového sodíkového kanálu (ENaC) zatím není diagnosticky využitelné [98]. Existují i onemocnění „podobná“ CF, která jsou důsledkem mutací v non-CFTR genech, ale tyto případy jsou velmi vzácné [99, 100]. Mimo genetické vyšetření je velmi dobrým prognostickým znakem i biochemický korelát v podobě koncentrace chloridů v potu. V zásadě platí, že čím vyšší jsou koncentrace chloridů v potu, tím „závažnější“ je molekulární dysfunkce a tak i klinický průběh onemocnění [101, 102, 103].
Názvosloví mutací v genu CFTR
Názvosloví mutací v genu CFTR by se nyní mělo principiálně řídit současnými všeobecně akceptovanými návrhy pro jednotné názvosloví mutací od Human Genome Variation Society (HGVS) http://www.genomic.unimelb.edu.au/ mdi/mutnomen/. Nicméně většina mutací v genu CFTR byla identifikována dlouho před publikováním současných návrhů na standardizované názvosloví. Z tohoto důvodu je praktické používat „původní“ názvosloví [104], a to tak, jak je dosud používané v databázi CFGAC (viz výše), které je navíc v současné době celosvětově uznávané a spolupracujícími klinickými pracovišti široce akceptované (tab. 1). K tomu, aby se předešlo chybným interpretacím, by měl výsledkový protokol obsahovat odkaz, podle které nomenklatury (standardní = původní nebo progresivní = genomické) se označení vykazovaných mutací řídí. Velmi dobrý konvertor „Mutalyzer“ mezi oběma názvoslovími lze nalézt na webové stránce – www.lovd.nl/mutalyzer.
Závěr
Specializované genetické poradenství a molekulárně genetické vyšetření nejčastějších mutací v genu CFTR by mělo být integrální součástí diagnostického procesu u pacienta s CF a jeho rodiny. Genetické poradenství v graviditě je nedirektivní a vždy respektuje přání rodiny.
Naším cílem je zlepšit kvalitu života pacientů s CF a jejich rodin ve spolupráci s dalšími specialisty CF center v České republice a nabízet superkonziliární služby v této oblasti.
Podpořeno VZ FNM 00064203(6112) a projekty EU: EuroGentest/EuroCareCF.
Prof. MUDr. Milan Macek ml., DrSc.
Ústav biologie a lékařské genetiky UK 2. LF
V Úvalu 84
150 06 Praha 5
e-mail: milan.macek.jr@lfmotol.cuni.cz
Sources
1. Davis PB. Cystic fibrosis since 1938. Am. J. Respir. Crit. Care Med. 2006;173 : 475–482. American College of Medical Genetics, 2006 ed.: Technical Standards and Guidelines for CFTR Mutation Trstiny, http://www.acmg.net/Pages/ACMG_Activities/stds-2002/cf.htm.
2. Welsh MJ, Ramsey BW, Accurso F, Cutting GR. Cystic fibrosis. In Scriver CR, Beaudet AL, Sly WS, Valle D (eds). The Metabolic and Molecular Basis of Inherited Disease. 8th ed. New York: McGraw-Hill, 2001 : 5121–5188.
3. Cutting GR. Cystic fibrosis In Rimoin DL, Connor JM, Pyeritz RD (eds). Principles and Practice of Medical Genetics. New York: Churchill Livingstone, 1997 : 2685–2717.
4. Vávrová V, a kol. Cystická fibróza. Praha: Grada, 2006.
5. Kosorok MR, Wei W, Farrel PM. The incidence of cystic fibrosis. Statistics in Medicine 1997;15 : 449–462.
6. Houštěk J, Vávrová V. K výskytu cystické fibrosy pankreatu v ČSSR. Čs. Pediat. 1962;17 : 445–451.
7. Holubová A, Balaščáková M, Skalická V, et al. Novorozenecký screening cystické fibrózy v České republice – závěry pilotní studie. Čes.-slov. Pediat. 2007;62(4): 187–195.
8. Southern K, Munck A, Pollitt R, et al. A survey of newborn screening for cystic fibrosis in Europe. Journal of Cystic Fibrosis 2007;6 : 57–65.
9. Dequeker E, Cassiman JJ. Evaluation of CFTR gene mutation testing methods in 136 diagnostic laboratories: report of a large European external quality assessment. Eur. J. Hum. Genet. 1998;6 : 165–175.
10. Dequeker E, Cuppens H, Dodge J, et al. Recommendations for quality improvement in genetic testing for cystic fibrosis European Concerted Action on Cystic Fibrosis. Eur. J. Hum. Genet. 2000;8: S2–S24.
11. Girodon Boulandet E, Cazeneuve C, Goossens M. Screening practices in the CFTR gene ABCC7. Hum. Mutat. 2000;15 : 135–149.
12. Zielenski J, Rozmahel R, Bozon D, et al. Genomic DNA sequence of the cystic fibrosis transmembrane conductance regulator (CFTR) gene. Genomics 1991;10 : 214–228.
13. Kerem B, Rommens JM, Buchanan JA, et al. Identification of the cystic fibrosis gene: genetic analysis. Science 1989;245 : 1073–1080.
14. Riordan JR, Rommens JM, Kerem B, et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA. Science 1989;245 : 1066–1073.
15. Rommens JM, Iannuzzi MC, Kerem B, et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science 1989;245 : 1059–1065.
16. Bobadilla JL, Macek M Jr, Fine JP, Farell P. Cystic fibrosis: a worldwide analysis of CFTR mutations – correlations with incidence data and application to screening. Hum. Mutat. 2002;19 : 575–606.
17. The Molecular Genetic Epidemiology of Cystic Fibrosis. Report of a joint meeting of WHO/ECFTN/ICF (M)A/ECFS http://www.who.int/genomics/publications/ en/ and WHO Geneva, Human Genetics Programme WHO/HGN/CF/WG/04.02.
18. Serre JL, Simon-Bouy B, Mornet E, et al. Studies of RFLP closely linked to the cystic fibrosis locus throughout Europe lead to new considerations in population genetics. Am. J. Hum. Genet. 1990;84 : 449–454.
19. Zielenski J. Genotype and phenotype in cystic fibrosis. Respiration 2000;67 : 117–133.
20. Mickle JE, Cutting GR. Genotypephenotype relationships in cystic fibrosis. Med. Clin. North Am. 2000;84 : 597–607.
21. Rave-Harel N, Kerem E, Nissim-Rafinia M, et al. The molecular basis of partial penetrance of splicing mutations in cystic fibrosis. Am. J. Hum. Genet. 1997;60 : 87–94.
22. Audrezet MP, Chen JM, Raguenes O, et al. Genomic rearrangements in the CFTR gene: extensive allelic heterogeneity and diverse mutational mechanisms. Hum. Mutat. 2004;23 : 343–357.
23. Ferec C, Casals T, Chuzhanova N, et al. Gross genomic rearrangements involving deletions in the CFTR gene: characterization of six new events from a large cohort of hitherto unidentified cystic fibrosis chromosomes and meta-analysis of the underlying mechanisms. Eur. J. Hum. Genet. 2006;14 : 567–576.
24. Morral N, Bertranpetit J, Estivill X, et al. The origin of the major cystic fibrosis mutation (delta F508) in European populations. Nat. Genet. 1994;7 : 169–175.
25. Modiano G, Ciminelli BM, Pignatti PF. Cystic fibrosis: Cystic fibrosis and lactase persistence: a possible correlation. Eur. J. Hum. Genet. 2007;15 : 255–259.
26. Chiba-Falek O, Parad RB, Kerem E, Kerem B. Variable levels of normal RNA in different fetal organs carrying a cystic fibrosis transmembrane conductance regulator splicing mutation. Am. J. Respir. Crit. Care Med. 1999;159 : 1998–2002.
27. Vanscoy LL, Blackman SM, Collaco JM, et al. Heritability of lung disease severity in cystic fibrosis. Am. J. Respir. Crit. Care Med. 2007;175 : 1036–1043.
28. Macek M Jr, Krebsová A, Macek M, et al. Current possibilities of prenatal and postnatal molecular genetic diagnosis of cystic fibrosis in Czech and Slovak Republics. Čes.-slov. Pediat. 1997;52 : 557–564.
29. Lucarelli M, Narzi L, Piergentili R, et al. A 96-well formatted method for exon and exon/intron boundary full sequencing of the CFTR gene. Anal. Biochem. 2006;353 : 226–235.
30. McGinniss MJ, Chen C, Redman JB, et al. Extensive sequencing of the CFTR gene: lessons learned from the first 157 patient samples. Hum. Genet. 2005;118 : 331–338.
31. Dequeker E, Cassiman JJ. Genetic testing and quality control in diagnostic laboratories. Nat. Genet. 2000;25 : 259–260.
32. Pompei F, Ciminelli BM, Bombieri C, et al. Haplotype block structure study of the CFTR gene. Most variants are associated with the M470 allele in several European populations. Eur. J. Hum. Genet. 2006;14(1): 85–93.
33. Groman JD, Karczzeski B, Sheridan M, et al. Phenotypic and genetic characterization of patients with features of “nonclassic” forms of cystic fibrosis. J. Pediatr. 2005;146(5): 675–680.
34. Dörk T, Macek M Jr, Mekus F, et al. Characterization of a novel 21-kb deletion, CFTRdele2,3(21 kb), in the CFTR gene: a cystic fibrosis mutation of Slavic origin common in Central and East Europe. Hum. Genet. 2000;106 : 259–268.
35. Augarten A, Kerem BS, Yahav Y, et al. Mild cystic fibrosis and normal or borderline sweat test in patients with the 3849 + 10 kb C—>T mutation. Lancet 1993;342 : 25–26.
36. Highsmith WE, Burch LH, Zhou Z, et al. A novel mutation in the cystic fibrosis gene in patients with pulmonary disease but normal sweat chloride concentrations. N. Engl. J. Med. 1994;331 : 974–980.
37. De Braekeleer M, Allard C, Leblanc JP, et al. Genotype-phenotype correlation in cystic fibrosis patients compound heterozygous for the A455E mutation. Hum. Genet. 1997;101(2): 208–211.
38. Macek M Jr, Mackova A, Hamosh A, et al. Identification of common cystic fibrosis mutations in African-Americans with cystic fibrosis increases the detection rate to 75%. Am. J. Hum. Genet. 1997;60 : 1122–1127.
39. Burke W, Aitken ML, Chen SH, Scott CR. Variable severity of pulmonary disease in adults with identical cystic fibrosis mutations. Chest 1992;102 : 506–509.
40. Rosenstein BJ, Cutting GR. The diagnosis of cystic fibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel. J. Pediatr. 1998;132 : 589–595.
41. Macek M, Macek M Jr, Krebsová A. Molekulárně genetická diagnostika v prenatální genetické prevenci VVV a chorob. In Hájek Z, Kulovaný E, Macek M (eds). Prenatální diagnostika. Praha: Grada Publishing, 2000.
42. Modiano G, Bombieri C, Ciminelli BM, et al. A large-scale study of the random variability of a coding sequence: a study on the CFTR gene. Eur. J. Hum. Genet. 2005;13 : 184–192.
43. Bombieri C, Giorgi S, Carles S, et al. A new approach for identifying non-pathogenic mutations. An analysis of the cystic fibrosis transmembrane regulator gene in normal individuals. Hum. Genet. 2000;106 : 172–178.
44. Cuppens H, Teng H, Raeymaekers P, et al. CFTR haplotype backgrounds on normal and mutant CFTR genes. Hum. Mol. Genet. 1994;3 : 607–614.
45. Claustres M, Guittard C, Bozon D, et al. Spectrum of CFTR mutations in cystic fibrosis and in congenital absence of the vas deferens in France. Hum. Mutat. 2000;16 : 143–156.
46. Meschede D, Dworniczak B, Behre HM, et al. CFTR gene mutations in men with bilateral ejaculatory-duct obstruction and anomalies of the seminal vesicles. Am. J. Hum. Genet. 1997;61 : 1200–1202.
47. Cohn JA, Noone PG, Jowell PS. Idiopathic pancreatitis related to CFTR: complex inheritance and identification of a modifier gene. Review. J. Invest. Med. 2002;50 : 247S–255S.
48. Sharer N, Schwartz M, Malone G, et al Mutations in the CF gene in patients with chronic pancreatitis. N. Engl. J. Med. 1998;339 : 645–652.
49. Durie P. Pancreatitis and mutations in the cystic fibrosis gene. N. Engl. J. Med. 1998;339 : 687–688.
50. Macek M Jr. Molekulárně genetická podstata akutní/chronické pankreatitidy a pankreatická insuficience u cystické fibrózy. In Dítě P, et al. Onemocnění pankreatu. Praha: Galén, 2002 : 71–124.
51. Arduino C, Gallo M, Brusco A, et al. Polyvariant mutant CFTR genes in patients with chronic pancreatitis. Clin. Genet. 1999;56 : 400–404.
52. Pignatti PF, Bombieri C, Benetazzo M, et al. CFTR gene variant IVS8-5T in disseminated bronchiectasis. Am. J. Hum. Genet. 1996;58(4): 889–892.
53. Hubert D, Fajac I, Bienvenu T, et al. Diagnosis of CF in adults with diffuse bronchiectasis. J. Cyst. Fibros. 2004;3 : 203.
54. Bürger J, Macek M Jr, Sturmann M, et al. Genetic influences in the formation of nasal polyps. Lancet 1991;337 : 974.
55. Wang X, Moylan B, Leopold DA, et al. Mutation in the gene responsible for cystic fibrosis and predisposition to chronic rhinosinusitis in the general population. JAMA 2000;284 : 1814–1819.
56. Miller PW, Hamosh A, Macek M Jr, et al. Cystic fibrosis transmembrane conductance regulator (CFTR) gene mutations in allergic bronchopulmonary aspergillosis. Am. J. Hum. Genet. 1996;59 : 45–51.
57. Castellani C, Lira MG, Frulloni L, et al. Analysis of the entire coding region of the cystic fibrosis transmembrane regulator gene in idiopathic pancreatitis. Hum. Mutat. 2001;18 : 166.
58. Niksic M, Romano M, Buratti E, et al. Functional analysis of cis-acting elements regulating the alternative splicing of human CFTR exon 9. Hum. Mol. Genet. 1999;8 : 2339–2349.
59. Cuppens H, Lin W, Jaspers M, et al. Polyvariant mutant cystic fibrosis transmembrane conductance regulator genes. The polymorphic (TG)n locus explains the partial penetrance of the T5 polymorphism as a disease mutation. J. Clin. Invest. 1998;101 : 487–496.
60. Disset A, Michot C, Harris A, et al. A T3 allele in the CFTR gene exacerbates exon 9 skipping in vas deferens and epididymal cell lines and is associated with Congenital Bilateral Absence of Vas Deferens (CBAVD). Hum. Mutat. 2005;25 : 72–81.
61. Picci L, Cameran M, Scarpa M, et al. TG15 T5 allele in clinically discordant monozygotic twins with cystic fibrosis. Am. J. Med. Genet. 2007;143 : 1936–1937.
62. Cuppens H, Teng H, Raeymaekers P, et al. CFTR haplotype backgrounds on normal and mutant CFTR genes. Hum. Mol. Genet. 1994;3 : 607.
63. Amaral MD, Clarke LA, Ramalho AS, et al. Quantitative methods for the analysis of CFTR transcripts/splicing variants. J. Cyst. Fibros. 2004;3 : 17–23.
64. Ratbi I, Legendre M, Niel F, et al. Detection of cystic fibrosis transmembrane conductance regulator (CFTR) gene rearrangements enriches the mutation spectrum in congenital bilateral absence of the vas deferens and impacts on genetic counselling. Hum. Reprod. 2007;22 : 1285–1291.
65. Groman JD, Hefferon TW, Casals T, et al. Variation in a repeat sequence determines whether a common variant of the cystic fibrosis transmembrane conductance regulator gene is pathogenic or benign. Am. J. Hum. Genet. 2004;74 : 176–179.
66. Pagani F, Stuani C, Tzetis M, et al. New type of disease causing mutations: the example of the composite exonic regulatory elements of splicing in CFTR exon 12. Hum. Mol. Genet. 2003;12 : 1111–1120.
67. Delaney SJ, Rich DP, Thomson SA, et al. Cystic fibrosis transmembrane conductance regulator splice variants are not conserved and fail to produce chloride channels. Nature Genet. 1993;4 : 426–431.
68. Chillon M, Casals T, Mercier B, et al. Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens. N. Engl. J. Med. 1995;332 : 1475–1480.
69. Grody WW, Pressler T, Madsen HO, et al. Laboratory standards and guidelines for population-based cystic fibrosis carrier screening. Genet. Med. 2001;3 : 149–154.
70. Kiesewetter S, Macek M Jr, Davis C, et al. A mutation in CFTR produces different phenotypes depending on chromosomal background. Nat. Genet. 1993;5 : 274–278.
71. Scotet V, Audrezet MP, Roussey M, et al. Immunoreactive trypsin/DNA newborn screening for cystic fibrosis: Should the R117H variant be included in CFTR mutation panels? Pediatrics 2006;118 : 1523–1529.
72. Peckham D, Conway SP, Morton A, et al. Delayed diagnosis of cystic fibrosis associated with R117H on a background of 7T polythymidine tract at intron 8. J. Cyst. Fibros. 2006;5 : 63–65.
73. Buller A, Olson S, Redman JB, et al. Frequency of the cystic fibrosis 3199del6 mutation in individuals heterozygous for I148T. Genet. Med. 2004;6 : 108–109.
74. Rohlfs EM, Zhou Z, Sugarman EA, et al. The I148T CFTR allele occurs on multiple haplotypes: a complex allele is associated with cystic fibrosis. Genet. Med. 2002;4 : 319–323.
75. Watson MS, Cutting GR, Desnick RJ, et al. Cystic fibrosis population carrier screening: 2004 revision of American College of Medical Genetics mutation panel. Genet. Med. 2004;6 : 387–391.
76. Sims EJ, Clark A, McCormick J, et al. Cystic fibrosis diagnosed after 2 months of age leads to worse outcomes and requires more therapy. Pediatrics 2007;119 : 19–28.
77. Macek M, Tomášová H, Hronková J, et al. Changes in gammaglutamyltransferase activity of the amniotic fluid in fetuses with severe disorders of prenatal development. Čs. Pediat. 1988;43 : 129–133.
78. Simon-Bouy B, Satre V, Ferec C, et al. Hyperechogenic fetal bowel: a large French collaborative study of 682 cases. Am. J. Med. Genet. 2003;121A(3): 209–213.
79. Keymolen K, Goossens V, De Rycke M, et al. Clinical outcome of preimplantation genetic diagnosis for cystic fibrosis: The Brussels’ experience. Eur. J. Hum. Gen. 2007;15(7): 752–758.
80. Findlay P. Matthews, Quirke P. Preimplantation genetic diagnosis using fluorescent PCR: results and future developments. J. Assist. Reprod. Genet. 1999; 199–206.
81. Dequeker E, Ramsden S, Grody WW, et al. Quality control in molecular genetic testing. Nat. Rev. Genet. 2001;2 : 717–723.
82. Heng BC. Reluctance of medical proffesionals inadopting natural-cycle and minimal ovarian stimulation protocols in human clinical assisted reproduction. Reprod. Biomed. Online 2007;15(1): 9–11.
83. Sanchez-Albisua I, Borell-Kost S, Mau-Holzmann UA, et al. Increased frequency of severe major anomalies in children conceived by intracytoplasmic sperm injection. Dev. Med. Child Neurol. 2007;49(2): 129–134.
84. Machatková M, Krebsová A, Smetanová I, et al. Chromosome Y microdeletions in Czech men with severe reproductive disorders. Čas. Lék. čes. 2003;142(11): 670–675.
85. Macek M, Vilímová S, Potužníková P, Macek M Jr, a kol. Využití lékařské genetiky v reprodukční medicíně. Čas. Lék. čes. 2002;141(1):28–34.
86. Ogino S, Wilson RB. Bayesian analysis and risk assessment in genetic counseling and testing. JMD 2004;6(1).
87. Warwick WJ, Hansen LG, Brown IV, et al. Sweat chloride: quantitative patch for collection and measurement. Clin-Lab-Sci. 2001;14(3): 155–159.
88. Drumm ML, Konstan MW, Schluchter MD, et al. Genetic modifiers of lung disease in cystic fibrosis. N. Engl. J. Med. 2005;353 : 1443–1453.
89. Garred P, Pressler T, Madsen HO, et al. Association of mannose-binding lectin gene heterogeneity with severity of lung disease and survival in cystic fibrosis. J. Clin. Invest. 1999;104 : 431–437.
90. Dorfman R, Zielenski J. Genotype/phenotype correlations. In Bush A, Alton E, Davies J, Griesenbach U. (eds). Cystic Fibrosis in the 21st Century: Progress in Respiratory Research. Basel: Karger, 2006 : 61–68.
91. Yarden J, Radojkovic D, De Boeck K, et al. Polymorphisms in the mannose binding lectin gene affect the cystic fibrosis pulmonary phenotype. J. Med. Genet. 2004;41 : 629–633.
92. Stonebraker JR, Friedman KJ, Ling SC, et al. Genetic modifiers of severe liver disease in cystic fibrosis: a replication study. Ped. Pulmonol. 2007;Suppl. 30 : 381.
93. Wilschanski M, Rivlin J, Cohen S, et al. Clinical and genetic risk factors for CF-related liver disease. Pediatr. 1999;103 : 52–57.
94. Elborn JS. How can we prevent multisystem complications of cystic fibrosis? Seminars in Respiratory & Critical Care Medicine 2007;28(3): 303–311.
95. Lester LA, Kraut J, Lloyd-Still J, et al. Delta F508 genotype does not predict disease severity in an ethnically diverse cystic fibrosis population. Pediatr. 1994;93 : 114–118.
96. McKone EF, Goss CH, Aitken ML. CFTR genotype as a predictor of prognosis in cystic fibrosis. Chest 2006;130 : 1441–1447.
97. Koch C, Cuppens H, Rainisio M, et al. European Epidemiologic Registry of Cystic Fibrosis (ERCF): comparison of major disease manifestations between patients with different classes of mutations. Pediatr. Pulmonol. 2001;31 : 1–12.
98. Sheridan MB, Fong P, Groman JD, et al. Mutations in the beta subunit of the epithelial Na+ channel in patients with a cystic fibrosis-like syndrome. Hum. Mol. Genet. 2005;14 : 3493–3498.
99. Groman JD, Meyer ME, Wilmott RW, et al. Variant cystic fibrosis phenotypes in the absence of CFTR mutations. N. Engl. J. Med. 2002;347 : 401–407.
100. Mekus F, Ballmann M, Bronsveld I, et al. Cystic-fibrosis-like disease unrelated to the cystic fibrosis transmembrane conductance regulator. Hum. Genet. 1998;102 : 582–586.
101. Welsh MJ, Smith AE. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis. Cell 1993;73 : 1251–1254.
102. Wilschanski M, Zielenski J, Markiewicz D, et al. Correlation of sweat chloride concentration with classes of the cystic fibrosis transmembrane conductance regulator gene mutations. J. Pediatr. 1995;127 : 705–710.
103. Wilschanski M, Dupuis A, Ellis L, et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. Am. J. Respir. Crit. Care Med. 2006;174 : 787–794.
104. Beaudet A, Taji LC. A suggested nomenclature for designating mutations. Hum. Mutat. 1993;2(4): 245–248.
105. Mak V, Jarvi KA, Zielenski J, et al. Higher proportion of intact exon 9 CFTR mRNA in nasal epithelium compared with vas deferens. Hum. Mol. Genet. 1997;6 : 2099–2107.
106. Dörk T, Neumann T, Wulbrand U, et al. Intra and extragenic marker haplotypes of CFTR mutations in cystic fibrosis families. Hum. Genet. 1992;88 : 417–425.
107. Farrell PM, Rosenstein BJ, White TB, et al. Guidelines for Diagnosis of Cystic Fibrosis in the Era of Newborn Screening: Cystic Fibrosis Foundation Consensus Report. Submitted to J. Pediatr.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2008 Issue 2-
All articles in this issue
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Modern Management of Cystic Fibrosis and Its Influence upon General Health and Survival of Czech Patients
- Role of Novel Microbiological Diagnostics in the Care for Patients with Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
- Newborn Screening in the Czech Republic and in Europe
- Present International Projects in the Area of Diagnostics and Therapy of Cystic Fibrosis: Participation of Specialists from the Czech Republic into the Problem Solving
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Newborn Screening in the Czech Republic and in Europe
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

