-
Medical journals
- Career
Autoimunitní puchýřnatá onemocnění: část I. Pemfigus
Authors: H. Jedličková
Authors‘ workplace: Dermatovenerologická klinika Fakultní nemocnice u sv. Anny v Brně, přednostka prof. MUDr. Hana Jedličková, Ph. D. 1
Published in: Čes-slov Derm, 97, 2022, No. 4, p. 144-155
Category: Reviews (Continuing Medical Education)
Overview
Pemfigus patří mezi nejzávažnější kožní onemocnění. Existuje několik klinických jednotek, které se odlišují skladbou protilátek proti autoantigenům, průběhem i odpovědí na terapii. Stále se prohlubuje poznání o patofyziologii tvorby puchýře, v posledních letech se zásadně rozšiřují možnosti terapie, od klasických imunosupresiv k biologické terapii anti-CD20 protilátkami. Cílem tohoto článku je představit stručně současné znalosti o etiopatogenezi, diagnostice, klinice a terapii tohoto onemocnění.
Klíčová slova:
rituximab – pemfigus – desmoglein
ÚVOD
Autoimunitní puchýřnatá onemocnění jsou vzácná, potencionálně letální onemocnění kůže a sliznic. Podle roviny tvorby puchýře je dělíme na dvě skupiny, skupinu pemfigu s tvorbou intraepidemálního puchýře a skupinu s tvorbou subepidermálního puchýře – pemfigoidy a příbuzná onemocnění.
Ve skupině pemfigu v současnosti rozeznáváme několik jednotek, s variacemi cílových antigenů a klinického obrazu (tab. 1).
Table 1. Subtypy pemfigu a jejich cílové antigeny 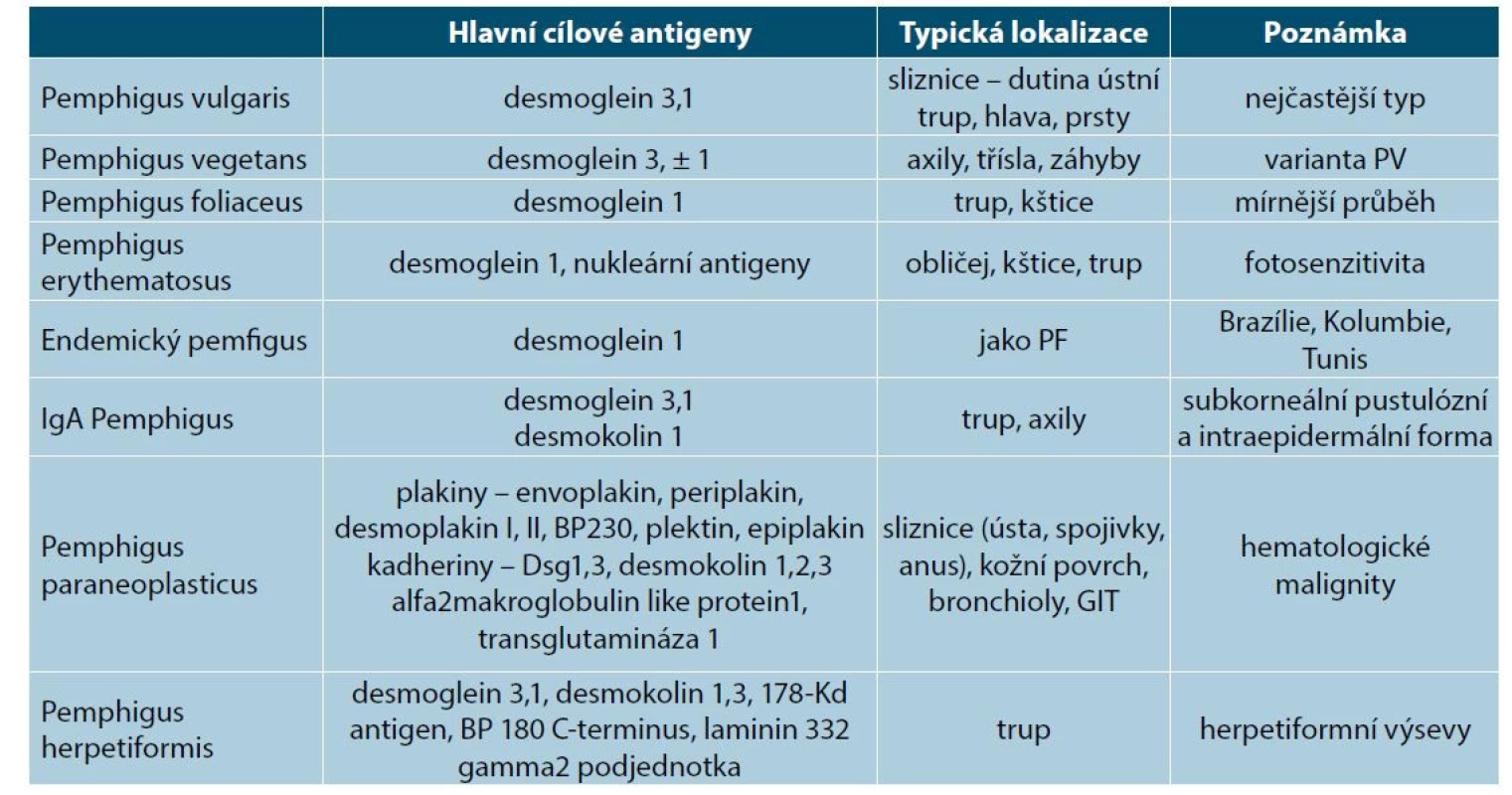
Epidemiologie
Pemfigus je vzácné onemocnění, s heterogenní epidemiologií podle jednotlivých podtypů a populací. Nejčastěji se setkáváme s pemphigus vulgaris/ vegetans (PV, PVeg) (85 % případů) a foliaceus/ erythematosus (PF/PE) (10 % případů). Incidence pemphigus vulgaris je v Evropě asi 6 nových případů na milion obyvatel. Ostatní jednotky jsou velmi vzácné, s celosvětově popsanými desítkami, maximálně stovkami případů a jejich incidence není přesně známa. Výjimkou je endemický pemfigus, který má v místech výskytu (Brazílie, Kolumbie, Tunis) incidenci až 50 případů na milion obyvatel [21].
Genetické faktory
U vulgárního pemfigu je častá asociace s alelami HLA DRB1*04 : 02, DRB1*04 : 01, DRB1*14 : 01/04, DQB1*05 : 03. Alely HLA DRB1*04 : 02 a DQB1*05 : 03 se prokazují jako rizikové u všech populací. Popsány byly i rizikové non HLA geny jako TAP2, IL-6 a ST18 (38). U pemphigus foliaceus jsou to např. alely DRB1*0102 and DRB1*0404, u endemického pemfigu je popsána také silná asociace s některými HLA DRB1 haplotypy. PV je častý u aškenázských Židů [7, 20].
Spouštěcí faktory
Virové infekce, stimulace imunitního systému jako je imunomodulace, očkování. Známá je indukce léky, nejčastěji léky se sulfhydrylovou skupinou (kaptopril, penicilamin), fenoly (acylpyrin), nesteroidními antiflogistiky (diklofenak, piroxikam) aj. [10].
Asociovaná onemocnění
Nejčastěji je udávána asociace s thymomem a Castlemanovou nemocí (PV, PF i PNP), často mají nemocní další autoimunitní onemocnění, jako je SLE, myastenia gravis (u thymomu), tyreopatie, revmatoidní artritida. Nově je popisována i asociace s neurologickými poruchami, anxietou a depresí [22]. Častá je osteoporóza, a to i nezávisle na kortikosteroidní terapii [41]. Zdá se, že významná je i asociace s psoriázou [20]. Nádorová onemocnění popsaná u PV jsou karcinomy ezofagu, laryngu, kolon, plic, leukémie, lymfomy aj. [20].
Věk a pohlaví
Onemocnění začíná ve středním věku, mezi 30–60 roky, u mladších osob se vyskytuje zřídka, vzácný juvenilní pemphigus vulgaris se může objevit v pubertě. Děti mohou být postiženy u endemického pemfigu a PNP. PV postihuje muže a ženy stejně. U tuniského PF jsou častěji postiženy ženy [21].
Mortalita
U PV mortalita po zavedení kortikosteroidů do léčby klesla z 30–75% na 5% [5, 37]. Pacienti mají 10 - a 20leté celkové přežití 89,7 % a 66,3 % [15], v porovnání s věkově srovnatelnou populací je ale mortalita 3,3krát vyšší [24]. Morbidita a mortalita u pemfigu je způsobena spíše dlouhodobými komplikacemi než vlastní aktivitou onemocnění. Nejčastější příčinou smrti jsou infekce, pneumonie a sepse. Riziko úmrtí na pneumonii je u PV 22,6krát vyšší než u srovnatelné populace [23].
PF probíhá zpravidla mírněji, mortalita není vyšší než u srovnatelné populace, i když recentní studie z Korey udává vyšší standardizovanou úmrtnost [26].
Nejvyšší mortalitu má paraneoplastický pemfigus (PNP), pětileté přežití je 38 % [27].
Etiopatogeneze
Hlavními autoantigeny u pemfigu jsou desmogleiny 1 a 3, což jsou adhezivní glykoproteiny ze skupiny kadherinů E, které jsou strukturální součástí desmozomu (obr. 1). U PV je nejdůležitějším autoantigenem desmoglein 3(Dsg3). Autoprotilátky jsou převážně třídy IgG4, které se nezapojují do aktivace komplementu, ačkoliv komplement je aktivován. Nejdůležitějším cílem protilátek jsou extracelulární domény Dgs3 EC1 a EC2. Autoprotilátky navázané na Dsg3 vyvolají akantolýzu – rozvolnění desmozomů keratinocytů. Anti Dsg3 protilátky se navazují i na pool extradesmozomálního Dsg3. Ztráta soudržnosti keratinocytů vede ke vzniku křehkého puchýře. Původně se za hlavní pochod předpokládal mechanismus tzv. steric hindrance – prostorové přestavení molekul Dsg, které po navázání protilátek antiDsg přestávají být funkční, v desmozomu se nevážou, podléhají endocytóze a netvoří se ani desmozomy nové [7]. Nicméně stále přibývají poznatky, že akantolýza je ovlivněna řadou dalších mechanismů, aktivují se signální cytokinové dráhy, apoptóza a oxidační stres. Ztrátu soudržnosti keratinocytů ovlivňují např. p38MAPK (p38 mitogenem aktivovaná proteinkináza), MK2 (MAPK aktivovaná proteinkináza 2), Ca++, proteinkináza C, Src, EGFR, RhoA, c-Myc, glykogen syntáza kináza 3, kaspázy [28, 34, 39]. Na tvorbě puchýře se podílí i FasL, TNF alfa, IL1beta, IL6 [34]. Popsáno je uvolnění intermediárních filament z desmozomu a poškození mitochondrií [34]. Stále se zkoumá význam apoptózy, není jednoznačně objasněno, zda předchází, či následuje rozvolnění desmozomů [31].
Image 1. Schéma desmozomu 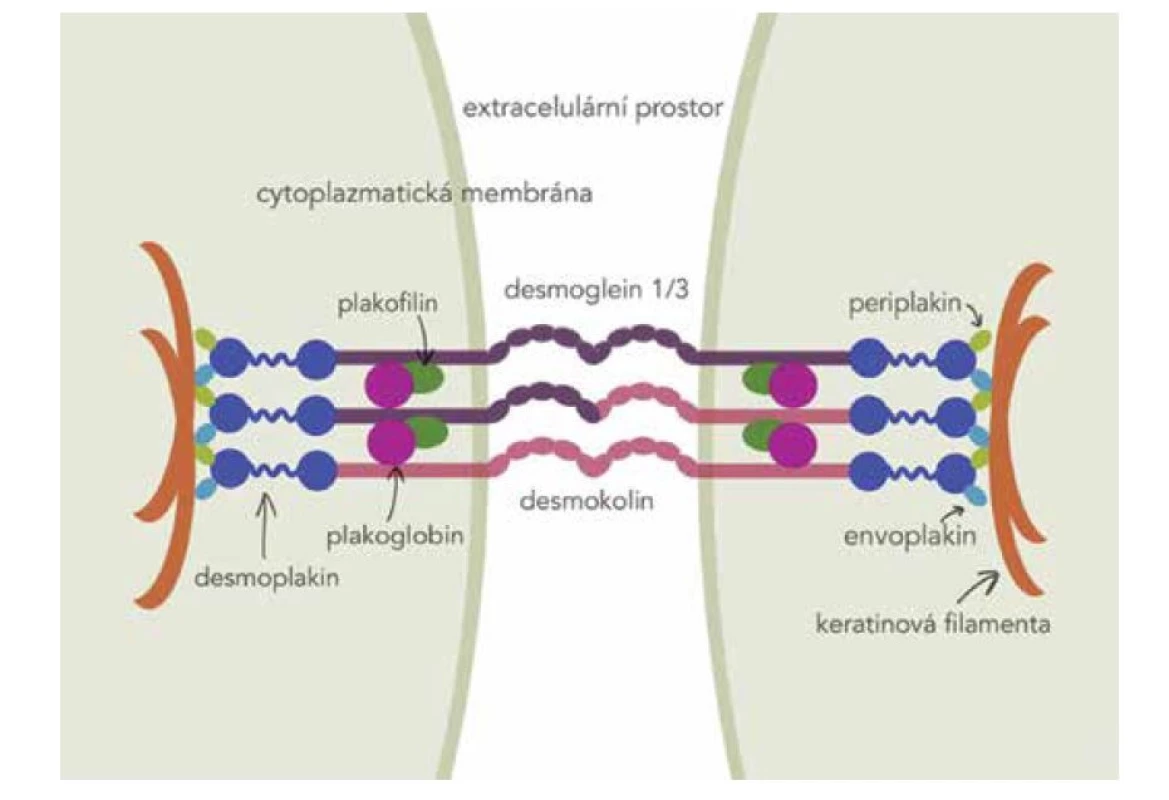
(M. Jedličková volně podle Washkeho a Hertla) Dsg3 a Dsg1 se liší expresí v rohovějícím a nerohovějícím epitelu. U slizničního pemfigu prokazujeme protilátky proti Dsg3, zatímco u PF pouze proti Dsg1. U PV pak detekujeme protilátky proti Dsg3 i 1. Rozdílný klinický obraz vysvětluje kompenzační teorie. Dsg1 je exprimován v celé epidermis, nejvíce v horní třetině epitelu, ve sliznici je silnější exprese Dsg3 než Dsg1. U pacientů s pouze antiDsg1 protilátkami se objevují superficiální puchýře na kůži, protože v dolní části epidermis a na sliznicích ztrátu kompenzuje Dsg3. Na sliznicích pak u pacientů s antiDsg3 protilátkami Dsg1 nestačí kompenzovat ztrátu funkce Dsg3, klinickým obrazem je slizniční PV [7]. Asi u třetiny pacientů nejsou antiDsg protilátky detekovány.
Non Dsg autoantigeny u PV
Nejvýznamnějšími dalšími autoantigeny jsou desmokoliny 1 a 3.
V současnosti již bylo detekováno téměř 50 dalších autoprotilátek se zatím neobjasněným klinickým významem. Řada z nich je patogenních, zasahuje do procesu akantolýzy, ale jen v součinnosti s ostatními faktory. Jsou to protilátky proti muskarinovým a nikotinovým acetylcholinovým receptorům, proti proteinům mitochondriím, tyreoidální peroxidáze, dalším adhezivním molekulám keratinocytů (plakofilin, plakoglobin, kadherin E aj.) HLA antigenům aj. [11]. Zajímavé jsou autoprotilátky proti hSPCA1 – Ca2+/Mn2±ATPáze, enzymu, který kóduje ATP2C1, mutovaný u familiárního pemfigu [2].
Tvorba puchýře je pak výsledkem komplexních dějů.
KLINICKÝ OBRAZ A CHARAKTERISTIKA PODTYPŮ
Pemphigus vulgaris postihuje kůži a sliznice. Projevy začínají ve většině případů v ústech, jako slizniční pemfigus, po týdnech, spíše měsících, dochází k rozšíření autoimunitní T a B buněčné reakce, rozšíření cílových antigenů, jako tzv. šíření epitopů, a zesílení tvorby autoprotilátek, s projevy i na kůži pod obrazem mukokutánního pemfigu. Postižena bývá dutina ústní, nazofarynx, larynx, ezofagus, oční víčka a spojivka, genitál, anus. Na bukální sliznici, patře, na jazyku a na rtech se tvoří velké bolestivé afty s pablánami, v subakutním stavu bývá sliznice houbovitá, rozbrázděná. Pacienti mohou chraptět nebo mít obtíže s polykáním. Predilekční místa tvorby puchýřů na kůži jsou oblast okolo nosu, kštice, trup. Končetiny jsou postiženy méně často – především dolní, s projevy na stehnech a na prstech kolem nehtů. Běžná je bakteriální superinfekce. Po odhojení jsou časté pozánětlivé pigmentace, na kůži pemfigus nejizví, ale ve kštici mohou zůstat alopetická ložiska (obr. 2, 3, 4, 5).
Image 2. Pemphigus vulgaris, postižení sliznic 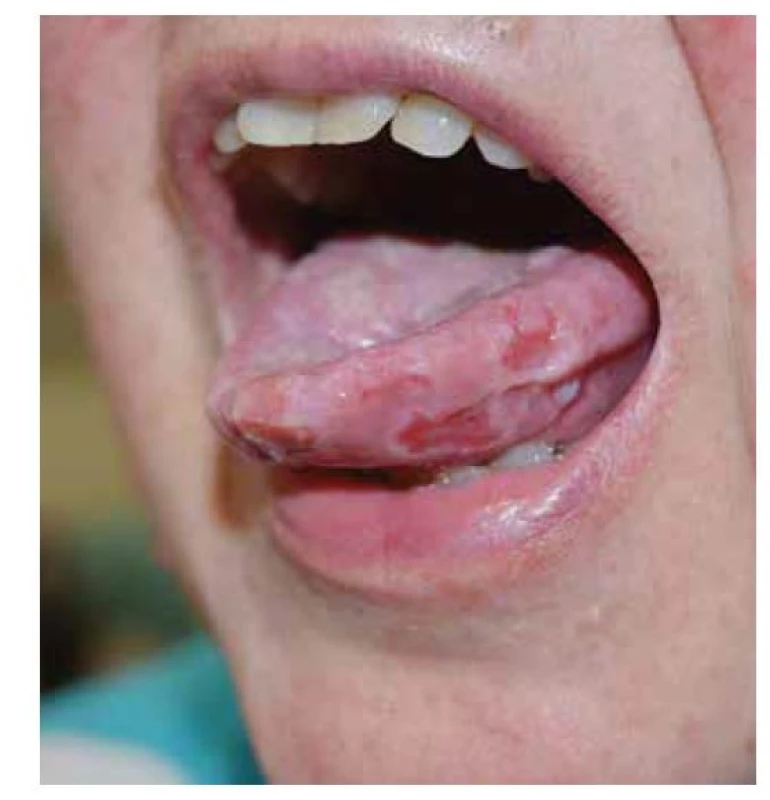
Image 3. Pemphigus vulgaris, těžký 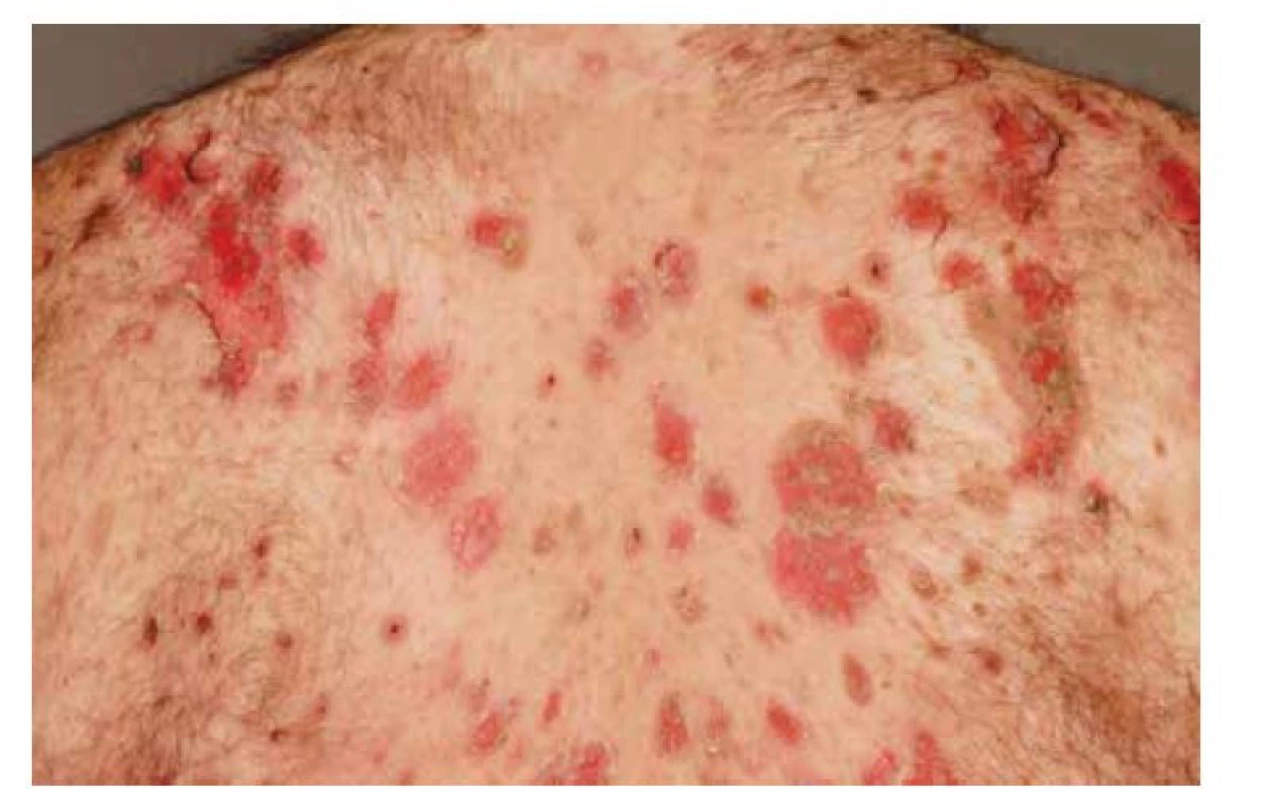
Image 4. Pemphigus vulgaris, středně těžký 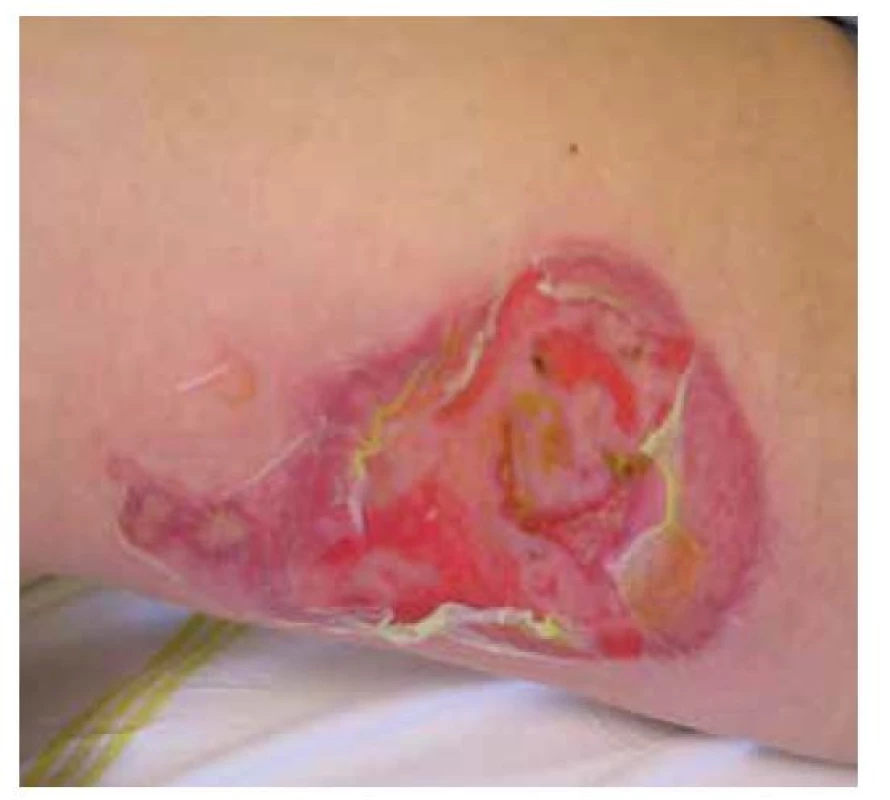
Image 5. Pemphigus vulgaris, postižení kštice 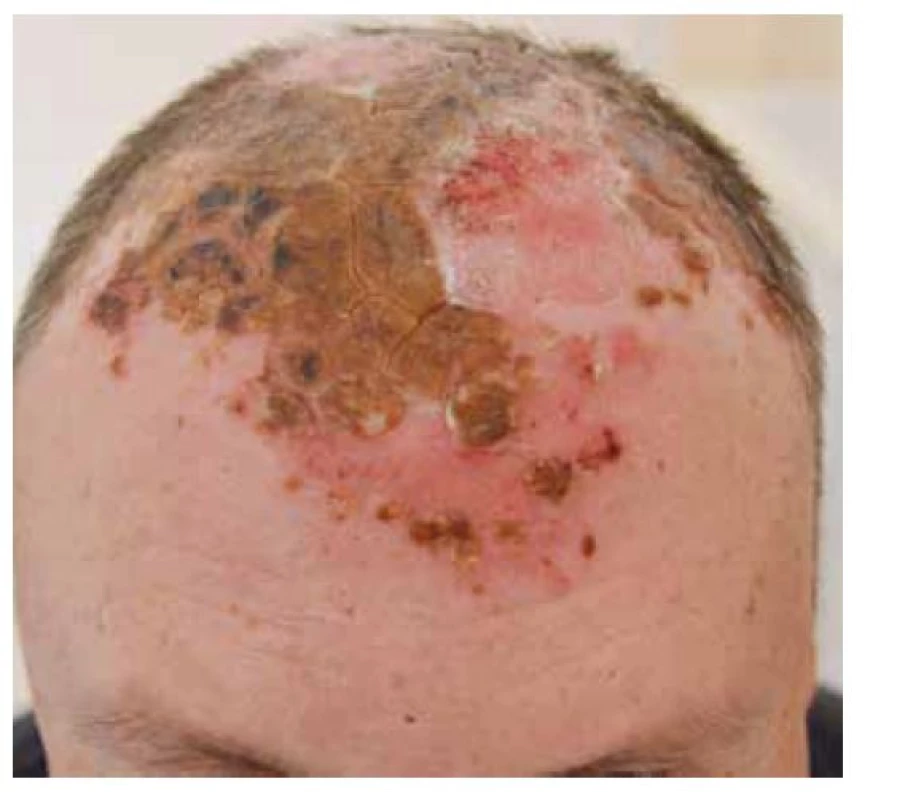
(Pozn. Projevy v ústech, tzv pyostomatitis vegetans, zaměnitelné s pemfigem se vyskytují u zánětlivých střevních onemocnění. Vztah k pemfigu zatím nebyl potvrzen.)
Pemphigus vegetans je variantou PV s tvorbou verukózních a papilomatózních vegetací ve flexurálních a intertriginózních lokalizacích, nejčastěji v tříslech a na přechodech kůže a sliznic. Klinicky můžeme ještě rozlišit dva podtypy – typ Neumann, u kterého se vegetující plaky vytvoří v místech puchýřů, a typ Hallopeau, u kterého se vyskytují pustuly (obr. 6).
Image 6. Pemphigus vegetans, typ Neumann 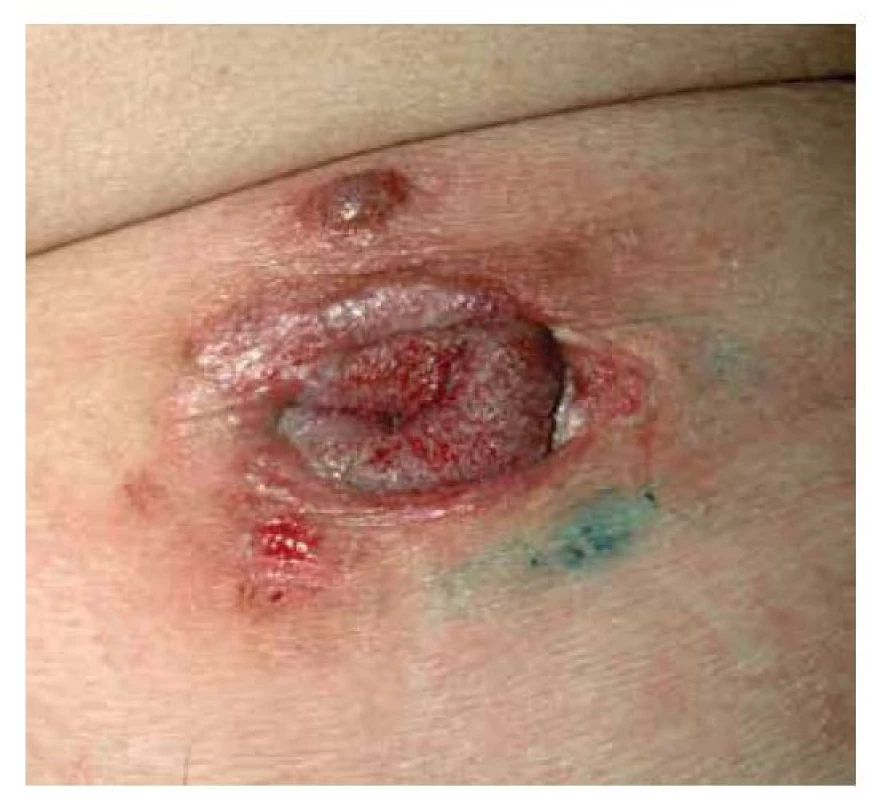
Vegetující projevy se mohou vyskytnout i u PV, u obou onemocnění detekujeme protilátky proti desmogleinům 1 a 3.
Pemphigus foliaceus je mírnějším typem pemfigu, s lepší prognózou. V klinickém obraze pozorujeme numulární červené terčíky, někdy mokvající, v okrajích čerstvých morf lze detekovat strženou epidermis. Častěji ale terčíky kryje šupinka, u rozsáhlých forem se šupiny vrství a vrstvení připomíná listové těsto. Projevy bývají v seboroické predilekci, ve střední části zad, na hrudníku, ale i kolem očí, ve kštici, v intertriginózních lokalizacích. Méně časté jsou splývající erytematózní plochy, které mohou progredovat do erytrodermie. Sliznice nebývají postiženy. Starší název pemphigus seborrhoicus upozorňuje na možnost záměny se seboroickou dermatitidou. PF lze zaměnit i za psoriázu či numulární ekzém (obr. 7, 8).
Image 7. Pemphigus foliaceus, detail 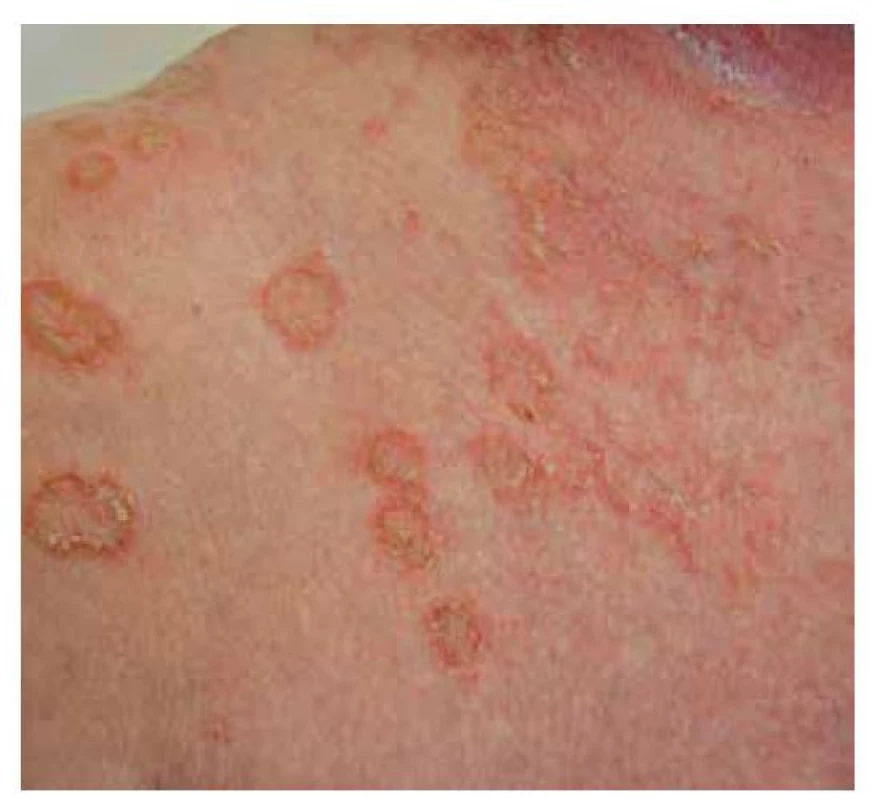
Image 8. Pemphigus foliaceus, postižení periorbitálně 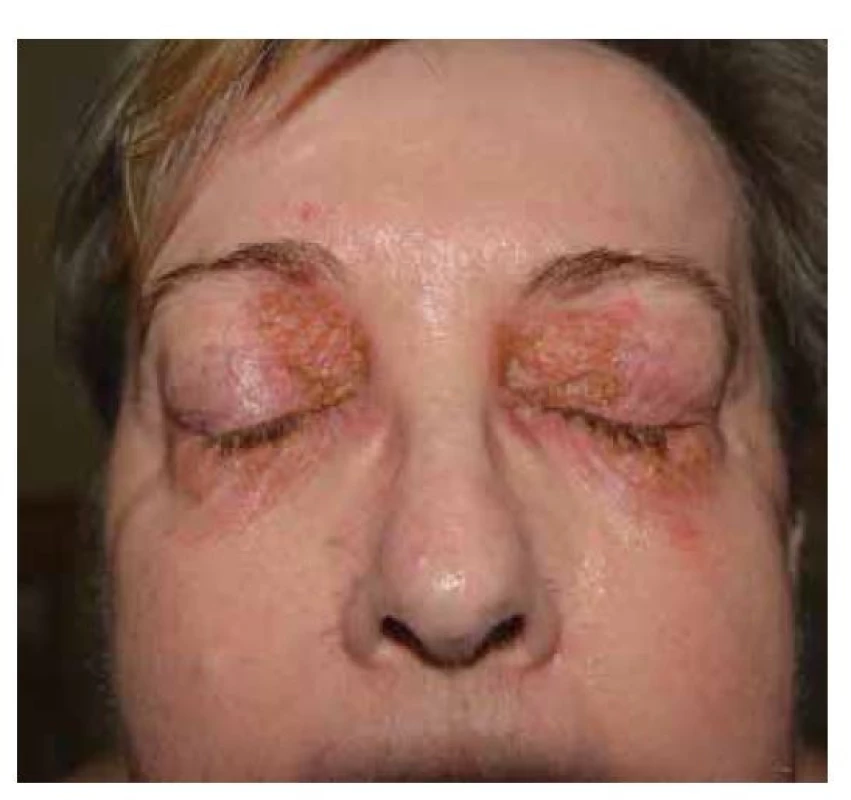
Variantou PF je pemphigus erythematosus, neboli morbus Senear Usher, s fotosenzitivitou, převahou projevů v solární lokalizaci, včetně exantému připomínají cího motýlka u LE a přítomností antinukleárních protilátek. Pacienti nesplňují kritéria pro dg. LE, ačkoliv LE může být asociováno s pemfigem.
Endemický pemfigus je variantou pemfigus foliaceus, který se vyskytuje endemicky v Brazílii (fogo selvagem), Kolumbii a dalších jihoamerických zemích a v Tunisu. Epidemiologie je odlišná od PF, onemocnění postihuje mladší subjekty, i děti, může být familiární. Nejlépe prostudovaný endemický pemfigus v Brazílii se vyskytuje v chudých venkovských oblastech, předpokládá se souvislost s napadením hmyzem, především muškou Simulium nigrimanum a reakcí na antigeny ze slin [12]. Zajímavé je, že prevalence v posledních letech klesá, ze 3 % na 2,3 % od 80. let do roku 2001, zřejmě v souvislosti se zlepšováním životních podmínek [1]. Fogo selvagem má klinický obraz obdobný jako PF.
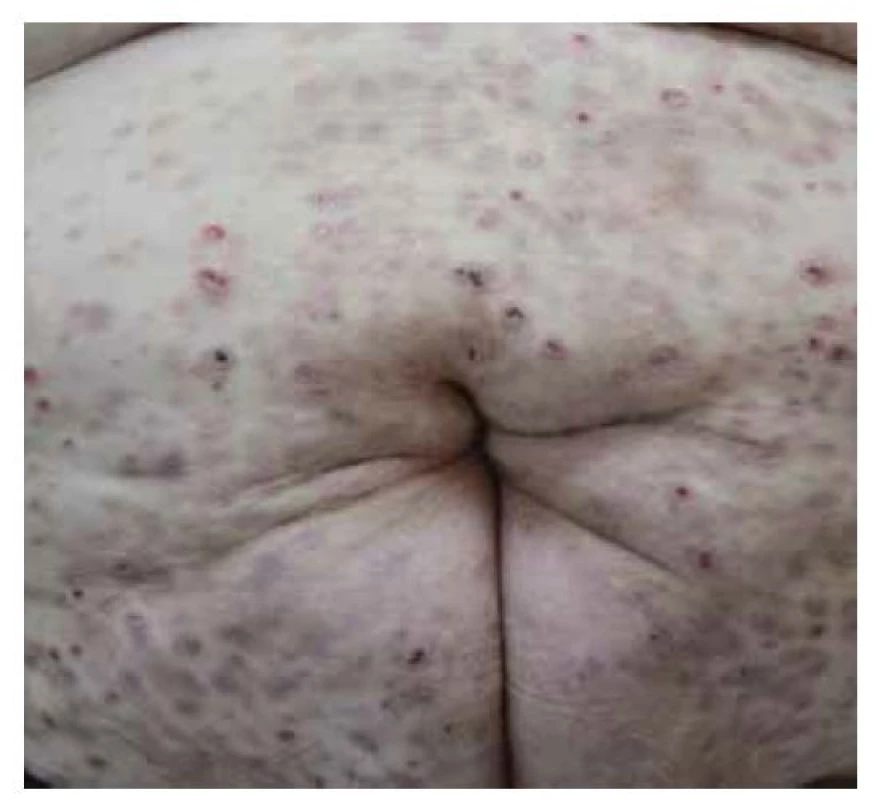
IgA pemphigus je vzácná varianta s autoprotilátkami třídy IgA, které jsou namířeny proti desmokolinu 1 (podtyp podobný subkorneální pustulóze), či Dsg1 a 3 (intraepidermální varianta). Typické jsou drobné pustuly v circinární konfiguraci, na trupu, v axilách. Onemocnění může být asociováno s IgA gamapatií. V diferenciální diagnóze je těžké odlišit subkorneální pustulózu (obr. 9).
Paraneoplastický pemfigus, nazývaný též paraneoplastický autoimunitní multiorgánový syndrom (PAMS) je vzácné onemocnění s vysokou letalitou, které se vyskytuje u pacientů s hematologickými, převážně lymfoproliferativními malignitami – non - i Hodgkinskými lymfomy, chronickou lymfatickou leukemií, monoklonální gamapatií, Morbus Waldenström, thymomem či Castlemanovou chorobou [19]. Asociace s karcinomy a sarkomy je méně častá. Popsána byla i indukce cytostatiky a radioterapií [30]. Kromě postižení kůže (puchýře, multiformní projevy až charakteru TEN, lichenoidní papuly, urtika, erytrodermie), rtů a sliznic (erozivní stomatitida, postižení faryngu, ezofagu, spojivek, anu) se projevuje i postižení respiračního epitelu jako obliterující bronchiolitida, s obstrukčním plicním onemocněním jako častou příčinou úmrtí. Dalšími postiženými orgány mohou být tlusté střevo, ledviny, asociována bývá autoimunitní tyreoiditida, myasthenia gravis s postižením svalů. Definované autoprotilátky se tvoří proti plakinům envoplakinu, periplakinu desmoplakinům I, II, epiplakinu, antigenu bulózního pemfigoidu 1 a 2, plektinu, kadherinům desmogleinu 1 a 3, desmokolinům 1,2,3, alfa-2-makroglobulinu-like-1 proteinu, nově byly zjištěny i protilátky proti tranglutamináze 1 [25]. Vysoká letalita souvisí s plicním postižením, septickými komplikacemi. Antitumorózní léčba většinou nemá na PNP efekt, i když u resekabilních tumorů může dojít k remisi [40].
Pemphigus herpetiformis je popisován vzácně. Onemocnění má stejné cílové antigeny jako PV, klinicky je charakterizováno herpetiformně konfigurovanými puchýřky, histologicky nacházíme eozinofilní a neutrofilní spongiózu a akantolýzu. Od roku 1975 bylo popsáno asi 100 případů, nově se rozšířilo spektrum autoantigenů o Dsc1, Dsc3 [4, 18]. Onemocnění nemá vztah k dermatitis herpetiformis, dobře reaguje na dapson.
Pro klinické hodnocení onemocnění se používají nejčastěji skórovací systémy ABSIS (autoimmune bullous skin disorder intensity score) a PDAI (pemphigus disease area index). (tab. 3) Dalším nástrojem je BSA (body surface area). Mírný PV má PDAI ≤ 15 a BSA pod 5 %, středně těžký pemfigus má skóre ≥ 16 a těžký pemfigus ≥ 45. ABSIS počítá rozsah pomocí BSA a rozsahu postižení, hodnotí i subjektivní obtíže, tj. omezení normálního příjmu potravy. Mírný pemfigus má 0–16 bodů, středně těžký ≥ 17 a těžký ≥ 53 bodů [13]. Pro hodnocení postižení dutiny ústní byl také vyvinut systém POLIS (Pemphigus Oral Lesions Intensity Score) [33].
Table 3. Hodnocení závažnosti pemfigu (Pemphigus Disease Area Index – PDAI, assessment of this severity score) 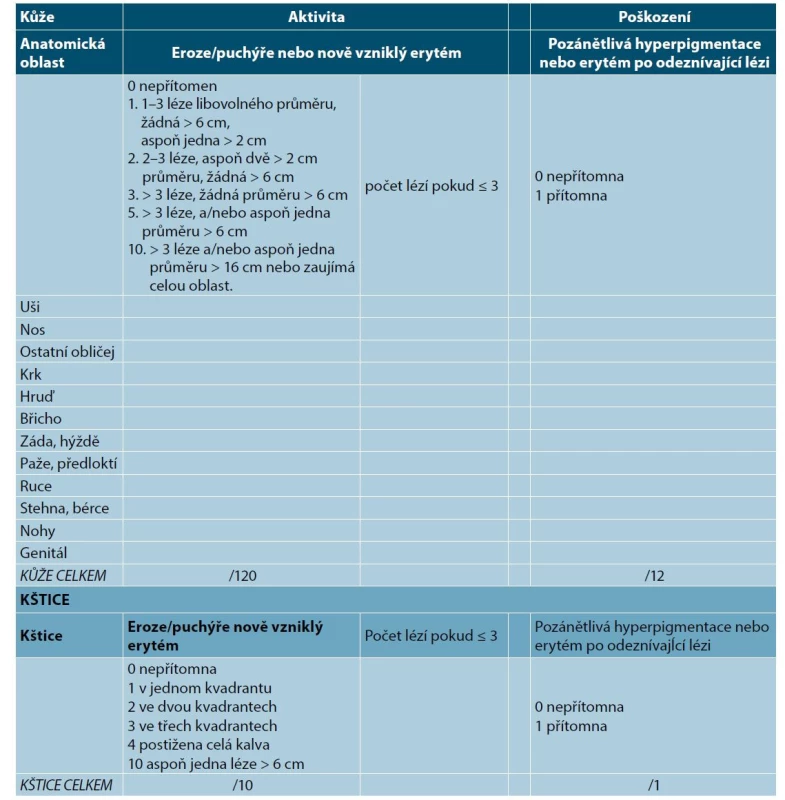
DIAGNOSTIKA
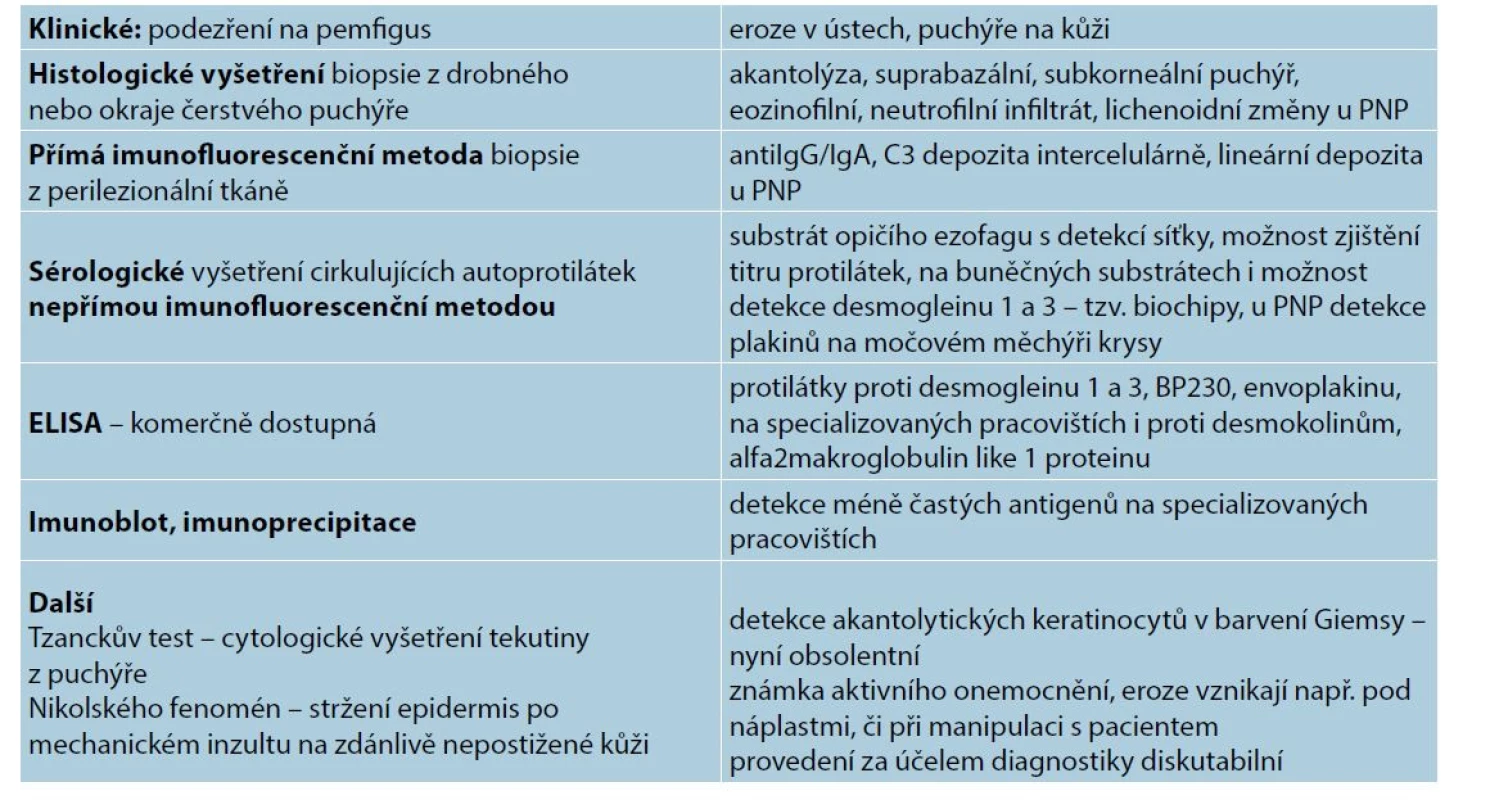
Diagnóza je stanovena na základě klinického obrazu, histologického a imunofluorescenčního vyšetření a vyšetření autoprotilátek v séru. U klasického PV jsou zpravidla všechna vyšetření pozitivní. U slizničního vulgárního pemfigu i u ostatních typů pemfigu nemusí být detekovány protilátky proti desmogleinům a ostatní vyšetření nemusí být jednoznačná, případně nejsou k dispozici, diagnóza tak může být obtížná.
Histologické vyšetření
U vulgárního pemfigu nacházíme intraepidermální puchýř s rovinou štěpení nad bazální vrstvou keratinocytů, která připomíná řadu náhrobních kamenů. V puchýři pak nacházíme volné akantolytické keratinocyty, které mají okrouhlý tvar. V zánětlivém infiltrátu převažují eozinofily, s menší příměsí neutrofilů a lymfocytů (obr. 10).
Image 10. Pemphigus vulgaris 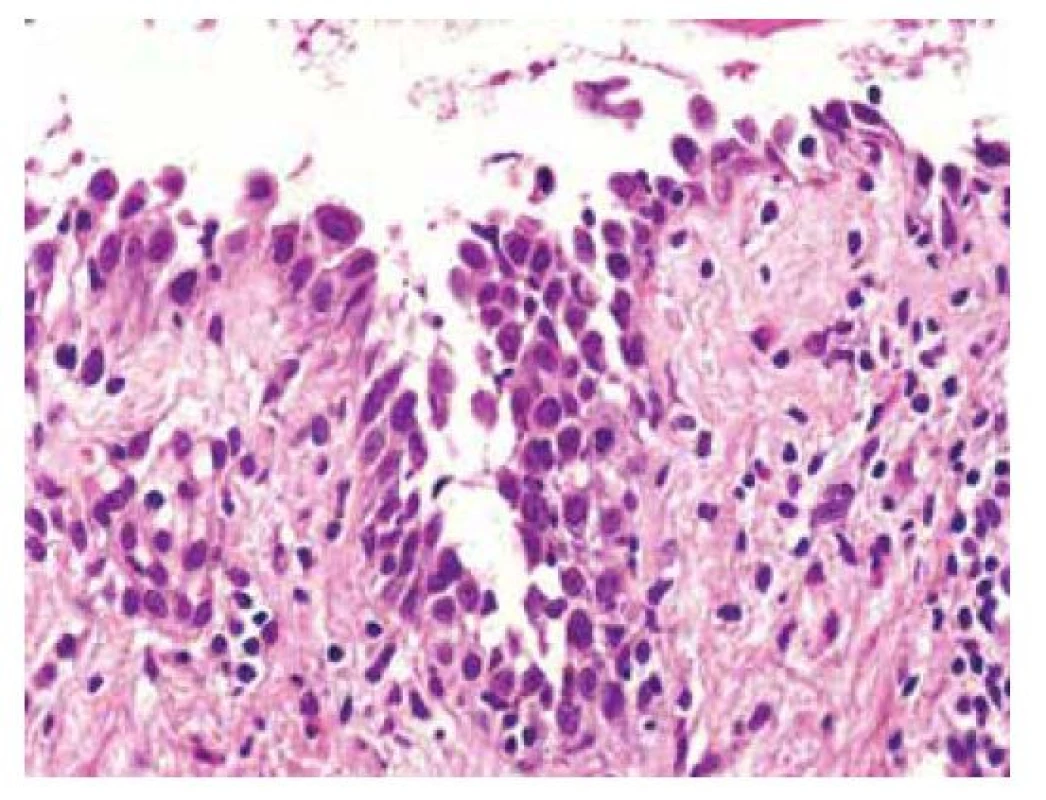
(hematoxylin eosin, původní zvětšení 400x, jfeit@atlases.muni.cz) Pemphigus vegetans může mít akantolýzu jen naznačenu, např. rozvolněním desmozomů připomínajícím spongiózu, provázenou infiltrátem eozinofilů.
U pemphigus foliaceus je rovina štěpení až na úrovni stratum granulosum. Akantolytické keratinocyty mohou připomínat odlupující se korneocyty ve stratum corneum, či dyskeratotické keratinocyty u Groverovy choroby. Zánětlivý infiltrát nebývá výrazný, řídce neutrofily a eozinofily.
U PNP nacházíme kromě suprabazální akantolýzy nekrózu keratinocytů, vakuolární degeneraci bazální vrstvy i se subepiteliálním puchýřem a lichenoidní infiltrát v přilehlém koriu. Nález se může lišit z různých míst.
IgA pemphigus má dvě varianty. Subkorneální pustulóze podobná varianta má subkorneální pustulky s nekonstantně detekovanou akantolýzou, intraepidermální varianta pak neutrofilní spongiózu, s nečetnými eozinofily.
Pemphigus herpetiformis vykazuje eozinofilní, popř. neutrofilní spongiózu, detekovatelná je i akantolýza.
Přímé imunofluorescenční vyšetření
IF vyšetření se provádí na zmražené tkáni, pro transport je možná fixace maleimidem (Michelovo medium). Standardně se používají protilátky proti lidskému IgG a C3 složce komplementu, které detekují intercelulárně navázané autoprotilátky. Současně s anti IgG mohou být detekovány i protilátky proti IgA. Varianta IgG/IgA pemfigu je zřejmě jen podtypem vulgárního pemfigu. Samotná přítomnost IgA protilátek ukazuje na vzácný IgA pemfigus. Vychytávání anti IgG v horní třetině epidermis může ukazovat na PF. IgM se intercelulárně nevychytává, může být součástí imunokomplexů. Fibrin, jako tkáňové lepidlo, je detekován nespecificky v místech poškození. Obecným problémem je křehkost vzorku, histopatolog nezřídka hodnotí poškozený epitel, kde může být IF nespecifická. ICS je nutno detekovat perilezionálně. Záměna za nespecifické barvení může nastat u familiárního pemfigu.
Vyšetření cirkulujících autoprotilátek
Autoprotilátková reakce u pemfigu je zamířena proti strukturám desmozomu. Hlavními autoantigeny jsou desmoglein 1 a 3, ačkoliv autoprotilátky mohou být namířeny i proti dalším molekulám.
Nepřímé imunofluorescenční vyšetření
Senzitivita vyšetření je vysoká, až 100%, podle titru lze posuzovat aktivitu onemocnění i reakci na terapii. Provádí se vstupně a poté v ročních intervalech ke zhodnocení aktivity protilátek (obr. 11).
Image 11. Nepřímá imunofluorescence – pozitivita ICS – IgG protilátky u pemfigu, opičí ezofagus 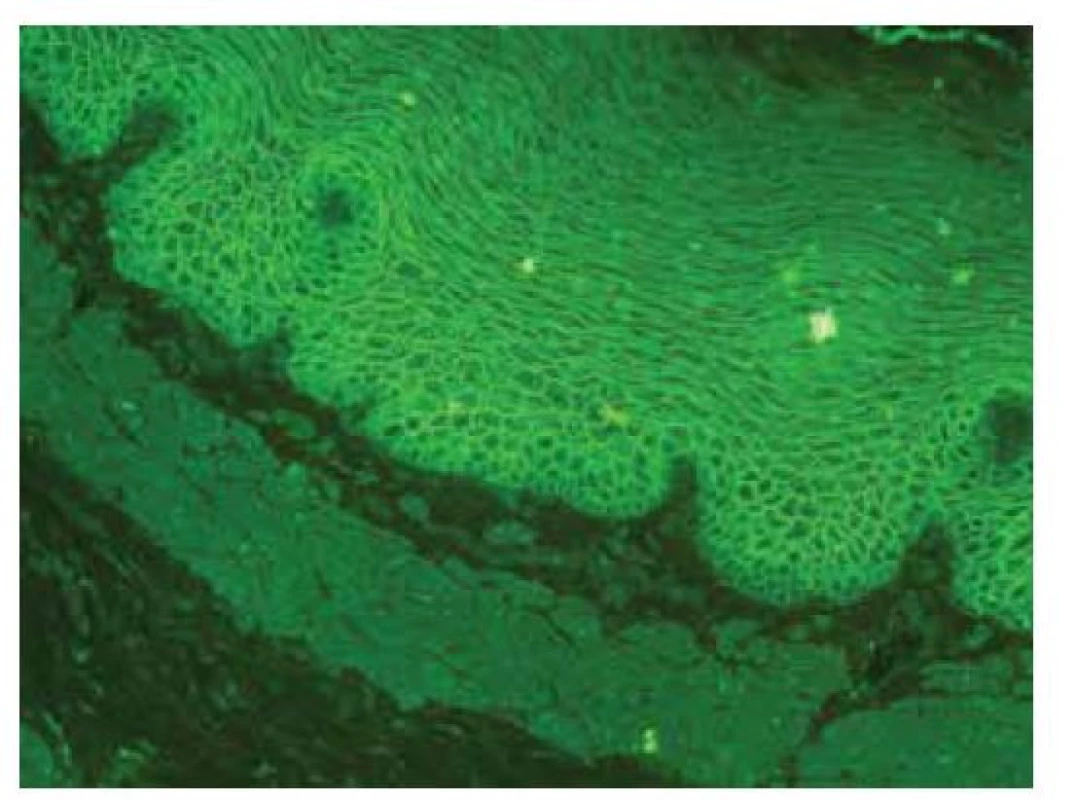
(Pozn. Pozitivní IF nález je někdy v nízkém titru detekován i u nemocných se zánětlivými střevními onemocněními. Vztah IBD s pemfigem zatím nebyl objasněn. Může se jednat o asociaci obou onemocnění nebo o epifenomén. Viz také pyostomatitis vegetans.)
ELISA vyšetření
Komerční ELISA vyšetření je již v České republice dostupné, provádí ho několik laboratoří, mělo by být provedeno u každého pacienta. Dostupná je detekce protilátek proti desmogleinu 1 a 3, BP230, envoplakinu, na specializovaných pracovištích mimo ČR lze vyšetřit i protilátky proti desmokolinům aj.
Dalšími možnými metodami detekce autoprotilátek jsou imunoblot a imunoprecipitace.
TERAPIE
Prognózu onemocnění výrazně zlepšilo použití kortikosteroidů v 60. letech minulého století. Výrazně se snížila mortalita onemocnění, nicméně kvalitu života nemocných dále ovlivňují závažné nežádoucí účinky kortikosteroidů, které jen mírně snížila kortikoidy šetřící imunosupresiva. Dalším výrazným milníkem je až zavedení antiCD20 protilátky rituximabu do léčby. Rituximab (Rtx) je chimérická myší/lidská monoklonální protilátka IgG1 proti CD20 antigenu B lymfocytů. CD20 antigen je specifický marker přítomný na normálních i maligních B lymfocytech, není přítomen na kmenových hematopoetických buňkách, plazmatických buňkách, necirkuluje volně. Po téměř 15 letech off-label používání je efekt rituximabu nezpochybnitelný a postupně se dostal až do první linie léčby pemfigu [17].
V přehledu terapie proto uvádíme především nejnovější doporučení léčby podle Doporučených postupů EADV z roku 2020, kde je Rtx indikován u pemphigus vulgaris a také i u pemphigus foliaceus jako terapie první linie. Podává se v revmatologickém schématu dvou infuzí ve dvou týdnech, s opakováním po 6–12 měsících podle stavu [16].
Mírný pemfigus vulgaris (BSA méně než 5% a/nebo limitované orální postižení bez omezení příjmu potravy a/nebo PDAI ≤ 15)
1. Rituximab 2 g tj. 1 g v infuzi po 14 dnech v monoterapii nebo s prednisonem 0,5 mg/kg/d s postupným ukončením kortikoterapie do 4 měsíců
nebo
2. Prednison 0,5–1,0 mg/kg/d v monoterapii nebo s azathioprinem či mykofenolát mofetilem.
Mírný pemfigus foliaceus
1. Dapson 50–100 mg/d, prednison 0,5–1,0 mg/kg/d
nebo
2. Rituximab 2 g tj. 1 g v infuzi po 14 dnech, v monoterapii nebo s kortikosteroidy 0,5 mg/kg/d.
Středně těžký a těžký pemphigus vulgaris a pemphigus foliaceus
(BSA > 5% a/nebo orální postižení s omezením příjmu potravy a/nebo PDAI ≥ 16, resp. > 45)
1. Rituximab 2 g, tj. 1 g v infuzi po 14 dnech, s prednisonem 1 mg/kg/d se snižováním k vysazení do 6 měsíců
nebo
2. Prednison 1–1,5 mg/kg/d samostatně či v kombinaci s imunosupresivem – azathioprin 1–2,5 mg/kg/d nebo mykofenolát mofetil 2 g/d nebo mykofenolová kyselina 1440 mg/d.
Pokud do 4 týdnů není efekt
a) pacienti s rituximabem – zvýšit prednison na 1,5 mg/ kg/d nebo kortikosteroidy v pulsech
b) pacienti jen s prednisonem – přidat rituximab nebo imunosupresivum.
Pokud je efekt po 6 měsících
a) možno zvážit u pacientů v kompletní remisi na terapii/ bez terapie
rituximab 500 mg – 1 g,
zvláště pokud měli vstupně těžký pemfigus a mají stále vysoké titry protilátek
b) u pacientů bez kompletní remise 2 g rituximabu.
Udržovací terapie po 12 a 18 měsících
U pacientů v remisi na terapii/bez terapie rituximab 500 mg, zvláště u pacientů s pozitivními protilátkami.
Terapie relapsu patří do rukou specialisty na léčbu pemfigu [modifikováno podle Joly et al., 16].
Toto schéma jistě není vyčerpávající, nicméně je dobrým vodítkem pro moderní léčbu pemfigu. Zatím nejsou k dispozici dlouhodobá data pro další udržovací terapii, lze předpokládat navození dlouhodobé či trvalé remise. Část pacientů dosáhne remise po prvním pulsu Rtx, většinou ale onemocnění relabuje po 6–24 měsících. Marker remise se zatím hledá. Známá je korelace titru antiDsg1 s pravděpodobností relapsu, nicméně spolehlivější budou spíše hodnoty specifických B nebo T lymfocytů [7]. Rituximab působí na B lymfocyty, neovlivňuje dlouho žijící plazmatické buňky. AntiDsg protilátky jsou zřejmě produkovány krátce žijícími plazmoblasty, které potřebují k obnově paměťové B lymfocyty. Při exacerbaci pemfigu i po letech se objevují klony netolerantních B lymfocytů, totožné s původními, někteří autoři předpokládají jejich přežívání v kůži [6, 35].
Ačkoliv je pemphigus vulgaris již uveden v indikacích rituximabu v českém Souhrnu informací o přípravku, lze jej zatím podat jen po schválení pojišťovnou. Dalším limitem podání je výrazný útlum B lymfocytů, který přetrvává řadu měsíců a tím i vyšší náchylnost k infekcím. Podle zkušeností posledních dvou let pacienti léčení rituximabem mají zvýšenou úmrtnost na covid-19 [3]. I to je důvodem, proč je doporučováno očkování proti covid–19 u pacientů s autoimunitními bulózními onemocněními, nejlépe v stabilizovaném stadiu onemocnění, či pokud možno před nasazením imunosuprese.
V případě, že rituximab není dostupný, nebo je kontraindikován, používají se v kombinaci s kortikosteroidy imunosupresiva první linie azathioprin, mykofenolát mofetil a mykofenolová kyselina.
Další možnosti terapie
Mezi další používaná imunosupresiva druhé linie patří metotrexát a pro svoji toxicitu nyní již obsolentní cyklofosfamid. Nedoporučuje se ani cyklosporin, u nějž nebyl prokázán dostatečný účinek.
Dlouhá léta patřilo užití intravenózních imunoglobulinů (IVIG) k nejlepším terapeutickým možnostem. IVIG jsou připravovány z velkého množství plazmy dárců, obsahují převážně IgG, nejsou imunosupresivní ale imunomodulační, mají protizánětlivý efekt, blokují Fc receptor, inaktivují prekursory komplementu, snižují počty dentritických buněk, ovlivňují produkci protilátek, hlavně zvyšují katabolismus imunoglobulinů blokací neonatálního Fc receptoru [8]. IVIG se podávají v opakovaných pulsech, po 6 týdnech, nyní jsou nahrazovány rituximabem s lepším efektem, jsou vhodné u pacientů, u kterých je Rtx kontraindikován nebo selhal, u pacientů s imunodefektem. Léčba IVIG je velmi nákladná.
U refrakterních případů pemfigu je indikována terapeutická aferéza – imunoadsorpce IgG, která probíhá v opakovaných cyklech. Krev pacienta prochází kolonou, která má vysokou afinitu k IgG a vyváže ho z oběhu. Na rozdíl od plazmaferézy neodstraňuje další plazmatické proteiny.
Důležitá je i podpůrná terapie – antibiotika, antimykotika, antiulceróza, kalcium a vitamin D, hrazení proteinů, stopových prvků a tekutin.
Doporučeno je očkování proti chřipce, covid-19, pneumokokovi, tetanu. Kontraindikovány jsou živé vakcíny.
Lokálně ložiska ošetřujeme antiseptickými roztoky, podpůrně antibiotiky a kortikosteroidy, důležité je nebolestivé krytí ran, např. silikonovými neadhezivními mřížkami.
Do dutiny ústní používáme antiseptické a hojivé výplachy (šalvěj, chlorhexidin), kortikosteroidy v roztoku či orální pastě, někteří pacienti profitují z aplikace pilokarpinových kapek (pilokarpin je agonista muskarinových receptorů).
Nové možnosti terapie
V možnostech ovlivnění onemocnění se zkoumá řada další látek. Je to například efgartigimod – lidský IgG1 Fc fragment se zvýšenou afinitou k neonatálnímu Fc receptoru FcRn, který blokuje receptor, čímž snižuje navázání endogenního IgG a snižuje recyklaci a koncentraci IgG, snižuje tak koncentraci cirkulujících protilátek. Neovlivňuje tvorbu IgG, hladiny IgA, IgM a albuminu [36].
Malá molekula apremilast, již používaná u lupenky, psoriatické artritidy a Behçetovy choroby, byla s úspěchem použita u vulgárního pemfigu. Apremilast, inhibitor fosfodiesterázy 4 (PDE4), patří mezi inhibitory fosfodiesteráz, které degradují intracelulárně cAMP. Nejúčinnější se zdá PDE4, jelikož je exprimována široce na imunitních, epiteliálních a endoteliálních buňkách. Hladiny cAMP se zvyšují po navázání IgG na Dsg3, inhibice PDE4 chrání před indukovanou IgG akantolýzou [29, 32].
V dalších možnostech se vyvíjí Dsg specifická imunoadsorpce a Dsg specifická deplece T lymfocytů. Velmi zajímavou možností je Dsg specifická deplece B lymfocytů metodou CAAR-T. Tato modifikace metody s úspěchem využité v onkologii, používá připravené chimerické autoprotilátkové receptory na T lymfocytech, které cílí na specifický antigen – antiDsg3 u B lymfocytů [7, 14].
V úvahu přicházejí také další anti CD20 protilátky, jako je ofatumumab a obinutuzumab, což jsou humanizované monoklonální protilátky druhé a třetí generace. Inhibitory brutonkináz také tlumí B lymfocyty, zkouší se látka PRN 1008. VAY736 je protilátka proti BAFF (B lymfocyty aktivující faktor) receptoru. Zajímavé je využití suprese pomocí Treg místo klasické imunosuprese [14]. U orálních lézí měla dobrý efekt terapie plazmou obohacenou destičkami [9].
Prognóza
Prognóza pacientů s pemfigem se v posledních letech výrazně mění k lepšímu. Dříve jsme dokázali zachránit pacienty se středně těžkým a těžkým pemfigem za cenu výrazných nežádoucích účinků kortikosteroidů a imunosupresiv, které zhoršují kvalitu života a jsou i nepřímou příčinou zkrácení života nemocných. Rituximab dokáže u řady pacientů dosáhnout dlouhodobé remise s výrazně menší celkovou dávkou KS a IS, výrazně redukovat nežádoucí účinky a tím zachovat velmi dobrou kvalitu života nemocných.
ZÁVĚR
Pemfigus patří mezi nejzávažnější kožní onemocnění. Existuje několik klinických jednotek, které se odlišují skladbou autoantigenů, průběhem i odpovědí na terapii. I mezi jednotlivými subtypy existuje variabilita tíže postižení od lehkého po závažné onemocnění. Prognózu pacientů ovlivňují i komorbidity. Stále se prohlubuje poznání o patofyziologii tvorby puchýře, v posledních letech se zásadně rozšiřují možnosti terapie. Velmi důležitá je komplexní diagnostika, která po specifikaci typu onemocnění umožní vybrat pacientovi terapii šitou na míru. Cílem tohoto článku je představit stručně současné znalosti o etiopatogenezi, diagnostice, klinice a terapii toto onemocnění.
Seznam zkratek, nevysvětlených v textu
Src – protein ze Src rodiny, nereceptorická tyrosinkináza
EGFR – epidermální růstový faktor
RhoA – transformující protein RhoA
c-Myc – protein z rodiny regulující proliferaci a apoptózu buněk
FasL – Fas ligand, transmembránový protein z rodiny
TNF IL – interleukin
TNF – tumor nekrotizující faktor
LE – lupus erythematosus
TEN – toxická epidermální nekrolýza
CAART – chimeric autoantibody receptor T cell (T lymfocyty s chimerickým autoprotilátkovým receptorem)
hSPCA1 – ATP-kalciová pumpa
Do redakce došlo dne 1. 7. 2022.
Adresa pro korespondenci:
prof. MUDr. Hana Jedličková, Ph.D.
Dermatovenerologická klinika LF a FN u sv. Anny v Brně
Pekařská 664/53
602 00 Brno
e-mail: hana.jedlickova @ fnusa.cz
Sources
1. ABRÈU-VELEZ, A. M., HASHIMOTO, T., BOLLAG, W. B. et al. A unique form of endemic pemphigus in northern Colombia. J Am Acad Dermatol, 2003, 49, p. 599–608.
2. AMBER, K. T., VALDEBRAN, M., GRANDO, S. A. Non-Desmoglein Antibodies in Patients With Pemphigus Vulgaris. Frontiers in Immunology, 2018, 9. doi: 10.3389/fimmu.2018.01190.
3. ANDERSEN, K. M., BATES, B. A., RASHIDI, E. A. et al. Long-term use of immunosuppressive medicines and in-hospital COVID-19 outcomes: a retrospective cohort study using data from the National COVID Cohort Collaborative. The Lancet Rheumatology, 2022, 4(1), e33–e41.
4. BOSCH-AMATE, X., IRANZO, P., IVARS, M. et al. Anti - Desmocollin Autoantibodies in Autoimmune Blistering Diseases. Frontiers in Immunology, 2021, 12. doi: 10.3389/fimmu.2021.740820.
5. BYSTRYN, J. C., STEINMAN, N. M. The adjuvant therapy of pemphigus. An update. Arch Dermatol., 1996, 132(2), p. 203–212.
6. COLLIOU, N., PICARD, D., CAILLOT, F. et al. Longterm remissions of severe pemphigus after rituximab therapy are associated with prolonged failure of desmoglein B cell response. Sci Transl Med., 2013, 5, 175ra30.
7. DIDONA, D., MAGLIE, R., EMING, R., HERTL, M. Pemphigus: Current and Future Therapeutic Strategies. Front Immunol., 2019, 10, p. 1418. doi: 10.3389/ fimmu.2019.01418.
8. DOURMISHEV, L. A., GULEVA, D. V., MITEVA, L. G. Intravenous immunoglobulins: mode of action and indications in autoimmune and inflammatory dermatoses. Int J Inflamm., 2016, p. 3523057. doi: 10.1155/2016/3523057.
9. EL-KOMY, M. H., HASSAN, A. S., ABDEL RAHEEM, H. M. et al. Platelet-rich plasma for resistant oral erosions of pemphigus vulgaris: A pilot study. Wound Repair Regen., 2015, 23(6), p. 953–955. doi: 10.1111/ wrr.12363.
10. GHAEDI, F., ETESAMI, I., ARYANIAN, Z. et al. Drug-induced Pemphigus: A Systematic Review of 170 Patients. Int. Immunopharmacology, 2021, 92, 107299. doi: 10.1016/j.intimp.2020.107299.
11. GUALTIERI, B., MARZANO, V., GRANDO, S. A. Atypical pemphigus: autoimmunity against desmocollins and other non-desmoglein autoantigens. Ital J Dermatol Venerol., 2021, 156(2), p.134–141. doi: 10.23736/S2784-8671.20.06619-5.
12. HANS-FILHO, G., AOKI, V., BITTNER, N. R. H., BITTNER, G. C. Fogo selvagem: endemic pemphigus foliaceus. An Bras Dermatol., 2018, 93(5), p. 638–650. doi: 10.1590/abd1806-4841.20188235.
13. HÉBERT, V., BOULARD, C., HOUIVET, E. et al. Large international validation of ABSIS and PDAI pemphigus severity scores. J. Invest. Derm., 2018, 139, p. 31–38. doi: 10.1016/j.jid.2018.04.042.
14. IZUMI, K., BIEBER, K., LUDWIG, R. J. Current Clinical Trials in Pemphigus and Pemphigoid . Front Immunol., 2019, 10. doi: 10.3389/FIMMU.2019.00978.
15. JELTI, L., CORDEL, N., GILLIBERT, A. et al. Incidence and mortality of pemphigus in France. J Invest Dermatol., 2019,139, p. 469–473.
16. JOLY, P., HORVATH, B., PATSATSI, Α. et al. Updated S2K guidelines on the management of pemphigus vulgaris and foliaceus initiated by the european academy of dermatology and venereology (EADV). J Eur Acad Dermatol Venereol., 2020, 34(9), p. 1900 – 1913. doi: 10.1111/jdv.16752.
17. JOLY, P., MAHO-VAILLANT, M., PROST-SQUARCIONI, C. et al. First-line rituximab combined with short-term prednisone versus prednisone alone for the treatment of pemphigus (Ritux 3): a prospective, multicentre, parallel-group, open-label randomised trial. Lancet, 2017, 389, p. 2031–2040.
18. KARRAY, M., BADRI, T. Pemphigus Herpetiformis. In: StatPearls [Internet]. Treasure Island (FL): Stat - Pearls Publishing, 2022. Dostupné na www: https:// www.ncbi.nlm.nih.gov/books/NBK482415/.
19. KIM, J. H., KIM, S. C. Paraneoplastic Pemphigus: Paraneoplastic Autoimmune Disease of the Skin and Mucosa. Front Immunol., 2019,10, p. 1259. doi: 10.3389/fimmu.2019.01259.
20. KRIDIN, K., SCHMIDT, E. Epidemiology of Pemphigus. JID Innov., 2021, 20,1(1), p. 100004. doi: 10.1016/j.xjidi.2021.100004.
21. KRIDIN, K., ZELBER-SAGI, S., BERGMAN, R. Pemphigus vulgaris and pemphigus foliaceus: differences in epidemiology and mortality. Acta Derm Venereol., 2017, 97, p. 1095–1099.
22. KRIDIN, K., ZELBER-SAGI, S., COMANESHTER, D. et al. Association between pemphigus and neurologic diseases. JAMA Dermatol., 2018, 154, p. 281–285.
23. KRIDIN, K., SAGI, S. Z., BERGMAN, R. Mortality and Cause of Death in Patients with Pemphigus. Acta Derm Venereol., 2017, 97(5), p. 607–611. doi: 10.2340/00015555-2611.
24. LANGAN, S. M., SMEETH, L., HUBBARD, R. et al. Bullous pemphigoid and pemphigus vulgaris – Incidence and mortality in the UK: population based cohort study. BMJ, 2008, 337, a180.
25. LANDEGREN, N., ISHII, N., ARANDA-GUILLEN, M. et al. A gene-centric approach to biomarker discovery identifies transglutaminase 1 as an epidermal autoantigen. Proc Natl Acad Sci U S A, 2021, 118.
26. LEE, Y. B., LEE, J. H., LEE, S. Y. et al. Incidence and death rate of pemphigus vulgaris and pemphigus foliaceus in Korea: a nationwide, population-based study (2006–2015). J Dermatol., 2018, 45, p. 1396 – 1402.
27. LEGER, S., PICARD, D., INGEN-HOUSZ-ORO, S. et al. Prognostic factors of paraneoplastic pemphigus. Arch Dermatol., 2012, 148, p. 1165–1172. doi: 10.1001/archdermatol.2012, 1830.
28. MAO, X., LI, H., SANO, Y. et al. MAPKAP kinase 2 (MK2)-dependent and -independent models of blister formation in pemphigus vulgaris. J Invest Dermatol., 2014, 134, p. 68–76. doi: 10.1038/ jid.2013.224.
29. MEIER, K., HOLSTEIN, J., SOLIMANI, F. et al. Case Report: Apremilast for Therapy-Resistant Pemphigus Vulgaris. Front Immunol., 2020, 11, 588315. doi: 10.3389/fimmu.2020.588315.
30. PAOLINO, G., DIDONA, D., MAGLIULO, G. et al. Paraneoplastic pemphigus: insight into the autoimmune pathogenesis, clinical features and therapy. Int J Mol Sci., 2017, 18, 2532. doi: 10.3390/ ijms18122532.
31. SCHMIDT, E., WASCHKE, J. Apoptosis in pemphigus. Autoimmun Rev., 2009, 8, p. 533–537. doi: 10.1016/j.autrev.2009.01.011.
32. SIGMUND, A. M., WINKLER, M., ENGELMAYER, S. et al. Apremilast prevents blistering in human epidermis by stabilization of keratinocyte adhesion in Pemphigus. Preprint. doi: https://doi. org/10.1101/2022.02.07.478931.
33. SINDHUJA, T., DE, D., HANDA, S. et al. Pemphigus Oral Lesions Intensity Score (POLIS): A Novel Scoring System for Assessment of Severity of Oral Lesions in Pemphigus Vulgaris. Front. Med., 2020. doi. org/10.3389/fmed.2020.00449.
34. SPINDLER, V., EMING, R., SCHMIDT, E. et al. Mechanisms Causing Loss of Keratinocyte Cohesion in Pemphigus. J Invest Dermatol., 2018, 138(1), p. 32 – 37. doi: 10.1016/j.jid.2017.06.022.
35. TAKAHASHI, H. Desmoglein 3-reactive B cells “hiding” in pemphigus lesions. J Invest Dermatol., 2017, 137, p. 2255–2257.
36. ULRICHTS, P., GUGLIETTA, A., DREIER, T. et al. Neonatal Fc receptor antagonist efgartigimod safely and sustainably reduces IgGs in humans. J Clin Invest., 2018, 128(10), p. 4372–4386. doi: 10.1172/JCI97911.
37. UZUN, S., DURDU, M., AKMAN, A. et al. Pemphigus in the Mediterranean region of Turkey: a study of 148 cases. Int J Dermatol., 2006, 45, p. 523–528.
38. VODO, D., SARIG, O., SPRECHER, E. The genetics of pemphigus vulgaris. Front Med., 2018, 5, p. 226.
39. WALTER, E., VIELMUTH, F., WANUSKE, M. T. et al. Role of Dsg1 - and Dsg3-Mediated Signaling in Pemphigus Autoantibody-Induced Loss of Keratinocyte Cohesion. Front Immunol., 2019, 24,10, 1128. doi: 10.3389/fimmu.2019.01128.
40. WANG, M., LI, F., WANG, X. et al. Features and Risk Factors for Paraneoplastic Autoimmune Multiorgan Syndrome in 145 Chinese Patients. Acta Derm Venereol., 2020, 100: adv00312.
41. WOHL, Y., DREIHER, J., COHEN, A. D. Pemphigus and Osteoporosis: A Case-Control Study. Arch Dermatol., 2010,146(10), p. 1126–1131. doi: 10.1001/archdermatol. 2010.257.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2022 Issue 4-
All articles in this issue
- Autoimmune Blistering Diseases: Part I. Pemphigus
- Kontrolní test
- Development of Antimicrobial Resistance of Neisseria Gonorrhoeae in The Years 2015–2020 in Prague in the European Context
- Nivolumab-Induced Psoriasis in a Patient with Lung Cancer. Case Report
- Cone-Shaped Hyperkeratotic Lesions on The Back – Rupioid Psoriasis. Minireview
- Zápis ze schůze výboru ČDS konané dne 28. 4. 2022
- Zápis ze schůze výboru ČDS konané dne 9. 6. 2022
- Odborné akce 2022
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoimmune Blistering Diseases: Part I. Pemphigus
- Development of Antimicrobial Resistance of Neisseria Gonorrhoeae in The Years 2015–2020 in Prague in the European Context
- Cone-Shaped Hyperkeratotic Lesions on The Back – Rupioid Psoriasis. Minireview
- Nivolumab-Induced Psoriasis in a Patient with Lung Cancer. Case Report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career