-
Medical journals
- Career
Necrobiosis lipoidica
Authors: J. Nováková
Authors‘ workplace: Kožní oddělení FN Ostrava a LF OU Ostrava, vedoucí pracoviště prim. MUDr. Yvetta Vantuchová, Ph. D.
Published in: Čes-slov Derm, 96, 2021, No. 2, p. 59-69
Category: Reviews (Continuing Medical Education)
Overview
Necrobiosis lipoidica je chronické granulomatózní onemocnění kůže, které bývá sdruženo s diabetem nebo glukózovou intolerancí. Etiologie nemoci není jasná, nejčastěji se zvažuje zásadní role mikroangiopatie. Typickým projevem jsou červenohnědé ploché papuly na přední straně bérců splývající v plošná atrofická ložiska s teleangiektaziemi. Komplikací může být vznik ulcerace v ložisku. Diagnóza se stanoví podle klinického obrazu a případného histologického vyšetření. Léčba necrobiosis lipoidica je neuspokojivá nejsou k dispozici přijaté léčebné postupy. Článek poskytuje současný přehled léčebných metod této nemoci.
Klíčová slova:
necrobiosis lipoidica – etiopatogeneze – diagnostika – léčba – diabetes mellitus
ÚVOD
Necrobiosis lipoidica (NL) je chronické granulomatózní onemocnění kůže. Může být sdruženo s diabetem nebo glukózovou intolerancí. Jeho výskyt je poměrně vzácný. U pacientů s diabetem je prevalence v rozmezí 0,3–1,2 %, u pacientů, kteří diabetem netrpí, nebyla prevalence přesně stanovena. U diabetických dětí je prevalence pod 0,05 % [18]. Největší skotská dotazníková studie odhalila pouze jeden případ mezi 1 557 dotázanými diabetickými dětmi, kazuistiky s případy NL u dětí jsou nečetné [44]. Nejčastěji postiženou věkovou skupinou jsou mladí dospělí a lidé v mladším středním věku. Pokud je choroba asociována s diabetem 1. typu, objevují se kožní projevy dříve (ve třetí dekádě věku), pokud je onemocnění spojeno s diabetem 2. typu anebo jsou postiženi nediabetičtí pacienti, lze první výskyt kožních projevů předpokládat později (ve čtvrté dekádě věku). NL se vyskytuje častěji u žen, poměr postižení žen a mužů je 3 : 1. Důvod vyššího výskytu u žen není znám [13, 18].
ETIOPATOGENEZE
Přesnou patogenezi onemocnění se zatím nepodařilo objasnit. Změny na cévách a s tím související změny v prokrvení v postižených oblastech by mohly být iniciálním impulzem vedoucím ke vzniku kožních projevů. Uvažuje se o imunologicky podmíněné vaskulitidě, tuto domněnku podporuje i nález IgM, C3 a fibrinu ve stěně cév a IgM, C3 a fibrinogenu v oblasti dermoepidermálního spojení v ložiskách NL v imunofluorescenčním vyšetření. V některých případech však vaskulitida detekovaná nebyla a nález na cévách byl v normě. U některých pacientů byla prokázána sekundárně vzniklá mikroangiopatie s depozity glykoproteinů ve stěnách cév. Tento stav může přispívat k rozvoji degenerace kolagenu následované vznikem zánětu v dermis. Obdobné změny na cévách s depozity glykoproteinů se nachází při diabetické mikroangiopatii s postižením oka nebo ledvin. Tyto komplikace diabetu jsou však poměrně časté, NL se ve srovnání s nimi vyskytuje výrazně vzácněji [18]. Výsledky studií zkoumajících vlastní průtok krve v postižených oblastech jsou rozporuplné až protichůdné. V některých případech byl zjištěn snížený průtok krve v ložiskách. Jiná měření naopak popisují průtok zvýšený, autoři jej přikládají přítomnosti zánětu. Zvýšený průtok krve zároveň vylučuje ischemii v ložiskách [34].
Další teorie stran patogeneze uvažují o primárním postižení kolagenu s druhotně se rozvíjejícím zánětem. U některých pacientů byly nalezeny protilátky proti kolagenu, ale nález nebyl signifikantní, v jiných případech tyto protilátky nebyly prokázány. Další vyšetření zaměřená na změny v oblasti dermis odhalila, že fibroblasty kultivované z postižených oblastí prokazují sníženou syntézu kolagenu, hustota kolagenu je u ložisek NL snížena, v elektronovém mikroskopu jsou patrné strukturální změny kolagenních vláken [44].
Mezi další zvažované patogenetické faktory patří porucha migrace neutrofilů, sekundární poškození tkáně při hyperlipidemii nebo venózní reflux [44]. Ve všech pozorováních není zahrnut větší počet hodnocených pacientů, jedná se spíše o jednotlivá pozorování a ta nepřinášejí jednoznačné potvrzení určitého patogenetického faktoru.
Rodinný výskyt NL je vzácný. HLA asociace nebyla prokázána a nebyly prokázány rozdíly v HLA profilech diabetických pacientů s NL ve srovnání s profily diabetiků bez kožního postižení, průzkum se však týkal pouze diabetiků 1. typu [34]. Zajímavostí je případ jednovaječných dvojčat, žen, diabetiček 2. typu, u kterých se u obou vyvinula ložiska NL. U první ženy se kožní projevy objevily o pět let dříve než u druhé a jejich vznik předcházel onemocnění diabetem 2. typu, u druhé ženy byl naopak nejprve diagnostikován diabetes mellitus 2. typu a až po půl roce po stanovení této diagnózy se objevila kožní ložiska. Obě sestry měly ložiska NL lokalizovaná ventrálně na bércích, histologické vyšetření dávalo obdobný výsledek, a v obou případech onemocnění nedostatečně reagovalo na lokální léčbu klobetasolem [37].
KLINICKÝ OBRAZ
Projevy NL jsou typicky lokalizovány pretibiálně. V počátku se prezentují jako hladké, tmavě červené splývající makulopapuly nebo ložiska, která se šíří do periferie erytematózním, často elevovaným, lemem, nabývají žlutavého odstínu, v centru jsou hladká, lesklá, s cévními ektaziemi, někdy indurovaná (obr. 1). Ve většině případů jsou projevy vícečetné a bilaterální, mohou však být solitární a jsou obdobného vzhledu u diabetiků i nediabetických pacientů (obr. 2). Mají tendenci přetrvávat dlouhodobě až trvale, někdy mohou ulcerovat (viz obr. 1). Ulcerace se vyskytují až u 35 % pacientů, mohou vznikat spontánně z transepidermální eliminace alterovaného kolagenu a elastických vláken nebo vznikají po drobných traumatech [13, 34]. U dlouhotrvajících projevů se velmi vzácně může vyvinout spinocelulární karcinom. Počet lézí a rychlost jejich progrese je u jednotlivých pacientů velmi variabilní.
Image 1. Necrobiosis lipoidica s počínající ulcerací 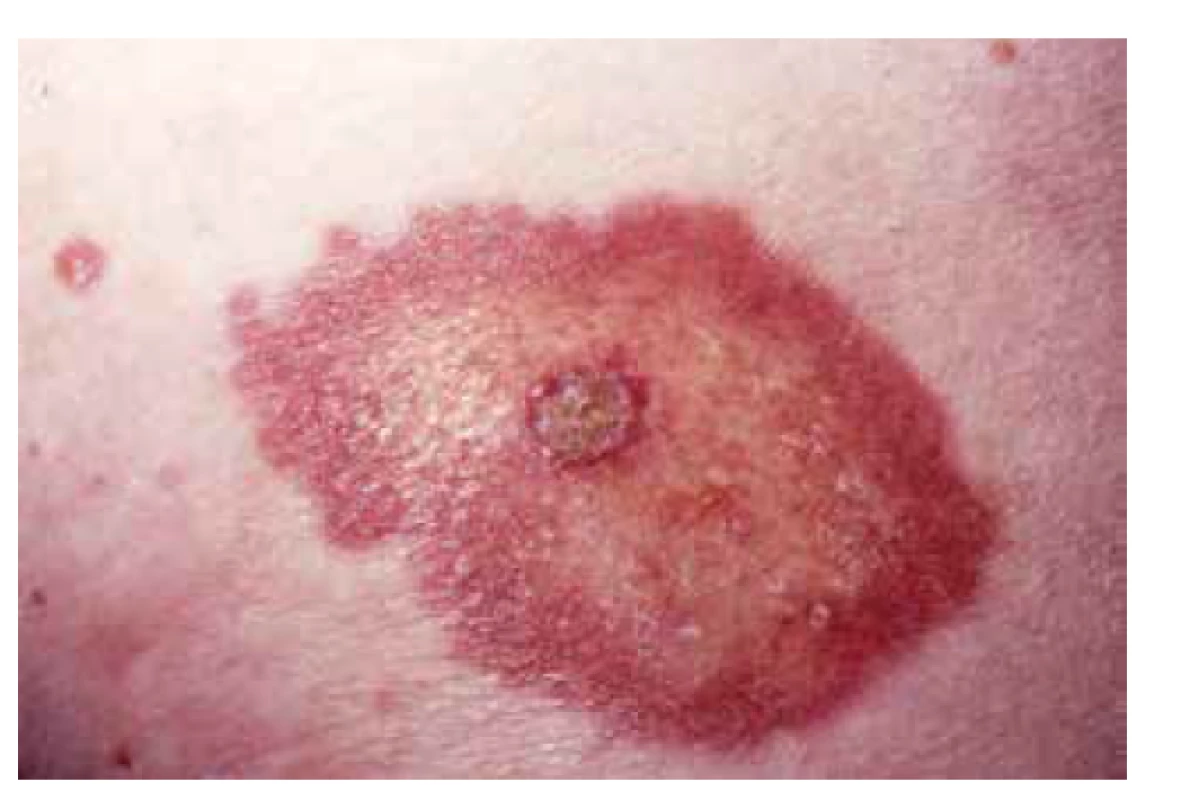
(archiv Dermatovenerologické kliniky 1. LFUK a VFN) Image 2. Necrobiosis lipoidica na trupu 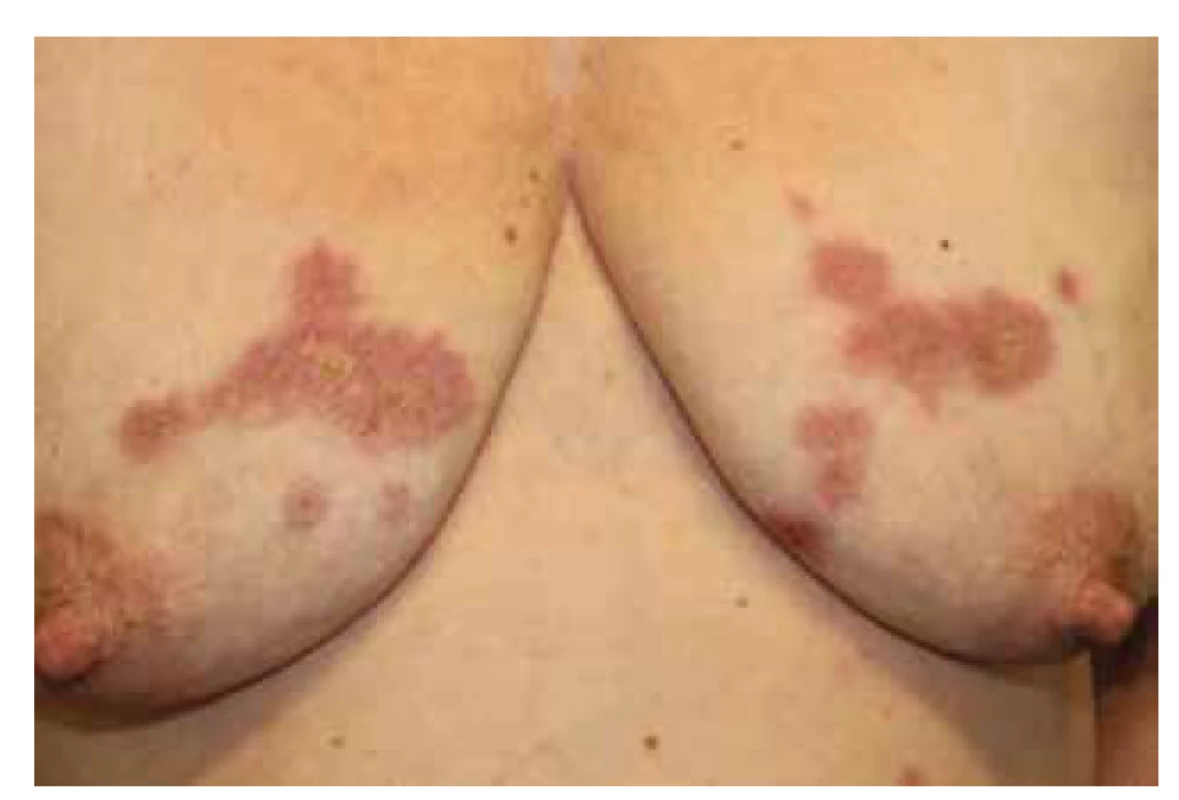
(archiv Dermatovenerologické kliniky 1. LFUK a VFN) Projevy jsou většinou bezpříznakové, vzácně pacienti udávají svědění, dysestezie, ulcerace mohou být bolestivé. Postižená kůže může vykazovat hypohidrózu a výpad ochlupení. V multicentrické retrospektivní studii 97,8 % z 236 nemocných s NL mělo projevy lokalizované na dolních končetinách, u 12,7 % byly přítomny ulcerace, bolesti udávalo 25 % a svědění 26 % pacientů [21].
Atypicky se ložiska mohou nacházet i v jiných oblastech na dolních nebo horních končetinách, vzácně na obličeji, ve vlasech nebo na genitálu, mohou být zároveň i na více rozdílných lokalitách na těle (viz obr. 2). Na obličeji a ve vlasech mívají léze anulární nebo serpiginózní vzhled s méně vyznačenou atrofií v centru [43]. V literatuře bylo publikováno několik případů výskytu NL v oblasti glans penis [9]. Většinou se jednalo o vícečetná ložiska velikosti 2–5 mm, intaktní nebo ulcerující. Průběh onemocnění byl zpravidla spojen s recidivami s hojením ulcerovaných ložisek jizvou. Ke stanovení diagnózy vždy napomohlo histologické vyšetření, v diferenciální diagnóze se zvažovalo granuloma anulare, sarkoidóza nebo epiteloidní sarkom.
Diseminovaná perforující necrobiosis lipoidica je vzácnou formou rozsáhlejšího onemocnění spojená transfolikulární eliminací degenerovaného kolagenu. Klinicky se projevuje hyperkeratotickými papulami a ložisky, lokalizovanými mnohočetně zejména na dolních končetinách, případně i na horních končetinách a na trupu. Onemocnění má chronický průběh s tendencí k jizvení anebo vzniku ulcerací. Léčba se neliší od léčby klasické formy NL. Diagnózu lze stanovit z histologického vyšetření, napomůže také dermatoskopické vyšetření s klasickým dermatoskopickým obrazem NL. Předpokládá se, že v patogenezi diseminovaného procesu by mohla hrát roli abnormální keratinizace v oblasti stratum basale, vedoucí k zánětlivé odpovědi proti keratinu s částečnou alterací pojivové tkáně a její eliminací spolu s keratinem a nekrotickými buňkami skrze epidermis [17].
Výjimečně je popisována koebnerizace lézí NL. Nejčastěji se jedná o výskyt solitárních nebo mnohočetných projevů v jizvách po operacích, úrazech anebo v oblasti po proběhlém herpes zoster, v místě tetováže anebo v místě po odstranění tetováže. Je také popsán případ vzniku ložisek na prsou po aplikaci silikonových implantátů. Časový odstup mezi vyvolávajícím impulzem a vznikem kožních projevů byl u jednotlivých případů různý, pohyboval se od několika týdnů po desítky let. Postiženi byli diabetici i pacienti bez diabetu, někteří měli jen ložiska vzniklá v rámci Koebnerova fenoménu, někteří měli i další projevy NL [15].
Vzácnou komplikací NL je vznik spinocelulárního karcinomu. Dosud bylo publikováno 14 případů, u nichž se nádor objevil v průměru po 21,5 letech od stanovení diagnózy NL. V době zjištění nádoru byly ve třech případech přítomny uzlinové metastázy (s průměrnou dobou 28 let od stanovení diagnózy NL) a v jednom případě došlo k diseminaci nádorového procesu [42]. Proč dojde v ložisku NL k maligní transformaci není zcela jasné, roli pravděpodobně hraje přítomnost chronického zánětu se špatnou vaskularizací a hypoxií tkáně, vliv by mohla mít i ztráta melaninové pigmentace v ložiskách NL zvyšující pravděpodobnost poškození UV zářením. U dlouhodobě se nehojících ulcerací špatně reagujících na léčbu je nutné zvážit možnost této komplikace a případně histologicky vyšetřit. V jednom případě byl popsán růst leiomyosarkomu v ložisku NL.
DIAGNOSTIKA
U typických projevů ke stanovení diagnózy NL vystačí klinické vyšetření pacienta [44]. V nejasných případech je vhodné histologické vyšetření. Nutnost biopsie kůže je potřeba vždy zvážit, neboť je zde riziko pomalého komplikovaného hojení defektu po biopsii.
Klasický histologický obraz NL vykazuje intersticiální a palisádující granulomatózní dermatitidu s nekrobiózou vaziva. Epidermis je normální nebo atrofická, v případě ulcerace chybí. V koriu jsou patrné většinou rozsáhlé horizontálně probíhající okrsky nekrobiotického vaziva obklopené infiltráty z histiocytů, i mnohojaderných, místy palisádovitě uspořádaných s příměsí lymfocytů a plazmatických buněk patrných i perivaskulárně a intersticiálně (obr. 3 a, b). Nekrobiotické okrsky vaziva, na rozdíl od granuloma anulare, v typických případech nevykazují přítomnost mucinu. Přítomnost mucinu spolu s dalšími histopatologickými jevy byla popisována u pacientů s asociovanou tyreopatií. Při delším trvání projevů dochází k fibróze vaziva. Nález perineurálního histiocytárního infiltrátu může připomínat lepru a může být příčinou dysestezie projevů. Dysestezie ložisek by také mohla být asociovaná s mikrovaskulárním postižením vedoucí k axonální degeneraci senzitivních nervových vláken. Někdy lze pozorovat vznik tuberkuloidních či sarkoidálních granulomů (obr. 4), případně výrazné postižení podkožní tukové tkáně. Vzácně může docházet k transepiteliální či transfolikulární eliminaci nekrobiotického vaziva.
Image 3. Necrobiosis lipoidica
a) horizontálně probíhající nekrobiotické okrsky vaziva obklopené perivaskulárním a intersticiálním zánětlivým infiltrátem (HE 25x)
b) nekrobiotický okrsek zrnitě se rozpadajícího vaziva (HE 100x)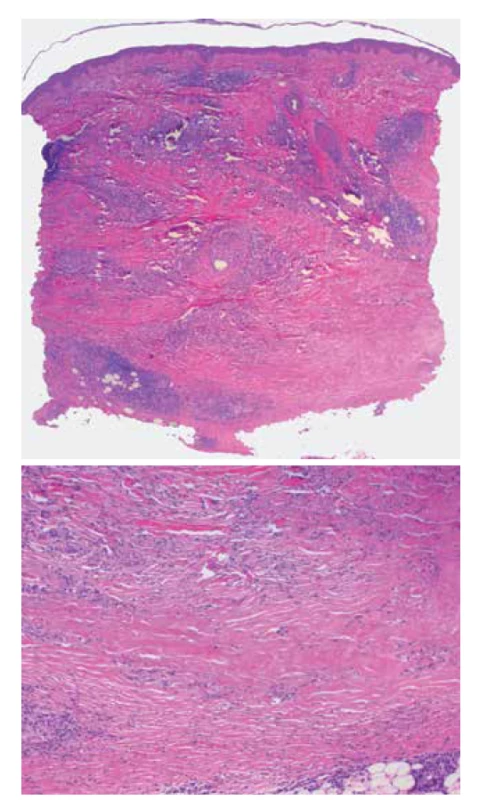
(archiv Dermatovenerologické kliniky 1. LFUK a VFN) Image 4. Sarkoidální granulomy u necrobiosis lipoidica (HE 200x) 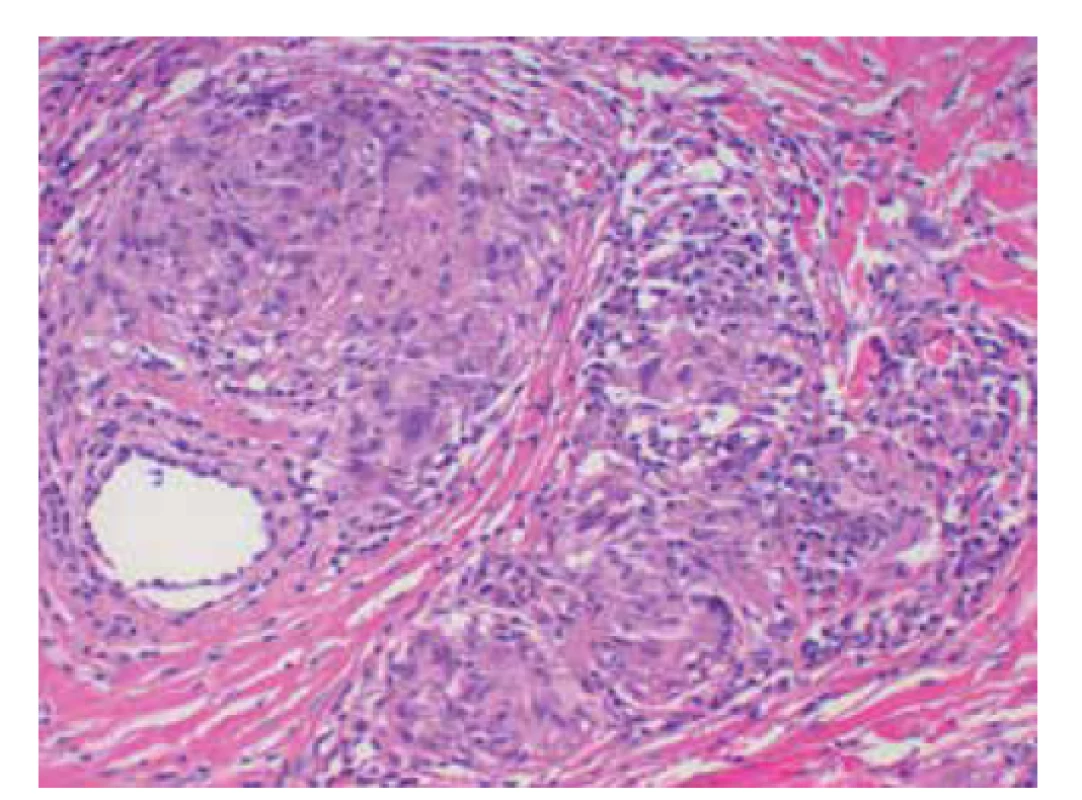
(archiv Dermatovenerologické kliniky 1. LFUK a VFN) V dermatoskopickém obraze NL vidíme u čerstvých projevů čárkovité kapiláry, u vyvinutějších projevů síťovité nebo prolongované, u pokročilých projevů větvící se a vinuté na žlutooranžovém nebo světlerůžovém pozadí s možnými akcentovanými růžovými okrsky. Také může být přítomna nesouvislá retikulární pigmentace, žluté krusty a ulcerace.
DIFERENCIÁLNÍ DIAGNÓZA
Diferenciální diagnóza NL zahrnuje jednak choroby s obdobným histologickým obrazem (granulomatózní choroby), jednak choroby s predilekční lokalizací na ventrální straně bérců [44].
Granuloma anulare má v klinickém obraze ery-témové nebo nafialovělé papuly, ložiska a circinární ložiska, často jsou postiženy děti. Na rozdíl od NL nebývají centra ložisek atrofovaná, nevyskytují se teleangiektazie ani žlutavé zabarvení lézí. Klasický histologický obraz granuloma anulare představuje okrskovitě uspořádané nekrobiotické palisádující granulomy s depozity mucinu, u NL je přítomnost mucinu vzácná, nekrobiotické okrsky jsou rozsáhlejší, horizontálního průběhu. Ojediněle se popisují případy souběžného výskytu granuloma anulare a necrobiosis lipodica.
Kožní sarkoidóza se vzácněji může manifestovat ložisky, která se podobají ložiskům NL. Odlišení v tomto případě může být pouze histologické, nález velkých epiteloidních granulomů a absence nekrobiózy podporuje diagnózu sarkoidózy. Navíc jsou u sarkoidózy postiženy další orgány jako plíce, oko, ledviny.
Nekrobiotický xantogranulom je nejčastěji asociovaný s IgG monoklonální gamapatií a může se projevovat žlutými ložisky nebo subkutánními noduly. Na rozdíl od NL se nekrobiotický granulom nejčastěji vyskytuje periorbitálně. Může však být i na trupu a končetinách. Histologicky v koriu a podkoží nacházíme větší oblasti nekrobiózy oproti nálezu u NL, cholesterolové štěrbiny, Toutonovy buňky, lymfoidní folikuly aj.
Morfea, zejména ve stadiu sklerotizace, se může podobat NL. Odlišení je možné histologicky, zejména nálezem nekrobiózy vaziva a granulomatózního zánětu u NL.
Purpura pigmentosa je zahrnuta v diferenciální diagnostice NL pro obdobnou lokalizaci projevů na ventrální straně bérců. Obě jednotky lze dobře odlišit v klinickém obraze, klasickým obrazem pigmentové purpury jsou petechie, purpura, hnědá dyskolorace. Kůže není indurovaná a projevy jsou v niveau.
Stasis dermatitis je chronický zánět kůže dolních končetin, zejména oblasti bérců, doprovázející chronickou venózní insuficienci. Odlišení od NL je v klinickém obraze, u stasis dermatitidy je postižení plošné, přechází i na boční stranu bérců a na lýtka a netvoří se ložiska.
Vzácně se může NL vyskytovat v koincidenci s granuloma anulare nebo sarkoidózou. V minulosti byly NL a granuloma anulare považovány jen za varianty jednoho onemocnění, až později byly tyto nemoci odlišeny jako dvě různé klinické jednotky. V souvislosti se sarkoidózou, jsou popsány případy, kdy se u pacienta zároveň nacházely klinicky i histologicky odlišné morfy náležící jak NL, tak sarkoidóze anebo pacienti trpěli plicní formou sarkoidózy a měli kožní projevy NL [1, 10]. Někdy však může být stanovení diagnózy obtížné. Problematickou variantou je atrofická a ulcerózní forma sarkoidózy, u které je klinický i histologický obraz necharakteristický jak pro sarkoidózu, tak pro NL. S přechodnou variantou onemocnění bez jednoznačného klinického a histologického zařazení se můžeme častěji setkat v místech atypické lokalizace pro NL – na obličeji a v oblasti vlasů.
KOMORBIDITY
• Diabetes mellitus
NL souvisí s diabetem, není však dosud přesně objasněno, proč tomu tak je. Samotný diabetes a výše hladiny krevní glukózy nemá pravděpodobně na vznik kožních ložisek zásadní vliv, spíše se předpokládá společný patofyziologický faktor hrající roli u obou onemocnění, zejména angiopatie. Souvislost s diabetem sledovala studie z Mayo Clinic a zpracovávající údaje 338 pacientů léčených na klinice v letech 1992–2017 [38]. Všichni pacienti měli klinicky nebo histologicky potvrzenou diagnózu NL. Diabetem zároveň trpělo 56 % pacientů, (33,5 % diabetem 2. typu, 22,5 % diabetem 1. typu). Přibližně třetina postižených diabetiků měla i další komplikace diabetu, jako je retinopatie, neuropatie nebo postižení ledvin. Druhé pozorování s velkým počtem pacientů pochází od Mullera a Winkelmanna z roku 1966 [31]. Zjistili, že 65 % ze 171 sledovaných pacientů mělo diabetes. Převažovali pacienti s diabetem 1. typu, dalších 15 % pacientů mělo porušenou glukózovou toleranci. Pozitivní rodinná anamnéza stran diabetu byla u 68 % pacientů s diabetem a u 45 % nediabetických pacientů. Další studie z Německa se 100 pacienty s NL odhalila 46 % diabetiků, 72 % z nich byly ženy [13]. Jiné studie s takto vysokým počtem sledovaných nebyly dělány. Menší studie pak tak vysoké procento diabetiků mezi pacienty s NL neodhalují.
Souhrnně lze na základě všech informací z publikovaných studií říci, že 11–65 % pacientů s NL má diabetes nebo porušenou glukózovou toleranci. Kožní projevy mohou diabetes předcházet (asi 14 % případů), být diagnostikovány souběžně s diabetem (asi 24 % případů) anebo se objevit po několika letech trvání onemocnění diabetem (asi 62 % případů) [13, 34, 38]. Nebylo prokázáno, že by průběh onemocnění NL mohl být pozitivně či negativně ovlivněn výší hladiny glukózy v krvi [30]. Ojediněle jsou popisovány případy odhojení NL po transplantaci pankreatu. Zde ale není jasné, do jaké míry se na zlepšení kožního stavu podílí normalizace hladin glukózy po transplantaci a do jaké míry nově zahájená imunosupresivní léčba [35]. Na větších souborech diabetických pacientů nebyl vliv normalizace glykemie na průběh onemocnění NL prokázán, nicméně existují sdělení poukazující na to, že normalizace hladiny glukózy může preventivně působit proti rozvoji komplikací včetně kožních komplikací [19].
• Hypertenze, obezita
Jen několik studií se zabývalo souvislostí NL, obezity a hypertenze [13, 21]. Retrospektivní americká studie odhalila u 40–50 % z 236 sledovaných pacientů s NL hypertenzi nebo obezitu, rovnoměrně byli zastoupeni pacienti s diabetem i bez diabetu. Je to více než celkově v populaci v oblasti sledování (zde postiženo asi 34 % jedinců) [21]. Naproti tomu u 100 sledovaných pacientů v jiné studii nebyl zaznamenán rozdíl v procentu zastoupení hypertoniků a diabetiků vzhledem k ostatní populaci, při detailnějším rozboru pacientů však bylo zjištěno, že obezitou a hypertenzí trpí více pacienti s ulcerací v ložisku NL [13].
• Thyreopatie
Na větším souboru pacientů pak byl pozorován trojnásobně vyšší výskyt onemocnění štítné žlázy u pacientů s NL oproti výskytu v běžné populaci [19]. Při současném postižení štítné žlázy se většinou jedná o autoimunitní thyreoiditidu [38].
• Gastrointestinální
NL je popisována v asociaci s dalšími chorobami, jako je ulcerózní kolitida, Crohnova nemoc [19] anebo stavy po střevním jejunálním bypassu. Jedná se však jen o jednotlivé kazuistiky [18].
PRŮBĚH A PROGNÓZA
Onemocnění je chronické, pomalá progrese v průběhu let je častá, ale mohou se objevit dlouhá klidová období nebo období pomalé regrese ložisek. Spontánní regrese po 8–12 letech od počátku onemocnění byla pozorována u 17 % ze 171 sledovaných pacientů [31]. Stupeň atrofie a jizvení v ložiskách je variabilní. Pacienti s NL, kteří mají diabetes, mají lehce vyšší pravděpodobnost vzniku ulcerace v ložisku, naopak pacienti, kteří diabetem netrpí, mají vyšší pravděpodobnost spontánní regrese onemocnění.
LÉČBA
Vzhledem k zatím neznámé etiologii a absenci patogenetického modelu neexistuje cílená léčba a ani doporučené postupy léčby. Nicméně i tak by péče o pacienta s NL měla být komplexní a měla by zahrnovat jak vlastní léčbu, tak režimová opatření. Onemocnění obecně odpovídá na léčbu špatně, úplného vyléčení pacienta lze dosáhnout jen stěží a jako úspěšnou můžeme hodnotit léčbu tehdy, pokud se nám podaří zastavit progresi onemocnění a zabránit vzniku ulcerace v ložisku. A tak je v péči o pacienta významná též edukace pacienta se záměrem realistického očekávání výsledků léčby.
Obecná opatření, režimová opatření
Na prvním místě je vhodná kompenzace všech interních chorob, kterými pacient trpí včetně případného diabetu. Pokud má pacient otoky dolních končetin, je třeba zjistit jejich příčinu a zajistit léčbu vedoucí k jejich redukci. Je vhodné doplnit kardiologické, interní nebo cévní vyšetření. Otoky kardiálního nebo interního původu jsou řešeny v režii kardiologa či internisty. V případě otoků žilního původu či přítomnosti lymfedému je žádoucí ve spolupráci s cévní ambulancí nastavit komplexní dekongestivní léčbu. Tato zahrnuje edukaci pacienta stran režimových opatření (vhodná pohybová aktivita, polohování končetin), použití komprese dolních končetin kompresivními obinadly nebo punčochami, eventuálně manuální či přístrojovou lymfodrenážní terapii. Drobné úrazy v oblasti lézí mohou vést ke vzniku špatně se hojících bolestivých ulcerací, a proto nemocný musí být poučen jak se před úrazy chránit (použití obvazu, návleků, pravidelné indiferentní promazání postižené oblasti ke zvláčnění kůže a ke snížení rizika protrhnutí kůže).
Farmakoterapie
U všech používaných léčebných metod chybí větší studie, které by objektivizovaly jejich efektivitu. Proto léčba první a druhé linie vychází zejména z pozitivní klinické zkušenosti při jejím častém širokém použití [18]. Další níže uvedené možnosti léčby mají charakter terapeutického pokusu či experimentální léčby a jsou zmiňovány jen v jednotlivých nečetných kazuistikách, nebo je tato léčba hodnocena na malých souborech pacientů (tab. 1) [13, 32, 34].
Table 1. Léčba necrobiosis lipoidica 
Lokální terapie (léčba první linie)
• Indiferentní léčba (emolencia) může být léčbou volby u pacientů s chronickými stacionárními ložisky NL, která nejeví známky aktivity a pacientovi nečiní žádné potíže. U těchto pacientů je potřeba zvážit, zda by u nich byla diferentní léčba přínosná i s ohledem na vedlejší účinky takovéto terapie.
• U neulcerovaných ložisek NL je v první linii léčby lokální aplikace silných kortikosteroidů [13, 34], nejlépe v okluzi doplněná o kompresivní terapii. Příznivý efekt léčby lokálními kortikosteroidy můžeme předpokládat jen u pacientů s aktivními ložisky. Chronická stacionární ložiska již nelze léčbou příliš ovlivnit, zde léčba není úspěšná a převažuje u ní riziko vzniku atrofie kůže a ulcerace. Lokální kortikosteroidy můžeme aplikovat v různých režimech, nicméně vždy bychom měli lék aplikovat jen na aktivní – erytémovou část ložiska, eventuálně i v úzkém lemu do okolní zdravé kůže. Podle možnosti je nutné vyhnout se aplikaci léku na neaktivní, často atrofické centrum ložiska. V menších studiích jsou popsány zkušenosti s podáním klobetazolu. V jedné z nich aplikovali klobetazol v krému na erytémový okraj ložiska NL 1krát denně, večer, do okluze, po dobu tří až čtyř týdnů. Poté zhodnotili efekt léčby, jako účinnou ji hodnotili tehdy, pokud došlo k ústupu erytému a oploštění ložiska. V tomto případě přešli k redukci dávky lokálně podaného kortikoidu na víkendové podání po dobu dalšího měsíce s následným ukončením léčby. Pokud nebyl v úvodním třítýdenním podání efekt zaznamenán, pokračovali další 3 týdny v každodenní aplikaci klobetazolu, ale již bez použití okluze, s následným přehodnocením efektu [44].
• Intralezionálně podané kortikosteroidy rovněž mohou ovlivnit pouze aktivní ložiska. Jejich účinek je silnější, je zde i větší riziko vzniku atrofie a následné ulcerace, také možnost přesunu pigmentu v ošetřované oblasti, většinou se jedná o hypopigmentaci. Perilezionální aplikace do zdravé kůže může bránit progresi onemocnění, zánětlivý lymfocytární infiltrát je histologicky detekovatelný i v okolí lézí v místě klinicky zdravé kůže. Intralezionální kortikosteroidy lze použít již primárně nebo také jako druhou linii léčby při neúspěchu lokálně podaného kortikosteroidu [2]. Nejvíce zkušeností je s triamcinolon acetonidem. Příkladem může být jeho použití v níže uvedeném režimu, který byl s úspěchem použit u několika pacientů. Jednalo se o aplikaci triamcinolon acetonidu v dávce 5–10 mg na mililitr do aktivního okraje ložiska NL nebo perilezionálně do zdravé kůže bezprostředně naléhající na ložisko, jednotlivé vpichy byly od sebe vzdáleny minimálně 1 cm. Celkově podaná dávka u jednoho ošetření nepřekračovala 40 mg triamcinolon acetonidu. Pacienti byli zkontrolováni po 6 týdnech od aplikace, jako úspěšná byla léčba vyhodnocena tehdy, pokud došlo k ústupu erytému a k oploštění případných papul nebo ložisek. Pokud byl efekt jen částečný a u pacienta nebyly známky atrofie kůže v ložisku, aplikace byla ještě 1krát, nejvýše 2krát po 6 týdnech zopakována. Pokud ani tehdy nedošlo ke zlepšení, další pozitivní efekt této léčby se již nepředpokládal a léčba byla ukončena [44].
• Takrolimus v masti je dalším lékem první linie. Jeho použití je sice off-label, ale přináší výhodu proti lokálně podanému kortikosteroidu v eliminaci rizika iatrogenně navozené atrofie v oblasti ošetřované kůže. Takrolimus patří mezi makrolidy, inhibuje tvorbu cytokinů T lymfocyty, inhibuje uvolňování mediátorů zánětu ze žírných buněk kůže, bazofilů a eozinofilů. Přesný mechanismus jeho účinku při léčbě NL není znám. V několika sděleních je popisován ústup zánětu a indurace neulcerovaných ložisek NL při aplikaci 0,1% takrolimu k jejich aktivnímu okraji. Takrolimus příznivě působí i na ulcerující léze. Někteří autoři usuzují, že přítomnost ulcerace při použití takrolimu dává předpoklad lepšího léčebného efektu než u neulcerujících lézí, což by mohlo být dáno lepším průnikem účinné látky k cílovým strukturám přes porušenou kůži. Toto by mohlo korelovat s popisovaným dobrým efektem takrolimu u pyoderma gangrenosum [16]. Takrolimus 0,1% mast byl také úspěšně použit u pacientky s atypickou lokalizací NL v oblasti obličeje, kdy došlo poměrně rychle k úplné ztrátě aktivity onemocnění a uspokojivý stav přetrvával i po jednom roce po ukončení léčby [25].
Fototerapie (léčba druhé linie)
• Lokální PUVA (fotochemoterapie) je v současné době v ČR obtížně aplikovatelná pro nedostupnost psoralenu. Několik prospektivních studií popisuje dobrý efekt lokální PUVA terapie s výrazným nebo alespoň částečným zlepšením stavu až u 50 % léčených pacientů [13, 32]. Příznivý efekt je popisován i u pacientů, kteří primárně neodpovídali na léčbu lokálními kortikoidy. Léčebná schémata k použití lokální PUVA terapie jsou různá, s frekvencí aplikací 2–3krát týdně. Fotosenzibilizátor, 8-methoxypsoralen, se aplikuje přísně na ložiska, následuje expozice UVA záření. Počáteční, stoupající i udržovací dávka UVA záření je individuální a určuje se podle tolerance pacienta a efektu léčby. Mezi vedlejší účinky lokální PUVA terapie patří hyperpigmentace, vznik puchýřů, erytém nebo iritace v ozařované oblasti. V jedné studii byla PUVA terapie aplikována 2krát týdně, dokud docházelo ke zlepšení, s průměrným počtem ozařování 20 (rozmezí 5–42). PUVA terapie byla úspěšně použita i u pacientů s ulcerací a nebyl u ní popsán vedlejší účinek ve smyslu atrofie kůže.
• Širokospektrá UVA fototerapie (320–400 nm) a úzkospektrá UVA1 fototerapie (340–400 nm) je účinná v léčbě zánětlivých kožních onemocnění, může se použít i v léčbě některých granulomatózních chorob, jako je sarkoidóza, granuloma anulare i necrobiosis lipoidica. Efekt UVA záření je dán jeho průnikem hluboko do dermis, kde indukuje apoptózu Th lymfocytů a snižuje počet Langerhansových buňek a mastocytů. V léčbě NL se přednostně používá záření UVA1, publikovaných sdělení týkajících se této léčby však není mnoho. Ucelená studie zahrnuje 6 pacientů s refrakterními ložisky NL léčených UVA1 fototerapií jako léčbou druhé nebo třetí linie. Efekt léčby byl dobrý u 5 pacientů, u kterých došlo k úplnému nebo částečnému zlepšení stavu, u jednoho pacienta neměla léčba efekt žádný. Pacienti nebyli léčeni podle jednotného protokolu, ozařování absolvovali 2–5krát týdně a celkem absolvovali 15–51 sezení. Při vyhodnocení výsledků došli autoři k závěru, že nejlépe vyhovoval režim s aplikací 2–3krát v týdnu, lepšího výsledku bylo dosaženo u pacientů, kteří absolvovali celkově větší počet sezení [5]. Jedná se však o zhodnocení velmi malého souboru pacientů.
Použití UVA1 fototerapie je limitováno jejím karcinogenním potenciálem, kdy se riziko vzniku nádorů zvyšuje s nárůstem kumulativní dávky záření. Při léčbě je třeba zvážit poměr rizika ku prospěchu, neboť podle výsledků vyhodnocení, byť malého souboru pacientů, se zdá, že je nutno léčbu provádět dlouhodoběji [5].
Ostatní léčba
Systémová léčba
• Celkově podané kortikosteroidy mohou zastavit progresi a navodit regresi ložisek, tato léčba by však měla být indikována jen ve výjimečných případech vzhledem k potenciálním nežádoucím účinkům celkově podaného kortikosteroidu, navíc často u prediabetických nebo diabetických pacientů. Udává se účinek prednisolonu podaného v úvodní dávce 1 mg/kg/den se snížením na dávku 40 mg/ den s viditelnou rychlou odpovědí a dramatickým zlepšením ložisek NL během prvních týdnů léčby. Léčba byla ponechána několik týdnů. Zcela vymizely klinické známky jako erytém a infiltrace a v následném několika měsíčním sledování nebyla patrná žádná recidiva. V jiném případě pětitýdenní podání systémového kortikosteroidu vedlo u všech 6 sledovaných pacientů k zastavení aktivity onemocnění a v následném sedmiměsíčním sledování zůstávalo onemocnění v remisi. Již vzniklé atrofické změny nebyly léčbou pozitivně ani negativně ovlivněny [33, 41].
• Cyklosporin A v léčbě je popsán v několika kazuistikách [11, 39]. Ve všech publikovaných případech byl cyklosporin podán u pacientů s ulcerovanými lézemi NL, které byly refrakterní k různé předcházející léčbě. Dávkování cyklosporinu bylo v rozmezí 2,5–5 mg/kg/den. Vždy došlo k poměrně rychlému nástupu účinku léčby (s viditelným pozitivním efektem do jednoho měsíce od zahájení léčby), cyklosporin byl podáván po dobu 4–8 měsíců a ve všech případech byla léčba hodnocena jako úspěšná s odhojením ložisek. Mechanismus účinku cyklosporinu u ulcerujících lézí není plně objasněn. Předpokládá se, že lék zastaví zánětlivou odpověď v místě alterovaného kolagenu a v terénu porušené mikrocirkulace umožní hojení lézí.
• Antimalarika se v dermatologii používají zejména v léčbě fotodermatóz a diskoidního a systémového lupus erythematodes. Využívá se jejich protizánětlivého a imunosupresivního účinku. Po dobu léčby jsou nutné pravidelné oční kontroly. Podání chlorochinu (v dávce 200 mg/den, po dobu 2–12 měsíců) nebo hydroxychlorochinu (v dávce 400 mg/den po dobu 12 měsíců) vedlo u 7 z 8 sledovaných pacientů ke zlepšení stavu NL ve smyslu ústupu zánětu a redukce erytému nebo postupného úplného odhojení ložisek s reziduální hyperpigmentací. U tří pacientů se objevil relaps po vysazení léčby [12]. V několika jiných popisovaných případech však léčba antimalariky neměla u NL efekt žádný.
• Doxycyklin je popsán jen u několika případů, zato s úspěšným výsledkem. Jakým mechanismem zde doxycyklin přesně působí, není jasné. Inhibuje metaloproteinázy, které hrají roli v etiologii zánětu, inhibuje tvorbu granulomů in vitro pravděpodobně cestou inhibice proteinkinázy C. Doxycyklin byl úspěšně použit v léčbě dalších granulomatózních onemocnění jako sakrokoidóza a granuloma anulare. Existuje kazuistika 12letého diabetického dítěte s torpidním ložiskem NL, které bylo léčeno lokálními a intralesionálními kortikoidy bez většího efektu, navíc se u něj začaly projevovat nežádoucí účinky lokálně aplikovaných kortikoidů, zejména výraznější atrofie ve stále aktivním ložisku. Do léčby byl přidán perorální doxycyklin v dávce 100 mg 2krát denně, došlo k rychlému zlepšení stavu, léčba však musela být ponechána několik měsíců [8].
• Estery kyseliny fumarové působí imunomodulačně a protizánětlivě cestou ovlivnění T lymfocytů, dendritických buněk, keratinocytů, gliálních buněk i buněk endotelu cév, snižují tvorbu zánětlivých cytokinů, indukují apoptózu, inhibují proliferaci keratinocytů, snižují expresi adhezivních molekul a redukují zánětlivý infiltrát. Jejich původní úzké použití v léčbě lupénky bylo rozšířeno o off-label léčbu dalších nemocí [13, 28], mimo jiné je i několik zmínek o jejich použití v léčbě NL. Jejich použití je provázeno častými vedlejšími účinky, způsobují lymfopenii a leukopenii, bolesti hlavy, bolesti břicha a průjmy.
Účinnost léčby estery kyseliny fumarové byla sledována u 18 pacientů s NL léčených ve standardním režimu používaném při léčbě psoriázy po dobu nejméně půl roku [26]. Tři pacienti léčbu nedokončili, u ostatních byl konstatován pozitivní efekt léčby, nicméně u některých pacientů se objevily gastrointestinální nežádoucí účinky.
• Intravenózní imunoglobuliny (IVIG) v léčbě NL jsou zmíněny pouze u pacientů, u kterých byly IVIG podány pro jiné onemocnění a ovlivnění ložisek NL nebylo primárním cílem léčby. U dvou pacientů léčených pro imunologické onemocnění došlo i k rychlému odhojení jejich ložisek nekrobiózy, efekt léčby přetrvával dlouhodoběji [3]. Další pacient s ložisky ulcerující NL, která byla rezistentní k dosavadní jiné terapii, reagoval na léčbu IVIG jen slabě, po přidání intravenózně podaného metylprednisolonu došlo ke zhojení lézí [4].
• Anti-TNF biologika mohou mít efekt v léčbě granulomatózních onemocnění. Tumory nekrotizující faktor je totiž protizánětlivý cytokin s významnou patogenetickou rolí u granulomatózního zánětu a u chronických zánětlivých procesů. V několika kazuistikách je zmíněno použití infliximabu, etanerceptu a adalimimabu v léčbě NL. V roce 2019 bylo publikováno souhrnné sdělení shrnující veškeré dostupné informace o použití anti-TNF preparátů v léčbě NL [36]. Zahrnuje celkem 15 léčených pacientů, biologika byla podávána převážně v klasickém dávkovacím režimu a ve většině případů došlo k odhojení projevů NL během několika měsíců bez recidivy po vysazení léčby.
• Thalidomid je látka ze skupiny imunosupresiv s imunomodulační, protizánětlivou a protinádorovou aktivitou spojenou s potlačením tvorby tumory nekrotizujícího faktoru, dále má účinky antiangiogenní, které jsou zprostředkovány inhibicí vaskulárního endoteliálního růstového faktoru a beta fibroblastového růstového faktoru. Používá se v léčbě erythema nodosum leprosum a mnohočetného myelomu. V literatuře jsou zmínky o jeho off-label užití v léčbě aftózní stomatitidy, pruriga, sarkoidózy, lichen planus, erythema nodosum i necrobiosis lipoidicia. Jedná se o ojedinělá sdělení. Je popisován případ úspěšného odhojení mnohočetných ložisek NL u 51leté pacientky léčené thalidomidem v úvodní dávce 150 mg/den, postupně snížené na 50 mg 2krát v týdnu. Nežádoucí účinky léčby se u ní neprojevily, po dvouletém sledování po ukončení léčby byla bez potíží [27]. Terapie thalidomidem je výrazně limitovaná jeho nežádoucími účinky, lék je silně teratogenní, vyvolává periferní neuropatie, trombembolické příhody, neuropenie, trombocytopenie. Jako léčebná možnost je zde uveden jen pro úplnost, jeho reálné použití v léčbě NL v praxi by bylo problematické.
• Kyselina acetylsalicylová a dipyridamol mají teoreticky také potenciál v léčbě NL. Jejich použití vychází z předpokladu, že v etiopatogenezi NL by mohla hrát určitou úlohu i angiopatie, a tak by preparáty mající vliv na cévy nebo srážení krve mohly mít smysl. Týká se to mimo jiné působením na fibrinolýzu, agregaci trombocytů a syntézu tromboxanu A2, které ovlivňují mikroangiopatii a vaskulární trombózu. Pacienti léčení aspirinem a dipyridamolem byli sledováni v menších studiích. Použití aspirinu v monoterapii nebylo vyhodnoceno jako efektivní, u 16 pacientů s NL léčených aspirinem v dávce 40 mg/den anebo placebem nebyl signifikantní rozdíl ve výsledku léčby. Ani kombinace aspirinu s dipiridamolem nevedla k uspokojivým výsledkům, bylo sledováno 14 pacientů léčených buď kombinací aspirinu (300 mg 3krát denně) a dipyridamolu (75 mg 3krát denně), anebo placebem; rozdíl v efektu nebyl žádný [40]. Existují však jednotlivé kazuistiky, které naopak popisují pozitivní efekt aspirinu, zejména pak při jeho použití u ulcerujících lézí.
• Pentoxifylin je látka ze skupiny xantinových derivátů, používá se k léčbě chorob s poruchou prokrvení aterosklerotické, diabetické nebo zánětlivé etiologie, také u dystrofických poruch, angioneuropatií. Způsobuje relaxaci hladkého svalstva arteriol a zároveň snižuje krevní viskozitu zejména v oblasti mikrocirkulace. Tím dochází ke zlepšení krevního průtoku a nasycení tkání kyslíkem. Pravděpodobně má také protizánětlivý a cytoprotektivní účinek, působí inhibičně na tvorbu cytokinů, zejména anti-TNF, snižuje aktivaci neutrofilů. Působí tedy na několik faktorů, které hrají roli v rozvoji ložisek NL. Vedlejší účinky jsou vzácné, mohou být v oblasti gastointestinálního traktu, hematologické, může se objevit hypotenze. Je popsáno několik kazuistik úspěšného podání pentoxifylinu v léčbě NL, a to jak u diabetických, tak u nediabetických pacientů [45]. Při podání u čerstvých lézí došlo k zastavení progrese zánětlivého procesu a zastavení aktivity onemocnění, v jednom případě i k téměř úplnému odhojení ložiska, při podání u dlouhotrvající léze s ulcerací došlo k zacelení ložiska a hojení do atrofie. Je opakovaně zdokumentována také úspěšná léčba pentoxifylinem u NL v atypické lokalizaci na glans penis [9]. Dávkování léku bylo vždy stejné, 3krát denně 400 mg, a lék byl podáván dlouhodoběji, po dobu 10 měsíců až jednoho roku [45].
• Nikotinamid je ve vodě rozpustný vitamín skupiny B, inhibuje cytokiny a snižuje migraci makrofágů. V dávce 500 mg podávané 3krát denně byl použit s částečným efektem jak v léčbě NL, tak v léčbě granuloma anulare [20].
• Klofazimin je lék používaný na léčbu multirezistentní tuberkulózy a lepry. Má četné závažné nežádoucí účinky, v ČR je používaný jen ve specifickém léčebném programu při léčbě těchto onemocnění. Zde je uveden pouze pro úplnost, neboť jsou zmínky o jeho pozitivním efektu na ložiska NL. Ve sledované studii 20 pacientů léčených pro diseminované granuloma anulare nebo NL klofaziminem v dávce 200 mg/den po dobu 6–12 měsíců došlo u 60 % z nich ke kompletní remisi onemocnění nebo výraznému zlepšení stavu, závažné nežádoucí účinky léku nebyly v této skupině zaznamenány [29].
Ostatní léčebné postupy
• Fotodynamická léčba (PDT) je v dermatologii využívána zejména v léčbě aktinické keratózy, morbus Bowen a superficiálního bazaliomu. Vzhledem k tomu, že k akumulaci fotosenzibilizátoru dochází také v ložiskách chronického zánětu, byla léčba použita i u NL [14]. Fotodynamická léčba je založena na selektivní fotosenzibilizaci pomocí lokálně aplikovaného fotosenzibilizátoru (jako jsou kyselina delta-aminolevulová nebo methylester kyseliny delta-aminolevulové), který po ozáření světlem vyvolá na kyslíku závislou cytotoxickou reakci. U ulcerujících lézí se předpokládá, že PDT působí pozitivně díky kombinaci protizánětlivého efektu, imunomodulační aktivity a fotoaktivace keratinocytů. PDT představuje cílenou léčbu, velkou limitací je bolestivost při ošetření. Soubory sledovaných pacientů léčených PDT jsou jen velmi malé, někdy se jedná jen o publikované jednotlivé kazuistiky, efekt léčby je rozdílný. Jediný větší soubor pacientů hodnotí retrospektivní studie 65 pacientů léčených PDT, jednalo se o pacienty diabetické i nediabetické, s ložisky ulcerovanými i bez ulcerace. PDT byla aplikována v klasickém režimu nebo s denním světlem, efekt léčby byl vyhodnocen jako dobrý u 66 % pacientů bez zjištění signifikantního rozdílu při použití klasického režimu nebo denního světla [24].
• Hyperbarická terapie v hyperbarické komoře je účinnou metodou v hojení chronických ran a může být přínosná i v léčbě NL, zejména u její ulcerované formy. Existují dvě kazuistiky popisující úspěšné zahojení ulcerujících ložisek NL rezistentních k rozličné dosavadní terapii. Počet sezení v hyperbarické komoře, který byl nutný k dosažení efektu byl vysoký (98 respektive 113) a léčba byla kombinována s lokální aplikací kortikoidů [7, 46].
• Pulzní barvivový laser (pulsed-dye laser, PDL) zmiňuje několik kazuistik, publikováno je několik případů pozitivního ovlivnění ložisek, kdy došlo k jejich oploštění, ústupu erytému, zlepšení stran ektazií, ústupu bolestivosti a celkově ke zlepšení komfortu nemocných. Efekt léčby může být u jednoho ložiska v jeho různých oblastech různý. Úplného odhojení lézí se nepodařilo dosáhnout. Nejlepší výsledky přináší opakované ošetření. Příkladem může být případ 57leté diabetičky se dvěma lézemi NL velikosti do 7 cm v průměru, opakovaně ošetřenými PDL (vlnová délka 595 nm, průměr ošetření 10 mm, tok 5 J/cm2, v pulzu 3 ms, intermitentně chlazení). K ošetření se dostavila nejprve 1krát měsíčně po dobu tří měsíců, následně pak 1krát za tři měsíce po dobu dalších 9 měsíců. Po úvodních třech sezeních došlo ke zlepšení stavu, ale výraznější efekt byl pozorován až po dalším opakovaném ošetření [6]. V literatuře se nachází zmínky o jednorázovém ošetření ložisek PDL, zde efekt léčby nebyl žádný. V jiném případě pak přineslo ošetření aplikované celkem 3krát v 8 týdenních odstupech jen velmi malou redukci ložisek NL. Z tohoto malého počtu publikovaných zkušeností se zdá, že výhodnější a účinnější je opakované ošetření ložisek laserem, jednorázové ošetření efekt nepřináší [6, 23]. V literatuře se popisuje také jeden případ použití laseru k léčbě neulcerující NL u dítěte. Autoři mají v tomto případě lepší zkušenost s použitím vlnové délky 585 nm, plochou ošetření 5 mm, tok 2–4 J/cm2 a krátkým pulzem trvajícím 250 μsec. Výhodu vidí v lepší toleranci, menší bolestivosti ošetření při srovnání s ošetřením 595 nm laserem [23].
Terapie ve zvláštních situacích
• Ulcerující NL léčebně zahrnuje léčbu samotné ulcerace, léčbu nekrobiotického ložiska a léčbu bolesti. Péče o vlastní ulceraci je nedílnou součástí léčby. Důležité je i řešení dalších faktorů, které obecně ovlivňují hojení ran (malnutrice, redukce otoku dolních končetin). Vlastní ulceraci ošetřujeme podle pravidel péče o chronickou ránu s použitím mastí či vhodného krytí. V léčbě samotného ložiska NL se doporučují spíše agresivnější postupy s aplikací vysokopotentních lokálních kortikosteroidů nebo lokálního takrolimu na kůži v okolí ulcerace, byl popsán efekt lokálně aplikované PUVA terapie, antimalarik a pentoxifylinu. Venotonická léčba je vhodným doplněním terapie. Chirurgické možnosti léčby ulcerující NL jsou omezené. Při povrchové excizi ložisko recidivuje, proto je nezbytné provést excizi dostatečně hluboko až do úrovně periostu či hluboké fascie. I tak ale může k rekurencím dojít. Je zde také možnost vzniku chirurgicky indukovaného Koebnerova fenoménu, také kosmetický efekt hluboké incize nemusí být ideální [34].
• Necrobiosis lipoidica u dětí je onemocnění vzácné, vyskytuje se rovněž s vazbou na diabetes, někdy mohou kožní projevy diabetes předcházet [8]. U dětí je klinický obraz a průběh obdobný jako u dospělých. Diferentní léčba je indikovaná, pokud má ložisko aktivní okraj nebo pokud ulceruje. K aktivnímu okraji je možno aplikovat lokální vysokopotentní kortikosteroidy nebo intralezionální kortikosteroidy, pod dohledem. Ulcerace lze léčit klasicky krytím, nehojící se ulcerace mohou vyžadovat léčbu kožními štěpy (skin grafting). Jiná účinná léčba není u dětí doporučována [22].
ZÁVĚR
NL je kožní onemocnění často sdružené s diabetem, proto je vhodné screeningové laboratorní vyšetření. Kauzální léčba zatím není k dispozici, současné léčebné možnosti však mohou zpomalit průběh onemocnění nebo jej zcela zastavit. Časná terapie může vést i k úplnému odhojení projevů. Sám pacient může režimovými a preventivními opatřeními napomoci příznivějšímu průběhu onemocnění. Smysluplná je i dispenzarizace pacienta pro riziko ulcerace a vzniku spinocelulárního karcinomu.
Do redakce došlo dne 9. 2. 2021.
Adresa pro korespondenci:
MUDr. Jana Nováková
Kožní oddělení FN Ostrava a LF OU Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: jana.novakova@fno.cz
Sources
1. ARAGHI, F., TABARY, M., RAKHSAN, A. et al. Necrobiosis lipoidica – like lesions in a nondiabetic patient with systemic sarcoidosis: A case report and review of the literature. Clinical Case Reports, 2020.
2. BALL, S. L., SALMON, N. J., TIDMAN, M. J. Treatment of necrobiosis lipoidica with intra-lesional glucocorticoid. Brit J Diab., 2018, 18(3), p. 122–123.
3. BAROUTI, N., CAO, A. Q., FERRARA, D., PRINS, CH. Succesful treatment of ulcerative and diabeticorum necrobiosis lipoidica with intravenous immunoglobulin in a patient with Common Variable Immunodeficiency. JAMA Derm., 2013, 149(7), p. 879–881.
4. BATCHELOR, J. M., TODD, P. M. Treatment of ulcerated necrobiosis lipoidica with intravenous immunoglobulin and methylprednisolon. J Drug Dermatol., 2012, 111(2), p. 256–259.
5. BEATTIE, P. E., DAWE, R. S., IBBOTSON, S. H. et al. UVA1 phototherapy for treatment of necrobiosis lipoidica. Clin Exp Dermatol., 2006, 31(2), p. 21.
6. BERGQVIST, E., BERGQVIST, G. The long - term effect of pulsed dye laser on necrobiosis lipoidica: A case study. Journal of Cosmetic and Laser Therapy, 2019, 21(1), p. 17–18.
7. BOUHANICK, B., VERRET, J. L., GOUELLO, J. P. et al. Necrobiosis lipoidica: Treatment by hyperbaric oxygen and local corticosteroids. Diabetes and Metabolism, 1998, 24(2), p. 156–159.
8. BURNS, E., UKOHA, U., CHAN, A. Necrobiosis lipoidica with rapid response to doxycycline. Pediatric Dermatology, 2020, 37(5), p. 981–982.
9. CHAN, S. A., THOMAS, M., SNEAD, D. Penile necrobiosis lipoidica: A case report and literature rewiew. Clin Exp Dermatol., 2018, 44(4), p. 441–443.
10. CHANDAN, N., JERDAN, K., TSOUKAS, M. et al. Sarkoidosis with cutaneous manifestations of necrobiosis lipoidica. Am Jour Dermatopathol., 2020, 42(4), p. 308–311.
11. DARVAY, A., ACLAND, K. M., RUSSEL-JONES, R. Perzistent ulcerated necrobiosis lipoidica responding to treatment with cyclosporin. Br J Dermatol., 1999, 141, p. 725–727.
12. DURUPT, F., DALLE, S., DEBARBIEUX, S. et al. Successful treatment of necrobiosis lipoidica with antimalar agents. Arch Dermatol., 2008, 144, p. 118–119.
13. ERFURT-BERGE, C., DISSEMOND, J., SCHWEDE, K. et al. Updated results of 100 patients on clinical and therapeutic options in necrobiosis lipoidica in a retrospective multicentre study. Eur. J. Derm., 2015, 26(6) p. 595–601.
14. FIALOVÁ, P., VAŠKŮ, V. PDT a možnosti jejího využití v dermatologii. Dermatologie pro praxi, 2017, 11(4), p. 166–169.
15. GEBAUER, K.,ARMSTRON, M. Koebner phemomenon with necrobiosis lipoidica diabeticorum. Inter Journ Derm., 1993, 23(12), p. 895–896.
16. GINOCCHIO, I., DRAGHI, L., DARVISHIAN, F. et al. Refractory ulcerated necrobiosis lipoidica: Closure of a difficult wound with topical tacrolimus. Adv Skin Wound Care, 2017, 30(10), p. 469–472.
17. GORI, N., DI STEFANI, A., DE LUCA, E. V. et al. A case of disseminated perforating necrobiosis lipoidica. Clin Case Rep., 2020, 8, p. 808–810.
18. GRIFFITHS, CH., BARKER, J., BLEIKER, T. et al. Rooks Textbook of Dermatology, 2017, Vol. III, 9 th Edition. p. 97.8–97.11.
19. HAMMER, E., LILIENTHAL, E., HOFER, S. E. et al. Risk factors for necrobiosis lipoidica in type I diabetes mellitus. Diabetic Medicine, 2017, 34(1), p. 86–92.
20. HANDFIELD-JONES, S., PEACHEY, R. High dose nicotinamide in the treatment of necrobiosis lipodicia. Br JDerm., 1988, 118, p. 693–696.
21. HASHEMI, D. A., BROWN-JOEL, Z. O., TKACHENKO, E. Clinical features and comorbidities of patients with necrobiosis lipoidica with or without diabetes. JAMA Derm., 2019, 155(4), p. 455–459.
22. IRVINE, A. D., HOEGER, P. H., YAN, A. C. Harpers Text-book of Dermatology, 2012, Third Edition, Vol III, p. 172.22.
23. JEAN-LOIC, M., ODILE, R. Treatment of necrobiosis lipodica with 595 nm pulsed laser - a case report. Open Der Jour., 2008, 2, p. 22–25.
24. KAAE, J., PHILIPSEN, P. A., WULF, H. CH. Photodynamic therapy of necrobiosis lipoidica using methyl aminolevulate: A retrospective follow-up study. Photodiagnosis and Photodynamic Ther., 2018, 22, p. 223–226.
25. KOURA-NISHIURA, A.,YONEDA, K., NAKAI, K. Clearence of atypical facial necrobiosis lipoidica with tacrolimus ointement. JEADV, 2016, 30(2), p. 833–385.
26. KREUTER, A., KNIERIM, C., STUCKER, M. et al. Fumaric acid esters in necrobiosis lipoidica: results of prospective noncontolled study. Br J Dermatol., 2005, 153(4), p. 802–807.
27. KUKREJA, T., PETERSEN, J. Thalidomide for treat-ment of refractory necrobiosis lipoidica. Arch Dermatol., 2006, 142(1), p. 20–22.
28. MEISSNER, M., VALESKY, E. M., KIPPENBERGER, S. et al. Dimethyl fumarate – only anti-psoriatic medication? JDDG, 2012, 10, p. 793–801.
29. MENSING, H. Clofazimine – therapeutic alternative in necrobiosis lipoidica and granuloma annulare. Hautarzt, 1989, 40, p. 99–103.
30. MISTRY, B. D., ALAVI, A., ALI, S. A systematic review of the relationship between glycemic control and necrobiosis lipoidica diabeticorum in patiens with diabetes mellitus. Int Jour Derm., 2017, 56(12), p. 1319–1327.
31. MULLER, S. A., WINKELMANN, R. K. Necrobiosis lipoidica diabeticorum. A clinical and pathological investigation of 171 cases. Arch Dermatol., 1966, 93, p. 272–281.
32. PECKRUHN, M., TITTELBACH, J., ELSNER, P. Update: Treatment of necrobiosis lipoidica. Deutsche Dermatologic Gesellschaft, 2017, p. 151–157.
33. PETZELBAUER, P., WOLFF, K., TAPPEINER, G. Necrobiosis lipoidica: treatment with systemic cortico-steroids. Brit Jour Derm., 1992, 126, p. 542–545.
34. REID, S. D., LADIZINSKI, B., LEE, K. Update on necrobiosis lipoidica: A review of etiology, diagnosis, and treatment. J Am Acad Dermatol., 2013, 69(5), p. 783–791.
35. RODENAS-HERRANZ, T., LINARES-GONZÁLEZ, L. L., ESPAŇA, R. R. Pancreas-kidney transplantation resolves chronic necrobiosis lipoidica: A case report. Derm Ther., 2020, 33(4), p. e 13484.
36. SANDHU, J. K., ALAVI, A. The role of anti-tumor necrosis factor in wound healing: A case report of refractory ulcerated necrobiosis lipoidica treated with adalimumab and reiew of the literature. JCMS Case Report, 2019, 7, p. 1–5.
37. SCHIMANOVICH, I., ERDMANN, H., GRABBE, J. Necrobiosis lipoidica in monozygotic twins. JAMA Derm., 2008, 144(1), p. 119–120.
38. SEVERSON, K., XIE, D., CHA, S. et al. 338 Necrobiosis lipoidica comorbidities and complications. Jour Invest Derm., 2018, 138(5), p. 557.
39. STANWAY, A., RADEMAKER, M., NEWMAN, P. Healing of severe ulcerative necrobiosis lipoidica with cyklosporin. Australas JDerm., 2004, 45(2), 1, p. 119–122.
40. STATHAM, B., FINALY, A. Y., MARKS, R. A randomized double blind comparsion of an aspirin dipyrimadol combination versus a placebo in the treatment of necrobiosis lipoidica. Acta Derm Venereol., 1981, 61, p. 270–271.
41. TAPPEINER, G. Necrobiosis lipoidica: treatment with systemic corticosteroids. Br J Dermatol., 1992, 126, p. 542–545.
42. UVA, L., FREITAS, J., SOARES DE ALMEIDA, L. et al. Squamous cell carcinoma arising in ulcerated necrobiosis lipoidica diabeticorum. Inter Wound Jour., 2015, 12(6), p. 741–743.
43. YASAR, S., KAYNAK, E., GUNES, P. et al. Atypical localisation of Necrobiosis Lipoidica: Involvement of the Face and Scalp. Skin Appendage Disord., 2017, 3, p. 92–94.
44. WANAT, K., ROSENBACH, M. Necrobiosis lipoidica. 2018, Uptodate.com.
45. WEE, E., KELLY, R. Penoxyfylline: An effective therapy for necrobiosis lipoidica. Australasian J Derm., 2015, 58(1), p. 65–68.
46. WEISZ, G., RAMON, Y., WAISMAN, D. et al. Treatment of necrobiosis lipoidica by hyperbaric oxygen. Act Derm Vener., 1993, 73(6) p. 447–448.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2021 Issue 2-
All articles in this issue
- Necrobiosis lipoidica
- KONTROLNÍ TEST
- Účinnost biologické léčby středně těžké až těžké psoriázy – analýza z registru BIOREP
- Periungvální útvar prstu ruky. Popis případu
- Dermatoskopické obrazy miniaturních a tenkých melanomů zachycených při dispenzarizaci nemocných s melanomem. Série případů
- Zápis z on-line schůze výboru ČDS 25. 2. 2021
- Odborné akce 2021
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Necrobiosis lipoidica
- Dermatoskopické obrazy miniaturních a tenkých melanomů zachycených při dispenzarizaci nemocných s melanomem. Série případů
- Periungvální útvar prstu ruky. Popis případu
- Účinnost biologické léčby středně těžké až těžké psoriázy – analýza z registru BIOREP
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

