-
Medical journals
- Career
Kožné nežiaduce účinky inhibítorov receptora epidermálneho rastového faktora v onkologickej terapii
: M. Kuklová 1; S. Urbanček 1; M. Šimaljaková 2
: Dermatovenerologická klinika SZU, FNsP F. D. Roosevelta, Banská Bystrica 1; Dermatovenerologická klinika LFUK a FNsP, Bratislava 2
: Čes-slov Derm, 85, 2010, No. 2, p. 92-98
: Pharmacologyand Therapy, Clinical Trials
V poslednom desaťročí sa v klinickej praxi začali uplatňovať nové protinádorové preparáty označované pre svoj špecifický účinok termínom „cielená“ liečba. Prostriedkami cielenej terapie sú monoklonálne protilátky, inhibítory tyrozínkináz, inhibítory proteazómov a angiogenézy. Napriek ich nespornému medicínskemu prínosu sa s využitím tejto terapie spája množstvo nežiadúcich účinkov, pričom medzi najčastejšie radíme nežiaduce účinky na kožu. Tieto prejavy sú veľmi často pozorované pri terapii látkami inhibujúcimi aktivitu epidermálneho rastového faktora a jeho receptora.
Kľúčové slová:
cielená liečba – monoklonálne protilátky – inhibítory tyrozínkináz – receptor epidermálneho rastového faktora – nežiadúce účinkyÚvod
Na základe výrazného pokroku v oblasti poznania onkogenézy bolo v posledných rokoch uvedených do klinickej praxe viacero nových onkologických preparátov na určité typy karcinómov ako lokálne pokročilý alebo metastazujúci nemalobunkový karcinóm pľúc, metastazujúci kolorektálny karcinóm, karcinóm prsníka, metastatický karcinóm prsníka, pokročilý a/alebo metastatický karcinóm z obličkových buniek, skvamocelulárny karcinóm hlavy a krku a iné. Tieto nové liečebné modality označujeme termínom „cielená liečba“ pre ich špecifický účinok v rôznych fázach procesu karcinogenézy. Účinok terapie zahŕňa inhibíciu rastových faktorov, inhibíciu membránových a cytoplazmatických receptorov, inhibíciu transdukčnej kaskády blokádou rôznych tyrozínkináz, inhibíciu regulačných proteínov bunkového cyklu, inhibíciu angiogenézy a metastazovania, indukciu apoptózy a diferenciácie (4). Do skupiny týchto moderných preparátov patria monoklonálne protilátky proti receptoru epidermálneho rastového faktora (epidermal growth factor receptor – EGFR), zamerané na extracelulárnu časť receptora (napríklad cetuximab, panitumumab, transtuzumab a.i.) a inhibítory tyrozínkinázy (napríklad erlotinib, gefinitib, sorafenib a.i.) zamerané na intracelulárnu časť receptora.
EGF-receptor je transmembránový proteín, nachádzajúci sa na povrchu niektorých buniek. Exprimujú ho viaceré nádorové bunky, ale taktiež bunky niektorých normálnych tkanív. EGFR je aktivovaný rastovými faktormi – ligandmi, ktoré sa viažu na extracelulárnu časť receptora. Pri aktivácii dochádza k autofosforylácii intracelulárnej tyrozínkinázovej domény. Táto fosforylácia vedie k dimerizácii receptorov, čím je vlastne zahájená signálna kaskáda a takto je prenesený signál až do jadra. V jadre sa prenesená informácia prejaví aktiváciou transkripcie cieľových génov. V kaskáde intracelulárnych signálov pri aktivácii EGFR sa zúčastňujú aj proteínkinázy, ktoré vedú k proliferácii, rezistencii k apoptóze a zvýšenej tendencii k angiogenéze. Liečba založená na inhibícii EGFR dokáže inhibovať prenos proliferačných signálov. Uvedené molekuly v súčasnosti znamenajú nesporne významný posun v onkologickej terapii. Prvé použitie monoklonálnych protilátok povolené americkou FDA (Food and Drug Administration) v liečbe nádorových ochorení bolo v roku 1997 (4).
Tieto preparáty vykazujú polymorfné spektrum nežiadúcich účinkov so širokým orgánovým postihnutím – postihnutie kože, gastrointestinálne ťažkosti (hnačka, dyspepsia, nauzea), poruchy krvotvorby (anémia, leukopénia, trombocytopénia), poruchy nervového, muskuloskeletálneho, kardiovaskulárneho, dýchacieho a vylučovacieho systému, ale i celkové nežiadúce účinky ako únava, horúčka, asténia a iné. Vzhľadom na frekventnosť výskytu ich delíme na veľmi časté (≥1/10), časté (≥1/100, <1/10), menej časté (≥1/1000, <1/100), zriedkavé (≥1/10 000, <1/1000) a veľmi zriedkavé (<1/10 000), pričom účinky na kožu zaraďujeme medzi veľmi časté (1). EGFR sú exprimované viacerými nádorovými bunkami, no vyskytujú sa taktiež fyziologicky v keratinocytoch, bunkách vlasových folikulov, potných a sebaceóznych žľazách, preto prejavy na koži sú priamo spojené s mechanizmom účinku, ktorý sa od týchto molekúl očakáva (1). Tým sa kožné prejavy môžu stať istým prediktívnym faktorom účinnosti onkologickej terapie. Mechanizmus, ktorým inhibícia EGFR vedie ku kožným symptómom, je prevažne neznámy (8, 12, 15), zostáva stále predmetom skúmania. Aktivácia EGFR v koži plní dôležitú funkciu v podporovaní proliferácie keratinocytov, ich prežívania a regulácii diferenciácie a keratinizácie (13), preto sa v etiopatogenéze akneiformných erupcií uvažuje, že pri blokáde EGFR sa vyvoláva zvýšenie apoptózy keratinocytov, zvýšenie ich diferenciácie, ztenšenie stratum corneum epidermis, vzniká zápalová infiltrácia folikulov, ich zväčšenie a vyplnenie veľkým množstvom keratínu (5), eventuálne že cielená liečba môže pôsobiť na imunitný systém priamo uvoľnením produkcie chemokínov v koži, nasledujúc chemotaxiou leukocytov a následnou infiltráciou do kože (13).
Z kožných prejavov sa najčastejšie jedná o akneiformné erupcie (8, 11, 13) (etiologicky odlišné od acne vulgaris). Taktiež sa vyskytujú: xeróza kože, pruritus, hypertrichóza, trichomegália rias, paronychia, kožné fisúry, exfoliácia, zmeny kvality vlasov (spomalený rast, jemnosť, lámanie, špecifické krútenie až možnosť alopécie), postihnutie slizníc – cheilitídy, glositídy a iné.
Akneiformné erupcie
Akneiformné prejavy, folikulitída sa objavuje v 43 až 85 % prípadov u pacientov liečených týmito preparátmi (11). Najčastejšími lokalitami sú seboroické zóny na tvári, v kapilíciu, na hrudníku a chrbte (1) (obr.1). Niekedy sa prejavy môžu vyskytnúť aj na dolnej časti chrbta, brucha, ramenách i dolných končatinách. Primárnou léziou je zapálená folikulárne viazaná papula alebo pustula, komedá sa nikdy nevyskytujú (2). Intenzita výsevu varíruje od ľahkých až po ťažké formy. Mikrobiologické kultivačné vyšetrenie iniciálnej primárnej lézie je negatívne (11). Akneiformné erupcie sa po zahájení terapie objavujú pomerne rýchlo, medián je v literatúre uvádzaný interval 8–21 dní (1), najčastejšie 7–10 dní (6, 11) od začiatku terapie. Prejavy sú často sprevádzané až neznesiteľným svrbením (1). Štádium toxicity sa hodnotí vzhľadom k rozsahu prejavov podľa NCI-CTCAE (National Cancer Institute – Common Terminology Criteria for Adverse Events, U.S. Department of health and human services), verzia 4.0 (9) (tab.1).
1. Akneiformný exantém u pacienta pri liečbe erlotinibom pre metastatický nemalobunkovým karcinómom pľúc. 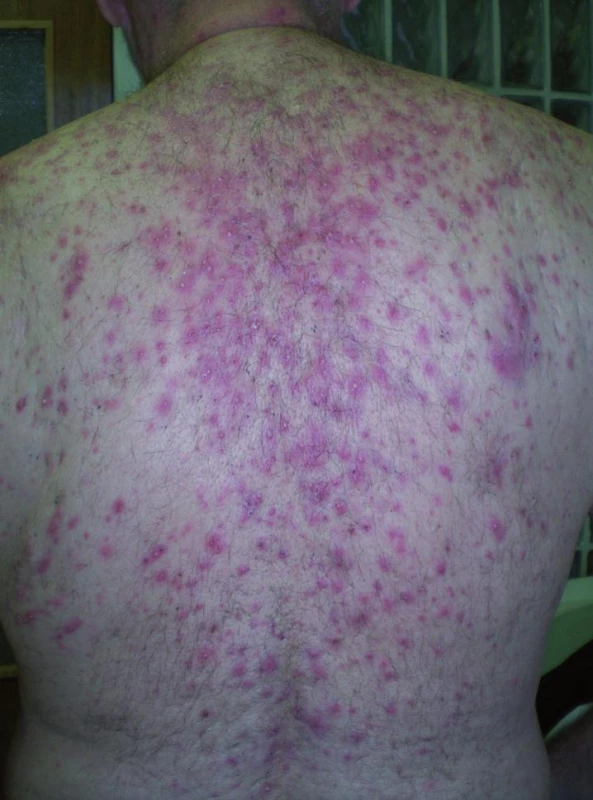
V tabuľke 1 sú rozdelené stupne toxicity v závislosti od rozsahu a závažnosti postihnutia kože a pridružených symptómov do stupňov 1 až 4, ako stupeň 5 sa pri akneiformných prejavoch udáva smrť. Najčastejšie sa vyskytujú prejavy patriace do stupňa 1 a 2 (6). Podľa jednotlivých stupňov postihnutia je doporučená lokálna terapia, celková terapia, prerušenie, eventuálne pozastavenie onkologickej terapie.
1. Prehľadná tabuľka nežiaducich účinkov podľa NCI-CTCAE (National Cancer Institute – Common Terminology Criteria forAdverse Events, U.S. Department of health and human services), verzia 4.0 (9): 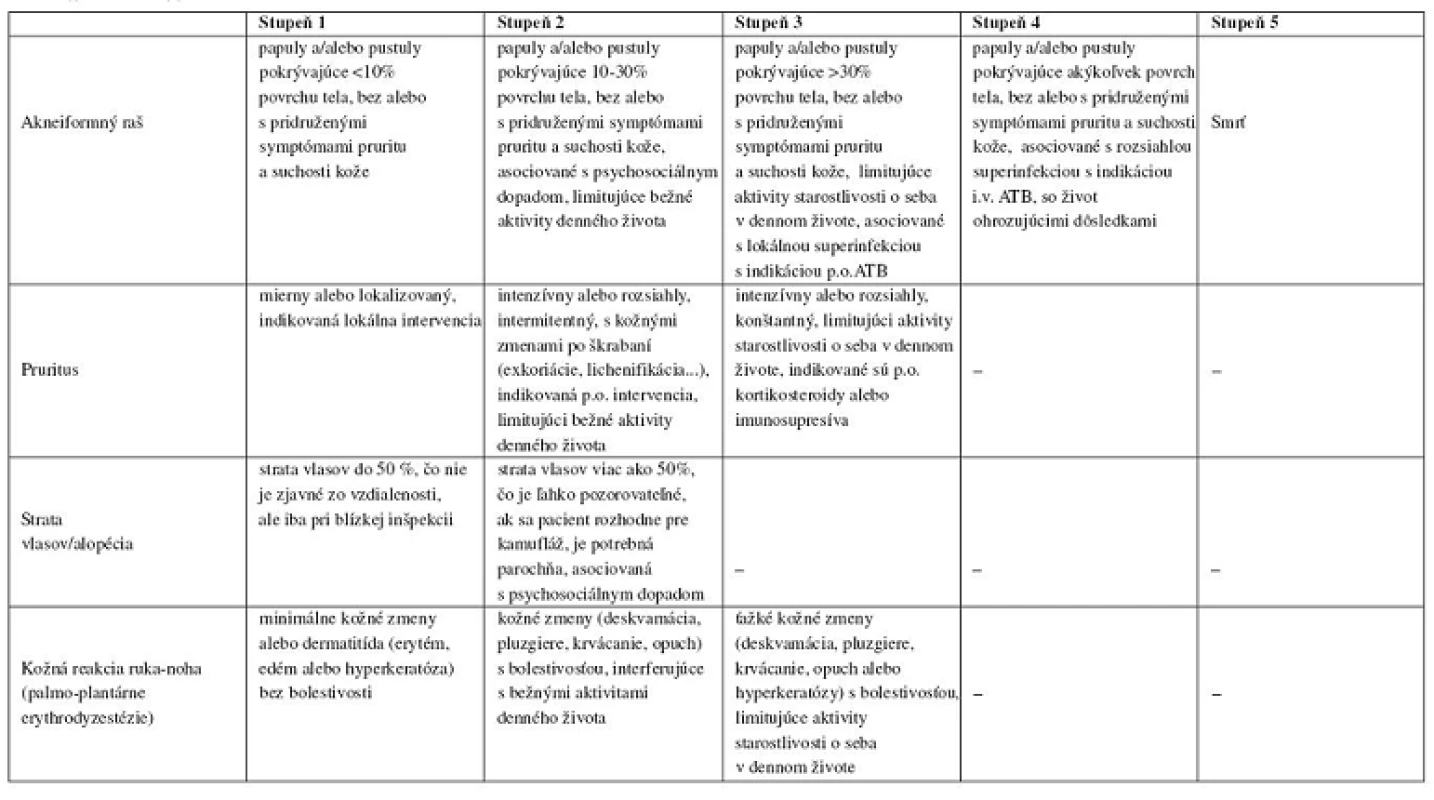
Voľba dermatologickej liečby je doporučená konsenzom odborníkov, ktorých návrhy môžu byť predmetom diskusie (1, 14). Navrhované liečebné postupy sú často analogické s liečbou akné (eventuálne s liečbou rozacey). Lokálne sa aplikujú erytromycín, klindamycín, kyselina fusidová, lokálne kortikosteroidy, benzoylperoxid, lokálne retinoidy, metronidazol. V celkovej terapii hlavne tetracyklíny (minocyklín, doxycyklín) v predĺženej dobe podávania, izotretinoín v nízkej dávke 10–20 mg denne (1, 6), s upozornením, že musí byť podávaný s opatrnosťou a za podmienky, že zlyhali ostatné intervencie. Niektorí autori odporúčajú v štádiu 3 a 4 podávanie methylprednisolonu na krátku dobu (3). Pri svrbení podávame symptomaticky antihistaminiká, analgetiká pri bolesti. Názory na podávanie orálneho izotretinoínu sa rôznia pre možnosť potencovania nežiadúcich účinkov EGFR inhibítorov a retinoidu pri xeróze kože a paronychiách (1, 6, 13). Prečo sú lokálne a systémové antibiotiká účinné, je neznáme (11). Ak sú prejavy obmedzené na oblasť tváre, hlavne u žien, je odporúčané používať kryciu dermatokozmetiku za účelom zamaskovania prejavov a tým zlepšenie spoločenského uplatnenia sa pacientov, často izolujúcich sa od spoločnosti pre svoj „hendikep“.
Xeróza kože, pruritus
Sú veľmi časté (1, 11). S porušením epidermálnej ochrannej bariéry hrozí riziko sekundárnej infekcie najčastejšie baktériou Staphylococcus aureus a vírusom Herpes simplex. Môže sa pridružiť i suchosť slizníc (1). V terapii sa používajú emolienciá, veľmi dobre pôsobí externum s obsahom 5–10% urey. Suchosť kože je často asociovaná so svrbením kože, ktoré pacienti opisujú od mierneho až po „neznesiteľný“. Tu sa tiež uplatňujú emolienciá, premasťujúce a hydratačné externá, v celkovej terapii antihistaminiká.
Zmeny vlasov, rias
Progresívna trichomegália nie je zriedkavá pri liečbe cetuximabom a erlotinibom (1) (obr.2). Taktiež môže byť pozorovaná hypertrichóza tváre. Na druhej strane môže byť rast vlasov spomalený (pacienti väčšinou udávajú zriedkavejšiu potrebu strihania vlasov ako predtým), dochádza k lámaniu vlasov, špecifickému krúteniu až k alopécii androgénneho typu (obr.3). Zaznamenané zmeny súvisia s prolongovanou terapiou EGFR inhibítormi. EGFR má kľúčovú úlohu v regulácii cyklu vlasového rastu. Fázy vlasového cyklu sú kontrolované rôznymi rastovými faktormi, vrátane EGFR, ktoré sú exprimované keratinocytmi bazálnej vrstvy a bunkami vlasových folikulov. Vlasový cyklus je pre jednotlivé časti tela rôzny. Vlasy sú naprogramované rozdielne čo sa týka ich dĺžky a počtu cyklov a potom blokáda EGFR v jednom čase samozrejme vyúsťuje v rôzne vlasové zmeny, ktoré sú závislé na type vlasu (v niektorých častiach alopécia – frontálne, v iných častiach rast a kučeravenie – tvár a riasy). V prípade potreby je riešením skrátenie rias a obočia, depilácia v prípade hypertrichózy tváre, avšak na prejavy alopécie účinná liečba nie je známa.
2. Trichomegália u pacientky pri liečbe cetuximabom pre metastatický kolorektálny karcinóm. 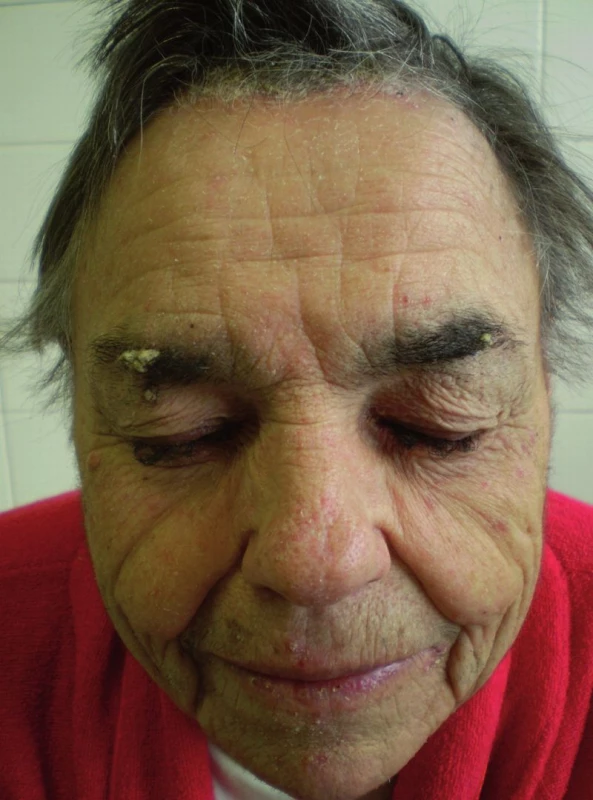
3. Alopécia androgénneho typu s výraznou xerózou u pacientky pri liečbe erlotinibom pre metastatický nemalobunkový karcinóm pľúc. 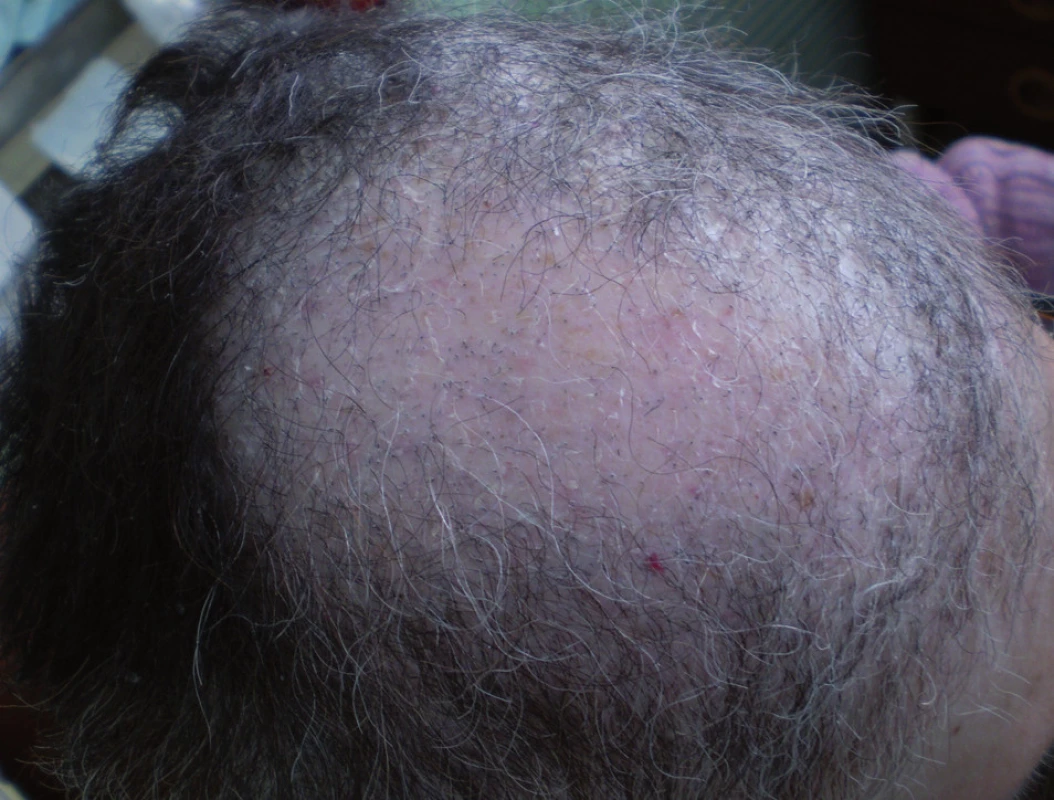
Paronychiá
Sú pozorované u 10–15 % pacientov a radia sa medzi neskoršie prejavy liečby. Zväčša začínajú obyčajne po 4–8 týždni terapie (1, 2, 7) (obr. 4). Sú pre pacientov veľmi bolestivé, limitujúce manuálnu prácu, nosenie bežnej obuvi. Často imitujú prejav unguis incarnatus, taktiež častá je sekundárna infekcia Staphylococcus aureus. Postihnuté môžu byť všetky prsty, no najčastejšie dochádza k postihnutiu palcov na rukách a nohách. Dôležité sú preventívne opatrenia – nosenie pohodlnej, voľnej obuvi, vyvarovanie sa traumatizácii (napríklad strihanie nechtov príliš nakrátko, ohrýzanie nechtov atď.) V lokálnej terapii sa uplatňujú kortikosteroidy, antiseptické, antibiotické externá, v horších prípadoch v celkovej terapii antibiotiká a niekedy liečba musí byť doplnená chirurgickou intervenciou.
4. Paronychium na haluxe pravej dolnej končatiny pri liečbe cetuximabom pre metastatický adenokarcinóm hrubého čreva. 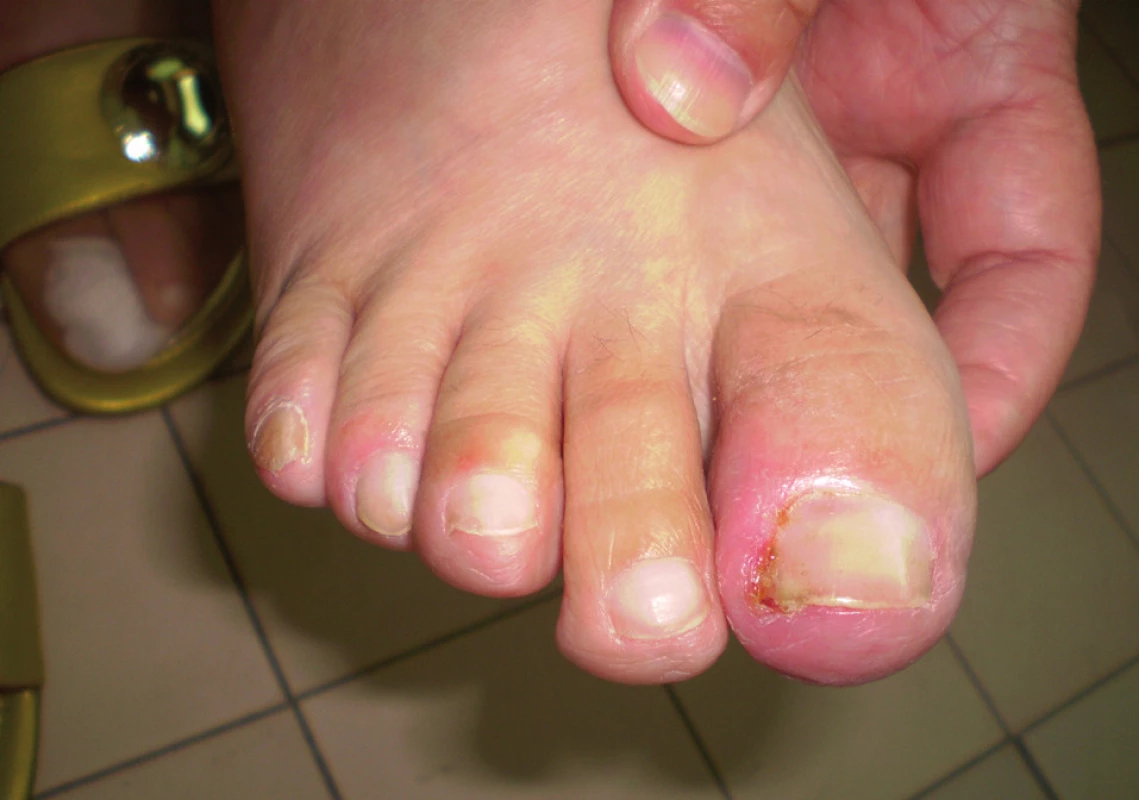
Z iných, menej častých prejavov sú to kožná reakcia ruka – noha (palmo – plantárne erytrodyzestézie) pri liečbe sunitibom a sorafenibom (symetrické erytematózne a edematózne plochy), môžu sa vyskytovať aj bolestivé hyperkeratózy na miestach vystavených tlaku, obkolesené erytematóznymi a edematóznymi prstencami). Objavujú sa po 2–4 týždňoch terapie EGFR inhibítormi (11), javia sa závislé na dávke a miznú rýchlo po prerušení liečby. V lokálnej terapii sa uplatňujú externá s obsahom urey, kyseliny salicylovej, topické kortikosteroidy (10). Ďalej zo zriedkavejších prejavov sa objavujú subunguálne trieskovité hemorágie, zmeny vlasovej a kožnej pigmentácie, periokulárne edémy.
Metodika
V období od decembra 2008 do novembra 2009 bolo na našom pracovisku vyšetrených 62 onkologických pacientov, ktorí mali kožné nežiaduce účinky onkologickej liečby. Jednalo sa o 39 mužov a 23 žien odoslaných z onkologickej a onkopneumologickej ambulancie.
Všetci pacienti boli vyšetrení anamnesticky, klinicky (so zameraním sa na druh a stupeň postihnutia kože, viditeľných slizníc a adnexov a tiež na lokalitu postihnutia) a dotazníkovou metódou (otázkami zameranými na kožné nežiaduce účinky – subjektívne hodnotenie ich závažnosti u jednotlivca, či boli pre neho stresujúce, deprimujúce alebo obmedzujúce v jeho pracovnom eventuálne v osobnom živote).
Výsledky
V súbore vyšetrených podľa pohlavia bolo 39 (62,9 %) mužov a 23 (37,1 %) žien, pomer muži : ženy bol 1 : 0,59. Priemerný vek vyšetrených pacientov bol 56 rokov, priemerný vek žien bol 53,5 rokov, u mužov 64 rokov. Najnižší vek v sledovanej skupine bol u ženy 36 rokov, najvyšší u muža 76 rokov. Vyšetrení pacienti boli z onkologického hľadiska nastavení na liečbu: cetuximab (Erbitux®) – 28 pacientov, erlotinib (Tarceva®) – 21 pacientov, panitumumab (Vectibix®) – 6 pacientov, sunitinib (Sutent®) – 3 pacienti, sorafenib (Nexavar®) – 3 pacienti, trastuzumab (Herceptin®) – 1 pacient. U vyšetrených pacientov bol pozorovaný jeden prejav kožných nežiaducich účinkov u 21 pacientov, kombináciu 2 kožných nežiaducich účinkov u 25 pacientov a 3 a viac kožných nežiaducich účinkov u 16 pacientov (obr.5). Pri 2 nežiaducich kožných účinkoch boli najčastejšie pozorované kombinácie: xeróza – akneiformný raš v 19-tich prípadoch, akneiformný raš – paronýchia v 3 prípadoch, xeróza – zmeny vlasov v jednom prípade, palmo-plantárne erythrodyzestézie (PPE) – stomatitída v jednom prípade a palmo-plantárne erythrodyzestézie (PPE) – xeróza v jednom prípade (obr. 6).
5. Počet pozorovaných kožných prejavov u jedného pacienta. 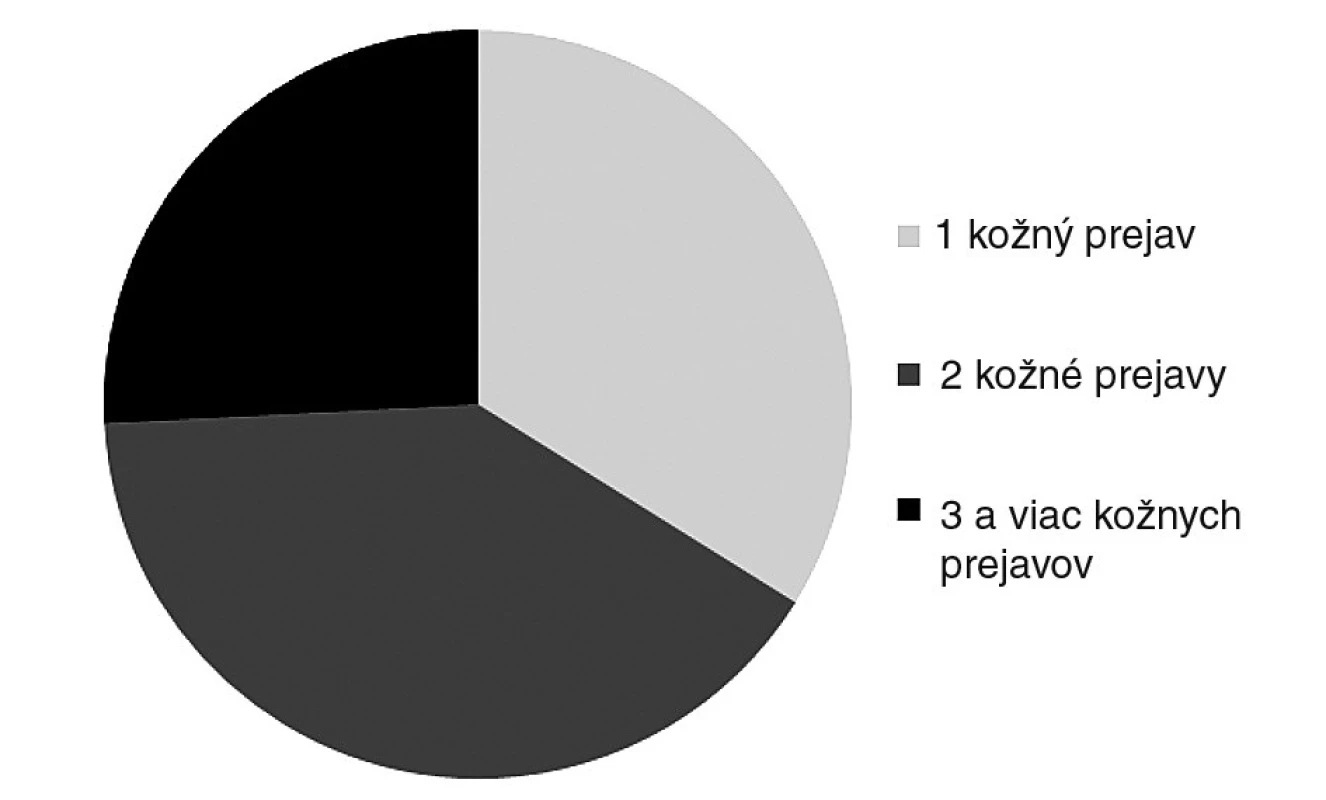
6. Najčastejšie pozorované kombinácie kožných zmien. 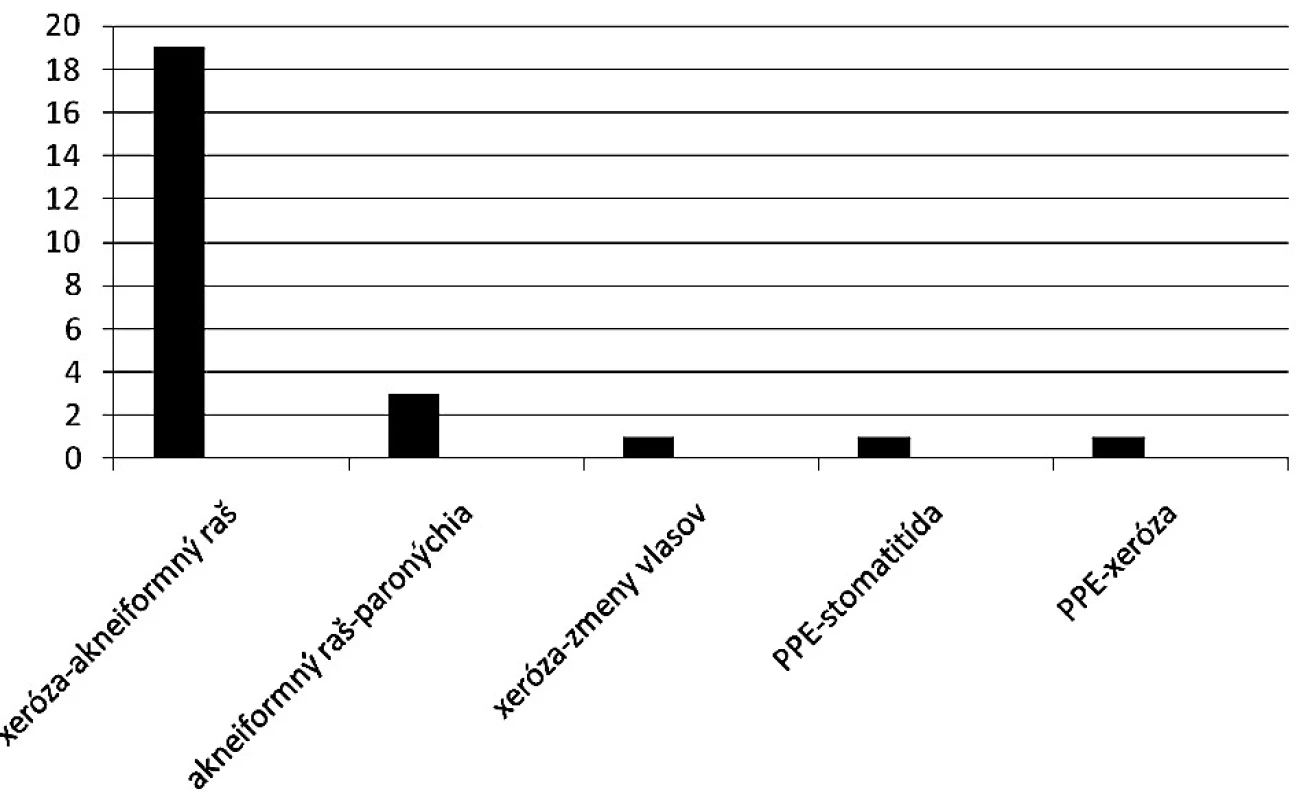
Podľa klinického nálezu boli pacienti zadelení pri prvom vyšetrení do štádia podľa Common Terminology Criteria for Adverse Events (CTCAE): ako stupeň 1 sme hodnotili prejavy u 37 pacientov, stupeň 2 prejavy u 15 pacientov a stupeň 3 bol pozorovaný u 10 pacientov. Pri 3. stupni kožných nežiaducich reakcií bola indikovaná celková terapia. Na základe nášho odporúčania bola onkológmi onkologická liečba na čas prerušená, pokiaľ sa u pacienta na základe celkovej a lokálnej terapie stav nezlepšil na stupeň 2. Celková terapia doxycyklínom bola teda indikovaná u 10 pacientov s prejavmi akneiformného exantému štádia 3. U všetkých pacientov sme zaznamenali dobrý efekt antibiotickej liečby, no u 3 pacientov aj napriek protrahovanej antibiotickej liečbe tetracyklínom pri znovu nasadení onkologickej terapie dochádza k recidíve akneiformného exantému štádia 3. U týchto troch pacientov volíme liečbu izotretinoínom po zvážení všetkých kontraindikácií. Pri následnom sledovaní efektu terapie retinoidom stav hodnotíme ako veľmi dobrý, pacienti sú v štádiu 1–2, recidíva štádia 3 sa nezaznamenala a onkológovia môžu pokračovať v antikanceróznej liečbe bez prerušenia alebo vysadenia z kožnej indikácie.
V skupine pacientov s prejavmi paronychií u 2 pacientiek bola indikovaná celková terapia antibiotikom penicilínovej rady pre hnisovú secernáciu s progresiou inflamácie. Chirurgická intervencia na nechtovej platničke zatiaľ indikovaná v sledovanej skupine nebola. Liečba u týchto pacientov je zdĺhavá, vyžaduje si denné ošetrovanie a starostlivosť. V lokálnej liečbe sa najviac uplatnili kortikosteroidy, antiseptické, antibiotické externá.
Najrýchlejší klinický efekt liečby a subjektívne zlepšenie bolo dosiahnuté v skupine pacientov trpiacich xerózou kože, ktorá bola vo všetkých prípadoch asociovaná s pruritom. V lokálnej liečbe sme odporúčali emolienciá, veľmi dobrý efekt sme zaznamenali s externami s 5% až 10% ureou, pri nedostatočnom efekte externej liečby na potlačenie pruritu pridávame antihistaminikum.
V liečbe palmo-plantárnych erythrodyzestézií je arzenál liečby značne obmedzený a aj napriek intenzívnej starostlivosti často neprináša želaný efekt. Lokálne pacientom boli odporúčané premasťujúce, keratolytické externá, často kortikoidné externá, ktoré pri výrazných bolestiach až páleniach dlaní a stupají sme dávali do oklúzie s dobrým efektom redukcie pálenia a bolesti. Do celkovej liečby sme pridávali vitamín skupiny B (pyridoxín) pre jeho pozitívny vplyv na nervový a svalový systém.
Z časového hľadiska, v skupine pacientov s akneiformným exantémom sa kožné prejavy objavili po 7 až 14 dňoch liečby, u jedného pacienta sa prejavy začali v oblasti tváre už na 5. deň po podaní liečby, najneskôr sa akneifornmé erupcie objavili po 20 dni od začiatku podávania terapie.
Zmenám vlasov pacienti v úvode nevenujú až tak veľa pozornosti ako akneiformnému rašu, ktorý na nich pôsobí rušivejšie. Zmeny vlasov si začnú všímať až keď je postihnutie výrazné a viditeľné, v skupine pacientov udávané približne 3 mesiace od začiatku terapie. Čo sa týka paronychií, vznik udávajú pacienti v 6. až 8. týždni od začiatku liečby. Prejavy palmo-plantárnych erytherodyzestézií boli pozorované v 3. týždni od začiatku terapie.
V dotazníkovom zisťovaní 7 pacientov pokladá svoje kožné postihnutie za „ťažké“, 38 pacientov udáva ako „stredne ťažké“ a 17 pacientov pokladá svoje kožné postihnutie za „mierne“. Žiaden pacient nehodnotí svoje kožné ťažkosti ako „takmer žiadne“ alebo „žiadne“. Zaujímavosťou je, že aj pacienti v štádiu 1 s už minimálnymi prejavmi, ktoré neobmedzujú ich bežné aktivity denného života, citlivo vnímajú ich kožné/adnexálne postihnutie a hodnotia sa v kategórii mierneho postihnutia. V zisťovaní stresujúceho alebo deprimujúceho vplyvu kožných efektov a obmedzenia v ich osobnom alebo pracovnom živote, v dotazníku odpovedalo 49 pacientov, že tento vplyv pociťujú, negatívne sa vyjadrilo 13 pacientov.
Diskusia
Najčastejšie sa v nami sledovanej skupine vyskytli prejavy kožných nežiaducich účinkov stupňa 1 a 2, čo koreluje aj s údajmi uvádzanými v literatúre (1, 6). Porovnávali sme časovú súvislosť vzniku kožných nežiaducich účinkov uvádzanú v literatúre a údajmi od našej skupiny pacientov a zistili sme, že údaje začiatku prejavov sa zhodujú s údajmi uvádzanými vo svetových publikáciách (1, 11, 13). Čo sa týka prognózy onkologického ochorenia, uvažuje sa, že kožné prejavy spojené s cielenou onkologickou liečbou sú prediktívnym ukazovateľom účinnosti a efektivity liečby, čo je predmetom viacerých štúdií. V tejto skutočnosti však narážame na protichodnosť. Na jednej strane, sú nežiaduce účinky cielenej liečby vlastne „žiaduce“ a pri ich absencii by bolo nutné uvažovať, v akej miere bude liečba efektívna, a pri stúpajúcom stupni postihnutia zase predpokladáme lepší efekt antikanceróznej liečby. Na druhej strane so stúpajúcim stupňom postihnutia je pacient vystavený väčšiemu riziku celkových komplikácií a zároveň musíme zvažovať prerušenie alebo redukciu dávky a v konečnom dôsledku nevieme predpokladať, aký efekt zanechá vynechanie alebo redukcia dávky v pôsobení na rakovinové bunky.
Záver
Kožné prejavy cielenej onkologickej liečby významne znižujú kvalitu života pacienta jednak subjektívnym vnímaním prejavov, jednak prehlbovaním depresívnej symptomatológie onkologického pacienta primárne trpiaceho na základné ochorenie. Časť kožných reakcií je natoľko závažných, že sa musí onkologická liečba prerušiť. Onkológovia dosiaľ zvyknutí na vedľajšie účinky nešpecifickej chemoterapie sa v súčasnosti čoraz častejšie stretávajú s odlišnými účinkami špecifickej chemoterapie, pričom kožné nežiadúce účinky sú často prvé, na ktoré sa pacient sťažuje. Z toho vyplýva dôležitosť sledovania a liečby pacienta dermatológom. Liečba je individuálna v závislosti na type kožných lézií, rozsahu postihnutia a tolerancie pacienta.
MUDr. Marianna Kuklová
Dermatovenerologická klinika SZU
FNsP F.D.Roosevelta,
L. Svobodu 1,
975 17 Banská Bystrica
SR
E-mail: marianna.kuklova@gmail.com
Sources
1. Deslandres, M., Sibaud, V., Chevreau, C., Delord, J.-P. Effets secondaires cutanés des nouvelles molécules anticancéreuses: focus sur les molécules ciblant les récepteurs tyrosine kinase et le récepteur á I’EGF. Ann Dermatol Venerol, hors série 1, 2008, p. 16-24.
2. Dick, SE., Crawford, GH. Managing cutaneous side effects of epidermal growth factor receptor (HER1/EGFR) inhibitors. Commun Oncol, 2005, 2, p. 492-496.
3. Iacovelli, L. Clinical management of EGFRI-associated dermatologic toxicities: Pharmacy perspective. Oncology, 2007,11(5), p.31-33.
4. Klener, P. Omezilo zavádění tzv. cílené léčby význam protinádorovej chemoterapie? Onkológia, 2007, 2(6), s. 363-366.
5. Krajsová, I. Kožní projevy cílené léčby nádorů. Remedia, 2006, 16, s.416-420
6. Lacouture, ME., Melosky, BL. Cutaneous reactions to anticancer agents targeting the epidermal growth factor receptor:A dermatology-oncology perspective. Skin Therapy Letter, 2007, 12 (6), p.1-5.
7. Lee, MV., Seo, CW., Kim, SW., Yang, HJ., Lee, HW., Choi, JH., Moon, KC., Koh, JK. Cutaneous side effects in non-small cell lung cancer patients treated with Iressa (ZD1839), an inhibitor of epidermal growth factor. Acta Derm Venereol, 2004, 84 (1), p.23-26.
8. Lynch, TJ. Jr., Kim, ES., Eaby, B., Garey, J., West, DP., Lacouture, ME. Epidermal growth factor receptor inhibitor-associated cutaneous toxicities: An evolving paradigm in clinical management. The Oncologist, 2007, 12 (5), p.610-621.
9. National Cancer institute. Common Terminology Criteria for Adverse Events (CTCAE) version 4.0, May 28, 2009 (v4.02:Sept.15, 2009), http://evs.nei.nih.gov/ftp1/CTCAEַ4. 02ַ2009-09-15ַQuickReferenceַ5x7.pdf
10. Robert, C., Mateus, Ch., Spatz, A., Wechsler, J., Escudier, B. Dermatologic symptoms associated with the multikinase inhibitor sorafenib. J Am Acad Dermatol, 2009, 60, p. 299-305.
11. Robert, C., Soria, J-C., Spatz, A., Le Cesne, a., Malka, D., Pautier, P., Wechsler, J., Lhomme, C., Escudier, B., Boige, V., Armand, J-P., Le Chevalier, T. Cutaneous side-effects of kinase inhibitors and blocking antibodies. Lancet Oncol, 2005, 6, p.491-500.
12. Rodeck, U. Skin toxicity caused by EGFR antagonists – an autoinflamatory condition triggered by deregulated IL-1 signaling? J Cell Physiol, 2009, 218 (1), p.32-34.
13. Segaert, S., Van Cutsem, E. Clinical signs, pathophysiology and management of skin toxicity during therapy with epidermal growth factor receptor inhibitors. Ann Oncol, 2005, 16(9), p.1425-1433.
14. Siegfried, S., Van Cutsem, E. Clinical management of EGFRI dermatologic toxicities: The European perspective. Oncology, 2007, 21(11), p. 22-26.
15. Tan, AR., Steinberg, SM., Parr, AL., Nguyen, D., Yang, SX. Markers in the epidermal growth factor receptor pathway and skin toxicity during erlotinib treatment. Ann Oncol, 2008, 19(1), p.185-190.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2010 Issue 2-
All articles in this issue
- Rosacea Fulminans
- A Case Study of a Female with Atypical Localization of Syphilitic Chancre
- Skin Reactions to New Agents (Biologicals and Targeted Anticancer Drugs)
- Contact Hypersensitivity to Cosmetic and Pharmaceutical Additives in Patients with Eczema
- Skin Side Effects of Epidermal Growth Factor Receptor Inhibitors in Oncologic Therapy
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A Case Study of a Female with Atypical Localization of Syphilitic Chancre
- Skin Reactions to New Agents (Biologicals and Targeted Anticancer Drugs)
- Rosacea Fulminans
- Skin Side Effects of Epidermal Growth Factor Receptor Inhibitors in Oncologic Therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

