-
Medical journals
- Career
Atopická dermatitida v roce 2009
Authors: N. Benáková
Authors‘ workplace: Dermatovenerologická klinika 1. LF UK Praha přednosta prof. MUDr. Jiří Štork, CSc. ; Dermatoalergologická ordinace Praha vedoucí lékař MUDr. Radek Klubal
Published in: Čes-slov Derm, 84, 2009, No. 2, p. 65-85
Category: Reviews (Continuing Medical Education)
Overview
Autorka uvádí přehled současných názorů na etiopatogenezi atopické dermatitidy – genetiku, poruchy kožní bariéry, imunologickou dysbalanci směrem k Th2 odpovědi, provázanosti nespecifické a specifické imunity, role zlatého stafylokoka, dvojfázový model zánětlivé reakce, fáze vývoje atopické dermatitidy od intrinzické přes extrinzickou až k autoimunitní. V kapitole prevence provokačních vlivů rozvádí vlivy potravinové a kontaktně alergické. V léčbě ozřejmuje stupňovité schéma od emoliencií přes kortikoidy a lokální imunomodulátory až k fototerapii a léčbě celkové. Uvádí postup vedení vyšetření a léčby, zvládání atopické dermatitidy pro praxi a význam léčebného plánu. Podrobně se věnuje edukaci pacienta ke zlepšení compliance a k zábraně kortikofobie, významu galenických forem, krytí i specifické hygienické péče o kůži. V celkové léčbě uvádí cyklosporin A jako lék první volby, zdůrazňuje užívání kortikoidů pouze jako záchranné intervence, uvádí léky druhé linie jako azathioprin a methotrexát. V závěru naznačuje perspektivní lokální i celková léčiva a apeluje na psychosomatický přístup k nemocným.
Klíčová slova:
atopická dermatitida – etiopatogeneze – diagnostika – léčba – prevence – praktické postupyÚvod
Atopická dermatitida (AD) patří společně s psoriázou k nejčastějším tématům odborných dermatologických článků, avšak na rozdíl od psoriázy zde převažují teoretické novinky z oblasti etiopatogeneze a méně se dostávají výsledky výzkumu do praxe. Snad i proto, že AD je chorobou patogeneticky ještě komplexnější, tedy i komplikovanější, než psoriáza a účinných léčiv s přijatelným bezpečnostním profilem je pomálu. Téma atopické dermatitidy je tak obsáhlé, že by každá kapitola vydala na samostatnou knihu. Tento článek proto obecně shrnuje problematiku s významnými novinkami, ale nemůže zacházet do podrobností.
Atopická dermatitida je chronická svědivá zánětlivá dermatóza s hyperreaktivitou kůže, která je způsobena genetickou dispozici k dysfunkci kožní bariéry a k neuroimunologické dysbalanci. Manifestuje se působením zevních vlivů na tento terén (obr. 1). V průmyslově rozvinutých zemích je to velmi častá kožní choroba, zejména v dětské populaci.
Image 1. Etiopatogeneze atopické dermatitidy. 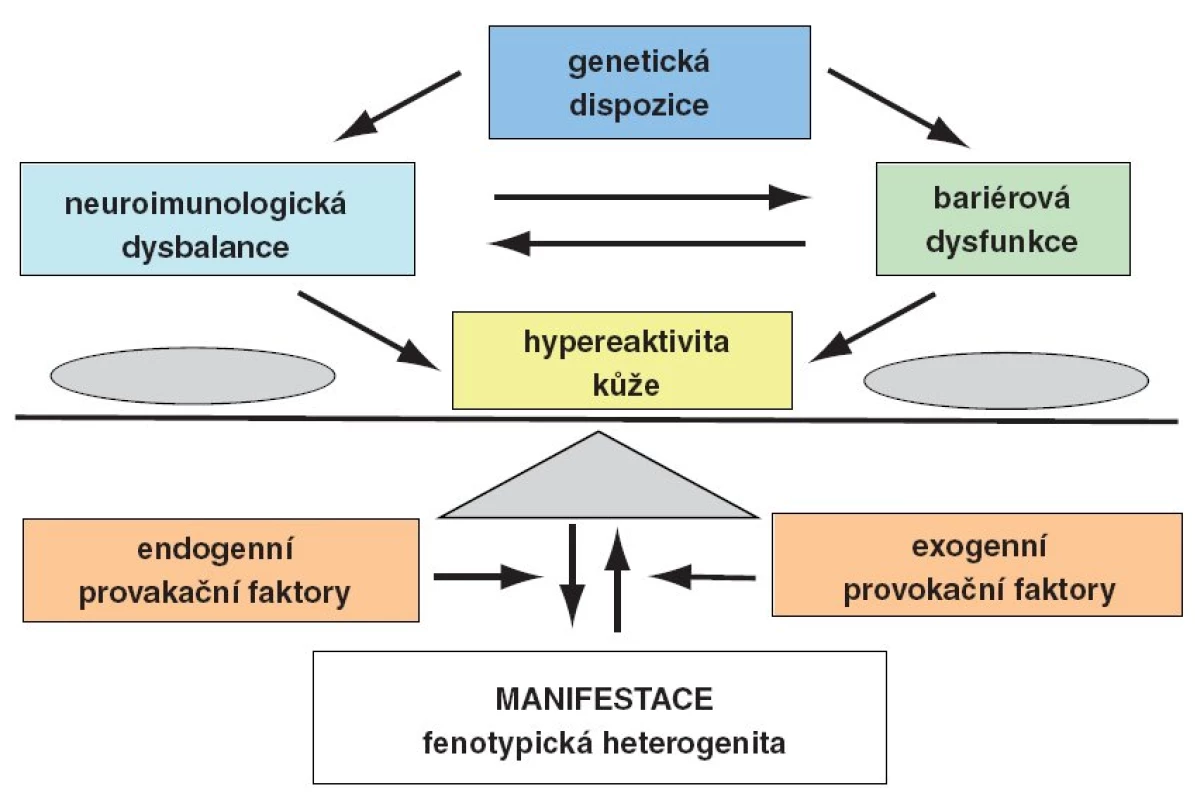
Společnými klinickými rysy pro všechny projevy AD jsou chronický průběh, pruritus, xeróza a dermatitida (4, 6, 33), tedy patofyziologicky porucha kožní bariéry a chronický kožní zánět s následnou senzibilizací vůči alergenům potravin a zevního prostředí obecně (7, 8). Histologicky se akutní fáze projevuje v epidermis intercelulárním edémem (spongiózou) a výrazným perivaskulárním infiltrátem z lymfocytů, monocytů/makrofágů, dendritických buněk a i eozinofilů v dermis. V chronické fázi je histologickým podkladem lichenifikovaných ložisek ztluštění epidermis, zejména hypertrofie horních vrstev a dále fibróza v dermis.
Její závažnost je dána nejen rozsahem či intenzitou objektivních a subjektivních příznaků, ale i průběhem, komplikacemi a dopadem na kvalitu života. Velmi časté exacerbace či kontinuální průběh bez remisí, postižení partií omezujících práceschopnost a soběstačnost (ruce) či psychosociálně hendikepujících (obličej), časté kožní infekce s případnou diseminací a příslušnými riziky (eczema molluscatum, eczema herpeticatum), pruritus vedoucí k výrazným poruchám spánku s následnou sníženou výkonností a dalšími sociálními a psychosomatickými důsledky a také nedostatečná klinická odpověď na léčbu – všechny tyto skutečnosti pak ústí ve značné snížení kvality života postiženého jedince. Současně s ní se často vyskytují jiné atopické choroby, jako je alergická rhinitida či bronchiální astma, resp. choroba s sebou nese riziko vzniku závažných systémových alergických chorob až rozvoje autoimunity v rámci vývoje AD – tzv. atopického pochodu.
Klinické projevy i průběh jsou pestré, proměnlivé. Liší se mezi jednotlivci i u jednoho člověka, a to podle morfologie, lokalizace, stadia i věku (tab. 1). V současnosti se AD nedělí striktně na jednotlivé formy podle věku (kojenecká, dětská, dospělých) či morfologie, ty se vnímají jako určité kontinuální spektrum jedné choroby (8, 25, 36). V kojeneckém věku se objevuje nejčastěji v obličeji a kštici s případným šířením na trup a extenzorové partie končetin, v dětském věku ve flexurách (loketní jamky, zápěstí, zákolenní, kotníky a nárty) a v dospělosti kromě flexur dominuje postižení hlavy, krku a dekoltu (head and neck dermatitis) a rukou. AD však může postihnout prakticky kterékoliv místo na těle. V dětství je tendence k diseminaci AD, v dospělosti spíše k lokalizaci projevů. Predikovat průběh je obtížné, obecně je chronický se střídáním remisí a exacerbací. U řady atopiků dochází k sezónnímu zlepšení v létě. Dlouhodobý průběh u konkrétního jedince je nepředvídatelný, nicméně zlepšení po pubertě je časté a po 50. roce se AD vídává řídce.
Table 1. Formy a lokalizace atopické dermatitidy 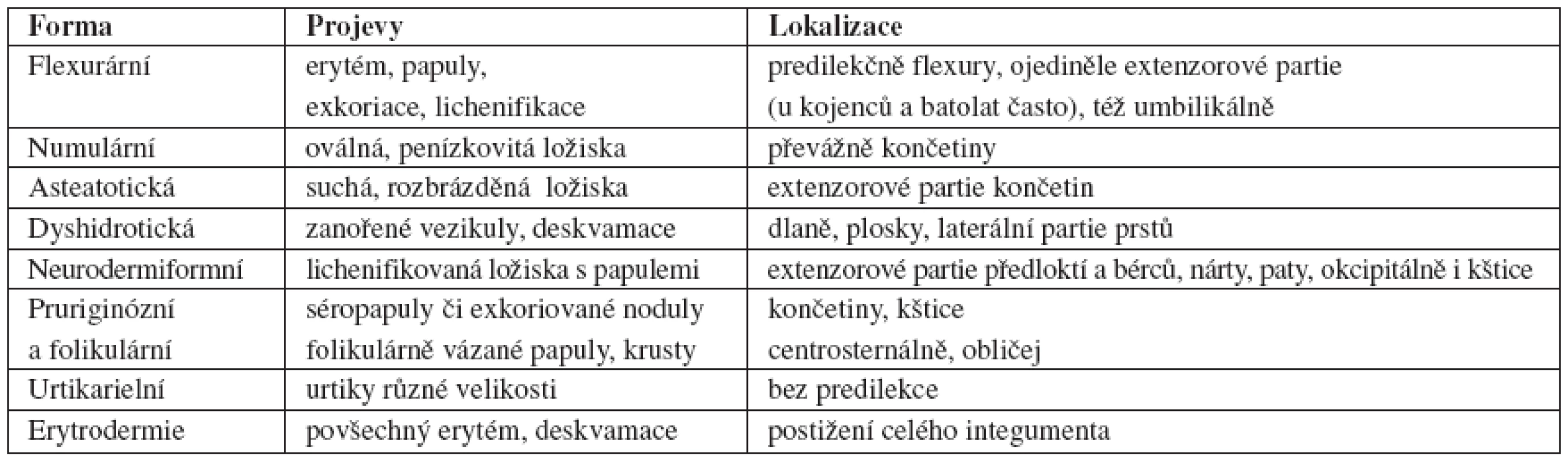
Epidemiologie
Atopická dermatitida je ve vyspělých zemích častým onemocněním – ve střední Evropě je kumulativní prevalence okolo 10 %, celosvětová 15–30 %, s mírnou převahou dívek nad chlapci. Většina případů AD vzniká do šesti let věku, s maximem v kategorii do tří let, tzv. časně vzniklá AD („early-onset AD“) (8). Tento časový interval se vysvětluje skutečností, že imunitní systém dozrává právě okolo třetího roku věku, kdy se původní převaha Th2 odpovědí vyrovnává do rovnováhy s Th1 odpovědí. Přirozený imunitní stav novorozence je dán převahou Th2 odpovědi, a ta je pro manifestaci AD optimální situací. Do šesti měsíců vzniká 45 % případů, do jednoho roku 60 % a do pěti let pak 85 % případů. Přibližně 70 % těchto dětí dosáhne spontánní remise před dosažením dospělosti (8). Do dospělosti perzistuje až 30 % případů, nepříznivé prediktivní ukazatele jsou pozitivní rodinná anamnéza, časný vznik v kojeneckém věku, těžší průběh AD v dětství a přítomnost respirační atopie; z laboratorních pak vysoké IgE v pupečníkové krvi a nulová alela genu pro filagrin (6).
Prevalence AD v dospělé populaci se udává okolo 2 až 10 % (8). V poslední době se pozornost věnuje též této věkové skupině AD, která může jednak perzistovat z dětství či mládí, a jednak vznikat v dospělosti de novo („late-onset AD“), kde je v posledních letech patrný i mírný nárůst. Mezi těmito pacienty je řada jedinců bez prokazatelné senzibilizace zprostředované IgE protilátkami. Ti tedy nemají zvýšené IgE, zato zvýšený INFγγ, mají normální hladiny IL-4, IL-5 i IL-13, negativní atopickou rodinnou anamnézu, nemají další atopické choroby v osobní anamnéze a většinou vykazují i mírnější průběh (AD označovaná dříve jako neatopická, intrinzická) (18). Primární poruchu kožní bariéry u této skupiny potvrzují i novější nálezy geneticky dané dispozice k vyšší aktivitě endogenních proteáz (SCCE, stratum corneum cleavage enzymes), což extrinzická skupina (s pozitivitou specifických IgE) nemá. Jedná se pravděpodobně o přechodnou intrinzickou fázi jedné choroby (8) a jedinec může, ale nemusí, přejít do dalších fází – extrinzické a autoimunitní. Předpokládá se zde úloha specifických T-lymfocytů, tedy reakce nezávislá na IgE (podporuje to např. pozitivita atopických patch testů při negativitě specifických IgE). Také sérologické hodnoty IgE nemusí odpovídat jejich množství v kůži, tj. v krvi normální hodnoty a v kůži zvýšené. V současnosti se již upouští od poněkud rigidní klasifikace atopické dermatitidy podle přítomnosti specifických IgE na atopickou (alergickou, extrinzickou) a neatopickou (nealergickou, intrinzickou), protože ty nejsou předpokladem ani hlavní příčinou vzniku AD (34). Senzibilizace, tedy přítomnost specifických IgE, je však s AD asociována – méně u osob s mírnou, více u osob s těžkou AD (11). Senzibilizace není jednoduchým vztahem příčin a následků (34). Z epidemiologických studií vyplývá, že samotná časně vzniklá AD nepředstavuje vyšší riziko vzniku astmatu v dětství, pokud dítě současně nemá časně vzniklou alergickou rhinitidu (senzibilizaci). Tedy ani geneticky ani epidemiologicky zde není takový vztah, jak se v učebnicích traduje. Předpokládá se spíše komanifestace dvou fenotypů za působení stejných provokačních faktorů než přímý důsledek atopického pochodu. K přesnému zmapování je třeba dlouhodobých, metodicky dobře koncipovaných epidemiologických studií (34). Odhalení existence této uvedené subpopulace (bez specifických IgE) je důležité i z praktického hlediska, neboť není smysluplné zde rozsáhle pátrat po senzibilizaci, ale je třeba se soustředit na nealergické vlivy (mikrobiální a fyzikální faktory, poruchy bariéry atp.). Též z hlediska terapie je zde vhodný poněkud odlišný přístup a konečně se zdá, že i přirozený průběh se liší – rizika atopického pochodu, tedy senzibilizace jsou nižší (30). Epidemiologické údaje o této intrinzické subpopulaci se liší (20–30 % atopiků), rozhodně se jedná o početně menší skupinu, než jsou atopici s pozitivitou specifických IgE.
Až epidemický nárůst atopické dermatitidy v 80. letech se obvykle přisuzuje vlivům životního prostředí, změnám v životním stylu jedince, rodiny, společnosti, shrnovaným pod pojem tzv. hygienické teorie. Co se týče protektivního vlivu infekcí na vznik AD epidemiologické studie tuto postulovanou teorii neprokázaly. Dokonce některé infekce, např. spalničky, riziko vzniku AD zvyšují. Záleží tedy na typu infekce a věku jedince a aktuálních okolnostech, tedy na načasování. Také je pravděpodobné, že protektivní vlivy vůči vzniku AD, které jsou zřejmé u dětí v kolektivních zařízeních, dětí majících domácí zvířata, dětí s více sourozenci či z ekonomicky a sociálně slabších vrstev a dětí prodělávajících různé infekce, mohou být způsobeny nepatologickou mikrobiální stimulací imunitního systému dítěte v časném dětství (34). Vliv faktorů zevního prostředí, které vedou k expresi geneticky dané poruchy bariéry (interakce genů a prostředí), je zde zřejmý, jinak by pouze na základě genetické dispozice nemohlo dojít k tak velkému nárůstu AD. A záleží na „dávce“ genů a na „dávce“ vlivů životního prostředí, zda a v jaké intenzitě se choroba klinicky manifestuje (11). Studie z Německa a Skandinávie, sledující situaci od 90. let až doposud, však vykazují stabilizovaný trend incidence AD – manifestace v populaci (fenotyp) pravděpodobně dosahuje hodnot genetické dispozice (genotyp). A skutečně v řadě západoevropských zemí se nárůst zastavuje. Avšak v méně vyspělých zemích, kde byla prevalence AD dosud nízká a kde dochází k hospodářskému rozvoji („westernizace“), je nárůst atopických chorob zřejmý (27).
Pokud by však nárůst atopie pokračoval stávajícím tempem, tak se předpokládá, že v roce 2015 bude každý druhý Evropan alergikem.
Etiopatogeneze
Atopická dermatitida se dosud považovala za klasické alergické – atopické onemocnění s projevy na kůži, kdy imunologické odchylky vedou k senzibilizaci zprostředkované IgE protilátkami a kde je porucha epidermální bariéry pak důsledkem lokálního zánětu (inside-outside hypotéza). Pokrok v molekulárně biologických a genetických vyšetřovacích metodách však přinesl překvapivé objevy. Defekt kožní bariéry se považuje za primární a zvýšená produkce IgE spíše za sekundární jev (epifenomén) v důsledku porušené kožní bariéry (outside-inside hypotéza). Z hlavních objevů to jsou mutace genů pro filagrin, involukrin a lorikrin (vedoucí k poruše maturace keratinocytů a integrity kožní bariéry) (31), změněný profil spektra ceramidů (v důsledku vyšší aktivity enzymu sfingomyelin deacylázy, vedoucí ke snížené funkci intercelulárních lipidů udržet v epidermis vodu) a vysoká koncentrace kožních serinových proteáz (díky vyšším koncentracím inhibitoru SCCE, vedoucí k předčasné ztrátě soudržnosti keratinocytů a deskvamaci) (8, 34). Toto jsou dvě současné zásadní hypotézy patogeneze AD. Jak to však u komplexních chorob bývá, skutečnost není tak přímočará. V roce 2008 se objevily práce prokazující, že exprese mutovaných genů pro filagrin je závislá na atopickém cytokinovém prostředí (prof. Stingl, kongres EADV Paříž 2008). Tedy zánět v pozadí zhoršuje expresi genů, důležitých pro funkci epidermální bariéry, což umožňuje společně se škrábáním průnik alergenů, potencuje zánět a riziko senzibilizace. Vliv cytokinů Th2 typu na geneticky danou dispozici poruchy bariéry vede k její manifestaci. Porucha bariéry je v tomto kontextu primární (bariéra jako součást nespecifické imunity kůže) a je ovlivňována dysregulací imunity specifické. Tedy jakýsi sjednocující prvek, vytvářející přehlednější pohled na tuto problematiku. Obecným problémem všech sjednocujících koncepcí je určité zjednodušení. V případě AD totiž dosud neznáme všechny podtypy, které se mohou lišit jak etiopatogenetickým podkladem – odlišná míra postižení kožní bariéry a imunologických/alergických reakcí, tedy jiná patogenetická situace u akutní oproti chronické AD, jiná u AD dospělých oproti dětem, a i jiná reakce na léčbu. U někoho dominují poruchy bariéry se suchou kůží, u jiného pak imunologický zánět a senzibilizace. Klinická manifestace AD je tedy dána souhrou genů a zevního prostředí, kožních a neuro-imunologických odchylek jako dvě strany jedné mince, a nelze podceňovat ani jednu z nich.
Objevy poruchy kožní bariéry mají přímý dopad do dermatologické praxe – podtrhují důležitost doprovodné lokální léčby, dříve poněkud neprávem označované za indiferentní. Je prokázáno i histologicky, že i v nepostižené kůži atopiků je určitá reziduální, minimální dermatitida vždy přítomna (a podobně i zhojená kůže má nadále poruchu bariéry a ztrácí vodu) – což opodstatňuje význam udržovací léčby nejen pro snížení častosti exacerbací a prevenci fixace chronického zánětu, ale i senzibilizace. Vývoj potenciálních nových léčiv by tedy měl být zaměřen nejen proti faktorům alergickým, tedy IgE senzibilizaci, ale i ke zlepšení struktury a funkce kožní bariéry. Objevy poruch kožní bariéry také směřují i do oblasti alergologické, kde podnítily další zkoumání bariér slizničních a souvisejících faktorů jejich nespecifické imunity (např. Langerhansovy buňky orální sliznice s receptory TLR a jejich využití jako adjuvans v navození imunitní tolerance při sublingvální imunoterapii).
Genetické předpoklady
AD je geneticky komplexní choroba (dříve termín polygenní dědičnost), vznikající v důsledku interakce jednak mezi samotnými geny navzájem a jednak mezi geny a zevním prostředím. Kůže představuje v rozvoji tohoto onemocnění důležité místo vzájemné interakce genů a vlivů životního prostředí. Některé provokační faktory totiž fungují jako „zapínače“ genů (např. stafylokoky). U AD se zkoumáním genomu zjistila řada potenciálních lokusů – 3q21, 16q, 17q25, 20p, 3p26, největší asociaci však vykazuje lokus 1q21, kde se nachází komplex genů epidermální diferenciace. Také gen pro filagrin (FLG) je lokalizován v této oblasti, totiž 1q21.3. Mutace FLG se nacházejí u ichthyosis vulgaris a u časně vzniklé AD, kde jsou markerem pro dispozici k astmatu. Mutace FLG se zjistily ale pouze u 30 % evropských pacientů s AD, a proto se zde budou uplatňovat i odchylky dalších genů, např. pro epidermální tryptické enzymy (SCTE) či pro epidermální kolagen. Ke kandidátním genům patří např. geny na chromosomu 5q31-33, kódující cytokiny důležité pro syntézu IgE, IL-4, IL-5, IL-12, IL-13, GM-CSF. U AD ovlivňuje geneticky daná převaha cytokinů Th2 typu maturaci B-lymfocytů a způsobuje přesmyk z IgG na IgE (8). Také se zde zjistily polymorfismy (mutace) genu pro IL-18, který normálně směřuje imunitní odpověď T-lymfocytů k směrem k typu Th1, tzv. Th1 polarizace. Tato odchylka a též mutace genů kódujících receptory systému nespecifické imunity jsou patrně zodpovědné za nerovnováhu mezi Th1 a Th2 odpovědí.
U AD jsou tedy geny specifické pro AD, geny obecně prozánětlivé (stejné např. u psoriázy), geny atopické, geny kožně specifické – ty všechny tvoří vnímavost pro AD – „susceptibility genes“ (prof. Bradleyová – 22). AD je chorobou geneticky heterogenní a tomu odpovídá i fenotypická pestrost klinické manifestace. Z praxe i genetických studií je známo, že se dispozice k AD dědí častěji po matce.
Porucha kožní bariéry a protiinfekční imunita kůže
Porucha kožní bariéry s sebou nese poruchy hydratace (zvýšené ztráty a snížená schopnost vázat vodu), reparace (zhoršení procesu hojení), což klinicky odpovídá suché a olupující se kůži s výrazným sklonem k atrofii, a pohotovost k nespecifickému (nealergickému) zánětu – keratinocyty po kontaktu s detergenty či mechanické zátěži tvoří prozánětlivé cytokiny jako IL-1, TNF a GM-CSF; obecně je u AD zvýšená pohotovost k iritační dermatitidě (6). Tyto prozánětlivé cytokiny jsou schopné indukovat expresi genů pro endogenní proteázy, a tak dále zhoršovat funkci kožní bariéry. Tu ještě zhoršují mikrobi působením svých exogenních proteáz (např. Staphylococcus aureus či roztoči domácího prachu) a též fyzikální vlivy jako častý kontakt s vodou či detergenty, které navíc posunem pH do neutrálního až alkalického pásma aktivují endogenní proteázy, a tak dochází opět k poškozování bariéry. K tomu přispívají i tzv. sekundární proteázy, uvolňované buňkami zánětlivého infiltrátu u aktivní AD (např. chymáza z mastocytů) (11). Na zhoršené funkci bariéry se podílí i signifikantně snížené hodnoty δ-6-desaturázy, ovlivňující metabolismus kyseliny arachidonové, vedoucí jednak ke zvýšení PGE2 (a zánětu), a jednak ke snížení nenasycených mastných kyselin v epidermis. I zde může stav zhoršovat vyšší pH, neboť narušuje formování lipidových dvojvrstev – pomyslné malty ve zdi, kde keratinocyty představují cihly a korneodesmosomy vyztužovací tyče podobně jako armovací tyče v železobetonu.
Vliv lokálních kortikoidů na kožní bariéru se dá označit jako bivalentní. Na jedné straně svým antiproliferačním působením ztenčují kůži a snižují obnovu kůže, snižují tvorbu intercelulárních lipidů, zvyšují endogenní proteázy – jeden z mechanismů vzniku rebound fenoménu po jejich vysazení a „závislosti“ na kortikoidech (kortikoidní adikce). Na druhé straně však potlačením zánětu a sekundárních a mikrobiálních proteáz snižují imunologické faktory, které k poruše bariéry přispívají (11). Co z tohoto poznání vyplývá pro praxi – krátkodobá léčba dostatečně účinnými kortikoidy ano, dlouhodobá ne; je třeba využívat též lokální imunomodulátory. Vždy doplňovat léčbu lokálními prostředky pro zlepšení kožní bariéry. Nahradit mýdla a detergenty mycími emoliencii, používat šampony s nejnižší koncentrací detergentů, volit vhodné masťové základy a emoliencia (bez či s minimem surfaktantů/emulgátorů) pro diferentní i podpůrnou léčbu. Z preventivních opatření chránit kůži před fyzikálními (tření, tlak, horko aj.), chemickými (kontakt s vodou, detergenty aj.) a mikrobiálními vlivy – opatření ke snížení roztočů a stafylokoků jsou vhodná u všech pacientů s AD (i u pacientů bez specifických IgE). Ochrana bariéry snižuje častost exacerbací AD (11).
Keratinocyty jsou součástí faktorů nespecifické imunity a představují první linií obrany. Oplývají řadou důležitých receptorů – TLR, C-lektiny aj., které rozeznávají bakteriální, mykotické, virové či jiné mikrobiální struktury (PAMP – pathogen-associated molecular patterns).Toll-like receptory (TLR) jsou fylogeneticky staré struktury, vedoucí k rychlé, neselektivní obranné reakci, umožňující přežití jedince. Aktivace keratinocytů přes receptory TLR vede normálně k tvorbě přirozených antimikrobiálních peptidů – defensinů, kathelicidinů a dermicidinů. Kromě antimikrobiálních účinků mají i účinky chemotaktické, fungují jako signály nebezpečí (danger signals), po kterých dochází k uvolnění potřebných cytokinů. TLR se uvolňují po traumatu, kdy vedou též k zvýšení hladiny inhibitorů serinových proteáz a lipáz, a tak ke zpevnění bariéry. Mají fyziologický význam pro integritu kůže, růst epitelu a angiogenezi, tedy též pro hojení ran (prof. Lokaj – 21). Díky zánětlivému cytokinovému prostředí (IL-4, IL-10 a IL-10) a mutacím TLR jsou hladiny těchto antimikrobiálních peptidů u AD výrazně snížené, což v kombinaci s poruchou kožní bariéry vysvětluje vyšší náchylnost k bakteriální kolonizaci či infekci a i k virovým infekcím. Postižená i nepostižená kůže bývá masivně kolonizována bakteriemi, jako jsou stafylokoky, či kvasinkami, jako jsou malasezie. Atopici častěji též trpí na virové infekce, jako jsou moluska, herpes simplex, vulgární a ploché veruky, poněvadž nemají dostatečné množství antivirově působícího peptidu kathelicidinu.
Pluripotentní působení zlatého stafylokoka u AD
Kolonizace kůže atopiků kmeny Staphylococcus aureus (SA) je přítomna až u 90 % pacientů. Stafylokoky tvoří na kůži biofilm – zvláštní, dobře fungující autonomní společenství. Už samotný pruritus, resp. škrábání zvyšuje adherenci SA ke kůži, podobně ji umožňují cytokinové prostředí, tedy IL-4 přes vyšší expresi lamininu a fibronektinu a IL-13 přes snížení exprese antimikrobiálních peptidů a konečně i vyšší, tedy alkalické pH atopické kůže. Obtížnou eliminaci, resp. přežívání či rekolonizaci kůže atopiků stafylokoky umožňuje nízká koncentrace kožních antimikrobiálních peptidů (především kathelicidin LL-37 a β-defensin HBD 2). Dále polymorfismus receptorů TLR4 zvyšuje Th2 odpověď, a tím i atopický zánět, polymorfismus TLR2 zvyšuje identifikaci stafylokoků, a tak i tvorbu IgE proti nim (prof. Krejsek – 21).
SA přispívají ke vzniku, intenzitě a udržování atopického zánětu, ale také k senzibilizaci následujícími mechanismy:
- ceramidáza z SA zhoršuje poruchu kožní bariéry (lýza fosfolipidů)
- enterotoxiny SA způsobuji kožní zánět, a zhoršují tak atopický zánět
- enterotoxiny indukují vznik specifických IgE proti enterotoxinu (hladina koreluje se závažností AD), což vede ke kontinuální stimulaci Langerhansových buněk a i mastocytů a bazofilů k uvolňování histaminu a dalších biologicky aktivních mediátorů
- superantigenní působení SA (celkem definováno 19 superantigenů), hlavní jsou enterotoxiny, které přímo reagují s molekulami MHC II. třídy a β-řetězcem receptoru T-lymfocytů (TCR), což vede k proliferaci T-lymfocytů nezávislé na antigenu, která je podstatně větší než bývá u stimulace antigenem (tzv. polyklonální expanze) a jedná se opět o převahu Th2, čímž je atopické cytokinové prostředí nadále udržováno
- enterotoxiny zvyšují (upregulace) expresi usídlovacích (homing) molekul CLA (cutaneous lymphocyte antigen) na T-lymfocytech a tvorbu chemotaktických cytokinů v keratinocytech, což vede k migraci T-lymfocytů do kůže
- superantigeny indukují tvorbu GM-CSF, což vede ke snížení apoptózy a delšímu přežívání monocytů/ makrofágů, a tak je společně s působením CLA+ T-lymfocytů zánět udržován v chronickém stavu
- enterotoxiny indukují β-izoformu nukleárního receptoru pro glukokortikoidy (zejm. v monocytech), což ústí v kompetitivní rezistenci na lokální léčbu kortikoidy
- přes indukci proteinu podobného TNF na antigen prezentujících buňkách vedou k potlačení supresivní aktivity regulačních T-lymfocytů, tedy k jejich snížené funkci při potlačení zánětu
- exotoxiny jsou schopné zvýšit expresi IL-31 a jeho receptorů, a tak zhoršovat pruritus (8, 10, 21)
Jedná se vlastně o bludný kruh a z hlediska průběhu a léčby přispívají stafylokoky k závažnosti a chronicitě AD, k torpidnosti a refrakternosti na léčbu, pokud nejsou eliminovány či alespoň redukovány, a to jak na kůži, tak pravděpodobně i na sliznicích. Někteří němečtí autoři připodobňují proces aktivace a udržování zánětu u AD ke mlýnu s dvěma koly, tzv. atopický mlýn. Jedno kolo představuje aktivace daná antigeny/alergeny a druhé pak aktivace stafylokokovými superantigeny (přednáška prof. Wollenberga na semináři Tacrolimus – zkušenosti a doporučení v léčbě atopické dermatitidy 21.11.2008 v Praze).
Zatímco v praxi řada alergologů a lékařů ORL negativní vliv SA nasliznicích pro průběh AD a snahu dermatologa o eradikaci často bagatelizovala a argumentovala faktem, že se jedná prakticky o běžnou a neškodnou kolonizaci, v poslední době se objevují zajímavé práce věnované roli stafylokoků, jejich antigenům a superantigenům v onemocněních horních cest dýchacích (2). Z nich lze zjistit nejen řadu analogií s působením SA na kůži či je predikovat, ale dovozovat i negativní systémové imunologické účinky SA – dříve empiricky shrnované pod pojem vliv fokálních infekcí. Stafylokokové superantigeny nejenže vychylují slizniční imunitu k Th2 typu, ale stimulují i B-lymfocyty k proliferaci a vedou k polyklonální tvorbě IgE. Pozoruhodné na druhé straně je, že tvorba IgE může být omezena pouze na lokální tvorbu a že vzestup lokální koncentrace IgE je nezávislý na výsledcích intradermálních testů či hodnotách IgE v séru. Přítomnost SA též vede k výraznému zvýšení tvorby zánětlivých eikosanoidů (studie porovnávající dvě skupiny pacientů s chronickou rhinosinusitidou a nosními polypy – jedna s SA a druhá bez SA). Také dvojitě slepá studie s třítýdenním podáváním antibiotika vedla u skupiny s aktivním léčivem k výraznému potlačení zánětlivých parametrů a ke zmenšení polypů. Autoři shrnují, že SA jednoznačně přispívají k závažnosti a chronickému průběhu eozinofilního zánětu. Dodávají, že k prokázání účinnosti a snášenlivosti dlouhodobé léčby antibiotiky či dalších potenciálních možností léčby, jako je očkování proti SA či využití antagonistů stafylokokového enterotoxinu, bude třeba provést další studie (2).
Průběh a provázanost faktorů nespecifické a specifické imunity
Porušená bariéra je tedy branou pro vznik senzibilizace a umožňuje vývoj atopie, tzv. atopický pochod. Na jeho počátku je v raném dětství dítě (či dospělý) s ekzémem bez senzibilizace – tzv. intrinzická fáze, poté dochází k senzibilizaci na alergeny potravin a zevního prostředí – tzv. extrinzická fáze a nakonec k senzibilizaci na autologní proteiny a vzniku autoimunity – autoimunitní fáze – (obr. 2) (8). Kůže může být místem systémové senzibilizace, tedy i pro alergeny postihující respirační či trávicí ústrojí. Obecně mají osoby s AD cca 2,5krát vyšší riziko vzniku alergické rhinokonjunktivitidy a téměř 5krát vyšší riziko astmatu (7). Senzibilizace na aeroalergeny se do tří let objeví u 28 % pacientů s AD, do puberty pak u 60 až 80 % (prim. Gutová – 22). Proto jsou včasná a správná diagnostika i léčba AD pro zábranu tohoto vývoje tak zásadní.
Image 2. Fáze atopického vývoje (atopický pochod). 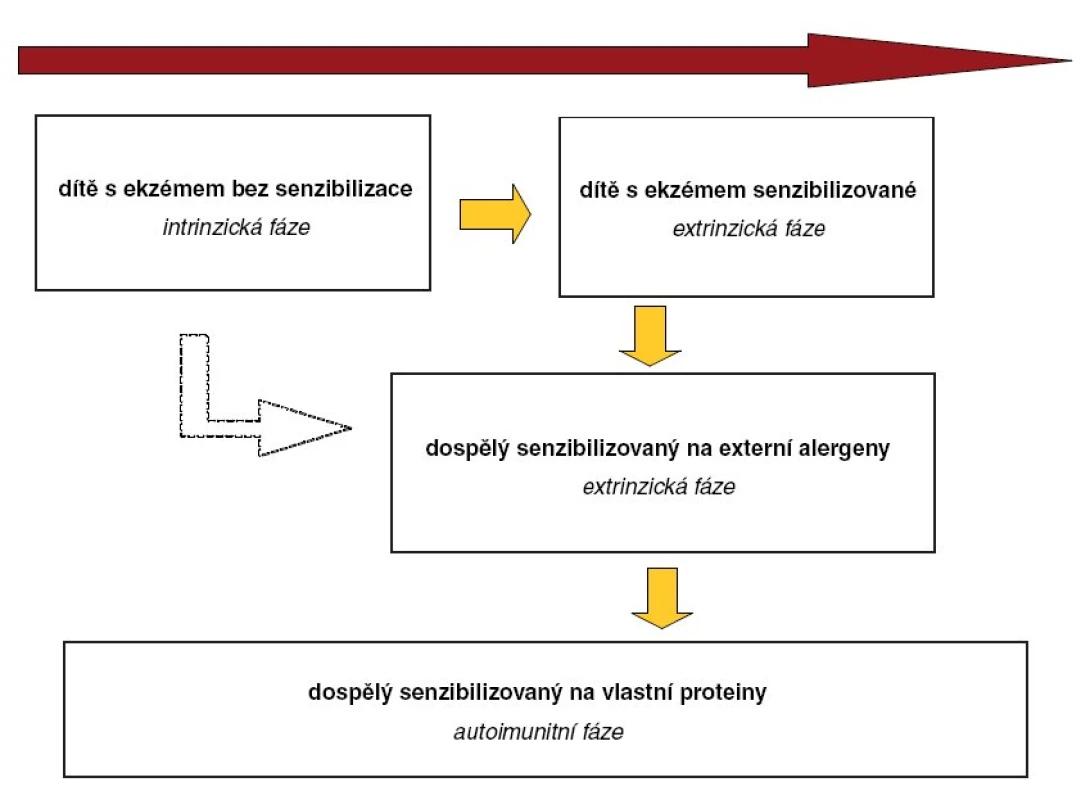
Porušená kožní bariéra je pro vznik senzibilizace nutným, nikoliv však postačujícím předpokladem. Tento fakt dobře ilustruje vznik senzibilizace a manifestace AD u příjemce kostní dřeně od dárce s AD, což svědčí pro úlohu hematopoetického systému jako přídatného faktoru ke geneticky dané poruše kožní bariéry.
Důležitou roli při vzniku a udržování zánětu u AD mají dendritické buňky, které představují jakési pojítko mezi nespecifickou a specifickou imunitou. Vzdušné či potravinové alergeny aktivují tyto dendritické buňky a ty směřují imunitní reakci T-lymfocytů k Th2 typu. Dále samy keratinocyty tvoří TSLP (thymic stromal lymphopoietin), cytokin podobný IL-7, který stimuluje dendritické buňky k signálům vedoucím také k Th2 polarizaci. Epidermální dendritické buňky (DC) u AD se však svým spektrem a funkcí liší od kůže ostatních jedinců (8). Prakticky zcela zde chybí plazmocytoidní DC (pDC), důležité pro antivirovou obranu díky tvorbě INFαα, ale v krvi jsou pDC naopak u AD zvýšené, což svědčí pro porušenou regulaci imunitní odpovědi i na této úrovni. Dominují zde Langerhansovy buňky (LB) v akutní a zánětlivé dendritické epidermální buňky (IDEC) v chronické fázi AD. Oba typy DC na rozdíl od osob bez AD exprimují na svém povrchu trimerický vysokoafinní receptor pro IgE (FcεεRI, jinak přítomný v tetramerické formě především na mastocytech a bazofilech a dále v malé míře i na eozinofilech a trombocytech), na který se vážou alergeny či antigeny. Poměr LB a IDEC v kůži určuje, zda nastane tolerance či zánět (prof. Nowaková – 22). Antigen prezentující buňky předkládají alergen T-lymfocytům Th1 a Th2 typu a pravděpodobně i regulačním T-lymfocytům. Regulační T-lymfocyty (fenotyp CD 4+,CD25+, FOXP3+) jsou u AD v krvi sice zvýšené, ale v kůži jsou snížené a navíc nefunkční (8). Předkládání na IgE navázaného alergenu T-lymfocytům vede k řádově mnohanásobně vyšší proliferaci T-lymfocytů (facilitovaná prezentace antigenu), tedy k intenzivnější zánětlivé reakci než při obvyklé prezentaci jako např. u kontaktně alergické reakce. Po zachycení alergenu polarizují Langerhansovy buňky reakci směrem k Th2 typu, zatímco IDEC k Th1 typu. To je základem tzv. bifázického modelu zánětu u AD. V akutní fázi zánět způsobují Th2 lymfocyty s cytokiny IL-4, IL-5, IL-13; nově též Th17 lymfocyty s IL-17 a IL-22. V chronické fázi pak působí Th1 a Th0 lymfocyty s cytokiny INFγγ, IL-12, IL-5 a GM-CSF. Lymfocyty Th0 se mohou podle převažujícího cytokinového prostředí později diferencovat v Th1 či Th2 subpopulaci. V kůži atopiků je obecně velké množství lymfocytů T, přibližně dvojnásobek počtu v periferní krvi a lze zde zachytit alergenově specifické T-lymfocyty CD4+ i CD8+ fenotypu. Příliv lymfocytů T do kůže je způsoben řadou chemotakticky působících faktorů z keratinocytů a zánětlivých buněk. Např. cytokin TSLP z keratinocytů stimuluje dendritické buňky ke tvorbě cytokinu TARC (CCL17), který přitahuje a aktivuje Th2 lymfocyty, a tak násobí a udržuje alergickou reakci směrem k chronickému průběhu.
Aktivní antigen prezentující buňky (APC) na svém povrchu exprimují molekulu CD40 (upregulace), jejíž exprese (tj. počet buněk CD40+ v kůži) koreluje s aktivitou choroby a s hladinami IgE. Dendritické buňky aktivované prostřednictvím CD 40 a TSLP směřují reakci k Th2 odpovědi, a tak jsou tyto molekuly potenciálními místy zásahu nových léčiv (26).
Zánik keratinocytů s histologickým obrazem spongiózy je dán apoptózou, za kterou je zodpovědný jiný cytokin – INFγ, který na keratinocytech indukuje expresi apoptického receptoru Fas. Za dermální fibrózu u chronické AD jsou zodpovědné patrně eozinofily. Tvoří IL-11 a TGF-β a stimulují tvorbu kolagenu, především typu I. Svou roli zde sehrává i zvýšená exprese růstového endotelového faktoru (VEGF), způsobujícího hyperpermeabilitu cév u AD.
A tak odchylky ve funkci dendritických buněk ovlivňujících rovnováhu Th1/Th2, ale i v regulačních T-lymfocytech, vedou k abnormitám v zahájení a kontrole zánětu u AD.
Rozvoj autoimunity
Až u 25 % pacientů s těžkou AD lze prokázat protilátky proti autologním proteinům z keratinocytů či endotelií (např. proti cytoplazmatickému proteinu keratinocytů Hom s1, proti magnézium superoxiddismutáze aj.). Jejich sérové hladiny korelují se závažností AD. Škrábání se pravděpodobně podílí na uvolňování intracelulárních proteinů z keratinocytů. Tyto proteiny mohou vést ke zkřížené imunitní reakci, pokud mají obdobné sekvence, resp. homologie s mikrobiálními proteiny, a tak být příčinou vzniku autoprotilátek třídy IgE. Obvykle se jedná o pacienty s časně vzniklou AD, intenzivním pruritem, recidivujícími kožními infekcemi a vysokými hladinami IgE. Specifické IgE proti vlastním proteinům lze však prokázat u pacientů s AD již v jednom roce věku. Některé autoalergeny dokáží velmi silně indukovat zánětlivou odpověď Th1 typu, takže zhoršují atopický zánět, který je obvykle vyvolán specifickými IgE proti alergenům ze zevního prostředí (8).
Pruritus, neurogenní zánět a psychosomatika
Na patogenezi AD se podílí i neurogenní zánět. Tato oblast je však zatím nejméně probádaná. Empiricky známá je zvýšená citlivost a dráždivost na taktilní podněty, snížený práh pro pruritus. Pruritus lze u AD považovat za primární projev. Vyšší intenzita svědění v noci je patrně dána změnou ladění ze sympatikotonie na parasympatikotonii (prof. Gieler – 21).
Jako alokineze se popisuje vlastnost atopické kůže reagovat svěděním na minimální podněty (zevní – např. mechanické, ale i vnitřní – např. psychické). Vznik ekzému po poškrábání lze považovat za analogii Kobnerova fenoménu. Tedy ekzému lze teoreticky zabránit, pokud se předchází všemu, co provokuje svědění (4).
V posledních letech se též prokázalo, že do kůže zasahují až do vrchních vrstev epidermis nemyelinizovaná vlákna C pro pruritus, která se liší od vláken pro bolest. Keratinocyty fungují jako neurosensory, secernují dokonce NGF (nervový růstový faktor). Hodnoty NGF jsou v krvi atopiků vyšší a korelují s tíží AD (receptory pro NGF jsou přítomné na nervech, keratinocytech, mastocytech). Hlavními patologickými mediátory pruritu u AD nejsou histamin či serotonin, což v praxi dokumentuje malá účinnost antihistaminik i antidepresiv na potlačení pruritu. Není to pouze jedna látka, ale celé skupiny – neuropeptidy (např. substance P), proteázy a jejich receptory (PAR), kininy (např. kalikrein 7) a cytokiny, zejm. IL-31. Posledně jmenovaný je silně pruritogenní, prodlužuje přežívání hematopoetických buněk, stimuluje tvorbu prozánětlivých cytokinů a je v současnosti považován za hlavní patogenetický faktor pruritu u AD. Stafylokokové exotoxiny jsou schopné zvýšit expresi právě IL-31 a jeho receptorů (8).
Z biochemických odchylek jsou u AD zvýšené hodnoty fosfodiesterázy PDE4, vedoucí k snížení β-adrenergních receptorů (podstata bílého dermografismu), ale i ke zvýšené produkci IgE. Vyšší aktivitě fosfodiesterázy se připisuje též zvýšená tvorba prozánětlivých cytokinů (IL-1, TNF α, GM-CSF) z keratinocytů, které přispívají k přesmyku na Th1 imunitní reakci, a nepřímo (přes INFγ) tedy i k zvýšení apoptózy keratinocytů. Tyto nálezy jsou ale jen kaménky v pomyslné mozaice. Ze základního výzkumu neurobiologie kůže se ukazuje, že existuje přímá interakce periferního a centrálního nervstva a kůže s vlivem na imunomodulaci a homeostázu kůže. K postresovým jevům, které jsou v porovnání se zdravými jedinci u AD skutečně odlišné, patří např. nižší uvolňování kortisolu, periferní vzestup eozinofilů, vzestup T-lymfocytů s fenotypem CD8+ a CLA+, změna cytokinového profilu ve smyslu zvýšení INFγ a IL-5. Stres působí prokazatelnou porucha bariéry – zvýšení TEWL (transepidermal water loss), snížení tvorby lipidových dvojvrstev (prof. Gieler – 21).
S pokrokem v oblasti výzkumu psychiatrických chorob se postupně odhalují další důkazy o propojenosti psycho-neuro-imunologických dějů, tedy objektivně prokazatelné mediátory a mechanismy (neuropeptidy, neurotransmitery, neurotropiny, neurohormony). Kožní změny u mnohých pacientů s AD představují také chronickou zátěž psychosociální.
Součástí komunikace s nemocným byl měl být psychosomatický přístup. Vzhledem k tomu, že psychogenní složka hraje u AD význačnou roli, je namístě v indikovaných případech profesionální, cílená psychoterapie – nácvik relaxace, úprava návyků, kognitivně behaviorální přístupy a nácvik zvládání stresu, také léčba interpersonální či rodinná (28).
AD je choroba multifaktoriální – na základě genetické dispozice vzniká dysfunkce kožní bariéry a neuroimunologická dysbalance, jež jsou navzájem provázané a u konkrétního jednotlivce různě vyjádřené. Vedou k hyperreaktivitě kůže a různé fenotypické manifestaci.Díky genetické komplexnosti, fenotypické heterogenitě, různorodosti průběhu i provokačních faktorů AD a podobnosti s kožními projevy u různých imunologických a metabolických chorob se nabízí otázka, zda se v případě AD nejedná o chorobu, ale spíše o syndrom (22). Současná medicína na tuto otázku zatím jednoznačnou odpověď nemá.
Diagnostika
Diagnostika AD je komplexní proces a je založena na:
- zhodnocení kompletní anamnézy – zaměřené na atopické choroby v rodinné anamnéze, na objektivní i subjektivní obtíže pacienta současné i anamnestické
- důkladném morfologickém vyšetření – na znalosti projevů a forem AD
- zvážení diferenciálních diagnóz (tab. 2); AD nemá specifický histologický obraz (5).
Table 2. Diferenciální diagnostika atopické dermatitidy 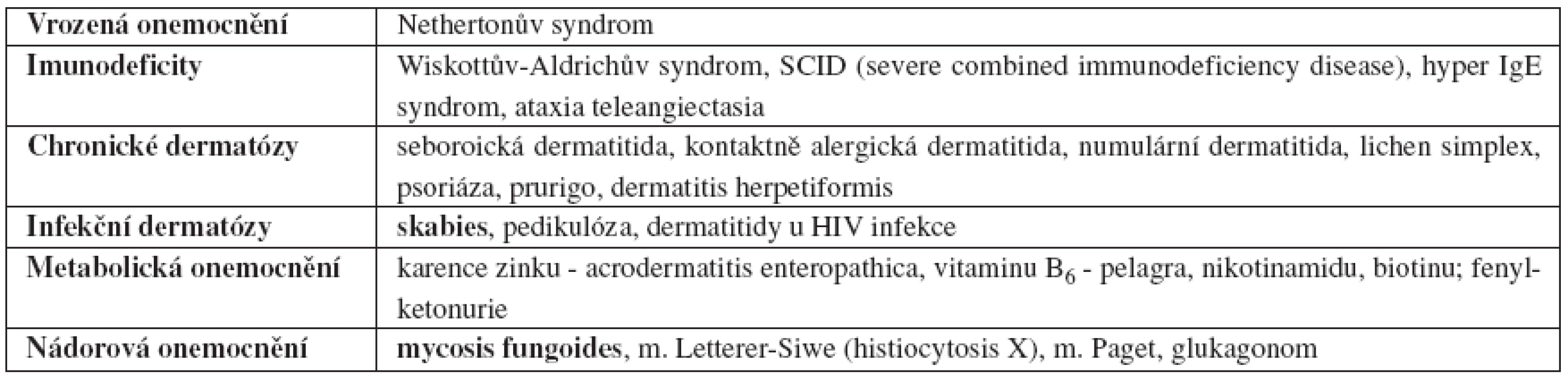
Nezbytnou součástí anamnézy je posouzení dosavadního průběhu – délka remisí, frekvence exacerbací, počet hospitalizací či pracovních neschopností, reakce na předchozí léčbu – účinnost a snášenlivost a analýza provokačních faktorů (33).
„Anamnéza je kontinuálním procesem, který nikdy nekončí a v průběhu opakovaných nebo dlouhodobých kontaktů s pacientem se mají získané informace znovu ověřovat, doplňovat a revidovat. Poznávání pacienta ze všech hledisek je trvalou výzvou. Stále se přesvědčujeme, že nám něco uniká a něco v pacientově obraze chybí“ (prof. Špičák, EUNI).
Diagnostická kritéria
V praxi obvykle diagnóza nečiní obtíží, ale pro účely epidemiologického sledování a klinických studií (s dopadem pro praxi, tedy prevenci a léčbu) je třeba onemocnění přesněji charakterizovat. A zde je problém – právě pro variabilitu a pestrost klinického obrazu. Toto onemocnění je obtížné definovat vzhledem k rozdílné lokalizaci, morfologii a průběhu, ale též proto, že nemáme k dispozici žádný diagnostický test, který by sloužil jako standardní (12). Původní velká a malá kritéria (Hanifin a Rajka) jsou složitá a málo specifická. Také kritéria Britské pracovní skupiny pro AD (Williams et al.) se šířejí neujala. V současnosti se spíše využívají tzv. kritéria nového tisíciletí (Bos a van Leent), která se skládají ze 3 skupin kritérií:
- nutné kritérium – přítomnost alergen specifických IgE
- zásadní kritéria – typická morfologie a distribuce dermatitidy, pruritus, chronický či chronicky recidivující průběh
- malá kritéria – viz dále v textu.
Ale i tato kritéria mají své nedostatky – např. pozitivita specifických IgE nereflektuje existenci početné subpopulace intrinzické AD, resp. tuto vývojovou fázi AD (viz v textu dříve), takže by tito pacienti nebyli diagnostikováni, resp. vyhodnoceni jako atopický ekzém.
Z hlediska klinického obrazu je tedy pro diagnostiku v praxi zásadní trias: dermatitida (i mimo flexurární predilekci), xeróza, pruritus. Pátráme též po tzv. frustních či lokalizovaných formách, kdy jsou ekzémem izolovaně postiženy jen některé lokalizace, a aktivně vyhledáváme tzv. stigmata kožní atopie (tab. 3). Tyto známky kožní atopie jsou v klasifikacích AD označované jako malá kritéria. Jedná se o neekzematózní projevy, které jsou pro atopickou diatézu příznačné, protože se bez atopie vyskytují jen sporadicky. Atypické formy či kombinace AD s dalšími ekzémy a dermatitidami jsou diagnosticky náročnější (5).
Table 3. Stigmata kožní atopie a lokalizované formy atopické dermatitidy 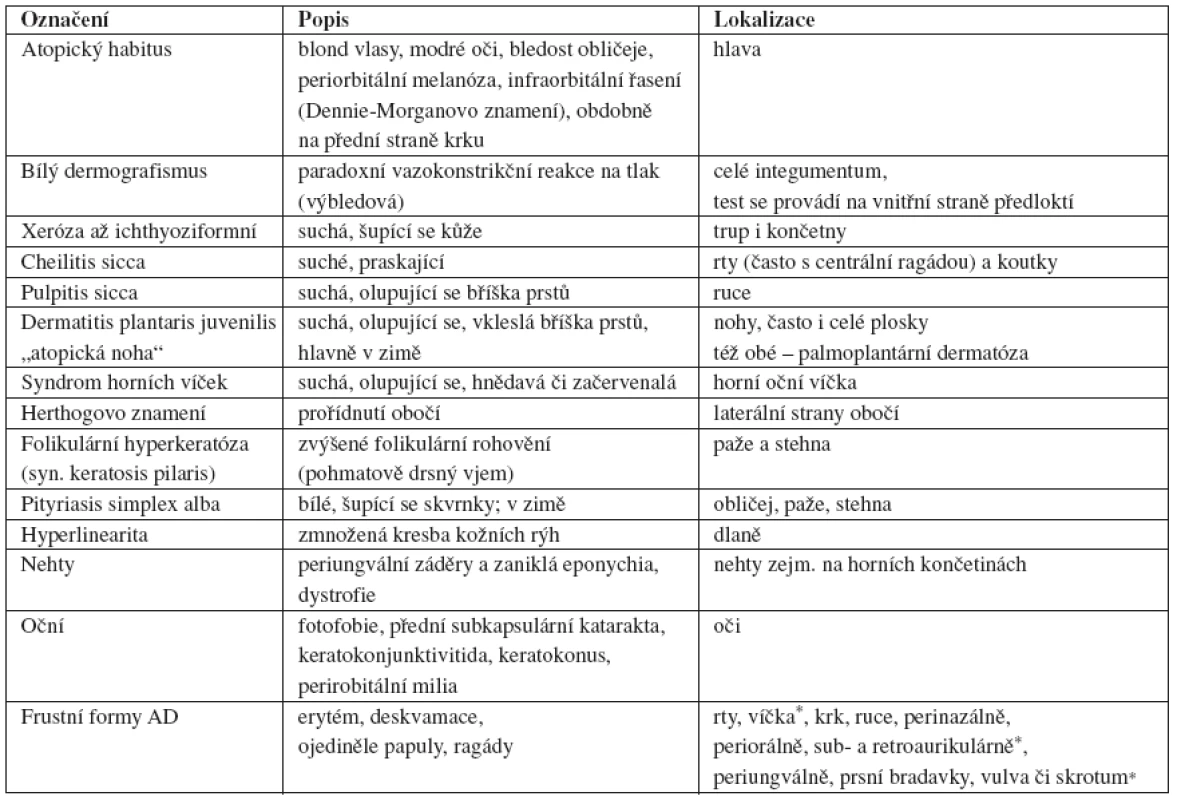
*nejtenčí kůže na lidském těle, nejsnazší průnik iritancií, alergenů, ale i léčiv Léčba
Volba léčby se řídí především podle závažnosti AD. Ta je dána nejen rozsahem a intenzitou, ale i průběhem, reakcí na léčbu, tolerancí léčby, komplikacemi, ovlivněním kvality života atp. V klinických studiích se používají různé skórovací systémy (SCORAD, EASI, Rajka a Langeland), v běžné praxi vycházíme z orientačního posouzení aktuálního rozsahu a intenzity AD, včetně intenzity pruritu, z psychosomatického dopadu na pacienta a rodinu a dále z anamnestických údajů o dosavadním průběhu. Podle závažnosti má volba léčby stupňovitý charakter – postupuje se od léčby lokální přes fototerapii až k systémové léčbě. S rostoucí závažností se tedy v dalších stupních (krocích) přidávají další léčebné linie (tab. 4).
Table 4. Léčba atopické dermatitidy podle závažnosti 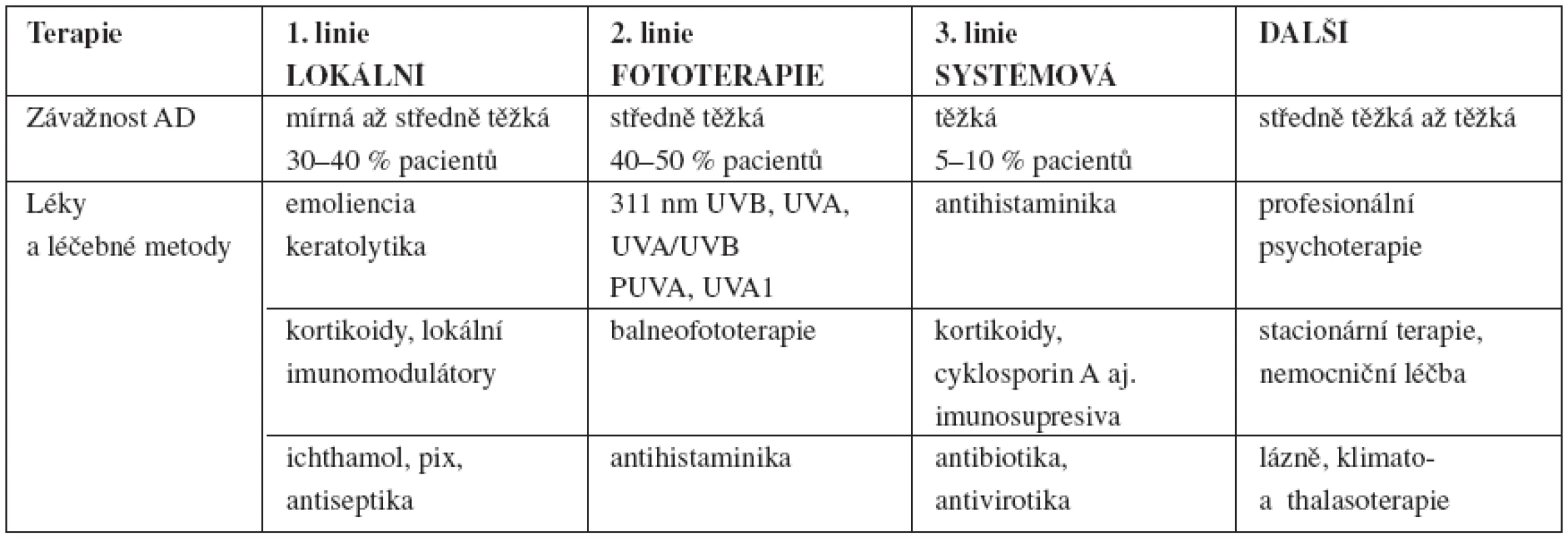
Léčba patří především do rukou dermatologa. Léčby správně diagnostikovaných, mírných forem se mohou ujmout i nedermatologové při respektování příslušných zásad. Léčba AD má ctít zásady komplexnosti, včetně bio-psycho-sociálního přístupu k pacientovi. Vlastní léčba má být kombinovaná, zaměřená na jednotlivé složky, jako jsou zklidnění zánětu, obnova kožní bariéry, odstranění infekce, snížení pruritu a ovlivnění imunologické dysbalance (16). Monoterapie má tedy chabou šanci na úspěch. K dalším pravidlům patří léčba diferencovaná podle věku, lokalizace, závažnosti a fáze. U mírné AD má léčba charakter „reaktivní“ – aktivní léčba už vzniklých exacerbací, zatímco u středně těžké a těžké AD má charakter „proaktivní“ – včasná léčba při prvních příznacích aktivace, ale také i dlouhodobá udržovací léčba s cílem účinného a kontinuálního potlačení zánětu a kolonizace zlatým stafylokokem (1, 6). Podobně jako u jiných chronických chorob můžeme u AD rozlišovat léčbu intervenční v akutní fázi, léčbu přemosťovací v přechodné fázi a v chronické fázi pak léčbu udržovací. Léčba by měla být též individualizovaná – přizpůsobená možnostem a prioritám konkrétního pacienta – „ušitá na míru“. Hlavním cílem je zmírnění či zhojení aktuálních projevů a do budoucna dosažení stabilizace choroby – snížení frekvence exacerbací a zlepšení celkového průběhu. Včasná a dostatečně účinná léčba může zabránit, resp. zmírnit rozvoj atopického pochodu a omezit vznik závažných projevů, jako je asthma bronchiale (pacienti s AD mají obecně až 50% riziko). Trendem je zvládání choroby a jejího průběhu samotným pacientem, tzv. self management (6, 25).
„Léčit co nejdříve a co nejúčinněji“ – tak výstižně vyjádřil hlavní zásadu léčby AD prof. Thomas Luger na pražském Workshopu o atopické dermatitidě v roce 2007 (22).
Postup vedení vyšetření a volby léčby lze shrnut takto:
- anamnéza osobní i rodinná zaměřená na atopii → dispozice, závažnost
- obecná edukace pacienta → postoj k chorobě
- cílená analýza provokačních faktorů → eliminace/redukce, prevence
- zrevidování předchozí a současné léčby → chyby, rezervy ze strany pacienta i lékaře
- klinický stav → návrh komplexní terapie
- zjištění compliance, priorit pacienta → individualizace terapie
- instruktáž o frekvenci, množství, délce doby podávání KS či TIM, aplikační technice, informace o nežádoucích účincích a režimech používání → účinnost a bezpečnost
- instruktáž ohledně koupání/mytí a výběru a používání emoliencií → péče o kůži
- stanovení dlouhodobého léčebného a vyšetřovacího plánu a základní psychoterapie → compliance, dlouhodobé zvládání choroby, vztah pacient – lékař
Poučení pacienta
Dobře léčebně zvladatelná je mírná až středně těžká AD. Problémem bývá spíše compliance pacienta ve smyslu dodržování pravidelnosti léčby a režimových opatření. AD je obecně křížem pro pacienta i lékaře. Současné léky a léčebné metody dokáží akutní exacerbaci dobře zvládnout a zhojit zjevné projevy, ale logicky nemohou, bohužel, chorobu definitivně vyléčit a často ani zásadněji preventivně ovlivnit její průběh – vzhledem k již uvedeným, často neodstranitelným multifaktoriálním příčinám. Zahraniční studie ukazují, jak propastné rozdíly jsou mezi pacienty a lékaři ve vnímání úspěšnosti léčby, zvládání choroby či důsledků choroby (spánek, finance, kvalita života) (33). Identifikovat se s chronickou chorobou, která je všem zjevná a provázená úporným svěděním, je nelehkým úkolem. Atopická dermatitida vyžaduje trpělivost, disciplinovanost a spolupráci jak pacienta, tak lékaře. Lékař by měl s pacientem (či jeho rodiči) probrat, do jaké míry je schopen a ochoten investovat energii a čas do léčby a prevence a co jsou jeho priority. Před vlastní volbou léčby by měla proto nejdříve proběhnout edukace. „Pacienty nezajímají polemiky o etiopatogenezi AD, spory odborníků o optimální léčbu. Zajímá je pouze okamžitá úleva od jejich svědivého, chronického onemocnění, které nepříjemně poznamenává jejich vzhled, omezuje je v řadě aktivit. Pacient by neměl vycítit rozpolcený a nejistý přístup lékaře k léčbě, zejména u kortikoidů. Tato nejistota se snadno přenese na nemocného či jeho rodiče“ (13). Při dobré informovanosti pacientů a pečlivém dodržování preventivních a léčebných opatření lze dostat průběh AD pod kontrolu. U dětí (ale i partnerů dospělých atopiků) je důležitá adaptace všech členů rodiny na dlouhodobé onemocnění (13, 32), podstatný je postoj matky k léčbě, vztah matka – lékař a z psychologického hlediska také zaangažování otce do péče o dítě – ekzematika. Cílem je pacienta, včetně budoucích maminek, u dětských pacientů pak rodiče, přesvědčit o nutnosti a prospěšnosti dodržování režimových opatření a pravidelnosti léčby a také je nasměrovat na individuální vyhledávání provokačních faktorů a jejich vyloučení či omezení (tab. 5 a 6). Režimová opatření se týkají domova, školy či zaměstnání a též volného času. V tomto kontextu je důležitá i volba vhodného vzdělání a povolání – nevhodná profese či pracovní zařazení vedou k aktivaci ekzému, častým pracovním neschopnostem a hospitalizacím, nutnosti rekvalifikace a často závažným psychosomatickým a psychosociálním důsledkům.
Table 5. Provokační faktory 
*oblečení se doporučuje hladké, světlé, z bavlny, event. s Lycrou, nebo z hedvábí či mikrovlákna, příp. polypropylenová ke zlepšení odvádění potu. Někteří výrobci tyto materiály inkorporují stříbrem či jinými antiseptickými látkami. **roztoči mohou AD provokovat jak kontaktně alergickými, tak kontaktně iritačními mechanismy ***ve spánku dochází k tvorbě intercelulárních lipidů, důležitých pro funkci bariéry Table 6. Strava v graviditě, v období kojení a raného dětství 
*preventivní účinky probiotik, užívaných matkou proti vzniku AD u dítěte jsou teoreticky zdůvodnitelné. Ale většina studií ho neprokazuje. Rozhodně nemají vliv na průběh již vzniklé AD. Probiotika obecně mají účinky protizánětlivé a imunomodulační (Th1/Th2 rovnováha). Je třeba je ale užívat s dostatkem vláknité stravy (bifidobakterie a laktobacily se množí pouze ve vláknité stravě). Pro preventivní účinky proti vzniku AD padají v úvahu kromě probiotik vysoké dávky lipopolysacharidů a pak kolonizace správnou mikroflórou. Probiotika nemohou změnit dlouhodobé složení střevní mikroflóry, protože mají účinky přechodné, pouze po dobu užívání (prof. Tlaskalová–21) Sklon k ekzému má atopický pacient doživotně, a proto by se měl provokačním faktorům vyhýbat a o kůži pečovat, i když je bez zjevného ekzému. Vhodné jsou i písemné materiály – informační brožurky či letáčky reflektující nejčastější otázky pacientů (FAQ – frequent asked questions) a také chyby a rezervy v prevenci a léčbě (29) (tab. 8), dále kontakty na seriózní internetové adresy – avšak individuální interakci pacienta s lékařem nemohou nahradit.
Při poučení o chorobě je kromě orientačního seznámení s léčebnými možnostmi vhodné uvést i limitace léčby pro reálnou představu pacienta, co je k dispozici a co lze očekávat. Součástí je i základní informace o nežádoucích účincích a interakcích a instruktáž o správné aplikaci léčiv. Správná aplikace a režim jsou totiž stejně důležité jako lék sám. Tedy, aby se pacient naučil sám chorobu zvládat, jak z hlediska prevence, tak ošetřování podle fáze AD. Rozsah těchto informací i formu musí lékař přizpůsobit danému pacientovi a situaci. Přemíra informací nebo obtížná srozumitelnost odborných termínů může některé jedince odradit. Proto je praktické i z časových důvodů poskytnout informace základní a pacientovi předat písemné poučení – letáček k nastudování doma s tím, že případné dotazy lze probrat při příští návštěvě u lékaře. Cestou k lepší compliance je i písemný léčebný plán pro pacienta k domácímu ošetřování (a to pro všechny věkové kategorie), tedy popis v jaké fázi, jaký lék, jakým způsobem, v jaké dávce a jak dlouho aplikovat. Také stanovení termínu příští kontroly u lékaře posiluje adherenci k léčbě. Na toto téma se v poslední době objevují i odborné práce v zahraniční literatuře (17). Ti kolegové, kteří jsou schopni a ochotni dlouhodobě s atopiky pracovat, takovéto pomůcky již dávno používají.
Kontaktní alergeny
Dříve se soudilo, že u AD je díky převaze Th2 odpovědi nižší potenciál vzniku kontaktní alergie. V současnosti je známo, že prevalence kontaktní alergie je u AD stejná jako u ostatní populace. Klasické kontaktní alergeny, jakož i aeroalergeny, hrají roli zejména u AD dospělých. Kontaktní alergie může být příčinou i tzv. selhání léčby. Ač má kontaktně alergická a atopická dermatitida řadu styčných bodů v patogenezi, jedná se o koexistenci dvou chorob. Je to dvoucestný proces: kontaktní senzibilizace exacerbuje příznaky AD, ale sama atopie díky porušené bariéře predisponuje k jejímu vzniku. Dysfunkční kožní bariéra je i příčinou vyššího výskytu kontaktně iritačních reakcí u AD, a to i v klidovém stavu bez aktivního ekzému. Nejčastějšími kontaktními alergeny u AD jsou kovy (nikl, méně pak chróm a kobalt), latex, parfémy a Peru balzám, méně konzervační a emulgační látky (parabeny, kathon CG, alkoholy lanolinu).
Kontaktní alergická reakce vyvolaná aeroalergeny a zprostředkovaná IgE je důležitým patogenetickým faktorem u AD. Kožní projevy mohou být exacerbovány expozicí roztočům domácího prachu, pylům a zvířecím epiteliím. V takových případech jsou projevy často lokalizovány především na obličeji, krku, rukou, resp. i jiných nekrytých partiích. Atopické epikutánní testy jsou v takových případech přínosné, resp. tam, kde je třeba zjistit klinickou relevanci aeroalergenů. V epikutánních testech se u AD můžeme setkat i s klinicky nerelevantní kontaktní alergií, např. při pozitivitě thiomersalu jako projevu latentní kontaktní alergie vzniklé nejčastěji používáním očních kapek (30).
Potravinové vlivy
Potravinové vlivy jako zdroj aktivace ekzému jsou často pacienty, ale i lékaři přeceňovány. A tak se pozornost soustředí z hlediska prevence na různé diety. Svůj význam mají především u kojenců a malých dětí, kde se potravinová alergie obecně vyskytuje v 20–50 % (12), vliv potravinové alergie na aktivaci AD se udává okolo 35 % (3). Potravinová alergie se totiž nejčastěji projevuje anafylaktickými reakcemi, orálním alergickým syndromem, gastrointestinálními potížemi, případně urtikarií a ne primárně AD. Přítomnost potravinové alergie je však ale spojena s těžší atopickou dermatitidou či tento nepříznivý vývoj predikuje (také vznik astmatu a alergické rhinitidy). Na potravinovou alergii pomýšlíme jednak, pokud se objevují příznaky časně po požití určitého jídla, ale také u dětí a dospělých se středně těžkou až těžkou atopickou dermatitidou, kde je stav navzdory správné a pečlivě prováděné léčbě torpidní. Také lokalizace AD v obličeji u dětí bývá častěji spojena s potravinovou alergií. Americká akademie dermatovenerologie doporučuje u nekojených dětí pod šest měsíců věku se středně až těžkou atopickou dermatitidou, která je torpidní i přes léčbu emoliencii a lokálními kortikoidy, zkusit na 6–8 týdnů nahradit obvyklé mléčné dětské výživy přípravky s vysokým stupněm hydrolyzace či přípravky s aminokyselinami (3). Nemá smysl při podezření na alergii na kravské mléko podávat jen částečně hydrolyzovaná nebo jen modifikovaná mléka a dále je takovéto dítě třeba odeslat k poradě k pediatrovi, resp. nutričnímu specialistovi. Obecně vede nekompletní eliminace podezřelých potravin k matoucím závěrům. Na druhou stranu testovat potravinovou alergii u dětí s mírnou AD nebývá přínosné (3).
Nejčastějšími dětskými alergeny jsou kravské mléko, vaječný bílek i žloutek, pšeničná mouka, arašídy a sója. Po třetím roce věku však obvykle tyto alergie vyhasínají. V dospělosti se uplatňují spíše ořechy, ryby a korýši, sója a případně aditiva. Tyto alergie obvykle s věkem nevyhasínají. Citrusy, jahody, čokoláda či kakao způsobují reakce spíše přítomností farmakologicky aktivních látek, deliberujících histamin a jiné mediátory, než alergickou reakcí. Je třeba zmínit, že neodůvodněné, „preventivní“ diety jsou především v dětském věku nevhodné. Málo alergenů v potravě totiž vede ke špatnému navození tolerance a riziku vzniku alergie a autoimunity, na druhé straně přemíra alergenů vede k riziku senzibilizace. Každý extrém je pro organismus nevhodný, optimální je vyváženost (prim. Fuchs–21) (tab.6).
Z hlediska vyloučení určitých potravin lze postup u AD rozdělit do dvou kategorií: jednak obecná „ekzémová“ dieta, tj. v aktivní fázi ekzému vyloučit takové potraviny a nápoje, které vedou obecně ke zhoršení (iritace, vazodilatace, nealergická histaminoliberace a jiné mechanismy), jednak specifická dieta, tj. na základě průkazu specifických IgE vůči potravinám (prick test a RAST) anebo expozičním testem, optimálně profesionálně provedeným (dvojitě slepý, placebem kontrolovaný – nejsenzitivnější metoda, protože řada potravinových alergií je non-IgE charakteru) či osobním vypozorováním s respektováním pravidel objektivity, např. na základě deníčku.
Po požití ovoce či zeleniny se může objevit tzv. orální alergický syndrom, vznikající v důsledku zkřížené přecitlivělosti mezi pyly a potravinami či latexem a potravinami. Projevuje se akutním otokem rtů, někdy i obličeje, polykacími a i dýchacími obtížemi, při subakutním průběhu se vznikem ekzémové cheilitidy i s periorálním ekzémovým postižením. Pacient při tom nemusí mít specifické IgE vůči inkriminovaným potravinám pozitivní, proto je vhodné pacienty s alergií na pyly či latex na toto riziko upozornit, např. formou letáčku.
Potraviny však u atopiků mohou způsobovat kontaktní dermatitidy: jednak častou iritační dermatitidu a jednak vzácnější, ale závažnější – proteinovou kontaktní dermatitidu (Hjort), která má klinicky charakter kombinace ekzému s urtikarií. Nastupuje do několika minut po kontaktu s bílkovinami – ovoce, zelenina, koření, rostliny, živočišné proteiny, obilí, enzymy. Respirační příznaky a rhinokonjkunktivitida se častěji objevují u dvou posledně jmenovaných. Patogeneticky se předpokládá reakce I. a IV. typu v kombinaci s reakcí atopickou (přes Langerhansovy buňky vázající IgE). Proto bývají často epikutánní testy negativní, ale pokud se provádí test skarifikačně nebo se přímo provede intradermální test, tak je výsledek pozitivní. Atopie je pro proteinovou kontaktní dermatitidu, která je v současnosti klasifikována jako forma kontaktní urtikarie, jednoznačně rizikovým faktorem (50 % případů) (23).
Doplňující vyšetření
Z komplementárních vyšetření má smysl stěr z kůže na bakteriologické vyšetření a citlivost, případně mykologické vyšetření, pátrání po fokálních infekcích, nejčastěji v oblasti horních cest dýchacích a močových (výtěry z krku a nosu, kultivace moči).
Atopici mají větší výskyt kontaktně iritačních než kontaktně alergických dermatitid. Ty se ale mohou „sekundárně“ vyvinout v důsledku porušené bariéry. Epikutánní testy, event. atopické epikutánní testy cíleně indikuje a provádí v této oblasti zkušený dermatolog.
Alergologické a imunologické vyšetření a testy je vhodné indikovat cíleně, tedy pokud je pro ně důvod :
- gastrointestinální obtíže – potravinové alergeny, zejména u dětí do jednoho roku věku
- respirační obtíže či aerogenní lokalizace ekzému – aeroalergeny
- při anamnestickém podezření na senzibilizaci na další alergeny
- při podezření na poruchu imunity – recidivující mezotitidy, chronické rhinitidy, herpetické infekce atp.
- anebo při pátrání po faktorech podílejících se na torpidnosti průběhu a refrakternosti AD i při správně zvolené a pacientem pečlivě prováděné léčbě
- obecně v případech, kde je potřeba atopii diferenciálně diagnosticky potvrdit či vyloučit (5).
Čtyři principy úspěšnosti léčby AD stručně formuloval prof. Růžička na EADV kongresu v Paříži v roce 2008: správná diagnóza, správná volba léku, u extern volba vhodné galenické formy a vyhýbání se provokačním faktorům.
Přehled léčiv a léčebných metod
1. Lokální léčiva
Základem je léčba zevní, lokální. Musí být komplexní, tj. týká se jak vlastní léčby, tak péče o kůži. Specifikou zevní léčby je zohlednění výběru léčiva, galenické formy a dávky podle fáze onemocnění, lokalizace, věku – obecně viz tab. 7. Čím je onemocnění akutnější, tím větší roli hraje volba galenické formy vehikula, čím je chroničtější, tím více rozhoduje o úspěchu volba účinné látky.
Table 7. Léčebné spektrum extern podle fáze atopické dermatitidy 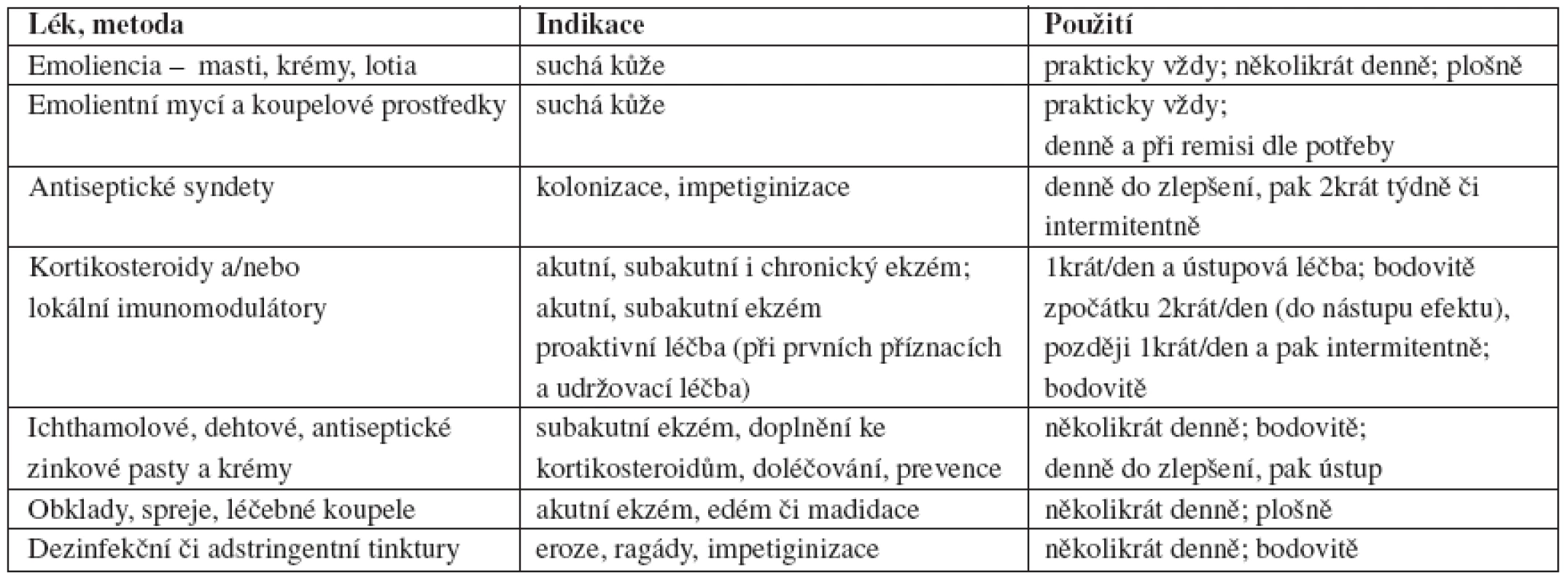
Prvořadá je u atopika péče o suchou kůži jako léčebné i preventivní opatření. Tyto prostředky se nazývají emoliencia – zlepšují, některá i obnovují kožní bariéru, hydratují, upravují patologické pH, zvláčňují, promašťují, šetří kůži před steroidy – pro tyto účinky se někdy hovoří o tzv. korneoterapii. Patří mezi základní léčbu AD. Je známo, že 50 % léčebného efektu lze dosáhnout jen s vhodným masťovým základem. Z IVLP magistraliter základů, které mají účinky pouze promašťující a bariérové, jsou to např. vazelína, synderman, pontin, kutilan; krémové, jako jsou ambiderman či neoaquasorb, jsou vhodné spíše jako doplnění léčby v akutní fázi než jako emoliens k ochraně bariéry pro dlouhodobé používání. Jako keratoplastická či slabě keratolytická přísada se do masťových základů používá kyselina salicylová (3–5%) či urea(4%), která má navíc hydratační a antipruriginózní účinek. Také kyselina boritá patří mezi tradiční látky, má mírné antimikrobiální a protizánětlivé účinky. V EU je povolena pouze u dospělých a maximálně v 3% koncentraci.
V oblasti HVLP se jedná spíše než o čistá emoliencia o dermokosmetické přípravky, kde jsou do vhodného základu přidávány navíc látky s určitými léčebnými účinky, obvykle přírodního původu (vitaminy, antioxidanty, antiflogistická fytofarmaka, humektanty, keratolytika aj.) Jsou to přípravky a řady např. Atoderm, Dermalibour, Dexeryl, Eucerin, Excipial, Exomega, Konopná dermokosmetika, Leciderm, Linola, Lipobase, Lipikar, Lipoderm Omega, Menalind, Neutrogena, Physiogel, Sebamed, Sensicutan, Shea butter, Trixera, Vitella. Na ragády se osvědčuje Cicaplast, Cicalphate; z klasických extern též Bepanthen plus, Calcium pantothenicum ung. Některé z nich mají díky kombinacím účinných látek a ověření klinickými studiemi i charakter léčiv – např. v USA Atopiclair® (vitis vinifera, telemestin, vitaminy C a E, natrium hyaluronát, butyrospermum Parkii, kyselina glyciretinová) nebo v SRN Zarzenda® (palmitoyletanolamid, vitis vinifera, telmestin, kyselina glyciretinová) či i u nás dostupné Halicar® (cardiospermum halicacabum) nebo Sensicutan® (heparin, levomenol, kyselina salicylová) .
Obecně platí, že čím mastnější (masti, mastné krémy) a čím méně složek základ obsahuje, tím lépe. Nevhodná jsou lotia, jednak pro malé bariérové vlastnosti, jednak pro vysoký obsah surfaktantů, které zhoršují kožní bariéru a v konečném důsledku kůži vysušují. Samozřejmě je lze používat na den „do práce“ z hlediska lepšího komfortu, ale je nutno je doplnit vhodnými emoliencii pro použití „na doma“. Nevhodné jsou prostředky parfémované, včetně ung. leniens (s geraniovou silicí), ung. Holt (s tct. carbonis detergens, geraniovou silicí a levomenolem) či Ondřejova mast (s kyselinou salicylovou, levandulovým olejem). Také bylinné a živočišné přísady nejsou vždy ku prospěchu, neboť se často jedná o potenciální alergeny (např. heřmánek, propolis). Optimální je aplikovat emoliencia často, v tenké vrstvě a šetrně je nanášet. Proto by lékař měl předepisovat, resp. pacient si pořizovat množství až 250 – 500 gramů týdně.
Obecně trvá proces hojení kůže, reparace, 4–8 týdnů a po toto období je kůže i iritabilnější (35). U atopické dermatitidy, kde zánět probíhá opakovaně, resp. chronicky, je zapotřebí napomáhat obnově kožní bariéry trvale. Proto se emoliencia aplikují nejen jako udržovací péče, ale i preventivně v období bez zjevných příznaků onemocnění. Často pacienti tyto léky nepoužívají pravidelně s odůvodněním, „že jim na ekzém nepomáhají“. Proto je vhodné předem vysvětlit, že „se jedná o preventivní léky, působící na suchou kůži, ne zjevně na zánět“. A že „i nepostižená kůže není zcela zdravá, proto je třeba udržovací péče“. Nesmírně důležitá je i vhodná a šetrná hygienická péče o kůži atopika – používají se emoliencia koupelová a mycí, např. Balmandol, Balneum Hermal, Linola olbad, Oilatum; Balneum Hermal plus má i antipruritickou přísadu a Oilatum plus zase antiseptickou – vhodné ke zvládání a prevenci stafylokokové kolonizace. Z léčebných syndetů (syntetické detergenty, „mýdlo bez mýdla“) jsou nás na trhu vhodné např. Atoderm syndet, Lipikar syndet, Physiogel cleanser nebo antiseptický Cytéal (obsahuje hexamidin, chlorhexidin a chlorokrezol). U dospělých atopiků se doporučují olejová emoliencia formou krátkého sprchování a spíše chladnější vodou. Oproti dřívějším dobám se ustupuje od metod doporučujících kůži nemýt denně, protože je třeba snížit jak množství mikrobů, tak vzdušných alergenů na kůži. V akutní fázi onemocnění samozřejmě volíme hygienu jen na nejnutnější partie.
Koupele (léčebné) jsou praktické hlavně u dětských pacientů. Z hlediska pozice mezi lokálními léky mají podpůrný, doplňující charakter. Používají se nejčastěji koupele olejové, bylinné, koloidní (otruby), hypermanganové, méně minerální (termální prameny) či solné (mořská sůl). K dosažení efektu je zapotřebí pravidelnost, vhodná volba léčebné přísady podle fáze onemocnění a správné provedení. Koupel by měla být krátká, do 10 minut. Koupele mají u dětí efekt nejen očistný a léčebný, ale i významný efekt psychologický. Lze je provádět i doma. Po omytí, resp. očistné i léčebné koupeli se doporučuje aplikovat do tří minut emoliencia nebo diferentní externa, dokud je kůže ještě vlhká. Jinak si kůže nezachová hydrataci, voda se odpaří, dojde ke kontrakci rohové vrstvy, popraskání a dalšímu přesušení kůže. Pokud je stav tak iritabilní, že koupel nesnese, je namístě zařadit obklady či sprejování.
Obklady se používají v akutní fázi, např. sol. Jarisch formou tzv. odpařujících, vysýchavých obkladů, u vezikul či madidace např. liq. aluminii aceticotartarici ředěný s vodou v poměru 1 : 20, také formou lokální koupele, osvědčená jsou i některá fytofarmaka, např. odvar z dubové kůry (tanin), v improvizovaných podmínkách lze použít odvar ze silného černého čaje bez přísad; u impetiginizace např. slabě růžový roztok hypermanganu (ředění 1 : 10 000) nebo na malé plochy roztok dusičnanu stříbrného (0,25%). V lidovém léčitelství oblíbený heřmánek je častým alergenem. Chlazením a odpařováním tekutiny dochází k ochlazování kůže, osmoticky k zástavě mokvání a celkově ke zmírňování zánětu. Podobného efektu při malém rozsahu lze dosáhnout sprejováním, např. hromadně vyráběné léčebné termální vody jako La Roche Posay sprej či Avéne sprej. Obklady i spreje se používají jen po dobu nutnou ke zklidnění stavu, dlouhodobější používání vede k přesušení.
Krytí je vhodné všude, kde je to technicky proveditelné. Chrání postižené partie před zevními vlivy, včetně škrábání a současně umožní působení podpůrných i diferentních léčebných prostředků (kortikoidy, ichthamol, pix). Za hospitalizace se řeší klasicky gázovým obinadlem, v ambulantní složce obvykle bavlněnými rukavičkami na ruce a na trup hladkým starším světlým bavlněným tričkem s dlouhými rukávy, na dolní končetiny obdobně pyžamovými kalhotami. Princip odpařování a krytí se využívá i při technice odpařujícího obvazu (wet wrap dressing, bandaging). Za tím účelem je i u nás dostupný speciální tubulární elastický obvaz z jemné, řídké tkaniny o různých průměrech (na prst, končetinu, trup atd.), což výrazně zjednodušuje ošetřování (Coverflex, fy Hartmann). Lze jej předepsat jako zdravotní pomůcku na příslušnou žádanku. Tento obvaz lze lehce „podetřít“ lokálním kortikosteroidem („fett-feucht“ německých autorů), což má synergický efekt a zejména u malých dětí není pak třeba se uchylovat k silnějším preparátům.
Péče o kůži dětí a i léčba vyžaduji zvláštní pozornost. Dítě není malý dospělý, je zde jiný poměr tělesného povrchu k hmotnosti. Je třeba mít stále na paměti otázky farmakodynamiky a farmakokinetiky uvažované léčby a obecně poměr účinnosti k bezpečnosti. U dětí, zejména v kojeneckém a batolecím věku, je rizikové použití kyseliny salicylové, borité a kamenouhelného dehtu (intoxikace), trifenylmetanových barviv jako genciánová violeť, brilantová zeleň, metylénová modř, rivanol (nekrózy ve vyšších koncentracích), dále soli stříbra na velké plochy (agranulocytóza, hyperbilirubinémie), u kojenců neomycin (ototoxicita) a též chloroxin (endiaron), hexachlorofen, triklosan a chlorokrezol (deriváty fenolu, intoxikace), jod na velké plochy (intoxikace, nefropatie, retinopatie) (13, 24). Krytí je u dětí důležité zejména přes den, u malých dětí s velkým pruritem i na noc, současně se stříháním nehtů nakrátko.
V akutní fázise k intervenční léčbě používají lokální kortikoidy. Po zlepšení se sekvenčně přechází na imunomodulátory (topical immunomodulators, TIMs). Ty se primárně zavádí také při proaktivní léčbě, tedy při subakutních projevech. Při zlepšování se pak frekvence aplikace diferentních extern snižuje až do vynechání nebo udržovací frekvence. A také tam, kde nelze dosáhnout úplného zhojení, se v chronické udržovací léčbě prosazují jako standard imunomodulátory v intermitentním režimu, u velmi těžkých případů pak v kombinaci s kortikoidy pulzně či intervalově.
Pro akutní stavy jsou pro své silné protizánětlivé účinky základními externími léky lokální kortikosteroidy (KS). Zasahují do patogeneze AD na řadě míst, a proto jsou tak účinné. Jsou léky dosud nepostradatelnými, mají velmi dobrou snášenlivost, příznivou cenu, širokou paletu galenických forem na různé fáze a lokalizace (na akutní lotia a hydrokrémy, na chronické oleokrémy a masti; na obličej a intertriga krémy, do kštice roztoky a lotia). Vzhledem k nežádoucím účinkům KS a chronickému průběhu AD dáváme obecně přednost moderním kortikoidům IV. generace s lepším bezpečnostním profilem, než mají starší molekuly. Lékař musí obecně vybalancovat žádoucí efekt vůči nežádoucím účinkům. Fluorované kortikoidy by neměly být vůbec používány u dětí a do rizikových partií u dospělých, jako jsou obličej a intertriga (krk, axily, inguiny, anogenitálně) (1). U mírných forem a u dětí jsou standardem slabé, resp. středně silné KS, např. hydrokortison butyrát (Locoid) či alklometason propionát (Afloderm). U středně těžkých až těžkých forem a u dospělých volíme KS středně silné až silné, např. metylprednisolon aceponát (Advantan), flutikason dipropionát (Cutivate) či mometason furoát (Elocom).
Bezpečnostní opatření a poučení při léčbě lokálními kortikosteroidy (3):
- KS aplikujeme jen 1krát denně – častější aplikace nepřináší větší efekt, jen vyšší riziko nežádoucích účinků. Výjimečně v urgentních případech lze použít 2krát/den po 2–3 dny. Aplikujeme jen tenkou vrstvu – do kůže proniká jen 1 % (max. 10 %) a vyšší vrstva (dávka) znamená jen vyšší riziko, ne vyšší efekt
- po nástupu efektu – zlepšení, ustupujeme s aplikací KS ob den, pak ob dva dny, ob tři dny atd. (ústupová léčba) až do zhojení a vysazení. Náhlé, nepostupné vynechání KS vede zpětnovazebně k exacerbaci ekzému
- kde nelze stav kompletně zahojit či stabilizovat, přecházíme na intervalovou léčbu - obvykle 2krát týdně, resp. ob tři dny, neboť v kůži po aplikaci zůstává určité depo kortikoidu (např. pondělí a pátek). U relativně stabilních chroniků lze použít i víkendovou léčbu (víkend kortikoidy, všední dny zevní léčba bez kortikoidů)
- pacientům je třeba zdůraznit, že kortikoid není prostředek k promazávání, je to lék první pomoci zklidňující zánět, který nemůže mít efekt na suchost a nelze ho používat preventivně. Praktičtější je proto pro odlišení psát hotové KS než magistraliter směsi. Pro odpovídající efekt je třeba pacientovi předepsat dostatečné množství (do příští kontroly), na druhou stranu monitorovat příp. větší spotřebu (pacient si telefonuje o dopsání dalšího balení ještě před kontrolou)
- zábrana kortikofobie – vhodná formulace pro pacienty je např. „nežádoucí účinky nastávají jen při nesprávném používání“. Systémové nežádoucí účinky nastávají při aplikaci na velké plochy (>30 % tělesného povrchu) a při velké spotřebě silných KS; lokální nežádoucí účinky mohou nastat při vícečetné aplikaci za den, ve velkém množství a po dlouhou dobu; náchylnější jsou rizikové partie (obličej, intertriga a flexury) a rizikový věk (malé děti, staří). Lze jim předcházet dodržováním pravidel frekvence, aplikovat přísně jen na postižené partie a řídit se zásadami ústupové léčby. Je důležité nežádoucí účinky též pacientovi přiměřeně popsat. Pro pacienty dobře srozumitelný příměr vyjádřil jeden francouzský kolega: „S léčbou kortikoidy je to jako s jízdou autem – je bezpečná, pokud se dodržují pravidla“. Navíc je lepší proaktivní než reaktivní léčba, tedy zavčasu zahájená léčba vede k včasné zábraně šíření zánětu, který by se jinak musel léčit déle a silnějšími kortikoidy, což je riskantnější. Kortikofobie vede k podléčenosti, nedostatečné kontrole zánětu a riziku těžkého průběhu s kožními i slizničními projevy atopie
- nespolupracující pacient = rizikový pacient (5).
K doplnění na den a při ústupu od kortikoidů k dohojování či k udržovací léčbě projevů a také jako základní diferentní léčba u mírných forem lze použít tradiční látky, jako je např. bílý ichthamol v galenické formě pasty (Ichthyo Care, I-care, Ictamo Pro pasta) nebo magistraliter pasty s tmavým ichthamolem v 1–3% koncentraci. Ve stejné indikaci jsou vhodné antiseptické pasty s chloroxinem (Endiaron pasta) anebo i čistá Pasta zinci mollis.
Pix lithantracis pro svůj kancerogenní potenciál není v Evropské unii od roku 2002 pro volný prodej a hromadně vyráběné preparáty povolen. Magistraliter preskripce s pix lithantracis zůstává zachována, protože je vázána na lékařský předpis, a tudíž jsou lépe ošetřena bezpečnostní pravidla. V EU platí zákaz používání kamenouhelného dehtu pro děti, použití u dospělých je limitováno maximálně na 1/5 tělesného povrchu a maximální přípustná koncentrace je 5%. V nemocnicích a stacionářích se tradičně používá i surový pix lithantracis, tedy v 100% koncentraci, k „tečkování“ na chronické partie.
Lokální imunomodulátory (topical immunomodulators, TIM, inhibitory kalcineurinu) mají protizánětlivé účinky na úrovni mírných až středně silných KS, nemají tachyfylaxi, rebound fenomén a atrofogenní potenciál jako KS. Dále mají výrazný, tolik žádoucí, antipruritický účinek. Příznivě ovlivňují ovšem všechny základní morfologické parametry AD – erytém, infiltraci, exkoriace, lichenifikaci. Důležitým zjištěním je, že pimekrolimus i takrolimus příznivě modifikují dlouhodobý průběh choroby. Při jejich intermitentním používání signifikantně klesá frekvence akutních exacerbací. Jsou vhodné především k léčbě AD v obličeji, na krku, v oblasti genitálu a ve flexurách končetin, protože zde dosahují nejvyšší účinnosti. Méně účinné jsou na horních a dolních končetinách (velká molekula léku, horší penetrace do kůže). Tzv. nonrespondenti jsou udáváni v 5–20 % případů. Na trhu jsou v současnosti 1% pimekrolimus (Elidel krém) a 0,03% takrolimus (Protopic, mast), které jsou hrazeny na mírně až středně těžkou AD pro kategorii 2–18 let a 0,1% takrolimus (Protopic, mast), který je hrazen na střední až těžkou AD pro kategorii od 16 let. Aplikuji se při prvních příznacích aktivace a v akutní fázi 2krát/den (obvykle do tří týdnů), v dohojovací 1krát/den. Není-li dostatečný efekt, nárazově lze použít KS a při nástupu efektu přejít zpět na TIM. Z dlouhodobého pohledu se aplikují intermitentně. U těžkých případů lze analogicky jako u kortikoidů přejít na udržovací intervalovou léčbu 2–3 týdně, což nyní dokladují i klinické studie. Indikační limitace je na případy, kde konvenční léčba KS je nedostatečná, netolerovaná či riskantní; preskripce je vázána na dermatologa.
Léčba TIM se nemá kombinovat u AD s fototerapií pro teoretické riziko potenciace imunosupresivních efektů. Kombinace s bazálními podpůrnými léčivy (emoliencia) je vhodná; z důvodu lepšího vstřebávání (velká molekula léčiva) se doporučuje emoliencia aplikovat až za půl hodiny po aplikaci krému s pimekrolimem nebo za dvě hodiny po ošetření mastí s takrolimem; je třeba je aplikovat na suchou kůži nejméně 30 minut po umytí nebo koupeli. Pokud je totiž kůže vlhká, zvyšuje se riziko pálení a svědění v místě aplikace. I při používání TIM platí nutnost eliminovat mikrobiální vlivy (superantigeny), jinak se AD nehojí a infekt se naopak může nebezpečně šířit. U bakteriálních infekcí není obvykle nutno TIM vynechat, ale základní infekci lokálně či celkově přeléčit antibiotiky. Při infekci herpes simplex virem je třeba TIM vynechat a znovu je aplikovat až po zaléčení, respektive zahojení této virové infekce (cave eczema herpeticatum).
Mírné iritační reakce jsou v prvním týdnu léčby běžné, trvají od několika minut do jedné hodiny a nebývají důvodem k vynechání. Jsou to nejčastěji pocit tepla, pálení, štípání. Je dobré na ně pacienta předem upozornit. K méně častým nežádoucím účinkům patří folikulitida a virové kožní infekce jako veruky, moluska, herpes simplex. Je třeba na ně pacienty také předem upozornit, jakož u dospělých na riziko alkoholového flushingu – přechodný erytém v obličeji, krku, event. i na trupu, po požití i malého množství alkoholu. Rodiče dětí s AD je třeba informovat o nepoužívání léku před a po očkování. I když současné studie potvrzují, že léčba TIM neovlivňuje postvakcinační odpověď, je rozumné doporučit vynechání TIM (při velkoplošné aplikaci) u malých dětí týden před plánovaným očkováním a vrátit se opět k léčbě až po vstřebání infiltrátu v místě vpichu, tj. nejdříve za dva týdny. Studie zkoumající dlouhodobou bezpečnost už od nejútlejšího věku jsou v běhu a průběžné výsledky jsou zatím příznivé. Výsledkem dlouhodobé léčebné strategie by mělo být získání kontroly nad průběhem onemocnění a zlepšení kvality života nemocného.
Lokální antibiotika jako fusidinová kyselina (Fucidin), mupirocin (Bactroban), retapamulin Altargo) či neomycin (Framykoin) indikujeme při známkách impetiginizace či na základě citlivosti ze stěru na bakteriologické vyšetření, a to jen po nezbytně dlouhou dobu. V případě indikace je nicméně třeba používat antibiotická externa denně souvisle a minimálně po dobu 14 dnů – řada pacientů je používá krátkodoběji či intermitentně, a tak potencuje riziko nejen lokální, ale systémové rezistence na antibiotika. Řada lokálních antibiotik je vyráběna již rovnou v kombinaci s KS (např. Belogent, Fucidin H, Fucicort, Pimafucort) – i zde je třeba pacientům zdůraznit zásady antibiotické léčby. Případně jsou k dispozici kombinace KS s antimykotiky či antiseptiky (např. Imacort, Triamcinolon E), vhodné právě pro intermitentní použití. Na velké plochy a pro dlouhodobější kontrolou nad kolonizací Staphylococcus aureus jsou vhodná antiseptika v krémech či ve vhodných mycích prostředcích. Při velkém rozsahu či současném nálezu fokální infekce zvažujeme i podání antibiotik celkově (viz dále).
2. Fototerapie
Světloléčba je indikována spíše u chronických, event. subakutních AD, pro které se používá úzkopásmové UVB o vlnové délce 311 nm, širokospektré UVA anebo kombinace pásem UVA/UVB. Fototerapie se vždy kombinuje se zevní, event. celkovou léčbou a dle možností i balneoterapií. V ambulantních podmínkách ji provádějí kožní stacionáře, sanatoria a kožní oddělení či kliniky. Doba léčby bývá průměrně dva měsíce, ve frekvenci 3krát týdně. Velmi dobrý efekt lze očekávat cca u 20 %, dobrý u 40 % pacientů. Odpověď na léčbu je individuální, takže fototerapie není u AD metodou první volby ani u těžších pacientů. U dětí odpovídá věková hranice pro indikaci fototerapii přibližně začátku školního věku (podle závažnosti ekzému, typu fototerapie, schopnosti spolupráce dítěte), optimálně od 12 let. Fototerapie AD je v ČR plně hrazena ze zdravotního pojištění. Představuje dostupnou, u většiny pacientů použitelnou, relativně bezpečnou a účinnou léčebnou modalitu. Výrazně snižuje zejména pruritus a i spotřebu lokálních kortikosteroidů.
Vysokodávková UVA1 fototerapie se zdála být slibnou pro svou výraznou účinnost a dobrou snášenlivost na akutní AD, ale stále ještě nejsou pro praxi uspokojivě dořešeny otázky dlouhodobé bezpečnosti (5).
Na ragády a opary mívá příznivé účinky světloléčba biolampou, což je volně prodejný přístroj emitující polarizované viditelné světlo.
3. Celková léčiva
Celková léčba u AD tvoří nesourodou skupinu, kde jsou zásadními léky imunosupresiva a pak ostatní léky jako antihistaminika, příp. imunomodulátory a systémové protiinfekční léky (antibiotika, antivirotika, antimykotika) (5, 7, 9, 12, 14, 19).
Antihistaminika nejsou u AD základními celkovými léky, neboť nezasahují podstatným způsobem do patogeneze AD a ovlivňují jen jeden z mnoha mediátorů pruritu. Podávají se spíše nárazově. Klinická odpověď na antihistaminika je u kožních projevů, na rozdíl od slizničních alergických projevů, variabilní a individuální (14). Výraznější antipruriginózní efekt mají spíše sedativní antihistaminika, anxiolytika či tricyklická antidepresiva. Preventivní dlouhodobé podávání antihistaminik má smysl při současném výskytu příznaků respirační atopie, u těžkého průběhu, kde se obvykle volí kombinace nesedativních antihistaminik 2. generace na den a sedativních na noc, resp. při zhoršení. Někdy se osvědčují i kombinace antihistaminik se stabilizátory mastocytů, tedy ketotifenem. U potravinových alergií se používá kombinace s kromoglykátem sodným (preskripční limitace na alergologa). Slibnou skupinou ke zvládnutí pruritu se jeví léky ovlivňující neuropeptidy a jejich receptory v kůži, které jsou ve stadiu klinického výzkumu.
Antibiotika přicházejí k použití u prokázaných fokusů, impetiginizace či v případech, kde se kolonizace podílí na těžkém průběhu – zde je vhodné přeléčit stav celkovými antibiotiky podle citlivosti. Jsou to především širokospektrá a protistafyloková antibiotika jako dikloxacilin, oxacilin (penicilináza rezistentní) či amoxicilin s kyselinou klavulanovou, z makrolidů erytromycin, azitromycin, klaritromycin. U rezistence na makrolidy pak cefuroxim axetil, cefalexin, ko-trimoxazol či klindamycin nebo ciprofloxacin. Lokálně je vhodné sanovat intranazální fokus – mupirocin, fusidinová kyselina anebo retapamulin (10).
Zajímavým a logickým postupem, ale bez ověření u AD, je dlouhodobější podávání antibiotik (2) pro antimikrobiální efekt a dlouhodobější redukci či eliminaci SA z kůže i sliznic. Zde by se jako potenciální jevila především tetracyklinová antibiotika, neboť podle recentních výzkumů tato skupina navíc blokuje proteázy, jejichž množství je právě u AD zvýšené a jednou z příčin poruch kožní bariéry.
Imunomodulační léčba u pacientů s pozitivitou aerogenních alergenů, respektive provokací AD těmito alergeny (tzv. airborn dermatitis) má za cíl desenzibilizaci, ovšem s potenciálním rizikem zhoršení AD po dobu vakcinace. Sporadické studie ukazují příznivý vliv na průběh AD s použitím vakcíny – alergoidu roztočů domácího prachu. Při častých interkurentních či fokálních infekcích či torpidním průběhu s bakteriální kolonizací kůže mají smysl bakteriální preparáty např. Biostim, Luivac, Bronchovaxom, Ribomunyl nebo isoprinosine či autovakcíny k posílení slizniční a kožní imunity.
Antivirotika mají smysl u hrozícího či vzniklého eczema herpeticatum. Infekce virem HSV se u pacientů s atopií vyskytuje častěji, rizikoví jsou pacienti s vysokým IgE a časným vznikem AD v anamnéze. Tato infekce je pro ně vysloveně riziková. Proto je včasná léčba celkovými antivirotiky jednoznačně indikována; nejčastěji se používá aciklovir v dávce 5krát 200 mg po 5–10 dnů.
Antimykotika – v odborné literatuře jsou popsány případy (14) úspěšného zvratu v nepříznivém průběhu chronické těžké AD hlavy a krku u pacientů s kolonizací kvasinkami po léčbě celkovými antimykotiky a antibiotiky. U řady pacientů byly též prokázány specifické IgE proti kvasinkám rodu Pityrosporon (Malassezia).
Imunosupresiva. V těžkých, refrakterních případech, kde lokální léčba ani v kombinaci s fototerapií nevede k efektu, je k dispozici celková imunosupresivní léčba. Je zatížena výraznými nežádoucími účinky, především dlouhodobými, a proto je před jejím zavedením třeba pečlivě zvážit poměr rizik léčby ku prospěchu pro pacienta. Nezbytná je z těchto důvodů spolupráce pacienta, jak z hlediska pravidelného užívání imunosupresiva, docházení na laboratorní a klinické kontroly, tak z hlediska dodržování prevence a lokální léčby, které jsou pro efekt léčby a dlouhodobou stabilizaci nutné. Je logické, že po vynechání imunosupresiv dojde k exacerbaci choroby – u velmi těžké AD je choroba tak aktivní, že jakmile přestane působit tlumivý vliv léku, znovu se projeví, což je vhodné pacientům zdůraznit. Optimální by byl lék ke kontinuálnímu používání, ale takový zatím není k dispozici. Léčba je zde skutečně individualizovaná, protože nejsou univerzální postupy či dávky, které by byly stejně účinné u všech pacientů. Dlouhodobou léčbu by měl vést zkušený dermatolog, resp. imunolog ve spolupráci s dermatologem – z důvodů zkušenosti s imunosupresivy a jejich kombinacemi či kombinacemi s jinými léky, které nejsou dermatologům dostupné, např. s inhibitory či antagonisty leukotrienů (zileuton, montelukast, zafirlukast, pranlukast). A také proto, že tito pacienti s velmi těžkou AD mívají obvykle i výraznou polyvalentní alergii, vysoké hodnoty celkových IgE a nezřídka i známky automunity, což vyžaduje alergoimunologické zohlednění při vedení léčby.
K lékům první linie v systémové léčbě se řadí kortikoidy a cyklosporin A, do druhé linie jsou řazeny azathioprin, methotrexát a 311 nm UVB (fototerapie je řazena v posledních letech k metodám systémové léčby) (9).
Celkové kortikoidy byly dříve často používány, a to i v dlouhodobých režimech. V současnosti se vzhledem k jejich nežádoucím účinkům považují za léky pouze „záchranné“, k akutnímu zklidnění a zcela nevhodné pro dlouhodobé použití, resp. udržovací léčbu u AD (1). Také farmakologické nežádoucí účinky, jako jsou rebound fenomén, tachyfylaxe a kortikoidní adikce, hovoří jednoznačně proti dlouhodobé léčbě celkovými kortikoidy. Dosud jsou bohužel, v dermatologických praxích více užívanými léky než cyklosporin A. Tam, kde potřebujeme jen krátkodobý náraz, lze použít např. hydrokortison 100–200 mg (Hydrokortison solub.) nebo metylprednisolon (medrol inj.) i. m. K překlenutí jinak nezvládnutelné akutní exacerbace s cílem delšího efektu volíme depotní preparáty, např. betamethason dipropionát (Diprophos inj.) i. m. – množství betametasonu v 1 ampuli odpovídá cca 55 mg prednisonu. Efekt je promptní a výrazný. Vzhledem k farmakokinetice, resp. vylučování z oběhu „vydrží“ supresivní efekt u velmi těžké AD cca dva týdny, proto je třeba mít připravený léčebný plán (např. sekvenčně přechod na fototerapii nebo cyklosporin A). A také poučit pacienta, aby nepolevoval v prevenci a dodržování lokální léčby, protože průběh po parenterální aplikaci kortikoidů lze přirovnat příslovím „rychle nabyl, rychle pozbyl“. V ostatních případech může ale tento puls navodit příznivý zvrat v průběhu onemocnění a lze pokračovat pouze lokální léčbou. Při perorálním podání se obvykle volí střední dávky, odpovídající 40 až 60 mg prednisonu/den, respektive 1 mg/kg/den p.o. Rychlé jednoměsíční schéma po 5 dnech snižuje dávku z 60 mg/den na 40 mg/den a po dalších 5 dnech na 20 mg/den. Pak se dávkuje 20 mg ob den a po týdnu se vynechá (7). Při snižování se současně pokračuje s lokálními kortikoidy či imunomodulátory a zintenzivňuje se používání emoliencií, aby se předešlo rebound fenoménu po vysazení celkových kortikoidů. Za hospitalizace lze použít i bolusové podání metylprednisolonu i.v. k úvodní léčbě analogicky jako se provádí např. při zahájení léčby pemfigu. U velmi těžké AD, kde je obecně třeba dlouhodobé celkové léčby ke zvládání choroby, lze použít kortikoidy sekvenčně, tj. v kombinaci s jinými imunosupresivními či imunomodulačními léky s cílem postupného úplného vynechání kortikoidů.
Imunosupresivem, které je lékem první volby v celkové léčbě AD, je v současnosti cyklosporin A (Sandimmun Neoral, Consupren, Equoral) – makrolid působící inhibici kalcineurinu, což vede k relativně selektivnímu potlačení aktivace T-lymfocytů (bez negativního vlivu na hematopoezu). Je třeba pečlivě zvážit poměr prospěchu k bezpečnosti, neboť je kumulativně nefrotoxický a je spojen s rizikem vzniku hypertenze, infekcí a malignit. Nicméně pro dlouhodobější léčbu je relativně bezpečnější než celkové KS. Je možné jej použít od tří let, výjimečně již od jednoho roku věku (9). Obvyklá počáteční dávka je 3–5 mg/kg/den, rozdělená do dvou dávek, užívaných před jídlem. Někteří autoři doporučují začínat rovnou maximální dávkou 5 mg/kg/den a pak snižovat, jiní postupně po dvou týdnech zvyšovat. Z dosavadních zkušeností se ale ukazuje, že u řady pacientů lze s úspěchem používat dávkování nezávislé na váze. Je třeba ale dodat, že na rozdíl např. od psoriázy je zde obecně třeba vyšších dávek (v literatuře popsáno až 7 mg/kg/den) a že odezva je individuální. Po dosažení stabilizace či zhojení projevů se dávka titruje, snižuje po 1 mg/kg/den měsíčně na nejnižší účinnou dávku. Naopak při malém účinku se dávka obdobně zvyšuje a pokud nenastane efekt do 3 měsíců, nemá smysl v léčbě dále pokračovat. Celková doba podávání by v kontinuálním režimu neměla přesáhnout 1–2 roky, obvykle se ale doporučují intermitentní schémata. Relapsy do 2–6 týdnů po ukončení léčby jsou pravidlem, rebound fenomén však nastává minimálně a výhodou je, že po opakovaném podání bývá klinická odpověď stejně dobrá. Zajímavý je též fakt, že po opakovaných cyklech dochází k příznivému ovlivnění dlouhodobého průběhu. Lék je z hlediska krátkodobých nežádoucích účinků dobře snášen, nejčastěji to bývají bolesti hlavy, event. kloubů a svalů, parestézie a někdy hypertrichóza. Děti kupodivu snášejí lék lépe než dospělí (9). Ohledně dalších informací o CsA odkazuji na dermatologickou literaturu.
Z dalších celkových léků je to azathioprin (Azamun), purinový analog s protizánětlivými, imunosupresivními a antiprolifračními účinky na všechny rychle se obnovující buněčné populace (cytostatické účinky). Používá se u AD v denní dávce 2,5–3,5 mg/kg, resp. průměrně 100 mg/den. Pro potenciál myelosuprese (u dětí až od 5 let) se začíná podávat v třetinové dávce, která se zvyšuje po 3–4 týdnech (pokud není vyloučena mutace thiopurin metyltransferázy – TPMT). U osob bez mutace lze léčbu zahájit s plnou dávkou (9). Proto je před použitím léku nutné provést její stanovení v erytrocytech. Užívá se u AD velmi řídce, nejvíce referencí a zkušeností je z Velké Británie, kde ho používá až polovina dermatologů (7). Má pomalejší nástup účinku, za 8–12 týdnů, a není vždy dobře tolerován. Monitoring se týká především potenciální myelotoxicity. K dalším nežádoucím účinkům patří nauzea a epigastrická bolest, dále někdy hypersenzitivita (pyrexie, myalgie – obtížné odlišení od chřipky), hepatopatie (u dětí málo), imunosuprese (málo) – ale je nutná edukace rodičů v tomto směru: u kontaktu s virem VZV je třeba podat specifický protizosterový imunoglobulin, odložit očkování, při infekci oparem a molusky nedávat. Mutagenita či riziko malignit se objevuje u osob nad 60 let věku a při léčbě delší než10 let. Používá se hlavně v případech, kde snižování dávky cyklosporinu A vede k exacerbaci, tj. sekvenčně se z cyklosporinu A přechází na azathioprin. U dospívajících pacientů s AD s vysokými hladinami IgE lze tento lék použít i jako první linii. Doba léčby a titrace na nižší účinné dávky je obdobná jako u všech imunosupresiv u AD, tedy maximálně 1–2 roky. Remise či stabilizace bývá u 60 % pacientů ještě jeden rok po skončení sedmiměsíční léčby (prof. Atherton – 22). V ČR tento lék není pro léčbu AD registrován.
Dále je to methotrexát (Methotrexat), antimetabolit kyseliny listové – inhibitor dihydrofolát reduktázy s antiproliferativními, ale především účinky imunomodulačními, resp. protizánětlivými. Na rozdíl od psoriázy není dávkování 1krát týdně účinné, proto se používá v dělené (dividované) dávce 4krát týdně 2,5 mg. Efekt nastupuje během tří měsíců, obvykle mezi 4.–8. týdnem a udává se 50–70 % zlepšení (15). Efekt sice není tak markantní jako u cyklosporinu A a azathioprinu, zato má ale methotrexát lepší dlouhodobý bezpečnostní profil. Je tedy v pořadí na třetím místě z hlediska volby celkové léčby. Ke stabilizaci dochází po 3–6 měsících, pak se lze pokusit o snižování dávky (9). K nejčastějším nežádoucím účinkům patří hematologické a gastrointestinální. Také u AD se doporučuje suplementace kyseliny listové v dávce 5 mg týdně, a to v den mimo užívání methotrexátu. Co se týče dalších informací o léčbě methotrexátem odkazuji na příslušnou dermatologickou literaturu. Podobně jako u kortikoidů je jeho podávání u AD formálně možné, protože jeho indikace jsou charakterizovány obecně, ne výčtem diagnóz.
Mykofenolát mofetil (Cellcept) je inhibitor syntézy purinů, inhibuje proliferaci lymfocytů T a B. Používá se v transplantační medicíně. Reference o jeho použití u AD jsou zatím kazuistického charakteru a jeho reálný klinický profil se musí ověřit v klinických studiích. Připadá v úvahu u těch případů, kde selhaly léky první volby (cyklosporin A či kortikosteroidy). Doporučovaná dávka je 30 až 50 mg/kg/den, obvykle tedy 2 g/den. Má o něco lepší bezpečnostní profil než cyklosporin A. Nejčastější nežádoucí účinky jsou gastrointestinální a jako u všech imunosupresiv je to potenciální kancerogenita. V ČR tento lék není pro léčbu AD registrován (7, 12).
U chronických, hyperkeratotických, palmoplantárních AD se mohou s prospěchem použít i retinoidy, respektive acitretin (Neotigason). A to v relativně nízkých dávkách 10–20 mg/den na dobu 1–2 měsíců. V těchto případech je to bezpečnější varianta než užití systémových KS (5).
K dalším méně obvyklým lékům patří: antimalarika, inhibitory fosfodiesterázy pentoxifylin a theofylin nebo imunomodulační thymopentin. Výzkumně se zkouší celkově pimekrolimus i takrolimus, které jsou spíše imunomodulační než imunosupresivní. Zajímavé jsou též i. v. imunoglobuliny, tzv. IVIG terapie, používaná v jiných oblastech medicíny k léčbě autoimunitních a systémových zánětlivých chorob. Mechanismy účinku nejsou přesně známé. Podle současných poznatků se zdá, že protizánětlivé účinky má jen část molekuly IgG, a to tzv. sialyzované Fc fragmenty. A tak by takováto rekombinovaná léčiva zamezila podávání jednak velkého objemu imunoglobulinu a jednak by odpadly problémy s variabilitiou mezi jednotlivými preparáty a jejich šaržemi. Jedno balení může totiž obsahovat imunoglobuliny až od 20 000 dárců. V současnosti jsou ve fázi I. klinických studií (20). Účinky IVIG terapie nastupují jednak do několika dnů (rychlé), jednak v horizontu dvou až čtyřech měsíců (pozdní) a přetrvávají i po ukončení léčby. Z odborné literatury jsou příznivé reference spíše při použití v kombinované léčbě než jako monoterapie (19).
Výzkum a vývoj
V různé fázi uvedení na trh či výzkumu jsou i další léčiva pro léčbu AD – selektivní agonisté glukokortikoidních receptorů (SEGRA) – tedy kortikoidy bez atrofogenního potenciálu (klinické studie III. fáze se očekávají v roce 2014). Dále pak agonisté PPAR receptorů jako nesteroidní protizánětlivá léčiva, inhibitory fosfodiesterázy a inhibitory kožních proteáz, stimulátory exprese filagrinu a dokonce i vitamin D (lokální i celkové podání ve studiích vedlo ke zvýšení antimikrobiálních peptidů v kůži). Významný bude též vývoj antimikrobiálních peptidů nejen pro AD a protistafylokokovou léčbu, ale pro protinfekční léčbu v celé medicíně vzhledem ke stoupající rezistenci na antibiotika. Také sofistikovanější a komfortnější emoliencia by mohla výrazně přispět k novým lokálním léčivům.
Z celkových léků jsou potenciálními na chronické palmoplantární hyperkeratotické formy AD retinoidy (alitretinoin, již výsledky klinických studií III. fáze). A dále i biologika – interferon γ, monoklonální protilátky proti IgE (omalizumab), IL - 5 (mepolizumab), IL-13 (unrakinzumab) a další antagonisté cytokinů jako basiliximab (anti IL-2R). Reference o jejich použití, včetně biologik známých z léčby psoriázy (efalizumab a alefacept proti T-lymfocytům a antagonisté TNF infliximab, etanercept, adalimumab) jsou opět pouze kazuistického rázu s různými výsledky (36). Protilátka proti povrchové molekule CD 30 B lymfocytů – rituximab se jevila jako perspektivní, ale podle nejnovějších poznatků není v této indikaci dostatečně účinný. Potenciální jsou i biologika proti IL-4, IL-17, IL-31 a TSLP.
Závěr
Ke dlouhodobému zvládání atopické dermatitidy patří prevence včetně režimových opatření, pravidelná a individualizovaná péče o kůži (bariéru), snížení mikrobiální kolonizace kůže a sliznic a tlumení zánětu správným používáním lokálních kortikoidů či imunomodulátorů. U mírné AD má tato léčba charakter reaktivní – aktivní léčba už vzniklých exacerbací, zatímco u středně těžké a těžké AD má charakter proaktivní – včasná léčba při prvních příznacích, ale také i dlouhodobá udržovací léčba s cílem účinného a kontinuálního potlačení zánětu a kolonizace zlatým stafylokokem. AD je sice chronická choroba a nelze odstranit její příčinu, ale je naštěstí nemocí léčitelnou, kde můžeme dosáhnout zhojení či zmírnění aktuálních příznaků, a tak bránit i progresi do budoucna.
Atopická dermatitida představuje často crux medicorum, ale současně je i výzvou. Základní i klinický výzkum přináší mnoho poznatků z oblasti genetiky, imunologie, molekulární biologie. Avšak ani ta nejmodernější léčiva nemohou atopický proces zvládnout, pokud v dostatečné intenzitě působí provokační faktory anebo vázne compliance pacienta. A tak se v posledních letech napříč medicínskými obory zdůrazňuje psychosomatický přístup k nemocnému. V běžně denní praxi to v nejelementárnější podobě znamená vytvářet partnerský vztah mezi lékařem a pacientem, vybudovat vzájemnou důvěru, edukovat o povaze choroby a ujistit pacienta o lékařově podpoře do budoucnosti (tab. 8). Na takovém základě lze rozvíjet pacientovu zodpovědnost za vlastní zdraví, a tak i jeho compliance. Tyto staronové zásady starých praktiků by i přes velký pokrok ve farmakoterapii měly zůstat standardní, rutinní součástí péče o nemocné s atopickou dermatitidou.
Table 8. Nejčastější chyby ze strany pacienta a lékaře při léčbě AD 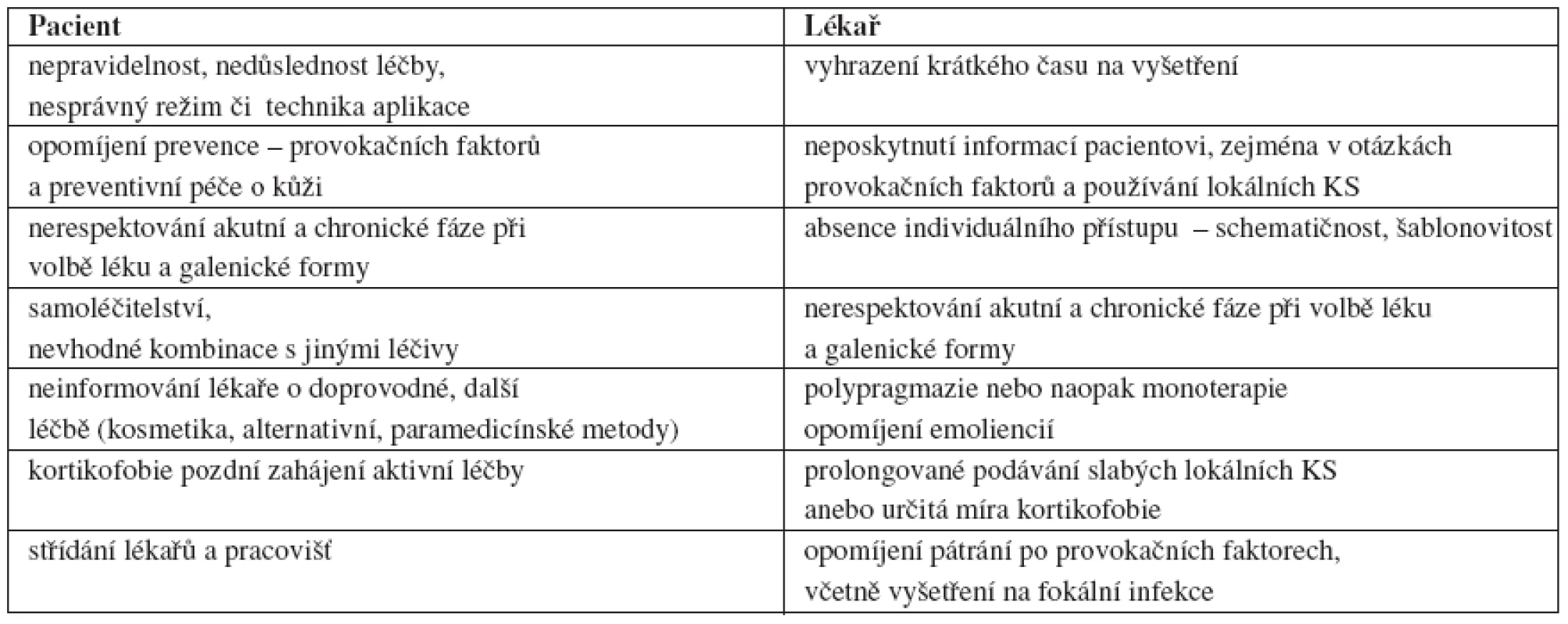
Došlo do redakce: 30. 1. 2009
MUDr. Nina Benáková
Dermatoalergologická ordinace
Karlovo nám. 7
120 00 Praha 2
E-mail: nina.benakova@email.cz
Sources
1. ABRAMOWITS, W. A clinician paradigm in the tratment of atopic dermatitis. Am Acad Dermatol, 2005, 53, S 70-76.
2. BACHEET, C., ZHANG, N., PATOU, J. et al: Role of staphylococcal superantigens in upper airway disease. Curr Opin Allergy Clin Immunol, 2008, 8, p. 34-38
3. BARCLAY, L. Guidleines for treating atopic eczema in children. Medcsape Continual medical Education, April 2008, www. medscape.com
4. BELTRANI, VS. The clinical spectrum of atopic dermatitis. J Allergy Clin Immunol, 1999, 104 (3), S 87-S 98.
5. BENÁKOVÁ, N.: Ekzémy a dermatitidy. Praha: Maxdorf, 2006, 125 s.
6. BENÁKOVÁ, N. Léčba atopické dermatitidy/ekzému u dospělých. Interní Med, 2007, 5, p. 240 – 246.
7. BIEBER, T. LEUNG DYM. (ed.) Atopic dermatitis. New York: Dekker, 2002, 633 p.
8. BIEBER, T. Mechanism of disease: atopic dermatitis. N Eng J Med, 2008, 358 (14), p.1483-1495
9. BORCHARD, KLA., Orchard, D. Systemic therapy of paediatric atopic dermatitis: an update. Australas J Dermatol, 2008, 49, p. 125-136.
10. CARDONA, ID., CHO, SH., LEUNG DYM. Role of bacterial superantigens in atopic dermatitis. Am J Clin Dermatol, 2006, 7 (5), p. 273-279.
11. CORK, MC., ROBINSON, DA., VASILOPOULOS, Y. et al. New perspectives on epidemal barrier dysfunction in atopic dermatitis: gene – enviroment interactions. J Allergy Clin Immunol, 2006,118 (1), p. 3-20.
12. ČAPKOVÁ, Š. Léčba atopické dermatitidy v roce 2008. Farmakoterapie, 2008, Suppl. 3, p. 22-31.
13. ČAPKOVÁ, Š.: Současné možnosti léčby atopické dermatitidy v dětském věku a poučení rodičů. Referátový výběr z dermatovenerologie, 2004, 46, (S1), p. 5-12.
14. DI CARLO, JB., MCCALL, CO. Pharmacologic alternatives for severe atopic dermatitis. Int J Dermatol, 2001, 40, p. 82-88.
15. GOUJON, C., BÉRARD, F., DAHEL, K. et al. Methotrexate for the treatment of adult atopic dermatitis. Eur J Dermatol, 2006, 16 (2), p. 155-158.
16. HOLOBRADÁ, M: Komplexná liečba atopickej dermatitidy. Derma, 2006, 4, p. 11-15.
17. CHISOLM, SS. Written action plans: potential for improving outcomes in childrem with atopic dermatitis. JAAD, 2008, 59 (4), p. 677-683.
18. CHRISTOPHERS, E., FOLSTER-HOSTZ, R. Atopic versus infantile eczema. J Am Acad Dermatol, 2001, 45, p. 4-6.
19. CHROMEJ, I. Atopický ekzém. Dali Banská Bystrica 2007, 240 p.
20. KAVERI, SV., LACROIX-DESMAZES, S., BAYRY, J. The antiinflammatory IgG. N Eng J Med, 2008, 359 (3), p.307-309.
21. KLUBAL, R. (koordinátor) et al. Workshop on atopic dermatitis. Praha 26. - 28. 4. 2006.
22. KLUBAL, R. (koordinátor) et al. Workshop on atopic dermatitis. Praha 25.-27.5. 2007.
23. LEVIN, C., WARSHAW, E. Protein contact dermatitis: allergens, pathogenesis and management. Dermatitis, 2008, 19 (5), p. 241-251.
24. MACHOVCOVÁ, A. Péče o kůži v dětském věku. Příloha Pediatrie pro praxi 2006, 7, 50 s.
25. MOHRENSCHLAGER, M., DARSOW, U., SCHNOPP, C. et al. Atopic eczema: what is new ? JEADV, 2006, 20, p. 503-511.
26. OFLAZOGLU, E., SIMPSON, EL., TAKIGUCHI, R et al: CD 40 expression of antigen presenting cells and correlation with disease severIty in atopic dermatitis. Eur J Dermatol, 2008, 18 (5), p. 527-533.
27. OLESEN, AB. Atopic dermatitis - has the epidemic stopped or just begun ? EADV Congress news, 2006, p. 4.
28. PÁNKOVÁ, R. Psychosociální souvislosti atopické dermatitidy. Referátový výběr, 2008, 50, (S II), p. 37-40.
29. POLÁŠKOVÁ, S. Proč může selhat léčba u dětí s atopickou dermatitidou. Farmakoterapie, 2008, Suppl. 3, p.32-35.
30. PÓNAYAI, G., HIDVÉGI, B., NÉMETH, I et al. Contact and aeroallergens in adulthood atopic dermatitis. JEADV, 2008, 22, p.1346-1355.
31. SANDILANDIS, A. et al. Prevalent and rare mutations in gene encoding filaggrin cause ichthyosis vulgaris and predispose individuals to atopic dermatitis. J Invest Dermatol, 2006, 126, p. 1770-1775.
32. SCHMIEDBERGEROVÁ, R. Eczema atopicum. Pediatrie pro praxi, 2005, 4, p. 145-150.
33. THESTRUP - PEDERSEN, K. Atopic eczema – new insights in definition, diagnostics and disease management. Acta Derm Venereol, 2005, Suppl. 215, p. 7-48.
34. WILIAMS, H., FLOHR, C. How epidemiology has changed 3 prevailing concepts about atopic dermatitis. J Allergy Clin Immunol, 2006, 118 (1), p. 209-213.
35. ZÁHEJSKÝ, J.: Zevní dermatologická terapie a kosmetika. Praha: Grada, 2006, 140 s.
36. Kolektiv autorů: Atopic dermatitis: current approaches and future treatment options. Dermatology News, 2007, 9, p. 1-4.
Doporučená literatura pro pacienty:
• Čapková Š., Špičák V., Vosmík F.: Atopický ekzém. Praha : Makropulos, 2005, 138 s.
• Fuchs: Alergie číhá v jídle a pití. Praha: nakl. Adéla, 2005, 189 s.
• doporučení pro pacienty na stránkách České společnosti klinické alergologie a imunologie a České iniciativy pro astma: www. csaki. cz , www. cipa. cz
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2009 Issue 2-
All articles in this issue
- Atopická dermatitida v roce 2009
- Konzervanty uvolňující formaldehyd jako příčina profesionálních ekzémů u obráběčů kovů
- Využití oxidované celulózy v terapii chronických ulcerací cévního původu – výsledky klinické studie
- Precitlivenosť na nikel – stále aktuálny problém
- Difúzna reflexná spektrofotometria I. Spektrofotometer a technické prevedenie
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difúzna reflexná spektrofotometria I. Spektrofotometer a technické prevedenie
- Atopická dermatitida v roce 2009
- Konzervanty uvolňující formaldehyd jako příčina profesionálních ekzémů u obráběčů kovů
- Precitlivenosť na nikel – stále aktuálny problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

