-
Medical journals
- Career
Ranní a večerní chronotypy u revmatoidní artritidy
Authors: V. Kutal
Authors‘ workplace: Revmatologická ambulance, Brno
Published in: Čes. Revmatol., 21, 2013, No. 2, p. 81-85.
Category: Original Papers
Overview
Příslušnost k ranním, neutrálním nebo večerním chronotypům (diurnální preference) patří k důležitým charakteristikám jedince a je spojena i s kvantitativními a časovými změnami sekrece kortizolu, IL6 a melatoninu, které hrají významnou roli v průběhu a možná i vzniku revmatoidní artritidy. Autor proto sledoval, zda se diurnální preference projeví v prevalenci revmatoidní artritidy. Ve sledovaném souboru 154 pacientů s revmatoidní artritidou bylo nalezeno 59,1 % ranních, 35,1 % neutrálních a 5,8 % večerních typů. Kontrolní soubor tvořilo 70 osob bez zánětlivého revmatického onemocnění a bylo zjištěno 37,1 % ranních, 50,0 % neutrálních a 12,9 % večerních typů. Větší podíl ranních typů pacientů s revmatoidní artritidou je statisticky významný (t < 0,05). Možným vysvětlením preference ranních typů u revmatoidní artritidy jsou odlišné poměry v časování sekrece kortizolu, cytokinů a melatoninu u jednotlivých chronotypů.
Klíčová slova:
Revmatoidní artritida, chronobiologické rytmy, cytokiny, melatonin, zánětlivá aktivitaÚvod
Převážná část pozornosti se v medicíně věnuje prostorovému uspořádání živých organismů, ale často je opomíjen časový faktor, i když naprostá většina fyziologických procesů v živých organismech probíhá cyklicky v čase. Jedná se v naprosté většině o cirkadiánní rytmy (s periodou 24 hodin), které známe i z vlastní zkušenosti, jako je cirkadiánní rytmus bdění a spánku, tělesné teploty i krevního tlaku, v revmatologii jako denní průběh revmatoidní artritidy (RA). Cirkadiánní rytmus ranní ztuhlosti se stal dokonce jedním z diagnostických kritérií RA.
Cyklické projevy aktivity RA jsou projevem cyklického uvolňování řady mediátorů do vnitřního prostředí. Mediátory můžeme v zásadě rozlišit na prozánětlivé a protizánětlivé. Hlavním protizánětlivým mediátorem je kortizol (KZ) jako konečný produkt osy hypotalamus-hypofýza-nadledvina (HHN). Do prozánětlivých mediátorů můžeme zahrnout hlavně prozánětlivé cytokiny (IL1, TNF alfa a IL6), ale i melatonin (MLT). MLT je produkován epifýzou převážně v noční době, je silným synchronizátorem mnoha fyziologických procesů a má hluboký dopad na vnitřní prostředí organismu. Synchronizuje organismus s vnějším cyklem dne a noci, synchronizuje, zapíná a vypíná i centrální a periferní hodinové geny (1) a tím např. i cirkadiánní syntézu cytokinů a KZ. MLT může aktivovat zánětlivou odpověď v mnoha rovinách a jeho výsledný efekt je prozánětlivý. Mimo synchronizační funkce hraje MLT i důležitou roli v oblasti imunity. Váže se na receptory některých T lymfocytů a zasahuje tak do tvorby cytokinů, např. stimuluje produkci IL1, IL2, IL6 (2,3), může ovlivňovat expresi glukokortikoidních receptorů a tak se podílet na glukokortikoidní rezistenci (3). Bylo zjištěno, že pacienti s RA mají signifikantně vyšší koncentraci MLT než zdravé osoby a odlišují se i jiným časovým průběhem sekrece (3,4). U pacientů s RA nastupuje maximum sekrece MLT o 2 hodiny dříve a má asi 2 hodiny trvající plato, což u zdravých osob nepozorujeme a jeho koncentrace následně klesá pomaleji. U zdravých osob dosahuje MLT své maximální koncentrace kolem 1. hodiny ráno, zatím co KZ kolem 6. hodiny ráno. IL1, TNF alfa a IL6 dosahují svého maxima mezi 1.–4. hodinou ranní, kdy je ale současně nízká koncentrace KZ (2). IL6, IL a TNF alfa však stimulují osu HHN s výsledkem zvýšení sekrece KZ, který kompenzuje jejich prozánětlivý efekt. Tento vzorec časování sekrece cytokinů, MLT a KZ je kromě kvantitativních poměrů velmi důležitý k udržení rovnovážného stavu.
Pokud je však z nějakých důvodů rovnováha porušena ve prospěch prozánětlivých mediátorů, může vzniknout imunopatologický stav. K poruše však může dojít nejenom kvantitativními změnami sekrece mediátorů, ale i poruchou časování jejich sekrece.
V souhlase s průběhem uvolňování jednotlivých mediátorů probíhají i klinické známky aktivity RA. Zánětlivá aktivita RA významně koreluje s nadledvinovou sekrecí KZ. Ve stavu zvýšené zánětlivé aktivity je však sekrece KZ u pacientů s RA v ranních hodinách kvantitativně nižší než pro danou situaci nutná a není proto schopna potlačit podstatně zvýšenou sekreci cytokinů a MLT. Osa HHN je tedy u pacientů s RA minimálně relativně insuficientní. Kvantitativně dostatečná časově koordinovaná sekrece KZ je tedy zásadní pro potlačení efektu prozánětlivých cytokinů.
K významným osobním charakteristikám jedince patří jeho diurnální preference, tj. příslušnost k ranním, neutrálním nebo večerním chronotypům. Ta může být i příčinou odlišnosti průběhu mnoha biologických cyklů včetně časování sekrece MLT a KZ (5, 6) a je dána z větší části geneticky (7, 8).
U ranních typů udávají někteří autoři vyšší ranní sekreci KZ (9, 10, 11) oproti typům večerním. Sekrece KZ u ranních typů nastupuje asi o 55 minut dříve než u typů večerních a jeho koncentrace je u večerních typů i lehce nižší a je tedy pravděpodobné, že diurnální preference je příčinou interindividuální variability sekrece KZ. Rovněž sekrece MLT začíná u ranních typů časněji než u večerních typů (12). Jak již bylo zmíněno, je dostatečný ranní vzestup koncentrace KZ a jeho optimální časování důležitým faktorem k potlačení zánětlivé aktivity RA. Pokud tedy mají ranní typy skutečně zvýšenou ranní sekreci KZ, mohly by být ve srovnání s typy večerními i odolnější ke vzniku RA. Cílem práce bylo ověření tohoto předpokladu. V literatuře nebyla nalezena zpráva o práci se stejným zaměřením.
Soubor a metodika
Příslušnost k jednotlivým chronotypům je běžně hodnocena dotazníkem Horna a Ostberga (13). Jeho český překlad ověřil Skočovský (5) na souboru 133 osob (tab. 1), ve kterém se vyskytovalo 35,3 % ranních typů, 50,4 % neutrálních typů a 14,3 % večerních typů. Dotazník se skládá z celkem 19 souborů otázek, které jsou bodově hodnoceny. Výsledné skóre zařadí sledovanou osobu do příslušného chronotypu. Ranní typy: skóre 59–86, neutrální typy: skóre 43–58, večerní typy: skóre 16–42.
Table 1. Hodnoty sledovaného a kontrolního souboru a jejich statistické hodnocení. Připojeny údaje souboru z práce Skočovského (5). 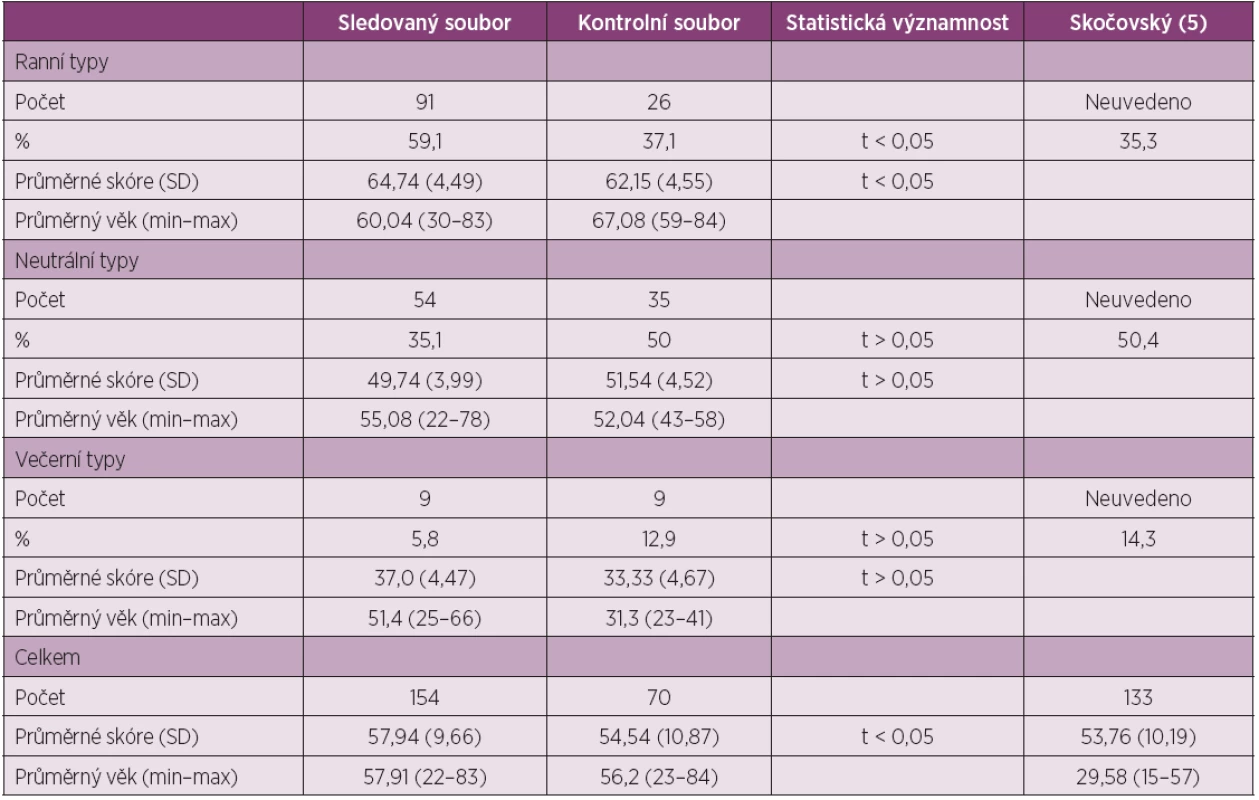
Statistické hodnocení bylo provedeno prostřednictvím programu Exel a podle potřeby doplněno manuálními výpočty (Studentův t-test) (14).
Sledovaný soubor tvořilo 154 pacientů s RA, kteří splňovali kritéria ACR z roku 1988, kontrolní soubor tvořilo 70 osob bez prokazatelných zánětlivých revmatických onemocnění.
Výsledky
Sledovaný soubor tvořilo 154 náhodně vybraných pacientů s RA, kteří splňovali kritéria ACR z roku 1988, z toho 124 žen a 30 mužů (tab. 1). Bylo zjištěno celkem 91 (59,1 %) ranních typů, 54 (35,1 %) neutrálních typů a 9 (5,8 %) večerních typů. Ve sledovaném souboru bylo 68 séronegativních a 86 séropozitivních pacientů. Ve skupině séronegativních pacientů bylo nalezeno 34 (50,0 %) ranních typů, 32 (47,1 %) neutrálních typů a 2 (2,9 %) večerních typů průměrného věku 58,32 (22–83) roků. Ve skupině séropozitivních pacientů 54 (62,8 %) ranních typů, 26 (30,2 %) neutrálních typů a 6 (7,0 %) večerních typů průměrného věku 57,9 (25–78). Rozdíly mezi oběma skupinami nejsou statisticky významné, i když preference ranních typů u séropozitivní skupiny je zřejmá.
Kontrolní soubor tvořilo 70 osob. Zjištěno bylo 26 (37,1 %) ranních typů, 35 (50,0 %) neutrálních typů a 9 (12,9 %) večerních typů. Statisticky významný rozdíl (t < 0,05) byl nalezen mezi ranními typy ve sledovaném a kontrolním souboru, ve srovnání ostatních souborů nebyly zjištěny statisticky významné rozdíly. V tabulce jsou pro srovnání uvedeny i výsledky práce Skočovského (5). V námi sledovaných souborech byl zjištěn vzestup preferencí ranních typů se stoupajícím věkem, ale ne statisticky významný. Stejně jako Skočovský (5) jsme nezjistili žádné statisticky významné rozdíly mezi ženami a muži.
Diskuse
Proti původnímu předpokladu je prevalence RA vyšší u ranních typů, přestože jejich ranní sekrece KZ je vyšší než u typů večerních.
Patrně tedy existují i jiné faktory než kvantitativní, které také tento výsledek ovlivňují. Jedním z důležitých bude jistě i časování sekrece (timing) jednotlivých mediátorů tohoto složitého systému. Cutolo a spol. (2) udávají časový průběh průměrné hodnoty sekrece KZ, MLT a IL6 zjištěných na souboru 12 zdravých mužů. Maximum průměrné koncentrace dosahuje MLT kolem 1. hodiny ranní, IL6 kolem 2. hodiny ranní a KZ kolem 6. hodiny ranní, jak schematicky ukazuje graf sestrojený s použitím dat z této práce.
Graph 1. Schematické znázornění sekrece mediátorů zánětu – průměrné hodnoty ze souboru 12 zdravých mužů (upraveno podle Cutolo a spol. [2]). ![Schematické znázornění sekrece mediátorů zánětu – průměrné hodnoty ze souboru 12 zdravých mužů (upraveno podle Cutolo a spol. [2]).](https://pl-master.mdcdn.cz/media/image/13a9be19a2d4c72d612f172aaaab00ec.png?version=1537792517)
Sekrece sledovaných mediátorů i jejich časování je však přísně individuální, jak vyplývá z práce Perryho a spol. (15) a proto průměrné hodnoty mají jen omezenou vypovídající hodnotu. Autoři hodnotili soubor 16 pacientů (z toho polovina žen) s poměrně aktivní RA (průměrné DAS 28 5,1), kteří nikdy neužívali kortikoidy.
Minimální průměrná koncentrace KZ v souboru zdravých osob byla zjištěna ve 22.00 hod. (8,6 ng/ml) a maximální hodnota v 5.45 hod. (56,9 ng/ml). V souboru zdravých osob se koncentrace IL6 v průběhu noci měnila velmi málo – minimální průměrná hodnota byla ve 21.0 hod. (15,3 pg/ml) a maximální v 8.0 hod. (19,7 pg/ml).
Minimální průměrná koncentrace KZ souboru pacientů s RA byla v 23.47 hod. (56,9 ng/ml) a maximální koncentrace v 8.28 hod. (228,7 ng/ml). U téhož souboru byla minimální koncentrace IL6 v 20.44 hod. (34,5 pg/ml) a maximální koncentrace v 7.46 hod. (64,4 pg/ml).
V celém sledovaném souboru pacientů s RA dosáhla průměrná koncentrace KZ maxima v 8.28 hod. a koncentrace IL6 v 7.49 hod., tj. asi o 40 minut dříve.
U 8 pacientů začala stoupat koncentrace IL6 před vzestupem koncentrace KZ (0,01–4,83 hod.), u 3 pacientů po vzestupu koncentrace KZ (1,11–5,14 hod.). U ostatních 5 pacientů byl čas sekrece IL6 a KZ přibližně stejný.
Byl zjištěn statisticky významný rozdíl mezi pacienty s nízkým a vysokým DAS 28. U pacientů s vysokým DAS 28 bylo maximum sekrece KZ v 7.38 hod. (225 ng/ml), zatímco u pacientů s nižším DAS 28 maximum v 10.06 hod. (247 ng/ml).
Srovnáme-li tedy hodnoty maxima sekrece KZ a IL6 udávaných výše uvedenými autory (2, 15), je zřejmé, že časový interval mezi sekrecí těchto mediátorů je delší u zdravých osob (přibližně 4 hodiny) než u osob s RA (přibližně 40 minut) a odlišuje se i podle aktivity choroby měřené DAS 28. Toto srovnání může naznačovat, že z hlediska vzniku imunopatologické poruchy je patrně výhodnější dosažení maxima sekrece KZ s dostatečným časovým odstupem po maximu sekrece IL6, kdy zkracující se interval nebo i jeho obrácení se může podílet na vzniku imunopatologické poruchy. Je tedy možné, že aktivita RA (i její vznik?) částečně souvisí s individuálními poměry sekrece jednotlivých mediátorů zánětu. Vzorec časování sekrece mediátorů zánětu je i přes vyšší ranní koncentraci KZ u ranních typů možná z tohoto pohledu méně výhodný než u typů večerních. K poruše může dojít nejenom kvantitativními změnami sekrece mediátorů zánětu, ale i desynchronizací jejich časování.
Velmi důležitou součástí tohoto systému je MLT (1, 4), jehož sekrece byla u pacientů s RA zjištěna zvýšená a jinak časovaná. Melatonin je fylogeneticky velmi starým mediátorem a sekrece ostatních mediátorů bude na něm závislá a může tedy i významně zasahovat do jejich synchronizace či desynchronizace.
Je tedy zřejmé, že cyklická sekrece jednotlivých mediátorů zánětu i jejich časování je individuální a liší se u jednotlivých chronotypů.
Je ovšem s podivem, že sekrece mediátorů je sice cyklická, ale cyklická není i terapie. Tento pohled však není nijak nový. O potřebě hledání optimálního času pro podání derivátů kortizolu se zmiňují i Dostál a spol. (16). Pro každého pacienta např. s RA nebo jinou imunopatologickou chorobou existuje pravděpodobně rozdílná optimální doba k podání kortikoidů a patrně i DMARDs i jiných léků. Takové pokusy byly již učiněny a bylo zjištěno, že podání kortikoidů v nočních hodinách má lepší efekt na snížení aktivity RA než běžné ranní podání (17, 18). Tento postup jsme zkoušeli i u několika pacientů v naší ambulanci. Podání části denní dávky kortikoidů ve 2 hodiny ráno mělo u některých nemocných výborný efekt na potlačení aktivity, u jiných však bylo zcela bez efektu nebo byl efekt krátkodobý. To lze i očekávat, protože u těchto pacientů patrně nebyla zvolena správná individuální doba podání.
To a spol. (19) zjistili při pokusech na myších, že k největšímu potlačení sekrece TNF alfa dojde při podání methotrexátu při začátku vzestupu jeho koncentrace v rámci cirkadiánního rytmu. Pokud tyto chronoterapeutické poznatky použili i v léčbě RA methotrexátem, zjistili, že maximálního potlačení známek aktivity bylo dosaženo při jeho podání v době ulehnutí ke spánku (at bedtime). Tato doba je velmi důležitá, neboť je z velké části vázána na počátek vzestupu sekrece MLT, která je přísně individuální a je i podstatně odlišná pro ranní i večerní chronotypy.
Přibližným vodítkem doby podání kortikoidů by mohlo být monitorování tělesné teploty v nočních hodinách, jejíž minimum je v určitém vztahu k sekreci jednotlivých mediátorů zánětu.
Byla již zmínka o významu MLT na synchronizaci sekrece mediátorů zánětu. Určitý krok tímto směrem naznačují některé práce v psychiatrii (20), kdy známky deprese u některých pacientů vykazují ranní maximum, což by mohlo naznačovat určitou vnitřní souvislost s diurnálním průběhem RA. Ukazuje se, že melatoninový agonista agomelatin je schopen převzít řízení cirkadiánní rytmicity a upravit desynchronizovaný cirkadiánní rytmus a tím příznivě ovlivnit průběh deprese. V léčbě RA se však MLT dosud neosvědčil, neboť jeho podání zvyšovalo produkci prozánětlivých cytokinů a zhoršovalo klinický stav (4). Byl však podáván bez ohledu na cirkadiánní rytmy.
Závěr
Výsledkem práce je zjištění, že u pacientů s RA je větší prevalence ranních chronotypů ve srovnání s nezánětlivými revmatickými chorobami i zdravou populací. Tento závěr bude nutné dále ověřit na větším souboru pacientů, neboť v literatuře neexistuje možnost srovnání s podobnou prací.
Pokud by se podařilo podrobně popsat chronobiologický podklad tohoto zjištění, mohlo by dojít k obohacení možností klasické léčby v revmatologii i v době fascinace biologickou léčbou.
Chronobiologické aspekty léčby nejsou dosud dostatečně využívány, i když jsou dlouho známy. Již jeden z největších geniů medicíny Paracelsus (21) velmi dobře věděl, že složení a dávka podaného léku jsou stejně důležité jako doba jeho podání ve vztahu ke kosmickým cyklům. Přeloženo do dnešní terminologie – ve vztahu k chronobiologickým zákonitostem biologických dějů.
Adresa pro korespondenci:
MUDr. Vladimír Kutal
Revmatologická ambulance
Zahradníkova 2/8
611 41 Brno
e-mail: vlakut@volny.cz
Sources
1. Illnerová H, Sumová A. Vnitřní časový systém. Interní Med 2008; 10 : 350-352.
2. Cutolo M, Seriolo B, Craviotto C, Pizzoini C, Sulli A. Circadian rythms in RA. Ann Rheum Dis 2003; 62 : 593-596.
3. Cutolo M, Maestroni GJM. The melatonin-cytokine connection in rhematoid arthritis. Ann Rheum Dis 2005; 64 : 1109-1111.
4. Cutolo M, Straub RH. Insights into endokrine-immunological distubances in autoimmunity and their impact on treatment. Arthritis Res Ther 2009; 11(2): 218.
5. Skočovský KD. Psychometrické vlastnosti české verze Dotazníku ranních a večerních typů (MEQ). In: Svoboda M, Humpolíček P, Humpolíčková J (Eds). Sociální procesy a osobnost. Brno: Psychologický ústav FF MU v Brně; 2003 : 260-267.
6. Skočovský KD. Chronopsychologie: Výzkum rytmicity v lidském chování a prožívání. Československá psychologie 2004; 48 : 69-83.
7. Koskenvuo M, Hublin C, Partinen M, Heikkila M, Kaprio J. Heritability of diurnal type: a nationwide study of 8753 adult twin pairs. J Sleep Res 2007; 16 : 156-162.
8. Paine SJ, Gander PH, Travier N. The epidemiology of morningness/eveningness: influence of age, gender, ethnicity and socioeconomic factors in adults (30-49 years). J Biol Rhytms 2006; 26 : 68-76.
9. Kudielka BM, Federenko IS, Hellhammer DH, Wüst S. Morningness and eveningness: The free cortisol rise after awakening in „early birds“ and „night owls“. Biopsych 2006; 72 : 141-146.
10. Scheer FA, Buijs RM. Light affects morning solivary cortisol in humans. J Clin Endocrinol Metab 1999; 84 : 3395-8.
11. Neeck G, Federlin K, Graef V, Rusch D, Schmidt KL. Adrenal secretion of cortisol in patients with rheumatoid arthritis. J Rheumatol 1990; 17 : 24-29.
12. Griefahn B. The validity of temporal parameters of the daily rythms of melatonin levels as an indicator of morningness. Chronobiol Int 2002; 19 : 561-577.
13. Horne JA, Ostberg O. A self-assessment questionnaire to determine morningness-eveningness in human circadian rhythms. J Clin Chronobiol 1976; 4 : 97-110.
14. Gerylovová A, Holčík J. Základy statistiky. Brno: Masarykova univerzita v Brně, lékařská fakulta; 1995.
15. Perry MG, Kirwan JR, Jessop DS, Hunt LP. Overnight variations in cortisol, interleukin 6, tumour necrosis factor o and other cytokines in people with rheumatoid arthritis. Ann Rhem Dis 2009; 68 : 63-68.
16. Dostál C, Hrnčíř Z. Glukokortikoidy. In: Pavelka K, Rovenský J. Klinická revmatologie. Praha: Galén; 2003 : 819-828.
17. Arvidson NG, Gudbjörnsson B, Larsson A, Hällgren R. The timing of glucocorticoid administration in rhemattoid arthritis. Ann Rheum Dis 1997; 56 : 17-31.
18. Westhovens R. The importance of chronotherapeutics in the treatment of rheumatoid arthritis. Eur Muskuloskeletal Rev 2010; 5 : 9-13.
19. To H, Yoshimatsu H, Tomonari M, Ida H, Tsurumoto T, Tsuji Y. Methotrexate Chronotherapy is Effective Against Rheumatoid Arthritis. Chronobiol In 2011; 28 : 267-274.
20. Höschl C. Chronobiologie a léčba deprese. VII. Slovenský psychiatrický zjazd; 2006 Jun 22-24; Jasná pod Chopkom, Slovensko.
21. Rippe O, Madejsky M, Amann A, Ochsner P, Rätsch Ch. Paracelsovo lékařství. Praha: Volvox globator; 2004.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2013 Issue 2-
All articles in this issue
- Doporučení České revmatologické společnosti pro diagnostiku a sledování nemocných se systémovým lupus erythematodes
- Průběh těhotenství u žen se systémovým lupus erythematodes
- Ranní a večerní chronotypy u revmatoidní artritidy
- Eozinofilní fasciitida
- Je ultrazvuk spolehlivým pomocníkem revmatologa?
- Co bychom měli vědět o diagnostických testech
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Průběh těhotenství u žen se systémovým lupus erythematodes
- Eozinofilní fasciitida
- Doporučení České revmatologické společnosti pro diagnostiku a sledování nemocných se systémovým lupus erythematodes
- Co bychom měli vědět o diagnostických testech
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

