-
Medical journals
- Career
Průběh těhotenství u žen se systémovým lupus erythematodes
: D. Tegzová; K. Andělová
: ÚPMD, Praha ; Revmatologický ústav, Praha
: Čes. Revmatol., 21, 2013, No. 2, p. 72-80.
: Original Papers
Průběh gravidity i laktace u pacientek se systémovým lupus erythematodes (SLE) je rizikový. Riziko vyplývá ze samotné choroby, její aktivity, orgánového postižení, dále léčby matky před koncepcí, v průběhu těhotenství a i laktace. Nejčastěji dojde ke vzplanutí nemoci ve formě kožně kloubních změn a leukopenie, častý bývá i renální relaps. Existuje i riziko vzniku lupus neonatorum s ireverzibilním AV blokem až III. stupně u novorozence u matek s pozitivitou anti-Ro a anti-La protilátek. Vyšší je riziko opakovaných abortů v důsledku antifosfolipidového syndromu (APS). Charakter systémového onemocnění s přítomností autoprotilátek s protrombotickou a prozánětlivou aktivitou může být příčinou řady dalších komplikací v průběhu gravidity od vyššího počtu abortů, vyšší incidence preeklampsie, hypertenze, růstové retardace až po předčasné porody. Rovněž imunosupresivní léčba SLE má s ohledem na graviditu závažná rizika. Zásadní význam pro sledování rizikových gravidních pacientek se SLE má koordinovaná léčba, která by měla být zahájena již před graviditou výběrem správné antikoncepce a plánováním koncepce na dobu, kdy je onemocnění pod kontrolou nebo zcela v remisi. V Revmatologickém ústavu ve spolupráci s ÚPMD v Praze-Podolí probíhá dlouholetý výzkum rizikových gravidit u SLE .
Cíl:
Cílem sledování v posledních 2 letech bylo zhodnotit průběh gravidity u 44 žen se SLE a sledovat vývoj vybraných klinických i laboratorních parametrů.Metodika:
Byl sledován klinický stav, celková aktivita SLE dle skóre SLEDAI, terapie v průběhu gravidity a vybrané hematologické, biochemické a imunologické parametry. Pacientky absolvovaly vyšetření před početím, dále na počátku gravidity, poté po jednotlivých trimestrech gravidity a bezprostředně po porodu. Byl sledován výskyt komplikací gravidity: vzplanutí SLE, vznik gestačního diabetu, hypertenze, preeklampsie, poruchy růstu plodu, výskyt neonatálního lupusu a vrozených vad.Výsledky:
Většina pacientek se SLE byla léčena malou dávkou glukokortikoidů, pacientky s APS užívaly jako antiagregační terapii nízkou dávkou Anopyrinu a v graviditě pak nízkomolekulární heparin. Celková aktivita SLE byla u naprosté většiny pacientek nízká, což vyjadřovala i nízká hodnota skóre SLEDAI. Orgánové manifestace SLE nebyly časté. 17 žen porodilo císařským řezem. Porodů donošených novorozenců po 37. týdnu bylo 25. Průměrná porodní hmotnost byla 2860 g, tedy nižší oproti zdravé populaci. U 6 pacientek byly známky pozdní růstové retardace. Matky těchto dětí byly častěji léčeny pro hypertenzi a měly v graviditě i perzistující proteinurii. Nejčastější komplikací průběhu gravidity byla hypertenze. U jediné pacientky došlo k rozvoji preeklampsie, která byla indikací pro ukončení gravidity. Gestační diabetes byl diagnostikován u 6 pacientek, všechny byly léčeny dlouhodobě glukokortikoidy. Výskyt gestačního diabetu nebyl závislý na dávce glukokortikoidu a četnost jeho výskytu byla vyšší, než ve zdravé populaci. Zajímavým nálezem je vysoký počet pacientek se současným onemocněním štítné žlázy, kdy ve všech případech se jednalo o hypotyreózu léčenou substitucí tyreoidálních hormonů. Nejpravděpodobnějším vysvětlením je autoimunnitní původ v terénu zvýšené pohotovosti k tvorbě autoprotilátek. Nebyla nalezena žádná vrozená vývojová vada ani přítomnost neonatálního lupusu.Závěr:
Gravidita proběhla zcela bez komplikací a bez exacerbace nemoci u většiny pacientek se SLE (bez nebo/s přítomností sekundárního APS), které měly při koncepci nízkou aktivitu onemocnění. Zvýšení aktivity onemocnění SLE a přítomnost orgánové manifestace v průběhu těhotenství byly u sledovaného souboru důležitým prediktem vývoje jak onemocnění SLE, tak i celého průběhu gravidity.Klíčová slova:
Systémový lupus erythematodes, antifosfolipidový syndrom, gravidita, komplikace, relaps onemocněníÚvod
Systémový lupus erythematodes (SLE) je onemocnění, jež postihuje zejména mladé ženy ve fertilním věku. Pokud žena se SLE otěhotní, podaří se jí to obyčejně v období nízké aktivity základního onemocnění, kdy není fertilita poškozena. Nicméně těhotenství je nutno každopádně pokládat za dosti rizikové, protože na jedné straně gravidita ovlivňuje průběh základního onemocnění, např. nebezpečím vyvolání exacerbace SLE, na druhé straně choroba sama ovlivňuje vlastní průběh těhotenství. Je nepochybné, že SLE a průběh gravidity se tedy vzájemně negativně ovlivňují (1–4).
Rizikovost gravidity u nemocných žen se SLE vyplývá ze samotné podstaty onemocnění SLE, které je vázáno zejména k ženskému pohlaví, vzniká nejčastěji ve fertilním věku a jeho vznik i průběh jsou pravděpodobně významně závislé na estrogenních hormonech. SLE postihuje nejvíce mladé ženy ve fertilním věku, má v průběhu gravidity či v laktaci tendenci k relapsům a není vzácné, že se v průběhu gravidity manifestuje úplně poprvé. Mezi nejčastější komplikace gravidity u SLE patří možnost exacerbace onemocnění, dále vznik tzv. lupus neonatorum, větší četnost spontánních potratů a riziko vzniku preeklampsie (1, 5–9).
Exacerbace SLE může vzniknout rovnoměrně v průběhu všech trimestrů gravidity i v období krátce po porodu (1, 4). V minulosti byla popisována až u 50 % gravidních žen se SLE, avšak v posledních 20 letech její počet významně klesá (3). U pacientek, u nichž bylo onemocnění SLE v době před početím v remisi, se frekvence výskytu vzplanutí nemoci v průběhu gravidity přibližuje k počtu exacerbací u žen, které gravidní nejsou. Nejčastější formou relapsu SLE bývá nefritida nebo kožní a kloubní projevy. U žen s lupusovou nefritidou je v průběhu těhotenství vyšší riziko ztráty plodu, které je udáváno až do 75 %, a dále větší riziko exacerbace nemoci ve formě jednak progrese nefropatie, jednak vzniku jiných orgánových projevů (2). V případě, že v době před početím byla nefritida alespoň šest měsíců v remisi, je frekvence exacerbace v době gravidity udávána od 7 do 33 %. U žen, jež měly před početím aktivní nefritidu, je výskyt vzplanutí vysoký a je popisován u 61–67 % případů. Toto riziko ještě stoupá u těch žen, které měly v době před početím hypertenzi (1, 2, 9).
Závažnou komplikací průběhu gravidity může být vznik preeklampsie (10), která je nejen závažným zdravotním, ale i diagnostickým problémem, neboť bývá obtížné odlišit ji od vzplanutí lupusové nefritidy. Preeklampsie je popisována u 13 % těhotných žen a vyskytuje se zejména u nemocných s přítomností antifosfolipidových protilátek nebo s anamnézou lupusové nefritidy, hypertenze a diabetu (1, 2, 11–15).
U žen se SLE je rovněž vyšší riziko ztráty plodu, které je udáváno mezi 20–30 %, některými autory až v 50 % (10, 16, 17). Mezi významné rizikové faktory pro ztrátu plodu patří přítomnost antifosfolipidových protilátek a projevy vysoké aktivity SLE, zejména pak vysoký titr protilátek proti dsDNA, nízká hladina komplementu a lupusová nefritida. Riziko spontánních potratů je vysoké zejména v případě pozitivity antifosfolipidových protilátek (19–25). Takto nemocné ženy totiž nejsou často schopny plod donosit a ztrácí jej opakovaným potrácením nejčastěji ve druhém nebo na začátku třetího trimestru. Za příčinu tohoto jevu je pokládána přítomnost a působení antifosfolipidových autoprotilátek (aPL), a to jak lupusového antikoagulans (LA), tak antikardiolipinových protilátek (ACLA). Předpokládá se, že tyto protilátky vyvolávají trombózu cév placenty, a tím negativně ovlivňují přívod kyslíku a výživy k plodu, což vede k jeho předčasnému zániku. Tomu lze předcházet včasně nasazenou antiagregační a antikoagulační léčbou, která je u rizikových žen podávána téměř po celou dobu gravidity (13–16).
Dalším rizikem pro plod je přítomnost cirkulujících autoprotilátek typu anti-Ro a anti-La v organismu matky, které mohou vyvolat u plodu vznik lupus neonatorum, jehož nejzávažnějším, i když vzácným projevem je kompletní srdeční atrio-ventrikulární (A-V) blok (1–3, 25). Lupus neonatorum se ale vyskytuje nejen u pacientek se SLE, ale i u jiných systémových chorob, v jejichž autoprotilátkovém spektru nacházíme pozitivitu zmíněných autoprotilátek anti-Ro a anti-La, které jsou transplacentárně přeneseny do organismu plodu. Na vzniku AV bloku se etiopatogeneticky uplatňuje vazba anti-Ro52 na kardiomyocyty s následnou indukcí apoptózy a vazba anti-La na apoptotické kardiomyocyty. Poté je indukována produkce řady prozánětlivých a fibrotizujících cytokinů, dochází k diferenciaci fibroblastů na myofibroblasty a poté k fibrotizaci až k ireverzibilnímu jizvení převodního aparátu u geneticky citlivých jedinců (2). Zde hraje roli nejspíše polymorfismus genu pro transformující růstový faktor beta, jehož zvýšená produkce je asociována právě s fibrotizujícími vlastnostmi. Kongenitální AV blok je popisován v incidenci 1 : 15–20 tisíc porodů a vyskytuje se u 2–5 % matek s pozitivitou anti-Ro a anti-La autoprotilátek (4). Má významnou perinatální mortalitu a někdy je spojen i s vývojem endokardiální fibroblastózy nebo dilatační kardiomyopatie. Terapeuticky jej lze ovlivnit glukokortikoidy s nízkou molekulovou hmotností, které pronikají placentou (např. dexametazon), ale efekt není jistý a jeho podmínkou je naprosto včasné zahájení terapie bezprostředně po vzniku blokády. Její časná detekce je pak podmíněna častým prováděním fetální echokardiografie dle doporučených schémat (17–19, 26).
Významnou roli v graviditě hraje rovněž typ terapie, kterou je žena před graviditou i v jejím průběhu léčena a která může mít negativní vliv na plod (3–6). Naprostá většina pacientek se SLE je léčena glukokortikoidy, které jsou v obvyklých nižších dávkách bezpečné a ani eventuální přechodné zvýšení jejich dávky v případě nutnosti nepředstavuje vysoké riziko (26–30). Nemocné s orgánovou manifestací SLE však bývají léčeny i kombinovanou imunosupresivní léčbou s cytotoxickými léky, a ty jsou pro graviditu zásadně kontraindikovány. Vysazení takovéto léčby není ovšem vždy možné a bezpečné, a tudíž je nutno u každé nemocné se SLE dle možností graviditu řádně naplánovat na vhodnou dobu, kdy je nemoc v remisi nebo alespoň stabilizovaná při terapii, jež je i v graviditě bezpečná (26–36). Vysoce riziková je z hlediska gravidity i laktace zejména terapie cyklofosfamidem, u které je nutno mimo jiné před koncepcí preventivně zajistit ochranu vajíčka, aby nevznikla ireverzibilní amenorea. Nejvhodnější formou takovéto prevence je hormonální antikoncepce nebo zmrazení vajíčka. Rovněž terapie cyklosporinem A není v graviditě vhodná, ovšem v případě ohrožení života gravidní nemocné se SLE ji lze použít (11–15, 27–29). Terapie antimalariky je na základě novějších analýz a doporučení považována za vhodnou, jelikož se obecně připouští, že riziko relapsu SLE v graviditě a jeho důsledky převýší možné riziko eventuálních nežádoucích účinků terapie na plod (1–4, 11). Methotrexát je přísně kontraindikován, naopak azatioprin je možno jak v graviditě, tak v laktaci podávat, ovšem je doporučován pouze v případě relapsu nemoci nebo trvající vyšší aktivity, kdy nelze tuto terapii ukončit. Tato léčba je ale určena zejména pro ty ženy, u nichž dojde k vzplanutí nemoci (1, 3).
V Revmatologickém ústavu ve spolupráci s Ústavem péče o matku a dítě v Praze-Podolí sledujeme již téměř 20 let riziková těhotenství u žen se SLE i s jinými autoimunitními systémovými chorobami pojiva (8, 9). Naše pozorování a jeho výsledky bylo námětem několika publikací. V následujícím textu je prezentována analýza sledování pacientek se SLE z posledních 2 let (2010–2012).
Soubor nemocných
V období od ledna 2010 do září 2012 bylo sledováno 44 pacientek se systémovým lupus erythematodes (diagnóza SLE byla stanovena dle kritérií ACR z. r. 1997) (1, 4).
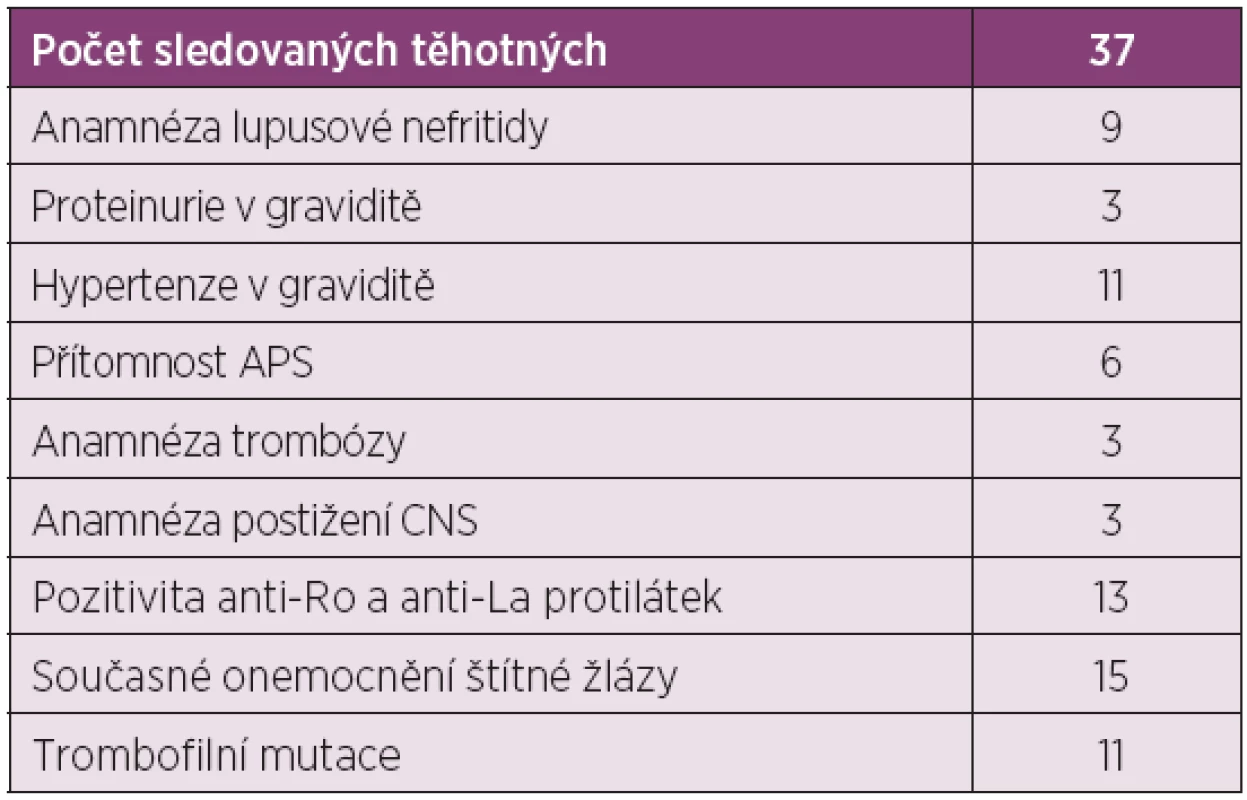
Průměrný věk pacientek byl 27 ± 7 let, průměrná doba trvání nemoci byla 6 ± 3 roky. Celkem 14 pacientek (32 %) mělo v anamnéze lupusovou nefritidu, z nichž 3 měly perzistující proteinurii po celou dobu gravidity. Čtyři pacientky s předchozím postižením ledvin byly již před graviditou léčeny pro hypertenzi. Dále bylo u 3 pacientek (7 %) v minulosti diagnostikováno postižení nervového systému při SLE (neuropsychiatrický lupus – NPSLE).
Šest pacientek splňovalo kritéria sekundárního antifosfolipidového syndromu při SLE s pozitivitou antifosfolipidových protilátek (ACLA, anti-beta 2GP1, lupus antikoagulans). Další 2 pacientky měly pouze pozitivitu protilátek ACLA a anti-beta2GP1, avšak nesplňovaly kritéria APS. Tři pacientky s APS měly v anamnéze arteriální či žilní trombózu. U 15 pacientek byly dlouhodobě pozitivní anti-Ro a anti-La protilátky.
Celkem 30 pacientek (68 %) bylo léčeno glukokortikoidy: methylprednisolonem v dávce 2–24 mg denně, dalších 5 pacientek bylo léčeno prednisolonem v dávce 5–10 mg denně. Dvě pacientky (5 %) byly léčeny pouze Plaquenilem a 7 pacientek (16 %) bylo po celou dobu gravidity bez systémové léčby. Pět pacientek (11 %) bylo současně s glukokortikoidy léčeno azathioprinem. Žádná ze sledovaných pacientek nebyla léčena dalšími imunosupresivy (tab. 1).
1. Terapie SLE sledovaných těhotných žen se SLE. 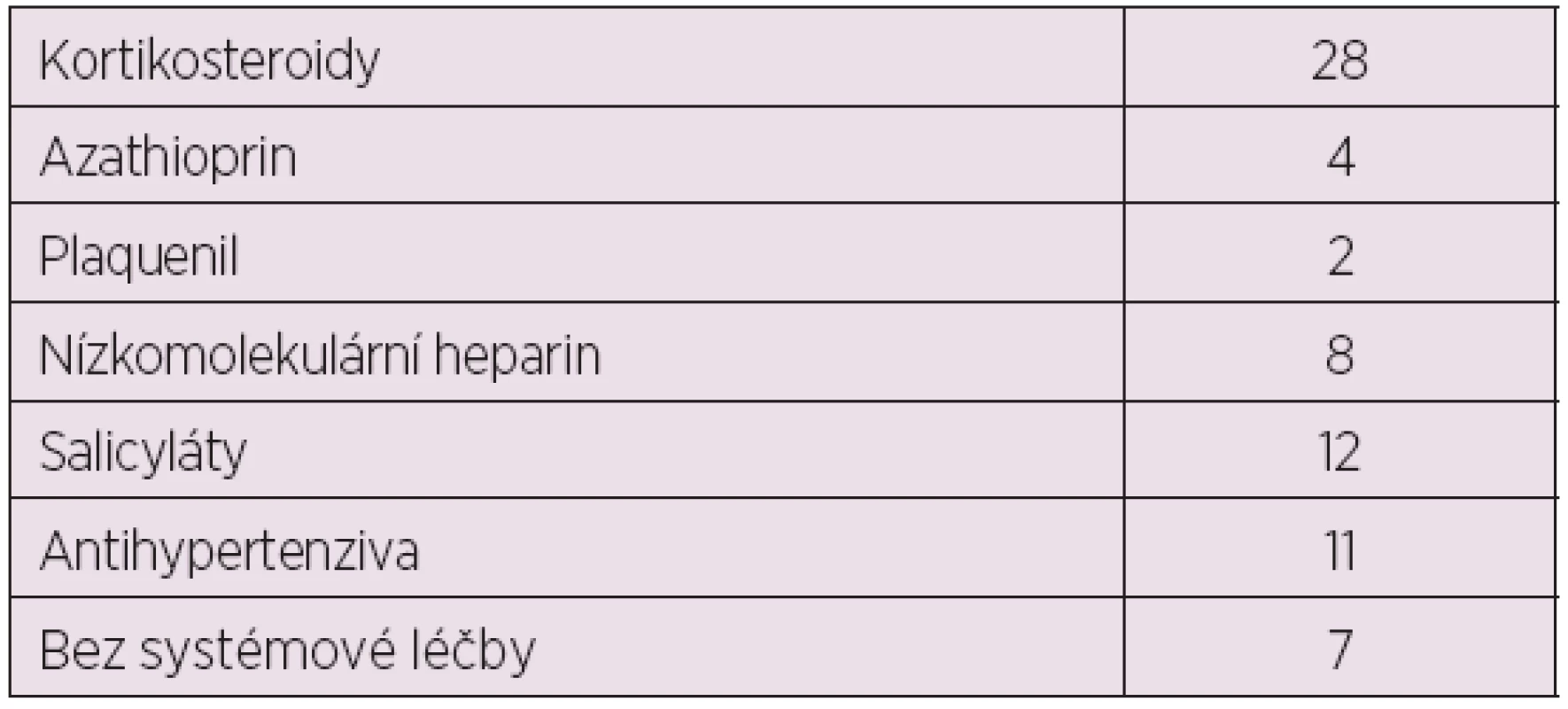
Všechny pacientky byly před graviditou nebo na počátku těhotenství vyšetřeny na přítomnost homofilních mutací a u 9 pacientek (20 %) byla nalezena MTHFR mutace a u dalších dvou Leidenská mutace faktoru V.
Z celkového počtu 44 pacientek mělo 16 pacientek (36 %) současné onemocnění štítné žlázy, ve všech případech se jednalo o hypotyreózu na substituci tyreoidálními hormony.
Osm pacientek (18 %) bylo v graviditě léčeno antikoagulační léčbou nízkomolekulárním heparinem (6 pacientek se sekundárním APS a dále 2 pacientky s Leidenskou mutací). Antiagregační léčbu salicyláty (Anopyrin v dávce 50–150 mg denně) dostávalo celkem 12 pacientek (27 %), z toho 6 pacientek se sekundárním APS, 3 pacientky s proteinurií od počátku gravidity a dále 3 pacientky s anamnézou lupusové nefritidy.
Metodika
U pacientek byl hodnocen klinický obraz včetně vybraných laboratorních parametrů, mezi něž patřilo vyšetření krevního obrazu, běžné biochemické vyšetření séra a moči, podrobné vyšetření vybraných autoprotilátek (ANA, anti ds-DNA, anti-ENA), dále vyšetření C3 a C4 složky komplementu, vyšetření aPL (LA, ACLA, anti-beta2GP) a hemokoagulační vyšetření. Všem pacientkám s pozitivitou anti-Ro a anti-La protilátek bylo provedeno opakovaně fetální echokardiografické vyšetření mezi 19.–29. týdnem gravidity.
Dále byla zhodnocena aktivita onemocnění SLE pomocí skórovacího indexu SLEDAI, a to na začátku onemocnění i po porodu. Uvedená vyšetření pacientky absolvovaly v průběhu sledování většinou několikrát: jednak v rámci vstupního vyšetření před početím, dále pak na počátku gravidity, poté po jednotlivých trimestrech gravidity a bezprostředně po porodu. Kontroly šest měsíců po porodu u některých žen ještě probíhají, a proto nejsou do analýzy zatím zahrnuty. Většina pacientek absolvovala všechna uvedená vyšetření, ovšem některé ženy byly do našeho souboru zařazeny až v průběhu gravidity.
Při sledování vlastní gravidity byly hodnoceny komplikace gravidity: počet relapsů SLE, vznik gestačního diabetu, hypertenze a preeklampsie. Dále byl hodnocen počet předčasných porodů, porodní hmotnost novorozenců a eventuální přítomnost vrozených vad nebo přítomnost lupus neonatorum.
Výsledky
Ze souboru 44 pacientek porodilo 31 pacientek 32 živých dětí (1x gemini), 7 pacientek bylo sledováno pouze prekoncepčně, z těchto bylo třem (43 %) doporučeno pro známky aktivity SLE graviditu odložit. V celém souboru byla ve dvou případech (4,5 %) gravidita ukončena v prvním trimestru pro zamlklý potrat a 1x (2,3 %) došlo k intrauterinnímu úmrtí plodu ve 23. týdnu gravidity, kdy se současně jednalo o těžkou růstovou retardaci plodu u pacientky se SLE se sekundárním APS, hypertenzí a anamnézou opakovaných trombotických příhod. Tři pacientky porodily mimo ÚPMD a nejsou přesné informace o výsledcích porodů, pouze u jedné z nich je známo, že porodila ve 38. týdnu gravidity.
Průměrné skóre indexu SLEDAI bylo na začátku gravidity 2,7, po porodu 4,1. Pouze u jedné pacientky došlo k exacerbaci lupusové nefritidy vyžadující léčbu vysokými dávkami glukokortikoidů, těhotenství bylo ukončeno při pokračující léčbě perorálními glukokortikoidy v poměrně vysokých dávkách ve 35. týdnu.
Dle očekávání byla nadpoloviční většina porodů vedena císařským řezem: celkem 17 gravidit (55 %), zbylých 14 gravidit (45 %) bylo ukončeno porodem vaginální cestou.
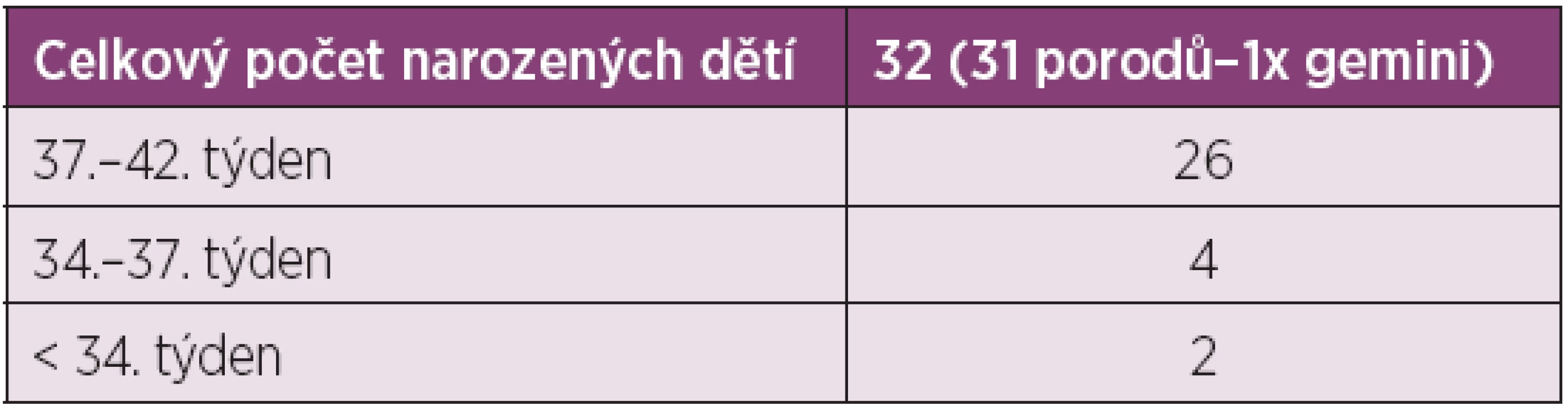
Porodů donošených novorozenců po 37. týdnu bylo 25 (81 %). Čtyři novorozenci (13 %) narození mezi 34.–37. týdnem těhotenství měli projevy mírné nezralosti. Pouze 2 děti byly narozeny před 34. týdnem těhotenství. Průměrná porodní hmotnost v souboru 32 porozených dětí byla 2860 g. Dle očekávání je průměrná porodní hmotnost nižší v souboru žen se SLE než u zdravých těhotných. U dětí porozených po 37. týdnu gravidity nebyly zjištěny poporodní komplikace. U novorozenců narozených před 37. týdnem odpovídal časný poporodní průběh stupni nezralosti (tab. 2, 3).
3. Počet porodů v jednotlivé fázi gravidity. 
U 6 pacientek (20 %) byly zachyceny známky pozdní růstové retardace a byly porozeny děti s porodní hmotností pod 5. percentilem. Všech těchto 6 těhotných bylo léčeno pro hypertenzi a 3 pacientky (10 %) měly perzistující proteinurii po celou dobu gravidity.
Nejčastější komplikací průběhu gravidity byla hypertenze. Čtyři pacientky byly pro hypertenzi léčeny již před graviditou, u dalších 7 (23 %) došlo k rozvoji hypertenze v průběhu gravidity, u 6 žen (20 %) se jednalo o mírnou hypertenzi vzniklou ve druhé polovině těhotenství. Pouze u jediné pacientky došlo k rozvoji preeklampsie, která byla indikací pro ukončení gravidity. Všechny pacientky, u kterých se vyvinula v těhotenství hypertenze, měly ve své anamnéze postižení ledvin, resp. lupusovou nefritidu různé závažnosti již před těhotenstvím.
Gestační diabetes byl diagnostikován u 6 pacientek (20 %), ve všech případech se jednalo o těhotné léčené dlouhodobě glukokortikoidy. Výskyt gestačního diabetu nebyl ale závislý na jejich dávce. Žádné z narozených dětí nemělo po porodu známky neonatálního lupusu. V celém souboru nebyla nalezena žádná vrozená vývojová vada (tab. 4).
Po porodu bylo u všech pacientek pokračováno ve stejné léčbě jako v graviditě, individuálně bylo dle rizika možné exacerbace onemocnění doporučeno zvýšení dávky imunosupresivní léčby. Všem pacientkám byl zdůrazněn význam kontroly revmatologem po šestinedělí.
Diskuse
Všechny ženy se SLE, u kterých proběhlo nekomplikované těhotenství, měly jak před početím, tak i po celou dobu gravidity nižší aktivitu nemoci a ve většině případů byly léčeny nízkou dávkou glukokortikoidů. Významná část sledovaných žen sice měla v anamnéze orgánové postižení při SLE (lupus nefritidu, NPSLE), které však bylo ve většině případů neaktivní. Nejčastěji zmiňovanými komplikacemi u gravidit se SLE jsou časné a pozdní aborty, dále hypertenze a preeklampsie a porody plodů s nízkou porodní hmotností (6–12, 37–42). Častější aborty souvisí nejen s aktivitou onemocnění, ale také s přítomností specifických antifosfolipidových (aPL), resp. antikardiolipinových (ACLA) protilátek a s přítomností protilátek proti beta2glykoproteinu (22–25). Přítomnost těchto tříd autoprotilátek nemusí mít přímou souvislost s aktivitou onemocnění, jejich pozitivita je většinou dlouhodobá. Aborty se u systémových onemocnění vyskytují jak v prvním, tak ve druhém trimestru (1–4). Ve sledovaném souboru pacientek se SLE došlo ke dvěma abortům v prvním trimestru a dále k jednomu abortu ve druhém trimestru. Jednalo se celkem o 3 pacientky, které ze souboru těhotných představovaly 8 %. Tento nález považujeme za pozitivní vzhledem k faktu, že ve zdravé populaci se aborty v prvním či druhém trimestru pohybují kolem 10 % všech gravidit. Vysvětlením pro tak nízký výskyt abortů ve sledované skupině může být důsledek velice pečlivého sledování pacientek, snahou o správné načasování gravidity a i včasného zahájení antikoagulační i antiagregační léčby u rizikových pacientek. Prvotrimestrální potrácení nemá často jasné vysvětlení v aktivitě onemocnění či přítomnosti specifických aPL a ACLA. Aborty ve druhém trimestru se vyskytují právě u pacientek se známkami větší aktivity onemocnění nebo u pacientek s kompletními, ale i inkompletními projevy APS (1, 22, 23). Aborty ve druhém trimestru jsou u pacientek často spojeny s růstovou retardací plodu, přičemž známky restrikce růstu se začnou objevovat ve druhém trimestru (18, 22, 23). Pokud se jedná o závažnou růstovou retardaci v takto časných stadiích gravidity, je naděje na další úspěšný průběh gravidity již jen minimální. Původem restrikce růstu plodu jsou nejspíše změny v cévách placenty, které vedou k omezení dostupnosti nutričních substrátů pro plod a vedou k poruše růstu plodu (8). Zajímavý je i fakt, že vyšetření placent žen se SLE obvykle nevykazuje žádné specifické histopatologické známky (8, 9). Placenty ale bývají menší, s malou hmotností a četněji se vyskytují placentární infarkty. Tyto změny je možno pozorovat i na placentách plodů s růstovou retardací ze zcela jiných příčin, než je systémové onemocnění. Je tedy pravděpodobné, že různé příčiny vedou k podobným cévním změnám v placentárním řečišti a tyto změny mohou být příčinou pozdních abortů (21, 22, 29–30). Předpokládanými cévními změnami jsou trombotické uzávěry v uteroplacentárním řečišti. Je známo, že důslednou antikoagulační a antiagregační léčbou lze placentárním změnám zabránit nebo je minimalizovat a umožnit tak úspěšný průběh gravidity (42–53). V našem souboru 6 pacientek se sekundárním APS při SLE byla pouze jedna těhotná s abortem ve druhém trimestru, ostatní pacientky porodily živé novorozence, v jednom případě byl porod předčasný, ostatní těhotenství byla s porodem v řádném termínu.
V našem sledovaném souboru byla průměrná porodní hmotnost 2860 g při naprosté většině porodů donošených novorozenců. Z literatury je známo, že porodní hmotnost u dětí matek se SLE ale i dalšími systémovými chorobami je nižší, než ve zdravé populaci, kde je udávána mezi 3200–3600 g (30, 39, 42). Toto se potvrdilo i u našich sledovaných pacientek. Donošené děti s nízkou porodní hmotností se po porodu chovaly jako děti zdravé, u dětí mírně nezralých byla jejich poporodní adaptace odpovídající stupni jejich nezralosti. Dvě děti porozené před 34. týdnem gravidity vykazovaly vedle nezralosti i mírnou růstovou retardaci a byly porozeny matkami se závažnějším průběhem onemocnění a anamnézou lupusové nefritidy. U jedné z nich došlo k exacerbaci lupusové nefritidy v průběhu gravidity s nutností podání vysokých dávek glukokortikoidů. V literatuře v souhlase s naším pozorováním je opakovaně uváděna nižší porodní hmotnost u pacientek s vyšší aktivitou onemocnění a s vyšším počtem orgánových komplikací před graviditou (42–47). V České republice v posledních letech stoupají počty porodů císařským řezem, téměř jedna čtvrtina všech gravidit je takto ukončena. Ve sledované skupině pacientek se SLE bylo císařským řezem ukončeno těhotenství v polovině případů (nad 50). Jde tedy o dvojnásobný počet operačních ukončení gravidity, než je ve zdravé populaci. Důvodů je nejspíše několik. Vedle porodnických indikací, které nemusí mít souvislost se základním onemocněním, jsou jistě v případě závažného onemocnění komplikujícího graviditu častěji indikovány císařské řezy, je zde jasná snaha neponechat pacientky plod přenášet. Část císařských řezů je tedy řešením neúspěšné indukce porodů. Dalšími příčinami indikace císařského řezu obecně mohou být známky růstové retardace, patologické kardiotokografické záznamy, hypertenze či preeklampsie. Všechny tyto důvody pro ukončení gravidity císařským řezem jsou v případě SLE častější a souvisí s poruchou placentární funkce charakteristickou pro autoimunitní onemocnění.
Hypertenze je považována za jednu z nejčastějších komplikací gravidit se SLE. Jedenáct pacientek v našem souboru bylo léčeno pro hypertenzi, přičemž 4 byly léčeny již před graviditou, u dalších 7 pacientek došlo k vývoji hypertenze v průběhu gravidity. U všech 11 pacientek byla v anamnéze v minulosti lupusová nefritida, 3 pacientky měly perzistující proteinurii po celou dobu gravidity, u jedné nemocné s trvalou proteinurií došlo k vývoji preeklampsie a gravidita byla proto ukončena. U 3 ze 4 pacientek s hypertenzí prekoncepčně byla před graviditou změněna léčba hypertenze z ACE inhibitorů na léky, které jsou pro graviditu bezpečné, jako methyldopa nebo betablokátory. Závažnost hypertenze nebyla závislá na přítomnosti aktivity onemocnění nebo na intenzitě léčby v těhotenství, pouze na přítomnosti proteinurie a historii lupusové nefritidy. Frekvence hypertenze ve zdravé populaci těhotných se pohybuje mezi 10–15 %, v našem souboru byl výskyt hypertenze podstatně vyšší. Jednalo se o 11 pacientek, které tvořily 38 % celého souboru. Tento nález není překvapením vzhledem k faktu, že všechny pacientky s preexistující či nově vzniklou hypertenzí měly v anamnéze lupusovou nefritidu různých stadií. Pokud se týče preeklampsie a její frekvence v graviditě obecně, udává se, že přibližně 4 % gravidit jsou ukončena pro příznaky preeklamsie , přičemž některé zdroje uvádějí i vyšší čísla (39–45). V našem souboru došlo k rozvoji typické preeklamsie pouze u jediné pacientky a pokud bychom přepočetli i tak malé číslo na procentuální vyjádření, bylo by to pouze u 1 % z pacientek, které rodily.
Třetina pacientek z celého sledovaného souboru měla nález pozitivity anti-Ro a anti-La protilátek, jejichž přítomnost je spojena s nálezy postižení převodního systému srdečního a výskytu atrio-ventrikulárních blokád různého stupně závažnosti od A-V blokády I. stupně po kompletní atrioventrikulární blokádu se závažnou bradykardií plodu vyžadující ihned po porodu zavedení kardiostimulátoru novorozenci. Všech 13 pacientek s pozitivitou anti-Ro a anti-La protilátek bylo vyšetřeno v dětském kardiocentru v době od 19.–28. týdne gravidity minimálně 2x s odstupem několika týdnů. U žádné ze sledovaných těhotných s pozitivitou zmíněných autoprotilátek nebyla nalezena porucha síňokomorového vedení typu A-V blokády ani jiná arytmie.
Zajímavým nálezem je vysoký počet pacientek se současným onemocněním štítné žlázy, kdy ve všech případech se jednalo o hypotyreózu léčenou substitucí tyreoidálních hormonů. Nejpravděpodobnějším vysvětlením je autoimunnitní původ v terénu zvýšené pohotovosti k tvorbě autoprotilátek. Ve sledovaném souboru pacientek bylo 38 % léčených pro onemocnění štítné žlázy. I přesto, že některá z forem tyreopatie (v naprosté většině se jedná o hypotyreózu) je poměrně častou komplikací v graviditě, je nález necelých 40 % postižení štítné žlázy v našem souboru poměrně nečekaný. Průměrný výskyt onemocnění štítné žlázy v celé populaci zdravých těhotných se pohybuje kolem 15 %. Podrobná analýza etiologie onemocnění štítné žlázy ve sledovaném souboru nebyla provedena.
Gestační diabetes byl nalezen u 20 % pacientek, přičemž všechny byly dlouhodobě léčeny glukokortikoidy. I v případě gestačního diabetu je četnost jeho výskytu u souboru pacientek se SLE vyšší než ve zdravé populaci, kde se pohybuje dle nových diagnostických kritérií kolem 10–15 %. Tento nález je v souladu s naší předchozí prací prezentovanou na FIGO 2009.
Více než dvě třetiny pacientek byly léčeny glukokortikoidy v různých dávkách, jen menší množství žen mělo i jinou imunosupresivní terapii (azathioprin, antimalarika). Sedm pacientek s nejméně komplikovaným průběhem onemocnění, které měly v minulosti pouze kožní či kloubní projevy bez postižení dalších orgánů a onemocnění bylo dlouhodobě v kompletní remisi, neměly žádnou systémovou léčbu a ani v graviditě nebylo nutno zahajovat imunosupresi pro zvýšenou aktivitu choroby. Otázkou zůstává, zda preventivně zvyšovat imunosupresivní léčbu v období těsně po porodu, kdy jsou pacientky se SLE ve vyšším riziku zhoršení onemocnění (35, 50–54). Jedním z důvodů tohoto rizika je zvýšená aktivita imunologické odpovědi, ke které dojde po delším období stavu relativně výraznější imunosuprese, jež trvá po celou dobu gravidity (6, 7, 10, 24). Ta je způsobena dlouhodobě vyšší hladinou glukokortikoidů produkovaných placentou a navozením stavu imunotolerance nezbytné pro vývoj plodu (26, 36, 52, 55).
Přes závažnost onemocnění SLE s řadou rizik pro matku i plod je ze sledování pacientek v našem souboru patrno, že důsledné sledování, včasná diagnostika komplikací a i úprava imunosupresivní léčby v průběhu gravidity vedou k dobrým výsledkům gravidit žen se SLE a umožní úspěšné porody zdravých novorozenců.
Shrneme-li výsledky našeho sledování, pak zjišťujeme, že v naší sledované skupině nemocných žen se SLE byla výše aktivity nemoci a přítomnost závažnějších orgánových projevů SLE v období před početím jedním z důležitých faktorů, který limitoval průběh jak gravidity, tak i vývoje SLE během těhotenství. Tyto závěry z našeho sledování odpovídají i výsledkům prací řady autorů, kteří sledovali průběh gravidity u žen se SLE a porovnávali je se zdravou populací (1–3, 8, 9). Z těchto prací vyplývá, že přítomnost či absence závažných orgánových projevů SLE, výše klinické a autoprotilátkové aktivity a způsob průběžného sledování nemocné v průběhu těhotenství patří mezi hlavní faktory, jež významně ovlivňují průběh gravidity Obdobně tak u gravidních žen s APS, které jsou systematicky léčeny příslušnou antiagregační a eventuálně i antikoagulační terapií, je popisováno snížení frekvence trombotických příhod včetně ztrát plodu (22–25).
Ve sledování budeme pokračovat i v budoucnu. Chtěli bychom se zaměřit na některé nové imunologické parametry, které významně ovlivňují úspěšnost gravidity u SLE, například na detekci protilátek proti endotelinu (27).
Závěr
Na rozdíl od relativně nedávných let není v dnešní době již důvod provádět přerušení těhotenství u žen se SLE z lékařských důvodů, ale po pečlivém zvážení a za příslušného léčení lze dovést ženu k porodu zdravého dítěte. Bezpečná gravidita u žen se SLE je tedy možná, ovšem za předpokladu splnění některých důležitých podmínek. Hlavní kontraindikací gravidity u žen se SLE jsou těžké formy orgánového postižení, zejména lupusová nefritida, neuropsychiatrické manifestace a plicní hypertenze.
Gravidita u žen se SLE by měla být vždy striktně plánována, a to na dobu, kdy je nemoc alespoň v částečné remisi a bez nutnosti léčby vysokými dávkami imunsupresivních, zejména pak cytotoxických léků. Od posledního relapsu nemoci by odstup gravidity měl být jeden rok. V případě nově diagnostikované choroby by měla žena plánovat graviditu až po 2 letech. Pro příznivý průběh gravidity u nemocné se SLE i pro vývoj plodu je důležité, aby minimálně šest měsíců před početím byla aktivita nemoci nízká a po celou dobu gravidity byly renální funkce ženy v normě (1, 3, 9).
V době aplikace rizikových léků je nutno dodržovat důslednou antikoncepci a rizikové léky musí být před koncepcí včas vysazeny. Je nutno preventivně sledovat eventuální nežádoucí účinky léků na gravidní ženu i na plod a ženu je nutno systematicky sledovat za spolupráce příslušných specialistů, tedy zejména revmatologa a gynekologa, resp. porodníka. Nemocná by měla rovněž absolvovat genetické vyšetření a eventuálně i konzultaci reprodukčního imunologa. Porod by měl probíhat v řádném termínu a měl by být zvýšeně sledován. Dále by měla být zajištěna specializovaná péče neonatologa pro případ poporodních komplikací (4, 10, 13).
Podporováno výzkumnými záměry MZ ČR č. 000 000 23728
Adresa pro korespondenci:
MUDr. Dana Tegzová
Revmatologický ústav a Revmatologická klinika 1. LF UK v Praze
Na Slupi 4
128 50 Praha 2
Sources
1. Lateef A, Petri M. Management of pregnancy in systemic lupus erythematosus. Nat Rev Rheumatol 2012;8(12):710-8.
2. Stojan G, Baer AN. Flares of systemic lupus erythematosus during pregnancy and the puerperium: prevention, diagnosis and management. Expert Rev Clin Immunol 2012;8(5):439-53.
3. Alvarez-Nemegyei J, Domínguez-Vallejo S, Saavedra-Déciga ME. Relapsing risk and obstetric-neonatal outcome in pregnancy and systemic lupus erythematosus. Rev Med Inst Mex Seguro Soc 2012;50(4):355-61.
4. Dostál C, Vencovský J. Těhotenství a SLE. In: Systémový lupus erytematodes. Praha, Medprint, 1997 : 147-153.
5. Petri M, Albritton J. Fetal outcome of lupus pregnancy: A retrospective case-control study of the Hopkins lupus cohort. J Rheumatol 1993;20 : 650-4.
6. Neds CJ, Brooks PM. Antirheumatic medicaton during lactation. Br J Rheumatol 1985;24 : 291-6.
7. Parke A, West B. Hydroxychloroquine in pregnant patients with systemic lupus erythematosus. J Rheumatol 1996;23 : 1715-1718
8. American College of Rheumatology Subcommittee on Rheumatoid Arthritis guidelines. Guidelines for the management of rheumatoid arthritis. 2002 update. Arthritis Rheum 2002;46 : 328-46.
9. Dostál C, Kolblová V, Nouza K. Systémový lupus erythematodes a těhotenství. Současný stav problému. Čas Lék čes 1992;19 : 582-587.
10. Dostál C, Madar J, Vítová J, et al. Praktické výsledky sledování těhotenství u žen se systémovým lupus erytematodes. Čas Lék čes 1996;24 : 789-95.
11. Palmsten K, Hernández-Díaz S, Kuriya B, Solomon DH. Use of disease-modifying antirheumatic drugs during pregnancy and risk of preeclampsia. Arthritis Care Res (Hoboken) 2012;64(11):1730-8.
12. Izmirly PM, Costedoat-Chalumeau N, et al. Maternal use of hydroxychloroquine is associated with a reduced risk of recurrent anti-SSA/Ro-antibody-associated cardiac manifestations of neonatal lupus. Circulation 2012;126(1):76-82.
13. Bramham K, Soh MC, Nelson-Piercy C. Pregnancy and renal outcomes in lupus nephritis: an update and guide to management. Lupus 2012 Oct;21(12):1271-83.
14. Wright D, Akolekar R, Syngelaki A, Poon LC, Nicolaides KH. A competing risks model in early screening for preeclampsia. Fetal Diagn Ther 2012;32(3):171-8.
15. Suzumori N, Obayashi S, Kumagai K, Goto S, Yoshida A, Sugiura-Ogasawara M. A Case of Microangiopathic Antiphospholipid-Associated Syndromes during Pregnancy. Case Report Med 2012 : 827543
16. Ragab A, Barakat R, Ragheb M, State O, Badawy A. Subfertility treatment in women with systemic lupus erythematosus. J Obstet Gynaecol 2012;32(6):569-71.
17. Yee CS, Akil M, Khamashta M, et al. The BILAG 2004 - Pregnancy index is reliable for assessment of disease activity in pregnant SLE patients. Rheumatology (Oxford) 2012;51(10):1877-80.
18. Shand AW, Algert CS, March L, Roberts CL. Second pregnancy outcomes for women with systemic lupus erythematosus. Ann Rheum Dis 2012 Jun 29. [Epub ahead of print.
19. Sciascia S, Murru V, Sanna G, Roccatello D, Khamashta MA, Bertolaccini ML. Clinical accuracy for diagnosis of antiphospholipid syndrome in systemic lupus erythematosus: evaluation of 23 possible combinations of antiphospholipid antibody specificities. J Thromb Haemost 2012;10(12):2512-8.
20. Andrade SE, Scott PE, Davis RL, et al. Validity of health plan and birth certificate data for pregnancy research. Pharmacoepidemiol Drug Saf. 2012 Jul 3. doi: 10.1002/pds.3319.
21. Fischer-Betz R. Rheumatic diseases during pregnancy. Internist (Berl) 2012;53(9):1047-53.
22. Alijotas-Reig J, Ferrer-Oliveras R. EUROAPS Study Group.The European Registry on Obstetric Antiphospholipid Syndrome (EUROAPS): a preliminary first year report. Lupus 2012;21(7):766-8.
23. Bertero MT. Primary prevention in antiphospholipid antibody carriers. Lupus 2012;21(7):751-4.
24. Ruffatti A, Calligaro A, Del Ross T, et al. Risk-based secondary prevention of obstetric antiphospholipid syndrome. Lupus 2012;21(7):741-3.
25. Erkan D, Lockshin MD. APS ACTION members. APS ACTION-AntiPhospholipid Syndrome Alliance For Clinical Trials and International Networking. Lupus 2012;21(7):695-8.
26. Blanford AT, Murphy BP. In vitro metabolism of prednisolone, dexamethasone, betamethasone and cortisol by the human placenta. Am J Obstet Gynecol 1977;27 : 264-268.
27. Björkander S, Bremme K, Persson JO, van Vollenhoven RF, Sverremark-Ekström E, Holmlund U. Pregnancy-associated inflammatory markers are elevated in pregnant women with systemic lupus erythematosus. Cytokine 2012;59(2):392-9.
28. Wechsler B, Le Thi Huong D, Piette JC. Pregnancy and systemic lupus erythematosus. Ann Med Interne 1999;150 : 408-18.
29. Janssen NM, Genta MS. The effects of immunosuppressive and anti-inflammatory medications on fertility, pregnancy and lactation. Arch Intern Med 2000;160 : 610-619.
30. Neson JL, Ostensen M. Pregnancy and rheumatoid arthritis. Rheum Dis Clin North Am 1997;23 : 195-212
31. Mintz G, Niz J, Gutierrez G, et al. Prospective study of pregnancy in systemic lupus erythematosus. Results of multidisvciplinary approach. J Rheumatol 1986;13 : 4-6.
32. Lockshin MD. Pregnancy does not cause SLE to worsen. Arthritis Rheum 1989;32 : 665-70.
33. Petri M, Howard D, Repke J. Frequency of lupus flare in pregnancy: The Hopkins lupus pregnancy centre experience. Arthritis Rheum 1991;34 : 1358-64.
34. Urowitz MB, Gladman DD, Farewell VT, et al. Lupus and pregnancy studies. Arthritis Rheum 1993;36 : 1392-6.
35. Domic, R, Ramsey-Goldman R, Manzi S. Epidemiology and classification of systemic lupus erythematosus. In: Hochberg MC, et al. Rheumatology. Vth ed. Philadelphia, Elsevier, 2008 : 1211-13.
36. Salmon JE, Pricip LD, Agati V. Immunopathology of systemic lupus erythematosus. In: Hochberg, MC., et al. Rheumatology. Vth ed. Philadelphia, Elsevier, 2008 : 1217–1237.
37. Gladman DD, Urowitz MB. Clinical features of systemic lupus erythematosus. In Hochberg, MC., et al. Rheumatology. Vth ed. Philadelphia, Elsevier, 2008 : 1277.
38. Mulherin D, Bresnihan B. Systemic lupus erythematodes Bailliere´s. Clin Rheumatol 1991;7 : 31–57.
39. Gordon C. Long-term complications of systemic lupus erythematosus. Rheumatology 2002;41 : 1095–1100.
40. Ruiz-Irastorza G, Lima F, Alves J, et al. Increased rate of lupus flare during pregnancy and : the puerperium. A prospective study of 78 pregnancies. Br J Rheumatol 1996;35 : 133-9.
41. Hayslett JP. Maternal and fetal complications in pregnant women with systemic lupus erythematosus. Am J Kidney Dis 1991;17 : 123-8.
42. Bobrie J, Liote F, Houillier P, et al. Pregnancy in lupus nephritis and related disorders. Am Kidney Dis 1987; 9 : 339-43.
43. Julkunen H, Kaaja R, Palosuo T, et al. Pregnancy in lupus nephropahy. Acta Obstet Gynecol Scand 1993;72 : 258-63.
44. Repke JT. Hypertensive disorders of pregnancy. Differentiating preeclampsia from active systemic lupus erythematosus. J Repord Med 1998, 43 : 350-5
45. Julkunen H, Jouhaikainen T, Kaaja R, et al. Fetal outcome in lupus pregnancy: A retrospective case-control study o 242 pregnanties in 112 patients. Lupus 1993;2 : 125-9.
46. Caritis S, Sibai B, Hauth J, et al. Low aspirin to prevent preeclampsia in women at high risk. N Engl J Med 1998;338 : 701-705.
47. Hunt BJ, Doughty H, Majumdar G, et al. Thromboprophylaxis with low molecular weight heparin in high-risk pregnancy. Thrombo Haemost 1997;77 : 39-43
48. Fritzler, MJ, Elkon KB. Autoantibodies in SLE. In Hochberg, MC., et al. Rheumatology. Vth ed. Philadelphia, Elsevier, 2008 : 1253–1264.
49. Brewster JA, Shaw NJ, Farquharson RG, et al. Neonatal and pediatric outcome of infants born to mothers with antiphospholipid syndrome. J Perinat Med 1999; 27 : 183-7.
50. Brester JA, Quenby SM. Alfirevic Z, et al. Intra-uterine death due to umbilical cord trombosis secondary to antiphospholipid syndrome. Lupus 1999;8 : 558-9.
51. Backos M, Rai R, Regan L, et al. Pregnancy complications in women with recurrent miscariiage associated with antiphospholipid antibodies treated with low dose aspirin and heparin. Br J Obstet Gynaecol 1999;106 : 102-7.
52. Juste JR, Beloqui O, Prieto J, et al. Antiphospholipid syndrome. Rev Med Univ Navarra 1998;42 : 194-207.
53. Lockshin MD, Reinitz E, Druzin ML, et al. Lupus pregnancy. Case-control prospective study demonstrating absence of lupus exacerbation during or after pregnancy. Am J Med 1984;77 : 893-7.
54. Meehan RT, Dorsey JK. Pregnancy among patients with systemic lupus erythematosus receiving immunosupressive therapy. J Rheumatol 1987;14 : 252-5.
55. Briggs GG, Freeman RK, Yaffe SJ. Drugs in pregnancy and lactation. 5thd. Baltimore, Williams and Wilkins, 1998 : 321-6.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2013 Issue 2-
All articles in this issue
- Recommendations of the Czech Society for Rheumatology for the diagnosis and monitoring of patients with systemic lupus erythematosus
- The course of pregnancy in female patients with systemic lupus erythematosus
- Morning and evening chronotypes in rheumatoid arthritis
- Eosinophilic fasciitis
- Is ultrasound a reliable help for a rheumatologist?
- What we should know about diagnostic tests
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The course of pregnancy in female patients with systemic lupus erythematosus
- Eosinophilic fasciitis
- Recommendations of the Czech Society for Rheumatology for the diagnosis and monitoring of patients with systemic lupus erythematosus
- What we should know about diagnostic tests
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career